Генетика, 2022, T. 58, № 1, стр. 76-85
Общие и специфические генетические факторы риска развития трех расстройств с депрессивной симптоматикой
Е. И. Рафикова 1, *, Д. В. Шибалёв 1, М. И. Шадрина 2, П. А. Сломинский 2, А. Б. Гехт 3, А. П. Рысков 1, В. А. Васильев 1
1 Институт биологии гена Российской академии наук
119334 Москва, Россия
2 Институт молекулярной генетики Национального исследовательского центра “Курчатовский институт”
123182 Москва, Россия
3 Научно-практический психоневрологический центр им. З.П. Соловьева
115419 Москва, Россия
* E-mail: kat.rafikov@gmail.com
Поступила в редакцию 24.02.2021
После доработки 31.03.2021
Принята к публикации 20.04.2021
- EDN: YFEVPO
- DOI: 10.31857/S0016675822010106
Аннотация
Большинство исследований кандидатных генов ранее проводилось с использованием выборок, объединяющих пациентов с разными нозологическими формами депрессии. В настоящей работе были исследованы пациенты с расстройствами, отличающимися выраженной депрессивной симптоматикой (N = 357). Они были разделены на три выборки в соответствии с диагнозом: депрессивный эпизод (ДЭ), рекуррентная депрессия (РД) и смешанное тревожное и депрессивное расстройство (СТДР). В контрольную группу было включено 163 человека из восточнославянской популяции Москвы и регионов Центральной России. Было изучено 12 локусов девяти генов, связанных с нейромедиаторными или гормональными системами, влияющими на формирование настроения. Выбранные для изучения локусы, как показано ранее, ассоциированы с уровнем экспрессии гена, активностью белка или депрессивными расстройствами. В данном исследовании показано, что ген SLC6A3 (локус 40 пн VNTR) ассоциирован со всеми изученными расстройствами, носители генотипа LL имеют более низкий риск развития всех изученных заболеваний. Полиморфный вариант 120 пн VNTR в гене DRD4 ассоциирован с риском РД и СТДР. Также была показана ассоциация локуса rs6311 гена HTR2A с риском ДЭ и СТДР. Специфическим для РД генетическим фактором риска в изученных выборках является локус rs53576 гена OXTR. Для носителей гомозиготного по минорному аллелю генотипа AA риск развития РД оказался ниже, чем для носителей других генотипов. Распределение генотипов изученных полиморфных локусов не коррелирует с тяжестью симптомов депрессии. Локусы rs6311 (ген HTR2A) и 120 пн VNTR (ген DRD4) ассоциированы с симптомами ситуационной и личностной тревоги. Тяжесть симптомов ситуационной тревоги также ассоциирована с локусами rs53576 гена OXTR и Stin2 гена SLC6A4.
Исследование генетических причин депрессивных и тревожных расстройств продолжается около трех десятилетий. Однако накопленные экспериментальные данные не позволяют прийти к окончательному заключению об ассоциации тех или иных генов с риском заболевания и тяжестью его течения. Для большинства локусов, выбранных в настоящем исследовании, ранее была показана ассоциация с уровнем экспрессии гена или активностью белкового продукта. Так, была показана ассоциация VNTR-полиморфизма (variable-number tandem repeat, вариабельное число тандемных повторов) гена дофаминового транспортера SLC6A3 с длиной повторяющихся фрагментов 40 пн, а также локусов 48 пн VNTR и 120 пн VNTR гена DRD4 (дофаминовый рецептор D4) с транскрипционной активностью соответствующих генов [1–4]. Исследование post mortem показало, что полиморфный локус rs1800497 гена DRD2 (рецептор дофамина D2) ассоциирован с количеством рецепторов в мозге [5]. Ген COMT (катехол-О-метилтрансфераза) содержит в 158-м кодоне полиморфный локус rs4680, который представляет собой замену нуклеотида G на A, приводящую к замене аминокислоты валин (Val) на метионин (Met). Этот локус известен также под обозначением Val158Met. Аллели данного локуса отличаются активностью белкового продукта [6]. Уровень экспрессии гена серотонинового транспортера (SLC6A4/5HTT) ассоциирован с несколькими локусами. В промоторном регионе расположен полиморфный локус 5‑HTTLPR, содержащий 14 или 16 тандемных повторов длиной 20–23 пн. В шестом повторе того же локуса находится замена A на G (rs25531) [7]. Показано, что длинный аллельный вариант локуса 5‑HTTLPR (аллель L) ассоциирован с более высоким уровнем экспрессии, но только если в шестом повторе в локусе rs25531 находится аденин (аллель LA). При этом короткий аллель S и длинный аллель LG отличаются сниженной транскрипционной активностью [8]. Другой полиморфный локус гена SLC6A4, известный под обозначением Stin2, расположен в интроне 2 и представляет собой VNTR-полиморфизм с длиной повторяющихся фрагментов 16–17 пн. Количество повторов в данном локусе также коррелирует с транскрипционной активностью гена [9]. Также было показано, что однонуклеотидные замены в генах рецепторов серотонина первого типа А HTR1A (локус rs6295), первого типа B HTR1B (локус rs6296) и второго типа А HTR2A (локус rs6311) ассоциированы с уровнем экспрессии [10–13]. Предыдущие исследования показывают возможную ассоциацию между риском развития депрессивных расстройств и полиморфизмом этих функционально значимых локусов [14–19]. На данный момент не известна функциональная роль полиморфного локуса rs53576 гена окситоцинового рецептора OXTR. Однако было показано, что этот локус ассоциирован с объемом гиппокампа у здоровых людей [20], а также с риском униполярной депрессии [21]. Было проведено множество исследований кандидатных генов с использованием выборок, объединяющих пациентов с разными нозологическими формами депрессии под общим диагнозом “большое депрессивное расстройство”, однако результаты остаются противоречивыми [19]. Целью данной работы было проверить, являются ли найденные ранее ассоциации общими для всех расстройств депрессивного спектра или есть локусы, которые ассоциированы с риском развития определенного заболевания. Ранее мы опубликовали результаты анализа ассоциаций между полиморфизмом генов дофаминергической системы и тремя видами расстройств с выраженными симптомами депрессии: депрессивным эпизодом (ДЭ), рекуррентной депрессией (РД) и смешанным тревожным и депрессивным расстройством (СТДР) [22]. В настоящем исследовании мы объединили результаты генотипирования по локусам дофаминергической, серотонинергической и эндокринной систем и протестировали их ассоциацию с отдельными заболеваниями депрессивного спектра с использованием нескольких моделей наследования. Кроме того, мы провели анализ ассоциации исследованных нами локусов с тяжестью депрессивной и тревожной симптоматики.
МАТЕРИАЛЫ И МЕТОДЫ
Были исследованы пациенты с расстройствами, отличающимися выраженными симптомами депрессии (N = 357). Выборка пациентов была разделена на три группы в соответствии с диагнозом по МКБ-10: 1) F 32.1, депрессивный эпизод (N = 106, 58.5% женщин, 41.5% мужчин; средний возраст 31.8 ± 8.5 лет); 2) F 33.1, рекуррентная депрессия (N = 149, 67.8% женщин, 32.2% мужчин; средний возраст 34.2 ± 7.3 лет); 3) F 42.1, смешанное тревожное и депрессивное расстройство (N = 97, 50.5% женщин, 49.5% мужчин; средний возраст 33.9 ± 7.2 лет). Обследование пациентов и получение образцов крови проводились в Научно-практическом психоневрологическом центре департамента здравоохранения г. Москвы. Симптомы заболевания проявились у пациентов в возрасте 18–45 лет. В выборку были включены пациенты, соответствующие следующим критериям: восточнославянское происхождение, отсутствие в анамнезе шизофрении, алкоголизма, злоупотребления наркотиками, онкологических заболеваний и неврологических расстройств (деменция, болезнь Паркинсона, инсульт, эпилепсия и др.). У всех пациентов была проведена оценка тяжести симптомов депрессии (опросник Гамильтона), ситуационной и личностной тревоги (опросник Спилбергера). В контрольную группу было включено 163 человека из восточнославянской популяции Москвы и регионов Центральной России (62% женщин, 38% мужчин; средний возраст 61.9 ± 9.3 лет). Подробные данные о пациентах и контрольной группе и результаты генотипирования представлены в Приложении (табл. П.1).
Таблица 1.
Ассоциации между аллельным полиморфизмом изученных генов и риском депрессивного эпизода
| Генотип | Контрольная группа, N (%) | ДЭ, N (%) | Модель: LRT, p | ОШ, p, 95% ДИ |
|---|---|---|---|---|
| Ген SLC6A3/DAT1, локус 40 пн VNTR | ||||
| LL | 113 (69.3) | 59 (55.7) | Кодоминантная: 7.49, 0.024* Доминантная: 5.9, 0.015* Сверхдоминантная: 4.44, 0.035* Аддитивная: 6.41, 0.011* |
0.57, 0.032*, 0.35–0.95 |
| LS | 46 (28.2) | 41 (38.6) | 1.56, 0.094+, 0.93–2.61 | |
| SS | 4 (2.5) | 6 (5.7) | 2.34, 0.197, 0.64–8.49 | |
| Ген HTR2A, локус rs6311 | ||||
| GG | 63 (38.6) | 41 (38.7) | Кодоминантная: 7.49, 0.022* Сверхдоминантая: 3.03, 0.081+ |
1.01, 0.967, 0.61–1.66 |
| AG | 72 (44.2) | 58 (54.7) | 1.52, 0.092+, 0.93–2.48 | |
| AA | 28 (17.2) | 7 (6.6) | 0.33, 0.013*, 0.14–0.79 | |
Примечание к табл. 1–4: LRT – тест отношения правдоподобий (likelihood-ratio test); ОШ – отношение шансов, рассчитаны для каждого генотипа против двух других генотипов, ДИ – доверительный интервал; ДЭ – депрессивный эпизод; РД – рекуррентная депрессия; СТДР – смешанное тревожное и депрессивное расстройство; ** выделены значения p < 0.01, * выделены значения p < 0.05, “+” – выделены значения p < 0.1.
От всех пациентов было получено информированное согласие. Исследование было одобрено Этическим комитетом Института молекулярной генетики.
Геномная ДНК была выделена из 250 мкл антикоагулированной венозной крови с использованием набора innuPREP Blood DNA Mini (Analytik Jena AG, Германия), в соответствии с рекомендациями производителя. Генотипирование проводилось с использованием локус-специфичной ПЦР и рестрикции специфичными эндонуклеазами рестрикции по методикам, описанным ранее [23–25].
Соответствие распределения частот генотипов равновесию Харди–Вайнберга было рассчитано с помощью онлайн-калькулятора (https://wpcalc.com/ en/equilibrium-hardy-weinberg/). Оценка ассоциации между генотипом и наличием заболевания проводилась методом логистической регрессии.
Были протестированы следующие модели наследования:
1. Кодоминантная. Эта модель предполагает, что каждый генотип ассоциирован с риском заболевания независимо от других.
2. Доминантная. Гомозиготы по распространенному аллелю тестируются против гомо- и гетерозигот по редкому аллелю.
3. Рецессивная. Гомозиготы по редкому аллелю тестируются против гомо- и гетерозигот по распространенному аллелю.
4. Сверхдоминантная. Гетерозиготы противопоставляются всем гомозиготам.
5. Аддитивная. Эта модель предполагает, что наличие двух ассоциированных с заболеванием аллелей увеличивает риск заболевания в 2 раза больше, чем наличие одного такого аллеля. Тест был проведен с использованием логистической регрессионной модели, а генотипы были закодированы как 0, 1 и 2 в зависимости от количества минорного аллеля.
Логистическая регрессия проводилась отдельно для каждой модели наследования. Для анализа ассоциации генотипа с такими количественными переменными, как тяжесть симптомов тревоги и депрессии, использовался метод отрицательной биномиальной регрессии. Значимость ассоциаций между генотипами и зависимыми переменными оценивалась с помощью теста отношения правдоподобий (likelihood-ratio test, LRT). Подбор наиболее подходящего варианта модели логистической регрессии для каждой модели наследования, как и подбор модели отрицательной биномиальной регрессии для количественных переменных, осуществлялся с помощью информационного критерия Акаике (Akaike information criterion, AIC). Локусы исключались из модели по одному, в порядке от наибольшего значения p-value к наименьшему, затем все варианты моделей сравнивались с помощью AIC и финальной считалась та модель, для которой коэффициент AIC минимален. Таким образом, из каждой статистической модели удалялись все локусы, исключение которых повышало ее качество. В табл. 1–4 приведены все локусы, которые остались в финальных вариантах статистических моделей. Анализ методами логистической и отрицательной биномиальной регрессии проводился с помощью инструментов R‑статистики (программа RStudio).
Таблица 2.
Ассоциации между аллельным полиморфизмом изученных генов и риском рекуррентной депрессии
| Генотип | Контрольная группа, N (%) | РД, N (%) | Модель: LRT, p | ОШ, p, 95% ДИ |
|---|---|---|---|---|
| Ген SLC6A3/DAT1, локус 40 пн VNTR | ||||
| LL | 113 (69.3) | 85 (57) | Доминантная: 6.63, 0.01* Сверхдоминантная: 6.02, 0.014+ Аддитивная: 5.87, 0.015* |
0.59, 0.025*, 0.37–0.94 |
| LS | 46 (28.2) | 59 (39.6) | 1.67, 0.034*, 1.04–2.68 | |
| SS | 4 (2.5) | 5 (3.4) | 1.38, 0.636, 0.36–5.24 | |
| Ген DRD4, локус 120 пн VNTR | ||||
| LL | 116 (71.2) | 116 (77.9) | Кодоминантная: 8.39, 0.015* Рецессивная: 8.26, 0.004** Аддитивная: 3.38, 0.066+ |
1.42, 0.178, 0.85–2.38 |
| LS | 41 (25.1) | 33 (22.1) | 0.85, 0.533, 0.5–1.43 | |
| SS | 6 (3.7) | 0 | 0.08, 0.089+, 0.0045–1.45 | |
| Ген HTR1A, локус rs6295 | ||||
| СС | 42 (25.8) | 33 (22.1) | Кодоминантная: 4.88, 0.087+ Рецессивная: 2.96, 0.086+ |
0.82, 0.455, 0.49–1.38 |
| CG | 91 (55.8) | 98 (65.8) | 1.52, 0.073+, 0.96–2.4 | |
| GG | 30 (18.4) | 18 (12.1) | 0.57, 0.077+, 0.3–1.06 | |
| Ген OXTR, локус rs53576 | ||||
| GG | 68 (41.7) | 71 (47.7) | Кодоминантная: 31.49, <0.001** Рецессивная: 30.54, <0.001** Аддитивная: 13.29, <0.001** |
1.27, 0.29, 0.81–1.99 |
| GA | 67 (41.1) | 77 (51.7) | 1.53, 0.062+, 0.98–2.4 | |
| AA | 28 (17.2) | 1 (0.7) | 0.03, 0.0008**, 0.004–0.24 | |
Таблица 3.
Ассоциации между аллельным полиморфизмом изученных генов и риском смешанного тревожного и депрессивного расстройства
| Генотип | Контрольная группа, N (%) | СТДР, N (%) | Модель: LRT, p | ОШ, p, 95% ДИ |
|---|---|---|---|---|
| Ген SLC6A3/DAT1, локус 40 пн VNTR | ||||
| LL | 113 (69.3) | 49 (50.5) | Кодоминантная: 11.9, 0.003** Доминантная: 10.01, 0.001** Рецессивная: 5.55, 0.019* Сверхдоминантная: 5.06, 0.024* Аддитивная: 11.76, 0.0006** |
0.48, 0.005**, 0.29–0.8 |
| LS | 46 (28.2) | 39 (40.2) | 1.63, 0.071+, 0.96–2.75 | |
| SS | 4 (2.5) | 9 (9.3) | 3.93, 0.026*, 1.18–13.13 | |
| Ген HTR2A, локус rs6311 | ||||
| GG | 63 (38.6) | 48 (49.5) | Доминантная: 2.8, 0.09+ Рецессивная: 3.47, 0.019* Сверхдоминантная: 5.06, 0.06+ Аддитивная: 3.6, 0.057+ |
1.47, 0.137, 0.89–2.42 |
| AG | 72 (44.2) | 40 (41.2) | 0.92, 0.73, 0.55–1.51 | |
| AA | 28 (17.2) | 9 (9.3) | 0.54, 0.112, 0.25–1.16 | |
| Ген DRD4, локус 120 пн VNTR | ||||
| LL | 116 (71.2) | 61 (62.9) | Доминантная: 4.2, 0.04* Сверхдоминантная: 3.64, 0.056+ |
0.69, 0.169, 0.41–1.17 |
| LS | 41 (25.1) | 33 (34) | 1.53, 0.124, 0.89–2.64 | |
| SS | 6 (3.7) | 3 (3.1) | 0.81, 0.768, 0.2–3.31 | |
Таблица 4.
Ассоциации между аллельным полиморфизмом изученных генов и тяжестью симптомов тревоги
| Шкала | Ген | Полиморфный локус | LRT | p |
|---|---|---|---|---|
| Ситуационная тревога | HTR1A | rs6295 | 9.49 | 0.009** |
| HTR2A | rs6311 | 4.61 | 0.0998+ | |
| OXTR | rs53576 | 6.17 | 0.046* | |
| SLC6A4 (5HTT) | Stin2 | 9.16 | 0.01* | |
| DRD4 | 120 пн VNTR | 6.18 | 0.045* | |
| Личностная тревога | HTR1A | rs6295 | 7.94 | 0.019* |
| DRD4 | 120 пн VNTR | 6.51 | 0.038* |
Кроме того, ассоциация между генотипами по изученным локусам и риском расстройства с депрессивной симптоматикой оценивалась с использованием отношений шансов (ОШ) с 95%-ным доверительными интервалами (ДИ) с помощью онлайн-калькулятора (https://www.medcalc.org/calc/ odds_ratio.php). Результаты считались статистически значимыми при р < 0.05.
Аллели с полиморфизмом вариабельного числа тандемных повторов (VNTR) были классифицированы в соответствии с данными об их транскрипционной активности. Аллели локуса SLC6A3 40 пн VNTR были разделены на короткий аллель S (<10 повторов) и длинный аллель L (≥10 повторов), соответственно было изучено распределение генотипов LL, LS и SS. Аллели DRD4 48 пн VNTR также были классифицированы как длинные L (≥7 повторов) и короткие S (<7 повторов). При исследовании полиморфизма гена SLC6A4 учитывались два локуса, 5-HTTLPR и rs25531. Аллели были разделены на low (низкий уровень экспрессии, аллели S и LG) и high (высокий уровень экспрессии, аллель LA). Аллели локуса SLC6A4 16–17 пн VNTR были классифицированы как high (12 повторов) и low (9, 10 повторов) в соответствии с уровнем экспрессии.
РЕЗУЛЬТАТЫ
Нами были изучены следующие гены дофаминергической, серотонинергической и эндокринной систем: SLC6A3/DAT1 (локус 40 пн VNTR), DRD2 (локус rs1800497), DRD4 (локусы 120 пн VNTR и 48 пн VNTR), COMT (локус rs4680), SLC6A4/5HTT (локусы 5-HTTLPR + rs25531 и Stin2), HTR1A (локус rs6295), HTR2A (локус rs6311), HTR1B (локус rs6296), OXTR (локус rs53576). Распределение аллелей и генотипов всех изученных локусов в наших выборках соответствует равновесию Харди–Вайнберга.
Депрессивный эпизод ассоциирован с полиморфными вариантами генов SLC6A3/DAT1 и HTR2A (табл. 1). Остальные локусы были исключены при подборе моделей логистической регрессии. Ассоциация локуса 40 пн VNTR гена SLC6A3 с ДЭ оказалась значимой в кодоминантной (p = 0.024), доминантной (p = 0.015), сверхдоминантной (p = = 0.035) и рецессивной (p = 0.011) моделях. Генотипы SS и LS встречаются значительно чаще у пациентов с ДЭ, а для носителей генотипа LL риск развития заболевания оказался ниже, чем для носителей других генотипов (ОШ = 0.57, 0.35–0.95, p = 0.032). Локус rs6311 гена HTR2A статистически значимо ассоциирован с ДЭ только в кодоминантной модели (p = 0.022). Генотип AA более распространен в контрольной группе, и было показано, что он может играть защитную роль (ОШ = 0.33, 0.14–0.79, p = 0.013).
Генетическими факторами риска для рекуррентной депрессии являются полиморфные варианты генов SLC6A3 (40 пн VNTR), DRD4 (120 пн VNTR) и OXTR (rs53576) (табл. 2). Ассоциация между РД и локусом VNTR 40 пн гена SLC6A3 значима в доминантной (p = 0.01) и аддитивной (p = 0.015) моделях. Носители генотипа LL имеют низкий риск развития заболевания (ОШ = 0.59, 0.37–0.94, p = 0.025). Для локуса 120 пн VNTR гена DRD4 была показана ассоциация с РД в кодоминантной (p = 0.015) и рецессивной (p = 0.004) моделях. Гомозиготный по минорному аллелю генотип SS отсутствует в выборке пациентов с РД, в контрольной группе частота генотипа SS составила 3.7%. Локус rs53576 гена OXTR статистически значимо ассоциирован с риском РД по результатам тестирования кодоминантной, рецессивной и аддитивной моделей (p < 0.001). Несмотря на то что генотип AA встречается с достаточно высокой частотой в контрольной группе (17.2%), только один пациент с РД является носителем этого генотипа, и поэтому он сильно коррелирует с низким риском заболевания (ОШ = 0.03, 0.004–0.24, p = 0.0008). При подборе модели логистической регрессии для тестирования кодоминантой и рецессивной моделей наследования локус rs6295 гена HTR1A был оставлен в финальной версии, однако корреляция между распределением генотипов этого локуса и РД не была статистически значимой (табл. 2).
Наиболее сильная ассоциация со смешанным тревожным и депрессивным расстройством была показана для локуса 40 пн VNTR гена SLC6A3, результат оставался статистически значимым при тестировании любых моделей наследования (табл. 3). Генотип SS ассоциирован с высоким риском развития заболевания (ОШ = 3.93, 1.18–13.13, p = 0.026), а LL-генотип играет защитную роль (ОШ = 0.48, 0.29–0.8, p = 0.005). Полиморфный вариант rs6311 в гене HTR2A ассоциирован с СТДР при тестировании рецессивной (p = 0.019), а локус 120 пн VNTR гена DRD4 – доминантной (p = 0.04) моделей наследования.
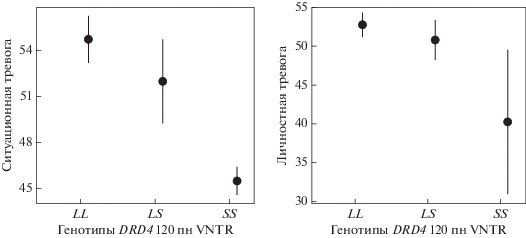
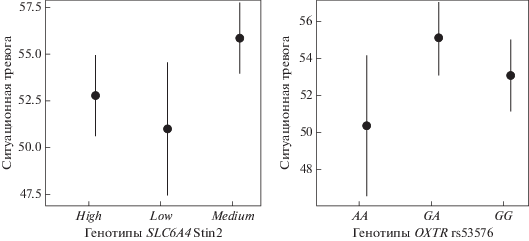
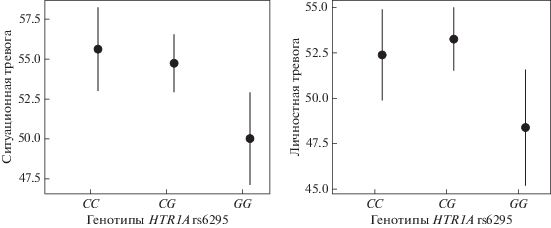
Чтобы проверить связаны ли изученные локусы с тяжестью течения заболевания, мы объединили всех пациентов в одну выборку и проанализировали ассоциации между генотипами и тяжестью симптомов депрессии и тревоги (табл. 4). Локусы rs6295 гена HTR1A и 120 пн VNTR гена DRD4 ассоциированы с ситуационной (p = 0.009 и 0.045) и личностной (p = 0.019 и 0.038) тревогой (рис. 1 и 2). С тяжестью симптомов ситуационной тревоги также ассоциированы локусы rs53576 гена OXTR (p = 0.046) и Stin2 гена SLC6A4 (p = 0.01) (рис. 3). Не было обнаружено ассоциаций между изученными генами и тяжестью симптомов депрессии.
Рис. 1.
Ассоциация локуса rs6295 гена HTR1A с симптомами личностной и ситуационной тревоги. Для рис. 1–3: по шкале Y отложены баллы, полученные в результате тестирования пациентов на тяжесть симптомов тревоги. На шкале Х отмечены генотипы по изученным локусам.
ОБСУЖДЕНИЕ
Наше исследование было направлено на поиск генетических факторов риска, общих для разных расстройств с депрессивной симптоматикой и специфичных для определенного заболевания. Мы объединили пациентов в выборки, максимально однородные по диагнозу и этническому происхождению. В настоящем исследовании показано, что полиморфный локус 40 пн VNTR гена SLC6A3 ассоциирован со всеми изученными заболеваниями. Ранее была показана ассоциация между аллелем 9R и тяжестью симптомов депрессии [14]. В наших выборках генотип SS, представляющий собой любые сочетания аллелей 6R, 8R и 9R, ассоциирован с высоким риском депрессивных заболеваний, но не с тяжестью симптомов депрессии и тревоги. Частота генотипа LL (аллели 10R и 11R) выше в контрольной группе, чем у пациентов. Результат тестирования доминантной модели наследования, противопоставляющей генотип LL остальным, значим во всех выборках. Анализ ОШ подтверждает, что носители генотипа LL имеют сниженный риск развития всех изученных расстройств. Кроме того, для всех заболеваний значим результат тестирования аддитивной модели наследования, что указывает на более высокий риск заболевания у носителей генотипа SS по сравнению с носителями только одного аллеля S. Аллельный вариант 10R ассоциирован с более высокой активностью транскрипции по сравнению с аллелем 9R [1], поэтому наши результаты позволяют предположить, что низкая активность экспрессии гена дофаминового транспортера ассоциирована с риском развития всех изученных расстройств депрессивного спектра. В выборках с РД и СТДР статистически значимые отличия наблюдались в распределении генотипов локуса 120 пн VNTR гена DRD4. В опубликованном ранее исследовании, проведенном на выборке пациентов с общим диагнозом “большое депрессивное расстройство”, была обнаружена ассоциация генотипа LL с заболеванием [15]. В настоящем исследовании у пациентов с РД генотип LL, отличающийся более высокой транскрипционной активностью [4], также встречается чаще, чем в контрольной группе, и ни один пациент не является носителем генотипа SS. Самые значимые результаты получены при тестировании рецессивной модели наследования, противопоставляющей редкий генотип SS остальным генотипам. Кроме того, анализ ОШ позволяет предположить, что у носителей генотипа SS, ассоциированного с низким уровнем экспрессии, ниже риск развития РД. В группе СТДР ассоциация значима только при тестировании доминантной модели наследования, при этом самый распространенный генотип LL встречается у пациентов реже, чем в контрольной группе, и не ассоциирован с повышенным риском заболевания. С ДЭ в нашей выборке данный локус не ассоциирован. Кроме того, нами было показано, что этот полиморфный локус коррелирует с тяжестью симптомов ситуационной тревоги. Ввиду низкой встречаемости аллеля S эти результаты требуют проверки на больших выборках.
Полиморфный локус rs6311 гена HTR2A в изученных выборках ассоциирован с ДЭ и СТДР, но не с РД. Ранее было показано, что аллель A ассоциирован с повышенным уровнем экспрессии [13]. В обеих наших выборках генотип AA встречается реже, чем в контрольной группе, и, возможно, играет защитную роль. Вклад гена HTR2A в риск развития депрессивных расстройств был изучен ранее и, несмотря на результаты отдельных работ, метаанализ не выявил значимых ассоциаций [16]. Возможно, дальнейшие исследования, проведенные на однородных по диагнозу выборках большего размера, позволят уточнить эти результаты. Мы также показали возможную ассоциацию локуса rs6295 гена HTR1A с РД. Ранее были получены результаты, подтверждающие ассоциацию депрессивных и тревожных расстройств с аллелем G локуса rs6295 гена HTR1A [17, 18]. В нашем исследовании у пациентов чаще встречается генотип CG, но не GG, и ассоциация этого локуса с РД не является статистически значимой. Однако этот полиморфный локус оказался ассоциирован с тяжестью симптомов как ситуационной, так и личностной тревоги. Специфический генетический фактор риска был выявлен для РД. В предыдущем исследовании генотип GG локуса rs53576 гена OXTR был ассоциирован с униполярной депрессией [21], к которой относится в том числе рекуррентная депрессия, изученная нами отдельно. В наших выборках распределение генотипов локуса rs53576 гена OXTR не отличается у пациентов с ДЭ и СТДР по сравнению с контрольной группой. Отличия оказались значимыми только у пациентов с РД. Тестирование рецессивной модели наследования, в которой редкий генотип AA противопоставлен остальным, и анализ ОШ подтверждают, что риск РД для носителей генотипа AA статистически значимо ниже, чем для носителей других генотипов. Кроме того, этот локус ассоциирован с тяжестью симптомов ситуационной тревоги. Распределение генотипов локуса Stin2 гена SLC6A4 не ассоциированно в наших выборках с риском изученных заболеваний, но значимо коррелирует с тяжестью симптомов ситуационной тревоги. Исследование трехаллельного комбинированного локуса (5-HTTLPR + rs25531) гена серотонинового транспортера SLC6A4 с использованием классификации генотипов согласно их транскрипционной активности не подтвердило предположения об ассоциации уровня экспрессии этого гена с риском депрессивных расстройств.
Нами были показаны как общие для всех или некоторых из изученных заболеваний ассоциации, так и специфический генетический фактор риска для РД. Кроме того, были выявлены локусы, которые, возможно, не ассоциированы с риском заболевания у здоровых людей, но коррелируют с тяжестью симптомов у пациентов, уже страдающих от депрессивного или тревожного расстройства. Таким образом, разделение пациентов на группы с одинаковыми диагнозами может быть полезно для понимания того, с каким именно заболеванием ассоциирован тот или иной локус.
Данное исследование имеет ряд ограничений. Оно проведено на небольшой выборке, поэтому некоторые редкие генотипы отсутствуют или мало представлены в отдельных группах пациентов. Кроме того, в данной работе проводится анализ ассоциации между риском развития депрессивных расстройств и генотипами без учета каких-либо других факторов. Средний возраст пациентов при этом оказался ниже среднего возраста контрольной группы, однако в данной работе этот критерий не влияет на результат. Дальнейшие исследования, проведенные на гомогенных по диагнозу и этническому происхождению выборках, но при этом с большим числом пациентов и с учетом большего числа факторов, требуются для проверки полученных результатов.
Работа была выполнена на базе Центра коллективного пользования Института биологии гена Российской академии наук при поддержке грантов Российского фонда фундаментальных исследований (РФФИ) № 19-04-00383, 17-29-02203-ofi-m, 19-015-00380.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
VanNess S.H., Owens M.J., Kilts C.D. The variable number of tandem repeats element in DAT1 regulates in vitro dopamine transporter density // BMC Genet. 2005. № 6. P. 55. https://doi.org/10.1186/1471-2156-6-55
Inoue-Murayama M., Adachia S., Mishima N. et al. Variation of variable number of tandem repeat sequences in the 3'-untranslated region of primate dopamine transporter genes that affects reporter gene expression // Neurosci. Lett. 2002. V. 334. № 3. P. 206–210. https://doi.org/10.1016/S0304-3940(02)01125-4
Schoots O., Van Tol H.H. The human dopamine D4 receptor repeat sequences modulate expression // Pharmacogenomics J. 2003. V. 3. № 6. P. 343–348. https://doi.org/10.1038/sj.tpj.6500208
D’Souza U.M., Russa C., Tahiret E. et al. Functional effects of a tandem duplication polymorphism in the 5'flanking region of the DRD4 gene // Biol. Psychiatry. 2004. V. 56. № 9. P. 691–697. https://doi.org/10.1016/j.biopsych.2004.08.008
Noble E.P., Blum K., Ritchie T. et al. Allelic association of the D2 dopamine receptor gene with receptor-binding characteristics in alcoholism // Arch. Gen. Psychiatry. 1991. V. 48. № 7. P. 648–654. https://doi.org/10.1001/archpsyc.1991.01810310066012
Lachman H.M., Papolos D.F., Saito T. et al. Human catechol-O-methyltransferase pharmacogenetics: Description of a functional polymorphism and its potential application to neuropsychiatric disorders // Pharmacogenetics. 1996. V. 6. № 3. P. 243–250. https://doi.org/10.1097/00008571-199606000-00007
Heils A., Mossner R., Lesch K.P. et al. The human serotonin transporter gene polymorphism – basic research and clinical implications // J. Neural. Transm. (Vienna). 1997. V. 104. № 10. P. 1005–1014.
Hu X.Z., Lipsky R.H., Zhu G. et al. Serotonin transporter promoter gain-of-function genotypes are linked to obsessive-compulsive disorder // Am. J. Hum. Genet. 2006. V. 78. № 5. P. 815–826. https://doi.org/10.1086/503850
MacKenzie A., Quinn J. A serotonin transporter gene intron 2 polymorphic region, correlated with affective disorders, has allele-dependent differential enhancer-like properties in the mouse embryo // Proc. Natl Acad. Sci. USA. 1999. V. 96 № 26. P. 15251–15255. https://doi.org/10.1073/pnas.96.26.15251
Lemonde S., Turecki G., Bakish D. et al. Impaired repression at a 5-hydroxytryptamine 1A receptor gene polymorphism associated with major depression and suicide // J. Neurosci. 2003. V. 23. № 25. P. 8788–8799. https://doi.org/10.1523/JNEUROSCI.23-25-08788.2003
Czesak M., Lemonde S., Peterson E.A. et al. Cell-specific repressor or enhancer activities of Deaf-1 at a serotonin 1A receptor gene polymorphism // J. Neurosci. 2006. V. 26 № 6. P. 1864–1871. https://doi.org/10.1523/JNEUROSCI.2643-05.2006
Duan J., Sanders A.R., Molen J.E. et al. Polymorphisms in the 5'-untranslated region of the human serotonin receptor 1B (HTR1B) gene affect gene expression // Mol. Psychiatry. 2003. V. 8. № 11. P. 901–910. https://doi.org/10.1038/sj.mp.4001403
Parsons M.J., D’Souza U.M., Arranzet M.J. et al. The ‒1438A/G polymorphism in the 5-hydroxytryptamine type 2A receptor gene affects promoter activity // Biol. Psychiatry. 2004. V. 56. № 6. P. 406–410. https://doi.org/10.1016/j.biopsych.2004.06.020
Bielinski M., Jaracz M., Lesiewska N. et al. Association between COMT Val158Met and DAT1 polymorphisms and depressive symptoms in the obese population // Neuropsychiatr. Dis. Treat. 2017. № 13. P. 2221–2229. https://doi.org/10.2147/NDT.S138565
Lai J.H., Zhuab Y.S., Huoet Z.H. et al. Association study of polymorphisms in the promoter region of DRD4 with schizophrenia, depression, and heroin addiction // Brain Res. 2010. № 1359. P. 227–232. https://doi.org/10.1016/j.brainres.2010.08.064
Zhao X., Sun L., Sun Y.H. et al. Association of HTR2A T102C and A-1438G polymorphisms with susceptibility to major depressive disorder: a meta-analysis // Neurol. Sci. 2014. V. 35. № 12. P. 1857–1866. https://doi.org/10.1007/s10072-014-1970-7
Lenze E.J., Shardellb M., Ferrell R.E. et al. Association of serotonin-1A and 2A receptor promoter polymorphisms with depressive symptoms and functional recovery in elderly persons after hip fracture // J. Affect Disord. 2008. V. 111. № 1. P. 61–66. https://doi.org/10.1016/j.jad.2008.02.005
Molina E., Cervilla J., Rivera M. et al. Polymorphic variation at the serotonin 1-A receptor gene is associated with comorbid depression and generalized anxiety // Psychiatr Genet. 2011. V. 21. № 4. P. 195–201. https://doi.org/10.1097/YPG.0b013e3283457a48
Рафикова Е.И., Рысков А.П. Васильев В.А. Генетика депрессивных расстройств: кандидатные гены и полногеномный поиск ассоциаций // Генетика. 2020. Т. 56. № 8. С. 878–892. https://doi.org/10.31857/S001667582008011
Na K.S., D’Souza U.M., Arranz M.J. et al. Interaction effects of oxytocin receptor gene polymorphism and depression on hippocampal volume // Psychiatry Res. Neuroimaging. 2018. V. 282. P. 18–23. https://doi.org/10.1016/j.pscychresns.2018.10.004
Costa B., Pini S., Gabelloni P. et al. Oxytocin receptor polymorphisms and adult attachment style in patients with depression // Psychoneuroendocrinology. 2009. V. 34. № 10. P. 1506–1514. https://doi.org/10.1016/j.psyneuen.2009.05.006
Рафикова Е.И., Рысков А.П., Шадрина М.И., Сломинский П.А., Гехт А.Б., Шибалёв Д.В., Васильев В.А. Влияние полиморфных вариантов генов дофаминергической системы на риск развития расстройств с депрессивной симптоматикой // Генетика. 2021. Т. 57. № 8. С. 941–948.
Sukhodolskaya E.M., Fehretdinova D.I., Shibalev D.V. et al. Polymorphisms of dopamine receptor genes DRD2 and DRD4 in African populations of Hadza and Datoga differing in the level of culturally permitted aggression // Ann. Hum. Genet. 2018. V. 82. № 6. P. 407–414. https://doi.org/10.1111/ahg.12263
Fehretdinova D.I., Sukhodolskaya E.M., Shibalev D.V. et al. Polymorphism of the Two Genes Encoding Catecholamine Degradation Enzymes (COMT and MAOA) in the Hadza and Datoga African Ethnic Populations // Mol. Genetics, Microbiol. and Virology. 2018. V. 33. № 3. P. 195–200. https://doi.org/10.3103/S0891416818030035
Суходольская Е.М., Васильев В.А., Шибалев Д.В. 3'‑UTR полиморфизм гена транспортера дофамина у мужчин хадзы и датога // Мол. биология. 2014. V. 48. № 2. P. 295–299.
Дополнительные материалы
- скачать ESM.xlsx
- Приложение 1.