Генетика, 2022, T. 58, № 1, стр. 45-51
Динамика генетической структуры популяций медоносной пчелы Apis mellifera на Южном Урале
М. Д. Каскинова 1, *, Л. Р. Гайфуллина 1, Е. С. Салтыкова 1, А. В. Поскряков 1, А. Г. Николенко 1
1 Институт биохимии и генетики – обособленное структурное подразделение
Уфимского федерального исследовательского центра Российской академии наук
450054 Уфа, Россия
* E-mail: kaskinovamilyausha@mail.ru
Поступила в редакцию 29.03.2021
После доработки 12.07.2021
Принята к публикации 10.08.2021
- EDN: XZWFPO
- DOI: 10.31857/S0016675822010040
Аннотация
Мы проанализировали выборки пчел из трех районов Республики Башкортостан, в том числе выборки из охраняемых природных территорий, отобранных с 6–8-летним интервалом для оценки изменений их генетической структуры. Проанализирован полиморфизм межгенного участка COI-COII митохондриальной ДНК и девять SSR-локусов ядерной ДНК. В популяции Apis mellifera mellifera из охраняемой природной территории была выявлена интрогрессия генофонда подвидов из эволюционной ветви С. Полученные результаты позволяют предложить меры по ограничению ввоза пчелосемей.
Медоносная пчела является важным опылителем сельскохозяйственных культур и естественных фитоценозов. В настоящее время наблюдается снижение численности и биоразнообразия опылителей, в том числе медоносной пчелы [1]. Среди причин сокращения численности медоносных пчел выделяют несколько факторов, в том числе гибридизацию подвидов, которая ведет к потере адаптивного потенциала [2, 3]. Происходит как естественная гибридизация в пограничных зонах распространения подвидов, так и антропогенная, вызванная импортом чужеродных подвидов. Темная лесная пчела (A. m. mellifera) – аборигенный подвид медоносной пчелы для России, является представителем эволюционной ветви М [4–7]. Некогда ареал распространения темной лесной пчелы занимал территорию от Пиренейских до Уральских гор [8], сейчас же этот подвид представлен отдельными локальными популяциями, которые сохранились в некоторых странах Европы и регионах России. Популяции темной лесной пчелы были выявлены на территории Пермского края (вишерская и южно-прикамская популяции), Башкортостана (бурзянская и татышлинская) и Удмуртии (камбарская) [9]. Импорт пакетов пчелиных семей, принадлежащих к эволюционной ветви С, куда входят два наиболее распространенных в коммерческом пчеловодстве подвида – итальянская медоносная пчела A. m. ligustica и краинская A. m. carnica, привел к фрагментации ареала A. m. mellifera. Проблема сохранения генофонда разных подвидов медоносной пчелы была поднята в связи с тем, что гибридизация приводит к потере генных ассоциаций, характерных для каждого конкретного подвида и экотипа, ответственных за адаптивность и экологическую пластичность.
Морфометрические и генетические исследования пчел из разных районов Республики Башкортостан (РБ) показали, что гибридизация популяции темной лесной пчелы в данном регионе достигла уровня, при котором естественное восстановление генофонда A. m. mellifera невозможно [10, 11]. В качестве одного из способов его восстановления было предложено создание закрытых локальных популяций, то есть селекционных центров по разведению темной лесной пчелы. В РБ охраной темной лесной пчелы занимается заповедник федерального значения “Шульган-Таш”. С целью охраны бурзянской популяции был также создан заказник регионального значения “Алтын Солок”. Помимо государственных природоохранных организаций, разведением темной лесной пчелы занимается племенное хозяйство в Иглинском р-не.
Цель данной работы – оценка изменения в генетической структуре популяций темной лесной пчелы на территории Бурзянского, Янаульского и Иглинского р-нов РБ на основе анализа выборок 2011–2013 гг. и 2019 г. Территория первых двух районов является ареалом обитания сохранившейся на Южном Урале популяции темной лесной пчелы. Территория Иглинского р-на относится к умеренно-гибридной зоне [9]. Тем не менее, этот район интересен тем, что в нем располагается племенное хозяйство, специализирующееся на разведении темной лесной пчелы, в условиях неблагоприятного трутневого фона. С помощью анализа полиморфизма межгенного локуса COI-COII мтДНК и девяти SSR-локусов нами была проанализирована генетическая структура данных выборок, отобранных с интервалом в 6–8 лет. Анализ межгенного локуса COI-COII мтДНК является одним из простых и надежных методов дифференциации эволюционных ветвей М и С [12]. Аллельные варианты P(Q)1 – n являются маркерами происхождения пчел от A. m. mellifera, вариант Q – от подвидов из эволюционной ветви С по материнской линии.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для анализа стали выборки из Янаульского (девять населенных пунктов, 2011 и 2019 гг.), Бурзянского (три пункта, заповедник “Шульган-Таш” и заказник “Алтын Солок”, 2013 и 2019 гг.) и Иглинского р-нов (одна племенная пасека, 2012 и 2019 гг.) РБ. Расположение районов приведено на рис. 1. В качестве референтных групп эволюционной ветви М были использованы выборки A. m. mellifera из Татышлинского р-на РБ (выборка 2003 г., N = 72) и Пермского края (выборка 2003 г., N = 67). Выборки из Республики Адыгея (выборка 2003 г., A. m. carnica, N = 15), Краснодарского края (выборка 2003 г., A. m. caucasica, N = 53), Закарпатской области Украины (выборка 2003 г., A. m. carpatica, N = 13) и Узбекистана (выборка 2016 г., A. m. carnica/A. m. carpatica, N = 52) использовались в качестве референсных выборок, принадлежащих к эволюционной ветви С.
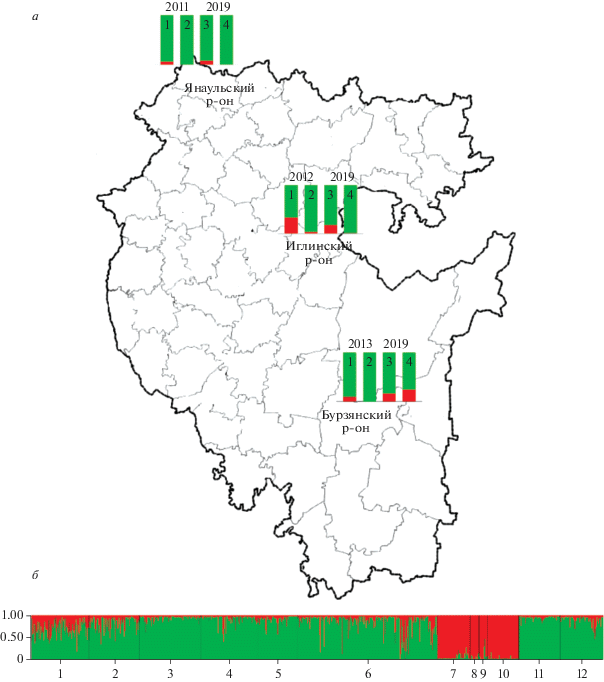
Рис. 1.
a – географическое расположение выборок и их генетическая структура на основе данных по локусу COI-COII мтДНК (2 и 4) и по данным SSR-локусов (1 и 3). б – генетическая структура популяции исследуемых выборок при K = = 2. 1 и 2 – Иглинская 2012 и 2019 гг., 3 и 4 – Янаульская 2011 и 2019 гг., 5 и 6 – Бурзянская 2013 и 2019 гг., 7 – Краснодарский край (A. m. caucasica), 8 – Республика Адыгея (A. m. carnica), 9 – Украина (A. m. carpatica), 10 – Узбекистан (A. m. carpatica/A. m. carnica), 11 – Пермский край (A. m. mellifera), 12 – РБ, Татышлинский р-н (A. m. mellifera). Зеленым цветом обозначена доля эволюционной ветви М, красным – ветви С.
Отобранные из каждой семьи живые рабочие пчелы фиксировались в 96%-ном этаноле и хранились до выделения ДНК при –30°С. ДНК выделяли из мышц торакса с использованием набора ДНК-ЭКСТРАН-2 (ООО “СИНТОЛ”, Москва). Качество и количество тотальной ДHK анализировали на спектрофотометре NanoDrop 1000 (Thermo, США). Подвидовую принадлежность определяли при помощи ПЦР-анализа мтДНК (межгенный участок COI-COII) и SSR-локусов Ap243, 4a110, А24, A8, A43, A113, A88, Ap049, A28 [13]. Для визуализации продуктов амплификации использовали электрофорез в 8% полиакриламидном геле с последующей детекцией в фотосистеме Gel Doc XR+ (Bio-Rad Laboratories).
Вычисления частот аллелей микросателлитных локусов и оценку попарных генетических расстояний Fst между выборками выполняли в FSTAT. Кластерный анализ данных был осуществлен в ПО Structure 2.3.4 (с использованием модели Admixture с Burnin Period и MCMC равными 10 000 и 100 000 соответственно). Число кластеров было задано от 1 до 12. Предполагаемое число кластеров рассчитывали в онлайн-сервисе Structure Harvester [14]. Полученные в Structure результаты обрабатывали в CLUMPP 1.1.2 с помощью алгоритма FullSearch [15].
РЕЗУЛЬТАТЫ
В табл. 1 представлены показатели интрогрессии генофонда эволюционной ветви С в исследуемых выборках на уровне мтДНК. Аллельный вариант Q был выявлен в бурзянской выборке за 2019 г. у 24% семей, в иглинской – у 2%. В янаульской выборке данный аллельный вариант не обнаружен.
Таблица 1.
Показатели интрогрессии генофонда эволюционной ветви С в исследуемых выборках на уровне митохондриальной ДНК
| Выборка | Янаульская | Бурзянская | Иглинская | |||
|---|---|---|---|---|---|---|
| Год (N) | 2011 (100) | 2019 (93) | 2013 (65) | 2019 (228) | 2012 (95) | 2019 (82) |
| Частота аллельного варианта Q COI-COII мтДНК | 0.00 | 0.00 | 0.00 | 0.24 | 0.03 | 0.01 |
| Частота аллельного варианта PQQ COI-COII мтДНК | 0.91 | 0.59 | 1.00 | 0.76 | 0.97 | 0.98 |
| Частота аллельного варианта PQQQ COI-COII мтДНК | 0.09 | 0.41 | 0.00 | 0.00 | 0.00 | 0.01 |
Анализ выходных данных Structure в Structure-harvester показал, что общая исследуемая выборка состоит из двух основных кластеров (K = 2, ΔK = 391.025947) (рис. 1). Первый кластер представлен темной лесной пчелой, в состав второго кластера входят оставшиеся подвиды из эволюционной ветви С.
В табл. 2 представлены данные об изменениях уровня интрогрессии генофонда линии С в исследуемой выборке, которые в целом соответствуют данным по локусу COI-COII.
Таблица 2.
Показатели интрогрессии генофонда эволюционной ветви С в исследуемых выборках на уровне ядерной ДНК
| Выборка | Янаульская | Бурзянская | Иглинская | |||
|---|---|---|---|---|---|---|
| Год (N) | 2011 (100) | 2019 (93) | 2013 (65) | 2019 (228) | 2012 (95) | 2019 (82) |
| Доля М (яДНК) | 0.938 | 0.919 | 0.903 | 0.839 | 0.677 | 0.823 |
| Увеличение +/снижение – уровня интрогрессии генофонда ветви С (яДНК), % | +1.9% | +6.4% | –14.6% | |||
Для оценки генетических расстояний между выборками были рассчитаны попарные Fst (табл. 3). Наибольший уровень дивергенции наблюдается между янаульской выборкой и референсной выборкой ветви С, представленной подвидами A. m. carnica, A. m. carpatica и A. m. caucasica (см. Материалы и методы). Наименьшая дивергенция с ветвью С наблюдается у иглинской выборки за 2012 г. Тогда как дивергенция между референсными выборками С и М составила 0.4920.
Проблема сохранения популяций A. m. mellifera является актуальной не только для России, но и в европейских странах [16–18]. Так, в 1964 г. была создана ассоциация, известная сейчас как BIBBA (Bee Improvers and Bee Breeders Association), целями которой стали сохранение, восстановление и изучение темной лесной пчелы, приспособленной к условиям обитания в Великобритании и Ирландии (https://bibba.com/). В Швеции еще в 1990 г. был организован проект по защите местных популяций темной лесной пчелы (https://www.nordbi.se/). Для восстановления генофонда темной лесной пчелы необходим поиск и дальнейший мониторинг сохранившихся популяций. Популяционно-генетические исследования на территории России на основе анализа межгенного участка COI-COII мтДНК и девяти SSR-локусов яДНК, используемых в данном исследовании, показали, что на Урале и в Поволжье сохранился массив чистопородного генофонда темной лесной пчелы, распределенный в пяти популяциях: бурзянской и татышлинской (РБ), южно-прикамской и вишерской (Пермский край) и камбарской (Республика Удмуртия) [11]. В данном исследовании было установлено, что в янаульской выборке за восемь лет произошло увеличение доли аллельного варианта PQQQ. Данный аллельный вариант PQQQ характерен для пчелосемей из Пермского края. В иглинской выборке наблюдается снижение доли интрогрессии ветви С как на уровне митохондриального, так и ядерного генома.
Для оценки динамики генетической структуры популяций темной лесной пчелы нами были оценены выборки из трех районов РБ. Это выборки из янаульской и бурзянской популяции темной лесной пчелы, где пробы были отобраны из разных пасек, и выборка из племенной пасеки Иглинского р-на, специализирующейся на разведении A. m. mellifera в отсутствии благоприятной буферной зоны. Кластерный анализ генетической структуры на основе полиморфизма SSR-локусов показал, что за семь лет в иглинской выборке произошло снижение уровня интрогрессии на 14.6%. Тогда как в янаульской и бурзянской произошло увеличение уровня интрогрессии генофонда линии С. Минимальная дивергенция между выборками, отобранными в разные годы, составила 0.0173 в Янаульском р-не. В иглинской и бурзянской выборках дивергенция почти одинакова и составила 0.0488 и 0.0503 соответственно. Следовательно, можно предположить, что за 6–7 лет произошло небольшое изменение генофонда данных выборок. Если в иглинской выборке изменение идет в сторону улучшения, то в бурзянской наблюдается гибридизация с подвидами из эволюционной ветви С. Дивергенция между выборками С и М, используемыми в данном исследовании как референсные, составила 0.4920. Наибольшая дивергенция наблюдается между янаульскими выборками и выборкой С (табл. 2). По данным J. Cridland с соавт., значение попарных Fst между выборками пчел из эволюционных ветвей М и С, вычисленное на основе полногеномных данных, составляет 0.268; в своем исследовании авторы изучали подвиды пчел, принадлежащие пяти эволюционным ветвям [6]. Нами были использованы подвиды пчел, принадлежащие только двум эволюционным ветвям – М и С. Эти результаты показывают, что используемый подход анализа генетической структуры популяций сильно зависит от численности выборок и количества анализируемых локусов.
Таблица 3.
Попарные Fst между выборками четырех подвидов
| С | М | Yn2011 | Yn2019 | Ig2012 | Ig2019 | Bz2013 | Bz2019 | |
|---|---|---|---|---|---|---|---|---|
| C | 0.0000 | 0.4920 | 0.5334 | 0.5119 | 0.2894 | 0.3988 | 0.4987 | 0.4045 |
| M | * | 0.0000 | 0.0263 | 0.0128 | 0.0980 | 0.0605 | 0.0828 | 0.0299 |
| Yn2011 | * | * | 0.0000 | 0.0173 | 0.1249 | 0.0759 | 0.0626 | 0.0278 |
| Yn2019 | * | * | * | 0.0000 | 0.1103 | 0.0589 | 0.0668 | 0.0251 |
| Ig2012 | * | * | * | * | 0.0000 | 0.0488 | 0.0895 | 0.0559 |
| Ig2019 | * | * | * | * | * | 0.0000 | 0.0700 | 0.0134 |
| Bz2013 | * | * | * | * | * | * | 0.0000 | 0.0503 |
| Bz2019 | * | * | * | * | * | * | * | 0.0000 |
На основе полученных данных мы предположили, что сохранению генофонда A. m. mellifera способствуют два основных фактора. Первый фактор – это наличие благоприятной буферной зоны, то есть наличие непрерывного массива семей A. m. mellifera. Сохранность янаульской популяции обеспечивается за счет соседства с Пермским краем и Удмуртией, где большинство семей принадлежат к A. m. mellifera. Второй фактор – это контроль со стороны пчеловода. Он включает в себя мониторинг подвидовой принадлежности с последующей заменой маток в гибридных семьях и искусственное осеменение спермой трутней, принадлежащих к A. m. mellifera, если естественный трутневый фон неблагоприятный. Пример иглинской выборки показывает, что данные мероприятия могут привести к восстановлению генофонда темной лесной пчелы.
Неожиданные результаты были получены для бурзянской популяции. Несмотря на действующий запрет ввоза пчелосемей на охраняемую природную территорию, в исследуемой выборке был выявлен опасный уровень гибридизации. За шесть лет интрогрессия генофонда ветви С увеличилась на 6.4% и составила 16.1% на уровне ядерного генома и 24% на уровне митохондриального. Причиной такой разницы является наличие благоприятного трутневого фона, который компенсирует последствия завоза пчелосемей из ветви С и таким образом сдерживает гибридизацию. Следовательно наличие благоприятного трутневого фона не является единственным гарантом сохранности генофонда темной лесной пчелы. Без контроля со стороны пчеловодов и отсутствия мониторинга дальнейшая судьба данной популяции находится под угрозой. На сегодняшний день запрещено завозить пчел на территорию заповедника “Шульган-Таш” и заказника “Алтын Солок”. Общая площадь данных охранных зон небольшая (225 и 899 км2 соответственно, т.е. около 25% от территории Бурзянского р-на) и, следовательно, для обеспечения охраны бурзянской популяции этой площади недостаточно. Необходимо ввести запрет на ввоз пчел не только на охраняемые территории, а на всю территорию Бурзянского р-на. Несмотря на то, что местное население старается контролировать завоз пчел, как показывают наши данные, он все же происходит. В Норвегии на территории площадью около 3500 км2 разрешается содержать только A. m. mellifera, и примерно такие же территории отведены под разведение A. m. carnica [19]. Аналогичную тактику пчеловодства можно внедрить и в РБ – выделить территории, где преобладает A. m. mellifera или A. m. carnica, и разводить их в пределах выделенной зоны.
Чтобы компенсировать потери пчелосемей пчеловоды вынуждены закупать пчелосемьи неизвестного происхождения. Зачастую ими оказываются пакеты с подвидами из эволюционной ветви С, поскольку они более доступны. Решением данной проблемы является создание селекционных центров по разведению темной лесной пчелы. Основная задача таких селекционных центров должна заключаться прежде всего не в создании экономически эффективных линий и породных типов, а в восстановлении естественного генофонда.
Авторы выражают благодарность В.О. Кугейко, М.Н. Косареву, АНО “Алтын Солок” (Золотая Борть), а также всем пчеловодам за предоставленный материал и сотрудничество.
Работа выполнена при финансовой поддержке гранта РФФИ № 19-54-70002 (3-й, 4-й и 5-й авторы) и госзадания AAAA-A21-121011990120-7 (1-й и 2-й авторы) с использованием оборудования ЦКП “Агидель” и УНУ “Кодинк” УФИЦ РАН.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Patel V., Pauli N., Biggs E. et al. Why bees are critical for achieving sustainable development // Ambio. 2021. V. 50. P. 49–59. https://doi.org/10.1007/s13280-020-01333-9
Jensen A.B., Palmer K.A., Boomsma J.J., Pedersen B.V. Varying degrees of Apis mellifera ligustica introgression in protected populations of the black honeybee, Apis mellifera mellifera, in northwest Europe // Mol. Ecol. 2005. V. 14. P. 93–106. https://doi.org/10.1111/j.1365-294X.2004.02399.x
Espregueira Themudo G., Rey-Iglesia A., Robles Tascon L. et al. Declining genetic diversity of European honeybees along the twentieth century // Sci. Reports. 2020. V. 10. 10520. https://doi.org/10.1038/s41598-020-67370-2
Wallberg A., Han F., Wellhagen G., Dahle B. et al. A worldwide survey of genome sequence variation provides insight into the evolutionary history of the honeybee Apis mellifera // Nat. Genetics. 2014. V. 6(10). P. 1081–1088. https://doi.org/10.1038/ng.3077
Techer M.A., Clemencet J., Simiand C. et al. Large-scale mitochondrial DNA analysis of native honey bee Apis mellifera populations reveals a new African subgroup private to the South West Indian Ocean islands // BMC Genet. 2017. V. 18(1). P. 53. https://doi.org/10.1186/s12863-017-0520-8
Cridland J.M., Tsutsui N.D., Ramirez S.R. The complex demographic history and evolutionary origin of the western honey bee, Apis mellifera // Genome Biol. Evol. 2017. V. 9(2). P. 457–472. https://doi.org/10.1093/gbe/evx009
Tihelka E., Cai C., Pisani D., Donoghue P.C.J. Mitochondrial genomes illuminate the evolutionary history of the Western honey bee (Apis mellifera) // Sci. Reports. 2020. V. 10. 14515. https://doi.org/10.1038/s41598-020-71393-0
Ruttner F. Biogeography and Taxonomy of Honey Bees. Berlin: Springer, 1998. 284 p. https://doi.org/10.1007/978-3-642-72649-1
Ильясов Р.А., Петухов А.В., Поскряков А.В., Николенко А.Г. Локальные популяции Apis mellifera mellifera L. на Урале // Генетика. 2007. Т. 43. № 6. С. 855–858.
Кугейко В.О. Морфофункциональные аспекты селекции среднерусских пчел в условиях Республики Башкортостан: Дис. … канд. биол. наук. Уфа: Башкирский гос. аграр. ун-т, 2002. 151 с.
Ильясов Р.А. Генетическая структура популяции и филогенетическое положение темной лесной пчелы Apis mellifera mellifera L. Урала и Поволжья: Дис. … доктора биол. наук. Уфа: Ин-тут биохимии и генетики Уфимского науч. центра РАН, 2016. 326 с.
Bertrand B., Alburaki M., Legout H. et al. MtDNA COI-COII marker and drone congregation area: An efficient method to establish and monitor honeybee (Apis mellifera L.) conservation centres // Mol. Ecol. Resour. 2015. V. 15. P. 673–683. https://doi.org/10.1111/1755-0998.12339
Meixner M.D., Pinto M.A., Bouga M. et al. Standard methods for characterising subspecies and ecotypes of Apis mellifera // J. Apicultural Res. 2013. V. 52(4). P. 1–28. https://doi.org/10.3896/IBRA.1.52.4.05
Earl D.A., von Holdt B.M. Structure Harvester: A website and program for visualizing STRUCTURE output and implementing the Evanno method // Conservation Genet. Resources. 2012. V. 4(2). P. 359-361. https://doi.org/10.1007/s12686-011-9548-7
Jakobsson M., Rosenberg N.A. CLUMPP: A cluster matching and permutation program for dealing with label switching and multimodality in analysis of population structure // Bioinformatics. 2007. V. 14. P. 1801–1806. https://doi.org/10.1093/bioinformatics/btm233
Parejo M., Wragg D., Gauthier L. et al. Using whole-genome sequence information to foster conservation efforts for the European dark honey bee, Apis mellifera mellifera // Front Ecol Evol. 2016. V. 4. P. 140. https://doi.org/10.3389/fevo.2016.00140
Hassett J., Browne K.A., McCormack G.P. et al. A significant pure population of the dark European honey bee (Apis mellifera mellifera) remains in Ireland // J. Apicultural Res. 2018. V. 57(3). P. 337–350. https://doi.org/10.1080/00218839.2018.1433949
Pinto M.A., Henriques D., Chavez-Galarza J., et al. Genetic integrity of the Dark European honey bee (Apis mellifera mellifera) from protected populations: A genome-wide assessment using SNPs and mtDNA sequence data // J. Apicultural Res. 2014. V. 53(2). P. 269–278. https://doi.org/10.3896/IBRA.1.53.2.08
Bouga M., Alaux C., Bienkowska M. et al. A review of methods for discrimination of honey bee populations as applied to European beekeeping // J. Apicultural Res. 2011. V. 50(1). P. 51–84. https://doi.org/10.3896/IBRA.1.50.1.06
Дополнительные материалы отсутствуют.


