Генетика, 2022, T. 58, № 4, стр. 398-409
Анализ изменчивости хлоропластной ДНК подтверждает существование нескольких плейстоценовых рефугиумов липы на юге Сибири
С. А. Семерикова 1, *, А. К. Экарт 2, **
1 Институт экологии растений и животных Уральского отделения
Российской академии наук
620144 Екатеринбург, Россия
2 Институт леса им. В.Н. Сукачева Сибирского отделения Российской академии наук
660036 Красноярск, Россия
* E-mail: s.a.semerikova@ipae.uran.ru
** E-mail: aekart@yandex.ru
Поступила в редакцию 21.07.2021
После доработки 22.09.2021
Принята к публикации 08.10.2021
- EDN: ZFWXUQ
- DOI: 10.31857/S0016675822030122
Аннотация
Периодичность расширения ареалов представителей широколиственных неморальных лесов на юге Сибири в четвертичную эпоху и наличие ледниковых рефугиумов широколиственных видов остаются малоизученными. В настоящей работе мы исследуем изменчивость пяти фрагментов хлоропластной ДНК в двух известных популяциях липы Нащокина (Tilia nasczokinii Stepanov), расположенных вблизи г. Красноярска, и в пяти популяциях дальневосточного вида липы амурской (T. amurensis Rupr.) в сравнении с данными изменчивости липы мелколистной (T. cordata Mill.) и липы сибирской (T. sibirica Bayer). Результаты изучения хлоропластной ДНК сравнивались с полиморфизмом ядерных микросателлитных локусов, с флористическими и палеогеографическими данными. Установлено, что два исследованных сибирских таксона липы – T. sibirica и T. nasczokinii, имеют независимое происхождение, поскольку несут два значительно отличающихся гаплотипа хлоропластной ДНК. Гаплотип t3a, фиксированный у липы Нащокина, был найден только в Европе, в то время как гаплотип t2, фиксированный у липы сибирской (Кузнецкий Алатау), доминирует в восточных популяциях липы мелколистной в Западной Сибири, на Урале и на Русской равнине. Оба гаплотипа отличаются от найденных у липы амурской, что исключает вклад дальневосточных видов лип в образование сибирских популяций. Выявленная структура изменчивости хлоропластной ДНК у эндемичных таксонов Tilia в Сибири согласуется с результатами изменчивости ядерных маркеров и подтверждает видовой статус T. nasczokinii. В совокупности эти данные позволяют предположить, что липа Нащокина независимо от липы сибирской и раньше нее отделилась от липы мелколистной и в дальнейшем, как и T. sibirica, переживала на юге Сибири несколько ледниковых максимумов.
Характерный для неогена и продолжившийся в четвертичное время тренд снижения температуры породил разрыв ареалов и изоляцию родственных видов – представителей широколиственных лесов Палеарктики. В то же время теплые фазы ледниковых циклов вызывали периодические расширения ареалов умеренных видов Европы и Восточной Азии вплоть до Южной Сибири. Однако масштаб, возраст и эволюционное значение таких экспансий остаются малоизученными. Флористические исследования “черневой тайги” в Южной Сибири, рассматриваемой в качестве наследия широколиственных лесов, обнаруживают значительное количество неморальных видов растений, т. н. “третичных реликтов” как европейского, так и дальневосточного происхождения (или родства) [1–3]. Исследование разнообразия насекомых юга Сибири также выявило виды, характерные для широколиственных лесов, большая часть из которых имеет восточноазиатское распространение [4].
Однако палеоданные, способные пролить свет на историю широколиственных видов в Сибири, весьма отрывочны и противоречивы. Согласно предположению, основанному на некоторых флористических, фаунистических и палеопалинологических исследованиях [1, 2, 4, 5], восстановление пояса широколиственных лесов на юге Сибири могло происходить в оптимум голоцена, причем преобладало распространение неморальных древесных пород с Дальнего Востока. По пыльцевым данным из пещер Алтая [6], широколиственные виды (липа) присутствовали на юге Сибири в позднем плейстоцене и голоцене. В то же время в торфяных и озерных отложениях голоцена на юге Западной Сибири и в Алтайском крае широколиственные деревья не найдены [7, 8]. При подтверждении палинологическим анализом периодического присутствия широколиственных древесных пород в теплые плейстоценовые фазы в отдельных районах Сибири [6, 9, 10], спорным остается возраст последнего широкого распространения неморальных пород в Южной Сибири, и, соответственно, возможных связей запад–восток и направления волн миграции.
Липа (Tilia, Malvaceae) является одним из “третичных реликтов” широколиственных лесов Сибири и единственной древесной породой, образующей в лице своих сибирских дериватов – липы сибирской (Tilia sibirica Bayer) [11–13] и липы Нащокина (T. nasczokinii Stepanov) [13–15], ряд изолированных популяций: на Западном склоне Кузнецкого Алатау, в Горной Шории и на Салаире – липа сибирская, на северо-западе Восточного Саяна вблизи Красноярска – липа Нащокина. Расстояние между популяциями двух таксонов, которые разделены Кузнецким Алатау – около 350 км. В существующей системе рода Tilia [16] сибирские популяции липы, соответствующие эндемичным таксонам, относятся к подвиду T. cordata subsp. sibirica (Fischer ex Bayer) Pigott широко распространенной в Евразии липы мелколистной (Tilia cordata Mill.). Предыдущие исследования изменчивости хлоропластной ДНК (хпДНК) T. cordata s. l. в Восточной Европе, на Урале и в Сибири [17] не включали популяции липы Нащокина. Были показаны резкие отличия популяций липы Русской равнины, Урала и Сибири от более западных популяций по составу хлоропластных гаплотипов: два распространенных на востоке гаплотипа отсутствовали в западных популяциях T. cordata, имевших при этом более высокое разнообразие [17]. Один из двух восточных гаплотипов (t2) был фиксирован у липы сибирской из Кемеровской обл., сближая ее по хпДНК с восточными популяциями липы мелколистной, что, однако, противоречит данным по ядерным микросателлитным маркерам (nSSR) [12]: nSSR-генотипы липы сибирской из Кузнецкого Алатау выделялись в один генетический кластер, а генотипы T. cordata s. s. из Западной Сибири и Европы – во второй. К тому же полученные на основе ядерных SSR оценки возраста отделения липы сибирской от липы мелколистной, включая европейские и западносибирские популяции, составляли ~450 тыс. лет назад (тыс. л. н.) [12]. Данный конфликт ядерной и хлоропластной ДНК был интерпретирован как следствие гибридного захвата липой мелколистной хпДНК липы сибирской [17].
Недавно проведенное сравнение популяций липы Нащокина на основе nSSR [13] с липой сибирской и липой мелколистной показало существенное отличие всех трех видов, косвенно свидетельствуя о значительном времени обособления липы Нащокина. В то же время вопрос о происхождении и исторических связях T. nasczokinii остается нерешенным.
Ряд исследователей липы Нащокина, исходя из флористических и экологических данных [14, 15], предполагают возможные исторические связи с дальневосточными видами липы. Так, геоботанические исследования лесных массивов, в которых находятся две известные приенисейские популяции липы, почти не выявило неморальных видов, причем среди них не было европейских [14]. Кроме того, исследование морфологических особенностей липы Нащокина [15] указывает на ее сходство по некоторым признакам с дальневосточной липой амурской (T. amurensis Rupr.). Эти два обстоятельства не позволяют исключать происхождение липы Нащокина в результате миграции с Дальнего Востока.
При выявленных значительных генетических различиях сибирских таксонов липы особый интерес представляет оценка исторической динамики реликтовых популяций – степень распространения из отдельных убежищ и связи рефугиумов между собой, исследовать которую в Сибири на основе только палеоданных плейстоцена не представляется возможным [18]. Кроме особенностей липы: плохой сохранности макроостатков, малой пыльцевой продуктивности и трудности улавливания пыльцы за пределами липовых насаждений, которое возможно только в непосредственной близости от произрастания деревьев [11], существуют проблемы надежности датировок [например 19] и большой вероятности переотложения пыльцы широколиственных пород в минеральных отложениях [11].
Для дальнейшего исследования возможных связей липы Нащокина как с западными таксонами – T. cordata, T. sibirica, так и с восточными – T. amurensis, целесообразно использовать филогеографический подход в сочетании с маркерами матерински наследуемой хпДНК. Ранее исследование изменчивости пяти хлоропластных фрагментов [17] показало отсутствие монофилии гаплотипов T. cordata и родственность некоторых из них с гаплотипами дальневосточных видов, в том числе T. amurensis, представленной, однако, единственным образцом (GenBank – MH169579).
Цель данного исследования состоит в проверке гипотез о европейском или о дальневосточном происхождении липы Нащокина. Если подтвердится европейское происхождение, то являются ли липа Нащокина и липа сибирская результатом одной миграции, или они дифференцировались от основного ареала в разное время? Для этого мы исследуем структуру изменчивости хлоропластной ДНК и проводим сравнение с изменчивостью ядерных маркеров, палеогеографическими и флористическими данными. В сравнении с ранее полученными результатами [17], в работе впервые исследуются обе известные популяции липы Нащокина и пять популяций липы амурской с привлечением в анализ дополнительных выборок липы сибирской и липы мелколистной.
МАТЕРИАЛЫ И МЕТОДЫ
Изменчивость хлоропластной ДНК была изучена в двух известных популяциях T. nasczokinii (Манское займище и Каштак, окрестности г. Красноярска), всего 46 образцов. Ранее эти образцы были исследованы по ядерным микросателлитным локусам [13]. На Дальнем Востоке, в районе произрастания липы амурской, было изучено пять выборок этого вида: четыре из Амурской обл. и одна из Приморского края, всего 129 особей. В настоящем исследовании было добавлено восемь популяций T. cordata s. s. из основного ареала и одна дополнительная выборка из Крыма, всего 149 особей. Мы также расширили выборки T. sibirica из Кемеровской обл., дополнив к имеющимся данным еще две выборки. Кроме популяции “Липового острова-1”, недалеко от пос. Кузедеево, был исследован другой относительно крупный массив липняков в окрестностях пос. Тельбес [11]. Объем выборок и координаты включенных в исследование популяций липы приведены в табл. 1. Выделение геномной ДНК проводилось с помощью метода CTAB [20] из свежих или высушенных в силикагеле листьев.
Таблица 1.
Характеристика популяций Tilia sibirica (популяционные выборки – №№ 1, 2, 39, 40), T. nasczokinii (41, 42), T. amurensis (43–46), T. cordata s. s. (3–38)
| №1 | Популяции | Координаты | Объем выборки | Гаплотипы, гаплогруппа** (число особей) |
|
|---|---|---|---|---|---|
| с. ш. | в. д. | ||||
| Tilia sibirica | |||||
| 1* | Кузедеево | 53°19′54′′ | 87°13′59′′ | 23 | t2 (23) |
| 2* | Бия | 52°16′43′′ | 87°07′44′′ | 9 | t2 (9) |
| 39 | Тельбес | 53°14′55′′ | 87°22′01′′ | 28 | t2 (28) |
| 40 | Липовый остров-1 | 53°21′02′′ | 87°17′13′′ | 18 | t2 (18) |
| T. nasczokinii | |||||
| 41 | Манское займище | 55°57′51′′ | 92°29′57′′ | 23 | t3a (23) |
| 42 | Каштак | 55°57′26′′ | 92°46′41′′ | 23 | t3a (23) |
| T. amurensis | |||||
| 43 | Зейский заповедник | 53°53′17′′ | 127°24′06′′ | 28 | Am1 (28) |
| 44 | Норский заповедник | 52°25′22′′ | 129°56′06′′ | 23 | Am1 (23) |
| 45 | Благовещенск | 50°19′08′′ | 127°28′40′′ | 29 | Am2** (29) |
| 46 | Муравьевский пр. п. | 49°52′23′′ | 127°42′14′′ | 17 | Am2** (17) |
| 47 | Шкотово | 43°9′23′′ | 132°24′46′′ | 32 | Am1 (10), Am2** (22) |
| T. cordata | |||||
| 3* | Тобольск | 58°18′42′′ | 68°26′54′′ | 25 | t2 (25) |
| 4* | Екатеринбург | 56°53′31′′ | 60°19′34′′ | 29 | t1 (7), t2 (22) |
| 5* | Комарово | 56°29′22′′ | 58°50′53′′ | 10 | t2 (10) |
| 6* | Чандар | 55°21′27′′ | 56°40′39′′ | 24 | t2 (24) |
| 7* | Уфа | 54°51′41′′ | 55°50′32′′ | 10 | t2 (10) |
| 8* | Юмагузино | 53°01′53′′ | 56°29′50′′ | 25 | t1 (25) |
| 9* | Зилаир | 52°16′55′′ | 57°34′55′′ | 10 | t1 (10) |
| 10* | Малиновка | 51°46′45′′ | 56°50′17′′ | 24 | t1 (24) |
| 11* | Йошкар-Ола | 56°37′27′′ | 47°55′11′′ | 10 | t2 (10) |
| 12* | Нижний Новгород | 55°38′48′′ | 43°35′19′′ | 23 | t1 (2), t2 (20), t3a (1) |
| 13* | Москва | 55°37′28′′ | 37°33′12′′ | 26 | t1 (3), t2 (23) |
| 14* | Плющань | 52°49′00′′ | 38°59′00′′ | 24 | t1 (6), t2 (18) |
| 15* | Морозова гора | 52°36′00′′ | 38°55′00′′ | 19 | t2 (23) |
| 16* | Преображенский м-р | 52°26′00′′ | 38°58′00′′ | 23 | t2 (24) |
| 17* | Воронеж | 51°43′50′′ | 39°13′28′′ | 25 | t1 (4), t2 (21) |
| 18* | Брянская обл. | 53°12′00′′ | 34°34′00′′ | 21 | t1 (21) |
| 19* | Ольгино | 59°59′57′′ | 30°01′60′′ | 10 | t1 (1), t2 (6), t3a (1), t5 (1), t6 (1) |
| 20* | Сергиевка | 59°53′30′′ | 29°50′16′′ | 19 | t1 (1), t2 (14), t3a (4) |
| 21* | Луга | 58°52′16′′ | 29°50′56′′ | 26 | t2 (26) |
| 22* | Савино (Новгород) | 58°33′21′′ | 31°26′35′′ | 9 | t2 (8), t3a (1) |
| 23* | Себежский нац. парк | 56°04′35′′ | 28°20′10′′ | 8 | t2 (8) |
| 24* | Минск | 53°54′42′′ | 27°38′43′′ | 19 | t1 (6), t2 (13) |
| 25* | Крыжовка | 53°56′58′′ | 27°19′31′′ | 21 | t1 (5), t2 (9), t3b (1), t3c (1), t5 (5) |
| 26* | Винники (Львов) | 49°48′23′′ | 24°07′55′′ | 2 | t1 (2) |
| 27* | Креховский монаст. | 50°02′03′′ | 23°47′53′′ | 2 | t3c (2) |
| 29* | Крым, Ай-Петри | 44°29′21′′ | 34°05′46′′ | 11 | t4 (11) |
| 30 | Нижнеиргинская | 56°55′08′′ | 57°26′49′′ | 8 | t2 (8) |
| 31 | Таганай | 55°15′40′′ | 59°46′33′′ | 46 | t2 (46) |
| 32 | Тернополь | 49°49′08′′ | 25°17′05′′ | 7 | t1 (6), t3c (1) |
| 33 | Гродно | 53°42′06′′ | 23°46′39′′ | 12 | t1 (1), t2 (7), t3c (2), t5(2) |
| 34 | Краков | 50°00′26′′ | 19°48′06′′ | 12 | t1 (10), t3b (1), t5 (1) |
| 35 | Куршская коса | 54°58′55′′ | 20°33′03′′ | 3 | t3a (2), t3b (1) |
| 36 | Светлогорск | 54°56′43′′ | 20°05′15′′ | 17 | t1 (4), t3b (13) |
| 37 | Белогорье | 50°36′40′′ | 35°59′51′′ | 19 | t1 (16), t2 (3) |
| 38 | Крым, Б. Каньон | 44°31′55′′ | 33°58′33′′ | 25 | t2 (1), t3a (1), t4 (23) |
| Среднее | 18.6 | ||||
| Всего | 857 | ||||
Для анализа изменчивости хпДНК липы использовались пять фрагментов (psbC-trnD (CDt), trnH-trnK (HKt), trnD-trnT (DT), trnK1-trnK2(K1K2) и psbJ-petA), для которых ранее была выявлена изменчивость в восточной части ареала T. cordata и установлено отличие гаплотипов T. cordata и дальневосточных видов лип, в том числе T. amurensis [17]. Длины фрагментов, используемые праймеры, условия амплификации и секвенирования описаны в работе [17]. Продукты ПЦР очищали с помощью набора ExoSAP-IT (Affimetrix). Реакция секвенирования проводилась с помощью набора BigDye v. 3.1 (Applied Biosystems), продукты реакции анализировались на автоматическом секвенаторе Нанофор 05 (Институт аналитического приборостроения РАН, Россия) в Центре коллективного пользования “Современные технологии для экологических исследований” ИЭРиЖ УрО РАН. Редактирование и выравнивание полученных последовательностей выполняли вручную в программе BioEdit v. 7.2.5 [21].
Для типирования гаплотипов использовалось сочетание методов рестриктного анализа, секвенирования и (у липы амурской) электрофореза ПЦР продукта в 1%-ном агарозном геле. Ранее при исследовании T. cordata было установлено, что рестриктный анализ (PCR-RFLP) с комбинацией CD/TaqI позволяет идентифицировать большинство гаплотипов [17]. Продукты рестрикции разделялись с помощью электрофореза в 6%-ном поли-акриламидном денатурирующем геле с последующим серебряным окрашиванием. Рестриктный анализ был проведен для всех вновь исследованных образцов T. nasczokinii, T. sibirica, T. cordata (всего 241 дерево). По результатам рестриктного анализа проводилось секвенирование 1–2 образцов во всех популяциях для каждого гаплотипа. Так как у всех особей липы Нащокина было установлено фиксирование одного гаплотипа (t3a, см. Результаты), по всем фрагментам хпДНК было секвенировано четыре образца из двух разных выборок липы Нащокина – Манское займище и Каштак. Для наиболее изменчивых фрагментов (CDt и HKt) было дополнительно секвенировано еще по три образца из каждой выборки липы Нащокина. В новых выборках липы сибирской, где также был фиксирован один гаплотип (t2), было секвенировано три образца из выборки Тельбес.
Результаты секвенирования образцов из добавленных в исследование популяций T. cordata, и предварительно типированных с помощью рестриктного анализа как гаплотип t3 [17], показали присутствие изменчивости: было выявлено три родственных гаплотипа (t3a, t3d, t3c), различия между которыми были обнаружены во фрагментах HKt, psbJ и K1K2. Разделение родственных гаплотипов осуществлялось секвенированием этих фрагментов у 32 особей из 11 популяций, группа гаплотипов “t3” которых была определена рестриктным анализом (табл. 1).
У липы амурской секвенировано по два образца из каждой популяции, всего десять образцов по пяти фрагментам. Было установлено, что у двух дивергентных гаплотипов Am1 и Am2 (см. Результаты) длины фрагмента HKt отличаются на 89 пар нуклеотидов (пн). В связи с этим разделение дивергентных гаплотипов T. amurensis осуществлялось при электрофорезе ПЦР-продукта части фрагмента HKt (HKt(2) – HKt(H)) на агарозном геле. Его величина составляла у гаплотипа Am1 – 916 пн, у гаплотипов Am2a, Am2b и Am2c (гаплогруппа Am2) – 827 пн. Было определено соотношение дивергентных гаплотипов Am1 и Am2 для всех особей в исследуемых популяциях липы амурской.
Кроме гаплотипов, выявленных в данном исследовании, в филогенетический анализ хлоропластной ДНК Tilia были включены последовательности соответствующих фрагментов имеющихся в GenBank пластомов восточноазиатских видов лип: T. amurensis Rupr. [22], T. mandshurica Rupr. & Maxim., T. paucicostata Maxim., T. oliveri Szyszyl. [23] и T. taishanensis S.B. Liang [24]. Также нами по пяти фрагментам были получены последовательности T. americana L. (образец из Ботанического сада Балтийского федерального университета им. И. Канта), чья видовая принадлежность была подтверждена секвенированием маркера rpL32-trnL и сопоставлением с последовательностями T. americana из работы [25]. В качестве внешней группы для Tilia был взят представитель близкого Tilia рода хлопчатник Gossypium herbaceum L. Для филогенетического анализа нуклеотидные последовательности отдельных хлоропластных фрагментов были конкатенированы в общий алайнмент. Филогенетические деревья гаплотипов построены с использованием байесовского подхода (BI) [26] и метода максимальной экономии (MP) [27], как описано в [17]. В анализе учитывались все точковые мутации и инделы, за исключением мутаций числа повторов микросателлитных последовательностей. Из анализа были исключены инделы высокоизменчивого участка со сложным алайнментом во фрагменте HKt, включающим многочисленные тандемные повторы “TA” [17], ввиду неопределенности филогенетических отношений и возможной гомоплазии.
РЕЗУЛЬТАТЫ
По результатам секвенирования и рестриктного анализа установлено наличие у всех образцов липы Нащокина гаплотипа t3a, обнаруженного в основном ареале T. cordata. Исследование новых выборок липы сибирской из Кемеровской обл. подтвердило распространение у T. sibirica гаплотипа t2 во всех выборках (табл. 1).
Секвенирование 32 образцов из восточноевропейской части ареала T. cordata, ранее относимых нами рестриктным анализом к гаплотипу t3 [17], выявило три родственных гаплотипа (t3a, t3b и t3c) (табл. 1). Гаплотип t3a отличается от гаплотипа t3b тремя мутациями во фрагментах HKt, K1K2, psbJ, а от гаплотипа t3c – двумя мутациями в HKt. В двух фрагментах, CDt и DT, изменчивости между t3a, t3b и t3c не обнаружено. По результатам секвенирования образцы липы Нащокина совпали с образцами гаплотипа t3a из европейской части ареала липы мелколистной по последовательностям всех фрагментов, включая высокоизменчивые микросателлитные повторы и тандемные повторы “TA” во фрагменте HKt [17]. Гаплотип t3a выявлен спорадически в восточной части ареала T. cordata. Он нигде не преобладает, изредка встретился на северо-западе России в Ленинградской, Новгородской и Калининградской обл., единично в Нижегородской обл. и в Крыму (всего у десяти образцов в шести выборках). В Сибири t3a появляется только у липы Нащокина. Гаплотипы t3b и t3с распространены в более западных и южных областях T. cordata (Беларусь, Украина, Польша – в незначительной пропорции), гаплотип t3b преобладает в выборке из Калининградской обл. (рис. 1).
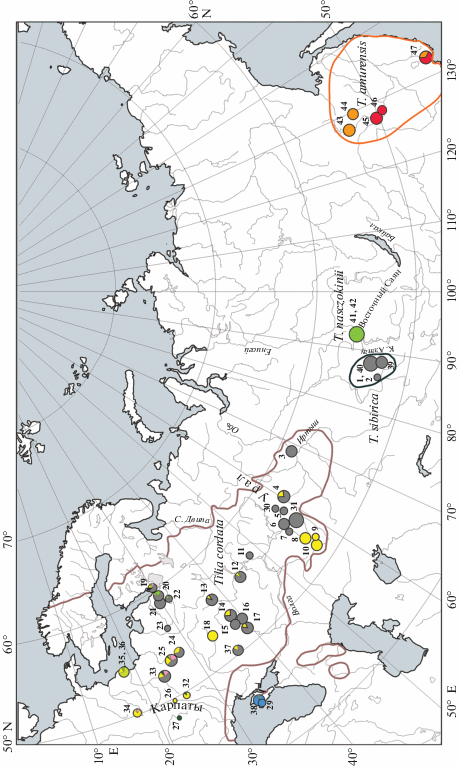
Рис. 1.
Географическое распределение хлоропластных гаплотипов в популяционных выборках липы сибирской (T. sibirica), липы Нащокина (T. nasczokinii), липы амурской (T. amurensis), восточной части ареала липы мелколистной (Tilia cordata s. s.). Цветовые обозначения гаплотипов соответствуют рис. 2. Распределение гаплотипов в выборках приведено в табл. 1. Площадь диаграмм пропорциональна размеру выборки. Цифрами обозначены номера популяций из табл. 1.
По результатам секвенирования пяти фрагментов у липы амурской T. amurensis было выявлено четыре гаплотипа, из которых три близкородственных (Am2a, 2b, 2c) отличались между собой 1–4 мутациями во фрагментах DT, K1K2 и HKt. При этом они в гораздо большей степени (30 мутаций) отличались от другого распространенного у липы амурской гаплотипа (Am1).
Анализ распределения двух дивергентных гаплогрупп (Am1 и Am2) показал примерно равное их соотношение в исследованных популяциях (рис. 1). Из 129 особей липы амурской у 61 дерева был обнаружен гаплотип Am1 (47%). В выборках из Зейского и Норского заповедников присутствовал только данный гаплотип, также он встретился в выборке Шкотово. В выборках Благовещенск и Муравьевский парк обнаружены только гаплотипы гаплогруппы Am2, в выборке Шкотово они преобладали. Близкородственные гаплотипы Am2a, Am2b, Am2c выявлены секвенированием в выборках Шкотово, Благовещенск, Муравьевский парк соответственно. Частотное распределение близких гаплотипов гаплогруппы Am2 по выборкам не проанализировано.
В восточной части ареала T. cordata добавление нового материала подтверждает сделанные ранее выводы и филогеографическую структуру хпДНК [17]: большее разнообразие в выборках из западных районов, наличие на востоке двух преобладающих гаплотипов, подразделение популяций Среднего и Южного Урала, отсутствие в восточных регионах западных гаплотипов (рис. 1). В Крыму, кроме преобладающего гаплотипа t4, зафиксировано два случая присутствия “северных” гаплотипов основного ареала T. cordata: в районе Большого Каньона в выборке образцов обнаружено по одному дереву с гаплотипами t2 и t3а.
Всего внутри изученных видов Tilia у 18 гаплотипов суммарно в пяти фрагментах обнаружено 103 изменчивых признака, не считая микросателлитных повторов, из которых 63 – это точковые мутации, 40 – инделы. Нуклеотидное разнообразие (π) у изученных видов Tilia составило 0.0018. Полученные последовательности всех фрагментов вновь обнаруженных гаплотипов T. cordata (t3а, t3b, t3c), T. amurensis (Am1, Am2a, 2b, 2c) и гаплотипа T. americana помещены в GenBank (номера: MZ700180–MZ700219).
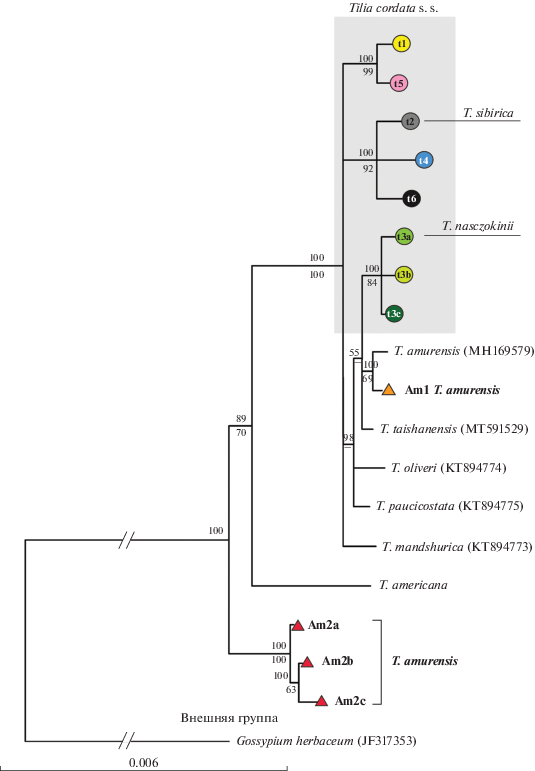
Средняя длина последовательностей фрагментов у Tilia составила: CDt – 2523 пн, HKt – 1975 пн, K1K2 – 2450 пн, DT – 1441 пн, psbJ-petA – 690 пн. Суммарная длина выровненных последовательностей (алайнмента) пяти хпДНК фрагментов вместе с внешней группой составила 9602 пн. На рис. 2 представлено байесовское дерево 18 гаплотипов Tilia. Дивергентные гаплотипы, обнаруженные у липы амурской (Am2a, 2b, 2c), оказались в базальном положении по отношению к объединенной кладе (89/70, BI/MP) американского вида T. americana и основной кладе евроазиатских гаплотипов. Гаплотип Am1 липы амурской из исследованных нами популяций оказался сестринским гаплотипу из GenBank, Корея (MH169579) и входит в хорошо поддержанную смешанную кладу евроазиатских гаплотипов (100/100), которые разделяются на несколько субклад без разрешения между ними. Состав клад не соответствует географическому распространению гаплотипов. Гаплотипы T. cordata не образуют монофилетическую группу и входят в три разных клады. Три родственных гаплотипа T. cordata (t3a, t3b, t3c), один из которых (t3a) был найден у липы Нащокина, входят в одну кладу с четырьмя восточноазиатскими видами (рис. 2).
Рис. 2.
Филогенетическое дерево 18 гаплотипов Tilia, построенное с помощью байесовского метода (50% консенсус) на основе нуклеотидных последовательностей пяти фрагментов хпДНК общей длиной 9079 пн. Над линиями приведена статистическая поддержка байесовским методом (BI, значения апостериорной вероятности, %), под линиями – бутстреп-поддержка (MP, 1000 репликаций). Для гаплотипов восточноазиатских видов лип и для внешней группы приводятся номера пластомов из GenBank.
ОБСУЖДЕНИЕ
Два исследованных сибирских таксона липы, T. sibirica и T. nasczokinii, вероятно имеют независимое происхождение, поскольку несут два значительно отличающихся хлоропластных гаплотипа. Оба гаплотипа встречаются у T. cordata s. s. и не найдены у T. amurensis, что говорит о европейском происхождении сибирских таксонов. Гаплотип t2 фиксирован в четырех исследованных нами популяциях липы сибирской и в западно-сибирской части ареала липы мелколистной, преобладает в восточных областях и не встречается в западной части ареала последней [17] (рис. 1). В отличие от липы сибирской, все исследованные образцы липы Нащокина имеют гаплотип t3а, который значительно отличается от гаплотипа t2. Несмотря на то, что из трех выявленных у T. cordata филогенетических ветвей хпДНК ветвь гаплотипов t3a, t3b и t3с наиболее близка к восточноазиатским видам Tilia, включая некоторые гаплотипы липы амурской (рис. 2), онa филогенетически отличается от ДВ-гаплотипов. При анализе 35 популяционных выборок липы мелколистной гаплотип t3а встречался спорадически на северо-западе России, а восточнее Нижнего Новгорода не был обнаружен вовсе (рис. 1). В более западных областях у липы мелколистной найдены гаплотипы t3b и t3с, близкие t3a. Совпадение хлоропластного гаплотипа липы Нащокина с одним из гаплотипов липы мелколистной и наличие у T. cordata близкородственных ему гаплотипов позволяет отвергнуть предположение о дальневосточном происхождении липы Нащокина.
Полученные данные изменчивости хпДНК у эндемичных таксонов липы в Сибири согласуются с данными по ядерным маркерам (nSSR), которые показали генетическую обособленность популяций T. nasczokinii от популяций T. sibirica в большей степени, чем от T. cordata [13], что поддерживает мнение о давнем обособлении этих таксонов, благодаря изоляции в ледниковых рефугиумах плейстоцена [14], и подтверждает видовой статус липы Нащокина [15].
Ранее в некоторых источниках и обзорах [4, 5, 10] высказывалось предположение о формировании непрерывного ареала широколиственных пород, в том числе липы, в Сибири в климатический оптимум голоцена (~5 тыс. л. н.), и о возникновении такого пояса в интерстадиалы эпохи зырянского оледенения, например в каргинское время (Marine Isotope Stage 3 (MIS 3) ~30 тыс. л. н. [4]). Вместе с тем, некоторые авторы [11] ставят под сомнение непрерывный характер ареала липы в оптимум голоцена на юге Западной Сибири. Они указывают, что при обнаружении пыльцы липы в минеральных остатках очень высока вероятность ее переотложения из более древних горизонтов, поэтому имеющиеся свидетельства нуждаются в тщательной проверке. Кроме того, ревизия датировок привела к значительному пересмотру представлений о палеоклимате каргинского времени, поскольку возраст отложений с широким участием широколиственных пород оказался соответствующим казанцевскому межледниковью (MIS 5, 130–80 тыс. л. н.) [19].
Значительные генетические различия липы сибирской (Кемеровская обл.) и липы Нащокина (Красноярский край) как по хлоропластным, так и по ядерным маркерам, свидетельствуют о длительном отсутствии генетического потока между ними, несмотря на относительную географическую близость популяций двух видов. Возможно популяции липы несколько расширялись в климатический оптимум голоцена [11], но, вероятно, непрерывного распространения данной породы в Сибири в голоцене не было. Возможно этому способствовали географические барьеры в виде Кузнецкого Алатау, а также сухой степной и лесостепной зоны к востоку от него.
Липа, наряду с другими неморальными растениями, считается “третичным реликтом”, остатком многопородных широколиственных лесов тургайской флоры, распространенных в плиоцене по всей территории Сибири [28]. В плейстоцене широколиственные породы не играли в Сибири доминирующей роли, однако, согласно палеоданным, во время нескольких плейстоценовых межледниковий в Южной Сибири, вероятно, было несколько этапов проникновения и расширения ареалов неморальных видов. По палеоданным Восточного Алтая [6], во время интергляциалов среднего плейстоцена (>660 тыс. л. н.), широколиственные леса в регионе были широко распространены и включали таксоны, произрастающие сегодня в Европе, на Дальнем Востоке, на Кавказе и в Крыму. В среднем плейстоцене в нескольких точках авторы указывают на пыльцу до четырех видов лип, в том числе дальневосточных видов Tilia. Возможно, последующее похолодание совпадает с исчезновением непрерывного ареала, так как в дальнейшем, в заключительный период среднего плейстоцена и в верхнем плейстоцене, пыльца ДВ видов лип не отмечается [6]. Последней фазой расселения в Сибири широколиственных пород, в том числе липы, может быть казанцевское межледниковье (~125 тыс. л. н.) [6, 9, 19]. Ввиду скудности палеонтологических свидетельств, генетические данные оказываются наиболее информативными для оценки возраста образования и реконструкции истории сибирских таксонов липы. Ранее, на основе ядерных микросателлитов и историко-демографического анализа, использующего аппроксимирующие байесовские вычисления (ABC), была получена среднеплейстоценовая оценка отделения липы сибирской от липы мелколистной – 447 тыс. л. н. (интервал от 901 до 154 тыс. л. н.) [12]. Хотя аналогичный анализ не проводился для липы Нащокина, но близкие уровни отличий между липой мелколистной и липой Нащокина, и между липой мелколистной и липой сибирской [13] позволяют предполагать и близкий возраст отделения от липы мелколистной обоих сибирских таксонов. Кроме того, тот факт, что гаплотип t3a, помимо липы Нащокина, распространен только на западе Русской равнины и в Прибалтике, означает достаточно древнее обособление липы Нащокина, когда структура распределения изменчивости хлоропластной ДНК у предка липы мелколистной в Евразии была иной. Также маловероятно, что отделение липы Нащокина могло происходить позже отделения липы сибирской, ареал которой расположен западнее популяций липы Нащокина. Таким образом, вероятными являются два сценария: последовательные отделения липы Нащокина, а затем липы сибирской, или одновременное отделение обоих сибирских таксонов с последующей фиксацией в них разных гаплотипов. Для выбора в пользу одного из сценариев в дальнейшем необходимо провести дополнительное демографическое исследование с ABC-моделированием.
В популяционно-генетических исследованиях древесных растений есть примеры выживания деревьев в микрорефугиумах в отрыве от ареалов родственных видов. Например пихта изящная Abies gracilis Kom. на Камчатке [29], имея крайне ограниченное распространение (около 20 га), существует в изоляции автохтонно на протяжении очень длительного плейстоценового времени. При этом она сохраняет довольно значительный уровень изменчивости ядерных маркеров [29]. Несмотря на то, что две известные популяции липы Нащокина в настоящее время очень малы (площадь популяции Манское Займище – 370 га с численностью ~300 особей, популяции Каштак – 1.5 га, ~200 особей, включая подрост), изменчивость nSSR, хотя и снижена по сравнению с липой мелколистной, но находится на достаточном уровне [13] и даже несколько выше, чем в популяциях липы сибирской. Кроме того, в выборке Каштак обнаружено два уникальных nSSR-аллеля. Это означает отсутствие критических сокращений численности в истории липы Нащокина. Возможно, существенное снижение числа особей в популяциях липы в окрестностях Красноярска произошло в последние столетия под воздействием антропогенного фактора [15].
Условия обитания липы в приенисейских популяциях [14] заметно отличаются от условий обитания липы в предгорьях Кузнецкого Алатау, многократно описанных в качестве рефугиума неморальной растительности. В отличие от популяций липы в Кузнецком Алатау, лесные массивы, содержащие липу Нащокина вблизи Красноярска, не находятся в поясе черневой тайги. С другой стороны, флора Восточного Саяна, к которому следует относить ареал липы Нащокина, вполне богата реликтовыми видами, как и другие горные системы юга Сибири. Там имеется пояс черневой тайги, и встречаются 25 неморальных реликтов [2], из которых большинство имеет европейское происхождение. Предположительно, выживанию липы Нащокина, помимо близости черневого пояса Восточного Саяна, способствовало также приуроченность к Енисею, сглаживающему неблагоприятные климатические факторы, а также создающему условия для миграций различных видов растений и животных. Значение крупных рек для поддержания микрорефугиумов и миграций древесных растений ранее отмечалось для лиственницы сибирской [30] и черемухи [31].
Еще одним фактором поддержания численности популяции и уровня генетической изменчивости липы в микрорефугиумах в неблагоприятные климатические интервалы может быть ее способность на протяжении многих поколений размножаться вегетативно. Так, в популяциях “Липового острова” Кузнецкого Алатау был выявлен высокий уровень клональности [12], что свидетельствует о преобладании вегетативного размножения.
Характерной особенностью филогенетического дерева хпДНК евроазиатских лип ранее отмечалось отсутствие монофилии видов, включая T. cordata, и наличие большого числа дивергентных гаплотипов, при явном недостатке родственных, редких гаплотипов [17, 32]. Была высказана гипотеза [17], что одной из причин указанных особенностей является длительное существование липы мелколистной в нескольких изолированных друг от друга ледниковых рефугиумах. Действительно, низкая подвижность хлоропластной ДНК, обусловленная материнским характером наследования в сочетании с фрагментацией ареала, препятствуют накоплению в отдельных популяциях изменчивости, и, с другой стороны, исключают закрепление во всех них общего гаплотипа, способствуя сохранению различающихся линий хпДНК. Наличие в Сибири двух таксонов липы связано с ее выживанием на протяжении нескольких ледниковых циклов в отдельных изолированных друг от друга рефугиумах. Разные гаплотипы этих таксонов служат иллюстрацией ранее высказанной гипотезы [17] относительно причин особенности хлоропластной филогении у лип.
В предыдущих исследованиях филогении рода Tilia [25, 32] гаплотипы T. amurensis разделились на две неродственные линии. В нашей работе, впервые проведенной на обширном материале из пяти популяций липы амурской, подтверждается наличие у этого вида дивергентных гаплогрупп (Am1 и Am2). Ранее у лип базальные гаплотипы, подобные Am2, были описаны, кроме липы амурской, также для T. maximowicziana Shiras и T. japonica (Miq.) Simonk [25]. Максимальное разнообразие видов Tilia, наличие глубоко дивергентных, предковых гаплотипов характеризует Восточную Азию как центр разнообразия и центр происхождения рода [16]. Структура изменчивости хпДНК липы амурской соответствует большому размеру популяции, препятствующему фиксации предкового полиморфизма. Явной географической структуры у липы амурской пока не обнаружено. В Амурской обл. в двух географически близких популяциях из северных районов был фиксирован гаплотип Am1, в двух более южных выборках распространены гаплотипы из гаплогруппы Am2 (рис. 1). Однако в выборке Шкотово (Приморье) встретились гаплотипы обеих дивергентных линий. Использованные хлоропластные маркеры показывают достаточный уровень изменчивости у T. amurensis и могут быть применены в филогеографических исследованиях дальневосточных видов лип.
ЗАКЛЮЧЕНИЕ
В данной работе первые с помощью маркеров хлоропластной ДНК изучены родственные связи и происхождение красноярских популяций липы, рассматриваемых Н.В. Степановым [15] в качестве нового вида T. nasczokinii. Структура изменчивости хпДНК T. nasczokinii и других таксонов липы, распространенных в Сибири и прилегающих территориях, и сопоставление с данными предыдущих исследований, свидетельствуют о выживании липы в Сибири во время последних ледниковых интервалов по крайней мере в двух рефугиумах. Полученные результаты могут служить обоснованием для охранных мероприятий этого редкого дерева – реликта третичных широколиственных лесов Сибири, с учетом сохранения его уникального генофонда.
Авторы благодарят М.И. Седаеву, Н.А. Кочунову, Т.Н. Веклич, Е.А. Андышеву, Л.А. Каменеву, А.И. Измайлова, И.Ю. Исакова, А.Г. Быструшкина, Т.В. Семерикову, Ю.Я. Хрунык, Л.И. Агафонова, В.Л. Семерикова за участие в сборе образцов липы, К.А. Паниковскую, А.Н. Кравченко за помощь в лабораторных анализах, Е.В. Зиновьева за палеонтологические консультации, и анонимного рецензента за конструктивные замечания.
Исследование выполнено при финансовой поддержке РФФИ, Правительства Красноярского края и Красноярского краевого фонда науки, проект № 19-44-240006 p_a, сбор части материала проведен в рамках государственного задания Института экологии растений и животных УрО РАН и Института леса им. В.Н. Сукачева СО РАН № 0287-2021-0009.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объектов животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объектов людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Малышев Л.И., Пешкова Г.А. Особенности и генезис флоры Сибири (Предбайкалье и Забайкалье). Новосибирск: Наука, 1984. 264 с.
Положий А.В., Крапивкина Э.Д. Реликты третичных широколиственных лесов во флоре Сибири. Томск: Изд-во ТГУ, 1985. 156 с.
Крапивкина Э.Д. Неморальные реликты во флоре черневой тайги Горной Шории. Новосибирск: Изд-во СО РАН, 2009. 229 с.
Dubatolov V.V., Kosterin O.E. Nemoral species of Lepidoptera (Insecta) in Siberia: A novel view on their history and the timing of their range disjunctions // Entomologica Fennica. 2000. V. 11. № 3. P. 141–166. https://doi.org/10.33338/ef.84061
Волкова B.C., Белова В.А. О роли широколиственных пород в растительности голоцена Сибири // Палеопалинология Сибири. М.: Наука, 1980. С. 112–117.
Bolikhovskaya N.S., Shunkov M.V. Pleistocene environments of Northwestern Altai: Vegetation and climate // Archaeol. Ethnol. Anthropol. Eurasia. 2014. V. 42. № 2. P. 2–17.
Tchebakova N.M., Blyakharchuk T.A., Parfenova E.I. Reconstruction and prediction of climate and vegetation change in the Holocene in the Altai-Sayan mountains, Central Asia // Envir. Res. Letters. 2009. V. 4. № 4. https://doi.org/10.1088/1748-9326/4/4/045025
Бляхарчук Т.А. Послеледниковая динамика растительного покрова Западно-Сибирской равнины и Алтае-Саянской горной области (по данным спорово-пыльцевого анализа болотных и озерных отложений): Дис. … д-ра биол. наук. Томск: Томский гос. ун-тет, 2010. 519 с.
Гуртовая Е.Е., Кривоногов С.К. Фитологическая характеристика континентальных отложений казанцевского горизонта // Микрофитофоссилии и стратиграфия мезозоя и кайнозоя Сибири. Новосибирск: Наука, Сиб. отд-ние. 1988. С. 69–91.
Стратиграфия нефтегазоносных бассейнов Сибири. Кайнозой Западной Сибири / ред. Волкова В.С., Архипов С.А., Бабушкин А.Е. и др. Новосибирск: Изд-во СО РАН, 2002. 246 с.
Амелин И.И., Бляхарчук Т.А. Распространение липы сибирской (Tilia sibirica Bayer) в Кемеровской области // Вестник Томского гос. ун-тета. Биология. 2016. № 2(34). С. 30–52. https://doi.org/10.17223/19988591/34/3
Logan S.A., Chytry M., Wolff K. Genetic diversity and demographic history of the Siberian lime (Tilia sibirica) // Perspect. Plant Ecol. Evol. Syst. 2018. V. 33. P. 9–17. https://doi.org/10.1016/j.ppees.2018.04.005
Экарт А.К., Ларионова А.Я., Кравченко А.Н. и др. Генетическая структура и дифференциация реликтовых популяций липы на основе анализа изменчивости ядерных микросателлитных локусов // Генетика. 2021. № 7. Т. 57. № 8. С. 916–924. https://doi.org/10.31857/S0016675821070079
Буторина Т.Н., Нащокин В.Д. Липа сибирская в заповеднике “Столбы” // Тр. гос. заповедника “Столбы”. 1958. Вып. II. С. 152–167.
Степанов Н.В. Tilia nasczokinii (Tiliaceae) – новый вид из окрестностей Красноярска // Ботан. журн. 1993. Т. 78. № 3. С. 137–144.
Pigott C.D. Lime-Trees and Basswoods: A Biological Monograph of the Genus Tilia. N.Y.: Cambridge Univ. Press, 2012. 395 p.
Семерикова С.А., Исаков И.Ю., Семериков В.Л. Изменчивость хлоропластной ДНК отражает историю Tilia cordata s. l. в восточной части ареала // Генетика. 2020. Т. 56. № 2. С. 188–200. https://doi.org/10.1134/S0016675820020113
Novák J., Trotsiuk V., Sýkora O. et al. Ecology of Tilia sibirica in a continental hemiboreal forest, Southern Siberia: An analogue of a glacial refugium of broad-leaved temperate trees? // The Holocene. 2014. V. 24(8). C. 908–918. https://doi.org/10.1177/0959683614534744
Лаухин С.А., Шилова Г.Н., Величкевич Ф.Ю. Палеоботаническая характеристика и палеоклиматы каргинского времени на Западно-Сибирской равнине // Вестн. Археол., антропол. и этнографии. 2007. № 7. С. 203–225.
Devey M.E., Bell J.C., Smith D.N. et al. A genetic linkage map for Pinus radiata based on RFLP, RAPD and microsatellite markers // Theor. Appl. Genet. 1996. V. 92. № 6. P. 673–679. https://doi.org/10.1007/BF00226088
Hall T.A. BioEdit: A user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucl. Ac. Symp. Series. 1999. V. 41. P. 95–98.
Yang J.Y., Lee W., Pak J.-H., Kim S.-C. Complete chloroplast genome of Ulleung Island endemic basswood, Tilia insularis (Malvaceae), in Korea // Mitochondrial DNA B-Resources. 2018. V. 3. № 2. P. 605–606. https://doi.org/10.1080/23802359.2018.1473731
Cai J., Ma P.F., Li H.T., Li D.Z. Complete plastid genome sequencing of four Tilia species (Malvaceae): A comparative analysis and phylogenetic implications // PLoS One. 2015. V. 10. № 11. https://doi.org/10.1371/journal.pone.0142705
Lu Y.Z., Li W.Q., Wang N. et al. Characterization of the complete chloroplast genome of Tilia taishanensis S.B. Liang (Tiliaceae) // Mitochondrial DNA B-Resources. 2020. V. 5. № 3. P. 2719–2720. https://doi.org/10.1080/23802359.2020.1788430
McCarthy D.M., Mason-Gamer R.J. Chloroplast DNA-based phylogeography of Tilia americana (Malvaceae) // Syst. Botany. 2016. V. 41. № 4. P. 865–880. https://doi.org/10.1600/036364416X693964
Swofford D.L. PAUP*. Phylogenetic Analysis Using Parsimony (*and other methods). Version 4.0 beta10. MA. Sunderland: Sinauer Associates, 2002. 144 p.
Ronquist F., Huelsenbeck J.P. MrBAYES 3: Bayesian phylogenetic inference under mixed models // Bioinformatics. 2003. V. 19. № 12. P. 1572–1574. https://doi.org/10.1093/bioinformatics/btg180
Белова В.А. Растительность и климат позднего кайнозоя юга Восточной Сибири. Новосибирск: Наука, 1985. 159 с.
Semerikova S.A., Semerikov V.L., Lascoux M. Post-glacial history and introgression in Abies (Pinaceae) species of the Russian Far East inferred from both nuclear and cytoplasmic markers // J. Biogeogr. 2011. V. 38. № 2. P. 326–340. https://doi.org/10.1139/cjfr-2012-0158
Semerikov V.L., Semerikova S.A., Polezhaeva M.A. et al. Southern montane populations did not contribute to the recolonization of West Siberian Plain by Siberian larch (Larix sibirica): A rangewide analysis of cytoplasmic markers // Mol. Ecol. 2013. V. 22. № 19. P. 4958–4971. https://doi.org/10.1111/mec.12433
Volkova P.A., Burlakov Y.A., Schanzer I.A. Genetic variability of Prunus padus (Rosaceae) elaborates “a new Eurasian phylogeographical paradigm” // Plant Syst. Evol. 2020. V. 306. № 1. https://doi.org/10.1007/s00606-020-01644-0
Phuekvilai P. Relicts, refugia, and reticulation: a study of population history, hybrids and phylogeny in the long-lived flowering tree genus Tilia: Thesis… for the degree of Doctor of Philosophy. UK: Newcastle Univ., 2014. 172 p.
Дополнительные материалы отсутствуют.


