Генетика, 2022, T. 58, № 4, стр. 463-469
Устойчивость к борной кислоте у Drosophila melanogaster зависит от уровня экспрессии гена Cyp9b2
П. А. Миляева 1, Л. Н. Нефедова 1, *
1 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: lidia_nefedova@mail.ru
Поступила в редакцию 29.07.2021
После доработки 24.09.2021
Принята к публикации 05.10.2021
- EDN: LOUEYF
- DOI: 10.31857/S0016675822040099
Аннотация
Drosophila melanogaster широко используется в качестве модельного объекта в исследованиях молекулярно-генетических механизмов ответа на воздействие на организм различных ксенобиотиков, в том числе инсектицидов. Борная кислота является одним из распространенных инсектицидов, однако механизмы ее воздействия на организм насекомых не изучены. Ранее у D. melanogaster был выявлен ген-кандидат Cyp9b2 – мутант, по которому приобретает чувствительность к борной кислоте. В настоящей работе исследована роль кластера двух высокогомологичных генов Cyp9b1 и Cyp9b2 в устойчивости D. melanogaster к борной кислоте. Уровень базовой транскрипции гена Cyp9b2 в пять раз выше, чем гена Cyp9b1, что коррелирует с in silico-анализом 5'-регуляторных областей этих генов, демонстрирующим их различный регуляторный потенциал. Устойчивость к борной кислоте зависит дозоспецифично от уровня транскрипции гена Cyp9b2, но не от уровня транскрипции гена Cyp9b1. Инактивация гена Cyp9b1 не сказывается на фенотипе и не влияет на уровень устойчивости к инсектициду.
Дрозофила широко используется в качестве модельного объекта в исследованиях молекулярно-генетических механизмов ответа на воздействие на организм различных ксенобиотиков, в том числе ответа на инсектициды [1]. Метаболизм инсектицидов, как и других ксенобиотиков, происходит в ходе трех последовательных фаз: фаза I осуществляется цитохромами P450, фаза II осуществляется глутатион-S-трансферазами, UPD-глюкоронозилтрансферазами и карбоксилэстеразами, фазу III осуществляют ABC-транспортеры, которые выводят продукты метаболизма ксенобиотиков из клетки [2]. Активация отдельных цитохромов в ответ на ксенобиотики может быть ткане- и полоспецифична, основными структурами, в которых происходит метаболизм ксенобиотиков, являются жировое тело, средняя кишка и мальпигиевы сосуды [3, 4].
Борная кислота является одним из распространенных инсектицидов. Ее действие на гистологическом уровне было продемонстрировано на Blatella germanica: при содержании борной кислоты в корме в больших концентрациях (20%) происходит полное разрушение эпителия средней кишки рыжего таракана [5]. При этом происходит активация глутатион-S-трансфераз в ответ на окислительный стресс, а также снижение активности ацетилхолинтрансферазы – мишени нейротоксичных инсектицидов, что свидетельствует о влиянии борной кислоты на нервную систему [5]. Борная кислота приводит к аномалиям средней кишки и мальпигиевых сосудов у муравьев-листорезов [6], аргентинских муравьев [7] и личинок медоносной пчелы [8], а также к дефектам средней кишки и жирового тела у восковой моли [9]. Конкретные физиологические механизмы воздействия борной кислоты на организм насекомых пока не изучены.
Drosophila melanogaster широко используется в качестве модельного объекта в исследованиях, касающихся различных окислителей, мутагенов и ксенобиотиков, в том числе борной кислоты [10, 11]. В ходе исследования [11] с использованием более 200 инбредных линий из коллекции DGRP (Drosophila Genetic Reference Panel) было проведено QTL-картирование локусов, связанных с метаболизмов борной кислоты у D. melanogaster, в ходе которого был выявлен единственный ген-кандидат – Cyp9b2, кодирующий цитохром семейства P450, нокдаун которого приводил к снижению примерно в 1.5 раза выживаемости восьмидневных самок на среде, содержащей полуторапроцентную борную кислоту [11].
Ген Cyp9b2 расположен в одном кластере с геном Cyp9b1. Гены образовались в результате дупликации: выравнивание нуклеотидных и аминокислотных последовательностей генов Cyp9b1 и Cyp9b2 показывает, что нуклеотидные последовательности генов Cyp9b1 и Cyp9b2 идентичны на 81%, а аминокислотные последовательности – на 75% (сходство составляет 86%). Следующий ближайший гомолог гена Cyp9b2, ген Cyp9f2, имеет с ним 62% сходства по аминокислотной последовательности продукта. Таким образом, гены Cyp9b1 и Cyp9b2 с большой вероятностью имеют сходную функцию, и оба могли бы вносить вклад в устойчивость к борной кислоте, взаимодействуя по типу полимерии. В исследовании [11] для инактивации гена Cyp9b2 использовали метод РНК-интерференции, что могло не исключать перекрестного выключения в данном эксперименте гена Cyp9b1.
Исследуя транскриптом лабораторной линии SS7K, мы обнаружили нонсенс-мутацию в первом экзоне гена Cyp9b1 (С91Т), причем линия оказалась гомозиготной по этой мутации [12]. Проведя анализ имеющихся лабораторных линий дикого типа, в том числе D32 (Д32), Canton-S, Oregon, методом аллель-специфичной-ПЦР, мы обнаружили, что данная мутация присутствует в некоторых линиях, но гомозиготные по мутации линии обнаружены не были. Так, линия Сanton-S полиморфна по этой же точковой мутации, и, по нашим подсчетам, частота мутантного аллеля Cyp9b1 в этой линии составляет около 10%. Таким образом, мутация в линии SS7K скорее всего не возникла в процессе культивирования в лаборатории, а присутствует в природных популяциях D. melanogaster.
Мы решили проверить, влияет ли инактивация гена Cyp9b1 на устойчивость к борной кислоте. В качестве контроля использовали линию дикого типа D32 из коллекции кафедры генетики МГУ, не содержащего мутацию в гене Cyp9b1. Поскольку сравниваемые линии имеют различный генетический фон, выживаемость исследовали и у их гибридов первого и второго поколений. В эксперименте использовали самок возрастом семь дней (по 100 особей каждой линии, по 25 особей в пробирке) инкубировали на среде, содержащей борную кислоту (1%), количество умерших мух подсчитывалось через 72, 96 и 120 часов после начала эксперимента. Последняя точка – 120 ч – максимальная продолжительность жизни на среде с борной кислотой для линии дикого типа в нашем эксперименте. В результате было выявлено, что выживаемость у особей линии SS7K несколько выше, чем у особей линии D32, но не очень значительно. Однако у гибридов линий SS7K и D32 как первого, так и второго поколения, наблюдалась значительно повышенная выживаемость на борной кислоте: через 96 ч инкубации выживаемость гибридов составляла 70–75% (рис. 1, p < 0.03 для всех сравнений в этой точке, кроме SS7K×D32_F2).
Рис. 1.
Выживаемость на среде, содержащей борную кислоту (верхняя часть рисунка), и уровень экспрессии генов Сyp9b1 и Cyp9b2 (нижняя часть рисунка) у самок линий SS7K, несущей мутацию в гене Cyp9b1, дикого типа D32, а также их гибридов первого и второго поколений (* – p < 0.5, ** – p < 0.01, *** – p < 0.001 по критерию Манна–Уитни; ns, not significant – незначимое изменение).
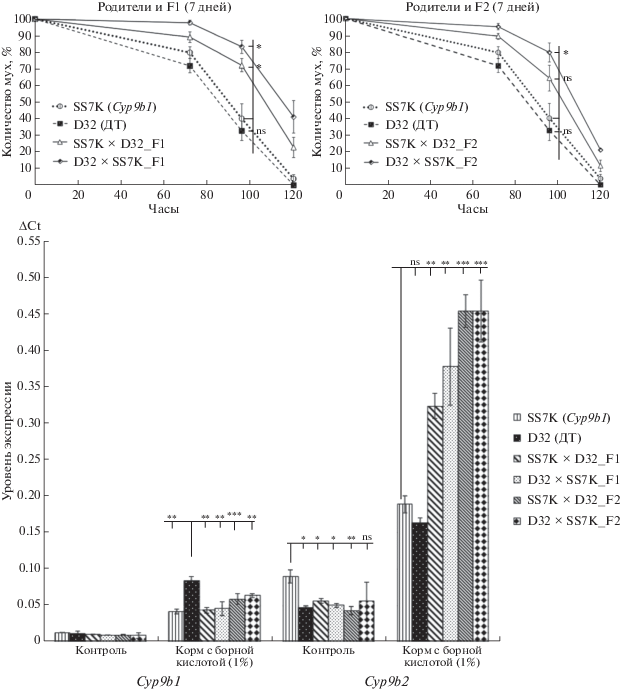
Чтобы ответить на вопрос, связана ли каким-то образом повышенная выживаемость гибридов с функцией гена Cyp9b1, мы провели генотипирование гибридных особей, выживших на борной кислоте через 120 ч инкубации, на наличие мутации в гене Cyp9b1. Выяснилось, что выживаемость гибридов не зависит от наличия мутации в гене Cyp9b1: расщепление по генотипу среди выживших особей составило 1/4 Cyp9b1+/Cyp9b1+ : : 1/2 Cyp9b1+/Cyp9b1 : 1/4 Cyp9b1/Cyp9b1. Таким образом, обнаруженный эффект повышения устойчивости к борной кислоте у гибридов не связан с мутацией в гене Cyp9b1, и может быть объяснен формированием нового генотипа у гибридов, что привело либо к активации функции неизвестных генов, участвующих в формировании устойчивости к борной кислоте у гибридов, либо к изменению регуляции экспрессии генов Cyp9b1 и Cyp9b2. Далее мы проверили, зависит ли повышение выживаемости от уровня экспрессии генов Cyp9b1 и Cyp9b2.
Выделение тотальной РНК из целых мух производили с помощью реактива ExtractRNA (Евроген) после 48-часовой инкубации на среде с борной кислотой в четырех биологических повторах. Перед постановкой реакции обратной транскрипции образцы РНК обрабатывали ДНКазой I (Fermentas). Для обратной транскрипции использовали набор MMLV-RT Kit (Евроген). ПЦР-РВ в присутствии SYBR Green I (Синтол) ставили в амплификаторе MiniOpticon Real-Time PCR System (Bio-Rad). В опыте анализировали относительную экспрессию генов Cyp9b1 и Cyp9b2, нормированную на экспрессию генов αTub84D, Rpl40 и Elo-B. Для аллель-специфичной ПЦР использовали праймеры к гену Cyp9b1 (5'-CCTTAAAGGTGCCAGTACTC/Т-3' и 5'-CAGTTAGCATTAATACATCAGGTG-3'), для ОТ-ПЦР использовали праймеры к генам: Cyp9b1 (5'-TGCAGCCATGTTACCTAAA-3' и 5'-CAGTTAGCATTAATACATCAGGTG-3'), Cyp9b2 (5'-GGAAGCACATGAGAAACAC-3' и 5'-GTTGGAGAGCTTGTTGCACA-3'), RpL40 5'‑CTGCGTGGTGGTATCATTG-3' и 5'-CAGGTTGTTGGTGTGTCC-3'), Elo-B (5'-GCACAAACATACACACTCACG-3' и 5'-TTTCCTACTTCGCTTGCACC-3'), αTub84D (5'-GTGCATGTTGTCCAACACCAC-3' и 5'-AGAACTCTCCCTCCTCCATA-3').
Выявлено, что уровень базовой (неиндуцированной) экспрессии гена Cyp9b1 одинаков у всех линий и примерно в пять раз ниже, чем уровень базовой экспрессии гена Cyp9b2 у линии дикого типа (рис. 1). Уровень базовой экспрессии гена Cyp9b2 значительно выше у линии SS7K по сравнению с линией дикого типа и гибридами. Борная кислота активирует транскрипцию гена Сyp9b1 до уровня базовой транскрипции гена Cyp9b2 в линии дикого типа, а в линии SS7K и у гибридов уровень индуцированной транскрипции гена Сyp9b1 примерно одинаков и в два раза ниже, чем в линии SS7K. Однако уровень транскрипции гена Cyp9b2 у гибридов на среде с борной кислотой активируется в 2.5–3 раза по сравнению с родительскими линиями. Таким образом, повышенный уровень выживаемости у гибридов обусловлен именно повышенным уровнем экспрессии гена Cyp9b2, так как значительное повышение экспрессии этого гена у гибридов коррелирует с их повышенной выживаемостью на среде с борной кислотой.
Суммарный уровень индуцированной транскрипции генов Сyp9b1 и Cyp9b2 в линии D32 сравним с таковым для гена Cyp9b2 в линии SS7K. Если предположить, что гены работают аддитивно, то, при условии отсутствия (из-за наличия стоп-кодона) белкового продукта гена Cyp9b1 линии SS7K, должна была бы наблюдаться повышенная устойчивость к борной кислоте в линии D32, а не в SS7K. Однако количество белковых продуктов не обязательно должно быть пропорционально количеству транскриптов и, тем более, выживаемости. Последнее следует из данных по гибридам, у которых транскрипция гена Cyp9b2 на среде с борной кислотой повышена примерно в три раза, а выживаемость – не более, чем в два раза, и то в определенных временны́х точках (рис. 1). Таким образом, опираясь на данные исследования [11] и полученные в настоящем исследовании данные, можно заключить, что выживаемость на борной кислоте строго коррелирует с уровнем транскрипции гена Cyp9b2, а экспрессии гена Сyp9b1 недостаточно, чтобы значимо повлиять на уровень устойчивости к борной кислоте.
По данным масштабного транскриптомного анализа, результаты которого размещены в базе данных FlyBase [13], уровень базовой транскрипции гена Cyp9b1 оценивается у имаго как очень низкий (2–3 условные единицы), Cyp9b2 – как умеренный (14–16 условных единиц). Очень высокий уровень неиндуцированной транскрипции гена Cyp9b2 (более 150 условных единиц) наблюдается в пищеварительной системе, высокий (50–100 условных единиц) – в тканях головы и каркаса. Для гена Cyp9b1 в тканях головы и пищеварительной системы наблюдается умеренный уровень (11–17 условных единиц) экспрессии. Характер экспрессии генов Cyp9b1 и Cyp9b2 в разных тканях и в ответ на воздействие различных ксенобиотиков в целом схож. Согласно анализу корреляции профилей экспрессии, проведенному FlyBase на основании сравнения транскриптомных данных, корреляция транскрипции генов Cyp9b1 и Cyp9b2 в разных тканях и в ответ на воздействие стрессоров, составляет 84.4 и 91.7% соответственно, что может свидетельствовать о сходном контроле транскрипции этих генов. Однако в списке HitList коррелирующих по профилю экспрессии в разных тканях генов, кроме Cyp9b1 и Cyp9b2, присутствуют еще шесть генов цитохромов (Cyp6g1, Cyp28d1, Cyp4ac1, Cyp6w1, Cyp6a2, Cyp4p1), а в списке коррелирующих по профилю экспрессии генов в ответ на стрессовые воздействия наряду с Cyp9b1 и Cyp9b2 присутствуют еще десять генов цитохромов (Cyp12a5, Cyp6a9, Cyp6a21, Cyp4p1, Cyp6a23, Cyp12e1, Cyp6a17, Cyp6a14, Cyp4d14, Cyp6d4). Таким образом, списки генов цитохромов, индуцируемых в разных тканях и в ответ на стрессовые воздействия, в основном, не пересекаются и содержат только три одинаковых гена – Cyp9b1, Cyp9b2 и Cyp4p1. Последний ген не попал в круг рассматриваемых кандидатов, выявленных в работе [11], и имеет незначительное структурное сходство с геном Cyp9b2 (Cyp4p1 и Cyp9b2 на 25% идентичны и на 40% сходны по аминокислотным последовательностям).
Следует отметить, что кроме корреляции профилей транскрипции, необходимо сравнивать еще уровень транскрипции генов цитохромов. Так уровень индуцированной экспрессии гена Cyp9b2 выше, чем Cyp9b1, в пять раз в тканях головы и каркаса и в 20 раз выше в тканях пищеварительной системы. Такой высокий уровень экспрессии гена Cyp9b2 в тканях пищеварительной системы может объяснять устойчивость к борной кислоте, которую мухи получали с пищей. Почему же ген Сyp9b1 имеет низкий базовый уровень транскрипции?
Поскольку гены Cyp9b1 и Cyp9b2 – результат дупликации предкового гена, мы проанализировали регуляторные 5'-регуляторные области (по 500 пн от начала кодирующей рамки) на предмет сходства нуклеотидных последовательностей и наличия общих регуляторных сайтов. Выравнивание последовательностей в программе Blastn (https://blast.ncbi.nlm.nih.gov/BlastAlign.cgi) не выявило протяженных участков гомологии сходства, что свидетельствует о значительной дивергенции последовательностей. Поиск коротких сходных последовательностей длиной 10–12 пн (допустимо наличие двух неспаренных нуклеотидов) в некодирующих 5'-регуляторных областях генов в программе Oligonucleotids repeats finder (http:// wwwmgs.bionet.nsc.ru/mgs/programs/oligorep/) выявил 20 гомологичных участков, из которых только пять имеют примерно одинаковые координаты в регуляторных областях. Предсказание сайтов связывания транскрипционных факторов в программе LASAGNA (https://biogrid-lasagna.engr.uconn.edu/lasagna_search/index.php) [14] с использованием алгоритма позиционно-весовых матриц и двух баз данных TRANSFAC (Insects, 38 моделей сайтов связывания) и JASPAR (Insects, 126 моделей сайтов связывания). Поиск в базе данных TRANSFAC выявил с вероятностью p < < 0.001 три предполагаемых сайта связывания транскрипционных факторов для гена Cyp9b1 и семь – для гена Cyp9b2. Поиск в базе данных JASPAR выявил с вероятностью p < 0.001 11 и 19 предполагаемых сайтов связывания транскрипционных факторов для генов Cyp9b1 и Cyp9b2 соответственно. Общим для двух генов и для двух баз данных оказался только один сайт связывания – сайт транскрипционного фактора CF-2II, контролирующего дифференцировку фолликулярных клеток и регулирующего экспрессию генов миогенеза. Таким образом, по крайней мере по данным биоинформатического анализа, регуляция работы генов Cyp9b1 и Cyp9b2 может различаться, а у гена Cyp9b2 может быть больше регуляторов транскрипционной активности. Однако предсказательная сила у биоинформатических методов поиска сайтов связывания транскрипционных факторов невысока и требует экспериментального подтверждения.
Опубликовано единственное исследование, в котором экспрессия на уровне транскрипции обоих генов, Сyp9b1 и Cyp9b2, согласовано повышалась до трех раз в ответ на воздействие ксенобиотиком – фенобарбиталом [15]. Индукция только гена Cyp9b2 под действием фенобарбитала обнаружена в работах [16, 17]. Примечательно, что фенобарбитал в низких концентрациях в ряде исследований используется как антиоксидант, повышающий устойчивость к определенным пестицидам при совместной обработке [18]. Чаще всего такой эффект обусловлен дополнительной индукцией систем антиоксидантой защиты, поскольку в ряде случаев цитохромы, участвуя в детоксикации ксенобиотиков, сами индуцируют окислительный стресс [19].
Различный характер экспрессии генов Cyp9b1 и Cyp9b2 был выявлен в нескольких работах, посвященных исследованию ответа цитохромов на различные стрессовые воздействия [20–25]. Показано, что Cyp9b1 снижает свою экспрессию при облучении молодых мух синим светом (наряду с девятью другими генами цитохромов – Cyp28d1, Cyp317a1, Cyp4c3, Cyp4e1, Cyp4e3, Cyp4s3, Cyp6a20, Cyp6a8, Cyp6a9), при этом индуцируются нейропротекторные гены [18]. Также ген Cyp9b1 снижает свою экспрессию в ответ на гипоксию у личинок третьего возраста (наряду с генами Cyp6a22 и Cyp6a17) [21]. Напротив, экспрессия Cyp9b2 повышается при голодании [22] и гипоксии [23]. У взрослых самцов экспрессия Cyp9b2 индуцируется на среде с туникамицином – индуктором стресса эндоплазматического ретикулума [24]. В работе [25] было обнаружено, что экспрессия гена Сyp9b2 индуцируется голоданием у дрозофилы. Таким образом, гены Cyp9b1 и Cyp9b2 могут активироваться как согласованно, так и дифференциально.
Примечательным является тот факт, что лабораторная линия SS7K, используемая в нашем эксперименте, оказалась полностью гомозиготной по мутации в гене Cyp9b1. Конечно это может быть результатом случайных событий. Но очевидно это свидетельствует о том, что ген не является важным и не поддерживается отбором в лабораторных условиях культивирования. Шел ли отбор в пользу закрепления в данной популяции мутантного аллеля гена Cyp9b1 – неизвестно. Однако те немногочисленные исследования, которые включали анализ транскрипции гена Cyp9b1, показывают, что его экспрессия снижается, то есть не является необходимой, при ряде стрессовых воздействий [20, 21]. А если и индуцируется некоторыми воздействиями, то в незначительной степени, в отличие от гена Cyp9b2, что делает роль этого гена второстепенной. По-видимому, ген Cyp9b1 не находится под действием стабилизирующего отбора, поскольку дублирует функцию Cyp9b2 и имеет слишком низкий уровень экспрессии.
Полученные нами данные о зависимости уровня устойчивости к борной кислоте в зависимости от дозы гена Cyp9b2 косвенно подтверждаются исследованиями на другом виде дрозофил – D. sechellia. Исследование генома D. sechellia, питающихся плодами растения Morinda сitrifolia, экстракт которого часто используют в качестве инсектицида с нейротоксическим действием, имеют три дополнительные копии гена Cyp9b2 (а также по одной дополнительной копии генов Cyp6d5, Cyp9f2, Cyp6a9, Cyp6a17, Cyp4p1, Cyp4d1, Cyp4d2) [26]. Очевидно ген Cyp9b2 является важным геном детоксикации, отвечающим на широкий спектр воздействий. Характер индукции гена Cyp9b2 свидетельствует о его участии в ответе на нейротоксический стресс, он активируется нейротоксичными ксенобиотиками (фенобарбитал, ротенон, кофеин, этанол) [27]. По-видимому борная кислота оказывает сходное воздействие, влияя и на пищеварительную, и на центральную нервную систему дрозофилы. Основной вопрос заключается в том, каким образом ген Cyp9b2 обеспечивает некоторый уровень устойчивости к борной кислоте. Известно, что борная кислота может физически взаимодействовать с одним из типов цитохромов, цитохромом с, в реакции in vitro [28]. Это не исключает возможности ее взаимодействия с другими типами цитохромов, что требует дальнейшего исследования.
Исследование выполнено в рамках Междисциплинарной научно-образовательной школы Московского университета “Молекулярные технологии живых систем и синтетическая биология”.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Yang J., McCart C., Woods D.J., Terhzaz S. et al. A Drosophila systems approach to xenobiotic metabolism // Physiol. Genomics. 2007. V. 30. P. 223–231.
Ranson H., Claudianos C., Ortelli F. et al. Evolution of supergene families associated with insecticide resistance // Science. 2020. V. 298. P. 179–181.
Petersen R.A., Zangerl A.R., Berenbaum M.R., Schuler M.A. Expression of CYP6B1 and CYP6B3 cytochrome P450 monooxygenases and furanocoumarin metabolism in different tissues of Papilio polyxenes (Lepidoptera: Papilionidae) // Insect Biochem. Mol. Biol. 2001. V. 31. P. 679–690.
Le Goff G., Hilliou F., Siegfried B.D. et al. Xenobiotic response in Drosophila melanogaster: sex dependence of P450 and GST gene induction // Insect Biochemistry and Molecular Biology. 2006. V. 36. № 8. P. 674–682.
Habes D., Morakchi S., Aribi N. et al. Boric acid toxicity to the german cockroach, Blattella germanica: alterations in midgut structure, and acetylcholinesterase and glutathione S-transferase activity // Pesticide Biochem. and Physiology. 2005. P. 17–24.
Sumida S., Da Silva-Zacarin E.C.M., Decio P. et al. Toxicological and histopathological effects of boric acid on Atta sexdens rubropilosa (Hymenoptera: Formicidae) workers // J. Economic Entomology. 2010. V. 103. № 3. P. 676–690.
Klotz J.H., Amrhein Ch., McDaniel S. et al. Assimilation and toxicity of boron in the Argentine ant (Hymenoptera: Formicidae) // J. Entomol. Sci. 2002. V. 37. № 2. P. 193–199.
da Silva Cruz A., da Silva-Zacarin E.C.M., Bueno O.C. et al. Morphological alterations induced by boric acid and fipronil in the midgut of worker honeybee (Apis mellifera L.) larvae // Cell Biol. Toxicol. 2010. V. 26. P. 165–176. https://doi.org/10.1007/s10565-009-9126-x
Büyükgüzel E., Büyükgüzel K., Snela M. et al. Effect of boric acid on antioxidant enzyme activity, lipid peroxidation, and ultrastructure of midgut and fat body of Galleria mellonella // Cell Biol. and Toxicology. 2013. V. 29. P. 117–129.
Sarıkaya R., Erciyas K., Kara M.I. et al. Evaluation of genotoxic and antigenotoxic effects of boron by the somatic mutation and recombination test (SMART) on Drosophila // Taylor and Francis. 2016.
Najarro M.A., Hackett J.L., Macdonald S.J. Loci contributing to boric acid toxicity in two reference populations of Drosophila melanogaster // G3: Genes, Genomes, Genetics. 2017. V. 7. № 6. P. 1631–1641.
Кукушкина И.В., Махновский П.А., Нефедова Л.Н. и др. Анализ транскриптома линий Drosophila melanogaster с нарушением контроля транспозиции ретротранспозона gypsy // Генетика. 2020. Т. 56. № 5. С. 550–560.
Brown J.B., Boley N., Eisman R. et al. Diversity and dynamics of the Drosophila transcriptome // Nature. 2014. V. 512. № 7515. P. 393–399.
Lee C., Huang C.-H. LASAGNA-Search: an integrated web tool for transcription factor binding site search and visualization // BioTechniques. 2013. V. 54. № 3. P. 141–153.
Willoughby L., Chung H., Lumb C., Robin C. et al. A comparison of Drosophila melanogaster detoxification gene induction responses for six insecticides, caffeine and phenobarbital // Insect Biochem. Mol. Biol. 2006. V. 36. P. 934–942.
Sousa-Polezzi R., Hermione B. Effect of phenobarbital on inducing insecticide tolerance and esterase changes in Aedes aegypti (Diptera: Culicidae). // Genet. Mol. Biol. 2004. V. 27. № 2.
King-Jones K., Horner M.A., Lam G., Thummel C.S. The DHR96 nuclear receptor regulates xenobiotic responses in Drosophila // Cell Metabolism. 2006. V. 4. P. 37–48.
Sun W., Margam V.M., Sun L. et al. Genome-wide analysis of phenobarbital-inducible genes in Drosophila melanogaster // Insect Mol. Biol. 2006. V. 15. P. 455–464.
Hrycay E.G., Bandiera S.M. Chapter Two – Involvement of cytochrome P450 in reactive oxygen species formation and cancer // Adv. in Pharmacology. 2015. V. 74. P. 35–84.
Hall H., Ma J., Shekhar S. et al. Blue light induces a neuroprotective gene expression program in Drosophila photoreceptors // BMC Neurosci. 2018. V. 19. № 43.
Li Y., Padmanabha D., Gentile L.B., Dumur C.I. et al. HIF- and non-HIF-regulated hypoxic responses require the estrogen-related receptor in Drosophila melanogaster // PLoS Genet. 2013. V. 9. № 1. e1003230.
Harbison S.T., Chang S., Kamdar K.P. et al. Quantitative genomics of starvation stress resistance in Drosophila // Genome Biol. 2005. V. 6. № R36.
Liu G., Roy J., Johnson E.A. Identification and function of hypoxia-response genes in Drosophila melanogaster // Physiol. Genomics. 2006. V. 25. P. 134–141.
Girardot F., Monnier V., Tricoire H. Genome wide analysis of common and specific stress responses in adult Drosophila melanogaster // BMC Genomics. 2004. V. 5. № 74.
Carsten L.D., Watts T., Markow T.A. Gene expression patterns accompanying a dietary shift in Drosophila melanogaster // Mol. Ecol. 2005. V. 14. P. 3203–3208.
Rane R.V., Clarke D.F., Pearce S.L. et al. Detoxification genes differ between cactus-, fruit-, and flower-feeding Drosophila // J. Heredity. 2019. V. 110. № 1. P. 80–91.
Giraudo M., Unnithan G.C., Le Goff G., Feyereisen R. Regulation of cytochrome P450 expression in Drosophila: Genomic insights // Pestic Biochem. Physiol. 2010. V. 97. № 2. P. 115–122.
Taler G., Eliav U., Navon G. Detection and characterization of boric acid and borate ion binding to cytochrome using multiple quantum filtered NMR // J. Magnetic Resonance. 1999. V. 141. № 2. P. 228–238.
Дополнительные материалы отсутствуют.


