Генетика, 2022, T. 58, № 9, стр. 1042-1055
Ареал, насекомые-переносчики и полиморфизм митохондриальной ДНК гамазового клеща Hoploseius oblongus (Mesostigmata, Blattisociidae) – облигатного микобионта трутового гриба Fomitopsis pinicola (Polyporales, Basidiomycota)
Б. В. Андрианов 1, 3, *, О. Л. Макарова 2, И. И. Горячева 1, А. Г. Зуев 2
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
119071 Москва, Россия
3 Московский государственный областной университет
141014 Мытищи, Московская область, Россия
* E-mail: andrianovb@mail.ru
Поступила в редакцию 27.01.2022
После доработки 03.03.2022
Принята к публикации 10.03.2022
- EDN: TPDDUW
- DOI: 10.31857/S0016675822090041
Аннотация
Охарактеризована генетическая изменчивость гамазового клеща Hoploseius oblongus Masan & Halliday, 2016, найденного во Франции, Дании, Украине и широко в России, от Кавказа до Заполярья. Этот вид, известный до сих пор по шести находкам в Словакии и Польше, обитает только в гименофоре живых плодовых тел трутового гриба Fomitopsis pinicola. Мы изучили 502 живых плодовых тела F. pinicola из 62 локалитетов и провели ДНК-штрихкодирование особей H. oblongus из 28 локалитетов на территории Европы, Кавказа, Западной и Средней Сибири. Не менее 90% плодовых тел F. pinicola в исследованных районах заселены клещом H. oblongus. Повсеместно в Западной Палеарктике, вплоть до долины Енисея на востоке, мы наблюдали ассоциацию F. pinicola с клещом H. oblongus. На всей исследованной нами территории обширного ареала H. oblongus характеризуется низкой изменчивостью нуклеотидной последовательности BOLD-фрагмента митохондриального гена COI и мономорфен по нуклеотидной последовательности фрагмента ядерного рибосомного повтора. Низкая генетическая изменчивость указывает на относительно недавнее происхождение популяции H. oblongus, возможно связанное с восстановлением лесного пояса Северной Евразии в голоцене. Эффективность расселения H. oblongus обеспечивается форезией взрослых клещей на яйцекладущих самках почвенных комариков детритниц (Sciaridae) в конце лета и начале осени. Реже клещи расселяются на взрослых галлицах (Cecidomyiidae) из трибы Brachineurini или на имаго некоторых других мелких видов насекомых из отряда Diptera.
Плодовые тела трутовых грибов, многочисленные и повсеместно встречающиеся в лесной зоне Голарктики, образуют специфическое местообитание для микрофауны, в первую очередь – различных клещей. Экологическая генетика этой микрофауны в настоящее время мало исследована, но сам комплекс микобионтов в последние годы является объектом активного изучения [1–7]. В данном сообщении мы впервые приводим характеристику генетической изменчивости клеща Hoploseius oblongus Masan & Halliday, 2016, обитающего в трубочках гименофора живых грибов Fomitopsis pinicola (Sw.) P. Karst.
Клещи рода Hoploseius Berlese, 1914 населяют преимущественно теплые регионы Земли, в том числе Центральную Америку, тропическую Африку, Ближний Восток, Юго-Восточную Азию и Авcтралию. Большинство видов связано с дереворазрушающими грибами [8]. Род насчитывает 12 видов, из которых лишь три распространены в Южной и Средней Европе [2, 9–12]. Баркодирование видов рода Hoploseius ранее не проводилось.
На территории России и Прибалтики клещи рода Hoploseius (как Hoploseius sp.) указывались неоднократно [1, 13–15]. Недавно этот вид описан как Hoploseius oblongus Masan & Halliday, 2016. Все находки H. oblongus связаны только с гименофором трутовика окаймленного (Fomitopsis pinicola) [1, 11, 13, 15]. Этот вид грибов широко распространен в умеренных и бореальных лесах Северного Полушария, где заселяет различные хвойные и лиственные породы деревьев, наиболее часто Picea spp. и Betula spp. [16]. Некоторые плодовые тела F. pinicola могут жить до 18 лет [17]. Этот вид гриба активно распространяет бурую гниль [18] и считается основным разрушителем мертвой древесины в Eвропе [19]. Видовой состав акарофауны Fomitopsis pinicola изучался в ряде работ [1, 2, 5, 12–15, 20, 21]. Пути заселения плодовых тел F. pinicola клещами-микобионтами ранее не изучались. В роде Hoploseius форезия на мелких короткоусых двукрылых показана для трех видов [20, 22]. Переносчики H. oblongus ранее не были известны, но их наличие не вызывало сомнений, принимая во внимание особенности биологии данного вида. Местообитание клеща образует в лесу динамичную во времени пространственную мозаику из заселенных клещами и вновь растущих грибов, которые разделены обширными пространствами, непригодными для жизни клещей. Это обстоятельство делает необходимой форезию клещей на летающих насекомых, способных переносить слабо мобильных клещей в новые плодовые тела трутовика.
В данной работе мы впервые проводим баркодирование сборов H. oblongus в грибах F. pinicola и оцениваем степень генетического единства его обширной популяции, а также уточняем ареал H. oblongus на территории Европы и Западной Сибири. Впервые определены группы насекомых, участвующие в расселении H. oblongus. Полученные данные позволяют реконструировать основные этапы формирования современного ареала этого узкоспециализированного вида клещей.
МАТЕРИАЛЫ И МЕТОДЫ
Сборы клещей
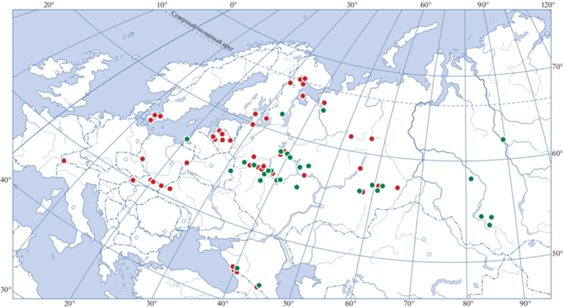
Сборы окаймленных трутовиков, Fomitopsis pinicola, проводили в 1989–2021 гг. в различных регионах России, а также на территории Украины, Дании и Франции. Анализировались только живые плодовые тела преимущественно средних размеров, возрастом 1–3 года, со светло-желтым или белым гименофором, без признаков повреждения. Грибы отделяли от деревьев, заворачивали в несколько слоев газетной бумаги (оставляя прослойку воздуха над гименофором) и полиэтиленовый пакет и доставляли в лабораторию. Иногда использовалась почтовая пересылка в течение 3–5 дней. Всего изучено 502 плодовых тела из 62 локалитетов. Географическое расположение мест сбора трутовиков представлено на рис. 1. Число грибов в сериях из одного локалитета варьировало от двух до 202 шт. Выгонку клещей проводили в лаборатории в эклекторах из плотной бумаги без специального освещения или подогрева до полного высыхания в течение 10–18 сут. Клещей фиксировали 96%-ным этанолом. Часть определенных по морфологическим признакам особей H. oblongus была использована в генетических исследованиях. При изготовлении препаратов применяли жидкость Хойера. Определяли процент инфицированных клещом плодовых тел 2–3-летнего возраста и количество особей H. pinicola всех стадий развития в каждом плодовом теле, которое пересчитывали на 1 дм2 площади гименофора. В ряде районов, представляющих основные климатические зоны в пределах ареала H. oblongus, был проведен поиск клещей H. oblongus в лесной почве. Пробы почвы отбирали с площади 5 × 5 см2, они включали подстилку и собственно почву до глубины 5 см. Выгонку клещей проводили в эклекторах.
Формирование выборки клещей H. oblongus для проведения ДНК-штрихкодирования
Для молекулярного анализа клещей собирали из одного плодового тела гриба. Из общего сбора микроартропод, собранных в эклектор, самок H. oblongus выбирали механически в количестве около 50 для одного выделения тотальной ДНК. Возможность применения такого метода сбора клещей связана с особенностями биологии H. oblongus. H. oblongus не образует стабильного заселения определенного места. Его колонии возникают, очевидно, от единственной самки-основательницы или от небольшой, вероятно родственной, группы клещей, перенесенных на гриб в результате форезии на летающем насекомом-переносчике. Колонии существуют обычно от одного года до четырех лет, пока гриб растет, и исчезают после отмирания гриба. Таким образом, при формировании каждой колонии клещей должен наблюдаться эффект основателя, что связано со снижением генетической изменчивости. В результате клещи из конкретного плодового тела гриба могут рассматриваться как одна митохондриальная линия, которую можно сравнивать с другими митохондриальными линиями из географически удаленных районов. Были обработаны выборки из 28 локалитетов. Места сборов клещей, охарактеризованных с помощью метода ДНК-щтрихкодирования, показаны на рис. 1. Описание мест сборов клещей и результат ДНК-штрихкодирования клещей по данным изменчивости нуклеотидной последовательности BOLD-фрагмента митохондриального гена COI представлены в табл. 1.
Таблица 1.
Сборы клещей Hoploseius oblongus, охарактеризованные методом ДНК-штрихкодирования
| № п/п | Регион | Локалитет и (дата сбора) | Имя COI гаплотипа | GenBank ID |
|---|---|---|---|---|
| 1 | Московская область | Шаховской р-н, д. Бурцево (30.06.2019) | Karelia_34 | MZ686921 |
| 2 | Московская область | Подольский р-н, Малинская биологическая станция ИПЭЭ РАН (29.12.2019) | Moscow_4 | MZ686922 |
| 3 | Тверская область | Центрально-лесной государственный заповедник (05.01.2020) | Karelia_34 | MZ686923 |
| 4 | Архангельская область | Пинежский р-н (09.01.2015) | Arkhangelsk_12 | MZ686924 |
| 5 | Калининградская область | Куршская коса, Биологическая станция “Фрингилла” ЗИН РАН (17.04.2020) | Curonian_Spit | MZ686925 |
| 6 | Ярославская область | Некоузский р-н, пос. Борок (08.05.2020) | Yaroslavl_16 | MZ686926 |
| 7 | Нижегородская область | Краснобаковский р-н, д. Старое Дмитриевское (02.05.2020) | N_Novgorod_17 | MZ686927 |
| 8 | Московская область | г. Москва, парк Покровско-Стрешнево (23.04.2020) | Moscow_13 | MZ686928 |
| 9 | Московская область | Пушкинский р-н, пос. Софрино (03.06.2020) | Moscow_18 | MZ686929 |
| 10 | Нижегородская область | Кстовский р-н, пос. Нижегородец (20.06.2020) | N_Novgorod_17 | MZ686930 |
| 11 | Тульская область | Заокский р-н (04.06.2020) | Moscow_13 | MZ686931 |
| 12 | Смоленская область | д. Дубровенка (09.07.2020) | Smolensk_22a | MZ686932 |
| 13 | Ярославская область | г. Ярославль, Скобыкинский лесопарк (15.07.2020) | Yaroslavl_0 | MZ686933 |
| 14 | Свердловская область | г. Первоуральск, д. Крылосово (15.07.2020) | Enisey_30a | MZ686934 |
| 15 | Владимирская область | г. Владимир, Загородный парк (17.08.2020) | Karelia_34 | MZ686935 |
| 16 | Свердловская область | г. Полевской (22.08.2020) | Enisey_30a | MZ686936 |
| 17 | Свердловская область | г. Екатеринбург, парк Березовая роща (04.09.2020) | Moscow_4 | MZ686937 |
| 18 | Пермская область | Суксунский р-н, д. Чекарда (29.08.2020) | Perm_29 | MZ686938 |
| 19 | Средняя Сибирь, среднее течение р. Енисей | пос. Мирное (18.08.2020) | Enisey_30a | MZ686939 |
| 20 | Томская область | Чаинский р-н, пос. Стрельниково (05.09.2020) | Tomsk_31 | MZ686940 |
| 21 | Алтайский край | пос. Тальменка (01.09.2020) | Altay_32 | MZ686941 |
| 22 | Владимирская область | Собинский р-н (12.09.2020) | Enisey_30a | MZ686942 |
| 23 | Карелия | Заповедник “Кивач” (26.09.2020) | Karelia_34 | MZ686943 |
| 24 | Нижегородская область | Сокольский р-н, д. Галицкая (27.09.2020) | Moscow_4 | MZ686944 |
| 25 | Алтайский край | д. Сухой Карасук (07.10.2020) | Altay_32 | MZ686945 |
| 26 | Алтайский край | Салаирский Кряж, пос. Казанцево (06.10.2020) | Altay_37 | MZ686946 |
| 27 | Адыгея | Майкопский р-н (09.10.2020) | Adygea_38 | MZ686947 |
| 28 | Северная Осетия | Пригородный р-н (06.01.2021) | Adygea_38 | MZ686948 |
Выделение тотальной ДНК и проведение ПЦР
Тотальную ДНК из самок клещей выделяли фенол-хлороформным методом [23]. Полученную ДНК растворяли в деионизованной воде. Концентрация ДНК определялась спектрофотометрически с использованием Implen NanoPhotometer NP80. Концентрацию ДНК в препаратах выравнивали до 4 нг/мкл. ПЦР проводили в конечном объеме 25 мкл с использованием наборов для амплификации EncycloPlus PCR kit (Евроген, Россия) в соответствии с инструкцией фирмы-производителя.
Стандартные фолмеровские праймеры LCO1490 и HCO2198 [24] дают нестабильную амплификацию BOLD-фрагмента на матрице тотальной ДНК клещей. Более стабильные результаты дает пара праймеров HOP611F–HCO2198, амплифицирующих укороченный с 5'-конца BOLD-фрагмент длиной 611 пн. Прямой праймер: HOP611F (5'-TATGAGCAGGAATAATTGGAACCT-3'), обратный праймер: HCO2198 (5'-TAAACTTCAGGGTGACCAAAAAATCA-3'). Праймеры были подобраны с помощью программы Primer3 [25]. Условия ПЦР: первичная денатурация – 3 мин при 94°С; затем 35 циклов: денатурация 94°С – 15 с, отжиг 60°С – 10 с, синтез 72°С – 40 с; и завершающий синтез при 72°С – 7 мин.
Для амплификации фрагмента рибосомного повтора гриба F. pinicola мы использовали модифицированный протокол из работы [26]. Праймеры: прямой ITS1 (5'-TCCGTAGGTGAACCTGCGG-3') и обратный ITS4 (5'-TCCTCCGCTTATTGATATGC-3') амплифицируют фрагмент длиной 625 пн, включающий следующие последовательности: фрагмент ITS1, ген 5.8S рРНК, ITS2, фрагмент гена 28S рРНК. Вследствие неожиданно высокой гомологии некоторых фрагментов ядерных рибосомных повторов у гриба и клеща, которую мы обнаружили эмпирически, те же праймеры позволяют амплифицировать аналогичный фрагмент рибосомного повтора клещей H. oblongus длиной 589 пн. Мы использовали эти праймеры для получения ПЦР-фрагмента, включающего последовательности ITS1, гена 5.8S рРНК, ITS2 и фрагмента гена 28S рРНК у клещей H. oblongus. Условия ПЦР: первичная денатурация – 3 мин при 94°С; затем 35 циклов: денатурация 94°С – 15 с, отжиг 58°С – 10 с, синтез 72°С – 40 с; и завершающий синтез при 72°С – 7 мин.
Очистка и секвенирование ПЦР-фрагментов
Фрагменты, полученные в результате амплификации, фракционировали в 1.5%-ном агарозном геле. Элюция фрагментов из геля проводилась с использованием набора для элюции Cleanup Mimi (Евроген, Россия) в соответствии с инструкцией фирмы-производителя.
Нуклеотидную последовательность ПЦР-фрагментов определяли с прямого и обратного праймеров на приборе 3500 Genetic Analyzer с использованием набора реагентов BigDye®Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems, США) согласно рекомендациям фирмы-производителя.
Биоинформационный анализ
Анализ хроматограмм проводили с помощью программы CromasPro 13.3 (Technelysium, Australia). Выравнивание последовательностей, полученных в результате секвенирования, с последовательностями, размещенными в базах данных GenBank, было выполнено с использованием ресурсов NCBI (http://www.ncbi.nlm.nih.gov). Для проведения кладистического анализа использовали программу MEGA7 [27]. Дендрограммы строили методом ближайших соседей (NJ). Статистическую достоверность полученной кластеризации таксонов оценивали при помощи величины бутстрэп-поддержки с числом репликаций 10 000. Количественные данные о величине нуклеотидной изменчивости выборки проводили в программе MEGA7 [27].
Медианная сеть митохондриальных гаплотипов была построена в программе PopART [28] с применением алгоритма TCS [29].
Поиск насекомых-переносчиков клещей
Для обнаружения видов насекомых-переносчиков H. oblongus были сконструированы ловчие камеры, состоящие из подноса, на котором располагались свежесобранные окаймленные трутовики, и ловчего экрана, расположенного над грибами на высоте нескольких сантиметров. Экран смазывался энтомологическим клеем “Полификс”, размягченным в бензиновом растворителе “Галоша”. Толщина слоя клея составляла около 0.1 мм. Экран располагали над свежими плодовыми телами трутовиков таким образом, чтобы он не касался грибов и подноса. Ловчие камеры размещали на открытом воздухе в защищенном от дождя месте, неподалеку от паркового леса в Москве, заселенного окаймленным трутовиком и H. oblongus. Можно было ожидать наличия в нем и насекомых-переносчиков H. oblongus. Насекомые-переносчики имели возможности залетать в камеры с плодовыми телами трутовиков и свободно покидать их, но часть насекомых прилипала к липкой поверхности ловчего экрана. Плодовые тела сменялись каждые 6–8 дней. В период с 16 мая по 30 сентября 2021 г. осмотр экранов проводили ежедневно под бинокулярным микроскопом. В описанных условиях мелкие насекомые надежно прилипали к экрану, смазанному энтомологическим клеем. Поскольку камеры были приоткрыты, насекомые могли как вылетать из грибов, так и залетать снаружи из соседнего парка. Клещи H. oblongus учитывались, если они были обнаружены на насекомых или непосредственно рядом с прилипшими насекомыми. Так как после прилипания насекомого форезирующие клещи способны недолго перемещаться в слое клея, часто наблюдалась следовая дорожка от клеща к насекомому, что позволяло установить факт форезии. Прилипших к экрану насекомых и клещей снимали с помощью иглы, помещали в отдельные пробирки и выдерживали в течение 5–7 дней в бензиновом растворителе, а потом 0.5–3 мес. – в этиловом спирте (96%). Из клещей и насекомых изготавливали постоянные препараты с жидкостью Хойера по стандартной методике, размещая их на одном стекле для фотографирования. Насекомых определяли до уровня семейства.
РЕЗУЛЬТАТЫ
Ареал Hoploseius oblongus
На рис. 1 приведены все известные к настоящему времени места находок H. oblongus. В 62 из 74 локалитетов H. oblongus был обнаружен впервые. Данные о встречаемости H. oblongus в различных частях ареала приведены в табл. 2. Встречаемость H. oblongus в трутовиках F. pinicola на территории Западной Палеарктики оказалась повсеместно высокой. В различных подзонах равнинной тайги и в смешанных лесах Европы, как и в горных лесах Кавказа и Алтая, клещи были найдены в 90–100% плодовых тел F. pinicola. H. oblongus является узкоспециализированным видом, обитающим только в плодовых телах F. pinicola. Этот вывод следует из анализа многолетних сборов клещей в лесной подстилке тех же биотопов, где собирались плодовые тела трутовиков. В пробах почвы было найдено только 3 экз. H. oblongus (табл. 2).
Таблица 2.
Встречаемость клещей Hoploseius oblongus в почве и плодовых телах Fomitopsis pinicola в разных природных зонах Евразии
| Природная зона/ подзона/ландшафт |
Район сборов микроартропод (число биотопов) | Почва | Плодовые тела F. pinicola | ||
|---|---|---|---|---|---|
| число проб без H. oblongus | число проб с H. oblongus | число плодовых тел без H. oblongus | число (%) плодовых тел с H. oblongus | ||
| Северная тайга | Архангельская область, Пинежский заповедник (9) | 84 | 1 | 0 | 13 (100%) |
| Средняя тайга | Республика Коми, Печоро-Илычский заповедник (4) | 54 | 1 | 0 | 13 (100%) |
| Южная тайга | Тверская область, Центрально-Лесной заповедник (3) | 150 | 0 | 2 | 31 (94%) |
| Шаховской р-н, окрестности д. Бурцево (3) | 35 | 0 | 3 | 34 (92%) | |
| Смешанные хвойно-широколиственные леса | Московская область, Истринский р-н, окрестности д. Новораково (5) | 51 | 0 | 3 | 32 (91%) |
| г. Москва, парк Покровско-Стрешнево (2) | 49 | 1 | 18 | 184 (91%) | |
| Московская область, Подольский р-н, окрестности д. Поляны (4) | 65 | 0 | 3 | 30 (91%) | |
| Горные леса Кавказа | Северная Осетия, Северо-Осетинский заповедник и окрестности (3) | 30 | 0 | 0 | 5 (100%) |
| Горные леса Алтая | Различные районы Алтайского края и Республики Алтай (34) | 880 | 0 | 0 | 5 (100%) |
Примечание. Сборы микроартропод из образцов почвы и грибов и идентификация вида H. oblongus по морфологическим признакам проведены в период с 1972 по 2021 г. О. Макаровой при участии А. Александровой, М. Антиповой, А. Бабенко, М. Бизина, Н. Владимировой, И. Марченко, Д. Палатова, Л. Поспелова, М. Потапова, О. Розановой, Е. Слепцовой, О. Стариковой, А. Фомичева, С. Цурикова.
Численность H. oblongus на единицу площади гименофора гриба варьирует от одного до 2300 экз./дм2 и обычно составляет 50–400 экз./дм2. На 1 см2 гименофора F. pinicola размещаются от 550 до 600 трубочек. Следовательно, при максимальной установленной нами плотности клещей на одного клеща “приходится” 26 трубочек гименофора.
Кроме Hoploseius oblongus в плодовых телах F. pinicola были обнаружены другие виды гамазовых клещей. Наиболее часто, вместе с H. oblongus, встречаются: Ameroseius fungicolis Masan, 1998, Aceosejus muricatus Koch, 1839, Lasioseius ometes Oudemans, 1903, Zerconopsis remiger Kramer, 1876, Oodinychus ovalis C.L. Koch, 1839, Sejus togatus C.L. Koch, 1836 и клещи из рода Mycolaelaps.
ДНК-баркодирование выборки H. oblongus
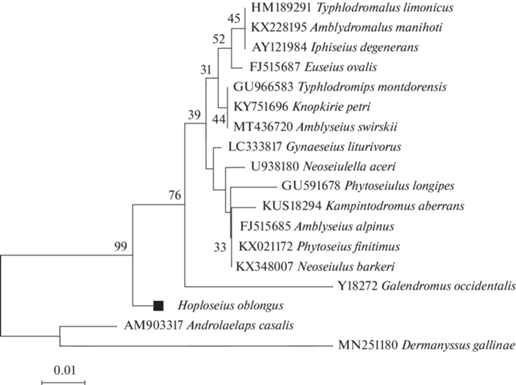
Результат ДНК-баркодирования выборки H. oblongus представлен в табл. 1. Всего мы проанализировали 28 образцов ДНК клещей и выявили 16 COI гаплотипов, различающихся точковыми однонуклеотидными замещениями. На рис. 2 представлен результат кластеризации полученных нами COI митохондриальных гаплотипов с наиболее сходными последовательностями, зарегистрированными в GenBank для других представителей Phytoseioidea (семейства Blattisociidae и Phytoseiidae). Семейство Blattisociidae, к которому принадлежит H. oblongus, представлено в GenBank тремя видами рода Lasioseius и 34 неидентифицированными точнее последовательностями, полученными в ходе сканирующего исследования фауны микроартропод национального парка “Ontario” в Канаде [30]. Все эти гаплотипы представлены на рис. 2. Обширное семейство Phytoseiidae также представлено на рис. 2 наиболее сходными с H. oblongus видами. Следует отметить, что изменчивость нуклеотидных последовательностей митохондриального гена COI в пределах этого семейства чрезвычайно велика и заслуживает специального обсуждения. Сравнение нуклеотидных последовательностей гена COI H. oblongus и Phytoseiulus persimilis (GenBank ID: MW074335), Phytoseiidae, показывает величину дивергенции 74.7%, что больше, чем величина дивергенции нуклеотидных последовательностей гена COI при сравнении H. oblongus и клещей Dermanyssus gallinae и Androlaelaps casalis, относящихся к неродственному надсемейству Dermanyssoidea.
Рис. 2.
NJ-дендрограмма BOLD-фрагментов COI гаплотипов H. oblongus и наиболее сходных по этому признаку представителей семейств Blattisociidae и Phytoseiidae. Последовательности H. oblongus обозначены именами гаплотипов, представленных в табл. 1. Нуклеотидные последовательности представителей семейств Blattisociidae (отмечены треугольником) и Phytoseiidae (отмечены кружком) приведены с номерами GenBank. В качестве внешней группы взяты нуклеотидные последовательности COI Dermanyssus gallinae и Androlaelaps casalis, относящихся к надсемейству Dermanyssoidea. Величины бутстреп-поддержки указаны рядом с узлами дендрограммы.

Нуклеотидная изменчивость между гаплотипами H. oblongus не превышает 1%. Средняя частота нуклеотидных замен при анализе всей выборки последовательностей H. oblongus равна 0.0046 замещений на сайт. Большинство нуклеотидных замещений молчащие. При сравнении продуктов концептуальной трансляции зарегистрированных гаплотипов H. oblongus длиной 203 аминокислоты обнаружено пять аминокислотных замещений у трех гаплотипов. Гаплотип Arkhangelsk_12 характеризуется заменой лейцина на фенилаланин в позиции 151 и лейцина на валин в позиции 177; гаплотип Tomsk_31 характеризуется заменой аланина на валин в позиции 155; и гаплотип Smolensk_22a характеризуется заменой аспарагина на серин в позиции 17 и аланина на треонин в позиции 173. Нормализованное отношение транзиций к трансверсиям (R) равно 5.31. Сравнительно высокая величина этого отношения указывает на наличие сильного стабилизирующего отбора на поддержание структуры гена COI.
Рассмотрение дендрограммы на рис. 2 выявляет некоторые необычные особенности кластеризации последовательностей COI семейств Blattisociidae и Phytoseiidae. Разделение семейств не поддержано. Представители обоих семейств образуют одну гетерогенную кладу с хорошей бутстреп-поддержкой. Генетические дистанции между кладами H. oblongus и Lasioseius neometes (обе из Blattisociidae) равно 23%. Такая же дистанция равная 23% разделяет клады H. oblongus и Amblyseius eharai из Phytoseiidae. Столь большая величина дистанции между двумя родами одного семейства (Hoploseius и Lasioseius) необычна. Вероятно, систематический ранг рода Hoploseius после изучения других представителей рода придется повысить до уровня трибы или выше.
Для характеристики изменчивости нуклеотидных последовательностей ядерного генома H. oblongus мы выбрали фрагмент ядерного рибосомного повтора, включающий фрагмент ITS1, ген 5.8S рРНК, ITS2, фрагмент гена 28S рРНК. Мы проанализировали те же образцы H. oblongus, которые ранее были взяты для определения митохондриального гаплотипа. Все образцы H. oblongus оказались мономорфны по этой последовательности, что подтверждает близкое родство всех популяций H. oblongus в Западной Евразии. Так как межвидовые сравнения последовательностей ITS у клещей показывало многочисленные случаи инсерций и делеций, затрудняющих сравнение, мы ограничились сравнением нуклеотидных последовательностей гена 5.8S рРНК, широко используемого в молекулярной систематике. Последовательности 5.8S рРНК известны у 71 вида клещей семейства Phytoseiidae, представляющих 15 родов. Виды каждого из родов семейства Phytoseiidae представлены на рис. 3. Представители семейства Blattisociidae ранее не были охарактеризованы по нуклеотидным последовательностям гена 5.8S рРНК. Полученные данные по изменчивости ядерного гена 5.8S рРНК согласуются с данными по изменчивости митохондриаьного гена COI, и также подтверждают своеобразие H. oblongus, соответствующее уровню подсемейства или семейства. Точнее определить таксономический статус H. oblongus в отряде Mesostigmata по молекулярным данным в настоящее время не представляется возможным.
Рис. 3.
NJ-дендрограмма 5.8S рРНК генов H. oblongus и наиболее сходных по этому признаку представителей семейства Phytoseiidae. Нуклеотидная последовательность 5.8S рРНК гена H. oblongus, полученная в настоящей работе, зарегистрирована в GenBank с номером (MZ686432). На дендрограмме она отмечена квадратом. Последовательности клещей, относящихся к семейству Phytoseiidae, приведены с номерами GenBank. В качестве внешней группы взяты последовательности генов 5.8S рРНК клещей Dermanyssus gallinae и Androlaelaps casalis, относящихся к надсемейству Dermanyssoidea. Величины бутстреп-поддержки указаны рядом с узлами дендрограммы.
Структура генетической изменчивости H. oblongus
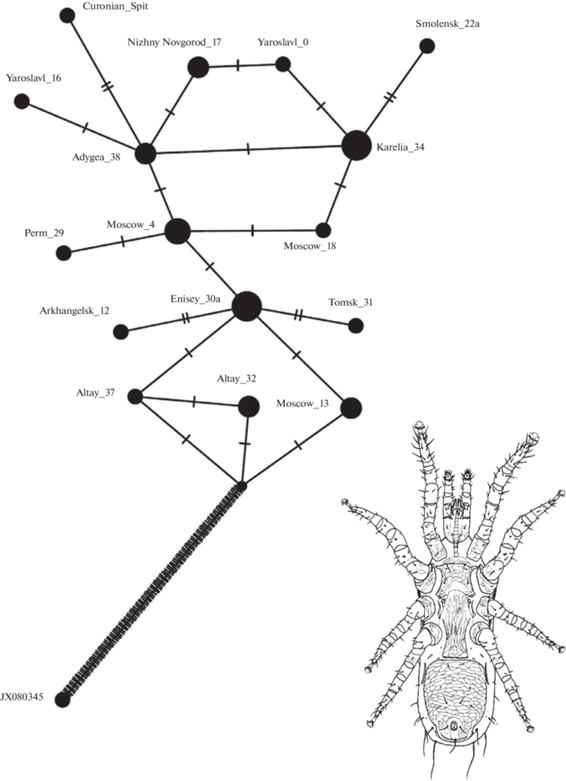
Для изучения генетической изменчивости H. oblongus по ареалу и получения информации об истории расселения вида мы построили медианную сеть митохондриальных гаплотипов. Дендрограммы не подходят для такого анализа, так как исходные допущения модели предполагают, что предковый гаплотип уже вымер, тогда как в случае недавних генетических процессов предковый гаплотип существует и часто является самым массовым. Полученный результат приведен на рис. 4. Популяция с H. oblongus слабо структурирована географически. Предковыми гаплотипами можно считать гаплотипы клещей Алтая, так как они меньше дивергировали от наиболее сходного с H. oblongus вида Amblyseius eharai. Максимальная дивергенция от предковой группы гаплотипов Алтая наблюдается у гаплотипов Smolensk_22a, Curanian_Spit, найденных на крайней западной границе изученной области ареала. Эти наблюдения позволяют предположить направление расширения ареала клещей с юго-востока на северо-запад.
Рис. 4.
Медианная сеть COI митохондриальных гаплотипов H. oblongus. Медианная сеть построена на основе 28 BOLD-фрагментов COI клещей H. oblongus длиной 611 пн. В качестве внешней группы выбран наиболее сходный с H. oblongus по нуклеотидной последовательности BOLD-фрагмента COI Amblyseius eharai (GenBank ID: JX080345). Гаплотипы соединены ломаными линиями. Нуклеотидные замены обозначены поперечными отрезками. Минимальное число нуклеотидных замещений, необходимое для преобразования одного гаплотипа в другой, обозначено числом отрезков на соединяющих гаплотипы линиях. Размер кругов пропорционален числу синонимичных последовательностей для данного гаплотипа. GenBank ID гаплотипов H. oblongus приведен в табл. 1. Рисунок взрослой самки клеща H. oblongus – внизу справа.
Насекомые-переносчики Hoploseius oblongus
Для идентификации насекомых-переносчиков H. oblongus, обеспечивающих его расселение между плодовыми телами F. pinicola, были сконструированы ловчие камеры, позволяющие отлавливать летающих насекомых, которые посещают плодовые тела трутовиков (см. МАТЕРИАЛЫ И МЕТОДЫ). Всего в период с 16 мая по 30 сентября 2021 г. в ловчих камерах было отловлено 919 особей насекомых, в основном из отрядов Diptera и Coleoptera. Прочие насекомые представлены единичными находками. Распределение пойманных насекомых и клещей по месяцам года представлено на рис. 5. С мая по июнь среди летающих насекомых, посещающих плодовые тела трутовика, преобладали жуки (преимущественно Staphylinidae), но они практически не переносили клещей (табл. 3). С июня и до сентября в сборах преобладали двукрылые. Всего было обнаружено 39 имаго насекомых, переносящих клещей (в том числе 38 – с клещами H. oblongus): 35 – представители Diptera (90%), 3– Hymenoptera (8%), 1 – Coleoptera (3%).
Рис. 5.
Динамика числа насекомых и клещей H. oblongus, отловленных на стенках ловчих камер с грибами Fomitopsis pinicola в сезон 2021 г. (Москва, р-н Сокол). Число имаго пойманных насекомых – потенциальных переносчиков H. oblongus обозначено столбиками диаграммы (левая вертикальная ось). Число пойманных клещей H. oblongus, форезирующих на насекомых, обозначено кружками, соединенными ломаной линией (правая вертикальная ось).
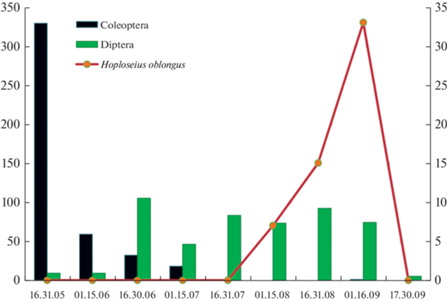
Таблица 3.
Насекомые-переносчики клещей Hoploseius oblongus, отловленные ловчими камерами с плодовыми телами трутового гриба Fomitopsis pinicola с мая по сентябрь 2021 г., и встречаемость на них клещей (Москва)
| Отряд | Семейство | Всего имаго, экз. | Число имаго с клещами | Число насекомых с разным количеством клещей | Доля (%) насекомых с форезирующими клещами | |||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |||||
| Diptera | Sciaridae | 175 | 20 (18♀, 2♂) | 11 | 4 | 3 | 2 | 11.4 |
| Cecidomyiidae | 147 | 7 (5♀, 2♂) | 6 | 1 | – | – | 4.8 | |
| Phoridae | 40 | 2 (1♀, 1♂) | 2 | – | – | – | 5.0 | |
| Scatopsidae | 42 | 2 (♀) | 2 | – | – | – | 4.8 | |
| Ceratopogonidae | 32 | 2 (1♀, 1♂) | 2 | – | – | – | 6.3 | |
| Coleoptera | Staphylinidae | 437 | 2 | – | 2 | – | – | 0.2 |
| Hymenoptera | Scelionidae, Encyrtidae | 27 | 3 (♀) | 3 | – | – | – | 11.1 |
Форезия H. oblongus наблюдалась с начала августа по конец сентября с четко выраженным пиком в первой половине сентября (рис. 5). Состав насекомых-переносчиков H. oblongus, определенных до семейства, представлен в табл. 3. Из полученных данных можно сделать вывод, что наиболее эффективно форезия H. oblongus осуществляется самками комариков из семейства детритниц (Sciaridae). Помимо переноса ими H. oblongus установлена форезия двух дейтонимф гамазового клеща Dendrolaelaps sp. (Digamasellidae) на самке Sciaridae (от 02.07.2021) и 18 самок клещей из семейства Scutacaridae, Trombidiformes, на другой самке Sciaridae (от 27.08.2021).
Среди 55 экз. H. oblongus, полученных с насекомых в ловчих камерах, 9 особей (16%) были самцами, остальные – самками. У каждой третьей самки в сперматеках были видны сперматодозы.
ОБСУЖДЕНИЕ
Ареал гамазового клеща H. oblongus оказался очень широким, а сам клещ – массовым видом, хотя описан он совсем недавно [11] и до сих пор был известен по единичным находкам в плодовых телах F. pinicola [1, 2, 11–15]. Гриб-трутовик F. pinicola распространен во всем Северном полушарии [16] и считается основным дереворазрушающим агентом в лесах Центральной Европы [19]. В настоящее время в Европе и Западной Сибири H. oblongus заселяет, по-видимому, почти 100% плодовых тел F. pinicola. Восточнее Енисея (Хабаровский край, Приморье) до сих пор нами были проанализированы только несколько (7) плодовых тел F. pinicola, в которых H. oblongus обнаружен не был. Таким образом, ареал H. oblongus может быть определен как западно-палеарктический температный, поскольку этот вид обнаружен в равнинных таежных и смешанных лесах, а также в различных (хвойных, смешанных и лиственных) горных лесах Европы, Сибири и Кавказа. Ареал гриба-хозяина F. pinicola значительно шире – он обычен в таежных лесах Голарктики, но отмечен также в Южной Америке, Африке, Центральной и Юго-Восточной Азии и Австралии, где указывался более чем на 100 видах деревьев [31, 32]. Заселяют ли клещи рода Hoploseius трутовик F. pinicola на других континентах в настоящее время неизвестно.
Род Hoploseius ранее не изучался с точки зрения генетической изменчивости. Мы впервые привели характеристику генетической изменчивости недавно открытого вида клещей H. oblongus, обитающего только в трубочках гименофора живых грибов F. pinicola. Крайне узкая специализация к пищевому субстрату и особенности популяционной структуры клеща, вероятно, во многом определили характер его генетической изменчивости. Несмотря на огромный ареал и регулярное половое размножение, вид мономорфен по структуре фрагмента ядерного рибосомного повтора и близок к мономорфизму по нуклеотидной последовательности BOLD-фрагмента митохондриального гена COI. Мы подтверждаем принадлежность H. oblongus к кладе, включающей семейства Blattisociidae или Phytoseiidae, но дальнейший выбор сделать невозможно, так как сами эти семейства подлежат генетико-систематической ревизии. Возможно, род Hoploseius принадлежит к особому семейству в отряде Mesostigmata. Изучение митохондриальной изменчивости H. oblongus по ареалу, в сочетании с известными историческими данными, позволяет сделать логичные предположения о расселении H. oblongus из ледникового рефугиума в районе современного Алтая. Наиболее сильно дивергировавшие от предполагаемого общего предка гаплотипы, характеризующиеся несинонимичными нуклеотидными заменами, найдены в крайне западных и северных из изученных выборок: на территории Смоленской и Архангельской областей.
H. oblongus – облигатный обитатель плодовых тел F. pinicola [1, 2, 11, 12, 14, 15], круглогодично заселяющий его живые плодовые тела, где клещ интенсивно размножается с середины мая до конца лета. При одновременных сборах почвенных и грибных клещей в целом ряде районов эти клещи были найдены почти исключительно в плодовых телах F. pinicola (табл. 2). Единичные находки H. oblongus в почве соответствующих лесных местообитаний, очевидно, связаны с падением дерева или с разрушением трутовиков.
Численность H. oblongus в гименофоре живых F. pinicola варьирует в очень широком диапазоне, но в свежих 2–3-летних плодовых телах она обычно высока (сотни экземпляров в одном грибе). Высокая плотность вида была отмечена также в Словакии [11] и Польше [2, 11, 12]. Рекордное в нашем материале значение плотности H. oblongus (2.3 тыс. экз./дм2) сходно со значениями, указанными для другого вида прода – Hoploseius tenuis – на полипоровых трутовиках в Мексике [33].
Наиболее частые виды гамазовых клещей, обитающих совместно с H. oblongus на трутовике окаймленном, – Aceosejus muricatus, Lasioseius ometes (Blattisociidae), Zerconopsis remiger (Ascidae), Oodinychus ovalis (Uropodidae) и Sejus togatus (Sejidae) – обитают как в различных грибах, так и в гниющей древесине; их нередко находят в лесной подстилке и растительных компостах [3, 4, 12, 34–36]. Совместное размножение в окаймленном трутовике H. oblongus c другими строгими микобионтами (Ameroseius fungicolis и Mycolaelaps sp.) наблюдается значительно реже [1].
Эффективность расселения H. oblongus, несомненно, обеспечена активной форезией самок на насекомых разных отрядов, в первую очередь – на представителях различных групп длинноусых двукрылых (табл. 3). Ранее для трех видов Hoploseius в качестве переносчиков указывались короткоусые двукрылые [22] и предполагалась специализированная форезия на Drosophilidae [20]. Самыми массовыми переносчиками H. oblongus в нашем материале были представители Sciaridae (51% всех переносчиков) и Cecidomyiidae (18%), целый ряд видов которых развивается в плодовых телах F. pinicola [37, 38]. Строгая связь всех выявленных переносчиков с трутовиком F. pinicola мало вероятна, хотя галлицу Camptomyia maxima Mamaev, 1961 до сих пор выводили только из его плодовых тел [38, 39]. Самый обычный на этих грибах в Фенноскандии вид детритниц – Lycoriella ingenua (Dufour) (=L. solani Winn.) [38, 40], вредящий культурам шампиньонов по всему миру, может развиваться в самых разных макро- и микромицетах, разлагающейся древесине, гниющих овощах и корнях живых растений [41, 42].
Наличие среди форезирующих самок оплодотворенных и неоплодотворенных особей после зимовки (а зимуют исключительно самки) гарантирует, вероятно, быстрый рост обоеполой популяции весной. Способ размножения этого вида не изучен, но для семейства Blattisociidae в целом характерна гапло-диплоидия (арренотокия) [43].
Пищевая специализация H. oblongus на одном виде трутовиков, F. pinicola, парадоксальна, так как род Fomitopsis включает около 40 видов, которые не имеют явных и известных особенностей, таких как видоспецифические токсины или пигменты, что позволяло бы объяснить узкую специализацию. Возможной ее причиной могут быть облигатно необходимые клещу макромолекулы именно данного вида гриба. Дальнейшее изучение данной симбиотической системы с привлечением данных полногеномного секвенирования может быть адекватно для разрешения этого вопроса.
Ареал клеща H. oblongus охватывает практически всю Европу и Западную Сибирь, где он обитает во всех подзонах тайги и широколиственных лесах, а также в горных лесах Кавказа и Алтая. Повсеместно вид строго связан с единственным видом трутовых грибов – F. pinicola, основным разрушителем мертвой древесины в Европе (среди трутовиков). На всей изученной области ареала H. oblongus наблюдается низкая изменчивость нуклеотидных последовательностей ядерного рибосомного повтора и митохондриальной ДНК. Генетическое единство популяции обеспечивается эффективными механизмами расселения клещей на имаго мелких длинноусых двукрылых из семейств детритниц и галлиц. Низкий уровень генетической изменчивости популяции клещей, вероятно, определяется эффектом основателя и сходством экологических условий внутри трубочек грибного гименофора по всему ареалу вида. Квазиоблигатный характер симбиоза H. oblongus и F. pinicola поднимает вопрос о возможной существенной роли клещей в поддержании жизнеспособности популяции трутовика, имеющего практическое значение.
Исследование выполнено при частичном финансировании РФФИ в рамках научного проекта № 19-34-90192 и всемерной поддержке дирекции ИПЭЭ РАН. Работа А.Г. Зуева поддержана РФФИ (проект № 20-34-90088).
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Все авторы статьи внесли равный вклад в исследование.
В течение многих лет мы получали дополнительный материал от наших коллег и друзей-натуралистов, среди которых А.И. Александрова, М.Д. Антипова, Д.И. Берман, М.С. Бизин, В.И. Булавинцев, Н.А. Булахова, Б.Д. Ефейкин, А.С. Голубцов, А.Р. Громов, Ю.Ю. Давыдова, А.А. Зайцев, Р.А. Захаров, Е.В. Захаров, В.А. Зрянин, А.Ю. Копцева, Д.И. Коробушкин, А.Б. Крашенинников, Е.Д. Лукашевич, А.А. Нехаева, Е.К. Макарова, К.В. Макаров, М.А. Машков, И.Ю. Машкова, Н.С. Морозов, А.А. Нехаева, С.В. Павлова, Д.М. Палатов, И.Н. Панов, М.Б. Потапов, И.Б. Рапопорт, О.Л. Розанова, Е.А. Сидорчук, Л.Л. Случевская, А.Н. Созонтов, Ю.Н. Сундуков, И.С. Турбанов, А.А. Фомичев, О.А. Хрулева, В.В. Худяков, С.М. Цуриков, Б.И. Шефтель. Определение двукрылых проведено или проверено Н.П. Кривошеиной, З.А. Федотовой, А.И. Зайцевым, А.Б. Крашенинниковым, Е.Д. Лукашевич, М.Б. Мостовским; перепончатокрылых – А.В. Тимоховым. Карта находок выполнена при основном участии К.В. Макарова, им же определены жуки. Многие полевые исследования проведены на территории ООПТ (в том числе в Пинежском, Печоро-Илычском, Кавказском, Северо-Осетинском и Центрально-лесном заповедниках) при деятельной помощи сотрудников заповедников. Консультации по работе с клеем “Полификс” нами получены от Р.А. Захарова. Всем перечисленным лицам и организациям приносим глубокую благодарность.
Список литературы
Макарова О.Л. Гамазовые клещи (Parasitiformes, Mesostigmata) – обитатели трутовых грибов Печоро-Илычского заповедника (Республика Коми) // Зоол. журн. 2004. Т. 83. № 11. С. 1335–1340.
Gdula A.K., Konwerski S., Olejniczak I. et al. The role of bracket fungi in creating alpha diversity of invertebrates in the Bialowieza National Park, Poland // Ecol. Evol. 2021. V. 11. P. 6456–6470. https://doi.org/10.1002/ece3.7495
Gwiazdowicz D.J. Ascid mites (Acari, Mesostigmata) from Selected Forest Ecosystems and Microhabitats in Poland. Poznań: Wydawnictwo Akademii Rolniczej, 2007. 248 p.
Gwiazdowicz D.J., Lakomy P. Mites (Acari, Gamasida) occurring in fruiting bodies of Aphyllophorales // Fragm. Fuan. 2002. V. 45. P. 81–89. https://doi.org/10.3161/00159301FF2002.45.1.081
Hagvar S., Amundsen T., Okland B. Mites of the genus Carabodes (Acari, Oribatida) in Norwegian coniferous forests: Occurrence in different soils, vegetation types and polypore hosts // Scandinavian J. Forest Research. 2014. V. 29. P. 629–638. https://doi.org/10.1080/02827581.2014.965195
Masan P., Joharchi O., Abramov V.V. A new genus and two new species of melicharid mites (Acari: Mesostigmata) associated with wood-decaying fungi and mycophagous erotylid beetles (Coleoptera: Erotylidae) in Europe // Zootaxa. 2021. V. 4980(1). P. 157–173. https://doi.org/10.11646/zootaxa.4980.1.10
Salmane I., Brumelis G. Species list and habitat preference of Mesostigmata mites (Acari, Parasitiformes) in Latvia // Acarologia. 2010. V. 50. P. 373–394. https://doi.org/10.1051/acarologia/20101978
De Moraes G.J., Britto E.P.J., Mineiro J.L.de C., Halliday B. Catalogue of the mite families Ascidae Voigts & Oudemans, Blattisociidae Garman and Melicharidae Hirschmann (Acari: Mesostigmata) // Zootaxa. 2016. V. 4112. P. 1–299. https://doi.org/10.11646/zootaxa.4112.1.1
Gwiazdowicz D.J. New species of Hoploseius Berlese, 1914 (Acari: Gamasida, Ascidae) from Poland // Acta Zool. Acad. Sci. Hung. 2002. V. 48(3). P. 219–224.
Plumari M. New records of Ascidae and Blattisociidae species from Italy (Acarina, Mesostigmata) // Atti Soc. it. Sci. nat. Museo civ. Stor. nat. Milano. 2009. V. 150. P. 77–90.
Masan P., Halliday B. A new species of Hoploseius (Acari: Blattisociidae) associated with the red-belted bracket fungus, Fomitopsis pinicola (Polyporaceae) in Slovakia // Systematic and Applied Acarology. 2016. V. 21. P. 1145–1156. https://doi.org/10.11158/saa.21.8.14
Gdula A.K., Skubała P., Zawieja B., Gwiazdowicz D.J. Mite communities (Acari: Mesostigmata, Oribatida) in the red belt conk, Fomitopsis pinicola (Polyporales), in Polish forests // Experimental and Applied Acarology. 2021. V. 84. P. 543–564. https://doi.org/10.1007/s10493-021-00635-1
Макарова О.Л. Фауна свободноживущих гамазовых клещей (Parasitiformes, Mesostigmata) северной тайги: анализ зональной специфики // Зоол. журн. 2009. Т. 88. № 9. С. 1039–1054.
Salmane I. Addition to the Latvian Mesostigmata (Acari, Parasitiformes) check-list // Latvijas Entomologs. 2005. V. 42. P. 72–76.
Salmane I. List of Mesostigmata mites (Acari, Parasitiformes) associated with Aphyllophorales fungi (Basidiomycetes) in Latvia // Latvijas Entomologs. 2005. V. 42. P. 45–57.
Hogberg N., Holdenrieder O., Stenlid J. Population structure of the wood decay fungus Fomitopsis pinicola // Heredity. 1999. V. 83. P. 354–360. https://doi.org/10.1038/sj.hdy.6885970
Hagvar S. How fast do the Tinder Polypore and the Red-banded Polypore grow? // Blyttia. 2008. V. 66. P. 225–230.
Lakomy P., Kwasna H. Atlas hub. MULTICO Oficyna Wydawnicza, Warszawa: Multico, 2008. 108 p.
Pentilla R., Siitonen J., Kuusinen M. Polypore diversity in managed and old-growth boreal Picea abies forests in southern Finland // Biol. Conserv. 2004. V. 117. P. 271–283. https://doi.org/10.1016/j.biocon.2003.12.007
Lindquist E.E. Remarkable convergence between two taxa of ascid mites (Acari: Mesostigmata) adapted to living in pore tubes of bracket fungi in North America, with description of Mycolaelaps new genus // Can. J. Zool. 1995. V. 73. P. 104–128. https://doi.org/10.1139/z95-013
Maraun M., Augustin D., Müller J. et al. Changes in the community composition and trophic structure of microarthropods in sporocarps of the wood decaying fungus Fomitopsis pinicola along an altitudinal gradient // Appl. Soil Ecol. 2014. V. 84. P. 16–23. https://doi.org/10.1016/j.apsoil.2014.06.004
Lindquist E.E. A taxonomic review of the genus Hoploseius Berlese (Acarina: Blattisocidae) // Can. Ent. 1963. V. 95. P. 1175–1185. https://doi.org/10.4039/Ent951175-11
Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. М.: Мир, 1984. 479 с.
Folmer O., Black M., Hoeh W. et al. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates // Mol. Mar. Biol. Biotechnol. 1994. V. 3. P. 294–297.
Untergasser A., Cutcutache I., Koressaar T. et al. Primer3 – new capabilities and interfaces // Nucl. Acids Res. 2012. V. 40. e115. https://doi.org/10.1093/nar/gks596
White T.J., Bruns T., Lee S. et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics // PCR Protocols, a Guide to Methods and Applications / Eds Innis M.A., Gelfand D.H., Sninsky J.J. et al. San Diego: Academic Press, 1990. P. 315–322. https://doi.org/10.1016/B978-0-12-372180-8.50042-1
Kumar S., Stecher G., Tamura K. MEGA7: Molecular Evolutionary Genetics Analysis Version 7.0 for Bigger Datasets // Mol. Biol. Evol. 2016. V. 33. P. 1870–1874. https://doi.org/10.1093/molbev/msw054
Leigh J.W., Bryant D., Nakagawa S. PopArt: full-feature software for haplotype network construction // Methods Ecol. Evol. 2015. V. 6. P. 1110–1116. https://doi.org/10.1111/2041-210x.12410
Clement M., Posada D., Crandall K.A. TCS: a computer program to estimate gene genealogies // Mol. Ecology. 2000. V. 9. P. 1657–1659. https://doi.org/10.1046/j.1365-294x.2000.01020.x
Young M.R., Proctor H.C., deWaard J.R., Hebert P.D.N. DNA barcodes expose unexpected diversity in Canadian mites // Mol. Ecology. 2019. V. 28(24). P. 5347–5395. https://doi.org/10.1111/mec.15292
Perrin P.W. First draft of a monographic card for Fomitopsis pinicola (Fr.) Karst, Document, Intern. Research Group on Wood Preservation, Working Group I, Biological Problems (IRG/WP/196). Vancouver: Western forest products lab., 1979. P. 8.
Hagvar S. Saproxylic beetles visiting living sporocarps of Fomitopsis pinicola and Fomes fomentarius // Norwegian J. Entomol. 1999. V. 46. P. 25–32.
Lindquist E.E. An unusual new species of Hoploseius Berlese (Acarina, Blattisociidae) from Mexico // Can. Ent. 1965. V. 97(11). P. 1121–1131. https://doi.org/10.4039/ENT971121-11
Брегетова Н.Г., Вайнштейн Б.А., Кадите Б.А. и др. Определитель обитающих в почве клещей Mesostigmata / Под ред. Гилярова М.С. Л.: Наука, 1977. 718 с.
Karg W. Acari (Acarina), Miben Parasitiformes (Anactinochaeta), Cohors Gamasina Leach. Raubmilben. Die Tierwelt Deutschlands, 59 Teil. Jena; Stuttgart; N.Y.: Gustaw Fischer Verlag, 1993. 524 p.
Masan P., Walter D.E. Description of the male of Hoploseius mariae (Acari, Mesostigmata), an European ascid mite associated with wood-destroying fungi, with key to Hoploseius species // Biologia Bratislava. 2004. V. 59. P. 527–532.
Яковлев Е.Б. Двукрылые Палеарктики, связанные с грибами и миксомицетами. Петрозаводск: Карельский научный центр РАН, 1994. 128 с.
Okland B., Hagvar S. The insect fauna associated with carpophores of the fungus Fomitopsis pinicola (Fr.) Karts. in a southern Norwegian spruce forest // Fauna Norvegica, Serie B. 1994. V. 41. P. 29–42.
Мамаев Б.M. Галлицы СССР. Сообщение 1. Новые виды рода Camptomyia Kieffer (Itonididae, Diptera) // Зоол. журн. 1961. Т. 40. № 11. С. 1677–1690.
Komonen A. Distribution and abundance of frugivorous insects in the fruiting bodies of Fomitopsis pinicola // Ann. Zool. Fennici. 2003. V. 40. P. 495–504.
Кривошеина Н.П., Зайцев А.И., Яковлев Е.Б. Насекомые – разрушители грибов в лесах Европейской части СССР. М.: Наука, 1986. 310 с.
Babytskiy A.I., Moroz M.S., Kalashnyk S.O. et al. New findings of pest sciarid species (Diptera, Sciaridae) in Ukraine, with the first record of Bradysia difformis // Biosyst. Divers. 2019. V. 27. P. 131–141. https://doi.org/10.15421/011918
Walter D.E., Lindquist E.E. The distributions of parthenogenetic ascid mites (Acari: Parasitiformes) do not support the biotic uncertainty hypothesis // Exp. Appl. Acarol. 1995. V. 19. P. 423–442. https://doi.org/10.1007/bf00048262
Дополнительные материалы отсутствуют.