Генетика, 2022, T. 58, № 9, стр. 1056-1067
О генетической структуре популяций Harmonia axyridis (Coleoptera, Coccinellidae) в нативном и инвазивном ареалах – взгляд с позиций молекулярной генетики
И. И. Горячева 1, 2, *, Д. М. Щепетов 3, 4, А. В. Блехман 3, И. А. Захаров 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Московский государственный областной университет
141014 Мытищи, Московская область, Россия
3 Институт биологии развития им. Н.К. Кольцова Российской академии наук
119334 Москва, Россия
4 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: iigoryacheva@mail.ru
Поступила в редакцию 31.01.2022
После доработки 21.03.2022
Принята к публикации 12.04.2022
- EDN: GMGDFP
- DOI: 10.31857/S0016675822090090
Аннотация
Harmonia axyridis Pallas (1773) (Coleoptera: Coccinellidae) – один из наиболее изученных инвазивных видов насекомых. H. axyridis появилась в Европе в 2000 г., и с этого момента продолжается экспансия вида на восток в направлении нативного ареала. Для определения популяций – источников формирования восточного фронта инвазии мы исследовали изменчивость и генетическую структуру инвазивных и нативных популяций вида с помощью 12 микросателлитных маркеров. Мы обнаружили, что в инвазивных популяциях по сравнению с нативными популяциями не произошло снижения средней ожидаемой гетерозиготности, однако наблюдается достоверное снижение аллельного разнообразия. Показано, что аллельное разнообразие в инвазивных популяциях зависит от их “возраста”. Мы обнаружили, что уровень дифференциации инвазивных популяций существенно выше, чем в группе нативных популяций. Кластерный анализ показал, что европейские инвазивные популяции H. axyridis делятся на две группы, что свидетельствует об их происхождении в результате нескольких миграционных волн. Наш анализ не показал достоверных различий между группами нативных популяций, что, вероятнее всего, является следствием гомоплазии микросателлитных маркеров, возникшей в ходе эволюции вида. Наши результаты позволяют предположить, что восточный фронт инвазии формируется потомками североитальянского отростка WNA.
Harmonia axyridis – один из наиболее изученных инвазивных видов насекомых. Эта крупная хищная кокцинеллида в границах своего нативного ареала встречается на обширной территории. В России H. axyridis обитает в Сибири, в Амурской области, Хабаровском крае, Приморье, на Сахалине и на Курильских островах [1–3]. Вид широко распространен в Северо-Восточном и Центральном Китае, Японии и Корее [1, 4]. H. axyridis встречается также в северо-восточном Казахстане [5], в северной части Монголии [1], на острове Тайвань [6] и в Северном Вьетнаме [7]. Западная граница ареала совпадает со средним течением р. Иртыш в Западной Сибири, а восточная – с побережьем Тихого океана, включая Сахалин и Южные Курилы. На севере ареал вида достигает 57°–58° с.ш., вероятно следуя границам зоны вечной мерзлоты. На юго-западе граница ареала охватывает лесостепную зону Северо-Восточного Казахстана, затем проходит через верховья р. Иртыш в Северо-Западной Монголии и поворачивает на юг, огибая пустынные и полупустынные районы Монголии и Северо-Западного Китая, а также Тибетское нагорье, достигая провинции Сычуань [8–10].
Глобальная инвазия H. axyridis началась с образования в 90-х годах на североамериканском континенте двух плацдармных инвазивных популяций, получивших названия восточного и западного плацдармов (WNA и ENA соответственно), из которых произошло расселение этого вида по территории Северной и Южной Америки, в Европу, Африку и Австралию [11, 12]. В Европе первые сообщения о дикой инвазивной популяции поступили из Германии из Франкфурта-на-Майне в 2000 г. [13]. В период с 2002 по 2006 г. H. axyridis распространялась с нарастающей скоростью, показав средний темп прироста 189% (5000 км2) в год с 10 000 км2 в 2002 г. до 31 000 км2 в 2006 г. [14]. К 2006 г. вид был обнаружен в Германии, Франции, Великобритании, Польше, Чешской Республике, Австрии и Швейцарии. К 2015 г. H. axyridis достигла долготы 37°36′ в центре европейской части России (Москва) и 45°03′ в Краснодарском крае [15]. К настоящему времени вид заселил Кавказ и расселяется по Поволжью, где обнаруживается в районе г. Тольятти на долготе 49°45′ [16]. Таким образом, в Европе (на Евразийском континенте) за 20 лет с момента первого сообщения о находке во Франкфурте H. axyridis преодолела расстояние около 3000 км на восток.
Исследование генетической структуры нативных популяций вида по комплексу морфологических признаков показало, что восточная и западная группы популяций различаются на уровне подвидов, при незначительной межпопуляционной изменчивости внутри каждой из них [17, 18]. Анализ полиморфизма митохондриальных молекулярно-генетических маркеров (фрагментов генов cox1, atp6 и D-петли) полностью подтвердил высокий уровень различий между восточными и западными популяциями при минимальной изменчивости внутри групп [19–21].
По данным микросателлитного анализа, нативные популяции также характеризовались значительным уровнем полиморфизма [11, 22] и незначительной генетической дифференциацией внутри западного и восточного кластеров популяций.
Исследования полиморфизма митохондриальных маркеров в инвазивных популяциях Европы показали, что по изменчивости фрагментов гена atp6 и контрольного региона европейские популяции от Атлантического побережья до Черноморского побережья Кавказа имеют однородную генетическую структуру [22]. Вариабельность гена cox1 мтДНК в инвазивных европейских популяциях также значительно снижена по сравнению с нативными популяциями, а генетические расстояния между европейскими популяциями минимальны и недостоверны [21]. Американские инвазивные популяции по изменчивости cox1 еще более однородны [23]. Анализ изменчивости микросателлитов также показал уменьшение уровня гетерозиготности и аллельного разнообразия в инвазивных популяциях [22, 24, 25].
Анализ изменчивости микросателлитов позволил сформулировать гипотезу о происхождении европейских инвазивных популяций. По данным Ломбера с соавт. [24], появление вида в западной части Европы (Бельгия, Франция, Голландия) стало следствием интродукции из восточного североамериканского плацдарма (ENA). Эти вселенцы, по всей видимости, смешались с жуками европейской биоконтрольной линии [11]. Западный североамериканский плацдарм (WNA) был в свою очередь источником по крайней мере двух независимых интродукций в Европе. Одна из этих интродукций привела к появлению H. axyridis в Северной Италии, тогда как вторая интродукция, вероятно, оказалась результатом смешения вселенцев из WNA с ранее образовавшейся инвазивной популяцией восточной и северной частей Западной Европы (Германия, Польша, Чешская Республика, Венгрия, Дания и Норвегия) [24].
Европейский инвазивный ареал H. axyridis продолжает активно расширяться на восток. Самой восточной точкой инвазивного ареала H. axyridis, в которой были проведены сборы в 2008 г., был венгерский город Батасек (18°41′) [24]. К 2020 г. размножающиеся колонии и скопления зимующих насекомых наблюдались на европейской территории России в городах Ряжск – 40°06′, Урюпинск – 42°00′, Нальчик – 43°37′, Махачкала – 47°30′ (личные наблюдения). Крайней восточной находкой вида оказывается географическая точка с координатами 58°13′ с.ш. 52°67′ в.д. вблизи города Глазов в Удмуртии [25]. Таким образом за 12 лет H. axyridis продвинулась на восток максимально на 2378 км по прямой. Несмотря на продолжающееся расширение инвазивного ареала, после работ Ломбера с соавт. [11, 22, 24], основанных на сборах из отдельных европейских популяций, сделанных в 2006–2009 гг., генетическая структура европейских инвазивных популяций не исследовалась. Наша работа предпринята с целью восполнить существующий пробел. Поскольку возраст инвазивной популяции имеет существенное значение для максимально точного выявления источников ее формирования, большинство анализируемых нами сборов максимально приближены к моменту вселения H. axyridis в соответствующий регион. Кроме того, динамика микроэволюционных процессов в популяциях на фронте инвазивного ареала вызывает особый интерес, поскольку именно в них изменения генетической структуры происходят наиболее быстро как за счет усиления давления естественного отбора в новых для вида местах обитания, так и за счет стохастических процессов.
Низкий уровень изменчивости митохондриальных маркеров, выявленный в инвазивных популяциях, очевидно ограничивает их использование для исследования генетической структуры молодых популяций. Поэтому в настоящей работе мы попытались оценить источники, из которых формировался восточный фронт инвазии, используя данные об изменчивости микросателлитных локусов.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор образцов
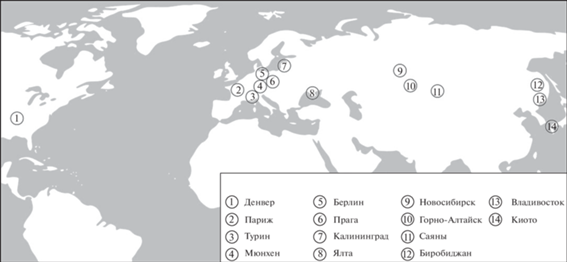
Материалом для данной работы послужили образцы H. axyridis, собранные из восьми природных популяций инвазивного ареала и из шести популяций, представляющих западную и восточную группы популяций нативного ареала. Места сбора образцов показаны на карте (рис. 1). Сборы в Турине и Калининграде сделаны в год и на следующий год соответственно после появления H. axyridis в этих регионах. Сборы в Денвере и Мюнхене были сделаны раньше, а в Париже и Праге позже, чем сборы из соответствующих регионов, проанализированные в работах Ломбера с соавт. [11, 22, 24]. Пойманных жуков замораживали и хранили при температуре –20°С до выделения ДНК. Подробные данные о коллекторах, местах и датах сбора, количестве выделенных и проанализированных образцов ДНК, а также местах их хранения представлены в табл. 1.
Таблица 1.
Характеристика сборов
| Статус популяций | Место сбора | Идентификатор популяции | Географические координаты места сбора | Дата сбора | Число проанализиро-ванных образцов (место хранения образцов ДНК) | |
|---|---|---|---|---|---|---|
| Инвазивные | Денвер | Den | 39°44′20′′ с.ш. 104°59′04′′ з.д. | Сентябрь 2004 | 32 (1) | |
| Мюнхен | Mu | 48°08′14′′ с.ш. | Октябрь 2006 | 11 (1) | ||
| 11°34′31′′ в.д. | ||||||
| Берлин | Ber | 52°31′27′′ с.ш. | Июль 2008 | 21 (1) | ||
| 13°24′37′′ в.д. | ||||||
| Париж | Par | 48°51′12′′ с.ш. | Июнь 2012 | 8 (1) | ||
| 2°20′55′′ в.д. | ||||||
| Турин | Tur | 45°04′13′′ с.ш. | Октябрь 2006 | 23 (2) | ||
| 7°41′12′′ в.д. | ||||||
| Прага | Prg | 50°05′16′′ с.ш. | Ноябрь 2011 | 24 (1) | ||
| 14°25′14′′ в.д. | ||||||
| Калининград | Kg | 54°42′23′′ с.ш. | Август 2010 | 24 (1) | ||
| 20°30′39′′ в.д. | ||||||
| Ялта | Ya | 43°35′57′′ с.ш. | Май 2013 | 25 (2) | ||
| 39°43′32′′ в.д. | ||||||
| Нативные | западная группа | Новосибирск | Nov | 55°02′29′′ с.ш. | Сентябрь 2006 | 32 (2) |
| 82°56′04′′ в.д. | ||||||
| Горно-Алтайск | GA | 51°57′38′′ с.ш. | Сентябрь 2005 | 8 (1) | ||
| 85°55′08′′ в.д. | ||||||
| Саяны | Sai | 53°42′56′′ с.ш. 91°25′45′′ в.д. | Октябрь 2011 | 32 (2) | ||
| восточная группа | Биробиджан | Bir | 48°47′34′′ с.ш. | Осень 2009 | 24 (2) | |
| 132°55′25′′ в.д. | ||||||
| Владивосток | Vl | 43°06′20′′ с.ш. | Осень 2009 | 32 (2) | ||
| 131°52′24′′ в.д. | ||||||
| Киото | Ki | 35°01′15′′ с.ш. | Май 2010 | 14 (1) | ||
| 135°45′13′′ в.д. | ||||||
Выделение ДНК
ДНК выделяли из брюшка жука методом фенол-хлороформной экстракции [26]. Концентрацию ДНК в полученных образцах измеряли с помощью NanoDrop8000 (Thermoscientific).
ПЦР и STR-анализ
Для выявления полиморфизма 12 STR-локусов, указанных в табл. 2, были использованы пары праймеров в соответствии с Луазо с соавт. [27].
Таблица 2.
Локусы, праймеры и мультилокусные панели
| Локус | Праймеры | Мультилокусная панель и краситель (цифра – номер панели) |
|---|---|---|
| H244 | F: TGACGGACGCACGAAGAT R: ACAGCTGACCATAGAGGATCG |
1 – FAM |
| H215 | F: CGAATCAATAACCCTAGGCG R: AGCGATCTCCTGTTCTACGG |
1 – R6G |
| H605 | F: TCCGACGCACAGATAACAGA R: GTTACGTTGACCCGTCGC |
1 – TAMRA |
| H234 | F: GCTAAAACCAACGTCAGG R: CTCGCGCGATTATTGGAC |
2 – FAM |
| H194b | F: ACCAGATTGCTGCTTGGATT R: ACAAATTGGGCGTGAGAAAC |
2 – R6G |
| H253 | F: GATACATCGTCCTTTCAGTCCTC R: CCTGCAAACTCTTCCAGACC |
2 – TAMRA |
| H267 | F: AACCTGTAATTCGATTGTGGAAC R: CCGACCTGACCTTTCGTC |
3 – FAM |
| H223 | F: TCGTTTAACCGTGATAGGAGAG R: ACGAATTCCGAAAGATGAGG |
3 – R6G |
| H105 | F: CGCCTAACAAATAGGCATCAC R: AGGGTGGAGAATGGAATAACC |
3 – TAMRA |
| H201 | F: CTTCGCCATCATCCACTAGG R: GTGCGGTCATTAATTCAGGC |
4 – FAM |
| H627 | F: CGTAACTTTAACGATCACTCAGC R: GAACATTGTCTTCGCGTGG |
4 – R6G |
| H094 | F: TTAGTCGGCGGGTCCATC R: GGGCCGATAAGTCAAACGAG |
5 – FAM |
Реакция амплификации проводилась в конечном объеме 25 мкл на термоциклере AB Veriti 96 well TC (Applied Biosystems, США) при следующих условиях: начальная денатурация – 4 мин при 95°С; далее пять циклов с использованием функции автодельта: денатурация – 40 с при 95°С, отжиг – 60 с с повышением температуры от 46 до 48°С на 0.5°С в каждом цикле, начиная со второго, полимеризация – 50 с при 70°С; затем следовали 35 циклов: денатурация – 40 с при 95°С, отжиг – от 60 с с понижением времени на 1 с за каждый цикл, начиная со второго, при 48°С и полимеризация – 60 с при 70°С.
Полученные продукты смешивали, как описано в табл. 2, длину фрагментов оценивали методом капиллярного гель-электрофореза на Applied Biosystems Genetic Analyzer 3500 (Thermo Fisher Scientific Inc., Waltham, MA, США) в ЦКП ИБР РАН. Полученные данные обрабатывали с помощью программы Gene-Marker [28]. Всего было генотипировано 310 особей из 14 выборок по 12 микросателлитным локусам.
Анализ генетической структуры популяций и межпопуляционных дистанций
Среднюю гетерозиготность (He) [29], выровненность (evenesse) [30–32], число аллелей и генетические расстояния (Gst sensu Nei) [29] определяли с помощью пакета poppr для R. Для проверки значимости различий Gst, Evenesse и средней ожидаемой гетерозиготности (He) между выделенными группами популяций использовали T-тест. Кластеризация образцов в предполагаемые популяции с помощью байесовского алгоритма поиска mcmc для найденных кластеров была выполнена с помощью пакета Geneland [33] для R (R Core Team 2017). Анализ был выполнен в пяти независимых итерациях 1 000 000 MCMC (thinning 100, отжиг 20%) поколений в рамках пространственной модели и модели коррелированных частот каждая. Все прогоны сходились с наибольшей апостериорной плотностью для четырех предполагаемых кластеров. Для дополнительной оптимизации отнесения отдельных особей к найденным кластерам был выполнен набор из 10 прогонов с фиксированным K = 4 по моделям и параметрам, предустановленным разработчиком. Прогон с наибольшим средним логарифмом апостериорной вероятности использовался для всего дальнейшего анализа.
РЕЗУЛЬТАТЫ
Мультилокусные генотипы были получены для всех образцов. Параметры полиморфизма использованных нами локусов указаны в табл. 3. Все локусы оказались полиморфными с 3–16 (в среднем 9.08) аллелями на локус. Средняя ожидаемая гетерозиготность и равномерность 0.63 и 0.71 соответственно указывают на то, что набор маркеров достаточно информативен для нашего набора образцов.
Таблица 3.
Полиморфизм микросателлитных локусов
| Показатель | H244 | H215 | H605 | H234 | H253 | H194b | H267 | H233 | H105 | H094 | H267 | H201 | Среднее |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Число аллелей | 16 | 10 | 16 | 13 | 7 | 4 | 8 | 7 | 6 | 3 | 10 | 9 | 9.08 |
| Средняя ожидаемая гетерозиготность (He) | 0.86 | 0.8 | 0.75 | 0.84 | 0.27 | 0.56 | 0.76 | 0.41 | 0.61 | 0.1 | 0.84 | 0.81 | 0.63 |
| Равномерность (evenesse) | 0.79 | 0.82 | 0.54 | 0.83 | 0.43 | 0.83 | 0.74 | 0.57 | 0.83 | 0.42 | 0.85 | 0.84 | 0.71 |
Внутрипопуляционная изменчивость
Показатели внутрипопуляционной изменчивости представлены в табл. 4.
Таблица 4.
Генетическая изменчивость популяций по12 микросателлитным локусам
| Популяции | Число образцов | He | Среднее число аллелей на локус |
|---|---|---|---|
| Восточная группа нативных популяций | |||
| Киото | 14 | 0.625 | 5.00 |
| Владивосток | 32 | 0.591 | 6.25 |
| Биробиджан | 24 | 0.556 | 5.17 |
| Киото + Владивосток + Биробиджан | 70 | 0.598 | 7.42 |
| Западная группа нативных популяций | |||
| Саяны | 32 | 0.569 | 5.17 |
| Горно-Алтайск | 8 | 0.591 | 3.92 |
| Новосибирск | 32 | 0.565 | 5.83 |
| Саяны + Горно-Алтайск + Новосибирск | 72 | 0.573 | 6.67 |
| Всего для нативных популяций | 142 | 0.582 | 8.17 |
| Инвазивные популяции | |||
| Денвер | 32 | 0.631 | 5.08 |
| Берлин | 21 | 0.585 | 4.75 |
| Мюнхен | 11 | 0.610 | 4.67 |
| Париж | 8 | 0.609 | 3.83 |
| Турин | 23 | 0.425 | 3.25 |
| Прага | 24 | 0.461 | 3.25 |
| Калининград | 24 | 0.525 | 3.92 |
| Ялта | 25 | 0.523 | 4.08 |
| Всего для инвазивных популяций | 168 | 0.627 | 6.50 |
| Всего | 310 | 0.634 | 9.08 |
Среднее число аллелей на локус в нативных популяциях составило 8.17, в том числе 6.67 для западной популяционной группы и 7.42 для восточной популяционной группы. В инвазивном ареале среднее число аллелей на локус составило 6.50. В европейских популяциях оно колебалось от 3.25 до 4.75 аллелей на локус, а в американской популяции Денвера составило 5.08.
Средняя ожидаемая гетерозиготность (He) в совокупности популяций нативного ареала составила 0.582, в том числе 0.573 для западной группы популяций и 0.598 для восточной группы. Средняя ожидаемая гетерозиготность (He) в инвазивных популяциях заметно варьирует. В центральной части Западной Европы (Берлин–Мюнхен–Париж) He не опускается ниже 0.585 (Берлин), тогда как в популяциях юга и востока Западной Европы (Турин–Прага–Калининград–Ялта) не превышает 0.525 (Калиниград). Средняя ожидаемая гетерозиготность (He) в популяции Денвера является максимальной для инвазивных популяций и составляет 0.631. He в совокупности инвазивных популяций составила 0.627.
Межпопуляционная изменчивость
Попарное сравнение популяций нативного ареала показало их слабую генетическую дифференциацию, несмотря на значительные географические расстояния (до более 4000 км) и географические барьеры между точками сбора образцов. Попарные оценки Gst варьировали от –0.0031 до 0.0081 между популяциями западной группы и от 0.0056 до 0.0316 между популяциями восточной группы (рис. 2).
Рис. 2.
Межпопуляционная генетическая дифференциация: матрица парных значений Gst. Цвет представляет приблизительное значение Gst как показано на шкале справа, точные значения для пар приведены в виде цифр. Популяции обозначены в соответствии с идентификатором популяций из табл. 1.

Среднее значение Gst при попарных сравнениях нативных популяций составило 0.013. Среднее значение Gst при попарных сравнениях популяций западной и восточной групп составило 0.0032. Среднее значение Gst для популяций восточной группы составило 0.0026, для популяций западной группы – 0.0039. Эти различия недостоверны (t = 2.02, d.f. = 2.67, p-value = 0.1473).
Межпопуляционная дифференциация инвазивных популяций оказалась существенно выше, чем межпопуляционная дифференциация нативных популяций (рис. 2). Среднее значение Gst при попарных сравнениях всех инвазивных популяций между собой составило 0.0890. В группе инвазивных популяций значительные различия наблюдаются при сравнении популяций центральной части Западной Европы (Берлин, Мюнхен, Париж) с популяциями южной (Турин) и восточной части Западной Европы (Прага, Калининград, Ялта). Gst не превышает значения 0.0576 при попарном сравнении популяций Берлина, Мюнхена и Парижа и не опускается ниже значения 0.1107 при попарном сравнении любой из этих популяций с популяциями Праги, Калининграда, Ялты и Турина. В последней группе (Прага, Калининград, Ялта и Турин) Gst варьирует от 0.0014 до 0.0467, при этом самые высокие значения Gst (0.0299–0.0467) получены при попарном сравнении с популяцией Праги. Попарные сравнения американской популяции Денвера с популяциями Центральной Европы (Париж, Берлин, Мюнхен) показывают их высокое сходство (Gst от –0.0020 до 0.0146). Напротив, уровень генетической дифференциации между популяцией Денвера и популяциями Восточной Европы оказывается существенно выше: Gst варьирует от 0.1182 до 0.1565.
Различие средних значений Gst для групп нативных и инвазивных популяций высоко достоверно: t = –6.5211, d.f. = 30.251, p-value = 3.155e-07 (0.0000003155). Среднее число аллелей на локус в совокупностях нативных и инвазивных популяций (табл. 4) также различается достоверно (t = = 2.7641, d.f. = 9.8753, p-value = 0.02021). Однако мы не обнаружили достоверных различий в значениях He между нативными и инвазивными группами популяций (t = 0.88138, d.f. = 8.8394, p‑value = 0.4014) (табл. 4).
Кластерный анализ индивидуальных образцов выявил четыре предполагаемых кластера (рис. 3), три из которых хорошо соотносятся с точками сборов (или географическими популяциями). Первый кластер, обозначенный зеленым цветом, включает большинство образцов из нативного ареала (за исключением одного образца из Владивостока). Второй (синий) и третий (фиолетовый) кластеры образованы образцами из инвазивных популяций и разделяют их на две группы А и Б, которые соответствуют двум центрам расселения (propagules) в Европе. Образцы четвертого кластера, обозначенного розовым цветом, присутствуют в популяциях как нативного, так и инвазивного ареала.
Рис. 3.
Генетическая кластеризация образцов H. axyridis. Цвет указывает на вероятность принадлежности особи к четырем предполагаемым кластерам. Первый ряд – образцы из восточной группы нативных популяций: Владивосток, Киото, Биробиджан; второй ряд – образцы из западной группы нативных популяций: Горно-Алтайск, Саяны, Новосибирск; третий ряд – образцы из инвазивных популяций Денвера, Берлина, Мюнхена и Парижа (группа А); четвертый ряд – образцы из инвазивных популяций Турина, Праги, Калининграда и Ялты (группа Б). Популяции обозначены в соответствии с идентификатором популяций из табл. 1.
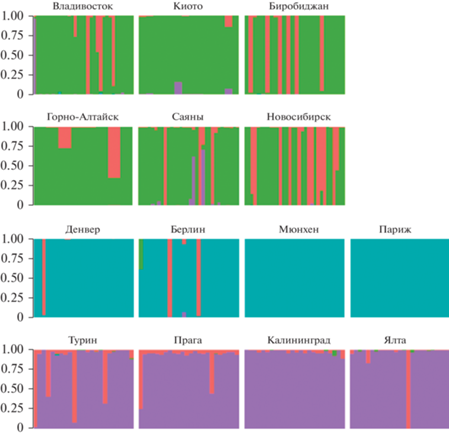
Различия инвазивных популяционных групп А и Б по значениям Gst (0.0205 и 0.0299 соответственно) (t = –0.86, d.f. = 9.78, p-value = 0.4086) и He (0.609 и 0.505 соответственно) (t = 2.5092, d.f. = = 3.3249, p-value = 0.0787) оказываются недостоверными. Однако эти кластеры достоверно различаются по среднему числу аллелей на локус – 4.58 и 3.62 соответственно (t = 2.7788, d.f. = 5.7857, p-value = = 0.0333).
ОБСУЖДЕНИЕ
Для более точной оценки микроэволюционных процессов, происходящих в популяциях во время расширения инвазивного ареала, мы изучили внутри- и межпопуляционную изменчивость микросателлитов у H. axyridis. Для анализа мы использовали сборы насекомых, приближенные к моменту появления вида в той или иной части европейского инвазивного ареала, а также сборы из разных частей нативного ареала. На основании проведенного анализа мы попытались определить источники, из которых формировался современный восточный фронт инвазии.
Наши результаты, представленные в табл. 4, показывают незначительное снижение аллельного разнообразия в инвазивных популяциях по сравнению с нативными популяциями. В то же время среди инвазивных популяций более низкое аллельное разнообразие выявлено в тех популяциях, из которых мы собрали образцы вскоре после появления H. axyridis в соответствующем регионе (Турин, Калининград, Ялта). Вероятнее всего снижение аллельного разнообразия в самых молодых инвазивных популяциях (т.е. недавно появившихся на новой территории) является следствием эффекта основателя.
Среди инвазивных популяций наибольшее среднее число аллелей на локус было обнаружено в популяции Денвера, расположенного в штате Колорадо, в предполагаемой зоне контакта двух североамериканских плацдармов – восточного (ENA) (1988) и западного (WNA) (1991) [24]. Высокие значения аллельного разнообразия также были обнаружены в популяциях Берлина и Мюнхена. В обоих случаях сборы проанализированных нами жуков были сделаны через пять или более лет после появления H. axyridis в соответствующих регионах – штате Колорадо [34] и Германии. Повышенное аллельное разнообразие в этих популяциях очевидно может быть следствием процессов смешивания инвазивных популяций в результате миграций, а также, возможно, повторных интродукций. В отличие от аллельного разнообразия средняя ожидаемая гетерозиготность в инвазивных популяциях снижается незначительно. Более того, в популяциях Берлина, Мюнхена и Парижа, наиболее близких к североевропейскому ядру инвазии, наблюдается тенденция к увеличению гетерозиготности. Наши результаты хорошо согласуются с известным теоретическим предположением о том, что аллельное разнообразие более чувствительно к бутылочному горлышку и его потеря оказывается несколько выше, чем потеря гетерозиготности [35, 36]. Изучение молекулярно-генетической внутрипопуляционной изменчивости около 70 интродуцированных видов из разных таксономических групп показало, что гетерозиготность их инвазивных популяций в большинстве случаев снижается по сравнению с исходными популяциями на 18.7%. Однако есть виды, у которых стохастическая потеря изменчивости из-за эффекта основателя компенсируется многократной реинтродукцией [36]. Очевидно, что H. axyridis относится к таким видам, так же как Coccinella septempunctata, для которой было показано, что значительный уровень изменчивости митохондриального гена COI в инвазивных популяциях является результатом многократных интродукций [37].
Результаты попарного сравнения популяций по коэффициенту дифференциации Gst, представленные на рис. 2, и кластерного анализа, представленного на рис. 3, показывают, что изученные инвазивные популяции дифференцируются на два кластера. Первый кластер – северный – включает популяции Берлина, Мюнхена и Парижа, а также популяцию Денвера; второй кластер –юго-восточный – включает популяции Турина, Праги, Калининграда и Ялты. Выявленная нами кластеризация подтверждает выводы Ломбера с соавт. о происхождении европейских инвазивных популяций H. axyridis в результате нескольких миграционных волн [24]. Состав юго-восточного кластера позволяет предположить, что популяции Калининграда и Ялты были сформированы потомками мигрантов южно-европейского ядра, источником которого был североитальянский отросток WNA. Поскольку популяции Калининграда и Ялты являются самыми восточными из изученных инвазивных популяций, можно предположить, что именно эта группа движется в настоящее время на восток, формируя восточный фронт инвазии.
У нас нет достаточных данных, чтобы сделать однозначный вывод о причинах объединения популяции Денвера в один кластер с популяциями Северной Европы. На наш взгляд сходство этих популяций может быть объяснено событиями смешивания, произошедшими как во время формирования популяции Денвера (между мигрантами двух американских плацдармов), так и во время формирования популяций в Северной Европе в результате неоднократных интродукций [11, 19, 24].
Данные о современной внутривидовой структуре H. axyridis, полученные ранее на основе исследования комплекса морфологических и митохондриальных признаков, показали, что западная и восточная группы нативных популяций, сформировавшиеся под влиянием глобальных климатических изменений плейстоцена и начала голоцена, различаются на уровне подвидов [17, 18, 21]. Однако полученные нами результаты анализа изменчивости микросателлитных маркеров свидетельствуют о том, что все нативные популяции образуют единый кластер. Мы можем объяснить выявленное нами отсутствие различий между западной и восточной группами нативных популяций явлением гомоплазии микросателлитных маркеров. Теоретические основы возникновения и эволюционных последствий гомоплазии были подробно рассмотрены ранее [38]. Во время Сартанского оледенения (последнего в плейстоцене), которое датируется периодом в 35–10 тыс. лет назад с максимумом похолодания в 20–18 тыс. лет назад [39–41], видовой ареал H. axyridis распадался на два длительно изолированных рефугиума (восточный и западный), из которых с наступлением потепления происходило расширение видового ареала вплоть до восстановления его целостности в голоцене [9, 18]. По всей видимости, за время изоляции в эволюционном прошлом вида в рефугиумах накопилось достаточное для возникновения гомоплазии количество ступенчатых мутаций в использованных нами микросателлитных локусах, что и отразилось в объединении образцов нативных популяций в единый кластер. В то же время по данным Ломбера с соавт. [11, 22, 24] нативные популяции делятся на два кластера, соответствующих восточной и западной группам. По всей видимости, причиной расхождений наших результатов стали разные модели, использованные в кластерном анализе. Ломбером была использована модель смешивания с коррелированными частотами аллелей и местом отбора проб в качестве предварительной информации [42]. Мы провели наше исследование, используя пространственную модель, в которой место сбора не учитывалось в качестве приоритетной информации, так как ранее было показано, что анализ на основе местоположения может приводить к смещению распределения образцов по кластерам [43].
В целом, основываясь на наших результатах, можно сказать, что европейским группам инвазивных популяций удалось сохранить достаточно высокий уровень внутрипопуляционной генетической изменчивости, что в соответствии с генетической теорией естественного отбора [44], может определять высокую жизнеспособность H. axyridis в новых местообитаниях.
Обсуждая дальнейшее развитие инвазии H. axyridis на Евразийском континенте, следует отметить, что с момента своего появления в Северной Италии в 2006 г. вид к 2021 г. продвинулся на восток на более чем 3300 км. До западной границы нативного ареала H. axyridis [10] осталось преодолеть чуть более 1000 км. В связи с этим возникает очень интересный вопрос о возможности смыкания инвазивного и нативного ареалов. Если это произойдет, то будущая контактная зона окажется исключительно привлекательным объектом для различных микроэволюционных исследований.
Авторы выражают благодарность Е.Я. Фрис-ману и В.П. Кораблеву за предоставленные выборки H. axyridis из Биробиджана и Владивостока.
Работа выполнена при финансовой поддержке проекта РНФ 16-16-00079_П.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Dobrzansky Th. Die geographisce und individuelle variabilitat won Harmonia axyridis // Biol. Zbl. 1924. V. 44. № 6. P. 401–421.
Кузнецов В.Н. Жуки-кокцинеллиды (Coleoptera, Coccinellidae) Дальнего Востока России. Ч. 1–2. Владивосток: Дальнаука, 1993. 334 с.
Кузнецов В.Н., Семьянов В.П. Эколого-фаунистический обзор кокцинеллид (Coleoptera, Coccinellidae) острова Сахалин // Систематика и эколого-фаунистический обзор отдельных отрядов насекомых Дальнего Востока. Владивосток, ДВНЦ АН СССР, 1983. С. 3–15.
Komai T. Genetics of ladybeetles // Adv. Genet. 1956. V. 8. P. 155–188.
Савойская Г.И. Определитель кокцинеллид Казахстана (Col., Coccinellidae) // Тр. Казах. НИИ защиты растений. Алма-Ата. 1972. Т. II. С. 45–73.
Кузнецов В.Н., Прощалыкин М.Ю. К фауне жуков-кокцинеллид (Coleoptera, Coccinellidae) Курильских островов // Евразиатский энтомол. журн. 2006. Т. 5. № 4. С. 264–270.
Orlova-Bienkowskaja M.J., Ukrainsky A.S., Brown P.M. Harmonia axyridis (Coleoptera: Coccinellidae) in Asia: A re-examination of the native range and invasion to southeastern Kazakhstan and Kyrgyzstan // Biol. Invasions. 2015. V. 17. P. 1941–1948.
Воронцов Н.Н., Блехман А.В. Ареал и внутривидовая структура божьей коровки Harmonia axyridis Pall., 1773 (Coleoptera, Coccinellidae) // Эволюция, экология, биоразнообразие: Материалы конф. памяти Н.Н. Воронцова (1934–2000). М., 26–27 декабря 2000 г. М.: Издат. отдел УНЦДО, 2001. С. 150–156.
Блехман А.В. Внутрипопуляционная и географическая изменчивость широкоареального вида Harmonia axyridis Pallas по комплексу полиморфных признаков: Автореф. дис. … канд. биол. наук. М.: Ин-т биологии развития РАН, 2009. 24 с.
Блехман А.В., Горячева И.И. Нативный ареал и биологические особенности инвазивной божьей коровки Harmonia axyridis // Успехи соврем. биологии. 2016. Т. 136. С. 461–471.
Lombaert E., Guillemaud T., Cornuet J.-M. et al. Bridgehead effect in the worldwide invasion of the biocontrol harlequin ladybird // PLoS One. 2010. V. 5. Iss. 3. e9743. https://doi.org/10.1371/journal.pone.0009743
Camacho-Cervantes M., Ortega-Iturriaga A., Del-Val E. From effective biocontrol agent to successful invader: The harlequin ladybird (Harmonia axyridis) as an example of good ideas that could go wrong // Peer J. 2017. Iss. 5. e3296. https://doi.org/10.7717/peerj.3296
Klausnitzer B. Harmonia axyridis (Pallas, 1773) in Germany (Col., Coccinellidae) // Entomol. Nachr. Ber. 2002. V. 46. P. 177–183.
Roy H.E., Brown P.M.J., Adriaens T. et al. The harlequin ladybird, Harmonia axyridis: global perspectives on invasion history and ecology // Biol. Invasions. 2016. V. 18. P. 997–1044. https://doi.org/10.1007/s10530-016-1077-6
Орлова-Беньковская М.Я. Массовое размножение божьей коровки Harmonia axyridis (Pallas, 1773) (Coleoptera, Coccinellidae) на Кавказе и возможные источники инвазии // Рос. журн. биологических инвазий. 2014. № 3. С. 73–81.
Ruchin A.B., Egorov L.V., Lobachev E.A. et al. Expansion of Harmonia axyridis (Pallas, 1773) (Coleoptera: Coccinellidae) to European part of Russia in 2018–2020 // Baltic J. Coleopterology. 2020. V. 20. Iss. 1. P. 51–60.
Блехман А.В., Горячева И.И., Захаров И.А. Внутривидовая дифференциация Harmonia axyridis Pall. по комплексу морфологических полиморфных признаков и изменчивости митохондриального гена coi // Вестн. Моск. ун-та. Биология. 2010. Т. 65. № 4. С. 50–53.
Блехман А.В. Современная структура широкоареального вида божьих коровок Harmonia axyridis (Coleoptera, Coccinellidae) и возможные причины ее формирования // Зоол. журн. 2014. Т. 93. № 7. С. 857–867.
Андрианов Б.В., Горячева И.И., Романов Д.А., Захаров И.А. Особенности митохондриальной изменчивости нативных и инвазивных популяций Harmonia axyridis (Coleoptera, Coccinellidae) // Генетика. 2018. Т. 54. № 11. С. 1309–1315. https://doi.org/10.1134/S0016675818110024
Андрианов Б.В., Романов Д.А., Горелова Т.В., Горячева И.И. Полиморфизм контрольного региона митохондриальной ДНК нативных и инвазивных популяций Harmonia axyridis (Coleoptera, Coccinellidae) // Генетика. 2019. Т. 55. № 7. С. 819–825. https://doi.org/10.1134/S0016675819070038
Blekhman A., Goryacheva I., Schepetov D., Zakharov I. Variability of the mitochondrial CO1 gene in native and invasive populations of Harmonia axyridis Pall. comparative analysis // PLoS One. 2020. V. 15. Iss. 4. P. 1–19. https://doi.org/10.1371/journal.pone.0231009
Lombaert E., Guillemaud T., Thomas C.E. et al. Inferring the origin of populations introduced from a genetically structured native range by approximate Bayesian computation : case study of the invasive ladybird Harmonia axyridis // Mol. Ecol. 2011. V. 20. P. 4654–4670. https://doi.org/10.1111/j.1365-294X.2011.05322.x
Greenstone M., Vandenberg N., Hu J. Barcode haplotype variation in north American agroecosystem lady beetles (Coleoptera: Coccinellidae) // Mol. Ecol. Resour. 2011. V. 11. Iss. 4. P. 629–637. https://doi.org/10.1111/j.1755-0998.2011.03007.x
Lombaert E., Guillemaud T., Lundgren J.R. et al. Complementarity of statistical treatments to reconstruct worldwide routes of invasion: the case of the Asian ladybird Harmonia axyridis // Mol. Ecol. 2014. V. 23. P. 5979–5997. https://doi.org/10.1111/mec.12989
Zakharov I., Ruchin A., Egorov E. et al. Invasion of the Asian ladybird Harmonia axyridis (Pallas, 1773) in the European part of Russia // Front. Conserv. Sci. 2021. V. 2:739313. https://doi.org/10.3389/fcosc.2021.739313
Sambrook J.F., Russell D.W. Molecular Cloning: A Laboratory Manual / Ed. Russell D.W. Cold Spring Harbor Lab. Press, 2001. 2100 p.
Loiseau A., Malausa T., Lombaert E. et al. Isolation and characterization of microsatellites in the harlequin ladybird, Harmonia axyridis (Coleoptera, Coccinellidae), and cross-species amplification within the family Coccinellidae // Mol. Ecol. Resour. 2009. V. 9. P. 934–937.https://doi.org/10.1111/j.1755-0998.2009.02517.x
HulceD., Li X., Snyder-Leiby T., Liu C.S.J. Gene-Marker® genotyping software: Tools to increase the statisti-cal power of DNA fragment analysis // J. Biomol. Tech. 2011. V. 22. S35.
Nei M. Analysis of gene diversity in subdivided populations // PNAS. 1973. V. 70. Iss. 12. P. 3321–3323. https://doi.org/10.1073/pnas.70.12.3321
Pielou E. Ecological Diversity. N.Y.: Wiley, 1975. 165 p.
Ludwig J., Reynolds J. Statistical Ecology: A Primer on Methods and Computing. N.Y.: Wiley-Inte, 1988. 337 p.
Grünwald N.J., Goodwin S.B., Milgroom M.G., Fry W.E. Analysis of genotypic diversity data for populations of microorganisms // Phytopathology. 2003. V. 93. Iss. 6. P. 738–746.https://doi.org/10.1094/PHYTO.2003.93.6.738
Guillot G. Inference of structure in subdivided populations at low levels of genetic differentiation – The correlated allele frequencies model revisited // Bioinformatics. 2008. V. 24. Iss. 19. P. 2222–2228. https://doi.org/10.1093/bioinformatics/btn419
Koch R.L., Venette R.C., Hutchison W.D. Invasions by Harmonia axyridis (Pallas) (Coleoptera: Coccinellidae) in the Western Hemisphere: Implications for South America // Neotrop. Entomol. 2006. V. 35. Iss. 4. P. 421–434. https://doi.org/10.1590/S1519-566X2006000400001
Nei M. Molecular Population Genetics and Evolution. Amsterdam: Amer. Els. Publ. Co., 1975. 275 p.
Dlugosch K.M., Parker I.M. Founding events in species invasions: genetic variation, adaptive evolution, and role of multiple introductions // Mol. Ecol. 2008. V. 17. P. 431–449.https://doi.org/10.1111/j.1365-294X.2007.03538.x
Kajita Y., O’Neill E., Zheng Y. et al. A population genetic signature of human releases in an invasive ladybeetle // Mol. Ecol. 2012. V. 21. P. 5473–5483. https://doi.org/10.1111/mec.12059
Estoup A., Jarne P., Cornuet J.M. Homoplasy and mutation model at microsatellite loci and their consequences for population genetics analysis // Mol. Ecol. 2002. V. 11. P. 1591–1604. https://doi.org/10.1046/j.1365-294x.2002.01576.x
Величко А.А. Общие особенности изменений ландшафтов и климата Северной Евразии в кайнозое // Изменение климата и ландшафтов за последние 65 миллионов лет (кайнозой: от палеоцена до голоцена). М.: ГЕОС, 1999. С. 219–233.
Еникеев Ф.И. Плейстоценовые оледенения восточного Забайкалья и юго-востока средней Сибири // Геоморфология. 2009. № 2. С. 33–49.
Волкова В.С., Михайлова И.В. Природная обстановка и климат в эпоху последнего (Сартанского) оледенения Западной Сибири (по пралинологическим данным) // Геология и геофизика. 2001. Т. 42. С. 678–689.
Hubisz M.J., Falush D., Stephens M., Pritchard J.K. Inferring weak population structure with the assistance of sample group information // Mol. Ecol. Resour. 2009. V. 9. P. 1322–1332. https://doi.org/10.1111/j.1755-0998.2009.02591.x/full
Wang J. The computer program Structure for assigning individuals to populations: easy to use but easier to misuse // Mol. Ecol. Resour. 2017. V. 17. P. 981–990. https://doi.org/10.1111/1755-0998.12650
Fisher R.A. The Genetical Theory of Natural Selection. Oxford: Clarendon Press, 1930. 272 p.
Дополнительные материалы отсутствуют.