Генетика, 2022, T. 58, № 9, стр. 1074-1084
Индивидуальные вариации длины теломер у здоровых индивидов: эффект полиморфного варианта гена TERT и урбанизации
А. В. Казанцева 1, 2, 3, *, Ю. Д. Давыдова 1, 2, Р. Ф. Еникеева 1, 2, Р. Н. Мустафин 4, М. М. Лобаскова 5, С. Б. Малых 5, 6, Э. К. Хуснутдинова 1, 2, 6
1 Институт биохимии и генетики – обособленное структурное подразделение
Уфимского федерального исследовательского центра Российской академии наук
450054 Уфа, Россия
2 Башкирский государственный университет
450076 Уфа, Россия
3 Уфимский государственный нефтяной технический университет
450064 Уфа, Россия
4 Башкирский государственный медицинский университет
450008 Уфа, Россия
5 Психологический институт Российской академии образования
125009 Москва, Россия
6 Московский государственный университет им. M.В. Ломоносова
119991 Москва, Россия
* E-mail: Kazantsa@mail.ru
Поступила в редакцию 11.01.2022
После доработки 17.03.2022
Принята к публикации 04.04.2022
- EDN: IYWSXZ
- DOI: 10.31857/S0016675822090107
Аннотация
Изменение длины теломерных повторов вследствие так называемой “проблемы концевой недорепликации” в существующей литературе связывают с развитием депрессивных расстройств. Однако использование длины теломерных повторов в качестве биомаркера депрессивности является неоднозначным, что связано с влиянием различных средовых факторов как на психоэмоциональное состояние, так и на изменение длины теломер. С целью выявления возможности использования относительной длины теломерных повторов (ОДТП) в лейкоцитах периферической крови в качестве биомаркера повышенной депрессивности до клинических форм расстройства, а также для определения зависимости между длиной теломер, социально-демографическими факторами, генетическими вариантами генов, регулирующих процессы элонгации теломерных концов, и уровнем депрессивности был проведен анализ ассоциаций локусов генов обратной транскриптазы (TERT rs7726159), теломеразного РНК-компонента (TERC rs1317082) и белка CST-комплекса (OBFC1 rs2487999) с ОДТП и уровнем депрессивности у здоровых индивидов (N = 1065) без психических нарушений в возрасте 18–25 лет. Наряду с генетическими вариантами анализируемые регрессионные модели включали различные социально-демографические параметры в качестве предикторов. В результате статистической обработки результатов было показано отсутствие связи ОДТП с индивидуальными вариациями в уровне депрессивности в изученной выборке. Тем не менее множественный регрессионный анализ позволил сконструировать статистически значимую модель межиндивидуальных вариаций ОДТП (P = = 4.3е–4; r2 = 0.018), которая включала полиморфный вариант rs7726159 гена TERT (P = 0.020; β = = 0.078), возраст (P = 0.001; β = –0.027) и место воспитания индивида (городская/сельская местность) (P = 0.048; β = 0.063). Полученные данные подтверждают вовлеченность варианта гена TERT и возраста в регуляцию длины теломер в выборке здоровых индивидов 18–25 лет, а также указывают на негативный эффект проживания в условиях урбанизации на укорочение длины теломер, что отражает уровень клеточного старения организма.
Теломеры (теломерные повторы) представляют собой гетерохроматиновые структуры, расположенные на концах хромосом, необходимые для поддержания их целостности и стабильности [1]. Известно, что теломеры состоят из тандемных повторов 5'-TTAGGG-3' протяженностью 10–15 тпн у человека, которые неизбежно сокращаются со скоростью от 50 до 200 пн в ходе каждого цикла репликации вследствие так называемой “проблемы концевой недорепликации”, а также действия специфических нуклеаз [2]. Тем не менее эта проблема решается в клетках с помощью компенсирующего действия теломеразы – рибонуклеиновой обратной транскриптазы. В состав теломеразы входят два основных компонента – обратная транскриптаза (кодируется геном TERT, 5p15.33) и теломеразный РНК-компонент (кодируется геном TERC, 3q26.2), содержащий матричный участок для синтеза теломерных повторов [3]. В здоровом организме человека теломераза обладает высокой активностью в зародышевых и стволовых клетках и проявляет умеренную активность в лейкоцитах [3]. С другой стороны, длина теломерных повторов регулируется действием шелтериновых и CST-комплексов [4]. CST-комплекс у высших эукариот состоит из белков Stn1 (кодируется геном OBFC1), Ten1 и CTC1 и участвует в ингибировании теломераз-зависимого удлинения теломерных повторов [4].
Близнецовые исследования указывают на наследуемость длины теломер ∼36%, в то время как средовые влияния определяют ∼49% изменений в их длине в ходе онтогенеза [5]. К настоящему времени проведены полногеномные анализы ассоциаций (GWAS), идентифицировавшие полиморфные локусы в генах TERC, TERT и OBFC1, ассоциация которых с длиной теломер была реплицирована [6, 7]. Функциональная значимость была показана для локусов TERT rs7726159, TERC rs1317082, OBFC1 rs2487999, ассоциированных с длиной теломер [7].
Изменение длины теломерных повторов, измеряемой в абсолютных или относительных единицах, в существующей литературе связывают с развитием онкологических заболеваний [7], сердечно-сосудистой патологии [8], а также ряда психических расстройств, включая посттравматическое стрессовое расстройство [3], депрессию [9], болезнь Альцгеймера [10]. Предполагается, что один из возможных молекулярных механизмов, лежащих в основе развития психических расстройств, связан с влиянием более короткой длины теломер на функционирование иммунных клеток в нервной системе или в системном кровотоке, что усиливает воспалительные процессы в ЦНС [10].
Согласно литературным данным, определение относительной длины теломер в легкодоступных образцах, таких как периферическая кровь, может давать надежные данные для установления относительной длины теломер в других тканях, включая нейрональные [11]. Возможность использования относительной длины теломерных повторов (ОДТП) в лейкоцитах периферической крови в качестве биомаркера депрессивных расстройств является неоднозначной: некоторые исследования сообщают об укорочении теломер у пациентов с депрессией по сравнению с контрольной группой [1, 9], в то время как в других работах подобной связи не наблюдалось [12].
Наряду с традиционным подходом использование биоинформатических пайплайнов для оценки длины теломер по данным полногеномного секвенирования (TelSeq) позволило выявить, что укорочение теломер при депрессивных расстройствах связано с наличием неблагоприятных условий среды [1]. Известно, что неблагоприятные стрессовые воздействия в раннем возрасте оказывают плейотропный поведенческий, физиологический и эпигенетический эффект на различные системы организма [13] вследствие изменения ответа гипоталамо-гипофизарно-надпочечниковой (ГГН) системы на стресс, что в дальнейшем может приводить к нарушению психического здоровья [14, 15]. Среди средовых факторов, влияющих на длину теломерных повторов, сообщается о возраст-зависимом снижении ОДТП [8], особенностях детско-родительских отношений [16], неблагоприятных травмирующих событиях в детстве [15], стрессовых воздействиях [17] и влиянии окружающей обстановки [18] и уровня доходов семьи [19]. Стоит отметить, что мужчины по сравнению с женщинами и индивиды европейского происхождения по сравнению с лицами других рас характеризуются более короткой длиной теломер [19]. Накопление активных форм кислорода и свободных радикалов в клетках, зависящее от возраста и связанное с действием стрессовых факторов, воспалительных реакций и неправильного образа жизни (табакокурения, избыточного приема алкоголя, низкой физической активности) приводит к укорочению теломер [2, 18]. Учитывая возможный эффект вышеуказанных средовых факторов на психоэмоциональное состояние [20, 21] и клеточное старение организма, изучение большого массива социально-демографических характеристик в контексте влияния на длину теломер представляется актуальным.
Таким образом, в настоящей работе было предположено, что относительная длина теломерных повторов может выступать в качестве биомаркера, отражающего действие негативных средовых факторов на предыдущих этапах онтогенеза человека и/или индивидуальную стрессовую чувствительность, которые, в свою очередь, могут определять манифестацию депрессивности. Альтернативная гипотеза состояла в том, что длина теломер зависит от индивидуальной стрессовой чувствительности и психоэмоционального состояния наряду с определенными средовыми факторами и генетическими вариантами, ассоциированными с работой теломеразы и CST-комплекса.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 1065 здоровых индивидов без нарушений психоэмоциональной сферы (79% женщин) – студенты ВУЗов Республики Башкортостан и Удмуртской Республики (ср. возраст 20.99 ± 3.32 лет), из них русских – 357, татар – 340, удмуртов – 234, индивидов смешанной этнической принадлежности – 134. Включенные в исследование индивиды не состояли на учете у психиатра и нарколога и не имели отягощенной наследственности по психическим заболеваниям. Участники исследования прошли психологическое тестирование для оценки уровня депрессивности с помощью валидированной для российской популяции методики – шкале депрессии Бека (Beck Depression Inventory, BDI). Все испытуемые также были проанкетированы для получения информации об этнической принадлежности до трех поколений, особенностях воспитания и детско-родительских отношений: эпизодах плохого обращения в детстве, воспитания в полной/неполной семье, материальном положении семьи, возрасте матери при рождении ребенка, месте воспитания – городская/сельская местность, числе детей в семье, возрасте матери ребенка и весе ребенка при рождении (вес менее 2500 г считался низким). Место воспитания (городская/сельская местность) определялось на основании численности населенного пункта: к сельской местности были отнесены демографические единицы численностью менее 50 000 человек [21]. На основании опроса была сформирована база данных, содержащая информацию о порядке рождения и количестве детей в семье, стиле родительского воспитания (согласно опроснику Parental Bonding Inventory), а также о воспитании в билингвальной семье для лиц татарской и удмуртской этнических принадлежностей. От всех участников было получено добровольное согласие на участие в исследовании. Данное исследование было одобрено биоэтическим комитетом ИБГ УФИЦ РАН.
Сбор биологического материала (периферической крови) осуществлялся в 2017–2019 гг. с последующим выделением ДНК методом фенольно-хлороформной экстракции. Генотипирование полиморфных вариантов генов TERT rs7726159, TERC rs1317082, OBFC1 rs2487999 проводили с помощью технологии конкурентной аллель-специфичной ПЦР (KАSPTM, LGC Genomics, UK) на амплификаторе “CFX96” (BioRad, США) с проведением анализа флуоресценции по конечной точке. Результаты оценки распределения частот аллелей и генотипов изученных полиморфных локусов соответствовали распределению Харди–Вайнберга: P = = 0.84 для rs7726159 (TERT), Р = 0.63 для rs1317082 (TERC), Р = 0.56 для rs2487999 (OBFC1). Для оценки относительной длины теломерных повторов ДНК анализируемых образцов была выравнена до концентрации 20 нг/мкл для дальнейшего анализа согласно работе [22]. Детекция синтезируемого продукта проводилась при помощи интеркалирующего флуоресцентного красителя IQ SYBR Green Supermix (BioRad). Для проведения ПЦР в режиме реального времени (“CFX96”, BioRad) использовались пары праймеров для амплификации теломерных повторов (T) и однокопийного гена бета-глобина (HGB), выбранного в качестве консервативного гена (S) [23]. При проведении ПЦР в реальном времени оценивался пороговый цикл (Ct) при амплификации фрагмента консервативного гена (S) и фрагмента ДНК, включающего теломерные повторы. Поскольку каждый образец (и экспериментальный, и стандартный) ставился в трех технических повторах, для дальнейшего анализа вычислялось среднее значение порогового цикла для каждого образца. В случае различий в численном выражении значения Ct между повторами более чем на 30% образец исключался. В качестве контрольного образца использовалась смесь ДНК нескольких индивидов (пул ДНК), идентичная в каждом запуске реакции. Воспроизводимость результатов составила более 98%.
Для определения относительного числа теломерных повторов использовалась широко применяемая методика [22], основанная на формуле 2–ΔΔCt. С этой целью вычислялись разница пороговых циклов для теломерного и контрольного ПЦР и относительное количество теломерных повторов в геноме (T/S) по формуле T/S = 2–ΔΔCt, где ΔΔCt = (CtT(образца) – CtT(пулаДНК)) – (CtS(образца) – CtS(пулаДНК)). По данным литературы относительное количество теломерных повторов в геноме (T/S) пропорционально 2–ΔΔCt и длине теломер в анализируемом образце.
Для изучения связи между длиной теломерных повторов и фенотипическими вариациями уровня депрессивности был проведен корреляционный анализ с использованием коэффициента корреляции Спирмена и множественный линейный регрессионный анализ (RStudio v4.1.2). В качестве зависимой переменной были использованы показатель депрессивности (в баллах) или длина теломерных повторов, а в качестве независимой переменной – ОДТП (или уровень депрессивности соответственно) наряду с полиморфными локусами в генах TERT, TERC, OBFC1 и средовыми факторами. С целью выявления модели с наибольшей предиктивной значимостью был использован алгоритм поочередного исключения независимых переменных из модели, включающей все независимые предикторы (backward elimination) до достижения наилучших показателей процента вариации (r2), уровня значимости (p-value) и критерия Акаике. Уровень статистической значимости принимался равным P = 0.05.
РЕЗУЛЬТАТЫ
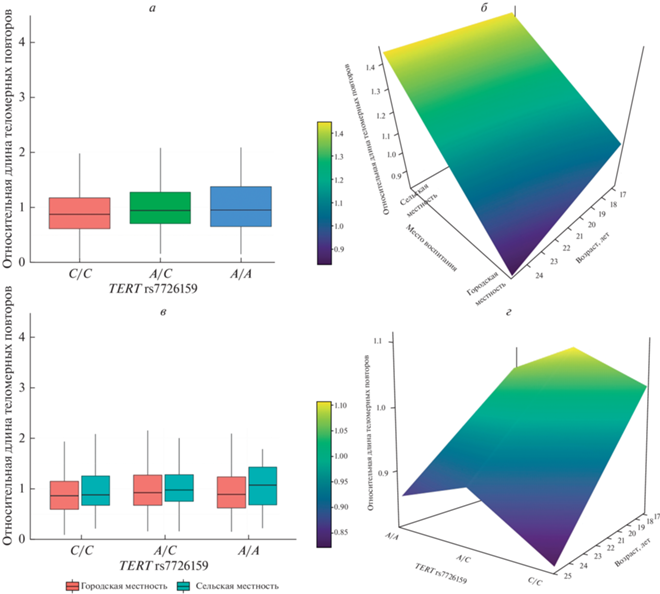
В рамках настоящего исследования был проведен корреляционный и линейный регрессионный анализ между уровнем депрессивности и относительной длиной теломерных повторов в лейкоцитах периферической крови у индивидов 18–25 лет, в результате которого было установлено отсутствие корреляции (P = 0.465; r = –0.023) и ассоциации (Р = 0.155; β = –0.003) между этими переменными. Поскольку литературные данные указывают на возможные различия в ОДТП в зависимости от половой и этнической принадлежности, нами была проведена оценка различий в относительной длине теломерных повторов между группами. Статистически значимых различий в показателях ОДТП не было выявлено между мужчинами и женщинами (Р = 0.137), между индивидами русской и татарской этнических принадлежностей (Р = 0.428). В то же время были обнаружены статистически значимые различия в показателях ОДТП между индивидами русской и удмуртской этнических принадлежностей (Р = 0.025), индивидами татарской и удмуртской этнических принадлежностей (Р = 0.005). В связи с этим дальнейший линейный регрессионный анализ, направленный на выявление вовлеченности полиморфных вариантов генов TERT rs7726159, TERC rs1317082, OBFC1 rs2487999 в формирование индивидуальных различий в длине теломер, проводился с включением этнической принадлежности в качестве ковариаты. В результате анализа были подтверждены статистически значимые различия в ОДТП между носителями генотипа rs7726159*A/C в гене TERT и мажорного генотипа rs7726159*С/C в аддитивной модели (P = 0.015; β = 0.076; r2 = 0.004) (табл. 1, 2). В частности, укорочение ОДТП было характерно для индивидов, не имеющих в своем генотипе минорного аллеля rs7726159*А (табл. 1, рис. 1,а). Средние значения показателей ОДТП в зависимости от генотипов изученных полиморфных локусов в общей выборке, среди женщин, мужчин, индивидов русской, татарской, удмуртской этнических принадлежностей представлены в табл. 1. В то же время не было обнаружено ассоциации между полиморфными вариантами генов TERC rs1317082 (P = 0.893) и OBFC1 rs2487999 (P = 0.426) и ОДТП в изученной выборке. В результате использования алгоритма поочередного исключения независимых переменных нами была выявлена статистически значимая модель межиндивидуальных вариаций ОДТП (P = 5.9е–4; r2 = 0.015), которая включала возраст (P = 0.001; β = –0.027) и место воспитания индивида (P = 0.066; β = 0.059) (рис. 1,б). При одновременном включении генетических и средовых предикторов наиболее значимой выступала регрессионная модель (P = 4.3е–4; r2 = 0.018), состоящая из полиморфного варианта rs7726159 гена TERT (P = 0.019; β = 0.078), возраста (P = 0.001; β = = –0.027) и места воспитания индивида (P = 0.048; β = 0.063) (табл. 2; рис. 1,в, г).
Таблица 1.
Средние значения (стандартное отклонение) показателей относительной длины теломерных повторов в изученных группах в зависимости от генотипов полиморфных вариантов генов TERT rs7726159, TERC rs1317082, OBFC1 rs2487999
| Вариант гена | Группа | Общая выборка (N = 1065) |
Женщины (N = 841) |
Мужчины (N = 224) |
Русские (N = 357) |
Татары (N = 340) |
Удмурты (N = 234) |
|---|---|---|---|---|---|---|---|
| TERT rs7726159 | С/C | 0.94 ± 0.46a | 0.94 ± 0.45b | 0.97 ± 0.47 | 0.96 ± 0.44 | 0.89 ± 0.47c | 0.98 ± 0.40 |
| A/C | 1.03 ± 0.50 | 1.05 ± 0.52 | 0.93 ± 0.40 | 1.02 ± 0.52 | 1.01 ± 0.47 | 1.12 ± 0.54 | |
| A/A | 1.00 ± 0.44 | 1.02 ± 0.42 | 0.90 ± 0.52 | 0.89 ± 0.40 | 1.03 ± 0.51 | 1.12 ± 0.41 | |
| TERC rs1317082 | A/A | 0.99 ± 0.46 | 1.00 ± 0.46 | 0.93 ± 0.45 | 0.99 ± 0.48 | 0.94 ± 0.42 | 1.08 ± 0.44 |
| A/G | 0.99 ± 0.48 | 0.99 ± 0.48 | 0.98 ± 0.45 | 0.98 ± 0.48 | 0.98 ± 0.52 | 1.06 ± 0.41 | |
| G/G | 0.96 ± 0.54 | 0.99 ± 0.57 | 0.86 ± 0.41 | 0.99 ± 0.45 | 0.94 ± 0.47 | 1.01 ± 0.66 | |
| OBFC1 rs2487999 | С/C | 1.00 ± 0.48 | 1.01 ± 0.49 | 0.93 ± 0.43 | 0.99 ± 0.48 | 0.97 ± 0.48 | 1.07 ± 0.47 |
| C/T + T/T | 0.96 ± 0.45 | 0.94 ± 0.44 | 1.02 ± 0.53 | 0.97 ± 0.44 | 0.90 ± 0.45 | 0.99 ± 0.45 |
Таблица 2.
Множественный регрессионный анализ, выявляющий эффект полиморфных вариантов генов TERT rs7726159, TERC rs1317082, OBFC1 rs2487999 и социально-демографических факторов (возраста и места воспитания) на формирование индивидуальных различий в длине теломер и уровне депрессивности
| ЗП | Предиктор | Группа | Модель 1 | Модель 2 | Модель 3 | Модель 4 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| β | p-value | β | p-value | β | p-value | β | p-value | |||
| ОДТП | Своб. коэф. | 0.949 | <2e–16 | 0.990 | <2e–16 | 0.997 | <2e–16 | 0.96 | <2e–16 | |
| TERT rs7726159 | A/C | 0.076 | 0.015 | – | – | – | – | 0.075 | 0.017 | |
| A/A | 0.044 | 0.373 | – | – | – | – | 0.043 | 0.389 | ||
| TERC rs1317082 | A/G | – | – | 0.003 | 0.917 | – | – | –0.001 | 0.961 | |
| G/G | – | – | –0.019 | 0.687 | – | – | –0.022 | 0.649 | ||
| OBFC1 rs2487999 | C/T | – | – | – | – | –0.042 | 0.302 | –0.038 | 0.347 | |
| T/T | – | – | – | – | –0.163 | 0.404 | –0.167 | 0.392 | ||
| p-value модели | 0.052 | 0.893 | 0.426 | 0.265 | ||||||
| Скорр. r2 | 3.8e–3 | <2e–16 | <2e–16 | 1.6е–3 | ||||||
| ОДТП | Своб. коэф. | 1.53 | <2e–16 | 1.483 | <2e–16 | 0.918 | <2e–16 | 1.478 | <2e–16 | |
| TERT rs7726159 | A/C | – | – | 0.074 | 0.020 | 0.080 | 0.017 | 0.078 | 0.019 | |
| A/A | – | – | 0.039 | 0.439 | 0.064 | 0.239 | 0.051 | 0.348 | ||
| Возраст | –0.027 | 1е–3 | –0.026 | 0.001 | – | – | –0.027 | 0.001 | ||
| Место воспитания | Сел. местность | 0.059 | 0.066 | – | – | 0.069 | 0.032 | 0.063 | 0.048 | |
| p-value модели | 5.9е–4 | 9.2е–4 | 0.019 | 4.3е–4 | ||||||
| Скорр. r2 | 0.015 | 0.013 | 0.008 | 0.018 | ||||||
| Депрессивность | Своб. коэф. | 9.261 | <2e–16 | 9.120 | <2e–16 | 8.867 | <2e–16 | 9.145 | <2e–16 | |
| ОДТП | –0.643 | 0.206 | –0.661 | 0.155 | –0.643 | 0.166 | –0.605 | 0.195 | ||
| TERT rs7726159 | A/C | –0.601 | 0.239 | – | – | – | – | –0.530 | 0.263 | |
| A/A | –0.274 | 0.739 | – | – | – | – | –0.176 | 0.814 | ||
| TERC rs1317082 | A/G | – | – | –0.139 | 0.768 | – | – | –0.073 | 0.877 | |
| G/G | – | – | –0.216 | 0.769 | – | – | –0.149 | 0.840 | ||
| OBFC1 rs2487999 | C/T | – | – | – | – | 0.961 | 0.110 | 0.931 | 0.123 | |
| T/T | – | – | – | – | –1.664 | 0.568 | –1.605 | 0.583 | ||
| p-value модели | 0.356 | 0.542 | 0.174 | 0.505 | ||||||
| Скорр. r2 | 2.7е–4 | <2e–16 | 0.002 | <2e–16 | ||||||
Примечание. ЗП – зависимая переменная; ОДТП – относительная длина теломерных повторов; своб. коэф. – свободный коэффициент в регрессионной модели; скорр. r2 – скорректированный коэффициент детерминации; β – коэффициент регрессии. Референсными группами в моделях являлись: для TERT rs7726159, TERC rs1317082, OBFC1 rs248799 – минорные генотипы; для места воспитания – городская местность. Статистически значимые различия выделены полужирным шрифтом.
Рис. 1.
Зависимость относительной длины теломерных повторов от аллельных вариантов локуса rs7726159 в гене TERT (а), возраста и места воспитания (городской/сельской местности) (б), указанных генетических и средовых предикторов одновременно (в, г).
С целью проверки гипотезы о связи уровня депрессивности с вариациями в длине теломер и изученными генетическими вариантами была проведена серия множественных регрессионных анализов, которые показали отсутствие ассоциации между полиморфными вариантами генов TERT rs7726159 (Р = 0.239), TERC rs1317082 (Р = 0.768), OBFC1 rs2487999 (Р = 0.110), ОДТП (Р = 0.195) (табл. 2) и психоэмоциональными характеристиками у здоровых индивидов без клинической депрессивной симптоматики.
ОБСУЖДЕНИЕ
В настоящей работе мы не подтвердили первоначальную гипотезу о связи уровня депрессивности у психически здоровых индивидов с длиной теломер с включением средовых факторов и вариантов генов, регулирующих восстановление числа теломерных повторов, в качестве предикторов. Тем не менее в рамках данного исследования было продемонстрировано, что место воспитания (городская/сельская местность), возраст, а также число минорных аллелей полиморфного локуса rs7726159 в гене TERT являются предикторами индивидуальных различий в длине теломер. Результаты опубликованного GWAS-исследования согласуются с полученными нами данными, указывая на ассоциацию минорного аллеля полиморфного варианта rs7726159 в гене TERT с увеличением длины теломер [7]. Несмотря на то что в литературе сообщается о связи укорочения теломер с наличием минорного аллеля локуса TERC rs1317082 и их увеличения – с наличием минорного аллеля локуса rs2487999 в гене OBFC1 [7], в нашей работе такого рода ассоциаций выявлено не было. Несмотря на выдвинутую нами гипотезу о связи длины теломер с манифестацией депрессивности и опубликованные данные о вовлеченности локусов в генах TERT и TERC в формирование интернализированных проблем (депрессии, тревожности и посттравматического стрессового расстройства) [3, 24], мы не смогли подтвердить наличие ассоциации этих генетических вариантов с уровнем депрессивности у психически здоровых индивидов.
Согласно результатам опубликованных работ все три изученных нами полиморфных локуса (TERT rs7726159, TERC rs1317082, OBFC1 rs2487999) были идентифицированы в GWAS-исследованиях длины теломер [6, 7]. Наши данные указывают на вовлеченность лишь полиморфного варианта rs7726159 в гене TERT (как в рамках основного эффекта, так и ген-средовых взаимодействий) в формирование индивидуальных различий в длине теломер у психически здоровых индивидов возраста ранней взрослости. В частности, носители гетерозиготного генотипа rs7726159*A/C характеризовались увеличением ОДТП по сравнению с носителями мажорного генотипа rs7726159*С/C. Ранее с использованием большой выборки (N = = 66 363) индивидов из датской популяции было показано статистически значимое укорочение длины теломер у носителей аллеля rs7726159*С в гене TERT [10], что согласуется с результатами настоящего исследования, также выявившими наименьшую ОДТП у индивидов с генотипом rs7726159*С/C по сравнению с носителями минорного аллеля А.
В ряде опубликованных работ, одновременно учитывающих как роль факторов, отражающих средовое воздействие в детском возрасте, так и длину теломерных повторов на развитие депрессии в послеродовой период, сообщается, как и в нашей работе, об отсутствии связи между уровнем депрессивности и вариациями в длине теломер [15]. В то же время негативные средовые воздействия в детском возрасте играют важную роль в изменении длины теломер и модификациях профиля метилирования ДНК, указывая на увеличение аллостатической нагрузки множества систем организма [15]. Авторы другой работы, оценивавшей возможную вовлеченность уровня депрессивности в изменение длины теломер в рамках крупномасштабного исследования депрессии и тревожности (Netherlands Study of Depression and Anxiety), аналогично нашим результатам показали отсутствие модифицирующего эффекта негативного психоэмоционального состояния на число теломерных повторов, хотя и обнаружили влияние неблагоприятной окружающей среды на снижение их числа [18]. Необходимо отметить, что постоянно повышенный уровень стресса способствует значительному укорочению хромосомных теломер в лонгитюдной парадигме, причем показана гендерная специфичность в восприятии стрессовых факторов различной природы [17].
Влияние возраста на длину теломер обсуждается в литературе достаточно давно [2, 18]. Известно, что со временем длина теломер в нормальных клетках уменьшается до тех пор, пока они не становятся слишком короткими, чтобы выполнять свою роль и сохранять свою способность к делению. Это приводит к клеточному старению, которое является одной из основных причин старения всего организма. По результатам нашего исследования даже в пределах небольшого возрастного периода (18–25 лет) был выявлен значимый негативный эффект возраста на укорочение длины теломер.
Наряду с влиянием возраста в настоящем исследовании был выявлен негативный эффект урбанизации на укорочение длины теломер совместно с основным эффектом генетического варианта rs7726159 в гене TERT. Отрицательный эффект проживания в городской местности в детском возрасте обусловлен тем, что этот период онтогенетического развития является наиболее чувствительным к негативному воздействию неблагоприятных факторов среды, что связано с анатомо-физиологическими особенностями детского организма: низкой эффективностью барьерных факторов верхних дыхательных путей, повышенной проницаемостью гематоэнцефалического барьера, слизистых оболочек, ограниченной экскреторной функцией почек, увеличением в процессе роста массы жировой и костной ткани, и способствует депонированию токсичных веществ. В то же время незрелость ферментных систем определяет снижение эффективности факторов местного иммунитета, антиоксидантной защиты, системы детоксикации химических соединений [25]. Ранее нашей научной группой также был продемонстрирован неблагоприятный эффект воспитания в условиях урбанизации на когнитивные способности человека в контексте ген-средовых взаимодействий, который был значимым даже в случае генетически “благоприятного” аллеля в гене аполипопротеина Е (АроЕ) [26]. Большое количество опубликованных работ указывает на статистически значимое влияние неблагоприятной окружающей обстановки на укорочение теломер, которое, по данным одной из работ [18], соответствует снижению хронологического возраста на 8.7–11.9 лет в числовом эквиваленте (или 69–174 пн) при ухудшении окружающих условий. Негативное влияние проживания в высокотехнологичном обществе по сравнению с малыми территориальными единицами, в первую очередь, связано с ежегодным выбросом миллионов тонн токсичных веществ в атмосферу с различных промышленных предприятий и в виде выхлопных газов. Известно, что тяжелые металлы (например, марганец), концентрация которых превышена в городской среде по сравнению с сельской местностью [25], оказывают негативное воздействие на ЦНС, приводя к сенсибилизации организма и развитию нейродегенеративных заболеваний [27]. Исследования, проведенные на модельных животных, демонстрируют влияние сварочного дыма на изменение длины теломер в тканях головного мозга, связанное с регуляцией компонентов шелтеринового комплекса (Trf1 и Trf2) без изменения активности теломераз, с одной стороны, и увеличение концентрации биомаркеров, ассоциированных с нейродегенеративными изменениями, с другой стороны [27].
По данным крупномасштабного исследования, включавшего информацию по суммарным концентрациям 37 ксенобиотиков, взятых из регистра Национальной оценки воздушных токсикантов США (The National Air Toxics Assessment), превышение содержания некоторых экотоксикантов в атмосфере (бензидина, 1,4-диоксана, четыреххлористого углерода, хлоропрена, дибромида этилена и дихлорида пропилена) ассоциировано с укорочением теломер вследствие инициирования процессов окислительного стресса в организме [28]. Негативное воздействие урбанизации и связанное с этим загрязнение окружающей среды наблюдается не только на организм человека, но и на другие живые объекты. Например, при изучении связи между концентрацией ряда ксенобиотиков (фталатов, хлорорганических и пиретроидных пестицидов, полихлорбифенилов, полибромдифениловых эфиров, полициклических ароматических углеводородов и их метаболитов) и длиной теломер у европейского голавля (Squalius cephalus) была показана отрицательная связь между уровнем метаболитов фталатов и длиной теломерных повторов, а также обитанием в гидрографической сети городских водоемов [29].
Необходимо отметить, что неблагоприятное воздействие загрязнения воздуха оказывает влияние на клеточное старение организма (снижение длины теломер) уже в период пренатального развития [30]. Поскольку проживание в городской/сельской местности в детстве в большей степени коррелирует с местом проживания матери в период гестации, существенный негативный эффект пренатального развития в условиях урбанизации на укорочение длины теломер может быть обусловлен молекулярными событиями, происходящими в плаценте и связанными с наличием токсичных веществ в окружающем воздухе. В частности, мелкодисперсные частицы РМ2.5 (размером меньше 2.5 мкм) легко проникают через гематоплацентарный барьер и оказывают влияние на развивающийся плод вследствие образования активных форм кислорода и азота. Частицы мелкодисперсной пыли могут иметь свободные радикалы на своей поверхности или образовывать активные гидроксильные радикалы в ходе реакции Фентона в присутствии переходных металлов (например, железа) на поверхности частиц [31]. С другой стороны, генерация активных форм кислорода может быть связана с индукцией твердыми частицами изменений в функционировании NADPH-оксидаз и активации воспалительных клеток [30]. Мелкодисперсный аэрозоль оказывает влияние на будущий организм посредством эпигенетических и генетических изменений. В частности, глобальный уровень метилирования ДНК (мобильных элементов LINE-1) в плаценте обратно коррелирует с воздействием мелкодисперсных частиц на организм матери и плода [30]. В свою очередь, снижение глобального уровня метилирования ДНК оказывает негативное влияние на длину теломер [32]. В то же время действие частиц РМ2.5 может изменять экспрессию микроРНК в плацентарной ткани и в определенных отделах развивающегося головного мозга [33], что указывает на важную роль таких модификаций в нейробиологических процессах.
Одним из сопутствующих проявлений проживания в городских условиях является воздействие антропогенного шума на живой организм, которое может быть особенно критичным на ранних этапах развития. Шум может выступать в качестве фактора стрессовой природы, приводя к клеточному старению, что выражается в укорочении длины теломер, например у особей большой синицы (Parus major), гнездующихся в условиях городской среды по сравнению с сельской местностью [34]. С другой стороны, ряд авторов также сообщает о связи наличия “озелененной” территории около места проживания и более длинных теломер [35]. Возможно, что проживающие в неблагоприятном окружении индивиды испытывают значительную аллостатическую нагрузку (старение всех систем организма) и хроническую активацию ответа организма на стресс, приводящие к гиперфункционированию ГГН-системы и переизбытку стрессовых гормонов, способствуя укорочению теломер.
На молекулярном уровне вовлеченность средовых факторов в регуляцию длины теломер может быть обусловлена изменениями эпигенетического профиля под их действием. Существует большое количество данных, связывающих уровень метилирования ДНК с негативным воздействием поллютантов (см. обзор [36]). В то же время безопасная окружающая обстановка оказывает благоприятный эффект на увеличение длины теломер в связи с гипометилированием. В частности, занятия медитативными практиками приводят к снижению метилирования короткого плеча хромосомы 4, характеризующегося отсутствием белок-кодирующих генов и соседствующего с инсуляторным регионом [37]. Предполагается, что метилирование ДНК в субтеломерных районах может играть роль в поддержании длины теломер [37]. Например, фермент ТЕТ (с англ. ten-eleven translocation, метилцитозиндиоксигеназа), участвующий в конвертации 5-метилцитозина в 5-гидроксиметилцитозин, может быть критичным для поддержания структуры теломер вследствие модулирования метилирования ДНК в субтеломерных районах [38]. Важная роль метилирования ДНК в гомеостазе теломер подтверждается результатами исследований, проведенных на модельных животных, в которых показано снижение глобального уровня метилирования субтеломерных регионов, сопутствующее чрезмерному удлинению теломер в эмбриональных стволовых клетках мыши с “выключенными” ДНК-метилтрансферазами [39]. Кроме того, предполагается, что средовые воздействия на эпигеном обусловлены чувствительными к стрессу транспозонами, запускающими процесс образования некодирующих РНК, способных влиять на модификации гистонов и метилирование определенных генетических локусов [40].
Таким образом, в результате настоящего исследования впервые был проанализирован большой объем данных, включающий информацию об относительной длине теломерных повторов, вариантах генов, белковые продукты которых участвуют в регуляции длины теломер, а также социально-демографических параметрах, у психически здоровых индивидов 18–25 лет. Нами была подтверждена вовлеченность генетического варианта rs7726159 гена обратной транскриптазы (TERT) и возраста в регуляцию длины теломер в изученной когорте. Кроме того, был выявлен негативный эффект проживания в условиях урбанизации в детском возрасте на укорочение длины теломер, характеризующей уровень клеточного старения организма. Несмотря на выдвинутую гипотезу о связи уровня депрессивности (вне клинических форм) со снижением длины теломер, в настоящей работе не удалось обнаружить такой закономерности у лиц в период ранней взрослости. Настоящее исследование характеризуется рядом преимуществ, включая большой объем выборки одной возрастной группы, собранной до пандемии COVID-19, что позволяет оценить психоэмоциональное состояние еще до действия вируса SARS-CoV-2, негативно влияющего на психическое здоровье человека. Другим преимуществом работы является попытка связать особенности воспитания в детском возрасте с изменениями в длине теломер впоследствии. Тем не менее нами не были учтены другие важные компоненты генной сети, участвующие в регуляции длины теломер, и неблагоприятные стрессовые воздействия в раннем возрасте, которые также способствуют укорочению хромосомных теломер.
Исследование выполнено при финансовой поддержке гранта Российского научного фонда (проект № 17-78-30028) (проведение психологического тестирования и сбор биологических образцов), мега-гранта Правительства Республики Башкортостан (генотипирование) и мега-гранта Правительства РФ (проект № 075-15-2021-595) (статистическая обработка и биоинформатический анализ данных).
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Cai N., Chang S., Li Y. et al. Molecular signatures of major depression // Curr. Biol. 2015. V. 25. № 9. P. 1146–1156. https://doi.org/10.1016/j.cub.2015.03.008
Portillo A.M., Peláez C. Mathematical modelling of ageing acceleration of the human follicle due to oxidative stress and other factors // Math. Med. Biol. 2021. V. 38. № 3. P. 273–291. https://doi.org/10.1093/imammb/dqab00
Avetyan D., Zakharyan R., Petrek M., Arakelyan A. Telomere shortening in blood leukocytes of patients with posttraumatic stress disorder // J. Psychiatr. Res. 2019. V. 111. P. 83–88. https://doi.org/10.1016/j.jpsychires.2019.01.018
Aramburu T., Plucinsky S., Skordalakes E. POT1-TPP1 telomere length regulation and disease // Comput. Struct. Biotechnol. J. 2020. V. 18. P. 1939–1946. https://doi.org/10.1016/j.csbj.2020.06.040
Andrew T., Aviv A., Falchi M. et al. Mapping genetic loci that determine leuko-cyte telomere length in a large sample of unselected female sibling pairs // Am. J. Hum. Genet. 2006. V. 78. № 3. P. 480–486. https://doi.org/10.1086/500052
Codd V., Nelson C.P., Albrecht E. et al. Identification of seven loci affecting mean telomere length and their association with disease // Nat. Genet. 2013. V. 45. № 4. P. 422–427, 427e1-2. https://doi.org/10.1038/ng.2528
Pooley K.A., Bojesen S.E., Weischer M. et al. A genome-wide association scan (GWAS) for mean telomere length within the COGS project: identified loci show little association with hormone-related cancer risk // Hum. Mol. Genet. 2013. V. 22. № 24. P. 5056–5064. https://doi.org/10.1093/hmg/ddt355
Li Y., Cheang I., Zhang Z. et al. Prognostic association of TERC, TERT gene polymorphism, and leukocyte telomere length in acute heart failure: a prospective study // Front. Endocrinol. (Lausanne). 2021. V. 12. P. 650922. https://doi.org/10.3389/fendo.2021.650922
Michalek J.E., Kepa A., Vincent J. et al. Genetic predisposition to advanced biological ageing increases risk for childhood-onset recurrent major depressive disorder in a large UK sample // J. Affect. Disord. 2017. V. 213. P. 207–213. https://doi.org/10.1016/j.jad.2017.01.017
Scheller Madrid A., Rasmussen K.L., Rode L. et al. Observational and genetic studies of short telomeres and Alzheimer’s disease in 67,000 and 152,000 individuals: a Mendelian randomization study // Eur. J. Epidemiol. 2020. V. 35. № 2. P. 147–156. https://doi.org/10.1007/s10654-019-00563-w
Friedrich U., Griese E., Schwab M. et al. Telomere length in different tissues of elderly patients // Mech. Ageing Dev. 2000. V. 119. № 3. P. 89–99. https://doi.org/10.1016/s0047-6374(00)00173-1
Verhoeven J.E., Penninx B.W.J.H., Milaneschi Y. Unraveling the association between depression and telomere length using genomics // Psychoneuroendocrinology. 2019. V. 102. P. 121–127. https://doi.org/10.1016/j.psyneuen.2018.11.029
Боринская С.А., Рубанович А.В., Ларин А.К. и др. Полногеномное исследование связи метилирования CpG-сайтов с агрессивным поведением // Генетика. 2021. Т. 57. № 12. С. 1450–1457. https://doi.org/10.31857/S0016675821120043
Davydova Yu.D., Enikeeva R.F., Kazantseva A.V. et al. Genetic basis of depressive disorders // Vavilov J. Genetics and Breeding. 2019. V. 23. № 4. P. 465–472. https://doi.org/10.18699/VJ19.515
Robakis T.K., Zhang S., Rasgon N.L. et al. Epigenetic signatures of attachment insecurity and childhood adversity provide evidence for role transition in the pathogenesis of perinatal depression // Transl. Psychiatry. 2020. V. 10(1). P. 48. https://doi.org/10.1038/s41398-020-0703-3
Chen X., Zeng C., Gong C. et al. Associations between early life parent-child separation and shortened telomere length and psychopathological outcomes during adolescence // Psychoneuroendocrinology. 2019. V. 103. P. 195–202. https://doi.org/10.1016/j.psyneuen.2019.01.021
Meier H.C.S., Hussein M., Needham B. et al. Cellular response to chronic psychosocial stress: Ten-year longitudinal changes in telomere length in the multi-ethnic study of atherosclerosis // Psychoneuroendocrinology. 2019. V. 107. P. 70–81. https://doi.org/10.1016/j.psyneuen.2019.04.018
Park M., Verhoeven J.E., Cuijpers P. et al. Where you live may make you old: the association between perceived poor neighborhood quality and leukocyte telomere length // PLoS One. 2015. V. 10. № 6. P. e0128460. https://doi.org/10.1371/journal.pone.0128460
Starkweather A.R., Alhaeeri A.A., Montpetit A. et al. An integrative review of factors associated with telomere length and implications for biobehavioral research // Nursing Research. 2014. V. 63. № 1. P. 36–50. https://doi.org/10.1097/NNR.0000000000000009
Davydova Yu.D., Kazantseva A.V., Enikeeva R.F. et al. The role of oxytocin receptor (OXTR) gene polymorphisms in the development of aggressive behavior in healthy individuals // Rus. J. Genet. 2020. V. 56. № 9. P. 1129–1138. https://doi.org/10.1134/S1022795420090057
Kazantseva A.V., Davydova Yu.D., Enikeeva R.F. et al. AVPR1A main effect and OXTR-by-environment interplay in individual differences in depression level // Heliyon. 2020. V. 6. № 10. P. e05240. https://doi.org/10.1016/j.heliyon.2020.e05240
Cawthon R.M. Telomere measurement by quantitative PCR // Nucl. Acids Res. 2002. V. 30. № 10. P. e47. https://doi.org/10.1093/nar/30.10.e47
O’Callaghan N.J., Fenech M. A quantitative PCR method for measuring absolute telomere length // Biol. Proced. Online. 2011. V. 13. P. 3. https://doi.org/10.1186/1480-9222-13-3
Kalungi A., Kinyanda E., Womersley J.S. et al. TERT rs2736100 and TERC rs16847897 genotypes moderate the association between internalizing mental disorders and accelerated telomere length attrition among HIV+ children and adolescents in Uganda // BMC Med. Genomics. 2021. V. 14. № 1. P. 15. https://doi.org/10.1186/s12920-020-00857-z
Атискова Н.Г. Обоснование гигиенических нормативов содержания марганца и никеля в атмосферном воздухе по результатам количественной оценки риска для здоровья населения: Дис. … канд. мед. наук. Пермь: ФБНУ “Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения”, 2015. 174 с.
Kazantseva A.V., Enikeeva R.F., Davydova Yu.D. et al. The role of the KIBRA and APOE genes in developing spatial abilities in humans // Vavilov J. Genetics and Breeding. 2021. V. 25. № 8. P. 839–846. https://doi.org/10.18699/VJ21.097
Shoeb M., Mustafa G.M., Kodali V.K. et al. A possible relationship between telomere length and markers of neurodegeneration in rat brain after welding fume inhalation exposure // Environ. Res. 2020. V. 180. P. 108900. https://doi.org/10.1016/j.envres.2019.108900
Niehoff N.M., Gammon M.D., Keil A.P. et al. Hazardous air pollutants and telomere length in the Sister Study // Environ. Epidemiol. 2019. V. 3. № 4. P. e053. https://doi.org/10.1097/ee9.0000000000000053
Molbert N., Angelier F., Alliot F. et al. Fish from urban rivers and with high pollutant levels have shorter telomeres // Biol. Lett. 2021. V. 17. № 1. P. 20200819. https://doi.org/10.1098/rsbl.2020.0819
Saenen N.D., Martens D.S., Neven K.Y. et al. Air pollution-induced placental alterations: an interplay of oxidative stress, epigenetics, and the aging phenotype? // Clin. Epigenetics. 2019. V. 11. № 1. P. 124. https://doi.org/10.1186/s13148-019-0688-z
Ghio A.J., Carraway M.S., Madden M.C. Composition of air pollution particles and oxidative stress in cells, tissues, and living systems // J. Toxicol. Environ. Health B Crit. Rev. 2012. V. 15. № 1. P. 1–21. https://doi.org/10.1080/10937404.2012.632359
Dong Y., Huang Y., Gutin B. et al. Associations between Global DNA methylation and telomere length in healthy adolescents // Sci. Rep. 2017. V. 7. № 1. P. 4210. https://doi.org/10.1038/s41598-017-04493-z
Chao M.W., Yang C.H., Lin P.T. et al. Exposure to PM2.5 causes genetic changes in fetal rat cerebral cortex and hippocampus // Environ. Toxicol. 2017. V. 32. № 4. P. 1412–1425. https://doi.org/10.1002/tox.22335
Salmón P., Nilsson J.F., Nord A. et al. Urban environment shortens telomere length in nestling great tits, Parus major // Biol. Lett. 2016. V. 12. № 6. P. 20160155. https://doi.org/10.1098/rsbl.2016.015
Miri M., de Prado-Bert P., Alahabadi A. et al. Association of greenspace exposure with telomere length in preschool children // Environ. Pollut. 2020. V. 266 (Pt 1). P. 115228. https://doi.org/10.1016/j.envpol.2020.115228
Cronjé H.T., Elliott H.R., Nienaber-Rousseau C., Pieters M. Leveraging the urban-rural divide for epigenetic research // Epigenomics. 2020. V. 12. № 12. P. 1071–1081. https://doi.org/10.2217/epi-2020-0049
Mendioroz M., Puebla-Guedea M., Montero-Marín J. et al. Telomere length correlates with subtelomeric DNA methylation in long-term mindfulness practitioners // Sci. Rep. 2020. V. 10. № 1. P. 4564. https://doi.org/10.1038/s41598-020-61241-6
Yang J., Guo R., Wang H. et al. Tet enzymes regulate telomere maintenance and chromosomal stability of mouse ESCs // Cell Rep. 2016. V. 15. № 8. P. 1809–1821. https://doi.org/10.1016/j.celrep.2016.04.058
Gonzalo S., Jaco I., Fraga M.F. et al. DNA methyltransferases control telomere length and telomere recombination in mammalian cells // Nat. Cell Biol. 2006. V. 8. № 4. P. 416–424. https://doi.org/10.1038/ncb1386
Мустафин Р.Н., Казанцева А.В., Еникеева Р.Ф. и др. Эпигенетика агрессивного поведения // Генетика. 2019. Т. 55. № 9. С. 987–997. https://doi.org/10.1134/S0016675819090091
Дополнительные материалы отсутствуют.


