Генетика, 2023, T. 59, № 1, стр. 26-38
Влияние гена aPKC, кодирующего атипичную протеинкиназу C, на продолжительность жизни D. melanogaster зависит от уровня экспрессии протеинкиназы GSK3
М. В. Тростников 1, *, Е. Р. Веселкина 1, Ю. А. Андреев 1, А. Ю. Хрячкова 1, Н. В. Рощина 1, 2, Е. Г. Пасюкова 1
1 Институт молекулярной генетики Национального исследовательского центра
“Курчатовский институт”
123182 Москва, Россия
2 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
* E-mail: mikhail.trostnikov@gmail.com
Поступила в редакцию 21.02.2022
После доработки 14.04.2022
Принята к публикации 26.05.2022
- EDN: CNOZBD
- DOI: 10.31857/S0016675823010125
Аннотация
Гены shaggy и aPKC Drosophila melanogaster кодируют высококонсервативные протеинкиназы GSK3 (Glycogen Syntase Kinase 3) и aPKC (Protein Kinase C), играющие ключевую роль во многих клеточных процессах. Ранее мы продемонстрировали, что изменение экспрессии гена shaggy в нейронах влияет на продолжительность жизни. В настоящей статье показано, что изменение экспрессии гена aPKC в нейронах также влияет на продолжительность жизни. Изменение экспрессии двух протеинкиназ во всех нейронах самцов и самок и в мотонейронах самцов приводило к изменению продолжительности жизни, свидетельствующему об отсутствии влияния aPKC на GSK3 и возможном ингибирующем действии GSK3 на aPKC. В то же время изменение экспрессии двух протеинкиназ в мотонейронах самок приводило к изменению продолжительности жизни, свидетельствующему о существовании пока неясного механизма взаимодействия между этими белками. Выяснение механизмов взаимодействия между aPKC, GSK3 и другими их партнерами позволит углубить и расширить наши представления о причинах долголетия и способах продления жизни.
В современной биологии старения одним из наиболее активно развивающихся направлений является поиск ключевых факторов, приводящих к сокращению продолжительности жизни и сопутствующих возрастным изменениям. Выявление наиболее эволюционно консервативных триггеров старения создает базу для поиска потенциальных способов влияния на этот процесс и для выяснения общебиологических закономерностей, лежащих в основе ограниченной продолжительности жизни. В широко цитируемой работе [1] были сформулированы основные фундаментальные механизмы старения: увеличение уровня геномной нестабильности, уменьшение протеостаза, сокращение длины теломер, нарушение эпигенетической регуляции, появление сенесцентных и истощение стволовых клеток, нарушение работы митохондрий, усиление окислительного стресса, ослабление пищевого баланса и ряд других факторов. Существуют ли среди многообразных механизмов старения такие, которые инициируют развитие остальных? В ряде работ в качестве такого базового механизма рассматривается нарушение протеостаза, приводящее к накоплению агрегированных белков, неспособных корректно выполнять свою изначальную функцию, и ассоциированное с возрастными изменениями, средней продолжительностью жизни и широким спектром патологий [2].
Одним из наиболее устойчивых к протеолитическому стрессу типов клеток являются стволовые клетки, в которых выявлен повышенный уровень деградации белков с нарушенной структурой [3, 4]. Предполагается, что контроль протеостаза связан сзависимым от возраста распределением нарушенных белков между материнскими и дочерними клетками в процессе асимметричного деления стволовых клеток. Так, в старых стволовых клетках нервной ткани млекопитающих асимметрия в распределении поврежденных белков нарушается, в результате чего в дочерней клетке количество поврежденных белков увеличивается, нарушая ее функциональность [5].
Белки, контролирующие асимметричность клеточного деления, высоко консервативны, поэтому разумным является исследование взаимосвязи между молекулярными механизмами, регулирующими асимметричное деление клеток нервной системы и процесс старения, на модельных организмах с достаточно короткой продолжительностью жизни. К настоящему моменту одной из наиболее изученных моделей асимметричного деления является деление нейробластов плодовой мушки Drosophila melanogaster [6]. В процессе этого деления ось полярности определяется формированием и активностью комплекса, состоящего из атипичной протеинкиназы С (aPKC), а также белков Partitioning – defective 6 (Par-6) и Bazooka (Baz, гомолог Par-3 млекопитающих) [7]. В связи с изучением старения особый интерес представляет aPKC, поскольку у человека продемонстрировано изменение уровня ее экспрессии, ассоциированное с возрастом и развитием болезни Альцгеймера [8]. Такая ассоциация может быть обусловлена взаимодействием aPKC с протеинкиназой GSK3 [9]. Известно, что GSK3 участвует в работе различных метаболических путей, связанных с контролем продолжительности жизни и целого спектра патологий, среди которых особенно выделяются нарушения работы нервной системы [10, 11].
Ранее мы выяснили, что сильное или умеренное увеличение либо уменьшение экспрессии гена shaggy (sgg), кодирующего протеинкиназу GSK3, во всех нейронах уменьшает продолжительность жизни дрозофилы. В то же время нарушение экспрессии sgg в различных нейронах может приводить как к уменьшению, так и к увеличению продолжительности жизни в зависимости от направления и степени изменения экспрессии, типа нейронов и пола особей [12–14]. В настоящей статье мы показали, что уменьшение экспрессии гена aPKC, кодирующего протеинкиназу aPKC, в нервной системе также повлияло на продолжительность жизни дрозофилы. Изменение экспрессии двух протеинкиназ во всех нейронах самцов и самок и в мотонейронах самцов приводило к изменению продолжительности жизни, свидетельствующему об отсутствии влияния aPKC на GSK3 и возможном ингибирующем действии GSK3 на aPKC. В то же время изменение экспрессии двух протеинкиназ в мотонейронах самок приводило к изменению продолжительности жизни, свидетельствующему о существовании сложного и пока неясного механизма взаимодействия между исследуемыми протеинкиназами.
МАТЕРИАЛЫ И МЕТОДЫ
Линии дрозофилы
Линии y[1]sc[*]v[1]; P{y[+t7.7]v[+t1.8]= =TRiP.HMC06305}attP40 (трансген aPKC_НД1) и y[1]sc[*]v[1]; P{y[+t7.7]v[+t1.8]=TRiP.HMS01689}attP40 (трансген aPKC_НД2) с трансгенами, локализованными во второй хромосоме, использовали для нокдауна гена aPKC, приводящего к уменьшению уровня экспрессии aPKC. Исходную линию без трансгенов y[1]v[1]; P{y[+t7.7]=CaryP}attP40 (контроль_aPKC) использовали в качестве контрольной в отношении нокдауна гена aPKC (http://flystocks.bio.indiana.edu/Browse/TRiPtb.htm).
Линию w[1118]; P{w[+mC]=UAS-sgg.B}MB5 (трансген sggRB) с трансгеном, локализованным в третьей хромосоме и кодирующим основной транскрипт гена sgg, RB [15], использовали для сверхэкспрессии гена sgg и увеличения уровня экспрессии GSK3. Исходную линию w[1118] (контроль_sgg) без трансгена использовали в качестве контрольной в отношении сверхэкспрессии гена sgg [15].
Линии P{w+mW.hs=GawB}elavC155w[1118]; P{w+mC=UAS-Dcr-2.D}2 (драйвер Д1) и w*; P{GawB}D42 (драйвер Д2) использовали для индукции экспрессии трансгенов во всех нейронах и в мотонейронах соответственно.
Измерение продолжительности жизни
Девственных самцов и самок каждого генотипа собирали в течение дня и помещали в пробирки с питательной средой (манная крупа, изюм, сахар, дрожжи, агар-агар, нипагин, пропионовая кислота), по пять мух каждого пола отдельно. Количество мертвых мух в пробирках регистрировали ежедневно; живых мух переносили на свежий корм раз в неделю; все культуры вели при 25°C. Выборка составила 50 особей на генотип/пол; опыты были повторены дважды. Для оценки полученных данных использовали стандартный статистический анализ продолжительности жизни [16, 17]. Для оценки статистической значимости различий между кривыми выживания использовали критерий Манна–Уитни.
Иммуногистохимический анализ
Личинок третьей стадии препарировали в натрий-фосфатном буфере (PBS) и фиксировали в 4%-ном параформальдегиде (Sigma-Aldrich) при комнатной температуре в течение 20 мин. Для иммуноокрашивания препараты помещали в блокирующий буфер (BlockPRO, Visual Protein Biotechnology Corporation) на один час при комнатной температуре, инкубировали с первичными антителами в течение ночи при 4°С, с вторичными антителами в течение двух часов и помещали в среду для иммунофлуоресценции (VectaShield, Vector Labs). После каждой стадии обработки препараты промывали в фосфатном буфере (3 × 15 мин). Были использованы первичные антитела против Bruchpilot (DSHB), белка, специфического для зон активных синаптических контактов [18], и пероксидазы хрена (Jackson ImmunoResearch), белка, широко используемого в качестве маркера пресинаптических мембран [19]. Нейромышечные связки были проанализированы в четвертой мышце третьего и четвертого сегментов брюшной полости пяти–семи личинок на генотип/пол с помощью конфокального лазерного сканирующего микроскопа (Zeiss LSM 900) и программ ImageJ (http://rsb.info.nih.gov/ij/index.html) и LSM Image Browser (Zeiss).
РЕЗУЛЬТАТЫ
Для анализа взаимодействия между генами aPKC и sgg, используя стандартные скрещивания с хромосомами-балансерами, мы получили линии, в геноме которых присутствовали первая хромосома w[1118]; вторая хромосома с одним из трансгенов, уменьшающих уровень экспрессии протеинкиназы aPKC; и третья хромосома с трансгеном, увеличивающим уровень экспрессии протеинкиназы GSK3, а также соответствующие контрольные линии. Линии были названы контроль_aPKC+ +контроль_sgg, aPKC_НД1+контроль_sgg, aPKC_НД2+контроль_sgg; aPKC_НД1+sggRB, aPKC_НД2+sggRB в соответствии с обозначением трансгенов (см. раздел “Материалы и методы”). Во всех линиях подтвердили отсутствие Wolbachia, симбионта дрозофилы, способного повлиять на ее продолжительность жизни [20].
Для индукции экспрессии трансгенов во всех нейронах или в мотонейронах самцов каждой из полученных линий скрещивали с самками соответствующей линии-драйвера. У самцов и самок всех генотипов была охарактеризована продолжительность жизни. Результаты двух повторных опытов хорошо совпали между собой (табл. 1), несмотря на небольшой объем каждого опыта, что, видимо, объясняется сильно выраженным влиянием уровня экспрессии aPKC и GSK3 на исследуемый признак. Это позволило нам ограничиться двумя повторностями и объединить их для представления результатов.
Таблица 1.
Параметры, характеризующие продолжительность жизни самцов и самок с нокдауном гена aPKC
| Тип клеток (драйвер) |
Линии с трансгенами | Пол | Вариант опыта | N | Средняя продолжительность жизни (ошибка средней), дни | Достоверность отличия от контрольного генотипа, тест Манна–Уитни* |
|---|---|---|---|---|---|---|
| Все нейроны (Д1) | Контроль_aPKC+контроль_sgg | ♂ | Опыт 1 | 50 | 50 (2.4) | |
| Опыт 2 | 50 | 61 (2.6) | ||||
| Сумма | 100 | 56 (1.9) | ||||
| ♀ | Опыт 1 | 50 | 79 (2.6) | |||
| Опыт 2 | 50 | 77 (2.2) | ||||
| Сумма | 100 | 78 (1.7) | ||||
| aPKC_НД1+контроль_sgg | ♂ | Опыт 1 | 50 | 17 (1.9) | <0.0001 | |
| Опыт 2 | 50 | 19 (1.3) | <0.0001 | |||
| Сумма | 100 | 18 (1.1) | <0.0001 | |||
| ♀ | Опыт 1 | 50 | 53 (2.3) | <0.0001 | ||
| Опыт 2 | 50 | 50 (1.8) | <0.0001 | |||
| Сумма | 100 | 51 (1.5) | <0.0001 | |||
| aPKC_НД1+sggRB | ♂ | Опыт 1 | 1 | 2 | – | |
| Опыт 2 | 2 | 2 | – | |||
| Сумма | 3 | 2 | 0.0032 | |||
| ♀ | Опыт 1 | 50 | 4 (2.4) | <0.0001 | ||
| Опыт 2 | 50 | 3 (1.4) | <0.0001 | |||
| Сумма | 100 | 4 (1.2) | <0.0001 | |||
| aPKC_НД2+контроль_sgg | ♂ | Опыт 1 | 50 | 34 (2.6) | <0.0001 | |
| Опыт 2 | 50 | 18 (1.8) | <0.0001 | |||
| Сумма | 100 | 26 (1.8) | <0.0001 | |||
| ♀ | Опыт 1 | 50 | 70 (2.6) | 0.0038 | ||
| Опыт 2 | 50 | 66 (3.0) | 0.0165 | |||
| Сумма | 100 | 68 (1.9) | 0.0003 | |||
| aPKC_НД2+sggRB | ♂ | Опыт 1 | 50 | 3 (0.2) | <0.0001 | |
| Опыт 2 | 50 | 2 (0.1) | <0.0001 | |||
| Сумма | 100 | 3 (0.1) | <0.0001 | |||
| ♀ | Опыт 1 | 50 | 4 (0.4) | <0.0001 | ||
| Опыт 2 | 50 | 4 (0.4) | <0.0001 | |||
| Сумма | 100 | 4 (0.3) | <0.0001 | |||
| Мотонейроны (Д2) | Контроль_aPKC+контроль_sgg | ♂ | Опыт 1 | 50 | 73 (2.5) | |
| Опыт 2 | 50 | 57 (2.6) | ||||
| Сумма | 100 | 65 (1.9) | ||||
| ♀ | Опыт 1 | 50 | 76 (2.9) | |||
| Опыт 2 | 50 | 85 (1.9) | ||||
| Сумма | 100 | 81 (1.8) | ||||
| aPKC_НД1+контроль_sgg | ♂ | Опыт 1 | 50 | 57 (1.7) | <0.0001 | |
| Опыт 2 | 50 | 47 (2.4) | <0.0001 | |||
| Сумма | 100 | 52 (1.6) | <0.0001 | |||
| ♀ | Опыт 1 | 50 | 70 (2.6) | 0.0331 | ||
| Опыт 2 | 50 | 77 (2.5) | 0.0059 | |||
| Сумма | 100 | 74 (1.8) | 0.0005 | |||
| aPKC_НД1+sggRB | ♂ | Опыт 1 | 50 | 25 (1.3) | <0.0001 | |
| Опыт 2 | 50 | 27 (1.3) | <0.0001 | |||
| Сумма | 100 | 26 (0.9) | <0.0001 | |||
| ♀ | Опыт 1 | 50 | 60 (1.6) | 0.0004 | ||
| Опыт 2 | 50 | 66 (1.9) | 0.0006 | |||
| Сумма | 100 | 63 (1.3) | <0.0001 | |||
| aPKC_НД2+контроль_sgg | ♂ | Опыт 1 | 50 | 54 (3.4) | <0.0001 | |
| Опыт 2 | 50 | 35 (2.4) | <0.0001 | |||
| Сумма | 100 | 45 (2.3) | <0.0001 | |||
| ♀ | Опыт 1 | 50 | 68 (1.9) | 0.0014 | ||
| Опыт 2 | 50 | 73 (2.6) | <0.0001 | |||
| Сумма | 100 | 70 (1.6) | <0.0001 | |||
| aPKC_НД2+sggRB | ♂ | Опыт 1 | 50 | 32 (2.1) | <0.0001 | |
| Опыт 2 | 50 | 22 (1.9) | 0.0006 | |||
| Сумма | 100 | 27 (1.5) | <0.0001 | |||
| ♀ | Опыт 1 | 50 | 63 (1.8) | 0.0388 | ||
| Опыт 2 | 50 | 66 (2.8) | 0.0827 | |||
| Сумма | 100 | 64 (1.7) | 0.0093 |
* Продолжительность жизни сравнивали у гибридов от скрещивания между линиями-драйверами Д1 или Д2 и следующими линиями с трансгенами: контроль_aPKC+контроль_sgg и aPKC_НД1+контроль_sgg; aPKC_НД1+контроль_sgg и aPKC_НД1+sggRB; контроль_aPKC+контроль_sgg и aPKC_НД2+контроль_sgg; aPKC_НД2+контроль_sgg и aPKC_НД2+sggRB. Описание генотипов см. разделы “Материалы и методы” и “Результаты”.
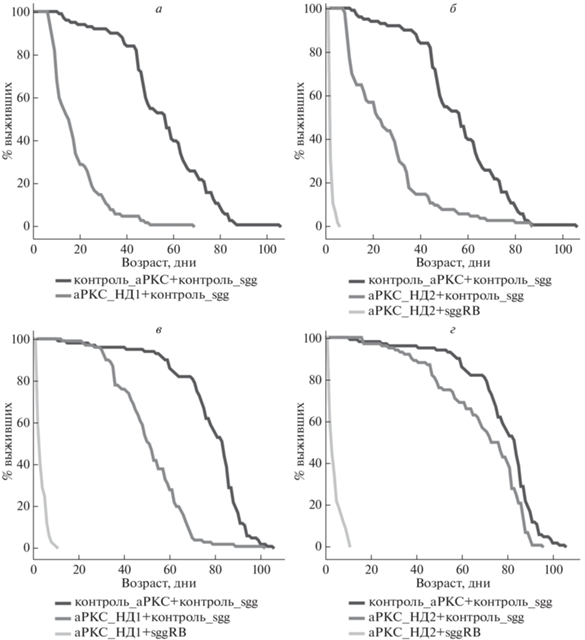
Уменьшение количества aPKC во всех нейронах снизило продолжительность жизни как самцов, так и самок (среднюю продолжительность жизни – на 68 и 35% в случае aPKC_НД1 и на 54 и 13% в случае aPKC_НД2; табл. 1, рис. 1). Этот эффект существенно усилился в том случае, когда уменьшение количества aPKC во всех нейронах происходило на фоне увеличении количества GSK3. Среди самцов с одним из вариантов нокдауна гена aPKC и сверхэкспрессией гена sgg выжило всего несколько особей, продолжительность их жизни не превышала двух дней; кривая выживания для этого случая не представлена (табл. 1, рис. 1,а). Самцы с другим вариантом нокдауна гена aPKC и сверхэкспрессией гена sgg выживали лучше, но средняя продолжительность их жизни не превышала трех дней (табл. 1, рис. 1,б). Средняя продолжительность жизни самок в обоих случаях также была крайне низкой (4 ± 0.2 дня; табл. 1, рис. 1,б, 1,г). Было показано, что GSK3 способна фосфорилировать aPKC и таким образом ингибировать ее [9]. Если это так, то у мух с нокдауном гена aPKC на фоне увеличения экспрессии GSK3 должно было наблюдаться дальнейшее уменьшение экспрессии aPKC и дальнейшее снижение продолжительности жизни. Именно такой эффект мы наблюдали в наших экспериментах, что позволяет говорить о возможном ингибирующем действии GSK3 на aPKC в нейронах в ходе контроля продолжительности жизни. В то же время дальнейшее снижение продолжительности жизни могло быть и следствием независимого, аддитивного влияния уменьшения активности aPKC и увеличения активности GSK3 в нейронах.
Рис. 1.
Влияние нокдауна гена aPKC, вызванного трансгенами во всех нейронах, на продолжительность жизни самцов (а, б) и самок (в, г). Продолжительность жизни сравнивали у гибридов от скрещивания между линиями-драйверами Д1 или Д2 и линиями с трансгенами. Описание генотипов см. разделы “Материалы и методы” и “Результаты”.
Действительно, в ранее проведенном исследовании мы показали, что само по себе увеличение экспрессии гена sgg, кодирующего GSK3, во всех нейронах также приводило к очень существенному снижению средней продолжительности жизни самцов и самок, до 3 ± 0.1 и 7 ± 0.4 дней соответственно [13]. Средняя продолжительность жизни самцов и самок с увеличенной экспрессией GSK3 во всех нейронах составила 4 и 9% от средней продолжительности жизни соответствующего контроля [13]. Результаты же, представленные в настоящей статье, показали, что средняя продолжительность жизни самцов и самок с увеличенной экспрессией GSK3 на фоне уменьшенной экспрессии aPKC во всех нейронах составила в среднем 12 и 8% от средней продолжительности жизни соответствующего контроля. Известно, что aPKC может фоcфорилировать и тем самым ингибировать GSK3 [21]. В таком случае в наших опытах у мух с увеличенной экспрессией GSK3 на фоне нокдауна гена aPKC должно было наблюдаться еще большее увеличение экспрессии GSK3, а следовательно еще большее снижение продолжительности жизни. Однако ни у самцов, ни у самок такого не наблюдалось, влияние увеличения экспрессии GSK3 на продолжительности жизни было сходным в отсутствие и в присутствии нокдауна гена aPKC. Тем не менее, поскольку продолжительность жизни была очень низкой у мух всех генотипов с увеличенной экспрессией GSK3, сделать надежное заключение о взаимодействии генов aPKC и GSK3 на основании полученных данных было трудно.
Чтобы преодолеть возникшее затруднение, мы использовали два подхода. Первый подход заключался в том, чтобы оценить влияние увеличенной экспрессии GSK3 на фоне нокдауна aPKC во всех нейронах не на продолжительность жизни, а на свойства нервной системы, поскольку ранее мы показали, что при увеличении уровня экспрессии GSK3 во всех нейронах эти признаки меняются согласованно [13].
Известно, что GSK3 и aPKC влияют на различные свойства нейронов [19, 22–24]. В частности, ранее мы показали, что увеличение уровня экспрессии GSK3 во всех нейронах приводит к достоверному уменьшению количества зон активных синаптических контактов в нейромышечных связках самок [13]. Синаптическая активность является одним из интегральных показателей работы нервной системы, а нейромышечные связки личинок дрозофилы часто используются в качестве модельной системы для изучения функции синапсов [25]. Поэтому чтобы оценить, как взаимодействуют GSK3 и aPKC в процессе контроля свойств нервной системы, мы измерили количество зон активных синаптических контактов у самок, полученных от скрещивания между самцами линий aPKC_НД1+контроль_sgg или aPKC_НД1+sggRB и самками линии-драйвера, индуцирующего экспрессию трансгенов во всех нейронах. Как и при изучении продолжительности жизни, полученные результаты о влиянии GSK3 на активность синапсов в присутствии нокдауна гена aPKC были сопоставлены с ранее полученными данными о таком влиянии в отсутствие нокдауна гена aPKC [13].
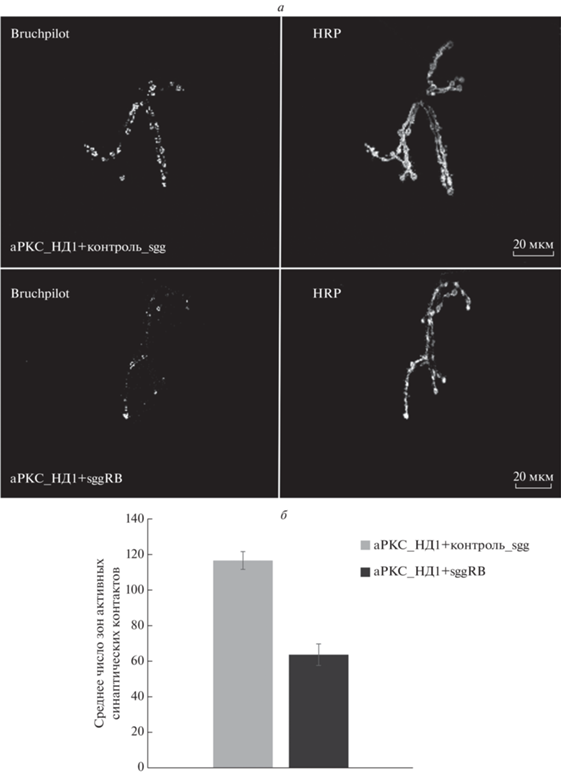
Увеличение экспрессии гена sgg, кодирующего GSK3, во всех нейронах приводило к достоверному снижению количества зон активных синаптических контактов у самок, со 158 ± 4.2 до 89 ± 3.0 [13]. Количество зон активных синаптических контактов у самок с увеличенной экспрессией GSK3 во всех нейронах составило, таким образом, 58% от контрольного. Количество зон активных синаптических контактов у самок с увеличенной экспрессией GSK3 на фоне уменьшенной экспрессии aPKC во всех нейронах также снижалось со 117 ± 9 до 66 ± 11 (рис. 2) и составило 55% от контрольного. Если aPKC является ингибитором GSK3 [21], то в наших опытах у особей с увеличенной экспрессией GSK3 на фоне нокдауна гена aPKC должно было наблюдаться еще большее увеличение активности GSK3, а следовательно еще большее снижение активности синапсов. Однако этого не произошло, и у самок с увеличенной экспрессией GSK3 во всех нейронах активность синапсов уменьшилась одинаково в отсутствие и в присутствии нокдауна гена aPKC. Этот результат хорошо соответствует описанному выше характеру влияния увеличенной экспрессии GSK3 в отсутствие и в присутствии нокдауна гена aPKC на продолжительность жизни. Таким образом, исследование взаимодействия aPKC и GSK3 в нейронах указывает на то, что aPKC не влияет на эффекты GSK3 в отношении активности синапсов и продолжительности жизни. Полученные результаты нельзя также объяснить аддитивным действием измененной экспрессии двух протеинкиназ.
Рис. 2.
Влияние нокдауна гена aPKC во всех нейронах на активность синапсов у самок. Число зон активных синаптических контактов сравнивали у гибридов от скрещивания между линией-драйвером Д1 и линиями с трансгенами. Описание генотипов см. разделы “Материалы и методы” и “Результаты”. Препарат нейромышечных связок личинок окрашивали антителами к пероксидазе хрена, маркеру пресинаптических мембран, и белку Bruchpilot, специфичному для зон активных синаптических контактов, белые точки (а). Достоверность отличия от контрольного генотипа, t‑тест: P < 0.001 (б).
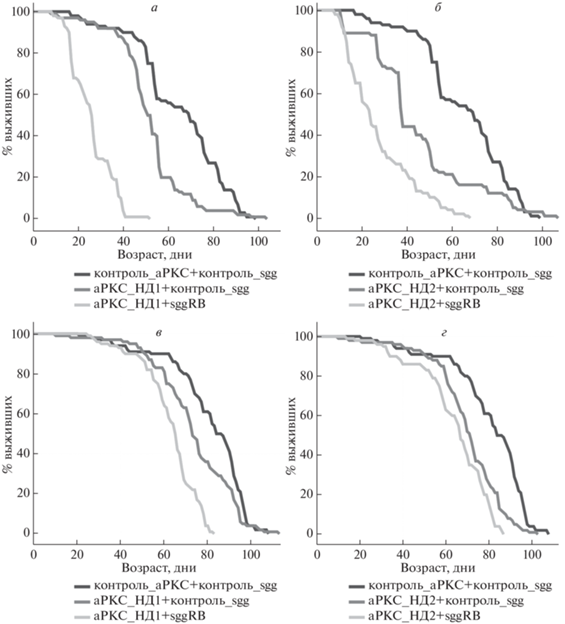
Второй подход заключался в том, что мы индуцировали экспрессию трансгенов в мотонейронах, поскольку ранее было показано, что увеличение экспрессии гена sgg в этих клетках снижает продолжительность жизни, но не так сильно, как увеличение экспрессии гена sgg во всех нейронах [13]. Оказалось, что уменьшение количества aPKC в мотонейронах снизило продолжительность жизни как самцов, так и самок, но менее значительно, чем в случае уменьшения количества aPKC во всех нейронах (на 20 и 9% в случае aPKC_НД1 и на 31 и 14% в случае aPKC_НД2; табл. 1, рис. 3). Этот эффект усилился в том случае, когда уменьшение количества aPKC в мотонейронах происходило на фоне увеличения количества GSK3 (табл. 1, рис. 3). Увеличение экспрессии GSK3 в мотонейронах само по себе также приводило к снижению средней продолжительности жизни самцов и самок [13]. Учитывая эти факты, можно заключить, что закономерности влияния нокдауна aPKC на продолжительность жизни в отсутствие и в присутствии изменений в уровне экспрессии GSK3 в мотонейронах и во всех нейронах совпали.
Рис. 3.
Влияние нокдауна гена aPKC в мотонейронах на продолжительность жизни самцов (а, б) и самок (в, г). Продолжительность жизни сравнивали у гибридов от скрещивания между линиями-драйверами Д1 или Д2 и линиями с трансгенами. Описание генотипов см. разделы “Материалы и методы” и “Результаты”.
Таким образом, изменение продолжительности жизни, вызванное нарушением экспрессии исследуемых протеинкиназ и во всех нейронах, и отдельно в мотонейронах, соответствовало как гипотезе обингибирующем действии GSK3 на aPKC, так и гипотезе об их независимом, аддитивном влиянии на исследуемый признак. Влияние GSK3 на aPKC и совместное действие двух протеинкиназ на продолжительность жизни было одинаковым у самцов и самок.
Средняя продолжительность жизни самцов и самок с увеличенной экспрессией GSK3 в мотонейронах составила 65 и 75% от средней продолжительности жизни соответствующего контроля [13]; средняя же продолжительность жизни самцов и самок с увеличенной экспрессией GSK3 на фоне уменьшенной экспрессии aPKC в мотонейронах составила 55 и 88% от средней продолжительности жизни соответствующего контроля. Таким образом, увеличение экспрессии GSK3 на фоне нокдауна гена aPKC в мотонейронах самцов привело к усилению отрицательного влияния на продолжительность жизни. Этот результат соответствует как гипотезе о том, что aPKC является ингибитором GSK3, так и гипотезе об аддитивности эффектов двух протеинкиназ. У самок со сниженной экспрессией aPKC в мотонейронах наблюдалось определенное смягчение отрицательного влияния увеличенной экспрессии GSK3 на продолжительность жизни. Такой результат невозможно объяснить независимым, аддитивным действием двух исследуемых протеинкиназ. Следовательно, можно говорить о том, что влияние уровня экспрессии GSK3 в мотонейронах на продолжительность жизни самок зависит от aPKC. Однако такой результат предполагает существование какого-то сложного, возможно непрямого взаимодействия между двумя белками.
Обобщая полученные результаты, можно сказать, что изменение продолжительности жизни, вызванное нарушением экспрессии исследуемых протеинкиназ во всех нейронах самцов и самок и отдельно в мотонейронах самцов, с наибольшей вероятностью соответствовало гипотезе об ингибирующем действии GSK3 на aPKC и отсутствии влияния aPKC на GSK3. В то же время характер изменения продолжительности жизни, возникающего в результате измененной экспрессии aPKC и GSK3 в мотонейронах самок, предполагает существование пока неизвестных механизмов взаимодействия между исследуемыми протеинкиназами.
ОБСУЖДЕНИЕ
В ранее проведенных пилотных экспериментах мы показали, что снижение уровня экспрессии гена aPKC в мотонейронах приводит к уменьшению продолжительности жизни самцов [14]. В настоящей статье представлены результаты более детального изучения роли нейрональной экспрессии aPKC в контроле продолжительности жизни, которые подтвердили и существенно расширили имевшиеся данные. Как и ожидалось, уменьшение экспрессии aPKC во всех нейронах оказало большее влияние на продолжительность жизни, чем уменьшение экспрессии протеинкиназы в мотонейронах. И в том, и в другом случае степень уменьшения продолжительности жизни зависела от пола – у самцов эффект был более сильным, чем у самок. Зависимость эффекта от пола не раз была отмечена в наших работах, в том числе при изменении уровня экспрессии GSK3 [13, 14], и в работах других ученых [26], однако причины такого диморфизма пока остаются неясными.
В настоящей работе были использованы две разные линии дрозофилы, вызывающие нокдаун гена aPKC в результате РНК-интерференции. На качественном уровне влияние нокдауна aPKC, вызванного трансгенами, находящимися в разных линиях, на продолжительность жизни оказалось одинаковым. Это важно, поскольку сделанные в работе выводы основаны на двух независимых вариантах опытов. Однако на количественном уровне эффекты двух разных трансгенов различались. Такие отличия могут быть связаны с тем, что трансгены влияют на разные транскрипты гена aPKC: aPKC_НД1 – на все 12 аннотированных транскриптов (https://flybase.org/reports/FBal0323907.html), а aPKC_НД2 – только на транскрипты RG и RJ (https://flybase.org/reports/FBal0278807.html). Эта характеристика трансгенов хорошо соответствует тому факту, что индукция aPKC_НД1 во всех нейронах снизила продолжительность жизни сильнее, чем индукция aPKC_НД2. Однако индукция aPKC_НД1 в мотонейронах вызвала меньший эффект, чем индукция aPKC_НД2. Этот факт можно объяснить, если предположить, что в мотонейронах наиболее важна экспрессия именно RG и/или RJ, а aPKC_НД2 нарушает ее сильнее, чем aPKC_НД1, поскольку малые интерферирующие РНК в первом случае расходуются только на эти два транскрипта, а во втором – на все 12. Конечно, это объяснение является механистическим и нуждается в экспериментальной проверке. В целом о функциях разных транскриптов гена aPKC у дрозофилы практически ничего не известно, и для выяснения роли каждого из них нужны дальнейшие исследования.
Наиболее интересным нам представлялся вопрос о том, взаимодействуют ли между собой гены/белки aPKC/aPKC и sgg/GSK3 в ходе контроля продолжительности жизни. Роль sgg/GSK3 в контроле продолжительности жизни была подробно исследована нами ранее [12–14]. Взаимодействие между aPKC и GSK3 также было экспериментально продемонстрировано в ряде работ. Так, было убедительно показано, что у дрозофилы GSK3 способна фосфорилировать aPKC, что может приводить к ее протеасомной деградации и, таким образом, ингибированию в ходе асимметричного деления эмбриональных нейробластов [9] и клеток эмбрионального эпителия [27]. Мы предположили, что такое же взаимодействие между двумя протеинкиназами может играть роль и в контроле продолжительности жизни, участие в котором каждой из них мы уже показали. Действительно, генетические эксперименты, описанные в настоящей статье, указывают на ингибирующее действие GSK3 на aPKC и в этом случае. В ходе контроля асимметричного деления клеток и клеточной полярности GSK3 взаимодействует с aPKC, находящейся в комплексе Par6–Baz–aPKC. Связано ли совместное влияние GSK3 и aPKC на продолжительность жизни с этим комплексом остается пока неясным.
В ряде опубликованных работ можно найти указания на то, что aPKC, в свою очередь, также способна фосфорилировать аминокислотные остатки, определяющие уровень активности GSK3, и таким образом ингибировать ее [21]. Кроме того, оказалось, что комплекс Par6–aPKC регулирует гибель и/или пролиферацию клеток: нарушение экспрессии Par6 подавляет aPKC и повышает активность ее мишени, GSK3, приводя к усилению апоптоза [28]. Наши генетические эксперименты, однако, не выявили ингибирующего действия aPKC на GSK3 в ходе контроля продолжительности жизни. Возможно, участие aPKC и GSK3 в контроле продолжительности жизни не связано с их взаимодействием с Par6–aPKC-комплексом. Стоит отметить также, что наши эксперименты позволяют оценить взаимодействие aPKC и GSK3 не в норме, а в условиях подавления/усиления экспрессии кодирующих их генов. Нельзя исключить, что в этом случае характер взаимодействия двух белков может отличаться от нормального. Правда, и в упомянутых выше работах других авторов взаимодействие белков было проанализировано у особей с измененным уровнем их экспрессии.
Мы показали, что уменьшение уровня экспрессии aPKC в нервной системе приводит к уменьшению продолжительности жизни, но пока неясно, каким может быть эффект увеличения уровня экспрессии aPKC. Известны гены (например, кодирующие белки, участвующие в детоксификации активных форм кислорода), увеличение экспрессии которых приводит к увеличению продолжительности жизни (https://genomics.senescence.info/genes/index.html). Кажется наиболее вероятным, однако, что любое сильное нарушение экспрессии генов, кодирующих такие многофункциональные белки как aPKC и GSK3, должно приводить к многочисленным сбоям в работе клеток и уменьшению продолжительности жизни. В то же время можно ожидать, что небольшие изменения экспрессии этих генов могут быть связаны с тонкой перенастройкой работы клеток и увеличением продолжительности жизни, Так, ранее мы показали, что небольшое снижение активности GSK3 в дофаминэргических нейронах связано с увеличением продолжительности жизни самок [14]. Можно предположить, что увеличение уровня экспрессии aPKC в дофаминэргических нейронах самок приведет к частичному ингибированию активности GSK3 и вследствие этого к увеличению продолжительности жизни. Экспериментальная проверка этого предположения позволит лучше понять, влияет ли aPKC на GSK3 в процессе контроля продолжительности жизни.
Регуляция механизмов клеточной полярности является одним из наиболее охарактеризованных процессов, в которых взаимодействуют GSK3 и aPKC, в том числе фосфорилируя общие мишени, такие как белок Par-1. На локализацию белка Par-1, вовлеченного в определение полярности клеточных компонентов Baz и Par-6 в эпителиальных клетках и ооцитах плодовой мушки, влияет фосфорилирование протеинкиназой aPKC [29]; одновременно с этим Par-1 является непосредственной мишенью фосфорилирования GSK3 [30]. Par-1 претендует на роль связующего звена между GSK3 и aPKC и в других молекулярных процессах, таких как Wnt-каскад [31]. В процессе регуляции работы ассоциированных с микротрубочками белков (MAP) одной из мишеней фосфорилирования киназами Par-1 и GSK3 является белок Tau [32, 33]. Стоит отметить, что белок Таu является одной из перспективных мишеней в изучении молекулярных основ ассоциированных со старением заболеваний нервной системы.
В настоящее время сведения о взаимодействии aPKC и GSK3 носят достаточно ограниченный характер и касаются их совместной работы лишь в ходе регуляции отдельных процессов. Тем не менее даже имеющиеся факты свидетельствуют о том, что взаимодействие между aPKC и GSK3 может быть достаточно сложным и неоднозначным. Наши генетические эксперименты также свидетельствуют о том, что в мотонейронах самок, например, взаимодействие между aPKC и GSK3 может быть достаточно сложным. Исследование влияния уровня экспрессии aPKC и GSK3 в мотонейронах самок на продолжительность жизни представляется особенно интересным, поскольку ранее мы показали, что небольшое увеличение активности GSK3 в них приводит к увеличению продолжительности жизни [14]. Выяснение механизмов взаимодействия между aPKC, GSK3 и другими их партнерами позволит углубить и расширить наши представления о причинах долголетия и способах продления жизни.
Мы выражаем глубокую признательность Центру культур Drosophila (Блюмингтон, США, https://bdsc.indiana.edu/index.html) за многолетнее содействие нашим исследованиям. Работа выполнена с использованием оборудования Центра коллективного пользования научным оборудованием НИЦ “Курчатовский институт” – ИМГ.
Работа была поддержана грантом РФФИ № 19-34-80042-мол_эв_а и Государственным заданием НИЦ “Курчатовский институт” – ИМГ, регистрационный № 121030200227.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
López-Otín C., Blasco M.A., Partridge L. et al. The hallmarks of aging // Cell. 2013. V. 153. № 6. P. 1194–1217. https://doi.org/10.1016/j.cell.2013.05.039
Hipp M.S., Kasturi P., Hartl F.U. The proteostasis network and its decline in ageing // Nat. Rev. Mol. Cell Biol. 2019. V. 20. № 7. P. 421–435. https://doi.org/10.1038/s41580-019-0101-y
Vilchez D., Boyer L., Morantte I. et al. Increased proteasome activity determines human embryonic stem cell identity // Nature. 2012. V. 489. № 7415. P. 304–308. https://doi.org/10.1038/nature11468
Schröter F., Adjaye J. The proteasome complex and the maintenance of pluripotency: Sustain the fate by mopping up? // Stem Cell Research & Therapy. 2014. V. 5. № 1. P. 24. https://doi.org/10.1186/scrt413
Moore D., Pilz G., Araúzo-Bravo M. et al. A mechanism for the segregation of age in mammalian neural stem cells // Science. 2015. V. 349. № 6254. P. 1334–1338. https://doi.org/10.1126/science.aac9868
Loyer N., Januschke J. Where does asymmetry come from? Illustrating principles of polarity and asymmetry establishment in Drosophila neuroblasts // Curr. Opinion in Cell Biology. 2020. V. 62. P. 70–77. https://doi.org/10.1016/j.ceb.2019.07.018
Gallaud E., Pham T., Cabernard C. Drosophila melanogaster neuroblasts: A model for asymmetric stem cell divisions // Results Probl. Cell Differ. 2017. V. 61. P. 183–210. https://doi.org/10.1007/978-3-319-53150-2_8
Shao C.Y., Crary J.F., Rhao C. et al. Atypical protein kinase C in neurodegenerative disease II: PKCiota/lambda in tauopathies and alpha-synucleinopathies // J. Neuropathol. Exp. Neurol. 2006. V. 65. № 4. P. 327–335. https://doi.org/10.1097/01.jnen.0000218441.00040.82
Colosimo P.F., Liu X., Kaplan N.A., Tolwinski N.S. GSK3beta affects apical-basal polarity and cell-cell adhesion by regulating aPKC levels // Dev. Dyn. 2010. V. 239. № 1. P. 115–125. https://doi.org/10.1002/dvdy.21963
Beurel E., Grieco S.F., Jope R.S. Glycogen synthase kinase-3 (GSK3): Regulation, actions, and diseases // Pharmacol. Ther. 2015. V. 148. P. 114–131. https://doi.org/10.1016/j.pharmthera.2014.11.016
Souder D.C., Anderson R.M. An expanding GSK3 network: Implications for aging research // Geroscience. 2019. V. 41. № 4. P. 369–382. https://doi.org/10.1007/s11357-019-00085-z
Тростников М.В., Веселкина Е.Р., Кременцова А.В. и др. Инсерционные мутации гена shaggy, кодирующего протеинкиназу GSK3, увеличивают продолжительность жизни Drosophila melanogaster // Генетика. 2019. Т. 55. № 9. С. 1099–1104. https://doi.org/10/1134/S0016675819090170
Trostnikov M.V., Roshina N.V., Boldyrev S.V. et al. Disordered expression of shaggy, the Drosophila gene encoding a serine-threonine protein kinase GSK3, affects the lifespan in a transcript-, stage-, and tissue-specific manner // Int. J. Mol. Sci. 2019. V. 20. № 9. https://doi.org/10.3390/ijms20092200
Trostnikov M.V., Veselkina E.R., Krementsova A.V. et al. Modulated expression of the protein kinase GSK3 in motor and dopaminergic neurons increases female lifespan in Drosophila melanogaster // Front. Genet. 2020. V. 11. https://doi.org/10.3389/fgene.2020.00668
Bourouis M. Targeted increase in shaggy activity levels blocks wingless signaling // Genesis. 2002. V. 34. № 1–2. P. 99–102. https://doi.org/10.1002/gene.10114
Wilmoth J.R., Horiuchi S. Rectangularization revisited: Variability of age at death within human populations // Demography. 1999. V. 36. № 4. P. 475–495.
Carey J.R. Longevity: The Biology and Demography of Lifespan. Princeton, NT: Princeton Univ. Press, 2003.
Wagh D.A., Rasse T., Asan E. et al. Bruchpilot, a protein with homology to ELKS/CAST, is required for structural integrity and function of synaptic active zones in Drosophila // Neuron. 2006. V. 49. № 6. P. 833–844. https://doi.org/10.1016/j.neuron.2006.02.008
Franco B., Bogdanik L., Bobinnec Y. et al. Shaggy, the homolog of glycogen synthase kinase 3, controls neuromuscular junction growth in Drosophila // J. Neurosci. 2004. V. 24. № 29. P. 6573–6577. https://doi.org/10.1523/JNEUROSCI.1580-04.2004
McGraw E.A., O’Neill S.L. Wolbachia pipientis: Intracellular infection and pathogenesis in Drosophila // Curr. Opin. Microbiol. 2004. V. 7. № 1. P. 67–70. https://doi.org/10.1016/j.mib.2003.12.003
Moore S.F., van den Bosch M.T.J., Hunter R.W. et al. Dual regulation of glycogen synthase kinase 3 (GSK3)α/β by protein kinase C (PKC)α and Akt promotes thrombin-mediated Integrin αIIbβ3 activation and granule secretion in platelets // J. Biol. Chem. 2013. V. 288. № 6. P. 3918–3928. https://doi.org/10.1074/jbc.M112.429936
Hapak S.M., Rothlin C.V., Ghosh S. aPKC in neuronal differentiation, maturation and function // Neuronal Signal. 2019. V. 3. № 3. P. NS20190019. https://doi.org/10.1042/NS20190019
Cuesto G., Jordán-Álvarez S., Enriquez-Barreto L. et al. GSK3β inhibition promotes synaptogenesis in Drosophila and mammalian neurons // PLoS One. 2015. V. 10. № 3. P. e0118475. https://doi.org/10.1371/journal.pone.0118475
Chiang A., Priya R., Ramaswami M. et al. Neuronal activity and Wnt signaling act through Gsk3-beta to regulate axonal integrity in mature Drosophila olfactory sensory neurons // Development. 2009. V. 136. № 8. P. 1273–1282. https://doi.org/10.1242/dev.031377
Ruiz-Cañada C., Budnik V. Introduction on the use of the Drosophila embryonic/larval neuromuscular junction as a model system to study synapse development and function, and a brief summary of pathfinding and target recognition // Int. Rev. Neurobiol. 2006. V. 75. P. 1–31. https://doi.org/10.1016/S0074-7742(06)75001-2
Tower J. Sex-specific gene expression and lifespan regulation // Trends Endocrinol. Metab. 2017. V. 28. № 10. P. 735–747. https://doi.org/10.1016/j.tem.2017.07.002
Kaplan N.A., Colosimo P.F., Liu X., Tolwinski N.S. Complex interactions between GSK3 and aPKC in Drosophila embryonic epithelial morphogenesis // PLoS One. 2011. V. 6. № 4. P. e18616. https://doi.org/10.1371/journal.pone.0018616
Kim M., Datta A., Brakeman P. et al. Polarity proteins PAR6 and aPKC regulate cell death through GSK-3β in 3D epithelial morphogenesis // J. Cell Sci. 2007. V. 120. № 14. P. 2309–2317. https://doi.org/10.1242/jcs.007443
Jiang H., McKinley R.F.A., McGill M.A. et al. Both the establishment and the maintenance of neuronal polarity require active mechanisms: Critical roles of GSK-3β and its upstream regulators // Cell. 2005. V. 120. № 1. P. 123–135. https://doi.org/10.1016/j.cell.2004.12.033
Kosuga S., Tashiro E., Kajioka T. et al. GSK-3beta directly phosphorylates and activates MARK2/PAR-1 // J. Biol. Chem. 2005. V. 280. № 52. P. 42715–42722. https://doi.org/10.1074/jbc.M507941200
Sun T.Q., Lu B., Feng J.J. et al. PAR-1 is a Dishevelled-associated kinase and a positive regulator of Wnt signalling // Nat. Cell Biol. 2001. V. 3. № 7. P. 628–636. https://doi.org/10.1038/35083016
Nance J., Zallen J.A. Elaborating polarity: PAR proteins and the cytoskeleton // Development. 2011. V. 138. № 5. P. 799–809. https://doi.org/10.1242/dev.053538
Nishimura I., Yang Y., Lu B. PAR-1 kinase plays an initiator role in a temporally ordered phosphorylation process that confers tau toxicity in Drosophila // Cell. Elsevier. 2004. V. 116. № 5. P. 671–682. https://doi.org/10.1016/s0092-8674(04)00170-9
Дополнительные материалы отсутствуют.


