Генетика, 2023, T. 59, № 3, стр. 316-326
Генетическое разнообразие можжевельника обыкновенного (Juniperus communis L.) в Евразии и на Аляске по данным анализа ядерных микросателлитов
Е. В. Хантемирова 1, *, В. А. Бессонова 1
1 Институт экологии растений и животных Уральского отделения
Российской академии наук
620144 Екатеринбург, Россия
* E-mail: hantemirova@ipae.uran.ru
Поступила в редакцию 25.04.2022
После доработки 16.09.2022
Принята к публикации 27.09.2022
- EDN: INZGJC
- DOI: 10.31857/S0016675823030050
Аннотация
Изучена структура генетической изменчивости можжевельника обыкновенного (Juniperus communis L.), широко распространенного голарктического ветроопыляемого кустарника семейства Cupressaceae. Для генотипирования выборок из 23 популяций этого вида со всего ареала в Евразии и одной популяции из Северной Америки (Аляска) использовали семь ядерных микросателлитных локусов, три из которых были применены для данного вида впервые. Географические закономерности распределения генетической изменчивости интерпретируются в сравнении с нашими предыдущими данными по изменчивости хпДНК. Получены такие же высокие значения генетического разнообразия, с максимальными показателями в северных популяциях (Швеция, Эстония, Мезень, Полярный Урал, Ямал, Колыма, а также Альпы), но более низкий уровень межпопуляционной дифференциации (FST = 9.8% для ядерных маркеров, FST = 76% для хлоропластных). С помощью байесовского кластерного анализа было установлено, что оптимальное число генетических групп (K) равно двум. Все 24 популяции J. communis делятся на восточную группу (северо-восток и Дальний Восток России, Аляска и Гималаи) и западную группу (Европа, Урал и Сибирь). Для популяций из Альп и Горной Шории характерно сочетание генотипов из разных генетических групп.
Холодостойкие кустарниковые виды растений играли важную роль в фитоценозах в прошлые геологические эпохи Земли, да и теперь имеют огромное значение в сложении растительного покрова северных и горных территорий, укреплении, обогащении почв и создании условий для будущих стадий сукцессий при возможных изменениях климата. При этом исследований их филогеографии и генетической изменчивости проведено гораздо меньше, чем для лесообразующих видов деревьев.
Известно, что на распределение генетической изменчивости внутри видов растений значительно влияли плейстоценовые колебания климата [1, 2]. В период похолодания некоторые адаптированные к холоду виды деревьев и кустарников Северного полушария не ограничивались южными ледниковыми рефугиумами, а сохраняли довольно обширные популяции вблизи ледниковых щитов [3]. Эти популяции расширяли свои ареалы во время теплых стадий и обладали значительным потоком генов [4].
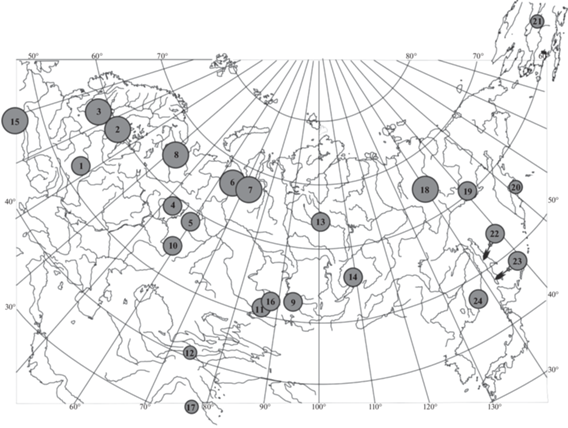
Одним из таких видов, которые могли выживать во время холодных эпизодов плейстоцена в высоких широтах в Северной Европе во многих перигляциальных микрорефугиумах, является можжевельник обыкновенный Juniperus communis L. Этот холодостойкий бореально-арктический хвойный кустарниковый вид из семейства Cupressaceae занимает обширный ареал благодаря широкой экологической толерантности, морфологической пластичности и эффективному способу распространения семян. Основная часть его ареала находится на территории России, которая обладает значительными, еще недостаточно изученными биологическими ресурсами этого ценного вида (рис. 1). Целебные свойства этого вечнозеленого кустарника были известны в древности. В настоящее время в его растительном сырье обнаружено большое количество терпенов, полифенолов и их производных, доказана его антиоксидантная, противомикробная, противовоспалительная, противораковая, нейропротекторная и гепатопротекторная активность и отмечен огромный потенциал применения этого вида в различных областях медицины [5].
Рис. 1.
Географическое распределение главных генетических групп J. communis по результатам анализа STRUCTURE. Номера популяций такие же, как в табл. 1. Каждая популяция разделена на два цветных сегмента пропорционально ее принадлежности к данной группе. Серым цветом выделен ареал вида.

Широкое географическое распространение J. communis L. при большом экологическом диапазоне вызвало образование разнообразных жизненных форм (от стлаников до деревьев). С полиморфизмом этого вида связаны и трудности во внутривидовой таксономической классификации. На территории Евразии прямостоячую форму этого вида, свойственную подлеску хвойных и лиственных лесов, принято относить к J. сommunis var. communis L., а кустовидную форму разной степени полегания – к J. communis var. saxatilis Pall. (=J. sibirica Burgsd, J. nana Willd., J. alpina S.F. Gray, J. pygmaea K. Koch., J. montana (Aiton) Lindl. & Gordon) [6]. Обе разновидности имеют сходные морфологические признаки и перекрывающийся ареал. На территории Северной Америки выделяют еще одну разновидность J. communis var. depressa Pursh. Из-за отсутствия четких разграничивающих признаков у этих разновидностей мы рассматриваем здесь J. communis sensu lato, т.е. в широком смысле.
Генетические исследования J. communis с помощью разных методов проводились большей частью в популяциях на территории Европы, где этот вид значительно сократил численность и подвергся антропогенной фрагментации [7, 8]. При этом во всех популяциях этого вида в Дании [9], Польше [10], в Ирландии [11] и Англии [12] был обнаружен высокий уровень генетической изменчивости, причем нередко даже внутри небольших фрагментарных популяций. С помощью анализа AFLP было показано, что даже маленькие реликтовые популяции J. communis на юге Англии (некоторые из них насчитывают около 11 растений) обладают высоким уровнем генетической изменчивости [12]. Высокий уровень межпопуляционной дифференциации, обнаруженный в этой же работе, авторы связывают с заселением острова можжевельником из трех разных источников, с последующей изоляцией и уменьшением размера популяций. Во всех других работах была выявлена низкая степень дифференциации, что свидетельствует о значительном генном потоке. Низкая генетическая дифференциация и высокое внутрипопуляционное разнообразие характерны для многих голосеменных растений и связаны с такими чертами их жизненного цикла как двудомность, ауткроссинг, ветроопыление, долгая продолжительность жизни [13].
Польскими исследователями [14] для этого вида были разработаны высокоизменчивые ядерные микросателлитные маркеры. Они были применены для изучения генетической изменчивости в редуцированных фрагментарных популяциях можжевельника на территории Европы, в Германии [15] и Бельгии [16]. С помощью этих маркеров в большинстве популяций также обнаружены высокое внутрипопуляционное генетическое разнообразие и низкая степень межпопуляционной дифференциации. В целом ядерные микросателлиты не выявили в европейских популяциях можжевельника какой-либо филогеографической структуры. В то же время в этих популяциях обнаружены высокие положительные значения коэффициента инбридинга. Связано ли это с наличием нуль-аллелей в большинстве локусов или с какими-то другими факторами – осталось непонятно.
Исследование внутривидовой изменчивости растений разными методами имеет большое теоретическое и практическое значение для решения проблем происхождения и эволюции видов, оценки их генетических ресурсов и эволюционного потенциала, а также для разработки правильных мер по охране и рациональному использованию видов.
В предыдущей работе мы изучили генетическую изменчивость этого вида с помощью хлоропластных маркеров в широком географическом контексте в природных ненарушенных популяциях в Евразии и частично в Северной Америке и выявили дифференциацию дальневосточных и центрально-азиатских популяций. Распределение генетической изменчивости по всему ареалу позволило нам выдвинуть некоторые гипотезы относительно плейстоценовой динамики вида [17]. В настоящей работе те же выборки можжевельника обыкновенного со всего ареала мы анализируем с помощью ядерных микросателлитов (SSR-маркеров).
Для этого мы используем высокоизменчивые микросателлитные локусы, разработанные польскими исследователями [14], дополнив их новыми, разработанными для других видов можжевельников и протестированными нами на J. communis.
В настоящей работе мы ставим своей целью оценить географические закономерности распределения генетического разнообразия и степень дифференциации популяций можжевельника обыкновенного на всем ареале в Евразии и частично в Северной Америке (Аляске) с помощью мультилокусного генетического анализа ядерных микросателлитов.
МАТЕРИАЛЫ И МЕТОДЫ
Мультилокусный генетический анализ с помощью ядерных микросателлитов был проведен на образцах ДНК J. communis из большей части тех же популяций, что и в исследовании хпДНК [17]. Изучены 24 популяции можжевельника (23 популяции в Евразии и одна в Северной Америке, на Аляске) (табл. 1, рис. 1). Всего прогенотипировано 363 образца, примерно по 16 образцов из каждой популяции. Микросателлитные локусы Jc16, Jc031, Jc032, Jc035, Jc037, разработанные для этого вида [14], были протестированы на нескольких образцах. Локус Jc037 исключен из-за нестабильной амплификации и трудности с интерпретацией аллелей. Кроме того, на J. communis были протестированы 9 пар праймеров, разработанных для J. przewalskii [18], и 13 пар праймеров – для J. cedrus [19] на предмет изменчивости и стабильности амплификации. Для этого на восьми образцах ДНК из двух популяций J. communis из разных географических точек проводили ПЦР-амплификацию с немечеными олигонуклеотидами, затем визуализировали продукты реакции на акриламидных гелях с серебряным окрашиванием. Шесть локусов, разработанных для J. cedrus (Jce01, Jce09, Jce10, Jce11, Jce12 и Jce13), оказались изменчивы также и для J. communis. Из них были отобраны три локуса Jce01, Jce10 и Jce13, которые лучше всего амплифицировались. В итоге отобрано семь локусов, из которых был составлен мультиплекс с учетом температуры отжига праймеров, сочетания флуоресцентного красителя и длины продукта (табл. 2). Использовалась следующая программа ПЦР: 5 мин при 95°C, затем 35 циклов: 30 с при 95°C, 90 с при 57°C или 61°C, 90 с при 72°C и 30 мин при 72°C. Для локуса Jc032 использовали протокол с понижением температуры отжига [14]. ПЦР-продукт разводили в 5 раз. 1 мкл разбавленного ПЦР-продукта смешивали с 8.5 мкл формамида и 0.5 мкл размерного стандарта или маркера молекулярной массы S-450 (Гордиз). Длины амплифицированных фрагментов определяли на НАНОФОР-05. Хроматограммы расшифровывались в программе GeneMapper v4.0 сначала автоматически, а затем проверялись вручную.
Таблица 1.
Показатели генетического разнообразия в 24 популяциях J. communis
| № | Местонахождение | Широта/долгота | Высота над ур. моря, м | N | Nа | I | HO | HE | F |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Беларусь | N 54°46′/E 26°49′ | 170 | 16 | 7.14 | 1.56 | 0.453 | 0.737 | 0.319 |
| 2 | Таллинн | N 57°27′/E 24°52′ | 22 | 16 | 8.43 | 1.73 | 0.480 | 0.779 | 0.388 |
| 3 | Упсала | N 59°53′/E 17°36′ | 21 | 16 | 8.43 | 1.67 | 0.507 | 0.756 | 0.310 |
| 4 | Удмуртия | N 57°31′/E 52°32′ | 150 | 16 | 7.57 | 1.58 | 0.472 | 0.708 | 0.270 |
| 5 | Полевской | N 56°25′/ E 60°11′ | 403 | 10 | 5.88 | 1.45 | 0.440 | 0.723 | 0.307 |
| 6 | Полярный Урал | N 66°51′/E 65°20′ | 547 | 16 | 8.27 | 1.76 | 0.534 | 0.796 | 0.313 |
| 7 | П-ов Ямал | N 67°11′/E 71°15′ | 3 | 16 | 8.71 | 1.80 | 0.532 | 0.807 | 0.337 |
| 8 | Мезень | N 65°18′/E 43°56′ | 22 | 17 | 8.86 | 1.75 | 0.423 | 0.760 | 0.467 |
| 9 | Ергаки | N 53°08′/E 92°56′ | 1750 | 15 | 6.0 | 1.44 | 0.332 | 0.710 | 0.523 |
| 10 | Зюраткуль, Южный Урал | N 54°56′/E 59°11′ | 943 | 16 | 7.14 | 1.54 | 0.606 | 0.716 | 0.114 |
| 11 | Алтай, Телецкое оз. | N 51°46′/E 87°17′ | 790 | 16 | 6.14 | 1.39 | 0.428 | 0.691 | 0.311 |
| 12 | Тянь-Шань, Киргизия | N 42°35′/E 74°29′ | 2000 | 16 | 5.57 | 1.26 | 0.440 | 0.628 | 0.306 |
| 13 | Тура | N 64°17′/E 100°17′ | 353 | 17 | 6.57 | 1.51 | 0.316 | 0.730 | 0.563 |
| 14 | Северо-Байкальск | N 55°42′/E 109°04′ | 536 | 16 | 5.71 | 1.32 | 0.414 | 0.640 | 0.322 |
| 15 | Альпы | N 46°30′/E 14°45′ | 1759 | 14 | 8.71 | 1.75 | 0.519 | 0.790 | 0.319 |
| 16 | Горная Шория | N 52°55′/E 88°00′ | 1570 | 16 | 5.14 | 1.33 | 0.459 | 0.693 | 0.314 |
| 17 | Гималаи | N 31°06′/E 77°10′ | 3300 | 15 | 4.29 | 1.01 | 0.332 | 0.537 | 0.324 |
| 18 | Колыма | N 63°26′/E 140°38′ | 1025 | 11 | 7.14 | 1.68 | 0.560 | 0.794 | 0.294 |
| 19 | Магадан | N 59°34′/E 151° 7′ | 30 | 16 | 6.57 | 1.50 | 0.360 | 0.724 | 0.480 |
| 20 | Камчатка | N 56°01′/E 161°11′ | 50 | 16 | 5.00 | 1.16 | 0.328 | 0.600 | 0.419 |
| 21 | Аляска, Сев. Америка | N 64°50′/E 147°40′ | 135 | 16 | 4.43 | 0.98 | 0.369 | 0.523 | 0.286 |
| 22 | Палево, центр. часть о-ва Сахалин | N 50°34′/E 142°42′ | 189 | 16 | 6.57 | 1.52 | 0.341 | 0.751 | 0.523 |
| 23 | Невельск, юж. часть о-ва Сахалин | N 46°40′/E 141°51′ | 6 | 8 | 5.86 | 1.48 | 0.551 | 0.751 | 0.195 |
| 24 | Сихоте-Алинь | N 45°48′/E 136°36′ | 1392 | 16 | 6.7 | 1.37 | 0.387 | 0.676 | 0.471 |
| Среднее | 6.69 | 1.48 | 0.440 | 0.708 | 0.355 | ||||
Таблица 2.
Характеристика семи микросателлитных локусов, используемых для J. communis
| Локус | Мотив | Размер фрагмента, пн* | Ta, °C* | Число аллелей | Размер фрагмента, пн** | Ta, °C** | Литературный источник |
|---|---|---|---|---|---|---|---|
| Jc035 F: FAM | (CA)20 | 131–167 | 50 | 24 | 127–172 | 57 | [14] |
| Jce01 F: FAM | (AAACCT)6 | 220–251 | 61 | 7 | 227–269 | 61 | [19] |
| Jce10 F: FAM | (ATC)10 | 292–301 | 61 | 10 | 266–293 | 61 | [19] |
| Jc016 F: HEX | (GT)24 | 118–154 | 50 | 24 | 118–172 | 57 | [14] |
| Jc031 F: HEX | (CA)15 | 174–242 | 50 | 32 | 174–242 | 57 | [14] |
| Jc032 F: ROX | (AC)14(ATC)8 | 158–224 | 50 | 44 | 172–242 | 57 | [14] |
| Jce13 F: TAMRA | (CATA)12 | 170–200 | 55 | 16 | 174–230 | 57 | [19] |
С помощью программ GenAlex v6.5 и Arlequin v3.5.2 вычисляли следующие параметры генетической изменчивости: среднее число аллелей на локус (Na), число уникальных аллелей, процент полиморфных локусов (%P), индекс Шеннона (I), наблюдаемая (HO) и ожидаемая (HE) гетерозиготность, индекс фиксации (F), коэффициент генетической дифференциации среди популяций (FST). Тест на равновесие Харди–Вайнберга (HWE) был выполнен с помощью GENEPOP v4.2 [20]. Частоту нулевых аллелей оценивали с помощью метода Брукфилда [21], реализованного в программном обеспечении MICRO-CHECKER 2.2.3 [22]. С помощью пакета программ Arlequin v3.5.1.2 [23] определяли уровень дифференциации и распределение генетической изменчивости между группами гаплотипов (анализ молекулярной вариации, AMOVA). Значение FST было получено для измерения молекулярной дивергенции между популяциями и группами популяций.
Несколько подходов были использованы для изучения популяционной структуры и филогенетического анализа можжевельника обыкновенного. Сначала с помощью анализа главных координат в GENALEX 6.5 была проведена кластеризация популяций на основе матрицы парных генетических дистанций (DA) [24]. Затем оценивался вклад генотипов в каждую изучаемую популяцию на основе байесовского подхода с алгоритмом MCMC (цепь Маркова Монте-Карло) с помощью STRUCTURE 2.3.4 [25]. Наиболее вероятное количество кластеров оценивалось на основе апостериорной вероятности данных для заданного K и проводилось с помощью STRUCTURE HARVESTER методом Evanno [26]. Для идентификации популяционных кластеров был также использован пространственный анализ молекулярной изменчивости (SAMOVA v1.0) [27]. Корреляцию между генетическим и географическим расстояниями для пар выборок анализировали посредством теста Мантела [28].
РЕЗУЛЬТАТЫ
При анализе изменчивости семи микросателлитных локусов в 24 популяциях J. communis выявлено 157 аллельных вариантов. Большинство локусов были полиморфными во всех выборках. Средний процент полиморфных локусов в популяциях составляет 99.32. Наиболее изменчив локус Jc032 (44 варианта аллелей), наименее – Jce01 (7 вариантов аллелей). Общее число уникальных аллелей составило 35.
В популяциях J. communis обнаружено высокое генетическое разнообразие (HE = 0.523–0.807). Причем наиболее высокие значения наблюдаются в северных популяциях – Уппсале, Эстонии, Мезени, Полярном Урале, Ямале, Колыме, а также в Альпах (табл. 1, рис. 2). В альпийской выборке присутствует также наибольшее число уникальных аллелей (6).
Рис. 2.
Показатели генетического разнообразия HE в 24 популяциях J. communis по данным изменчивости SSR-маркеров. Размер окружностей пропорционален уровню изменчивости: минимальный размер соответствует HE= 0.52–0.63, средний – 0.64–0.75, максимальный – 0.76–0.81.
Во всех микросателлитных локусах, кроме Jc035, обнаружены нуль-аллели. Во всех популяциях наблюдаются отклонения от Харди–Вайнберга c дефицитом гетерозигот. Значения F высокоположительные, варьирующие от 0.114 до 0.563.
Степень генетической дифференциации между всеми анализируемыми популяциями (FST = 9.8%) невысока по сравнению с той, что была выявлена при изучении изменчивости хпДНК (FST = 76%) [17], но примерно соответствует среднему значению, указанному для бипарентально наследуемых маркеров у хвойных видов (11.6%) [1].
Согласно тесту Мантела генетические расстояния между всеми изученными популяциями J. communis, основанные на частотах SSR-маркеров, достоверно коррелировали с географическими расстояниями между выборками (r = 0.574, p = 0.01). Однако пространственный анализ молекулярной изменчивости (SAMOVA v1.0) дифференцирует от всех остальных только две наиболее географически удаленные популяции – из Гималаев и с Аляски.
Оценка данных STRUCTURE методом Evanno показала, что оптимальное число генетических групп K равно двум, дельта K = 93.78. В восточном кластере кроме популяций Дальнего Востока России оказывается также гималайская популяция и популяция с Аляски (рис. 1), в западном – все европейские и урало-сибирские популяции. Две дополнительные подгруппы K = 4 (21.53) выделяют гималайскую популяцию вместе с популяцией из Горной Шории и Тянь-Шаня.
В результате анализа главных координат, основанного на генетических дистанциях Нея между выборками (рис. 3,а), все популяции разделились по первой главной координате (44.5% от общей изменчивости) на две большие группы: 1 – популяции восточного края ареала в Евразии, а также популяции Аляски и Альп; 2 – все остальные европейско-урало-сибирские популяции. Значительно отделена ото всех популяция с Гималаев. Разделение популяций можжевельника по второй главной координате не такое значительное. Можно только отметить близость популяции Приморья (Сихоте-Алинь) с югом Сахалина (Невельск), популяции Камчатки с Аляской, популяции северо-востока России (Колыма, Магадан) с севером Сахалина (Палево).
Рис. 3.
Ординация популяций J. communis методом главных координат (PCoA) на основании генетических дистанций Нея. а – все популяции, б – популяции западной генетической группы.

Однако если обширную вторую группу, включающую популяции с территории Европы, Урала и Сибири, анализировать отдельно (рис. 3,б), то выявляется некая внутренняя дифференциация. В результате анализа главных координат отделяются популяции Центральной Азии (Тянь-Шань вместе с Алтаем) и Южного Урала (Зюраткуль). Близки между собой популяции Северной Европы (Швеция, Эстония, Мезень), а также популяции с Ямала и Полярного Урала. SAMOVA также выделяет горные популяции Тянь-Шаня и Южного Урала в отдельные группы. Однако дифференциация во всей этой группе слабая (FST = 5.6%). Нет корреляции между генетическими и географическими дистанциями (r = 0.013, p = 0.47).
В некоторых популяциях (из Альп, Горной Шории и с юга Сахалина) наблюдается смешанный состав особей. Альпийская популяция по генетическим дистанциям Нея ближе всего к популяциям восточного края ареала (рис. 3,а). Однако согласно байесовскому анализу в этой популяции есть и особи, принадлежащие к западной группе, причем в преобладающем количестве (рис. 1). В популяции из Горной Шории преобладает доля особей восточной генетической группы, но есть особи из западной группы.
Основной вклад в дифференциацию всех популяций вносят локусы Jce01 и Jce13, разработанные для J. cedrus и которые впервые применены в настоящей работе для J. communis (табл. 3). При использовании только маркеров, разработанных для J. communis Михальчик с соавт. [14], не было дифференциации даже в пределах всего ареала (за исключением Гималаев), что свидетельствует о малой пригодности этих маркеров для филогеографических исследований, несмотря на их высокую изменчивость.
Таблица 3.
Значения показателей FIS, FIT, FST
| Локус | N | FIS | FIT | FST |
|---|---|---|---|---|
| Jc016 | 24 | 0.496 | 0.574 | 0.155 |
| Jc031 | 32 | 0.431 | 0.508 | 0.134 |
| Jc032 | 44 | 0.174 | 0.284 | 0.133 |
| Jc035 | 24 | 0.084 | 0.177 | 0.101 |
| Jce01 | 7 | 0.502 | 0.630 | 0.256 |
| Jce10 | 10 | 0.428 | 0.491 | 0.111 |
| Jce13 | 16 | 0.495 | 0.652 | 0.311 |
| Среднее | 0.373 ± 0.065 | 0.474 ± 0.068 | 0.172 ± 0.030 |
ОБСУЖДЕНИЕ
Таким образом, в исследованных популяциях J. communis мы наблюдаем высокое внутрипопуляционное разнообразие. Средние показатели сравнимы с теми, что обнаружены в европейских фрагментированных далеко отстоящих друг от друга популяциях в Нидерландах [9], Великобритании [12], Саксонии [15] и Бельгии [16], что может свидетельствовать о происхождение последних от исторически больших и взаимосвязанных популяций [29]. И, вероятно, время, прошедшее с начала фрагментации, было слишком коротким, чтобы иметь какие-либо демографическо-генетические последствия для такого долгоживущего вида как можжевельник.
В этих европейских популяциях можжевельника обнаружены также высокие положительные значения коэффициентов инбридинга, указывающие на дефицит гетерозигот [9, 15, 16]. Удивительно, что приблизительно такие же значения этого показателя получены и в настоящем исследовании даже в наиболее многочисленных, не испытывающих антропогенного влияния популяциях Ямала и Полярного Урала. Наличие нулевых аллелей влияет на значения коэффициента инбридинга, но не на общую генетическую структуру. Вероятно, какие-то другие факторы вносят свой вклад в наблюдаемую закономерность с коэффициентами инбридинга у J. communis. Есть мнение, что это явление характерно для многих видов семейства Cupressaceae [30]. Это также может быть связано с неоднородным пространственным распределением особей (эффект Валунда) [31].
Филогеографическая структура можжевельника обыкновенного, выявленная с помощью SSR-маркеров, в целом совпадает с результатами, полученными нами с помощью хлоропластных маркеров, но с меньшей степенью дифференциации. Фактически все популяции делятся на две большие группы – восточную (Гималаи, Дальний Восток России, Аляска) и европейско-урало-сибирскую.
Именно восточная группа вносит основной вклад в дифференциацию ядерных локусов на всем евразийском ареале. В плейстоценовой истории этой территории, которую еще называют Северной Пацификой, было несколько периодов оледенения, но все они были не покровными, а горно-долинными, поэтому растения могли сохраняться в местных рефугиумах [32]. Кроме того, с запада эта территория изолирована горными хребтами (Верхоянский хребет, Становой хребет и Джугджурские горы, Большой Хинганский хребет). Поэтому в этой части ареала многие виды растений и животных обладают значительным генетическим своеобразием. Это показано для ольховника [33], для Larix spp. [34] и леммингов Myopus schisticolor [35].
Происхождение восточной группы у можжевельника, вероятно, связано с дивергенцией и миграциями из Тибетского плато и прилегающих регионов в направлении на северо-восток Азии по непрерывным горным системам, соединяющим Центральную и Северную Азию. Этим можно объяснить близость популяции можжевельника с Гималаев и всех северо-восточных популяций, нахождение их в одной группе в байесовском анализе. Тибетское плато и прилегающие регионы являются важным центром биоразнообразия в мире из-за высокого видового богатства и обилия эндемичных видов [36]. Эти регионы является важной областью происхождения и дифференциации для таксонов с межконтинентальным разобщением [37]. Многие широко распространенные группы растений умеренного пояса Северного полушария, имеющие наибольшую диверсификацию в горных районах Азии, возникли в QTP и прилегающих высокогорьях прежде чем мигрировать в другие регионы Северного полушария и подвергнуться дивергенции [38, 39].
С помощью ядерных маркеров мы подтвердили существование одной большой группы европейских и урало-сибирских популяций с низкой степенью дифференциации. При этом и по хлоропластным, и по ядерным маркерам наиболее высокие значения генетического разнообразия наблюдались в северных популяциях. Этот факт, а также отсутствие в этой группе корреляции между генетической структурой и географической свидетельствуют в пользу перигляциального выживания J. communis на территории Центральной и Северной Европы, о чем также свидетельствуют результаты Михальчик с соавт. [40]. Генетическая однородность этой группы может быть связана с древним расселением можжевельника из какого-то одного источника, возможно Альп, с дальнейшим выживанием во время LGM в северной части современного ареала во множестве микрорефугиумов.
С помощью ядерных маркеров была выявлена дифференциация горных популяций Центральной Азии (Алтая, Тянь-Шаня), но по сравнению с результатами по хлоропластным маркерам она была значительно слабее. В то же время в отличие от результатов анализа изменчивости хпДНК с помощью ядерных маркеров удалось показать дифференциацию горной популяции J. communis с Южного Урала.
Смешанный состав генотипов в альпийской популяции и популяции из Горной Шории позволяет предположить, что эти популяции расположены в местах существования древних рефугиумов. В результате анализа изменчивости хпДНК в альпийских популяциях также были обнаружены гаплотипы из разных генетических линий [17]. Палеоэкологические и филогеографические данные доказали существование ледниковых рефугиумов вдоль юго-западной, южной, восточной и северной границы Альп [41]. В исследовании Pinus sibirica группу из Горной Шории также рассматривают как наиболее древнюю [42].
Хотя настоящее исследование сосредоточено на евразийской истории J. communis var. saxatilis и J. communis var. communis, некоторые выводы удалось сделать относительно J. communis var. depressa из Северной Америки. Ядерные маркеры в отличие от хлоропластных не отделили популяцию можжевельника с Аляски от северо-восточных и дальневосточных популяций Евразии. Это может свидетельствовать об их относительно недавнем расхождении и/или отсутствии строгой изоляции. В периоды существования Берингийского моста суши (в миоцене до 5.5–5.4 млн лет назад [43], в плейстоцене 70 и 20 тыс. лет назад [44, 45]) пыльца можжевельника с берегов Чукотки вполне могла достигать берегов Северной Америки. Потом поток пыльцы мог прекращаться, а миграции перелетных птиц в этом направлении, установившиеся в голоцене, могли способствовать расселению на большие расстояния.
Пример подобной неконгруэнтности результатов применения разных типов генетических маркеров известен для кедрового стланика, вида растущего в тех же сообществах, что и можжевельник, и обладающего похожими экологическими требованиями. По митохондриальной филогении Pinus pumila относится к американскому кластеру [46], а хлоропластные филогении размещают его в евроазиатском кластере [47].
Таким образом, в отношении можжевельника обыкновенного можно говорить о повторяемости результатов, полученных при помощи разных систем маркеров. Применение ядерных микросателлитов дало также некоторую дополнительную информацию. Однако этого все еще недостаточно, чтобы понять, какие эволюционные силы определили современную генетическую структуру вида, получить целостную картину плейстоценовых миграций, определить время дивергенции разных линий. Необходимы дополнительные исследования.
Мы благодарим М.А. Гурскую, А.А. Галимову, Е.А. Марчук, М.А. Полежаеву и Д.Р. Юнусову за помощь в сборе материала.
Работа выполнена в рамках Государственного задания Института экологии растений и животных УрО РАН № 122021000090-5.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Petit R.J., Aguinagalde I., de Beaulieu J.L. et al. Glacial refugia: Hotspots but not melting pots of genetic diversity // Science. 2003. V. 300. P. 1563–1565. https://doi.org/10.1126/science.1083264
Tribsch A., Stuessy T. Evolution and phylogeography of arctic and alpine plants in Europe: Introduction // Taxon. 2003. V. 52. P. 415–416. https://doi.org/10.2307/3647443
Tarasov P.E., Volkova V.S., Webb T. et al. Last glacial maximum biomes reconstructed from pollen and plant macrofossil data from northern Eurasia // J. Biogeogr. 2000. V. 27. P. 609–620. https://doi.org/10.1046/j.1365-2699.2000.00429.x
Maliouchenko O., Palmé A.E., Buonamici A. et al. Comparative phylogeography of two European birch species, Betula pendula and B. pubescens, with high level of haplotype sharing // J. Biogeogr. 2007. V. 34. P. 1601–1610. https://doi.org/10.1111/j.1365-2699.2007.01729.x
Gonçalves A., Flores-Félix J.D., Coutinho P. et al. Zimbro (Juniperus communis L.) as a promising source of bioactive compounds and biomedical activities: a review on recent trends // Int. J. Mol. Sci. 2022. V. 23. № 6. P. 3197. https://doi.org/10.3390/ijms23063197
Farjon A.A. World Checklist and Bibliography of Conifers. 2nd ed. England, The Royal Bot. Gardens: Kew, 2001. 309 p.
Clifton S.J., Ward L.K., Ranner D.S. The status of juniper Juniperus communis L. in north-east England // Biol. Conserv. 1997. V. 79. P. 67–77. https://doi.org/10.1016/S0006-3207(96)00101-2
McBride A. The status of common juniper (Juniperus communis L.) in the Scottish borders // Scottish Forestry. 1998. V. 52. P. 178–182.
Oostermeijer J.G.B., Knegt B. Genetic population structure of wind-pollinated dioecious shrub Juniperus communis in fragmented Dutch heathlands // Plant Species Biol. 2004. V. 19. P. 175–184. https://doi.org/10.1111/j.1442-1984.2004.00113.x
Filipowicz N., Piotrowski A., Ochocka R., Aszemborska M. The phytochemical and genetic survey of common and dwarf juniper (Juniperus communis and Juniperus nana) identifies chemical races and close taxonomic identity of the species // Planta Medica. 2006. V. 72. P. 850–853. https://doi.org/10.1055/s-2006-941543
Provan J., Hunter A.M., McDonald R.A. et al. Restricted gene flow in fragmented population of a wind-pollinated tree // Conserv. Genet. 2000. V. 9. № 6. P. 1521–1532. https://doi.org/10.1007/s10592-007-9484-y
Van der Merwe M., Winfield M.O., Arnold G.M., Parker J.S. Spatial and temporal aspects of the genetic structure of Juniperus communis populations // Mol. Ecol. 2000. V. 9. P. 379–386. https://doi.org/10.1046/j.1365-294x.2000.00868.x
Hamrick J.L., Godt M.J.W. Effects of life history traits on genetic diversity in plant species // Philos. Trans Roy. Soc. Lond. B Biol. Sci. 1996. V. 351(1345). P. 1291–1298. https://doi.org/10.1098/rstb.1996.0112
Michalczyk I.M., Sebastiani I.F., Buonamici A. et al. Characterization of highly polymorphic nuclear microsatellite loci in Juniperus communis L. // Mol. Ecol. Notes. 2006. V. 6. P. 346–348. https://doi.org/10.1111/j.1471-8286.2005.01227.x
Reim S., Lochschmidt F., Proft A. et al. Genetic structure and diversity in Juniperus communis populations in Saxony, Germany // Biodivers. Conserv. 2016. V. 42. P. 9–18. https://doi.org/10.1515/biorc-2016-0008
Jacquemart A.L., Buyens C., Delescaille L.-M., Rossum F.V. Using genetic evaluation to guide conservation of remnant Juniperus communis (Cupressaceae) populations // Plant Biol. 2021. V. 23. № 1. P. 193–204. https://doi.org/10.1111/plb.13188
Hantemirova E.V., Heinze B., Knyazeva S.G. et al. A new Eurasian phylogeographical paradigm? Limited contribution of southern populations of the recolonization of high latitude populations in Juniperus communis L. (Cupressaceae) // J. Biogeogr. 2017. V. 44. № 2. P. 271–282.https://doi.org/10.1111/jbi.12867
Zhang Q., Yang Y.Z., Wu G.L. et al. Isolation and characterization of microsatellite DNA primers in Juniperus przewalskii Kom (Cupressaceae) // Conserv. Genet. 2008. V. 9. P. 767–769. https://doi.org/10.1007/s10592-007-9387-y
Rumeu B., Sosa P.A., Nogales M., Gonzalez-Perez M.A. Development and characterization of 13 SSR markers for an endangered insular juniper (Juniperus cedrus Webb & Berth.) // Conserv. Genet. Resources. 2013. V. 5. P. 457–459. https://doi.org/10.1007/s12686-012-9827-y
Raymond M., Rousset F. GENEPOP (Version 1.2): Population genetics software for exact tests and ecumenicism // J. Hered. 1995. V. 86. P. 248–249. https://doi.org/10.1111/j.1471-8286.2007.01931.x
Brookfield J. A simple new method for estimating null allele frequency from heterozygote deficiency // Mol. Ecol. 1996. V. 5. P. 453–455. https://doi.org/10.1046/j.1365-294X.1996.00098.x
Oosterhout C.V., Hutchinson W.F., Wills D.P.M., Shipley P. Micro-checker: Software for identifying and correcting genotyping errors in microsatellite data // Mol. Ecol. Notes. 2004. V. 4. P. 535–538. https://doi.org/10.1111/j.1471-8286.2004.00684.x
Excoffier L., Lischer H. Arlequin suite ver 3.5: A new series of programs to perform population genetics analyses under Linux and Windows // Mol. Ecol. Resour. 2010. V. 10. P. 564–567. https://doi.org/10.1111/j.1755-0998.2010.02847.x
Nei M., Tajima F., Tateno Y. Accuracy of estimated phylogenetic trees from molecular data // J. Mol. Evol. 1983. V. 19. P. 153–170. https://doi.org/10.1007/BF02300753
Pritchard J.K., Stephens M., Donnelly P. Inference of population structure using multilocus genotype data // Genetics. 2000. V. 155. P. 945–959. https://doi.org/10.1093/genetics/155.2.945
Earl D.A., von Holdt B.M. Structure harvester: A website and program for visualizing STRUCTURE output and implementing the Evanno method // Conserv. Genet. Resour. 2012. V. 4. P. 359–361. https://doi.org/10.1007/s12686-011-9548-7
Dupanloup I., Schneider S., Excoffier L. A simulated annealing approach to define the genetic structure of populations // Mol. Ecol. 2002. V. 11. P. 2571–2581. https://doi.org/10.1046/j.1365-294X.2002.01650.x
Mantel N.A. The detection of disease clustering and generalized regression approach // Cancer Res. 1967. V. 27. P. 209–220.
Vanden Broeck A., Gruwez R., Cox K. et al. Genetic structure and seed-mediated dispersal rates of an endangered shrub in a fragmented landscape: A case study for Juniperus communis in northwestern Europe // BMC Genetics. 2011. V. 12. P. 1–7. https://doi.org/10.1186/1471-2156-12-73
Ritland C., Pape T., Ritland K. Genetic structure of yellow cedar (Chamaecyparis nootkatensis) // Can. J. Bot. 2001. V. 79. P. 822–828. https://doi.org/10.1139/b01-053
Somme L., Mayer C., Rasp E.O., Jacquemart A.L. Influence of spatial distribution and size of clones on the realized outcrossing rate of the marsh cinquefoil (Comarum palustre) // Annals Botany. 2014. V. 113. P. 477–487. https://doi.org/10.1093/aob/mct280
Егорова И.А. Краткий очерк истории формирования современной растительности Камчатки // Камчатка: события, люди: Материалы XXV Крашенинниковских чтений. Петропавловск-Камчатский, 2008. С. 88–93.
Hantemirova E.V., Marchuk E.A. Phylogeography and genetic structure of a subarctic-alpine shrub species, Alnus alnobetula (Ehrh.) K. Koch s. l., inferred from chloroplast DNA markers // Tree Genet. Genom. 2021. V. 17. P. 18. https://doi.org/10.1007/s11295-021-01503-0
Polezhaeva M.A., Lascoux M., Semerikov V.L. Cytoplasmic DNA variation and biogeography of Larix Mill. in Northeast Asia // Mol. Ecol. 2010. V.19. P. 1239–1252. https://doi.org/10.1111/j.1365-294x.2010.04552.x
Fedorov V., Goropashnaya A.V., Boeskorov G.G., Cook J.A. Comparative phylogeography and demographic history of the wood lemming (Myopus schisticolor): Implications for late Quaternary history of the taiga species in Eurasia // Mol. Ecol. 2008. V. 17. P. 598–610. https://doi.org/10.1111/j.1365-294x.2007.03595.x
Myers N., Mittermeier R.A., Mittermeier C.G. et al. Biodiversity hotspots for conservation priorities // Nature. 2000. V. 403. P. 853–858. https://doi.org/10.1038/35002501
Zhang J.-Q., Meng S.-Y., Allen G.A. et al. Rapid radiation and dispersal out of the Qinghai-Tibetan Plateau of an alpine plant lineage Rhodiola (Crassulaceae) // Mol. Phylogenet. Evol. 2014. V. 77. P. 147–158. https://doi.org/10.1016/j.ympev.2014.04.013
Zhang H.J., Feng T., Landis J.B. et al. Molecular phylogeography and ecological niche modeling of Sibbaldia procumbens s.l. (Rosaceae) // Front Genet. 2019. V. 10. P. 201. https://doi.org/10.3389/fgene.2019.00201
Jia D.R., Abbott R.J., Liu T.L. et al. Out of the Qinghai-Tibet Plateau: Evidence for the origin and dispersal of Eurasian temperate plants from a phylogeographic study of Hippophae rhamnoides (Elaeagnaceae) // New Phytol. 2012. V. 194. P. 1123–1133. https://doi.org/10.1111/j.1469-8137.2012.04115.x
Michalczyk I.M., Opgenoorth L., Luecke Y. et al. Genetic support for perglacial survival of Juniperus communis L. in Central Europe // Holocene. 2010. V. 20. № 6. P. 887–894. https://doi.org/10.1177/0959683610365943
Schönswetter P., Stehlik I., Holderegger R., Tribsch A. Molecular evidence for glacial refugia of mountain plants in the European Alps // Mol. Ecol. 2005. V. 14. P. 3547–3555. https://doi.org/10.1111/j.1365-294X.2005.02683.x
Shuvaev D.N., Ibe A.A. Genetic structure and postglacial recolonization of Pinus sibirica Du Tour in the West Siberian Plain, inferred from nuclear microsatellite markers // Silvae Genet. 2021. V. 70. P. 99–107. https://doi.org/10.2478/sg-2021-0008
Mao K., Hao G., Liu J. et al. Diversification and biogeography of Juniperus (Cupressaceae): variable diversification rates and multiple intercontinental dispersals // New Phytol. 2010. V. 188. P. 254–272. https://doi.org/10.1111/j.1469-8137.2010.03351.x
Величко А.А. Природный процесс в плейстоцене. М., 1973. 256 с.
Elias S.A., Short S.K., Birks H.H. Late Wisconsin environments of the Bering Land Bridge // Palaeogeogr., Palaeoclimatol., Palaeoecol. 1997. V. 136. P. 293–308.
Tsutsui K., Suwa A., Sawada K.S. et al. Incongruence among mitochondrial, chloroplast and nuclear gene trees in Pinus subgenus Strobus (Pinaceae) // J. Plant. Res. 2009. V. 122. P. 509–521. https://doi.org/10.1007/s10265-009-0246-4
Gernandt D.S., Lopez G.G., Garcia S.O., Liston A. Phylogeny and classification of Pinus // Taxon. 2005. V. 54. V. 1. P. 29–42.https://doi.org/10.2307/25065300
Дополнительные материалы отсутствуют.


