Генетика, 2023, T. 59, № 4, стр. 417-424
Новый аллель 5'-UTR LcyE коррелирует с повышенной экспрессией гена ликопин-ε-циклазы, определяющей поток ветви β-ε пути биосинтеза каротиноидов у кукурузы
Д. Х. Архестова 1, 2, Г. И. Ефремов 1, *, С. П. Аппаев 2, Е. З. Кочиева 1, А. В. Щенникова 1
1 Институт биоинженерии, Федеральный исследовательский центр “Фундаментальные
основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Институт сельского хозяйства – филиал Кабардино-Балкарского научного центра
Российской академии наук
360004 Нальчик, Россия
* E-mail: gleb_efremov@mail.ru
Поступила в редакцию 22.04.2022
После доработки 26.05.2022
Принята к публикации 31.05.2022
- EDN: INSQAK
- DOI: 10.31857/S0016675823030025
Аннотация
Окраска зерна кукурузы Zea mays L. определяется содержанием и составом каротиноидов, в том числе провитамина А, являющегося продуктом ветвей β-β (β-каротин, β-криптоксантин) и β-ɛ (α-каротин) каротиногенеза. Соотношение потоков ветвей зависит от активности ликопин-ɛ-циклазы LcyE, определяющей ветвь β-ɛ. В данной работе проведен анализ аллельных вариантов гена LcyE, потенциально эффективных для повышения биосинтеза β-каротина, у 20 инбредных линий кукурузы отечественной селекции, различающихся окраской зерна. Амплифицированы и секвенированы участки 5'-UTR гена LcyE. Анализ фрагментов показал присутствие аллеля “2” у четырех линий и нового аллеля “5” у 16 линий. Охарактеризован полиморфизм нового аллеля “5” – четыре мононуклеотидных полиморфизма и две делеции. Проведенное сравнение цис-регуляторных элементов в анализируемой области 5'-UTR аллелей “2” и “5” обнаружило различие в сайтах связывания с транскрипционными факторами. Экспрессия гена LcyE определена в листьях двух линий с аллелем “2” и трех – с аллелем “5”. Показана прямая зависимость между присутствием аллеля “5” и снижением экспрессии гена: уровень транскрипции гена в случае аллеля “2” в 10–15 раз выше, чем в случае аллеля “5”. Предполагаем, что наличие в геноме кукурузы аллеля “5” гена LcyE коррелирует со снижением или подавлением экспрессии данного гена и, при стабильной активности других ферментов каротиногенеза, с окраской зерна. Использование доноров аллеля “5” в комбинации с известной темно-желтой или оранжевой окраской зерна может быть использовано в селекции кукурузы с повышенным синтезом провитамина А в зерне.
Окраска зерна является важной характеристикой инбредных линий кукурузы Zea mays L., так как свидетельствует о наличии диетически ценных вторичных метаболитов – каротиноидов, и определяется содержанием и соотношением преимущественно лютеина, зеаксантина, β-каротина, β-криптоксантина и α-каротина [1]. Отсутствие каротиноидов или только цветных каротиноидов соответствует белой окраске зерна, тогда как обогащение зеаксантином или лютеином – оранжевой или желтой соответственно [2, 3].
В традиционных сортах кукурузы каротиноиды, являющиеся предшественниками дефицитного витамина А (β-каротин, β-криптоксантин и α-каротин), составляют всего 0.5–2.5 мкг/г сырого веса зерна [1, 4, 5]. β-Каротин и β-криптоксантин являются производными метаболической ветви β-β пути биосинтеза каротиноидов (рис. 1,а), когда под действием ликопин β-циклазы (LcyB) на обоих концах линейной молекулы ликопина формируются β-иононовые кольца (β-каротин, продукты гидроксилирования β-каротина – ксантофиллы, включая зеаксантин и β-криптоксантин) [6, 7]. α-Каротин является продуктом ветви β-ε (рис. 1,а) и представляет собой молекулу с β-иононовым кольцом на одном конце и ε-иононовым кольцом на другом конце изопреноидной цепи, образующуюся в результате совместного действия LcyB и ликопин-ε-циклазы (LcyE) (конечный продукт ветви β-ε – лютеин) [6, 7]. Благодаря присутствию в структуре двух β-иононовых колец окислительное расщепление β-каротина дает две молекулы витамина А. Поэтому β-каротин считается наиболее значимым предшественником витамина А в сравнении с α-каротином и β-криптоксантином (по одному β-кольцу) [8–10].
Рис. 1.
а – схема биосинтеза каротиноидов. Ветвь β-β начинается с синтеза δ-каротина (LcyE), который далее преобразуется в α-каротин (LcyB). Ветвь β-ε начинается с синтеза γ-каротина (LcyB), который далее преобразуется в β-каротин (LcyB). б – схематичное изображение аллелей 5'-UTR LcyE. Аллель “2” – аллель дикого типа; аллель “4” – аллель со вставкой транспозона (650 или 993 пн), предпочтительный для синтеза провитамина А [1, 11]; новый аллель “5” отличается от аллеля “2” двумя делециями (8 и 7 пн) и четырьмя SNPs. в – электрофоретическое разделение продуктов ПЦР на геномной ДНК кукурузы различных инбредных линий, соответствующих аллелям “2” и “5”.
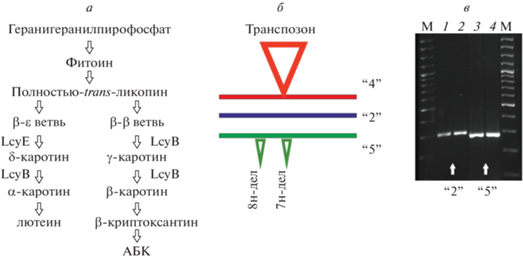
Характерным признаком преобладания ветви β-β каротиногенеза и, одновременно, потенциально более высокого содержания провитамина А, является оранжевая окраска зерна кукурузы [1, 5, 11]. Интересно при этом, что в традиционных линиях кукурузы в тканях зародыша зерна преимущественно действует ветвь β-β, тогда как в эндосперме – ветвь β-ε, и это ассоциировано с дифференциальной экспрессией генов ликопин-циклаз LcyB и LcyE [1, 12, 13].
Ранее посредством ассоциативного картирования, в последовательности гена LcyE были описаны полиморфные варианты, связанные с пониженной экспрессией гена и, соответственно, повышенным содержанием провитамина А [1]. Доноры мутантных аллелей lcyE активно использовались в селекции линий кукурузы, продуцирующих обогащенное провитамином A зерно [5, 11, 14]. Наибольший эффект наблюдался в случае полиморфных вариантов в области 5'-UTR (lcyE 5'TE) по сравнению с мутациями в экзоне 1 (lcyE SNP216), интроне 4 (lcyE SNP2238) и делецией в 3'-UTR (lcyE 3'InDel) [1]. При этом инсерции мобильных элементов в 5'-UTR рядом с точкой инициации трансляции (аллели “1” и “4”) были ассоциированы с самыми значительными изменениями соотношения синтеза каротиноидов у ветвей β-ε и β-β [1]. Последующие исследования подтвердили существенный рост накопления витамина А в зернах кукурузы в случае аллеля “4” [5, 11]. Поэтому биофортификация кукурузы для получения линий с повышенным содержанием провитамина А сфокусирована главным образом на снижении экспрессии гена LcyE путем использования в селекции генотипов с соответствующими аллелями [1, 4, 11]. Подобная корреляция между присутствием определенных аллелей и синтезом провитамина А консервативна у высших растений, что продемонстрировано на примере модельного вида Arabidopsis thaliana, рапса Brassica napus и картофеля Solanum tuberosum [14–16]. В некоторых генотипах пшеницы Triticum turgidum также идентифицированы мутации в последовательности LcyE, которые потенциально могут приводить к повышению синтеза β-каротина [17].
Помимо гена LcyE к повышению синтеза провитамина А могут приводить мутации в гене β-каротин-гидроксилазы 1 (CrtRB1) – участнике ветви β-β. Сочетание у генотипа кукурузы мутантных аллелей lcyE и crtRB1 увеличивает содержание β-каротина на порядок, поскольку выключение/снижение активности гена LcyE смещает равновесие в сторону ветви β-β, а выключение/снижение активности гена CrtRB1 ограничивает гидроксилирование β-каротина до ксантофиллов [1, 11, 18–20].
В данной работе был проведен анализ инбредных линий кукурузы отечественной селекции на предмет наличия аллельных вариантов 5'-UTR гена LcyE, потенциально эффективных для повышения биосинтеза провитамина А.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. В работе использовали 20 инбредных линий кукурузы из коллекции ИСХ КБНЦ РАН и ООО ИП АФ “ОТБОР” (Кабардино-Балкария, Россия) (табл. 1). Растения выращивали в 2021 г. в полевых условиях (ИСХ КБНЦ РАН, КБР, Россия). Самоопыленные початки собирали, отдельные зерна проращивали до формирования 2–4 истинных листьев (23/25°С, 16/8 ч – день/ночь, ЭУИК ФИЦ Биотехнологии РАН). Листовой материал использовали для анализа генной вариабельности и экспрессии.
Таблица 1.
Линии кукурузы, использованные в работе
| Номер линии | Окраска зерна | Аллель “2” | Аллель “5” |
|---|---|---|---|
| 21371 | Белая | + | |
| 24732 | + | ||
| 5254-12 | + | ||
| 5320-52 | + | ||
| 6097-12 | + | ||
| 5127-42 | Бледно-желтая | + | |
| 6004-12 | + | ||
| 6172-22 | + | ||
| 6639-12 | + | ||
| 24652 | + | ||
| 15431 | Насыщенно-желтая | + | |
| 56921 | + | ||
| 57021 | + | ||
| 5057-82 | + | ||
| 5580-12 | + | ||
| 5074-12 | Коричневый низ, желтый верх | + | |
| 5570-42 | Оранжевая | + | |
| 6466-12 | + | ||
| 5272-62 | + | ||
| 56771 | + |
Идентификация и анализ полиморфизмов в последовательности 5'-нетранслируемой области (5'-UTR) гена LcyE. Для идентификации аллелей LcyE, из собранного листового материала выделяли геномную ДНК, согласно [21]. Полученные препараты затем использовали как матрицы для ПЦР-амплификации участка последовательности 5'-UTR гена LcyE. Программа амплификации: исходная денатурация в течение 5 мин при 95°С, далее 32 цикла (денатурация 1 мин при 95°С, отжиг 30 с при 60°С, синтез 45 с при 72°С).
Предположительные продукты амплификации с праймерами F2 (5'-AAGCATCCGACCAAAATAACAG-3') и R2 (5'-GAGAGGGAGACGACGAGACAC-3') – фрагменты ДНК 248 или 993 пн (в зависимости от аллельного варианта) в соответствии с [1].
Фрагменты ожидаемой длины вырезали из геля (Zymoclean™ Gel DNA Recovery Kit, “ZymoResearch”, США) и секвенировали с праймера F2 на автоматическом секвенаторе ABI 310 Сapillary DNA Analyzer (“Applied Biosystems”, США; ЦКП “Биоинженерия” РАН).
Структурный анализ проводили с помощью NCBI-BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi) и MEGA 7.0 [22]. Поиск цис-регуляторных элементов в анализируемом участке 5'-UTR осуществляли с использованием PlantCARE [23].
Анализ экспрессии гена LcyE. Суммарную РНК выделяли из 50–100 мг ткани листьев (RNeasy Plant Mini Kit, QIAGEN, Германия), дополнительно очищали от примесей ДНК (RNase-free DNasy set, QIAGEN, Германия) и использовали для синтеза кДНК (GoScriptтм Reverse Transcription System, Promega, США) согласно протоколам производителей. Качество РНК проверяли методом электрофореза в 1.5%-ном агарозном геле. Концентрацию РНК и кДНК определяли на флуориметре Qubit 4 (Thermo Fisher Scientific, США) с помощью соответствующих реактивов (Qubit RNA HS Assay Kit и Qubit DS DNA HS Assay Kit, Invitrogen, США).
Экспрессию гена LcyE в листьях линий кукурузы определяли методом ПЦР в реальном времени (РВ-ПЦР) с нормализацией данных по референсному гену Zea mays polyubiquitin (NM_001329666.1; праймеры ZmUBI-rtF 5'-ATCGTGGTTGTGGCTTCGTTG-3' и ZmUBI-rtR 5'-GCTGCAGAAGAGTTTTGGGTACA-3'). Для проведения реакции использовали 3 нг кДНК-матрицы, кДНК-специфичные праймеры (ZmLcyE-F 5'-TTTACGTGCAAATGCAGTCAA-3' и ZmLcyE‑R: 5'-TGACTCTGAAGCTAGAGAAAG-3'), набор “Реакционная смесь для проведения РВ-ПЦР в присутствии SYBR GreenI и ROX” (ООО “Синтол”, Россия) и термоциклер CFX96 Real-Time PCR Detection System (Bio-Rad Laboratories, США). Реакции проводили в двух биологических и трех технических повторах. Программа амплификации: исходная денатурация в течение 5 мин при 95°С, далее 40 циклов (денатурация 15 с при 95°С; отжиг и синтез 40 с при 60°С).
Результаты РВ-ПЦР статистически обрабатывали с помощью GraphPadPrismv.8 (GraphPad Software Inc., США; https://www.graphpad.com/scientific-software/prism/). Данные выражали как среднее значение со стандартным отклонением (± SD) на основе двух биологических и трех технических повторов. Для оценки достоверности различий в экспрессии гена между линиями кукурузы использовали t-критерий Уэлча (unequal variance, Welch’s t-test) (при р < 0.05 различия статистически значимы).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Идентификация и структурный анализ участка последовательности 5'-UTR гена LcyE у инбредных линий кукурузы
Для выявления возможных полиморфных вариантов участка 5'-UTR гена LcyE, потенциально влияющих на уровень экспрессии LcyE, в работе использованы 20 инбредных линий кукурузы, различающихся окраской зерна (табл. 1), что говорит о вариациях в содержании и составе каротиноидов.
Основываясь на приведенных данных, 20 инбредных линий кукурузы были протестированы на возможное присутствие либо аллеля “2”, либо аллеля “4” гена LcyE (рис. 1,б), где последний ассоциирован с повышенным накоплением провитамина А [1]. Амплификация соответствующего участка 5'-UTR и электрофоретический анализ ПЦР-продуктов показали отсутствие фрагментов, соответствующих аллелю “4” [1]. При этом, независимо от окраски зерна, в геномах анализируемых линий присутствовал один из двух типов фрагментов размером ~230 или ~250 пн (рис. 1,в). Фрагмент длиной ~230 пн ранее не был описан. Размер ~250 пн теоретически соответствует аллелю “2” (248 пн) LcyE, неблагоприятному для повышенного синтеза провитамина А, согласно [1].
Секвенирование полученных фрагментов обнаружило, что четыре линии из 20 (по одной из каждой группы, различающейся по окраске зерна) содержат аллель “2” (табл. 1). Секвенирование фрагмента 5'-UTR LcyE длиной 233 пн, обозначенного как аллель “5” и присутствующего у оставшихся 16 линий, выявило две делеции (размером 8 и 7 нуклеотидов) и четыре мононуклеотидных полиморфных варианта (рис. 2,а).
Рис. 2.
а – сравнение последовательностей аллеля “2” (GeneID: OK032387.1) и нового аллеля “5” 5'-UTR гена LcyE; красным выделены мононуклеотидные полиморфизмы и делеции. б – профиль экспрессии гена LcyE в проростках линий кукурузы 6097, 5580-1, 5272-6 (аллель “5”), 5677 и 6709 (аллель “2”); буквами над столбиками указаны достоверные различия (P < 0.01) в уровне экспрессии LcyE между отдельными органами внутри одного вида. в – регуляторные мотивы в последовательности аллеля “2” и нового аллеля “5” 5'-UTR гена LcyE; красной рамкой выделены области аллеля “2”, делетированные в последовательности аллеля “5”.

Сравнительный анализ последовательности аллеля “5” с доступными данными в базе GenBank NCBI обнаружил последовательности 5'-UTR LcyE, гомологичные по первой и/или второй делеции. Таким образом, аллель “5” встречается с большой частотой (табл. 1), что может свидетельствовать о родственном происхождении линий и косвенно подтверждается общностью их оригинаторов (ИСХ КБНЦ РАН или ООО ИП АФ “ОТБОР”; КБР, Россия).
Уровень экспрессии гомологов гена LcyE у линий кукурузы коррелирует с присутствием аллеля “5”
Ранее было показано, что полиморфные варианты последовательности гена LcyE часто имеют критическое значение для работы фермента, и, в основном, это варианты, влияющие на уровень транскрипции гена [1, 11]. При этом предполагается высокий функциональный консерватизм LcyE для всех типов тканей, где может идти синтез каротиноидов, поскольку в геноме кукурузы отсутствуют другие гены, паралогичные LcyE, в отличие, к примеру, от ключевого фермента биосинтеза каротиноидов – фитоинсинтазы PSY, имеющей три паралога (PSY1–3) с функциональной и тканевой специфичностью [24, 25].
Для оценки влияния типа аллеля на уровень экспрессии гена LcyE проанализированы образцы пяти линий, две из которых содержат аллель “2” и три – новый аллель “5”. Обнаружено, что уровень транскрипции гена в листьях образцов с аллелем “2” в 10–15 раз выше, чем у образцов с аллелем “5”, где экспрессия носит следовый характер (рис. 2,б). Таким образом, наблюдается прямая зависимость между присутствием аллеля “5” и снижением экспрессии гена.
Для ранее описанных четырех типов полиморфизмов была показана ассоциация с 58% имеющимися вариациями подавления синтеза каротиноидов ветви β-ε [1, 11]. Можно предположить, что описанный нами полиморфизм аллеля “5” (четыре SNPs и две 7/8-пн делеции в области 5'-UTR) может быть связан с частью из оставшихся 42% вариаций.
Можно предположить, что уровень экспрессии гена LcyE в листьях коррелирует с синтезом каротиноидов/провитамина А не только в листьях, но и в зернах кукурузы. Проведенный сравнительный поиск цис-регуляторных элементов в последовательности аллелей “2” и “5” обнаружил, что два аллеля различаются сайтами связывания с транскрипционными факторами (ТФ) (рис. 2,в). Так, в сравнении с аллелем “2”, у аллеля “5” отсутствует A-box (сайт связывания с ТФ семейства bZIP) и присутствует элемент CATTTG (сайт связывания с ТФ семейства MYC). Оба семейства ТФ вовлечены в ответ растений на стресс. Помимо этого, bZIP-белки также участвуют в регуляции экспрессии генов, связанной с возрастом растения [26], а MYC-белки связаны с регуляцией генов фотоморфогенеза [27]. Если говорить о выявленных мотивах в контексте экспрессии LcyE в зернах, то регуляция генов может быть ассоциирована, скорее, с возрастными процессами, чем с чувствительностью к световым сигналам (зерна в початке полностью защищены от освещения). Это является вероятным косвенным свидетельством стимулирующего эффекта аллеля “2” по отношению к уровню транскрипции гена LcyE в сравнении с аллелем “5”.
Проанализированные в работе линии кукурузы характеризуются четырьмя типами окраски зерна (табл. 1). А именно: белой (предположительно, цветные каротиноиды отсутствуют); светло-желтой (за счет лютеина; преимущество ветви β-ε); насыщенно желтой (соотношение каротиноидов ветвей β-ε и β-β может быть эквивалентным); оранжевой (за счет β-каротина и зеаксантина; преимущество ветви β-β). Интересно, что среди выявленных образцов как с аллелем “2”, так и с аллелем “5” есть линии с окраской зерна всех четырех типов (табл. 1). Светло-желтая, желтая и оранжевая окраски могут объясняться различными вариациями в уровнях экспрессии генов LcyE (между аллелями “2” и “5”) и ликопин-β-циклазы LcyB (между анализируемыми генотипами), совместно определяющими силу и соотношение потоков β-ε и β-β, а также в экспрессии вышестоящих генов каротиногенеза (определяющих уровень синтеза и накопление окрашенных каротиноидов). У линий с зерном белой окраски (табл. 1) можно предположить нарушение экспрессии вышестоящих генов каротиногенеза, либо эффективную утилизацию каротиноидов (к примеру, переработку ксантофиллов ветви β-β с образованием абсцизовой кислоты).
Рассматривая полученные данные, можно сделать вывод о том, что наличие в геноме кукурузы нового аллеля “5” гена LcyE коррелирует со снижением или подавлением экспрессии данного гена и, при стабильной активности других ферментов каротиногенеза, с окраской зерна. Доноры аллеля “5”, формирующие зерно темно-желтой или оранжевой окраски, могут быть использованы в селекции кукурузы с повышенным синтезом провитамина А в зерне.
Работа выполнена при поддержке РНФ (№ 21-16-00008) и Министерства науки и высшего образования РФ.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Harjes C.E., Rocheford T.R., Bai L. et al. Natural genetic variation in lycopene epsilon cyclase tapped for maize biofortification // Science. 2008. V. 319. P. 330–333. https://doi.org/10.1126/science.1150255
Kurilich A.C., Juvik J.A. Quantification of carotenoid and tocopherol antioxidants in Zea mays // J. Agric. Food Chem. 1999. V. 47. P. 1948–1955. https://doi.org/10.1021/jf981029d
O’Hare T.J., Martin I., Fanning K.J. et al. Sweetcorn colour change and consumer perception associated with increasing zeaxanthin for the amelioration of age-related macular degeneration // Acta Horticulturae. 2014. V. 1040. P. 221–226. https://doi.org/10.17660/ActaHortic.2014.1040.30
Yadav O.P., Hossain F., Karjagi C.G. et al. Genetic improvement of maize in India: Retrospect and prospects // Agric. Res. 2015. V. 4. № 4. P. 325–338. https://doi.org/10.1007/s40003-015-0180-8
Zunjare R.U., Chhabra R., Hossain F. et al. Molecular characterization of 5'-UTR of the lycopene epsilon cyclase (lcyE) gene among exotic and indigenous inbreds for its utilization in maize biofortification // 3 Biotech. 2018. V. 8. № 1. Р. 75. https://doi.org/10.1007/s13205-018-1100-y
Cunningham F.X., Jr., Pogson B., Sun Z. et al. Functional analysis of the β and ε lycopene cyclase enzymes of Arabidopsis reveals a mechanism for control of cyclic carotenoid formation // Plant Cell. 1996. V. 8. P. 1613–1626. https://doi.org/10.1105/tpc.8.9.1613
Rosas-Saavedra C., Stange C. Biosynthesis of carotenoids in plants: Enzymes and color // Subcell Biochem. 2016. V. 79. P. 35–69. https://doi.org/10.1007/978-3-319-39126-7_2
Wong J.C., Lambert R.J., Wurtzel E.T., Rocheford T.R. QTL and candidate genes phytoene synthase and zeta-carotene desaturase associated with the accumulation of carotenoids in maize // Theor. Appl. Genet. 2004. V. 108. № 2. P. 349–359. https://doi.org/10.1007/s00122-003-1436-4
Krinsky N.I., Johnson E.J. Carotenoid actions and their relation to health and disease // Mol. Aspects of Med. 2005. V. 26. № 6. P. 459–516. https://doi.org/10.1016/j.mam.2005.10.001
Nagao A., Olson J.A. Enzymatic formation of 9-cis, 13-cis, and all-trans retinals from isomers of beta-carotene // Faseb J. 1994. V. 8. № 12. P. 968–973. https://doi.org/10.1096/fasebj.8.12.8088462
Babu R., Rojas N.P., Gao S. et al. Validation of the effects of molecular marker polymorphisms in LcyE and CrtRB1 on provitamin A concentrations for 26 tropical maize populations // Theor. Appl. Genet. 2013. V. 126. P. 389–399. https://doi.org/10.1007/s00122-012-1987-3
Baveja A., Muthusamy V., Panda K.K. et al. Development of multinutrient-rich biofortified sweet corn hybrids through genomics-assisted selection of shrunken2, opaque2, lcyE and crtRB1 genes // J. Appl. Genet. 2021. V. 62. № 3. P. 419–429. https://doi.org/10.1007/s13353-021-00633-4
Bai L., Kim E.H., DellaPenna D., Brutnell T.P. Novel lycopene epsilon cyclase activities in maize revealed through perturbation of carotenoid biosynthesis // Plant J. 2009. V. 59. № 4. P. 588–599. https://doi.org/10.1111/j.1365-313X.2009.03899.x
Yu B., Lydiate D.J., Young L.W. et al. Enhancing the carotenoid content of Brassica napus seeds by downregulating lycopene epsilon cyclase // Transgenic Res. 2008. V. 17. № 4. P. 573–585. https://doi.org/10.1007/s11248-007-9131-x
Diretto G., Tavazza R., Welsch R. et al. Metabolic engineering of potato tuber carotenoids through tuber-specific silencing of lycopene epsilon cyclase // BMC Plant Biol. 2006. V. 6. Р. 13. https://doi.org/10.1186/1471-2229-6-6
Pogson B.J., Rissler H.M. Genetic manipulation of carotenoid biosynthesis and photoprotection // Philos. Trans. R. Soc. Lond. B Biol. Sci. 2000. V. 355. № 1402. P. 1395–1403. https://doi.org/10.1098/rstb.2000.0701
Richaud D., Stange C., Gadaleta A. et al. Identification of lycopene epsilon cyclase (lcyE) gene mutants to potentially increase β-carotene content in durum wheat (Triticum turgidum L. ssp. durum) through TILLING // PLoS One. 2018. V. 13. № 12: e0208948. https://doi.org/10.1371/journal.pone.0208948
Yan J., Kandianis B.C., Harjes E.C. et al. Rare genetic variation at Zea mays crtRB1 increases beta carotene in maize grain // Nat. Genet. 2010. V. 42. P. 322–327. https://doi.org/10.1038/ng.551
Liu L., Jeffers D., Zhang Y. et al. Introgression of the crtRB1 gene into quality protein maize inbred lines using molecular markers // Mol. Breed. 2015. V. 35. № 8: 154. https://doi.org/10.1007/s11032-015-0349-7
Muthusamy V., Hossain F., Thirunavukkarasu N. et al. Development of β-carotene rich maize hybrids through marker-assisted introgression of β-carotene hydroxylase allele // PLoS One. 2014. V. 9. № 12. Р. e11583. https://doi.org/10.1371/journal.pone.0113583
Дьяченко Е.А., Слугина М.А. Внутривидовой полиморфизм гена сахарозосинтазы Sus1 у образцов Pisum sativum L. // Вавилов. журн. генет. и селекции. 2018. Т. 22. № 1. С. 108–114. https://doi.org/10.18699/VJ18.338
Kumar S., Stecher G., Tamura K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets // Mol. Biol. Evol. 2016. V. 33. № 7. P. 1870–1874. https://doi.org/10.1093/molbev/msw054
Lescot M. PlantCARE, a database of plant cis – acting regulatory elements and a portal to tools for in silico analysis of promoter sequences // Nucl. Ac. Res. 2002. V. 30. P. 325–327. https://doi.org/10.1093/nar/30.1.325
Li F., Vallabhaneni R., Wurtzel E.T. PSY3, a new member of the phytoene synthase gene family conserved in the Poaceae and regulator of abiotic stress – induced root carotenogenesis // Plant Physiol. 2008. V. 146. P. 1333–1345. https://doi.org/10.1104/pp.107.111120
Dibari B., Murat F., Chosson A. et al. Deciphering the genomic structure, function and evolution of carotenogenesis related phytoene synthases in grasses // BMC Genomics. 2012. V. 13. Р. 221. https://doi.org/10.1186/1471-2164-13-221
Vatov E., Ludewig U., Zentgraf U. Disparate dynamics of gene body and cis-regulatory element evolution illustrated for the senescence-associated cysteine protease gene SAG12 of plants // Plants (Basel). 2021. V. 10. № 7: 1380. https://doi.org/10.3390/plants10071380
Bai J.F., Wang Y.K., Guo L.P. et al. Genomic identification and characterization of MYC family genes in wheat (Triticum aestivum L.) // BMC Genomics. 2019. V. 20. № 1. Article 1032. https://doi.org/10.1186/s12864-019-6373-y
Дополнительные материалы отсутствуют.


