Генетика, 2023, T. 59, № 4, стр. 381-402
Регуляторный потенциал ко-локализованных с генами кардиомиопатий некодирующих РНК
А. Н. Кучер 1, М. С. Назаренко 1, *
1 Научно-исследовательский институт медицинской генетики, Томский национальный исследовательский медицинский центр Российской академии наук
634050 Томск, Россия
* E-mail: maria.nazarenko@medgenetics.ru
Поступила в редакцию 03.06.2022
После доработки 28.07.2022
Принята к публикации 05.09.2022
- EDN: AVMKVQ
- DOI: 10.31857/S0016675823040057
Аннотация
Некодирующие РНК (нкРНК) играют важную роль в регуляции активности генов, значимых для развития и функционирования сердечно-сосудистой системы. Внутригенные нкРНК координированно регулируются и/или экспрессируются с их генами-хозяевами, включая нкРНК, гены которых локализованы в области генов кардиомиопатий (КМП). Обзор посвящен обобщению результатов исследований участия внутригенных нкРНК в функционировании сердца в норме и при развитии КМП различного генеза. К числу наиболее активно привлекавшихся к исследованию ассоциированных с КМП внутригенных нкРНК относятся микроРНК (miR-1, miR-133a, miR-208a, miR-208b, miR-324, miR-490, miR-499a) и длинные нкРНК (MHRT, TTN-AS1 и KCNQ1OT1). Установлено, что уровень данных нкРНК в миокарде характеризуется онтогенетической динамикой, зависит от пола и анатомического отдела сердца. Их экспрессия изменяется в миокарде/сыворотке крови у человека и модельных животных при воздействии экзогенных и эндогенных факторов, демонстрируя ассоциацию с клиническими особенностями при развитии и прогрессии КМП. Изменение уровня нкРНК до появления клинических признаков болезни, зарегистрированная возможность приостановки развития КМП и даже восстановление нормального фенотипа посредством управления уровнями данных регуляторных молекул свидетельствуют об их вовлеченности в патогенез заболевания. микроРНК и длинные нкРНК, гены которых перекрываются по локализации с генами КМП, участвуют в различных метаболических процессах, значимых для нормального функционирования сердца, в том числе посредством вовлеченности в эпигенетические процессы.
Эпигенетические исследования, проводимые при различных заболеваниях сердечно-сосудистой системы, в том числе и при кардиомиопатиях (КМП), направлены на поиск как новых маркеров развития патологии, объясняющих развитие болезни и определяющих клинические особенности ее течения, так и возможных терапевтических мишеней [1–6]. К настоящему времени получен большой массив данных, свидетельствующих о разнообразных эпигенетических процессах, происходящих при развитии первичных (гипертрофической (ГКМП), дилатационной (ДКМП), аритмогенной (АКМП) КМП, некомпактного миокарда левого желудочка (НКМЛЖ)), и вторичных (ишемической, диабетической и др.) КМП в ткани миокарда и сыворотке крови индивидов [2, 3, 7].
Большое число исследований эпигенетических изменений в миокарде при развитии КМП выполнены на уровне модификации гистонов, метилирования ДНК и ремоделирования хроматина [7], а также при участии различных регуляторных некодирующих РНК [1, 2, 8, 9]. Эпигенетические модификации, которые выявляются в тканях сердца при КМП, оказывают влияние на экспрессию широкого спектра генов, вовлеченных в биохимические процессы и метаболические пути, значимые для развития и функционирования сердца (в том числе и при патогенезе), что указывает на неслучайность выявляемых транскриптомных изменений [10–13].
Примечательно, что некоторые гены (например, EYA4, GATAD1, PRDM16, DMD, SLC25A4, ANKRD1, LMNA, TNNI3), патогенные варианты которых приводят к развитию различных КМП, сами участвуют в эпигенетических процессах на уровне метилирования ДНК, модификации гистонов и ремоделирования хроматина [7]. Кроме того, наблюдаются перекрывания по локализации между генами КМП и генами, кодирующими различные типы некодирующих РНК (ncRNA, нкРНК), обладающих регуляторным потенциалом. Это указывает на возможную значимость таких нкРНК в функционировании сердца и соответственно в развитии патологических процессов.
Цель настоящего обзора состоит в обобщении результатов исследований, посвященных изучению вовлеченности в патогенез патологии миокарда регуляторных нкРНК, гены которых локализуются в области генов КМП.
ГЕНЫ РЕГУЛЯТОРНЫХ нкРНК, ПЕРЕКРЫВАЮЩИЕСЯ ПО ЛОКАЛИЗАЦИИ С ГЕНАМИ КАРДИОМИОПАТИЙ
Установлено, что в пределах генов КМП локализованы гены различных регуляторных нкРНК, в том числе микроРНК, длинных некодирующих РНК (lncRNA, lncРНК), кольцевых РНК (circRNA, circРНК) (табл. 1). МикроРНК относятся к классу коротких интерферирующих РНК, размером менее 200 нуклеотидов (длиной в среднем 22 нуклеотида). Основная функция микроРНК заключается в регуляции экспрессии генов на посттранскрипционном уровне: связываясь со своими мишенями на матричной РНК (мРНК), они приводят к репрессии трансляции [23, 24]. Как правило, одна и та же микроРНК имеет сайты связывания на мРНК многих генов, а мРНК одного и того же гена, в свою очередь, способна связывать несколько различных микроРНК. Описаны также неканонические эпигенетические механизмы действия микроРНК: в ядре они могут участвовать в активации или подавлении транскрипции генов-мишеней [24]. То, что микроРНК играют критическую роль в обеспечении развития и нормального функционирования сердца, подтверждается наблюдениями, что специфичная для кардиомиоцитов делеция Dgcr8 (гена, необходимого для биогенеза микроРНК) приводит к развитию полностью пенетрантного патологического фенотипа у мыши: развивается дисфункция левого желудочка, которая прогрессирует до ДКМП и ранней летальности [25], а также многочисленными клиническими наблюдениями и экспериментальными исследованиями.
Таблица 1.
Примеры генов регуляторных некодирующих РНК, локализованных в генах кардиомиопатий и вовлеченных в эпигенетическую регуляцию
| Ген | Значимы для КМП# (по [14–16]) |
Гены нкРНК (название нкРНК согласно miRbase [17], RNAcentral [18], Genecards [19]) |
|---|---|---|
| ACADVL | ДКМП, ГКМП | MIR324 (miR-324-5p, miR-324-3p) |
| ANK2 | ДКМП, ГКМП, КМП | MIR1243 (miR-1243),MIR8082 (miR-8082), ANK2-AS1 (ANK2-AS1) |
| CACNB2 | ДКМП, АПЖКМП, ГКМП | LOC107984213 (LOC107984213) |
| CELSR3 | ГКМП | MIR4793 (miR-4793-5p, miR-4793-3p) |
| CHRM2 | ДКМП, КМП | MIR490 (miR-490-5p, miR-490-3p), LOC349160 (LOC349160) |
| CRYAB | ДКМП, ГКМП, КМП | HSPB2-C11orf52 (HSPB2-C11orf52) |
| CSRP3 | ДКМП, ГКМП, КМП | CSRP3-AS1 (CSRP3-AS1) |
| CTNNA3 | ДКМП, ГКМП, АПЖКМП, НКМЛЖ | MIR7151 (miR-7151-5p, miR-7151-3p) |
| DNAAF3 | ДКМП, РКМП, КМП | DNAAF3-AS1 (DNAAF3-AS1) |
| DMD | ДКМП, ГКМП, АПЖКМП, РКМП, НКМЛЖ, КМП | MIR3915 (miR-3915), MIR548F5 (miR-548f-3p) |
| JPH2 | ДКМП, ГКМП, НКМЛЖ | LOC121853007 (LOC121853007), экспрессирует lncRNA |
| KCND3 | ДКМП | KCND3-AS1 (KCND3-AS1), KCND3-IT1 (KCND3-IT1) |
| KCNJ2 | ГКМП | KCNJ2-AS1 (KCNJ2-AS1) |
| KCNJ5 | ГКМП | KCNJ5-AS1 (KCNJ2-AS1) |
| KCNQ1 | ГКМП | KCNQ1OT1 (KCNQ1OT1) |
| LIPT2 | КМП | LIPT2-AS1 (LIPT2-AS1) |
| MYH6 | ДКМП, ГКМП, АПЖКМП, РКМП, НКМЛЖ, КМП | MIR208A (miR-208a-5p, miR-208a-3p), экспрессирует rt-circRNA* |
| MYH7 | ДКМП, ГКМП, АПЖКМП, НКМЛЖ, РКМП | MIR208B (miR-208b-5p, miR-208b-3p), MHRT (MHRT), экспрессирует rt-circRNA* |
| MYH7B | ГКМП | MIR499A (miR-499a-5p, miR-499a-3p), MIR499B (miR-499b-5p, miR-499b-3p) |
| MIB1 | ГКМП, НКМЛЖ, ДКМП& | MIR133A1HG (MIR133A1HG), MIR133A1 (miR-133a-1, miR-133a-5p, miR-133a-3p), MIR1-2 (miR-1-2, miR-1-3p) |
| PRDM16 | ДКМП, ГКМП, РКМП, НКМЛЖ | MIR4251 (miR-4251) |
| RYR2 | ДКМП, ГКМП, АПЖКМП, НКМЛЖ, КМП | MIR4428 (miR-4428) |
| SHOC2 | ГКМП | MIR548E (miR-548e-5p, miR-548e-3p) |
| SPATA13 | КМП*, НКМЛЖ* | MIR2276 (miR-2276-5p, miR-2276-3p) |
| SYNE2 | ДКМП, РКМП | MIR548H1 (miR-548h-5p) |
| TTN | ДКМП, ГКМП, АПЖКМП, РКМП, НКМЛЖ | TTN-AS1 (TTN-AS1), экспрессирует 80 circРНК |
Примечание. Составлено по [14–22]. # Приведены КМП, для которых в указанных генах локализованы патогенные/вероятно патогенные варианты или варианты с неопределенной/конфликтной значимостью. Жирным шрифтом выделены формы КМП, генетические варианты которых зарегистрированы как в Simple ClinVar [14], так и в ClinGen [16]. ДКМП – дилатационная кардиомиопатия, КМП – кардиомиопатия, ГКМП – гипертрофическая кардиомиопатия, АПЖКМП – аритмогенная правожелудочковая кардиомиопатия, РКМП – рестриктивная кардиомиопатия, НКМЛЖ – некомпактный миокард левого желудочка. & Установлено только на животных моделях. * Неоднозначность результатов, по мнению авторов, возможно является артефактом [21].
К категории lncРНК относят РНК, размер которых превышает 200 нуклеотидов, они имеют сложную и пока еще не устоявшуюся классификацию [26, 27]. В качестве самостоятельного подтипа выделяют дивергентные lncРНК, которые транскрибируются в противоположном соседним генам направлении и могут вовлекаться в регуляцию их экспрессии [28]. Среди lncРНК, гены которых перекрываются по локализации с генами КМП, выделяют, например, KCNQ1OT1 и TTN-AS1. circРНК также относят к длинным нкРНК [29], включая подтип rt-circRNA (read through-circRNA), продуцирующийся из экзонов двух соседних генов одной и той же цепи [30, 31].
Длинные нкРНК могут обладать различными функциями: в ядре участвуют в регуляции транскрипции, в цитоплазме контролируют стабильность мРНК, выступают в качестве “губки” для микроРНК и других РНК, снижая тем самым их эффекты [23, 27]. При наличии и для lncРНК, и для мРНК общих элементов распознавания на микроРНК (microRNA recognition elements – MREs), lncРНК может конкурентно связываться с микроРНК, что будет приводить к усилению экспрессии генов-мишеней микроРНК (т.е. lncРНК могут выступать в качестве конкурирующей эндогенной РНК – competitive endogenous RNA, ceRNA, ceРНК). Согласованность сети lncРНК–микроРНК–мРНК влияет на функциональное состояние клетки, органа и организма в целом, и ее разбалансировка может лежать в основе развития патологии [32–35].
Одним из механизмов продуцирования регуляторных lncРНК является альтернативный сплайсинг. Например, сложный альтернативный сплайсинг характерен для мРНК гена кардиомиопатий TTN, который происходит при участии РНК-связывающего белка-20 (кодирует ген RBM20) [20, 36]. Для TTN идентифицировано 80 экспрессирующихся circРНК, уровень которых не коррелировал с уровнем экспрессии его гена-хозяина, но эффективность продуцирования данного класса молекул зависела как от структуры гена TTN, так и от функционирования участвующего в генерации circРНК гена RBM20 [20]. Известно, что варианты в гене RBM20 могут приводить к развитию различных форм КМП – прежде всего ДКМП, а также ГКМП, аритмогенной правожелудочковой КМП (АПЖКМП), НКМЛЖ [14–16]. На основании установления связи между метилированием ДНК гена TTN-AS1 (специфичность метилирования которого наблюдали при ДКМП) и сплайсингом мРНК высказано предположение, что нарушение сплайсинга может вызывать пропуск экзонов при транскрипции TTN, особенно в той его области, которая входит в состав А-полос саркомера, что может имитировать фенотип ДКМП, наблюдаемый при наличии мутаций, приводящих к укорочению белка титина (TTNtv) [37]. В миокарде большое количество circРНК продуцируют гены MYH6 и MYH7 (в том числе circРНК, консервативные в миокарде человека, крысы и мыши), но из-за высокой гомологии между данными генами и увеличения вероятности артефактов авторы подчеркивают необходимость проведения более тщательных исследований [21].
Среди генов нкРНК, локализованных в области генов КМП, не все охарактеризованы с функциональной точки зрения. К числу наиболее изученных при КМП относятся гены микроРНК MIR1-2 и MIR133A1 (локализованы в интронах гена MIB1), MIR208A (в гене MYH6); MIR208B (в гене MYH7); MIR490 (в гене CHRM2) и MIR499A (в гене MYH7B); гены lncРНК MHRT и KCNQ1OT1, перекрываются с генами MYH7 и KCNQ1 соответственно; а также TTN-AS1 (перекрывается с геном TTN). Кодируемые данными генами нкРНК (miR-1, miR-133a, miR-208a, miR-208b, miR-490, miR-499a, MHRT, KCNQ1OT1 и TTN-AS1) экспрессируются в клетках миокарда и вовлечены в обеспечение функционирования сердца в норме и при развитии патологических процессов на разных этапах онтогенеза [38–42].
нкРНК В СЕРДЦЕ В НОРМЕ И ПРИ КАРДИОМИОПАТИЯХ
Для ряда регуляторных нкРНК, гены которых располагаются в области генов КМП, установлены онтогенетическая и возрастная динамика экспрессии и функции, а также поло- и камеро-специфичные различия по уровню данных микроРНК в сердце [43–49]. Онтогенетическая динамика экспрессии характерна для lncРНК Mhrt: ее уровень возрастает в ходе дифференцировки кардиомиоцитов по мере развития сердца у эмбриона и в постнатальном периоде с увеличением возраста [45]. miR-1 и miR-133a контролируют преимущественно ранние стадии кардиогенеза, поддерживая детерминацию специфического для сердца мышечного клона из эмбриональных стволовых клеток и мезодермальных предшественников, а miR-208 и miR-499 участвуют на поздних стадиях кардиогенеза, опосредуя дифференцировку кардиобластов в кардиомиоциты и спецификацию быстрых/медленных мышечных волокон [50]. Экспрессия miR-208b снижается в ходе развития эмбриона мыши и в сердце взрослой особи, в норме эта микроРНК не выявляется [51]. miR-208a, miR-208b и miR-499, гены которых перекрываются с генами Myh6, Myh7 и Myh7b соответственно, относятся к одному семейству микроРНК, причем miR-208b и mir-499 функционально дублируют друг друга [43].
В сердце взрослых мышей происходит совместная экспрессия miR-208a и ее гена-хозяина Myh6, а miR-208a, в свою очередь, регулирует экспрессию двух медленных миозинов и их интронных микроРНК, Myh7 и miR-208b, Myh7b и miR-499 [43], но экспрессия miR-208b может также происходить независимо от экспрессии гена-хозяина Myh7 [52]. С другой стороны, miR-208b и ее предшественник pri-miR-208b участвуют в регуляции экспрессии генов MYH6 и MYH7, в том числе посредством вовлечения в эпигенетическую регуляцию на уровне метилирования/ацетилирования ДНК [53, 54]. В частности, повышенная экспрессия pri-miR-208b способствует взаимодействию метилтрансферазы гистонов Ezh2 с межгенным двунаправленным промотором, происходит метилирование H3K27m3, что приводит к подавлению экспрессии генов, кодирующих MYH7 (α-MHC) и антисмысловой транскрипт MYH6 (AS β-MHC), вследствие чего развивается гипертрофия сердца [53]. С другой стороны, при использовании ингибиторов гистоновой деацетилазы наблюдали гиперацетилирование межгенного двунаправленного промотора (которое сопровождалось высвобождением комплекса Ezh2/pri-miR-208b) и восстановление экспрессии генов α-MHC и AS β-MHC [53]. Подавление pri-miR-208b приводит к изменению экспрессии Ezh2-регулируемых генов, среди которых – Anp, Bnp, Tgfb3, Spp1, а также AS β-MHC и α-MHC.
На модельных объектах в левом желудочке сердца установлены различия между полами по уровню экспрессии pri-miR-208b и гена Myh6 (более высокие уровни экспрессии показаны для самок при отсутствии различий по уровню метилирования CpG-сайтов промотора pri-miR-208b между полами), тогда как уровень экспрессии зрелой miR-208b, а также Mhrt и гена Myh7 у представителей разных полов был сопоставим [47]. Различия в экспрессии pri-miR-208b в сердце между полами могут быть связаны с поло-специфичными эпигенетическими процессами, происходящими на уровне РНК и ДНК. В регуляции экспрессии miR-208b участвует lncРНК Mhrt (ген-хозяин данной lncРНК – Myh7), для которой установлено специфическое для полов метилирование, что определяет характер взаимодействия считывающего метилирование белка MeCP2 на промоторе pri-miR-208b. Так как в сердце самцов lncРНК Mhrt в позиции CG18 неметилирована, MeCP2 и белковый корепрессорный комплекс (состоит из Brg1, Rest, Hdac2) взаимодействуют с промотором pri-miR-208b, что приводит к репрессии транскрипции; в сердце самок позиция CG18 метилирована и наблюдается ее обогащение MeCP2, что позволяет транскрипцию pri-miR-208b [47]. Различия по уровню экспрессии в левом желудочке сердца между полами зарегистрированы и для других микроРНК как в норме, так и при КМП (в частности, при ишемической КМП), причем спектр дифференциально экспрессирующихся микроРНК специфичен при разных функциональных состояниях (у человека различия по уровню между полами зарегистрированы в норме для 15 микроРНК, при ишемической КМП – для трех микроРНК) [55].
Для семейства miR-208 зарегистрирована также заметная камерная специфичность экспрессии: miR-208a-3p и miR-208a-5p в изобилии представлены в левых предсердиях сердца, тогда как miR-208b-3p и miR-208b-5p преимущественно выявлялись в левых желудочках (аналогичная ситуация наблюдалась и для их генов-хозяев – α-MHC (MYH6) и β-MHC (MYH7) соответственно) [46]. Камерная специфичность экспрессии зарегистрирована и для других микроРНК, в том числе и в ответ на воздействие кардиотоксичных препаратов [56].
Длинные нкРНК также модулируют экспрессию и функцию генов в развивающемся сердце, в том числе и путем вовлечения в широкий спектр эпигенетических процессов. В регионе гена Kcnq1ot1 (антисмыслового транскрипта, локализованного в импринтированном регионе гена KCNQ1, который играет важную роль в развитии и функционировании сердца) выявлено множество энхансеров, в том числе и значимых для регуляции экспрессии его гена-хозяина Kcnq1 в сердце [57]. Уровни Kcnq1ot1 обратно коррелируют с уровнем Kcnq1 во многих тканях, на основании чего высказано предположение, что экспрессия данных генов является взаимоисключающей, при этом отмечают тенденцию к более высокой экспрессии Kcnq1ot1 в эмбриональных тканях по сравнению с тканями взрослого организма [57]. Установлено также, что экспрессирующиеся продукты области Kcnq1ot1 по молекулярной структуре, количеству и сложности различаются на разных этапах онтогенеза [57]. Кроме того, по мере развития сердца в миокарде экспрессия Kcnq1ot1 переключается на двуаллельную: происходит активация материнского транскрипта Kcnq1ot1 (который короче отцовского); его активация зависит от альтернативного сайта начала транскрипции, находящегося ниже СpG-островков, что позволяет таким образом обходить метку метилирования ДНК [44].
Характер взаимодействия между Kcnq1ot1 и его геном-хозяином Kcnq1 также отличается на разных этапах онтогенеза: на ранних этапах в сердце импринтинг Kcnq1 устанавливается и поддерживается независимо от экспрессии данной lncРНК, но на более поздних стадиях развития Kcnq1ot1 участвует в модуляции уровней Kcnq1, так как отсутствие данной антисмысловой нкРНК ведет к сверхэкспрессии Kcnq1, что сопровождается аберрантной трехмерной структурой хроматина [44]. То, что Kcnq1ot1 модулирует трехмерную конформацию хроматина, отмечали и другие исследователи [58]. Являясь lncРНК, KCNQ1OT1 может вовлекаться в различные метаболические процессы, выступая в качестве конкурирующей эндогенной РНК для широкого спектра микроРНК.
Известно, что КМП являются возраст-зависимыми патологиями, регистрируются также различия в клинической картине между мужчинами и женщинами [59–61]. Кроме того, в ряде случаев имеет место специфичность поражения различных отделов сердца при разных типах КМП (например, чаще регистрируют аритмогенную кардиомиопатию правого желудочка, некомпактный миокард левого желудочка, по сравнению с поражением других отделов сердца). Описанные выше различия по уровню экспрессии нкРНК, гены которых располагаются в области генов КМП (возрастные особенности, различия между полами, камерная специфичность), представляют интерес с точки зрения объяснения особенностей клинической картины развития заболеваний миокарда. Кроме того, приведенные данные свидетельствуют о том, что регуляторные нкРНК являясь эпигенетическими маркерами вовлекаются в широкий спектр других эпигенетических процессов, имеющих важное значение для нормального функционирования сердца и развития патологических состояний.
ЭКСПРЕССИЯ нкРНК В МИОКАРДЕ И СЫВОРОТКЕ КРОВИ ПРИ КАРДИОМИОПАТИЯХ
Для нкРНК, гены которых локализуются в области генов КМП, зарегистрированы изменения экспрессии в миокарде и сыворотке крови при развитии различных КМП, а также установлена их ассоциированность с признаками, отражающими функциональное состояние сердца у человека и модельных животных (см. Приложение, составлено по [39, 46, 53, 54, 62–92 ]). Такие данные получены для микроРНК miR-1, miR-133a, miR-208a, miR-208b, miR-324, miR-490, miR-499a и lncРНК – KCNQ1OT1, MHRT и др. Различия по уровню экспрессии микроРНК регистрировали при ГКМП, ДКМП, АПЖКМП, ишемической, диабетической и других формах КМП по сравнению с контролем или с другими заболеваниями сердечно-сосудистой системы, а также между различными формами КМП.
При развитии КМП для большинства привлеченных к анализу микроРНК наблюдали разнонаправленные изменения уровня экспрессии в миокарде (сыворотке) по сравнению с непораженными тканями, за исключением miR-490 (более низкий уровень в миокарде выявлен у пациентов с ишемической и неишемической КМП), miR-499 (увеличение уровня в клетках миокарда при ДКМП и ГКМП у человека) и miR-324 (более высокие уровни в сыворотке крови при идиопатической и ишемической ДКМП) (рис. 1; приложение). Следует, однако, отметить, что число исследований miR-490, -499 и -324 при КМП относительно невелико.
Рис. 1.
Ассоциация экспрессии нкРНК в миокарде (а) и сыворотке крови (б) с кардиомиопатиями и клинически значимыми признаками у человека. * – нкРНК; up/down/no dif – увеличение/снижение/нет различий уровня нкРНК при КМП по сравнению с контролем; plus/minus – положительная/отрицательная корреляция уровня нкРНК с эндофенотипом КМП. Детали – см. приложение.
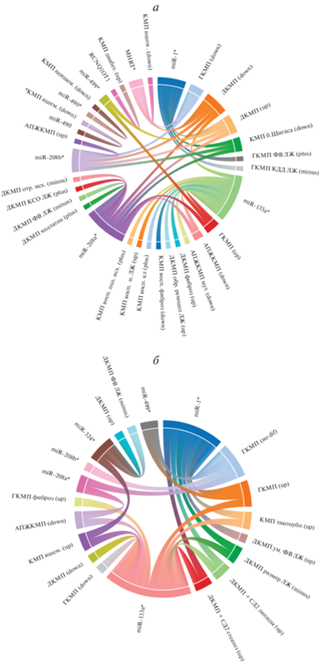
Для других микроРНК регистрировали разнонаправленные изменения уровня при развитии разных форм КМП, а также противоречивые результаты при исследовании одной и той же кардиомиопатии (рис. 1; Приложение). Так, и снижение, и увеличение уровня микроРНК по сравнению с контролем регистрировали для miR-1 при ГКМП, ДКМП, для miR-133a – при ГКМП, для miR-208a и miR-208b – при ДКМП. В некоторых случаях разнонаправленные изменения уровня микроРНК при одной и той же патологии могут быть связаны с возрастными особенностями анализируемых выборок, как, например, для miR-1 и miR-208a-5p при ДКМП у детей и взрослых [64, 72], но и для выборок взрослых индивидов также наблюдали разнонаправленные изменения уровня микроРНК при одной и той же КМП (рис. 1; Приложение).
МикроРНК miR-1 наиболее представлена в миокарде, на ее долю приходится 40% всей микроРНК [25], и она часто привлекалась к анализу при исследовании КМП. Помимо ДКМП и ГКМП от контроля отличался уровень miR-1 при КМП такоцубо (более высокий уровень в сыворотке крови) [65], а также при КМП у пациентов с хронической болезнью Шагаса (более низкий уровень в миокарде) [64]. Для miR-133a наряду с КМП, для которых зарегистрирован измененный уровень экспрессии miR-1 (за исключением КМП при хронической болезни Шагаса), отличия установлены для АПЖКМП, ишемической и воспалительной КМП (рис. 1; приложение). Интересно, что более низкий уровень miR-133a установлен не только у пациентов с АПЖКМП, в том числе у обладателей редких вариантов в генах DSP, PKP2 и JUP, но и у бессимптомных носителей данных вариантов среди членов семей, отягощенных данной патологией [84].
Несмотря на то что гены miR-1 и miR-133a имеют общий ген-хозяин (MIB1) и экспрессируются с одного транскрипта, для них регистрируются неоднозначные, а иногда и разнонаправленные изменения экспрессии при одной и той же КМП (рис. 1; Приложение). Например, в сыворотке крови у пациентов с ГКМП наблюдали повышенный уровень miR-133a и снижение уровня miR-1 (на уровне тенденции), что по мнению некоторых исследователей [66] может быть следствием их экспрессии в разных типах клеток и соответственно отражать вовлеченность в различные внутриклеточные метаболические процессы и разную функциональную значимость.
Для miR-208a и miR-208b наблюдали отклонения в уровне экспрессии в миокарде при ГКМП, ДКМП, АПЖКМП и КМП у пациентов с хронической болезнью Шагаса (рис. 1; Приложение). Также регистрировали увеличение уровня miR-499 в клетках миокарда при сердечной недостаточности и гипертрофии сердца у человека, которое было более выражено, чем для miR-208 [88].
Кроме того, различия по уровню экспрессии микроРНК установлены между образцами миокарда (реже образцами сыворотки крови) пациентов с различными формами КМП, причем различия наблюдали даже в случае однонаправленного изменения экспрессии при КМП по сравнению с контролем (приложение). Например, более низкие уровни miR-1 выявлены в миокарде пациентов и с ГКМП, и с ДКМП, но в связи с разным уровнем снижения данной микроРНК по сравнению с контрольными образцами регистрировались также значимые различия и между этими формами КМП [69]. Различия по уровню miR-324 в сыворотке крови установлены между пациентами с идиопатической и неидиопатической ДКМП, при том что для них показаны более высокие уровни данной микроРНК по сравнению со здоровыми индивидами [71].
По уровню экспрессии микроРНК в миокарде пациенты с КМП также отличались от лиц с другими заболеваниями сердечно-сосудистой системы: для miR-133 различия зарегистрированы между КМП такоцубо и инфарктом миокарда с подъемом зубца ST, между ДКМП и КМП у пациентов с хронической болезнью Шагаса и др. (приложение). Пациенты с АПЖКМП отличались по уровню экспрессии в перикардиальной жидкости miR-1-3p по сравнению с пациентами с постинфарктной желудочковой тахикардией [73]. Уровни экспрессии шести микроРНК, включая miR-133a, были информативными для дифференциации пациентов с АПЖКМП от здоровых индивидов, пациентов с другими КМП (ГКМП, ДКМП) и другими заболеваниями сердца (синдром Бругада, миокардитом), а также от здоровых членов семьи с АПЖКМП, являющихся носителями патогенных вариантов в демосомных генах [84]. Различия по уровню экспрессии в клетках миокарда установлены для miR-490-3p между пациентами с ишемической и неишемической КМП [87].
Важно подчеркнуть, что данные по изменению уровня экспрессии микроРНК в миокарде не всегда согласуются с оценками, полученными в образцах сыворотки крови даже для одних и тех же пациентов (рис. 1; табл. Приложение). Например, снижение уровня miR-1 и увеличение уровня miR-208a регистрировали в миокарде, но не в сыворотке крови [70]; уровень miR-133 в миокарде (но не в сыворотке) был предиктором комбинированной конечной точки у пациентов с ДКМП [82]. В то же время у пациентов с АПЖКМП уровень miR-133a-3p снижался в образцах и крови, и миокарда, причем даже независимо от наличия/отсутствия редких вариантов в десмосомных генах [84].
Для микроРНК установлена также ассоциированность с характером течения КМП (наличие фиброза, выживаемость, бессобытийность), ЭХО-кардиографическими параметрами, отражающими функциональное состояние сердца (рис. 1; табл. Приложение), что свидетельствует в пользу неслучайности выявленной динамики изменения уровня микроРНК при развитии КМП.
Несмотря на то что результаты исследований, выполненных на животных, не всегда соответствуют данным, полученным при обследовании человека, они существенно расширяют представления о значимости микроРНК в развитии различных КМП. Так, в дополнение к данным, полученным при обследовании человека, показано, что изменение уровня анализируемых микроРНК наблюдалось при воздействии различных провоцирующих развитие КМП стимулов, в том числе – мутаций в генах КМП (трансгенные животные); химических веществ (стрептозотоцин, фенантрен), механических (поперечное сужение аорты), стресса, параллельно с развитием патологических изменений в сердце, соответствующих различным КМП – ГКМП, АПЖКМП, диабетической КМП, а их уровень коррелировал с патофизиологическими признаками и клиническими особенностями (рис. 2; Приложение).
Рис. 2.
Уровень экспрессии нкРНК в миокарде у животных (мышь) при моделировании КМП. * – нкРНК; up/down – увеличение/снижение уровня нкРНК при КМП по сравнению с контролем. Детали – см. Приложение.

Для miR-499 на моделях животных были получены результаты, отличающиеся от таковых у человека (рис. 1 и 2; приложение). На мышиной модели (miR-499-трансгенные мыши) показано, что miR-499 индуцировала прогрессирующее увеличение сердца и сократительную дисфункцию, и с возрастом у таких особей развивалась ДКМП [88]. Однако снижение miR-499 в миокарде зарегистрировано у трансгенных мышей со специфичной для кардиомиоцитов сверхэкспрессией гена DSG2, несущего нонсенс-мутацию p.Gln558Ter, характерную для аритмогенной кардиомиопатии у человека [89], у трансгенных мышей, несущих двойную мутацию в генах ГКМП (p.Gly203Ser в TnI и p.Arg403Gln в Myh6) [63], и у мышей, страдающих диабетической КМП, с дефицитом лептиновых рецепторов [90], тогда как уровень данной микроРНК был повышен в миокарде мышей с диабетической КМП, индуцированной стрептозотоцином [67] и при Gq-опосредованной КМП [88]. Эти данные свидетельствуют о том, что направленность изменения уровня экспрессии микроРНК может не только различаться при разных типах КМП, но и зависеть от стимула (как эндогенного, так и экзогенного), вызвавшего развитие патологии.
Только на основании уровня экспрессии нкРНК нельзя сделать заключение об их участии в патогенезе болезни. Однако для рассматриваемых нкРНК была установлена вовлеченность в регуляцию экспрессии генов в миокарде. Изменение уровня miR-208a, miR-208b, miR-499 влияло на экспрессию в сердце генов, имеющих мишени для данных микроРНК (в том числе и транскрипционных факторов) [51, 88]. Так, активация miR-499 способствовала развитию сердечной недостаточности посредством прямой регуляции 67 первичных мРНК-мишеней и косвенной регуляции большого количества мРНК и белков сердца [88].
Кроме того, доказательства вовлеченности данных микроРНК в патогенез КМП получены на клиническом и молекулярно-генетическом уровнях. На животных моделях показано, что снижение уровней miR-1 и miR-133a в миокарде происходит на стадии, предшествующей ГКМП, и это предполагает их участие в раннем этапе развития болезни (рис. 2; приложение) [63]. Уровень miR-133 не только различался между пораженными и непораженными фиброзом участками сердца пациентов с ДКМП [81], но определял молекулярно-генетические преобразования при развитии данного патологического процесса. Так, на модельных животных и у пациентов с ГКМП показано, что уровень miR-133a был обратно пропорционален количеству фактора роста соединительной ткани (CTGF), выполняющего ключевую роль в процессе фиброза (на мРНК CTGF доказано наличие мишеней для miR-133a) [93]. У мышей с диабетической КМП, вызванной приемом стрептозотоцина, в миокарде наблюдали снижение уровня miR-133a, что сопровождалось увеличением мРНК коактиватора транскрипции EP300, основных маркеров фиброза (трансформирующего фактора роста-β1, фактора роста соединительной ткани, фибронектина (FN1) и COL4A1) и увеличением очагового фиброза, тогда как сверхэкспрессия сердечной miR-133a снижает уровни мРНК маркеров фиброза в сердце мыши с диабетом [76]. Однако не во всех исследованиях подтверждена связь данной микроРНК с фиброзом [82]. Кроме того, miR-133a, уровень которой изменяется в миокарде и сыворотке крови при КМП, развивающихся вследствие инфекционных процессов, в том числе и при COVID-19, коррелировал не только с морфофункциональными параметрами сердца, но и с клеточными и биохимическими маркерами воспаления [79, 83, 94].
Повышение уровня экспрессии miR-208а в миокарде было достаточно, чтобы развилась гипертрофия сердца, тогда как ингибирование данной микроРНК ослабляло индуцированную стрессом гипертрофию и ремоделирование сердца [38, 42]. Высокий уровень miR-208a не только вызывал гипертрофию миокарда и развитие аритмии, но также влиял на электрофизиологию и эхокардиографические показатели сердца [38, 42, 51]. Для miR-208а также установлена корреляция с уровнем мРНК β-MHC (Myh7), объемом миокардиального коллагена, с неблагоприятными клиническими исходами [85]. Повышенная экспрессия miR-208b в миокарде приводила у мышей к гипертрофии сердца, но подавление данной микроРНК предотвращало переход адаптивного ремоделирования в неадаптивное в мышиной модели ДКМП, связанной с нарушением работы гена Ttn (рис. 2; приложение) [54].
Для lncРНК MIHRT и KCNQ1OT1 также установлены изменения уровня экспрессии при развитии КМП (рис. 1 и 2; Приложение). В частности, зарегистрировано снижение в клетках миокарда уровня MHRT на 82.8, 72.8 и 65.9% при ГКМП, ишемической КМП и идиопатической ДКМП соответственно [39]. У пациентов с гипертонической болезнью в мононуклеарах крови наблюдали более высокий уровень MHRT, который значимо отрицательно коррелировал с индексом массы миокарда левого желудочка [95]. Несмотря на то что гены lncРНК Mhrt и микроРНК miR-208b расположены в области одного и того же гена КМП (Myh7), они оказывают разное влияние в отношении функционирования сердца: при перегрузке давлением Mhrt обладает защитным эффектом, тогда как miR-208 – неблагоприятным эффектом на сердце [39, 51, 96].
Участие в развитии гипертрофии миокарда показано для днРНК Kcnq1ot1. Kcnq1ot1 выступает в качестве эндогенной конкурирующей РНК, формируя ось Kcnq1ot1/miR-30e-5p/ADAM9: при секвестировании miR-30e-5p увеличивается экспрессия ADAM9 и происходит репрессия ангиотензин-II-индуцированного гипертрофического фенотипа в кардиомиоцитах [97].
Функциональная значимость TTN-AS1 исследовалась в основном при онкологических заболеваниях, в которых показано, что она может действовать как ceРНК, вовлекаясь в различные метаболические пути, в том числе и значимые для сердечно-сосудистой системы. В частности, TTN-AS1 выступает в качестве “губки” для miR-142-5p (которая регулирует уровень экспрессии циклинзависимой киназы 5 – CDK5) [98], для miR-573 (регулирует уровень экспрессии транскрипционного фактора E2F3) [99], для miR-376b-3p (регулирует уровень экспрессии репрессора транскрипции KLF12) [100], для miR-153-3p (регулирует уровень экспрессии фермента ZNRF2, необходимого для активации PI3K/Akt/mTOR метаболического пути) [101]. Среди этих микроРНК для miR-142 установлено изменение уровня в сыворотке крови детей с ДКМП [102], при развитии аритмогенной КМП по сравнению как с контролем, так и с другими КМП и заболеваниями сердечной мышцы [84]; у пациентов с семейной ДКМП, связанной с мутациями в гене LMNA, и у носителей данных мутаций без клинических проявлений [103]; у пациентов с тяжелым по сравнению с умеренным течением ДКМП [71]. Для miR-376b-3p установлена дифференциальная экспрессия в миокарде при КМП правого желудочка, индуцированной трикуспидальной регургитацией, по сравнению с нормальным миокардом (в данном случае установлена регуляторная ось с участием и данной микроРНК, и TTN-AS1 – TTN-AS1/hsa-miR-376b-3p/TRPM5) [101].
При КМП (в частности, при ДКМП) нарушается продуцирование circРНК из генов, патогенные мутации в которых приводят к КМП, в том числе – из генов TTN и RYR2 [20, 21]. В интронах генов, связанных с кардиомиопатиями (например, TTN, ACTC1, TPM1, JPH2, ANKRD1, DTNA, TMPO и FHL2), локализованы и другие lncРНК, которые дифференциально экспрессировались в миокарде между пациентами с ГКМП и здоровыми индивидами [22].
Таким образом, уровни микроРНК и днРНК, гены которых локализуются в области генов КМП, изменяются в миокарде и в сыворотке крови при развитии кардиомиопатий, но эти изменения не всегда воспроизводятся или даже могут носить разнонаправленный характер.
ВОЗМОЖНЫЕ ПРИЧИНЫ ПРОТИВОРЕЧИВОСТИ РЕЗУЛЬТАТОВ ОЦЕНКИ УРОВНЯ микроРНК И lncРНК В МИОКАРДЕ И СЫВОРОТКЕ КРОВИ ПРИ КАРДИОМИОПАТИЯХ
Противоречивость результатов изменения уровня микроРНК при КМП, полученных в разных исследованиях, может быть связана с различиями по полу и возрасту, стадии болезни индивидов, участвующих в исследовании, по участкам миокарда, в которых проводился молекулярный анализ, а также может быть следствием эффектов эндогенных и экзогенных средовых факторов.
На мышиной модели ГКМП (мыши c мутациями p.Gly203Ser в тропонине I (TnI-203) и p.Arg403Gln в тяжелой цепи α-миозина (MHC-403)) показано, что изменения экспрессии miR-1 и miR-133a в миокарде желудочков регистрируются еще до начала развития гипертрофии (которое для miR-1 сохраняется на всех стадиях – ранней, стабильной и конечной), тогда как снижение miR-499-5p выявлено только на конечной стадии болезни [63]. При ДКМП в верхушке сердца выявили снижение уровня ряда микроРНК (в том числе и miR-133a), тогда как в перегородке сердца между пораженными ДКМП и здоровыми сердцами различий не было выявлено [81]. Кроме того, для ряда микроРНК (miR-1, miR-133a, miR-208a, miR-324) установлены корреляции с параметрами, отражающими клинические особенности и тяжесть течения КМП (рис. 1; Приложение).
микроРНК также могут вовлекаться в разные с точки зрения патогенеза процессы, в том числе и с противоположными эффектами. Так, активация miR-499 связана как с патогенезом гипертрофии сердца посредством регуляции экспрессии генов саркомерных белков [88], так и с возможной кардиозащитной ролью через регуляцию проапоптотических генов, таких как Pdcd4 и Pasc2 [104]. Для miR-208a также показаны противоположные эффекты в отношении функционирования сердца при развитии ГКМП, посредством вовлеченности в различные молекулярные сети (см. обзор [42]). Так, miR-208a может регулировать экспрессию не только антигипертрофических, но и прогипертрофических генов (например, ген транскрипционного фактора Gata4, необходимый для развития гипертрофии сердца, ингибируется miR-208a) [51].
Экспрессионные профили нкРНК могут модифицироваться наличием сопутствующей патологии (и ее стадией) у обследованных индивидов. miR-208b рассматривают в качестве сывороточного маркера фибрилляции предсердий [105], ее уровень также повышен в миокарде у пациентов с данной патологией [69]. При этом фибрилляция предсердий может быть начальной стадией проявления кардиомиопатий (в том числе и у носителей патогенных/вероятно патогенных вариантов в генах КМП) [106], а фенотип аритмогенной КМП может встречаться при других генетически обусловленных кардиомиопатиях [107].
По сравнению с контролем наблюдали более высокие уровни экспрессии KCNQ1OT1 в сыворотке крови у пациентов с инфарктом миокарда с подъемом сегмента ST [108], у больных ишемической болезнью сердца [109], а MHRT – в мононуклеарных клетках периферической крови у пациентов с гипертонической болезнью [95]. В то же время для MHRT получены противоречивые данные об изменении ее уровня даже при одном и том же патологическом фенотипе. Так, в одном исследовании показано, что у пациентов с хронической сердечной недостаточностью уровень lncРНК MHRT был снижен в сыворотке крови, причем пациенты с низким уровнем данной lncРНК имели более неблагоприятный прогноз по выживаемости [110], в другой работе при этой же патологии зарегистрирован более высокий ее уровень в плазме крови, который положительно коррелировал с некоторыми кардиальными биомаркерами (аспартатаминотрансферазой и лактатдегидрогеназой) [111]. J. Zhang с соавт. [112] показано, что lncРНК MHRT обладает защитным эффектом для кардиомиоцитов, а концентрация MHRT в плазме может служить диагностическим биомаркером для инфаркта миокарда (ИМ), тогда как другая группа исследователей [113] отмечала, что MHRT способствовала фиброзу миокарда после ИМ через взаимодействие с miR-3185. Уровень MHRT при патологии может различаться в зависимости от стадии болезни [114].
На основании анализа дифференциально экспрессирующихся lncРНК, микроРНК, а также мРНК в миокарде при сердечной недостаточности была сформирована сеть ceРНК, состоящая из 58 узловых мРНК, 5 микроРНК, 82 lncРНК, причем KCNQ1OT1 была среди трех наиболее значимых lncРНК [115]. Таким образом, одна и та же регуляторная нкРНК может быть вовлечена в формирование различных сетей с участием ceРНК, что может быть связано с дифференцированным ответом экспрессии микроРНК и lncРНК на эндогенные и экзогенные стимулы.
ВОВЛЕЧЕННОСТЬ нкРНК В МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ ПРОЦЕССЫ В КАРДИОМИОЦИТАХ И МИОКАРДЕ В КОНТЕКСТЕ СРЕДОВЫХ ВОЗДЕЙСТВИЙ
Известно, что, с одной стороны, развитие КМП может быть спровоцировано воздействием каких-то внешних (стресс, прием лекарственных препаратов) или внутренних (беременность, гипергликемия, гипертиреоидизм) факторов, с другой, – такие же факторы могут влиять на изменение паттерна экспрессии нкРНК. При этом средовые факторы по-разному влияют на изменение уровня экспрессии нкРНК, которые вовлекаются в разнообразные патофизиологические процессы (в том числе и как сеРНК) и соответственно различаются по эффектам на функцию сердца и сосудов с точки зрения вред/польза. Так, уровень miR-1, miR-133a, miR-499 чувствителен к таким факторам как глюкоза, активные формы кислорода, фенантрен, ишемическое прекондиционирование и др., что может сказываться на патофизиологических процессах, значимых для развития КМП (табл. 2).
Таблица 2.
Вовлеченность нкРНК в молекулярно-генетические процессы в кардиомиоцитах и миокарде модельных животных или человека в контексте средовых воздействий
| Фактор | Объект | Изменение экспрессии | Включенность в регуляторную сеть | Эффект | Источник |
|---|---|---|---|---|---|
| Химические вещества | |||||
| Сероводород | Кардиомиоциты новорожденных крыс | ↓ miR-1 | miR-1/Hdac4 | Защита от апоптоза | [116] |
| Активные формы кислорода | Кардиомиоциты мыши | ↑ miR-133a-3p | circNCX1/miR-133a-3p/Cdip1 | Способствует апоптозу | [117] |
| Фенантрен | Миокард, клетки H9C2 крыс | ↓ miR-133a | miR-133a/CdC42, RhoA | Способствует гипертрофии кардиомиоцитов | [80] |
| Триоксид мышьяка | Кардиомиоциты, миокард мыши | ↓ Kcnq1ot1 | – | Внезапная сердечная смерть | [118] |
| Лекарственные препараты | |||||
| Карведилол, блокатор β-адренорецепторов | Сыворотка пациентов с CH | ↑ miR-1 | – | Кардиопротекция | [119] |
| Тикагрелор | Сосуды аорты, пациенты с ИБС | ↑ KCNQ1OT1 | – | Защитный эффект сосудов аорты | [109] |
| Доксорубицин | Кардиомиоциты AC16 из желудочков новорожденных крыс | ↑ модификации m6A Kcnq1ot1 | Mettl14/Kcnq1ot1(+Igf2bp1)/ miR-7-5p/Mettl14* | Регуляция ферроптоза кардиомиоцитов | [120] |
| Клетки миокарда мышей, ткани миокарда мышей с СН | ↑ Kcnq1ot1 | Kcnq1ot1/Fus | Уменьшение фиброза миокарда, ингибирование апоптоза кардиомиоцитов у мышей с СН | [121] | |
| Метаболиты | |||||
| Стимуляция TNF-α и IL-1β | Изолированные кардиомиоциты новорожденных крыс | ↑ miR-133а | – | Влияет на количество воспалительных клеток в миокарде и на восстановление функции ЛЖ | [79] |
| Глюкоза | Кардиомиоциты, миокард мыши с СД | ↓ miR-499-5p | Tug1/miR-499-5p | Развитие гипертрофии | [90] |
| Кардиомиоциты, миокард мыши с СД | ↑ Kcnq1ot1 | Kcnq1ot1/miR-181a-5p/Pdcd4 | Усиление воспаления миокарда и апоптоза кардиомиоцитов | [92] | |
| Глюкоза | Кардиомиоциты мыши с СД2 (модель) | При ↑ Kcnq1ot1 | Kcnq1ot1/miR-378a/mt-ATP6/ ATP | Положительное влияние на функциональность АТФ-синтазы в сердце при СД2 | [122] |
| Фибробласты сердца | ↑ Kcnq1ot1 | Kcnq1ot1/miR-214-3p/Caspase-1/ TGF-β1/Smad1/Smad2 | Прогрессирование диабетической КМП, активация пироптоза | [123] | |
| Ангиотензин II | Миокард мыши | ↑ Kcnq1ot1 | Kcnq1ot1/miR-384/Cacna1c | Фибрилляция предсердий | [124] |
| Гипертрофические кардиомиоциты мыши | Kcnq1ot1 | Kcnq1ot1/miR-30e-5p/Adam9 | Благоприятствует гипертрофии сердца | [97] | |
| Пищевые вещества | |||||
| Диетическое льняное масло | Миокард крыс | ↑ miR-133а | miR-133а/Col 1α1 | Кардиопротекция | [125] |
| 6-Гингерол | Кардиомиоциты | ↓ KCNQ1OT1 | KCNQ1OT1/miR-340-5p/ PI3K/AKT | Защита кардиомиоцитов от повреждения при гипоксии | [126] |
| Патологические состояния, заболевания | |||||
| Ишемическое посткондиционирование | Миокард пациентов, перенесших двойную замену клапанов | ↓ miR-1 | miR-1/BCL2 | Ослабление апоптоза | [127] |
| Гипоксия | Кардиомиоциты мыши, модель острого инфаркта миокарда | ↑ Kcnq1ot1 | Kcnq1ot1/miR-466k/miR-466i-5p/ Tead1 | Повреждение кардиомиоцитов в процессе острого инфаркта миокарда | [128] |
| Сепсис | Миокард крысы с сепсисом | ↓ Kcnq1ot1 | Kcnq1ot1/miR-192-5p/Xiap | Апоптоз кардиомиоцитов | [41] |
| Прекондиционирование гипертрофии миокарда, вызванное физической нагрузкой | Миокард мыши | ↑ Mhrt779 | Mhrt779/Brg1/Hdac2/p-Akt/ p-GSK3β | Антигипертрофический эффект | [129] |
| Гипертиреоз | ЛЖ крыс | ↑ в 5 раз Mhrt | – | Повышение соотношения Myh6/Myh7 | [130] |
| Патологический стресс | Миокард мыши | ↓ Mhrt | – | Развитие кардиомиопатии | [39] |
Интересно, что измененный уровень некоторых микроРНК в образцах левого желудочка сердца не восстанавливался после нормализации уровня глюкозы в крови: в частности, сохранялся повышенный уровень miR-342-3p, -490-3p и пониженный – miR-133a и miR-1 (miR-133a участвует в процессах аутофагии и гипертрофии, miR-1 – в развитии гипертрофии) [67]. В сыворотке крови крыс маркером кардиотоксичности, обусловленной лекарствами, является уровень miR-208 [131], а блокатор β-адренорецепторов карведилол приводит к увеличению экспрессии miR-1 в сыворотке крови, что оказывает кардиопротективный эффект у пациентов с сердечной недостаточностью [119].
При этом, с одной стороны, уровень регуляторных нкРНК зависит от других эпигенетических маркеров, а с другой, – они сами вовлекаются в эпигенетические процессы на разных уровнях. Например, в культуре H9C2 кардиомиоцитов крысы снижение уровня miR-133a при воздействии фенантреном достигается за счет увеличения метилирования CpG сайтов в промоторе гена Mir133a [80]. Уровень экспрессии miR-133a-1 при развитии кардиомиопатии контролируется гистондеацетилазами: показано, что HDAC1 и HDAC2 связываются с энхансерными областями гена Mir-133a-1, и на модельных объектах путем их блокировки удалось нормализовать уровень данной микроРНК и снизить неблагоприятные эффекты развития КМП (снижалась экспрессия фактора роста соединительной ткани, уменьшался фиброз миокарда и диаметр левого предсердия, приводя к улучшению диастолической функции сердца) [78].
miR-208 и miR-499 совместно с miR-1 и miR-133 влияют на уровень гистоновых метилтрансфераз и деметилаз, регулирующих триметилирование H3K27 (H3K27me3 – эпигенетическую модификацию, значимую для регуляции репрессии транскрипции), что приводит к изменению глобального уровня H3K27me3 (включая промоторные области кардиальных факторов транскрипции) и снижению их экспрессии в фибробластах сердца [132].
Уровень микроРНК может регулироваться lncРНК. На мышиной модели гипертрофии сердца показано, что lncРНК ROR способствует гипертрофии сердца посредством взаимодействия с miR-133 [133]. Высокий потенциал связывания с miR-133 показан для circALMS1_6, и это взаимодействие определяет процессы ремоделирования сердца [21]. Эффект miR-499-5p на развитие патологического фенотипа при диабетической КМП (диастолическая дисфункция, гипертрофия сердца) зависит от lncРНК TUG1, которая напрямую взаимодействует с данной микроРНК, участвуя в развитии гипертрофии сердца [90]. Нокдаун TUG1 ослаблял гипертрофию сердца, индуцированную диабетической КМП, и диастолическую дисфункцию за счет увеличения уровня miR-499-5p [90].
В ряде исследований для микроРНК и lncРНК установлена вовлеченность в формирование различных типов тройной сети “lncРНК–микроРНК–мРНК” (и более сложных), значимых для развития патологических процессов в сердечно-сосудистой системе (см. табл. 2). Например, на фибробластах сердца показано, что при воздействии глюкозы в результате увеличения уровня Kcnq1ot1 формирование оси Kcnq1ot1/miR-214-3p/Caspase-1/TGF-β1/Smad1/Smad2 способствует активации пироптоза и прогрессированию диабетической КМП [123].
В сложные эпигенетические взаимосвязи вовлечена lncРНК MHRT. Данная lncРНК защищает от патологической гипертрофической кардиомиопатии несколькими путями [9, 134, 135]. Так, Mhrt может ингибировать гипертрофию миокарда, индуцированную транскрипционным фактором миокардин (Myocd), посредством его ацетилирования с помощью HDAC5, а миокардин способен напрямую активировать транскрипцию Mhrt посредством связывания с CarG-боксом, т.е. Mhrt и миокардин образуют петлю регуляции в процессе гипертрофии сердца [134]. Возможны и иные пути участия Mhrt в возникновении и развитии гипертрофии миокарда, например путь Mhrt/KLF4/миокардин: Mhrt способствует экспрессии KLF4 посредством прямого связывания с miR-145a-5p или ингибирования фосфорилирования транскрипционного фактора KLF4 путем образования с ним комплекса для предотвращения связывания данного транскрипционного фактора с белками ERK, тем самым происходит ингибирование экспрессии миокардина и развитие гипертрофии миокарда [135].
Кроме того, Mhrt также может противодействовать функции фактора ремоделирования хроматина Brg1 путем связывания с его хеликазным доменом, что не позволяет Brg1 распознавать свои мишени в геномной ДНК (такие как Myh6, Myh7 и др.), предотвращая аберрантную реактивацию генов в сердце плода во время стресса [39, 45]. Mhrt779 (наиболее распространенная форма Mhrt в желудочках сердца взрослых мышей) может связывать SWI/SNF-ассоциированный матричный актин-зависимый регулятор хроматина Brg1, чтобы ингибировать активацию гистоновой деацетилазы 2 (путь Mhrt779/Brg1/Hdac2/p-Akt/p-GSK3β) [129]. Предварительное кондиционирование гипертрофии физической нагрузкой повышает экспрессию днРНК Mhrt779 за счет увеличения 3-метилирования гистона 3 на промоторе а4 Mhrt779 [129]. В то же время при патологическом стрессе вследствие активации репрессорного комплекса хроматина Brg1–Hdac–Parp регистрировали ингибирование транскрипции Mhrt в сердце, и это снижение способствовало развитию КМП (восстановление Mhrt до дострессового уровня защищало сердце от гипертрофии и сердечной недостаточности) [39].
При этом в условиях стресса гормон трийодтиронин (T3) активирует промотор Mhrt в двух чувствительных к гормонам щитовидной железы элементах, расположенных в критической области, которая необходима как для активации Mhrt, так и для Brg1-зависимой репрессии Mhrt (что происходит только в условиях гетерохроматизации ДНК) [130]. T3 также способен предотвращать избыточную экспрессию Brg1, наблюдаемую в условиях после ишемии/реперфузии миокарда, посредством пути, который может повлечь за собой T3-опосредованное повышение экспрессии miR-208a [130]. Избыточная экспрессия Mir208a приводит к резкому подавлению транскрипта фактора ремоделирования хроматина Brg1, что сопровождается более чем двукратным увеличением уровня экспрессии длинной нкРНК Mhrt и почти пятикратным увеличением отношения Myh6/Myh7 [130]. Авторы процитированного исследования заключили, что реципрокное ингибирование Mhrt-Brg1 представляет собой цепь отрицательной обратной связи, критически важную для поддержания функционирования сердца.
KCNQ1OT1 также чувствительна к средовым воздействиям. Токсичность для сердца препарата против острого промиелоцитарного лейкоза триоксида мышьяка (вызывает внезапную сердечную смерть в результате синдрома удлиненного интервала QT) связана с подавлением lncРНК Kcnq1ot1 [118]. В то же время тикагрелор (препарат, используемый для профилактики атеротромботических осложнений у пациентов с острым коронарным синдромом) увеличивает экспрессию lncРНК KCNQ1OT1, что активизирует процессы, предотвращающие повреждение окисленными липопротеинами низкой плотности (ox-LDL) в гладкомышечных клетках сосудов аорты [109].
KCNQ1OT1, выступая в качестве ceРНК, вовлекается в многочисленные метаболические пути с разнонаправленными эффектами, в том числе и патогенетически значимые для функционирования сердечно-сосудистой системы. Так, на основании анализа дифференциально экспрессирующихся в моноцитах генов показана высокая степень связности KCNQ1OT1 с микроРНК при ИБС (miR-186-5p, miR-29c-3p, miR-493-5p, miR-30b-5p, miR-326, miR-543, miR-376a-3p, miR-103a-3p) [136] и при сердечной недостаточности (miR-17-5p, miR-20b-5p, miR-107, miR-125a-5p и miR-140-5p) [115]. Уровень miR-186-5p повышался в кардиомиоцитах при неишемической ДКМП, вызванной длительным употреблением этанола (алкогольной КМП), и при обработке этанолом кардиомиоцитов, при этом снижался уровень ингибитора апоптоза XIAP, что способствовало апоптозу кардиомиоцитов [137]. Уровень miR-29c снижался в миокарде при ДКМП [81] и в крови при структурных и функциональных аномалиях сердца среди женщин-носительниц мутаций в гене дистрофина (DMD) [138]. При этом как одна и та же lncРНК может вовлекаться в регуляцию разных микроРНК, так и для одной и той же микроРНК в качестве конкурирующих могут выступать разные lncРНК. Например, для miR-376-3p в качестве ceРНК может выступать не только KCNQ1OT1, но и LINC01703 и MEG3 [115].
Kcnq1ot1, выступая в качестве губки для miR-466k и miR-466i-5p, обусловливает увеличение экспрессии транскрипционного фактора Tead1, тем самым вызывая повреждение кардиомиоцитов в процессе острого инфаркта миокарда [128], связываясь с miR-204-5p усугубляет ишемическо-реперфузионное повреждение миокарда у мышей за счет увеличения экспрессии LGALS3 [139], а с miR-223-3p – вовлекается в патогенез мерцательной аритмии [140], ослабляет гипертрофию сердца за счет модуляции оси miR-2054/AKT3 [141]. In vivo и in vitro показано, что ось KCNQ1OT1/miR-26a-5p/ ATG12 регулирует аутофагию и апоптоз кардиомиоцитов [142].
Уровень Kcnq1ot1 в митохондриях кардиомиоцитов значительно снижен по сравнению с контролем у пациентов с сахарным диабетом (СД) 2-го типа и 25-недельных мышей Db/Db (в данном случае была задействована метаболическая ось Kcnq1ot1/miR-378a/mt-ATP6/ATP) [122]. В то же время повышенный уровень экспрессии KCNQ1OT1 регистрировали в кардиомиоцитах человека, обработанных высокими концентрациями глюкозы, что приводило к увеличению уровня PDCD4 и снижению – miR-181a-5p (т.е. задействована ось KCNQ1OT1/miR-181a-5p/PDCD4) [92]. На мышиных моделях СД показано, что сайленсинг Kcnq1ot1 ингибировал апоптоз кардиомиоцитов у мышей с диабетической КМП, индуцированной стрептозотоцином, путем регуляции метаболической цепочки с участием miR-181a-5p/PDCD4 [92]. Однако 6-гингерол (растительное вещество, которое содержится преимущественно в корневище имбиря) препятствовал экспрессии KCNQ1OT1, и кардиомиоциты были защищены от повреждения, вызванного гипоксией через пути KCNQ1OT1/miR-340-5p/PI3K/AKT [126].
Длинная нкРНК KCNQ1OT1, выступающая в качестве губки miR-7-5p (имеет мишени на мРНК генов METTL14 и TFRC), подвергается модификации m6A при участии N6-метилтрансферазного комплекса (включает METTL14), при этом ассоциация KCNQ1OT1 с РНК-связывающим белком IGF2BP1 повышает стабильность данной lncРНК и надежность ингибирования активности miR-7-5p [120]. Эта ось – METTL14/ KCNQ1OT1/miR-7-5p/METTL14/TFRC, имеющая петлю положительной обратной связи, значима для регуляции ферроптоза в кардиомиоцитах желудочков новорожденных крыс [120].
Вовлеченность в эпигенетические процессы установлена и для других lncРНК. Так, уровни РНК-деметилазы FTO и Mhrt снижены в миокарде мышей с сердечной недостаточностью, при этом наблюдалось увеличение общего уровня метиладенозина N6 (m6A) и уровня m6A Mhrt, тогда как сверхэкспрессия FTO приводит к повышению уровня Mhrt и снижению m6A Mhrt в обработанных гипоксией/реоксигенацией клетках миокарда [143].
ЗАКЛЮЧЕНИЕ
Таким образом, эффекты регуляторных нкРНК, в том числе тех, чьи гены перекрываются по локализации с генами КМП, проявляются в результате сложных взаимодействий как между собой [21, 43, 47, 130], так и с другими РНК (lncРНК, микроРНК, circРНК, мРНК) и белковыми молекулами, в том числе и задействованными в эпигенетической регуляции на уровне модификации гистонов и ремоделирования хроматина [21, 47, 53, 90, 130, 132]. Нарушения в таких взаимодействиях могут определять функциональное состояние сердца и риск развития патологий. При этом экспрессия регуляторных нкРНК – это динамический процесс, специфичный для клеток и тканей на разных стадиях онтогенеза, чувствительный к эндогенным преобразованиям организма и экзогенным воздействиям.
микроРНК и lncРНК, рассмотренными в настоящей статье, не исчерпывается перечень тех регуляторных элементов, гены которых перекрываются с генами КМП. В связи с этим следует ожидать расширение спектра как генов нкРНК и кодируемых ими регуляторных элементов, так и патофизиологических процессов, участие в которых может быть значимым для формирования риска развития и определения характера течения КМП. Для моногенных форм КМП данные нкРНК могут выступать в качестве факторов, способствующих пенетрантности патогенных вариантов. Кроме того, в патологические процессы могут быть вовлечены также нкРНК, локализованные в других регионах генома.
Работа выполнена в рамках Государственного задания Министерства науки и высшего образования № 122020300041-7.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Zhou H., Wang B., Yang Y.X. et al. Long noncoding RNAs in pathological cardiac remodeling: A review of the update literature // Biomed. Res. Int. 2019. V. 2019. P. 7159592. https://doi.org/10.1155/2019/7159592
Mushtaq I., Ishtiaq A., Ali T. et al. An overview of non-coding RNAs and cardiovascular system // Adv. Exp. Med. Biol. 2020. V. 1229. P. 3–45. https://doi.org/10.1007/978-981-15-1671-9_1
Tang Y., Bao J., Hu J. et al. Circular RNA in cardiovascular disease: expression, mechanisms and clinical prospects // J. Cell. Mol. Med. 2021. V. 25. № 4. P. 1817–1824. https://doi.org/10.1111/jcmm.16203
Qin X., Huang L., Chen S. et al. Multi-factor regulatory network and different clusters in hypertrophic obstructive cardiomyopathy // BMC Med. Genomics. 2021. V. 14. № 1. P. 199. https://doi.org/10.1186/s12920-021-01036-4
Chiti E., Paolo M.D., Turillazzi E., Rocchi A. MicroRNAs in hypertrophic, arrhythmogenic and dilated cardiomyopathy // Diagnostics (Basel). 2021. V. 11. № 9. P. 1720. https://doi.org/10.3390/diagnostics11091720
Cao M., Luo H., Li D. et al. Research advances on circulating long noncoding RNAs as biomarkers of cardiovascular diseases // Int. J. Cardiol. 2022. V. 353. P. 109–117. https://doi.org/10.1016/j.ijcard.2022.01.070
Кучер А.Н., Назаренко М.С. Эпигенетика кардиомиопатий: модификации гистонов и метилирование ДНК // Генетика. 2023. Т. 59. № 3. С. 266–182.
Li M., Duan L., Li Y., Liu B. Long noncoding RNA/circular noncoding RNA-miRNA-mRNA axes in cardiovascular diseases // Life Sci. 2019. V. 233. P. 116440. https://doi.org/10.1016/j.lfs.2019.04.066
Shahzadi S.K., Naidoo N., Alsheikh-Ali A. et al. Reconnoitering the role of long-noncoding RNAs in hypertrophic cardiomyopathy: A descriptive review // Int. J. Mol. Sci. 2021. V. 22. № 17. P. 9378. https://doi.org/10.3390/ijms22179378
Meder B., Haas J., Sedaghat-Hamedani F. et al. Epigenome-wide association study identifies cardiac gene patterning and a novel class of biomarkers for heart failure // Circulation. 2017. V. 136. № 16. P. 1528–1544. https://doi.org/10.1161/CIRCULATIONAHA.117. 027355
Cheedipudi S.M., Matkovich S.J., Coarfa C. et al. Genomic reorganization of lamin-associated domains in cardiac myocytes is associated with differential gene expression and DNA methylation in human dilated cardiomyopathy // Circ. Res. 2019. V. 124. № 8. P. 1198–1213. https://doi.org/10.1161/CIRCRESAHA.118.314177
Liu C.F., Abnousi A., Bazeley P. et al. Global analysis of histone modifications and long-range chromatin interactions revealed the differential cistrome changes and novel transcriptional players in human dilated cardiomyopathy // J. Mol. Cell. Cardiol. 2020. V. 145. P. 30–42. https://doi.org/10.1016/j.yjmcc.2020.06.001
Pei J., Schuldt M., Nagyova E. et al. Multi-omics integration identifies key upstream regulators of pathomechanisms in hypertrophic cardiomyopathy due to truncating MYBPC3 mutations // Clin. Epigenetics. 2021. V. 13. № 1. P. 61. https://doi.org/10.1186/s13148-021-01043-3
Simple ClinVar [Electronic resource]. URL: https://simple-clinvar.broadinstitute.org/ Accessed 03.2022.
Pérez-Palma E., Gramm M., Nürnberg P. et al. Simple ClinVar: An interactive web server to explore and retrieve gene and disease variants aggregated in ClinVar database // Nucl. Acids Res. 2019. V. 47. № W1. P. W99–W105. https://doi.org/10.1093/nar/gkz411
ClinGen [Electronic resource]. URL: https://clinicalgenome.org/ Accessed 05.2022.
miRBase: the microRNA database. [Electronic resource]. URL: https://www.mirbase.org/ Accessed 04.2022.
RNAcentral: The non-coding RNA sequence database. [Electronic resource]. URL: https://rnacentral.org/ Accessed 04.2022.
GeneCards®: The Human Gene Database [Electronic resource]. URL: https://www.genecards.org/ Accessed 04.2022.
Khan M.A., Reckman Y.J., Aufiero S. et al. RBM20 Regulates circular RNA production from the titin gene // Circ. Res. 2016. V. 119. № 9. P. 996–1003. https://doi.org/10.1161/CIRCRESAHA.116.309568
Dong K., He X., Su H. et al. Genomic analysis of circular RNAs in heart // BMC Med. Genomics. 2020. V. 13. № 1. P. 167. https://doi.org/10.1186/s12920-020-00817-7
Gao J., Collyer J., Wang M. et al. Genetic dissection of hypertrophic cardiomyopathy with myocardial RNA-Seq // Int. J. Mol. Sci. 2020. V. 21. № 9. P. 3040. https://doi.org/10.3390/ijms21093040
Hombach S., Kretz M. Non-coding RNAs: classification, biology and functioning // Adv. Exp. Med. Biol. 2016. V. 937. P. 3–17. https://doi.org/10.1007/978-3-319-42059-2_1
Stavast C.J., Erkeland S.J. The non-canonical aspects of MicroRNAs: Many roads to gene regulation // Cells. 2019. V. 8. № 11. P. 1465. https://doi.org/10.3390/cells8111465
Rao P.K., Toyama Y., Chiang H.R. et al. Loss of cardiac microRNA-mediated regulation leads to dilated cardiomyopathy and heart failure // Circ. Res. 2009. V. 105. № 6. P. 585–594. https://doi.org/10.1161/CIRCRESAHA.109.200451
Yang L. Splicing noncoding RNAs from the inside out // Wiley Interdiscip. Rev. RNA. 2015. V. 6. № 6. P. 651–660. https://doi.org/10.1002/wrna.1307
Jarroux J., Morillon A., Pinskaya M. History, discovery, and classification of lncRNAs // Adv. Exp. Med. Biol. 2017. V. 1008. P. 1–46. https://doi.org/10.1007/978-981-10-5203-3_1
Luo S., Lu J.Y., Liu L. et al. Divergent lncRNAs regulate gene expression and lineage differentiation in pluripotent cells // Cell Stem Cell. 2016. V. 18. № 5. P. 637–652. https://doi.org/10.1016/j.stem.2016.01.024
Barrett S.P., Salzman J. Circular RNAs: analysis, expression and potential functions // Development. 2016. V. 143. № 11. P. 1838–1847. https://doi.org/10.1242/dev.128074
Liang D., Tatomer D.C., Luo Z. et al. The output of protein-coding genes shifts to circular RNAs when the pre-mRNA processing machinery is limiting // Mol. Cell. 2017. V. 68. № 5. P. 940–954.e3. https://doi.org/10.1016/j.molcel.2017.10.034
Vo J.N., Cieslik M., Zhang Y. et al. The landscape of circular RNA in cancer // Cell. 2019. V. 176. № 4. P. 869–881.e13. https://doi.org/10.1016/j.cell.2018.12.021
Kazimierczyk M., Kasprowicz M.K., Kasprzyk M.E., Wrzesinski J. Human long noncoding RNA interactome: detection, characterization and function // Int. J. Mol. Sci. 2020. V. 21. № 3. P. 1027. https://doi.org/10.3390/ijms21031027
Yuan Y., Wang J., Chen Q. et al. Long non-coding RNA cytoskeleton regulator RNA (CYTOR) modulates pathological cardiac hypertrophy through miR-155-mediated IKKi signaling // Biochim. Biophys. Acta Mol. Basis Dis. 2019. V. 1865. № 6. P. 1421–1427. https://doi.org/10.1016/j.bbadis.2019.02.014
Guo Q., Wang J., Sun R. et al. Comprehensive construction of a circular RNA-associated competing endogenous RNA network identified novel circular RNAs in hypertrophic cardiomyopathy by integrated analysis // Front. Genet. 2020. V. 11. P. 764. https://doi.org/10.3389/fgene.2020.00764
Guo Q., Wang J., Sun R. et al. Identification of circulating hub long noncoding RNAs associated with hypertrophic cardiomyopathy using weighted correlation network analysis // Mol. Med. Rep. 2020. V. 22. № 6. P. 4637–4644. https://doi.org/10.3892/mmr.2020.11566
Guo W., Schafer S., Greaser M.L. et al. RBM20, a gene for hereditary cardiomyopathy, regulates titin splicing // Nat. Med. 2012. V. 18. № 5. P. 766–773. https://doi.org/10.1038/nm.2693
Gi W.T., Haas J., Sedaghat-Hamedani F. et al. Epigenetic regulation of alternative mRNA splicing in dilated cardiomyopathy // J. Clin. Med. 2020. V. 9. № 5. P. 1499. https://doi.org/10.3390/jcm9051499
Oliveira-Carvalho V., Carvalho V.O., Bocchi E.A. The emerging role of miR-208a in the heart // DNA Cell. Biol. 2013. V. 32. № 1. P. 8–12. https://doi.org/10.1089/dna.2012.1787.0
Han P., Li W., Lin C.H. et al. A long noncoding RNA protects the heart from pathological hypertrophy // Nature. 2014. V. 514. № 7520. P. 102–106. https://doi.org/10.1038/nature13596
Zhao X., Wang Y., Sun X. The functions of microRNA-208 in the heart // Diabetes Res. Clin. Pract. 2020. V. 160. P. 108004. https://doi.org/10.1016/j.diabres.2020.108004
Sun F., Yuan W., Wu H. et al. LncRNA KCNQ1OT1 attenuates sepsis-induced myocardial injury via regulating miR-192-5p/XIAP axis // Exp. Biol. Med. (Maywood). 2020. V. 245. № 7. P. 620–630. https://doi.org/10.1177/1535370220908041
Huang X.H., Li J.L., Li X.Y. et al. miR-208a in cardiac hypertrophy and remodeling // Front. Cardiovasc. Med. 2021. V. 8. P. 773314. https://doi.org/10.3389/fcvm.2021.773314
van Rooij E., Quiat D., Johnson B.A. et al. A family of microRNAs encoded by myosin genes governs myosin expression and muscle performance // Dev. Cell. 2009. V. 17. № 5. P. 662–673. https://doi.org/10.1016/j.devcel.2009.10.013
Korostowski L., Sedlak N., Engel N. The Kcnq1ot1 long non-coding RNA affects chromatin conformation and expression of Kcnq1, but does not regulate its imprinting in the developing heart // PLoS Genet. 2012. V. 8. № 9. P. e1002956. https://doi.org/10.1371/journal.pgen.1002956
Wu C., Arora P. Long noncoding Mhrt RNA: Molecular crowbar unravel insights into heart failure treatment // Circ. Cardiovasc. Genet. 2015. V. 8. № 1. P. 213–215. https://doi.org/10.1161/CIRCGENETICS.115.001019
Kakimoto Y., Tanaka M., Kamiguchi H. et al. MicroRNA deep sequencing reveals chamber-specific miR-208 family expression patterns in the human heart // Int. J. Cardiol. 2016. V. 211. P. 43–48. https://doi.org/10.1016/j.ijcard.2016.02.145
Harikrishnan K.N., Okabe J., Mathiyalagan P. et al. Sex-based Mhrt methylation chromatinizes MeCP2 in the heart // iScience. 2019. V. 17. P. 288–301. https://doi.org/10.1016/j.isci.2019.06.031
Iannolo G., Sciuto M.R., Cuscino N. et al. miRNA expression analysis in the human heart: Undifferentiated progenitors vs. bioptic tissues-implications for proliferation and ageing // J. Cell. Mol. Med. 2021. V. 25. № 18. P. 8687–8700. https://doi.org/10.1111/jcmm.16824
Kim S.K., Bennett R., Ingles J. et al. Arrhythmia in cardiomyopathy: sex and gender differences // Curr. Heart Fail. Rep. 2021. V. 18. № 5. P. 274–283. https://doi.org/10.1007/s11897-021-00531-0
Chistiakov D.A., Orekhov A.N., Bobryshev Y.V. Cardiac-specific miRNA in cardiogenesis, heart function, and cardiac pathology (with focus on myocardial infarction) // J. Mol. Cell. Cardiol. 2016. V. 94. P. 107–121. https://doi.org/10.1016/j.yjmcc.2016.03.015
Callis T.E., Pandya K., Seok H.Y. et al. MicroRNA-208a is a regulator of cardiac hypertrophy and conduction in mice // J. Clin. Invest. 2009. V. 119. № 9. P. 2772–2786. https://doi.org/10.1172/JCI36154
Hupfeld J., Ernst M., Knyrim M. et al. miR-208b reduces the expression of Kcnj5 in a cardiomyocyte cell line // Biomedicines. 2021. V. 9. № 7. P. 719. https://doi.org/10.3390/biomedicines9070719
Mathiyalagan P., Okabe J., Chang L. et al. The primary microRNA-208b interacts with Polycomb-group protein, Ezh2, to regulate gene expression in the heart // Nucl. Acids Res. 2014. V. 42. № 2. P. 790–803. https://doi.org/10.1093/nar/gkt896
Zhou Q., Schötterl S., Backes D. et al. Inhibition of miR-208b improves cardiac function in titin-based dilated cardiomyopathy // Int. J. Cardiol. 2017. V. 230. P. 634–641. https://doi.org/10.1016/j.ijcard.2016.12.171
Tsuji M., Kawasaki T., Matsuda T. et al. Sexual dimorphisms of mRNA and miRNA in human/murine heart disease // PLoS One. 2017. V. 12. № 7. P. e0177988. https://doi.org/10.1371/journal.pone.0177988
Gioffré S., Ricci V., Vavassori C. et al. Plasmatic and chamber-specific modulation of cardiac microRNAs in an acute model of DOX-induced cardiotoxicity // Biomed. Pharmacother. 2019. V. 110. P. 1–8. https://doi.org/10.1016/j.biopha.2018.11.042
Schultz B.M., Gallicio G.A., Cesaroni M. et al. Enhancers compete with a long non-coding RNA for regulation of the Kcnq1 domain // Nucl. Acids Res. 2015. V. 43. № 2. P. 745–759. https://doi.org/10.1093/nar/gku1324
Terranova R., Yokobayashi S., Stadler M.B. et al. Polycomb group proteins Ezh2 and Rnf2 direct genomic contraction and imprinted repression in early mouse embryos // Dev. Cell. 2008. V. 15. № 5. P. 668–679. https://doi.org/10.1016/j.devcel.2008.08.015
Halliday B.P., Gulati A., Ali A. et al. Sex- and age-based differences in the natural history and outcome of dilated cardiomyopathy // Eur. J. Heart Fail. 2018. V. 20. № 10. P. 1392–1400. https://doi.org/10.1002/ejhf.1216
Pelliccia F., Limongelli G., Autore C. et al. Sex-related differences in cardiomyopathies // Int. J. Cardiol. 2019. V. 286. P. 239–243. https://doi.org/10.1016/j.ijcard.2018.10.091
De Bellis A., De Angelis G., Fabris E. et al. Gender-related differences in heart failure: beyond the “one-size-fits-all” paradigm // Heart Fail. Rev. 2020. V. 25. № 2. P. 245–255. https://doi.org/10.1007/s10741-019-09824-y
Palacín M., Reguero J.R., Martín M. et al. Profile of microRNAs differentially produced in hearts from patients with hypertrophic cardiomyopathy and sarcomeric mutations // Clin. Chem. 2011. V. 57. № 11. P. 1614–1616. https://doi.org/10.1373/clinchem.2011.168005
Bagnall R.D., Tsoutsman T., Shephard R.E. et al. Global microRNA profiling of the mouse ventricles during development of severe hypertrophic cardiomyopathy and heart failure // PLoS One. 2012. V. 7. № 9. P. e44744. https://doi.org/10.1371/journal.pone.0044744
Ferreira L.R., Frade A.F., Santos R.H. et al. MicroRNAs miR-1, miR-133a, miR-133b, miR-208a and miR-208b are dysregulated in Chronic Chagas disease Cardiomyopathy // Int. J. Cardiol. 2014. V. 175. № 3. P. 409–417. https://doi.org/10.1016/j.ijcard.2014.05.019
Jaguszewski M., Osipova J., Ghadri J.R. et al. A signature of circulating microRNAs differentiates takotsubo cardiomyopathy from acute myocardial infarction // Eur. Heart J. 2014. V. 35. № 15. P. 999–1006. https://doi.org/10.1093/eurheartj/eht392
Roncarati R., Viviani Anselmi C., Losi M.A. et al. Circulating miR-29a, among other up-regulated microRNAs, is the only biomarker for both hypertrophy and fibrosis in patients with hypertrophic cardiomyopathy // J. Am. Coll. Cardiol. 2014. V. 63. № 9. P. 920–927. https://doi.org/10.1016/j.jacc.2013.09.041
Costantino S., Paneni F., Lüscher T.F., Cosentino F. MicroRNA profiling unveils hyperglycaemic memory in the diabetic heart // Eur. Heart J. 2016. V. 37. № 6. P. 572–576. https://doi.org/10.1093/eurheartj/ehv599
de Gonzalo-Calvo D., van der Meer R.W., Rijzewijk L.J. et al. Serum microRNA-1 and microRNA-133a levels reflect myocardial steatosis in uncomplicated type 2 diabetes // Sci. Rep. 2017. V. 7. № 1. P. 47. https://doi.org/10.1038/s41598-017-00070-6
Li M., Chen X., Chen L. et al. MiR-1-3p that correlates with left ventricular function of HCM can serve as a potential target and differentiate HCM from DCM // J. Transl. Med. 2018. V. 16. № 1. P. 161. https://doi.org/10.1186/s12967-018-1534-3
Scolari F.L., Faganello L.S., Garbin H.I. et al. A systematic review of microRNAs in patients with hypertrophic cardiomyopathy // Int. J. Cardiol. 2021. V. 327. P. 146–154. https://doi.org/10.1016/j.ijcard.2020.11.004
Calderon-Dominguez M., Belmonte T., Quezada-Feijoo M. et al. Plasma microrna expression profile for reduced ejection fraction in dilated cardiomyopathy // Sci. Rep. 2021. V. 11. № 1. P. 7517. https://doi.org/10.1038/s41598-021-87086-1
Hailu F.T., Karimpour-Fard A., Toni L.S. et al. Integrated analysis of miRNA-mRNA interaction in pediatric dilated cardiomyopathy // Pediatr. Res. 2021. May 19. https://doi.org/10.1038/s41390-021-01548-w
Khudiakov A.A., Panshin D.D., Fomicheva Y.V. et al. Different expressions of pericardial fluid MicroRNAs in patients with arrhythmogenic right ventricular cardiomyopathy and ischemic heart disease undergoing ventricular tachycardia ablation // Front. Cardiovasc. Med. 2021. V. 8. P. 647812. https://doi.org/10.3389/fcvm.2021.647812
Liu Y., Li Y., Li J. et al. Inhibiting miR‑1 attenuates pulmonary arterial hypertension in rats // Mol. Med. Rep. 2021. V. 23(4): 283. https://doi.org/10.3892/mmr.2021.11922
Thottakara T., Lund N., Krämer E. et al. A novel miRNA screen identifies miRNA-4454 as a candidate biomarker for ventricular fibrosis in patients with hypertrophic cardiomyopathy // Biomolecules. 2021. V. 11. № 11. P. 1718. https://doi.org/10.3390/biom11111718
Chen S., Puthanveetil P., Feng B. et al. Cardiac miR-133a overexpression prevents early cardiac fibrosis in diabetes // J. Cell. Mol. Med. 2014. V. 18. № 3. P. 415–421. https://doi.org/10.1111/jcmm.12218
Fang L., Ellims A.H., Moore X.L. et al. Circulating microRNAs as biomarkers for diffuse myocardial fibrosis in patients with hypertrophic cardiomyopathy // J. Transl. Med. 2015. V. 13. P. 314. https://doi.org/10.1186/s12967-015-0672-0
Renaud L., Harris L.G., Mani S.K. et al. HDACs regulate miR-133a expression in pressure overload-induced cardiac fibrosis // Circ. Heart. Fail. 2015. V. 8. № 6. P. 1094–1104. https://doi.org/10.1161/CIRCHEARTFAILURE.114. 001781
Besler C., Urban D., Watzka S. et al. Endomyocardial miR-133a levels correlate with myocardial inflammation, improved left ventricular function, and clinical outcome in patients with inflammatory cardiomyopathy // Eur. J. Heart Fail. 2016. V. 18. № 12. P. 1442–1451. https://doi.org/10.1002/ejhf.579
Huang L., Xi Z., Wang C. et al. Phenanthrene exposure induces cardiac hypertrophy via reducing miR-133a expression by DNA methylation // Sci. Rep. 2016. V. 6. P. 20105. https://doi.org/10.1038/srep20105
Wang Y., Li M., Xu L. et al. Expression of Bcl-2 and microRNAs in cardiac tissues of patients with dilated cardiomyopathy // Mol. Med. Rep. 2017. V. 15. № 1. P. 359–365. https://doi.org/10.3892/mmr.2016.5977
Rubiś P., Totoń-Żurańska J., Wiśniowska-Śmiałek S. et al. The relationship between myocardial fibrosis and myocardial microRNAs in dilated cardiomyopathy: A link between mir-133a and cardiovascular events // J. Cell. Mol. Med. 2018. V. 22. № 4. P. 2514–2517. https://doi.org/10.1111/jcmm.13535
Dziewięcka E., Totoń-Żurańska J., Wołkow P. et al. Relations between circulating and myocardial fibrosis-linked microRNAs with left ventricular reverse remodeling in dilated cardiomyopathy // Adv. Clin. Exp. Med. 2020. V. 29. № 3. P. 285–293. https://doi.org/10.17219/acem/115088
Bueno Marinas M., Celeghin R., Cason M. et al. A microRNA expression profile as non-invasive biomarker in a large arrhythmogenic cardiomyopathy cohort // Int. J. Mol. Sci. 2020. V. 21. № 4. P. 1536. https://doi.org/10.3390/ijms21041536
Satoh M., Minami Y., Takahashi Y. et al. Expression of microRNA-208 is associated with adverse clinical outcomes in human dilated cardiomyopathy // J. Card. Fail. 2010. V. 16. № 5. P. 404–410. https://doi.org/10.1016/j.cardfail.2010.01.002
Xue J., Zhou D., Poulsen O. et al. Exploring miRNA-mRNA regulatory network in cardiac pathology in Na+/H+ exchanger isoform 1 transgenic mice // Physiol. Genomics. 2018. V. 50. № 10. P. 846–861. https://doi.org/10.1152/physiolgenomics.00048.2018
Qiang L., Hong L., Ningfu W. et al. Expression of miR-126 and miR-508-5p in endothelial progenitor cells is associated with the prognosis of chronic heart failure patients // Int. J. Cardiol. 2013. V. 168. № 3. P. 2082–2088. https://doi.org/10.1016/j.ijcard.2013.01.160
Matkovich S.J., Hu Y., Eschenbacher W.H. et al. Direct and indirect involvement of microRNA-499 in clinical and experimental cardiomyopathy // Circ. Res. 2012. V. 111. № 5. P. 521–531. https://doi.org/10.1161/CIRCRESAHA.112.265736
Calore M., Lorenzon A., Vitiello L. et al. A novel murine model for arrhythmogenic cardiomyopathy points to a pathogenic role of Wnt signalling and miRNA dysregulation // Cardiovasc. Res. 2019. V. 115. № 4. P. 739–751. https://doi.org/10.1093/cvr/cvy253
Zhao L., Li W., Zhao H. Inhibition of long non-coding RNA TUG1 protects against diabetic cardiomyopathy induced diastolic dysfunction by regulating miR-499-5p // Am. J. Transl. Res. 2020. V. 12. № 3. P. 718–730.
Yang F., Qin Y., Wang Y. et al. LncRNA KCNQ1OT1 mediates pyroptosis in diabetic cardiomyopathy // Cell. Physiol. Biochem. 2018. V. 50. № 4. P. 1230–1244. https://doi.org/10.1159/000494576
Zhao S.F., Ye Y.X., Xu J.D. et al. Long non-coding RNA KCNQ1OT1 increases the expression of PDCD4 by targeting miR-181a-5p, contributing to cardiomyocyte apoptosis in diabetic cardiomyopathy // Acta Diabetol. 2021. V. 58. № 9. P. 1251–1267. https://doi.org/10.1007/s00592-021-01713-x
Duisters R.F., Tijsen A.J., Schroen B. et al. miR-133 and miR-30 regulate connective tissue growth factor: Implications for a role of microRNAs in myocardial matrix remodeling // Circ. Res. 2009. V. 104. № 2. P. 170–178. https://doi.org/10.1161/CIRCRESAHA.108.182535
Gutmann C., Khamina K., Theofilatos K. et al. Association of cardiometabolic microRNAs with COVID-19 severity and mortality // Cardiovasc. Res. 2022. V. 118. № 2. P. 461–474. https://doi.org/10.1093/cvr/cvab338
Kontaraki J.E., Marketou M.E., Kochiadakis G.E. et al. The long non-coding RNAs MHRT, FENDRR and CARMEN, their expression levels in peripheral blood mononuclear cells in patients with essential hypertension and their relation to heart hypertrophy // Clin. Exp. Pharmacol. Physiol. 2018. V. 45. № 11. P. 1213–1217. https://doi.org/10.1111/1440-1681.12997
van Rooij E., Sutherland L.B., Qi X. et al. Control of stress-dependent cardiac growth and gene expression by a microRNA // Science. 2007. V. 316. № 5824. P. 575–579. https://doi.org/10.1126/science.1139089
Wang W., Wu C., Ren L. et al. MiR-30e-5p is sponged by Kcnq1ot1 and represses Angiotensin II-induced hypertrophic phenotypes in cardiomyocytes by targeting ADAM9 // Exp. Cell. Res. 2020. V. 394. № 2. P. 112140. https://doi.org/10.1016/j.yexcr.2020.112140
Jia Y., Duan Y., Liu T. et al. LncRNA TTN-AS1 promotes migration, invasion, and epithelial mesenchymal transition of lung adenocarcinoma via sponging miR-142-5p to regulate CDK5 // Cell Death Dis. 2019. V. 10. № 8. P. 573. https://doi.org/10.1038/s41419-019-1811-y
Chen P., Wang R., Yue Q., Hao M. Long non-coding RNA TTN-AS1 promotes cell growth and metastasis in cervical cancer via miR-573/E2F3 // Biochem. Biophys. Res. Commun. 2018. V. 503. № 4. P. 2956–2962. https://doi.org/10.1016/j.bbrc.2018.08.077
Dong M.M., Peng S.J., Yuan Y.N., Luo H.P. LncRNA TTN-AS1 contributes to gastric cancer progression by acting as a competing endogenous RNA of miR-376b-3p // Neoplasma. 2019. V. 66. № 4. P. 564–575. https://doi.org/10.4149/neo_2018_180927N721
Tian C., Yang Y., Ke Y. et al. Integrative analyses of genes associated with right ventricular cardiomyopathy induced by tricuspid regurgitation // Front. Genet. 2021. V. 12. P. 708275. https://doi.org/10.3389/fgene.2021.708275
Jiao M., You H.Z., Yang X.Y. et al. Circulating microRNA signature for the diagnosis of childhood dilated cardiomyopathy // Sci. Rep. 2018. V. 8. № 1. P. 724. https://doi.org/10.1038/s41598-017-19138-4
Toro R., Blasco-Turrión S., Morales-Ponce F.J. et al. Plasma microRNAs as biomarkers for Lamin A/C-related dilated cardiomyopathy // J. Mol. Med. (Berl.) 2018. V. 96. № 8. P. 845–856. https://doi.org/10.1007/s00109-018-1666-1
Wang J., Jia Z., Zhang C. et al. miR-499 protects cardiomyocytes from H2O2-induced apoptosis via its effects on Pdcd4 and Pacs2 // RNA Biol. 2014. V. 11. № 4. P. 339–350. https://doi.org/10.4161/rna.28300
Paul A., Pai P.G., Ariyannur P.S., Joy R.A. Diagnostic accuracy of MicroRNA 208b level with respect to different types of atrial fibrillation // Indian Heart J. 2021. V. 73. № 4. P. 506–510. https://doi.org/10.1016/j.ihj.2021.06.018
Yoneda Z.T., Anderson K.C., Quintana J.A. et al. Early-onset atrial fibrillation and the prevalence of rare variants in cardiomyopathy and arrhythmia genes // JAMA Cardiol. 2021. V. 6. № 12. P. 1371–1379. https://doi.org/10.1001/jamacardio.2021.3370
Cipriani A., Perazzolo Marra M., Bariani R. et al. Differential diagnosis of arrhythmogenic cardiomyopathy: Phenocopies versus disease variants // Minerva Med. 2021. V. 112. № 2. P. 269–280. https://doi.org/10.23736/S0026-4806.20.06782-8
Li M., Wang Y.F., Yang X.C. et al. Circulating long noncoding RNA LIPCAR acts as a novel biomarker in patients with ST-segment elevation myocardial infarction // Med. Sci. Monit. 2018. V. 24. P. 5064–5070. https://doi.org/10.12659/MSM.909348
Wang Y., Jiao J., Wang D. et al. Effects of ticagrelor on proliferation, apoptosis, and inflammatory factors of human aortic vascular smooth muscle cells through lncRNA KCNQ1OT1 // Am. J. Transl. Res. 2021. V. 13. № 12. P. 13462–13470.
Zhang L., Wu Y.J., Zhang S.L. Circulating lncRNA MHRT predicts survival of patients with chronic heart failure // J. Geriatr. Cardiol. 2019. V. 16. № 11. P. 818–821. https://doi.org/10.11909/j.issn.1671-5411.2019.11.006
Xuan L., Sun L., Zhang Y. et al. Circulating long non-coding RNAs NRON and MHRT as novel predictive biomarkers of heart failure // J. Cell. Mol. Med. 2017. V. 21. № 9. P. 1803–1814. https://doi.org/10.1111/jcmm.13101
Zhang J., Gao C., Meng M., Tang H. Long noncoding RNA MHRT protects cardiomyocytes against H2O2-induced apoptosis // Biomol. Ther. (Seoul). 2016. V. 24. № 1. P. 19–24. https://doi.org/10.4062/biomolther.2015.066
Lang M., Ou D., Liu Z. et al. LncRNA MHRT promotes cardiac fibrosis via miR-3185 pathway following myocardial infarction // Int. Heart. J. 2021. V. 62. № 4. P. 891–899. https://doi.org/10.1536/ihj.20-298
Zhou Q., Chen J., Wu D. et al. Differential expression of long non-coding RNAs SRA, HCG22 and MHRT in children with Kawasaki disease // Exp. Ther. Med. 2021. V. 22. № 3. P. 1022. https://doi.org/10.3892/etm.2021.10454
Ma X., Zhang Q., Zhu H. et al. Establishment and analysis of the lncRNA-miRNA-mRNA network based on competitive endogenous RNA identifies functional genes in heart failure // Math. Biosci. Eng. 2021. V. 18. № 4. P. 4011–4026. https://doi.org/10.3934/mbe.2021201
Kang B., Li W., Xi W. et al. Hydrogen sulfide protects cardiomyocytes against apoptosis in ischemia/reperfusion through MiR-1-regulated histone deacetylase 4 pathway // Cell. Physiol. Biochem. 2017. V. 41. № 1. P. 10–21. https://doi.org/10.1159/000455816
Li M., Ding W., Tariq M.A. et al. A circular transcript of ncx1 gene mediates ischemic myocardial injury by targeting miR-133a-3p // Theranostics. 2018. V. 8. № 21. P. 5855–5869. https://doi.org/10.7150/thno.27285
Jiang Y., Du W., Chu Q. et al. Downregulation of long non-coding RNA Kcnq1ot1: An important mechanism of arsenic trioxide-induced long QT syndrome // Cell. Physiol. Biochem. 2018. V. 45. № 1. P. 192–202. https://doi.org/10.1159/000486357
Shirazi-Tehrani E., Firouzabadi N., Tamaddon G. et al. Carvedilol alters circulating MiR-1 and MiR-214 in heart failure // Pharmgenomics. Pers. Med. 2020. V. 13. P. 375–383. https://doi.org/10.2147/PGPM.S263740
Zhuang S., Ma Y., Zeng Y. et al. METTL14 promotes doxorubicin-induced cardiomyocyte ferroptosis by regulating the KCNQ1OT1-miR-7-5p-TFRC axis // Cell. Biol. Toxicol. 2021. Oct 14. https://doi.org/10.1007/s10565-021-09660-7
Lai L., Xu Y., Kang L. et al. LncRNA KCNQ1OT1 contributes to cardiomyocyte apoptosis by targeting FUS in heart failure // Exp. Mol. Pathol. 2020. V. 115. P. 104480.https://doi.org/10.1016/j.yexmp.2020.104480
Durr A.J., Hathaway Q.A., Kunovac A. et al. Manipulation of the MiR-378a/mt-ATP6 regulatory axis rescues ATP synthase in the diabetic heart and offers a novel role for LncRNA Kcnq1ot1 // Am. J. Physiol. Cell. Physiol. 2022. V. 322. № 2. P. C482–C495. https://doi.org/10.1152/ajpcell.00446.2021
Yang F., Qin Y., Lv J. et al. Silencing long non-coding RNA Kcnq1ot1 alleviates pyroptosis and fibrosis in diabetic cardiomyopathy // Cell. Death. Dis. 2018. V. 9. № 10. P. 1000. https://doi.org/10.1038/s41419-018-1029-4
Shen C., Kong B., Liu Y. et al. YY1-induced upregulation of lncRNA KCNQ1OT1 regulates angiotensin II-induced atrial fibrillation by modulating miR‑384b/CACNA1C axis // Biochem. Biophys. Res. Commun. 2018. V. 505. № 1. P. 134–140. https://doi.org/10.1016/j.bbrc.2018.09.064
Parikh M., Kura B., O’Hara K.A. et al. Cardioprotective effects of dietary flaxseed post-infarction are associated with changes in MicroRNA expression // Biomolecules. 2020. V. 10. № 9. P. 1297. https://doi.org/10.3390/biom10091297
Pan F., Xu X., Zhan Z., Xu Q. 6-Gingerol protects cardiomyocytes against hypoxia-induced injury by regulating the KCNQ1OT1/miR-340-5p/PI3K/AKT pathway // Panminerva Med. 2021. V. 63. № 4. P. 482–490. https://doi.org/10.23736/S0031-0808.20.03956-7
Gao Y., Huang R., Chen R. et al. Ischemic postconditioning altered microRNAs in human valve replacement // J. Surg. Res. 2016. V. 200. № 1. P. 28–35. https://doi.org/10.1016/j.jss.2015.07.010
Liao B., Dong S., Xu Z. et al. LncRNA Kcnq1ot1 renders cardiomyocytes apoptosis in acute myocardial infarction model by up-regulating Tead1 // Life Sci. 2020. V. 256. P. 117811. https://doi.org/10.1016/j.lfs.2020.117811
Lin H., Zhu Y., Zheng C. et al. Antihypertrophic Memory after regression of exercise-induced physiological myocardial hypertrophy is mediated by the long noncoding RNA Mhrt779 // Circulation. 2021. V. 143. № 23. P. 2277–2292. https://doi.org/10.1161/CIRCULATIONAHA.120. 047000
Forini F., Nicolini G., Kusmic C. et al. T3 Critically affects the Mhrt/Brg1 axis to regulate the cardiac MHC switch: Role of an epigenetic cross-talk // Cells. 2020. V. 9. № 10. P. 2155. https://doi.org/10.3390/cells9102155
Nishimura Y., Kondo C., Morikawa Y. et al. Plasma miR-208 as a useful biomarker for drug-induced cardiotoxicity in rats // J. Appl. Toxicol. 2015. V. 35. № 2. P. 173–180. https://doi.org/10.1002/jat.3044
Dal-Pra S., Hodgkinson C.P., Mirotsou M. et al. Demethylation of H3K27 is essential for the induction of direct cardiac reprogramming by miR combo // Circ. Res. 2017. V. 120. № 9. P. 1403–1413. https://doi.org/10.1161/CIRCRESAHA.116.308741
Jiang F., Zhou X., Huang J. Long non-coding RNA-ROR mediates the reprogramming in cardiac hypertrophy // PLoS One. 2016. V. 11. № 4. P. e0152767. https://doi.org/10.1371/journal.pone.0152767
Luo Y., Xu Y., Liang C. et al. The mechanism of myocardial hypertrophy regulated by the interaction between mhrt and myocardin // Cell. Signal. 2018. V. 43. P. 11–20. https://doi.org/10.1016/j.cellsig.2017.11.007
Xu Y., Luo Y., Liang C., Zhang T. LncRNA-Mhrt regulates cardiac hypertrophy by modulating the miR-145a-5p/KLF4/myocardin axis // J. Mol. Cell. Cardiol. 2020. V. 139. P. 47–61. https://doi.org/10.1016/j.yjmcc.2019.12.013
Bian W., Jiang X.X., Wang Z. et al. Comprehensive analysis of the ceRNA network in coronary artery disease // Sci. Rep. 2021. V. 11. № 1. P. 24279. https://doi.org/10.1038/s41598-021-03688-9
Liu Y., Yu B. MicroRNA 186 5p is expressed highly in ethanol induced cardiomyocytes and regulates apoptosis via the target gene XIAP // Mol. Med. Rep. 2019. V. 19. № 4. P. 3179–3189. https://doi.org/10.3892/mmr.2019.9953
Florian A., Patrascu A., Tremmel R. et al. Identification of cardiomyopathy-associated circulating miRNA biomarkers in muscular dystrophy female carriers using a complementary cardiac imaging and plasma profiling approach // Front. Physiol. 2018. V. 9. P. 1770. https://doi.org/10.3389/fphys.2018.01770
Rong J., Pan H., He J. et al. Long non-coding RNA KCNQ1OT1/microRNA-204-5p/LGALS3 axis regulates myocardial ischemia/reperfusion injury in mice // Cell Signal. 2020. V. 66. P. 109441. https://doi.org/10.1016/j.cellsig.2019.109441
Dai W., Chao X., Jiang Z., Zhong G. lncRNA KCNQ1OT1 may function as a competitive endogenous RNA in atrial fibrillation by sponging miR‑223‑3p // Mol. Med. Rep. 2021. V. 24. № 6. P. 870. https://doi.org/10.3892/mmr.2021.12510
Chen Y., Zhang Z., Zhu D. et al. Knockdown of KCNQ1OT1 attenuates cardiac hypertrophy through modulation of the miR-2054/AKT3 axis // J. Thorac. Dis. 2020. V. 12. № 9. P. 4771–4780. https://doi.org/10.21037/jtd-20-203
Li J., Tong Y., Zhou Y. et al. LncRNA KCNQ1OT1 as a miR-26a-5p sponge regulates ATG12-mediated cardiomyocyte autophagy and aggravates myocardial infarction // Int. J. Cardiol. 2021. V. 338. P. 14–23. https://doi.org/10.1016/j.ijcard.2021.05.053
Shen W., Li H., Su H. et al. FTO overexpression inhibits apoptosis of hypoxia/reoxygenation-treated myocardial cells by regulating m6A modification of Mhrt // Mol. Cell. Biochem. 2021. V. 476. № 5. P. 2171–2179. https://doi.org/10.1007/s11010-021-04069-6
Дополнительные материалы отсутствуют.


