Геохимия, 2021, T. 66, № 9, стр. 811-817
Термодинамический анализ реакций CO2-флюида с гранатами и клинопироксенами при 3–6 ГПа
Ю. Г. Виноградова a, b, c, *, А. Ф. Шацкий a, b, c, К. Д. Литасов c
a Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
b Институт геологии и минералогии им. В.С. Соболева СО РАН
630090 Новосибирск, просп. Коптюга, 3, Россия
c Институт физики высоких давлений им. Л.Ф. Верещагина РАН
108840 Троицк, Москва, Калужское шоссе, стр. 14, Россия
* E-mail: vinogradova@igm.nsc.ru
Поступила в редакцию 09.12.2020
После доработки 05.02.2021
Принята к публикации 07.02.2021
Аннотация
Изучение включений в алмазах предоставляет информацию о составе верхней мантии. Помимо минералов многими исследователями было отмечено присутствие флюидных включений, одним из компонентов которых является CO2. Существующие экспериментальные работы показывают невозможность сосуществования CO2-флюида с основными компонентами мантии, однако есть основания полагать, что комплексный состав минералов способствует их стабилизации. В данной статье приводятся термодинамические расчеты для реакций твердых растворов диопсид-жадеит и пироп-гроссуляр с CO2. Показано, что образование твердых растворов расширяет область устойчивости СО2-флюида с минералами эклогитов в область более низких температур, соответствующих геотермальным условиям континентальной литосферы. Полученные закономерности подтверждаются результатами тестовых экспериментов с модельными смесями при высоких давлениях и температурах.
ВВЕДЕНИЕ
В настоящее время состав верхних слоев мантии Земли хорошо изучен, однако о наличии в них летучих компонентов можно судить лишь косвенно (Литасов, 2011; Похиленко и др., 2015; Литасов, Шацкий, 2019). Одним из таких источников информации являются включения в алмазах. В частности, в природных алмазах были обнаружены флюидные включения, содержащие значительное количество CO2 (Navon et al., 1988; Guthrie Jr. et al., 1991; Chinn, 1995; Томиленко и др., 2001; Рагозин и др., 2002, 2009; Smith et al., 2015). Особый интерес представляет работа Schrauder, Navon (1993), в которой сообщается о включениях чистого CO2, который согласно данным ИК-спектроскопии находился в твердом состоянии при давлении 5.0 ± 0.5 ГПа. Глубину образования данного алмаза авторы определяют на уровне 220–270 км.
В тоже время экспериментальные работы по изучению реакций CO2 c самыми распространенными минералами мантии – форстеритом Mg2SiO4, пиропом Mg3Al2Si3O12 и диопсидом CaMgSi2O6 – показывают, что образование CO2-флюида на таких глубинах происходить не должно (Luth, 1995; Koziol, Newton, 1998; Knoche et al., 1999). Сходная картина наблюдается в более сложных системах (Sharygin et al., 2015, 2017; Shatskiy et al. 2017). Так как минеральных включений в алмазе, изученном в работе Schrauder, Navon (1993), не было обнаружено, сложно судить о его источнике. Однако во многих работах (Рагозин и др., 2002, 2009; Ragozin et al., 2016; Smith et al., 2015) для алмазов установлен эклогитовый парагенезис и по наличию включений CO2-флюида делается вывод о возможности присутствия свободного CO2-флюида в эклогите.
В составе эклогитов в отличие от перидотитов отсутствует форстерит, что несколько расширяет область стабильности CO2-флюида, но остаются реакции с гранатом и клинопироксеном. Поскольку чистый пироп и диопсид с CO2 неустойчивы при данных параметрах (Luth et al., 1995; Knoche et al., 1999), было выдвинуто предположение о том, что многокомпонентный состав гранатов и пироксенов в эклогитах способствует их стабилизации с CO2 при более низких температурах (Knoche et al., 1999). Вместе с тем существующие термодинамические расчeты противоречивы. Согласно расчeтам, приведенным в работе Knoche et al. (1999), добавление гроссуляра расширяет область термодинамической устойчивости граната с CO2 флюидом в область низких температур. Однако результаты расчетов, приведенные в работах Баталёва и др. (2020); Bataleva et al. (2020), подразумевают обратное, а именно смещение области устойчивости граната с CO2 флюидом в область более высоких температур: с 1310 до 1460°С при 6 ГПа для чистого пиропа и для твердого раствора пироп 50 мол. % – гроссуляр 50 мол. % соответственно. Расчеты для пироксена ограничиваются чистым диопсидом (Knoche et al., 1999).
В настоящей работе внимание было сосредоточено на изучении расчетными методами реакций твердых растворов ряда пироп-гроссуляр и диопсид–жадеит, которые являются основными компонентами эклогитов, с СО2-флюидом.
МЕТОДИКА РАСЧЕТА
Исходя из условия термодинамического равновесия реакции:
положение линии равновесия в P-T координатах можно рассчитать, зная активности и уравнения состояния компонентов реакции:
(4)
$\begin{gathered} {{\Delta }_{f}}{{G}^{0}} = {{\Delta }_{f}}{{H}^{0}} + \int\limits_{{{T}_{0}}}^T {{{C}_{p}}dT} - \\ - \,\,T\left[ {{{S}^{0}} + \int\limits_{{{T}_{0}}}^T {\frac{{{{C}_{p}}}}{T}dT} } \right] + \int\limits_{{{P}_{0}}}^P {VdP,} \\ \end{gathered} $где для CO2-флюида $\int_{{{P}_{0}}}^P {VdP} $ заменяется на зависимость фугитивности CO2 от давления и температуры (Holland, Powell, 1998).
Твердые растворы пироп-гроссуляр (Prp-Grs) при расчетах рассматривались с позиции модели Ван Лаара для асимметричного взаимодействия, согласно которой активность компонентов твердого раствора равны:
(5)
${\text{a}}\left( {Prp} \right) = {{\left( {{{{\text{X}}}_{{{\text{Mg}}}}}{{g}_{{prp}}}} \right)}^{3}},$(6)
${\text{a}}\left( {Grs} \right) = {{\left( {\left( {1 - {{{\text{X}}}_{{{\text{Mg}}}}}} \right){{{\text{g}}}_{{Grs}}}} \right)}^{3}},$(7)
$RT\ln {{g}_{l}} = - \sum\limits_{i = 1}^{n - 2} {\sum\limits_{j > 1}^n {{{q}_{i}}{{q}_{j}}W_{{ij}}^{*}} ,} $Для ряда диопсид-жадеит (Di-Jd) было использовано приближение идеального раствора (Navrotsky, 1987), как наиболее простая модель, которая, как показано предыдущими исследователями (Gasparik, 1985; Wood et al., 1980), хорошо описывает активность компонентов данных твердых растворов при температурах свыше 1000°C:
где XMg и XCa – мольные доли кальция и магния в твердом растворе CaMgSi2O6–NaAlSi2O6. Расчеты были проведены в программе THERMOCALC v.3.45 с использованием базы данных (Holland, Powell, 1998). Исследовался интервал давлений от 3.0 до 6.0 ГПа, погрешность расчета температуры не превышала 10°C.В программе THERMOCALC реализованы два способа расчета линий реакции для твердых растворов. Первый вычисляет положение линий реакций для конечных членов ряда с учетом заданной активности. Второй вычисляет положение точек равновесия по алгоритму Гаусса–Ньютона для решения совокупности нелинейных уравнений, образованных из соотношений равновесия для независимых реакций между конечными членами ряда. На выходе получаются точки равновесия, отличающиеся соотношением компонентов раствора. Данные точки представляют собой условное пересечение линий реакции для отдельных компонентов раствора (условное, поскольку в ходе реакций твердых растворов могут образовываться фазы, отличные от продуктов реакций конечных членов). В данной работе применены оба способа, поскольку рассматриваются реакции как отдельных конечных членов, так и твердых растворов между ними.
РЕЗУЛЬТАТЫ РАСЧЕТОВ
Система пироп–гроссуляр
В случае твердых растворов пироп–гроссуляр оба компонента реагируют с CO2:
(9)
$\begin{gathered} {\text{M}}{{{\text{g}}}_{{\text{3}}}}{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{\left( {{\text{Si}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}} + 3{\text{C}}{{{\text{O}}}_{2}} = \\ = 3{\text{MgC}}{{{\text{O}}}_{3}} + {\text{A}}{{{\text{l}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{5}} + {\text{2Si}}{{{\text{O}}}_{2}}, \\ \end{gathered} $(10)
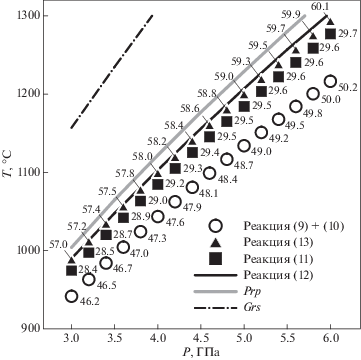
$\begin{gathered} {\text{С}}{{{\text{a}}}_{{\text{3}}}}{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{\left( {{\text{Si}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}} + 3{\text{C}}{{{\text{O}}}_{{\text{2}}}} = \\ = 3{\text{СaC}}{{{\text{O}}}_{{\text{3}}}} + {\text{A}}{{{\text{l}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{5}} + 2{\text{Si}}{{{\text{O}}}_{2}}. \\ \end{gathered} $Согласно расчетам, линия равновесия для реакции гроссуляр + CO2 располагается выше по температуре, чем линия для реакции пироп + СО2. При переходе к твердым растворам положение равновесия смещается в сторону более низких температур (рис. 1). Точки пересечения двух реакций находятся в следующих координатах: 3.0 ГПа – 942°C, Ca#46; 4.5 ГПа – 1090°C, Ca#48; 6.0 ГПа – 1216°C, Ca#50.
Рис. 1.
Расчетные линии равновесия для реакций с CO2-флюидом пиропа (Prp) и гроссуляра (Grs) (равновесия (9) и (10) соответственно) при образовании твердых растворов с различным кальциевым номером (Ca# = 100XCa = 100nCa/(nCa + nMg)).
Очевидно, что в области ниже обеих линий равновесия с CO2 будет реагировать весь твердый раствор. Образующийся продукт будет представлять собой не механическую смесь карбонатов кальция и магния, а их твердый раствор с тем же кальциевым номером. Так как согласно расчетам наиболее стабильные составы приближены к 50%, продукты реакции удобно представить в виде суммы стехиометричного доломита CaMg(CO3)2 и соответствующего карбоната. Тогда уравнения реакции запишутся в следующем виде:
(11)
$\begin{gathered} {\text{M}}{{{\text{g}}}_{{3{\text{ }}--}}}_{x}{\text{С}}{{{\text{a}}}_{x}}{\text{A}}{{{\text{l}}}_{2}}{{\left( {{\text{Si}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}} + 3{\text{C}}{{{\text{O}}}_{{\text{2}}}} = \left( {3 - 2x} \right){\text{MgC}}{{{\text{O}}}_{3}} + \\ + \,\,x{\text{CaMg}}{{\left( {{\text{C}}{{{\text{O}}}_{3}}} \right)}_{2}} + {\text{A}}{{{\text{l}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{{\text{5}}}} + {\text{ }}2{\text{Si}}{{{\text{O}}}_{2}}, \\ \end{gathered} $(12)
$\begin{gathered} {\text{M}}{{{\text{g}}}_{{{\text{1}}{\text{.5}}}}}{\text{С}}{{{\text{a}}}_{{{\text{1}}{\text{.5}}}}}{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{\left( {{\text{Si}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}} + 3{\text{C}}{{{\text{O}}}_{{\text{2}}}} = \\ = 1.5{\text{CaMg}}{{\left( {{\text{C}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}} + {\text{A}}{{{\text{l}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{5}} + 2{\text{Si}}{{{\text{O}}}_{2}}, \\ \end{gathered} $(13)
$\begin{gathered} {\text{M}}{{{\text{g}}}_{{3{\text{ }}--}}}_{x}{\text{С}}{{{\text{a}}}_{x}}{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{\left( {{\text{Si}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{3}} + 3{\text{C}}{{{\text{O}}}_{{\text{2}}}} = \left( {2x - 3} \right){\text{СaC}}{{{\text{O}}}_{3}} + \\ + \,\,\left( {3 - x} \right){\text{CaMg}}{{\left( {{\text{C}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}} + {\text{A}}{{{\text{l}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{5}} + 2{\text{Si}}{{{\text{O}}}_{2}}, \\ \end{gathered} $Расчеты для уравнений (11) и (13) дают наборы точек равновесия для твердых растворов, характеризующиеся определенным кальциевым номером (рис. 2). Выше линий, образованных данными точками, располагается область стабильности CO2 с гранатом. Из графика видно, что равновесие достигается при более низких температурах, чем для чистого пиропа. При этом точки для гранатов с Ca# порядка 60 и 30% оказываются ниже, чем линия реакции 50% раствора.
Система диопсид–жадеит
Реакция диопсида с CO2 хорошо изучена и протекает при температурах, близких к реакции пиропа (Luth, 1995):
(14)
${\text{СaMgS}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{6}}}} + 2{\text{C}}{{{\text{O}}}_{{\text{2}}}} = {\text{CaMg}}{{\left( {{\text{C}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{2}}}} + 2{\text{Si}}{{{\text{O}}}_{2}}.$В то же время о реакции жадеита с CO2 практически ничего не известно. Теоретическое положение равновесия рассчитать сложно, поскольку реакция предполагает образование комбинации Na–Ca–Mg карбонатов и их расплавов (Shatskiy et al., 2016; Podborodnikov et al., 2019, 2019a), термодинамические данные по которым отсутствуют. Поэтому данный вопрос требует прежде всего экспериментальных исследований.
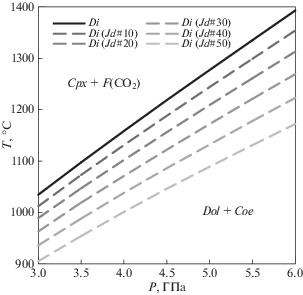
Проведенные расчеты по реакции (14) показывают, что существование диопсида в виде твердого раствора с жадеитом будет понижать его активность в реакции, расширяя область стабильности CO2 (рис. 3). По аналогии с твердыми растворами гранатов можно предположить, что зона стабильности твердых растворов диопсид–жадеит с CO2 будет находится ниже по температурам, чем для чистого диопсида. То, насколько сильно сместится линия реакции, будет зависеть от положения равновесия для чистого жадеита относительно диопсида.
МЕТОДИКА И РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
С целью верификации результатов расчетов нами были поставлены эксперименты на многопуансонном гидравлическом прессе “Discoverer-1500" DIA-типа в ячейке из оксида циркония при параметрах, представленных в таблице 1. Подробная методика проведения опытов представлена в работе Shatskiy et al. (2017a).
Таблица 1.
Параметры экспериментов
| Давление, ГПа | 4.5 | 4.5 | 6.0 | 6.0 |
|---|---|---|---|---|
| Температура, °C | 1000 | 1100 | 1100 | 1200 |
| Длительность, ч | 115 | 73 | 147 | 90 |
В качестве исходных веществ использовали порошки Na2CO3, CaCO3, MgCO3, просушенные при 300°С, и SiO2, Al2O3, прокаленные при 1000°С. Для получения однородных смесей готовые навески перетирали в ступке из карбида вольфрама под этанолом и держали в сушильном шкафу при 100°C до полного высыхания. Состав смесей приведен в табл. 2.
Таблица 2.
Состав исходных смесей
| Обозначение смеси | CaCO3,мол. % | MgCO3, мол. % | Al2O3, мол. % | Na2CO3, мол. % | SiO2, мол. % |
|---|---|---|---|---|---|
| Grt(Ca#60) | 25.8 | 17.1 | 14.2 | – | 42.9 |
| Cpx (Jd#10) | 23.1 | 23.1 | 1.3 | 1.3 | 51.2 |
Готовые образцы анализировали на сканирующем электронном микроскопе MIRA 3 LMU, совмещенном с энергодисперсионным рентгеновским микроанализатором INCA Energy 450 (Oxfords Instruments). Данная методика не позволяет измерить состав флюида, однако образование граната или клинопироксена из соответствующих карбонатов по уравнениям реакции (9)–(14) подразумевает образование молекулярного CO2, который в отсутствие расплава представляет собой свободный флюид при P-T параметрах экспериментов.
Рис. 4.
Микрофотографии образцов Grt (Ca#60) (а) и Cpx (Jd#10) (б) со сканирующего электронного микроскопа в режиме обратно рассеянных электронов. Grt – гранат, Сpx – клинопироксен, Dol – доломит, Coe – коэсит, Ky – кианит.

Результаты анализа системы пироп–гроссуляр показывают образование граната с долей гроссуляра 31–32 мол. %, хотя большая часть образца представлена кианитом, коэситом и доломитом с Ca# 58–62 (рис. 5а). Фазовый состав образцов хорошо согласуется с расчетами дли реакции (13), а присутствие в них в небольших количествах граната с низким кальциевым номером может свидетельствовать о большей стабильности таких гранатов с CO2.
Рис. 5.
Результаты экспериментов для систем а) Grt (Ca#60), б) Cpx (Jd#10). Grt# – твердый раствор пироп–гроссуляр с указанием кальциевого номера, Dol# – доломит с указанием кальциевого номера, Jd# – твердый раствор диопсид–жадеит с указанием жадеитового номера.
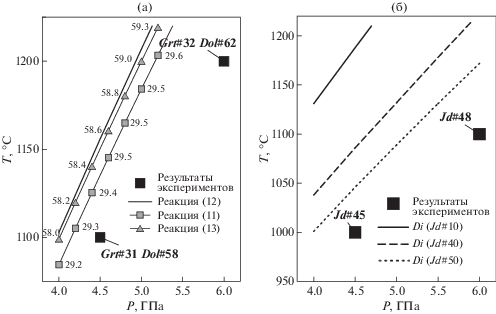
В образцах смеси диопсид–жадеит несмотря на изначальную долю жадеита 10 мол. % происходит образование клинопироксена с долей жадеита 48 мол. % при 4.5 ГПа и 45 мол. % при 6.0 ГПа (рис. 5б), однако основной объем занимают фазы доломита и коэсита, что не противоречит положению экспериментальных точек относительно расчетных линий реакции. Кроме клинопироксена фазы, содержащие натрий и алюминий, отсутствуют, из чего следует, что жадеит в составе твердого раствора устойчив с CO2-флюидом.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
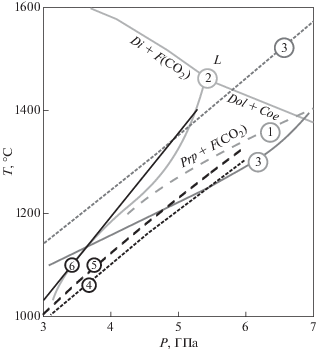
Сравнение рассчитанных линий с имеющимися литературными данными показало, что общая тенденция к снижению температуры при переходе к твердым растворам соответствует расчетам для пиропа и гроссуляра в работе Knoche et al. (1999). Сдвиги линий реакции при использовании модели, отличной от идеального смешения, имеют более низкие значения. Тем не менее расчеты показывают, что сосуществование твердых растворов пироп-гроссуляр с CO2-флюидом становится возможным в области под линиями реакций конечных членов. Наиболее заметны здесь различия с работой Bataleva et al. (2020), авторы которой приводят расчеты и эксперименты для системы CaMg(CO3)2–SiO2–Al2O3 с исходной долей кальция Ca#50. Как видно из диаграммы (рис. 6), положение линии равновесия для данной системы сильно отличается от рассчитанного в статье Bataleva et al. (2020), но в то же время хорошо согласуется с приведенными экспериментальными данными в области давлений свыше 5 ГПа.
Рис. 6.
Сравнение расчетных и экспериментальных линий равновесия. 1) экспериментальная кривая пироп-CO2 (Knoche, 1999); 2) экспериментальные кривые в системе диопсид-CO2 (Luth, 1995); 3) экспериментальная (сплошная) и расчетная (пунктриная) линия реакции для системы CaMg(CO3)2–SiO2–Al2O3 (Bataleva et al., 2020); 4) расчетная линия реакции (12); 5) расчетная линия реакции (9); 6) расчетная линия реакции (14).
ВЫВОДЫ
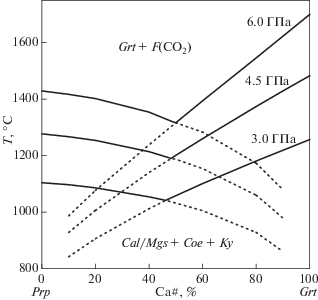
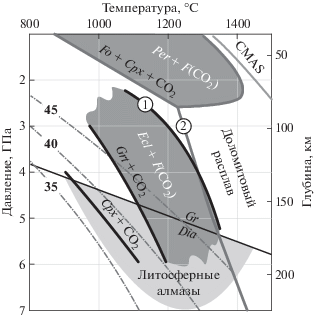
Проведенные в данной работе расчеты, а также тестовые эксперименты, подтверждают предположение о смещении области устойчивости твердых растворов гранат-гроссуляр и диопсид-жадеит с CO2-флюидом по сравнению с чистыми миналами, пиропом и диопсидом. Лучше всего согласуются с экспериментами расчеты для реакции (11). Образование во всех образцах граната и клинопироксена, соответственно, свидетельствует о существовании составов, полностью устойчивых с CO2 флюидом при геотермальных условиях литосферной мантии Земли, включая P-T область кристаллизации большинства природных алмазов (рис. 7). Тем не менее, сложная зависимость состава твердых растворов граната и клинопироксена в равновесии с СО2 флюидом от давления и температуры требует детального экспериментального исследования данных систем.
Рис. 7.
P-T области устойчивости СО2 флюида в равновесии с минералами эклогитового парагенезиса (Ecl + CO2), согласно расчётным данным (данная работа), и перидотитового парагенезиса, согласно экспериментам (Wyllie, Huang, 1975). (1) – солидус системы эклогит-СO2 (Yaxley, Brey, 2004), (2) – солидус перидотита в системе CMAS-CO2 (Dalton, Presnall, 1998). Серыми пунктирными линиями отмечены континентальные геотермы с величиной теплового потока 35, 40 и 45 мВт/м2 (Pollack, Chapman, 1977). Gr/Dia – Линия равновесия графит-алмаз (Kennedy, Kennedy, 1976).
Работы на сканирующем микроскопе выполнены в ЦКП Многоэлементных и изотопных исследований СО РАН.
Работа выполнена по государственному заданию ИГМ СО РАН при поддержке РФФИ (проект № 20-05-00811).
Список литературы
Баталева Ю.В., Новоселов И.Д., Крук А.Н., Фурман О.В., Реутский В.Н. Пальянов Ю.Н. (2020) Экспериментальное моделирование реакций декарбонатизации, сопряженных с образованием Mg, Fe-гранатов и CO2-флюида при мантийных P, T-параметрах. Геология и геофизика. 61(S5-6), 794-809.
Литасов К.Д. (2011) Физико-химические условия плавления мантии Земли в присутствии С–О–Н-флюида по экспериментальным данным. Геология и геофизика. 52(5), 613-635.
Литасов К.Д., Шацкий А.Ф. (2019) Исследование реакции MgCO3 + SiO2 при давлениях до 32 ГПа с помощью рентгеновской дифрактометрии и синхротронного излучения. Геохимия. 64(9), 1003-1012.
Litasov K.D., Shatskiy A.F. (2019) MgCO3 + SiO2 Reaction at Pressures up to 32 GPa Studied Using in-Situ X-Ray Diffraction and Synchrotron Radiation. Geochem. Int. 57(9), 1024-1033.
Похиленко Н.П., Агашев А.М., Литасов К.Д., Похиленко Л.Н. (2015) Взаимоотношения карбонатитового метасоматоза деплетированных перидотитов литосферной мантии с алмазообразованием и карбонатит-кимберлитовым магматизмом. Геология и геофизика. 56(1–2), 361-383.
Рагозин А.Л., Шацкий В.С., Рылов Г.М., Горяйнов С.В. (2002) Включения коэсита в округлых алмазах из россыпей северо-восточной части Сибирской платформы. ДАН. 384(4), 509-513.
Рагозин А.Л., Шацкий В.С., Зедгенизов Д.А. (2009) Новые данные о составе среды кристаллизации алмазов V разновидности из россыпей северо-востока Сибирской платформы. ДАН. 425(4), 527-531.
Томиленко А.А., Рагозин А.Л., Шацкий В.С., Шебанин, А.П. (2001) Вариации состава флюидной фазы в процессе кристаллизации природных алмазов. ДАН. 378(6), 802-805.
Bataleva Y.V., Kruk A.N., Novoselov I.D., Furman O.V., Palyanov Y.N. (2020a) Decarbonation reactions involving ankerite and dolomite under upper mantle P, T-parameters: Experimental modeling. Minerals. 10(8), 715.
Berman R.G. (1991) Thermobarometry using multi-equilibrium calculations: a new technique with petrological application. Can. Miner. 29(4), 833-855.
Chinn I.L. (1995) Cathodoluminescence properties of CO2-bearing and CO2-free diamonds from the George Creek K1 Kimberlite dyke. Int. Geol. Rev. 37(3), 254-258.
Dalton J.A., Presnall D.C. (1998) Carbonatitic melts along the solidus of model lherzolite in the system CaO–MgO–Al2O3–SiO2–CO2 from 3 to 7 GPa. Contrib Mineral Petrol. 131, 123-135.
Gasparik T. (1985) Experimentally determined compositions of diopside-jadeite pyroxene in equilibrium with albite and quartz at 1200–1350°C and 15–34 kbar. Geochim. Cosmochim. Acta. 3(49), 865-870
Guthrie G.D., Veblen D.R., Navon O., Rossman G.R. (1991) Submicrometer fluid inclusions in turbid-diamond coats. Earth Planet. Sci. Lett. 105(1–3), 1-12.
Holland T., Powell R. (1998) An internally consistent thermodynamic data set for phases of petrological interest. J. Metamorphic Geol. 16(3), 309-343.
Holland T., Powell R. (2003) Activity–composition relations for phases in petrological calculations: an asymmetric multicomponent formulation. Contrib Mineral Petrol. 145, 492-501.
Kennedy C.S., Kennedy G.C. (1976) The equilibrium boundary between graphite and diamond. J. Geophys. Res. 81(14), 2467-2470.
Knoche R., Sweeney R.J., Luth R.W. (1999) Carbonation and decarbonation of eclogites: the role of garnet. Contrib Mineral Petrol. 135(4), 332-339.
Koziol A.M., Newton R.C. (1998) Experimental determination of the reaction: Magnesite + enstatite = forsterite + CO2 in the ranges 6–25 kbar and 700–1100°C. American Mineralogist, 83(3–4), 213-219.
Luth R.W. (1995) Experimental determination of the reaction dolomite + 2 coesite = diopside + 2 CO2 to 6 GPa. Contrib Mineral Petrol. 122(1–2), 152-158.
Navon O., Hutcheon I., Rossman G., Wasserburg G. (1988) Mantle-derived fluids in diamond micro-inclusions. Nature. 335(6193), 784-789.
Navrotsky A. (1987) Models of crystalline solutions. In Thermodynamic Modeling of Geologic Materials: Minerals, Fluids, and Melts (Eds. Carmichael I.S.E., Eugster H.). De Gruyter, 499.
Podborodnikov I.V., Shatskiy A., Arefiev A.V., Bekhtenova A., Litasov K.D. (2019) New data on the system Na2CO3–CaCO3–MgCO3 at 6 GPa with implications to the composition and stability of carbonatite melts at the base of continental lithosphere. Chem. Geol. 515, 50-60.
Podborodnikov I.V., Shatskiy A., Arefiev A.V., Litasov K.D. (2019a) Phase relations in the system Na2CO3–CaCO3–MgCO3 at 3 GPa with implications for carbonatite genesis and evolution. Lithos. 330–331, 74-89.
Pollack H.N., Chapman D.S. (1977) On the regional variation of heat flow, geotherms, and lithospheric thickness. Tectonophysics. 38, 279-296.
Ragozin A.L., Zedgenizov D.A., Kuper K.E., Shatsky V.S. (2016) Radial mosaic internal structure of rounded diamond crystals from alluvial placers of Siberian platform. Mineral. Petrol. 110(6), 861-875.
Schrauder M., Navon O. (1993) Solid carbon dioxide in natural diamond. Nature. 365(6441), 42-44.
Sharygin I.S., Litasov K.D., Shatskiy A. F., Golovin A.V., Ohtani E., Pokhilenko N.P. (2015) Melting phase relations of the Udachnaya-East Group-I kimberlite at 3.0–6.5 GPa: experimental evidence for alkali-carbonatite composition of primary kimberlite melt and implication to mantle plumes. Gondwana Research. 28(4), 1391-1414.
Sharygin I.S., Litasov K.D., Shatskiy A., Safonov O.G., Golovin A.V., Ohtani E., Pokhilenko N.P. (2017) Experimental constraints on orthopyroxene dissolution in alkali carbonate melts in the lithospheric mantle: Implications for kimberlite melt composition and ascent. Chem. Geol. 455, 44-55.
Shatskiy A., Litasov K.D., Sharygin I.S., Egonin I.A., Mironov A.M. Palyanov, Y.N., Ohtani E. (2016) The system Na2CO3–CaCO3–MgCO3 at 6 GPa and 900–1250°C and its relation to the partial melting of carbonated mantle. High Pressure Research. 36(1), 23-41.
Shatskiy A., Litasov K.D., Sharygin I.S., Ohtani E. (2017) Composition of primary kimberlite melt in a garnet lherzolite mantle source: constraints from melting phase relations in anhydrous Udachnaya-East kimberlite with variable CO2 content at 6.5 GPa. Gondwana Research. 45, 208-227.
Shatskiy A., Podborodnikov I.V., Arefiev A.V., Litasov K.D., Chanyshev A.D., Sharygin I.S., Karmanov N.S., Ohtani E. (2017a) Effect of alkalis on the reaction of clinopyroxene with Mg-carbonate at 6 GPa: Implications for partial melting of carbonated lherzolite. American Mineralogist. 102(9), 1934-1946.
Smith E.M., Kopylova M.G., Frezzotti M.L., Afanasiev V.P. (2015) Fluid inclusions in Ebelyakh diamonds: Evidence of CO2 liberation in eclogite and the effect of H2O on diamond habit. Lithos. 216, 106-117.
Wood B.J., Holland T., Newton R.C., Kleppa O.J. (1980) Thermochemistry of jadeite-diopside pyroxenes. Geochim. Cosmochim. Acta. 9(44), 1363-1371.
Wyllie P.J., Huang W. (1975) Peridotite, kimberlite, and carbonatite explained in the system CaO–MgO–SiO2–CO2. Geology. 3, 621-624.
Yaxley G.M., Brey G.P. (2004) Phase relations of carbonate-bearing eclogite assemblages from 2.5 to 5.5 GPa: implications for petrogenesis of carbonatites. Contributions to Mineral. Petrol. 146(5), 606-619.
Дополнительные материалы отсутствуют.