Геохимия, 2022, T. 67, № 2, стр. 136-149
Особенности биогенной миграции азота и фосфора в соленых пересыхающих озерах Крыма
И. И. Руднева a, И. Н. Залевская b, *, В. Г. Шайда a, c, Г. Н. Меметлаева b, **, А. В. Щерба d
a Морской гидрофизический институт РАН
299011 Севастополь, ул. Капитанская, 2, Россия
b Крымский федеральный университет им. В.И. Вернадского
295007 Симферополь, пр. Вернадского, 4, Россия
c ООО “Экосервич-А”
107140 Москва, ул. Верхняя Красносельская, 17А, стр. 16, Россия
d ООО “Севстар”
299055 Севастополь, Хрусталева, 74-А, Россия
* E-mail: inz3@mail.ru
** E-mail: svg-41@mail.ru
Поступила в редакцию 16.06.2021
После доработки 25.06.2021
Принята к публикации 25.06.2021
- EDN: BUIFNK
- DOI: 10.31857/S001675252202008X
Аннотация
Представлены результаты исследований особенностей биогенной миграции элементов на примере изучения шести крымских пересыхающих гиперсоленых озер Евпаторийской группы. Поступление биогенов в соленые озера Крыма происходит за счет естественных источников, к которым следует отнести атмосферные осадки, продукты эрозии, перелив морской воды во время штормов, продукты жизнедеятельности водоплавающих птиц и животных, выпас которых осуществляется на прибрежных территориях, процессов в экосистемах (эвтрофирование, жизнедеятельность гидробионтов), а также азота и фосфора, содержащихся в стоках, попадающих как непосредственно в водные объекты, так и через грунтовые воды, рекреационной нагрузки на берегах озер. В летний период при достижении температуры воздуха и воды свыше +30°С происходит интенсивное испарение и их дальнейшее высыхание. Показано, что в пересохших водоемах нарушаются естественные циклы миграции азота и фосфора в связи с прекращением функционирования биоты, в частности микроводорослей, микробных сообществ и ракообразных артемии. В засушливые периоды происходит также накопление и концентрирование азота, фосфора и загрязняющих веществ на дне водоемов, которые во время сильных ветров и штормов, характерных для данного района, разносятся на прилегающие территории и тем самым представляют угрозу для здоровья человека. Обсуждаются вероятные сценарии трансформации экосистем соленых озер в условиях возможного потепления климата и при усилении антропогенной активности.
ВВЕДЕНИЕ
Гиперсоленые озера – это бессточные водоемы, содержащие более 44% воды и занимающие 23% площади всех озер на земле (Jellison et al., 2008; Wurtsbaugh et al., 2017), широко распространенные по всему миру и расположенные в основном в засушливых районах. Еще в древние времена на соленых озерах располагались солепромыслы, в настоящее время их ресурсы используются в более широких масштабах: в химическом и галургическом производстве, бальнеологии, фармацевтике, при изготовлении спа-материалов и косметических препаратов. На фоне крайне низкого биоразнообразия, доминирующим видом в этих водных объектах является жаброногий рачок артемия Artemia salina, широко применяемый в качестве стартового корма для объектов аквакультуры (Wooldridge et al., 2016; Shadkam et al., 2016). Артемия выполняет важную функцию в регуляции гидроминерального режима соленых озер. Будучи фильтратором, она способствует трансформации и утилизации различных минеральных и органических веществ, поступающих в эти водоемы, и тем самым является важным звеном в биогенной миграции элементов, в том числе веществ антропогенного происхождения. В связи с этим соленые озера принимают активное участие в осуществлении природных циклов различных элементов, что имеет важное экологическое значение.
Многие соленые озера расположены в зоне активной хозяйственной деятельности человека, которая отрицательно влияет на экосистемы, нарушает их эволюционно сложившийся баланс и взаимодействие с окружающей средой. Это приводят к драматическим последствиям для этих уникальных экосистем, что выражается в химическом загрязнении рапы, распреснении или засолении, изменении гидроминерального режима и элементного состава, нарушению отношений живых организмов, снижая и без того низкое биоразнообразие (Гулов, 2007). Происходящие изменения негативно влияют на микробные сообщества, нарушая баланс между различными группами микроорганизмов, в том числе тех, которые участвуют в трансформации органических и неорганических веществ, в биогеохимических циклах биогенных элементов – азота и фосфора (Chapra et al., 2012; Lazar et al., 2017). Совокупность этих процессов на фоне изменения климата может привести к крайне негативным последствиям для соленых озер, которые уже наблюдаются во многих местах планеты – их высыханию и полной деградации (Tusupova et al., 2020).
В Крыму имеется несколько десятков соленых прибрежно-морских озер, которые образовались в конце четвертичного оледенения и повышения уровня Мирового океана на 100–120 м. Лиманы, затопленные в результате подъема уровня моря, устьевые участки речных долин, а также лагуны – мелководные заливы, отделенные от моря песчаными косами-пересыпями по побережью Крымского полуострова, превратились в соленые озера (Понизовский, 1965; Хохлов и др., 2019). Губина этих водоемов не превышает 3 м. Их соленость и другие физико-химические параметры колеблются в широких пределах, зависят от гидрометеорологических (климатических) факторов, к которым относятся сезонные и суточные изменения температуры воздуха, водной среды и донных отложений на разной глубине их залегания, количества атмосферных осадков, скорости и направления ветра и т.д., которые обусловлены географическим положением и глобальным изменениями климата. Антропогенная деятельность также влияет на экологическое состояние соленых водоемов, которая выражается в рекреационной и сельскохозяйственной активности в этих районах, что сопряжено с поступлением большого количества биогенов в экосистемы. Соединения азота и фосфора играют большую роль в обеспечении нормальной жизнедеятельности водной экосистемы, поскольку способствуют развитию фитопланктона и участвуют в образовании первичной продукции (Guo et al., 2004; Mantyka-Pringle et al., 2016). При этом биомасса микроводорослей существенно сокращается, если концентрация биогенов ниже оптимальной, необходимой для их роста и развития. В то же время высокие концентрации биогенов ухудшают качество воды, что приводит к уменьшению биоразнообразия, эвтрофированию, падению содержания кислорода и гибели гидробионтов (Glibert et al., 2008).
Соленые озера Крыма полностью отделились от моря, но некоторые сохраняют с ним связь через проливы-гирла. Питание водоемов осуществляется посредством поверхностного притока за счет ливневых паводков, фильтрации воды из моря через косы-пересыпи или через гирла; грунтовыми водами, а также стоками с полей и других сельскохозяйственных угодий. На дне большинства озер имеются мощные отложения ила – минеральных грязей, имеющих лечебное значение (Васенко, 2012; Гулов, 2006). Сложные и многоплановые взаимодействия экосистем соленых озер с окружающей средой определяют особенности биогенной миграции элементов в них, что мы отмечали ранее (Руднева и др., 2020). Находясь в зоне засушливого климата, где среднегодовое количество осадков составляет 400 мм (Ежов, Тарасенко, 2002; Тарасенко, 2014), некоторые мелководные озера пересыхают в летне-осенний период, но поздней осенью, когда начинается сезон интенсивных выпадений осадков, происходит сукцессия экосистем. Можно предполагать, что в высохших озерах происходит нарушение естественных биогеохимических циклов элементов или же существенная их модификация. Поскольку экологическое состояние внутренних водоемов во многом определяется совокупным влияниям природных и антропогенных факторов на прилегающих территориях, исследование основных характеристик таких водных объектов представляет несомненный интерес как с точки зрения эффектов взаимодействия суши, водоема и моря, так и дает возможность составить прогноз дальнейшей трансформации водной экосистемы как результат этих взаимодействий (Моисеенко, Гашкина, 2010).
В связи с этим целью настоящей работы явилось изучение особенностей сезонной биогенной миграции азота и фосфора на фоне изменения гидрохимических показателей воды в пяти пересыхающих соленых озерах Евпаторийской группы (Республика Крым) в 2017 г.
ОБЪЕКТЫ, МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика объектов исследования
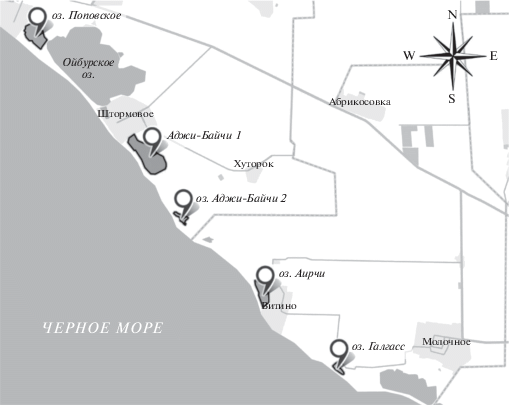
Координаты исследуемых озер представлены в табл. 1, расположение показано на рис. 1.
Таблица 1.
Координаты исследуемых соленых озер Евпаторийской группы
| Озеро | с.ш. | в.д. |
|---|---|---|
| Поповское | 45°29′16″80 | 33°04′79″88 |
| Аджи-Байчи 1 | 45°25′58″13 | 33°09′59″39 |
| Аджи-Байчи 2 | 45°23′71″15 | 33°11′04″73 |
| Аирчи | 45°21′39″18 | 33°14′54″92 |
| Галгасс | 45°19′13″66 | 33°17′74″78 |
Поповское озеро – мелководный бессточный водоем, отделенный дамбой от озера Ойбург и находящийся от него в 50 м. На дне озера находится черная с характерным запахом сероводорода лечебная грязь. Во времена Юрского периода водоем постепенно отделился от Черного моря вследствие действия сильных ветров и штормов. Два озера сообщаются между собой подземными течениями, и иногда их называют одним названием (Большое и Малое Ойбургские озера). Поповское озеро благодаря наличию лечебных грязей является местом активной рекреации. В летний период оно часто пересыхает.
Озеро Аджи-Байчи 1 – самое большое бессточное озеро лиманного происхождения. Площадь 0.75–1.2 км2, глубина до 0.2 м, наибольшая 0.65 м, длина 1.5 км, наибольшая ширина 0.7 км. Площадь водосборного бассейна составляет 41 км2, разница с уровнем моря 0.4 м. Отделено от Черного моря перешейком, по которому проходит дорога без твердого покрытия. На юго-востоке к озеру прилегают солончаки. Питание смешанное за счет поверхностных и подземных вод. Рапа мутная, зелено-серого цвета с неприятным запахом в результате эвтрофирования, когда развитие микроводорослей в некоторые годы придает летом озеру красноватый или зеленоватый оттенок. На поверхности дно покрыто илистыми черными отложениями, под ними залегают серые и стально-серые. Донные осадки не отвечают требованиям кондиций для лечебных грязей, но используются для этих целей туристами. При дальнейшем исследовании могут быть определены как ценный источник целебного сырья.
Озеро Аджи-Байчи-2 – небольшой водоем, площадь которого значительно уменьшается в теплый сезон вплоть до полного высыхания. Озеро расположено в степной зоне по побережью Черного моря, отделено от него песчаным перешейком. Хозяйственного значения не имеет, по берегам производится выпас сельскохозяйственных животных. Вода мутная, с неприятным запахом. В летний период времени рапа приобретает ярко-красный оттенок за счет бурного развития микроводоросли Dunaliella salina.
Озеро Аирчи расположено в районе базы отдыха. Площадь 0.5 км2, длина 1 км, наибольшая ширина 0.37 км, глубина до 0.2 м. Площадь водосборного бассейна 13.8 км2. высота над уровнем моря 0.3 м. От моря отделено песчаной пересыпью, через которую во время сильных штормов в акваторию происходит перелив морской воды. На юго-востоке к озеру прилегают солончаки, на севере в озеро впадают сухоречья. В верхнем слое на дне залегает толща илистых черных донных отложений, затем располагаются серые и стально-серые. В некоторые годы летом озерная рапа приобретает красноватый или зеленоватый цвет в результате бурного развития фитопланктона. В 19 веке на озере действовал солепромысел, на котором ежегодно добывалось до 500 т соли. Питание смешанное за счет поверхностных и подземных вод.
Озеро Галгасс имеет площадь 0.16 км2, площадь водосборного бассейна 11 км2, длина 420 м, средняя ширина 130 м, наибольшая 300 м, глубина 0.2–0.55 м. Отделено от Черного моря перешейком шириной 50 метров, по которому проходит дорога без твердого покрытия. Восточнее озера расположена ферма, севернее проходит территориальная дорога сообщения Молочное–Витино. На дне водоема залегает толща донных отложений. Интенсивная вегетация микроводорослей приводит к развитию процессов эвтрофирования, что придает рапе красноватый или зеленоватый оттенок. Питание смешанное за счет поверхностных и подземных вод. Лечебные илы озера используются в рекреационных целях для самолечения.
Следует отметить, что на берегах перечисленных озер в летний период располагаются туристы, в результате чего на побережье остается мусор и несанкционированные свалки, в связи с чем эти водоемы испытывают определенную антропогенную нагрузку.
Методы исследования
Анализ гидрохимических параметров рапы озер проводили в соответствие с методами, описанными нами ранее (Руднева и др., 2020). Пробы воды отбирали ежемесячно в каждом водоеме, координаты которых определяли с помощью смартфона GSMA51OF/DS (Samsung Electronics. CoLtd, Южная Корея) в течение 2017 г. Температуру воздуха и воды в озерах измеряли с помощью электронного термометра HANNA Instruments Check Temp – 1 (Россия) непосредственно в водоемах.
Пробы рапы отбирали в пластиковые бутылки объемом 2 л и транспортировали в лабораторию. В лабораторных условиях анализировали соленость воды с помощью рефрактометра PAL-06S LTA GO (Япония) и выражали в промилле ‰. Водородный показатель рН, окислительно-восстановительный потенциал Еh, концентрацию растворенного в воде кислорода определяли с помощью анализатора Expert-001 (Econix-Expert Moexa CoLtd, Москва, Россия) с использованием соответствующих электродов.
Содержание нитритов анализировали фотометрическим методом с реактивом Грисса в соответствие с ПНДФ 14.1:2:4.3-951995. (Массовая концентрация нитратов…, 2010). Метод основан на способности нитритных ионов давать интенсивно окрашенные диазосоединения с первичными ароматическими аминами. Проводили реакцию с сульфаниловой кислотой и альфа-нафтиламином (реактив Грисса) с образованием розовой окраски, интенсивность которой пропорциональна содержанию нитритов в воде. Содержание нитратов определяли потенциометрическим методом согласно РД 52.24.367-2010 (Методика измерений…, 1995). Концентрацию фосфатов в рапе устанавливали фотометрическим методом РД 52.24.382-2006 (Массовая концентрация фосфатов… 2006) Метод основан на взаимодействии фосфатов с молибдатом аммония в кислой среде с образованием молибдофосфорной гетерополикислоты Н7[Р(Мо2O7)6] · nH2О, которая затем восстанавливается аскорбиновой кислотой в присутствии антимонилтартрата калия до интенсивно окрашенной молибденовой сини.
Статистическая обработка результатов
Все определения проводили в трех повторностях, вычисляли средние значения, которые анализировали. Сравнительный анализ гидрохимических показателей воды исследуемых озер и содержания биогенных элементов проводили с помощью компьютерной программы STATISTICA (версия 12), использовали метод главных компонент и кластерный анализ.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
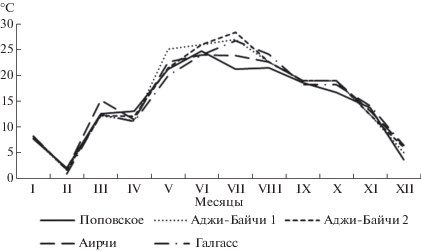
Максимальная температура воздуха в районе расположения озер была отмечена в июне-июле и достигала +27–28°С (рис. 2). При отборе проб в водоемах температура воздуха соответствовала среднемесячным значениям.
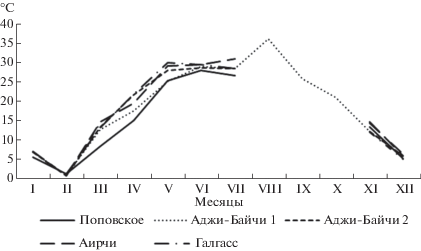
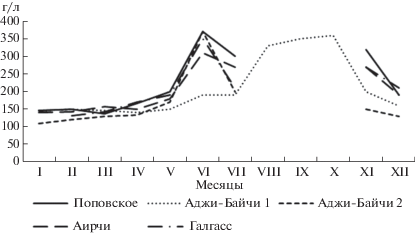
С повышением температуры воздуха происходило увеличение температуры рапы во всех тестируемых озерах (рис. 3). Когда температура воды приближалась к +30°С и выше происходил значительный рост солености, соль концентрировалась по берегам водоемов, которые затем высыхали, за исключением самого большого озера Аирчи, площадь которого уменьшилась на 2/3 (рис. 4).
Однако, в течение 2017 г. на фоне общих закономерностей изменение солености рапы в разных озерах имело определенные особенности. В озере Поповском соленость варьировала в пределах 137‰ в зимний и ранневесенний период, достигала максимальных значений 370‰ в июне, затем снижалась до 300‰, после чего озеро полностью высохло и оставалось таковым вплоть до ноября, когда выпадение атмосферных осадков привело к заполнению водоема. При этом соленость рапы последовательно уменьшалась с 300 до 137‰ в период ноябрь–март.
Сходная динамика отмечена для показателей солености в озерах Аджи-Байчи-2, Аирчи и Галгасс. Так, соленость рапы в озере Аджи-Байчи-2 последовательно увеличивалась от 110–130‰ в зимне-весенний сезон до 370‰ в июне, несколько падала в июле до 200‰, затем вплоть до ноября озеро оставалось сухим. После выпадения осадков соленость в нем составила 130–150‰. В озере Аирчи в период январь-май соленость колебалась в пределах 140–190‰, в июне возрастала до 360‰, снижалась в июле до 270‰, затем озеро пересыхало и оставалось сухим до ноября, когда в результате выпадения осадков последовательно снижалась до конца года от 270 до 190‰. Для озера Галгасс характерно изменение солености от 131‰ в январе до 350‰ в июне, затем некоторое снижение до 270‰ в июле. В период с августа по октябрь озеро высохло. В ноябре с началом сезона дождей водоем вновь наполнился водой, но соленость при этом была относительно высокой 210–270‰.
Иная динамика колебания солености рапы установлена в озере Аджи-Байчи-1. В период январь–май этот показатель варьировал в пределах 140–160‰, в июне-июле наблюдали подъем до 190‰, а в августе-октябре, когда озеро сильно обмелело и от его площади осталась всего треть, соленость резко возросла до 300–360‰. В ноябре с выпадением атмосферных осадков соленость рапы постепенно снизилась до 200–160‰.
Содержание кислорода также существенно колебалось в исследуемых озерах (рис. 5).
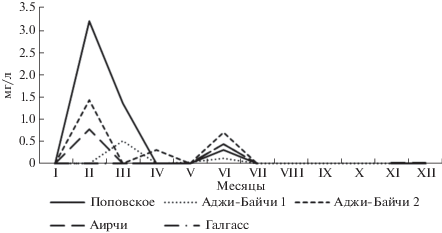
Самые низкие значения содержания кислорода в рапе озер отмечены с мая по июль, а самые высокие – в декабре и марте. Установлены особенности колебания этого показателя для каждого водоема. Содержание кислорода в рапе Поповского озера возрастало от 7.4 мг л–1 в январе до 11.0 мг л–1 в марте, после чего снижалось, достигая минимальных значений в июле (3.1 мг л–1), в ноябре-декабре по мере заполнения водоема в результате выпадения атмосферных осадков уровень кислорода повышался. Сходная динамика обнаружена для оз. Аджи-Байчи-2, в рапе которого концентрация кислорода возрастала с января по март от 3.8 до 12.9 мг л–1, после чего резко снижалась до 2.4 мг л–1 и вновь увеличивалась в ноябре–декабре до 11.3–13.4 мг л–1. В озере Галгасс максимальная концентрация кислорода (15.5 мг л–1) зафиксирована в марте, затем этот показатель уменьшался до 2.7 мг л–1 в мае и незначительно возрастал в июне–июле (5.2–5.4 мг л–1). После заполнения водоема водой в ноябре–декабре содержание кислорода установилось на уровне 7.3–8.7 мг л–1. В рапе озера Аирчи содержание кислорода поднималось от 2.7 до 13.7 мг л–1 в апреле, затем снижалось до 1.47 мг л–1 в июле, а в ноябре–декабре этот показатель возрастал до 11.4–17.4 мг л–1 соответственно.
Иная сезонная динамика содержания кислорода характерна для рапы озера Аджи-Байчи-1. Этот показатель варьировал в меньшей степени, чем в остальных исследуемых озерах: с июня по август он колебался в пределах 4.9–7.73 мг л–1, в остальные месяцы года в пределах 10.1–12.8 мг л–1.
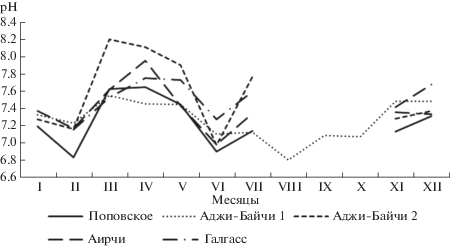
Сезонное изменение рН в целом также имело сходство в рапе исследуемых озер (рис. 6)
Общей тенденцией изменения рН рапы во озерах Поповское, Аджи-Байчи-2, Аирчи и Галгасс явилось увеличение этого показателя в период март-апрель, при этом самые высокие значения были установлены в рапе озера Аджи-Байчи-2 (8.2). В июне величина рН снижалась до 6.9–7.3, в июле происходил незначительный подъем этого показателя до 7.1–7.8, затем озера высыхали. В период ноябрь–декабрь при восстановлении экосистем pH рапы составляла 7.1–7.6. В озере Аджи-Байчи-1 выявлена иная картина динамики изменения рН. В этом случае значения колебались в пределах 6.8 в августе затем последовательно повышались до 7.5 в декабре и оставались на уровне 7.2–7.5 в период январь–июль.
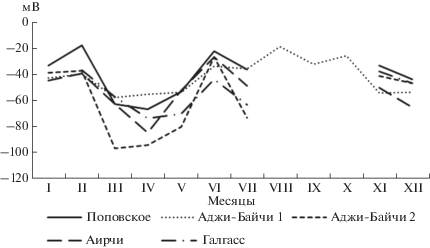
Общие закономерности обнаружены также для колебания окислительно-восстановительного потенциала рапы исследуемых водоемов за исключением озера Аджи-Байчи-1 (рис. 7). Самые низкие показатели Eh отмечены в период март-апрель, причем минимальные величины установлены в рапе озера Аджи-Байчи-2 (–96.7 мВ). К июню Eh возрастал до –27.2…–44.3 мВ и вновь снижался в июле, после чего озера высохли. В ноябре после восстановления экосистем значения Eh были отмечены в пределах – 44.7…–37.8 мВ, которые оставались таковыми в зимние месяцы. Сезонные колебания Eh в рапе озера Аджи-Байчи-1 были мнее выражены, характеризовались некоторым снижением в период март–май до –57.8… ‒53.4 мВ, затем возрастали в летние месяцы, достигая максимума в августе (–19.3 мВ), после чего вновь снижались до –54.2 мВ.
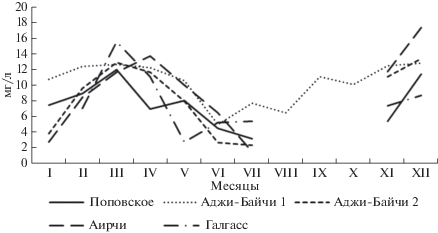
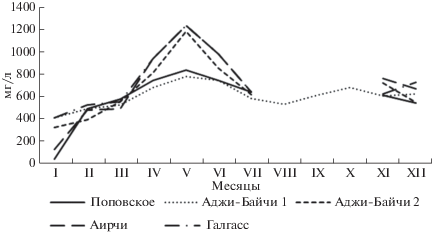
Содержание нитратов в рапе четырех пересыхающих озер Поповское, Аджи-Байчи-2, Аирчи и Галгасс имело одинаковую динамику: минимальные значения были установлены в январе (39.2–410.0 мг л–1), причем самые низкие показатели отмечены в озере Поповском (рис. 8).
Весной содержание нитратов последовательно увеличивалось, достигая максимума в мае, этот показатель в рапе озер Аджи-Байчи -2, Галгасс и Аирчи был значительно выше (1240 мг л–1), чем в Поповском озере и в озере Аджи-Байчи-1 (840 мг л–1). В июле содержание нитратов снижалось, в озере Аджи-Байчи-1 осталось на уровне 640–680 мг л–1до конца года, в январе этот показатель упал до 410 мг л–1. Остальные четыре озера с июля по ноябрь оставались пересохшими, и только в ноябре–декабре уровень нитратов был в пределах 600–700 мг л–1.
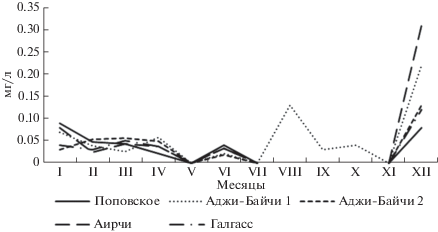
Нитриты в рапе исследуемых озер обнаружены в небольшом количестве (0.04–0.08 мг л–1) в зимне-весенний период, а также в июне (рис. 9). В озере Аджи-Байчи-1 0.13 мг л–1 нитритов было установлено в августе, затем содержание снижалось до 0.03–0.04 мг л–1 осенью, и в ноябре их не обнаружили. Однако в декабре концентрация этих компонентов резко возросла во всех исследуемых водоемах до 0.08–0.31 мг л–1 с максимум в озере Аирчи.
Динамика содержания фосфатов в рапе тестируемых озер имела как общие черты, так и различия (рис. 10). Наибольшая концентрация фосфатов установлена в рапе Поповского озера в феврале (3.18 мг л–1), в этот же месяц в озерах Аджи-Байчи-2 и Аирчи концентрация этих соединений составила 1.42 и 0.77 мг л–1 соответственно, тогда как в озерах Аджи-Байчи-1 и Галгасс они не обнаружены. В весенний сезон уровень фосфатов варьировал незначительно в пределах от 0 до 0.3 мг л–1, отмечено некоторое увеличение содержания этих соединений в рапе в июне. В летние месяцы и осенью концентрация фосфатов во всех исследуемых водоемах не превышала 0.01–0.02 мг л–1.
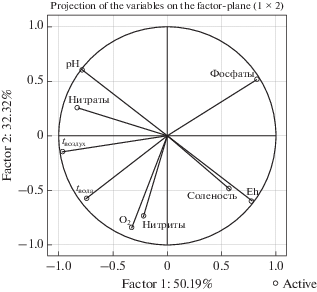
Метод главных компонент (РСА анализ) был использован для анализа полученных результатов с целью определения различий тестируемых гидрохимических показателей в пяти озерах (рис. 11), а также определения корреляций между ними.
На основании последующего факторного анализа можно заключить, что по сезонным изменениям исследуемых гидрохимических показателей сходство между озерами можно определить в виде последовательности Аджи-Байчи-2 → Галгасс → → Аирчи → Аджи-Байчи-1 → Поповское (рис. 12).
Рис. 12.
Диаграмма, иллюстрирующая совокупность средних значений тестируемых гидрохимических показателей в пяти исследуемых озерах.
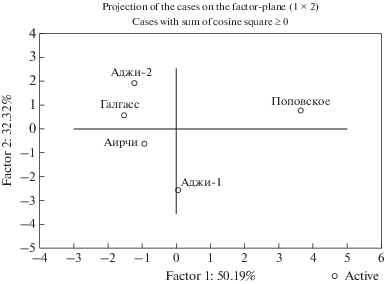
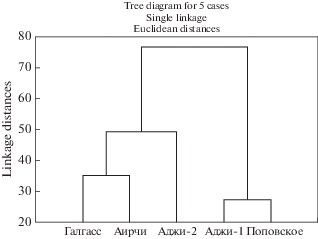
Последующий кластерный анализ подтвердил выявленные закономерности (рис. 13). Как можно видеть, исследуемые озера объединены в две группы Аджи-Байчи-1 + Поповское и Галгасс + Аирчи + Аджи-Байчи-2. Следует отметить, что данные группы совпадают и по географическому расположению (рис. 1), что обусловливает сходство и гидрохимических процессов, протекающих в них.
Таким образом, результаты исследований позволили установить определенную сезонную динамику гидрохимических показателей и содержания биогенов в четырех крымских соленых озерах, отметить как общие тенденции, так и специфические особенности, присущие каждому озеру, в том числе в критических ситуациях, обусловленных высыханием водоемов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Водные экосистемы, включая соленые озера, благодаря сбалансированности физико-химического состава и биоты, являются важнейшими участниками биогеохимических циклов, поскольку галофитные бактерии, микроводоросли и беспозвоночные-фильтраторы минерализуют органические вещества, поступающие в водоемы с осадками и паводковыми водами (Lazar et al., 2017). При этом биогеохимические циклы взаимодействуют между собой по многим путям, наиболее важные из которых включают окислительно-восстановительный и кислотно-щелочной баланс экосистемы, показатели которых определяют экологическое состояние водных объектов (Robert, Emerson, 2000). Однако, интенсивная хозяйственная деятельность человека приводит к изменению биогеохимических циклов в гидросфере в связи с выбросом избыточных количеств азот- и фосфорсодержащих соединений, следствием чего является нарушение циркуляции и трансформации этих элементов в природных водоемах (Моисеенко, 2017; Selemani et al., 2017). Изменение содержания азота в водных объектах влияет на физико-химические свойства воды, донных осадков, структуру сообществ организмов (Wang et al., 2016). Многие бактерии азотфиксаторы существуют только в анаэробных условиях, в то время как растворенный органический азот, частицы органического и неорганического азота будут превращаться в неорганические соединения, накапливаться в воде и нарушать сбалансированное содержание других минералов, которые ассимилируются фитопланктоном и азотфиксирующими бактериями (Santanu et al., 2015; Pepenel et al., 2020).
Нарушение баланса трансформации биогенных элементов в водных экосистемах стимулирует эвтрофирование, что ухудшает качество среды обитания как для гидробионтов, так и для водных ресурсов, используемых человеком (Liu et al., 2018; Huang et al., 2017; Bamba et al., 2017). Органические соединения азота – важнейшие активные компоненты лечебных илов, формирующихся в соленых озерах, в связи с чем нарушение циркуляции и трансформации биогенов может существенно изменить процессы в водных экосистемах, ухудшить качество их ресурсов вплоть до их непригодности для использования человеком и быть опасными для его здоровья. В то же время именно биогены в наибольших количествах поступают в водные экосистемы и наносят им существенный вред. Помимо этого, в условиях изменения климата и в ряде случаев пересыхания водных объектов концентрирование биогенных элементов также может оказать крайне негативные эффекты на экосистему и привести к ее необратимым изменениям, вплоть до деградации.
В настоящее время водно-солевой режим во многих гиперсоленых озерах характеризуется неуклонным ростом общей минерализации рапы и осаждением соли по берегам и на дне водоемов. Водный баланс внутренних водоемов обеспечивается за счет впадающих и вытекающих рек, грунтовых вод и осадков. Соленые озера – бессточные водоемы, в которых складывались специфические экологические условия, происходило накопление донных осадков, формирование флоры и фауны, уникальных микробных сообществ. Баланс этих экосистем в основном обеспечивается грунтовыми водами, фильтрацией морских вод, осадками и испарением. В последние 50–60 лет в мире отмечена тенденция снижения поступления вод, питающих соленые озера, в ряде случаев в результате антропогенной активности и одновременном усилении испарения вследствие климатических изменений. Эти процессы приводят к нарушению водно-солевого баланса в озерах, их пересыханию и исчезновению. Именно такая участь постигла озеро Овенс (Калифорния, США), Урмию (Иран), Аральское море и Великое Соленое озеро в Юте (США) (Wurtsbaugh et al., 2017). Такие же тенденции обнаруживаются и при исследовании крымских соленых озер Евпаторийской группы, поскольку морские пересыпи, отделяющие их от моря, в настоящее время за счет длительного антропогенного влияния не обеспечивают природного процесса фильтрации морской воды в необходимых объемах в акватории этих озер. Построенные и строящиеся на берегу Каламитского залива многочисленные санаторно-курортные комплексы и дороги ограничивают естественный приток морской воды в соленые озера. При этом наиболее критические изменения происходят в летний период, когда эти водоемы испытывают воздействие экстремально высоких температур при одновременной повышенной антропогенной нагрузке вследствие интенсивной рекреационной активности в этом районе.
Результаты исследований позволили установить выраженную сезонную динамику изменения физико-химических показателей и содержания биогенов в воде исследуемых водоемов, причиной которой являются как природные факторы, так и антропогенные, что отмечено также другими исследователями для соленых озер, расположенных в разных районах планеты (Di Meglio et al., 2016; Golan et al., 2016). Сезонная динамика обусловлена как климатическими флуктуациями, включая направление и силу ветра, способствующих перемешиванию вод и изменению их стратификации (Hetzel et al., 2015), так и физико-химическими процессами, минеральным составом, ионным обменом, особенностями растворения и выпадения элементов из солевых растворов, активностью микроорганизмов (галобактерий) (Cherekar, Pathak, 2016). Обнаружены общие закономерности динамики изменения физико-химических показателей рапы во всех тестируемых озерах. С увеличением температуры воздуха в летний период происходил рост температуры рапы и вследствие интенсивного испарения повышение солености до критических значений 300–350‰. В этот период отмечено осаждение соли по берегам и на дне озер, затем все озера высохли кроме самого большого водоема – озера Аджи-Байчи-1, которое обмелело на 2/3 и соленость рапы в котором составляла в этот период 300–350‰. В ноябре при наступлении сезона дождей пересохшие озера и озеро Аджи-Байчи-1 наполнились водой, соленость которой постепенно падала до 100–150‰ в зимний сезон. Содержание кислорода и рН в водоемах возрастали в весенний период, но показатели снижались летом. После восстановления водного режима экосистем содержание кислорода в них и значения рН возрастали к концу года, но уменьшались в январе-феврале, тогда как величины Eh характеризовались противоположной динамикой. В целом изменение физико-химических показателей рапы всех исследуемых водоемов имели сходство между собой, а также с теми закономерностями, которые были установлены нами ранее для четырех непересыхающих соленых озер, относящихся к Евпаторийской группе и расположенных в этом районе (Руднева и др., 2020). Сходные явления наблюдали и в других гиперсоленых озерах, расположенных в прибрежных зонах морей и океанов (Geldenhuys et al., 2016; Mitchell et al., 2017).
Ранее на фоне сезонных изменений физико-химических показателей рапы гипергалинных озер Евпаторийской группы нами были выявлены закономерности биогенной миграции нитратов, нитритов и фосфатов, которые имели как естественные причины, так и были обусловлены антропогенной деятельностью (Руднева и др., 2020).
Во всех исследуемых озерах в теплый период установлено увеличение содержания нитратов в воде, что согласуется с ранее полученными нами данными при исследовании непересыхающих гипергалинных водоемов, расположенных в этом районе.
Повышение содержания нитратов в воде исследуемых озер в теплый период происходит за счет прямой и непрямой регенерации органического вещества, а также за счет поливных вод с сельхозугодий, коммунальных стоков, попадающих в грунтовые воды и интенсивной рекреации в этом районе (Иванютин и др., 2016; Иванютин, Подовалова, 2018). Известно, что наибольший вклад в загрязнение подземных вод на полуострове вносят азотные соединения вследствие инфильтрации неочищенных и недостаточно очищенных стоков, отсутствия или устаревших канализационных коммуникаций, износ которых составляет 75%, что особенно критично для сельской местности, а также свалки бытового мусора и ТБО (Иванютин, 2016). Помимо этого, значительный вклад в загрязнение природных вод в Крыму вносят жидкие стоки промышленных производств, сельскохозяйственные сточные воды, содержащие остатки пестицидов, минеральных и органических удобрений. Как было показано выше (см. раздел “Материалы и методы”), поскольку питание всех исследуемых озер осуществляется за счет незначительных атмосферных осадков и в основном за счет подземных вод, то они подвержены действию поллютантов, содержащихся в стоках, что было отмечено и другими исследователями (Ravurmaci, Ustun, 2016; Amiri et al., 2016).
Ранее нами было показано (Руднева и др., 2020), что в соленых озерах в процессах трансформации биогенов самое активное участие принимает фито- и бактериопланктон, поскольку азот и фосфор необходимы для обеспечения их жизнедеятельности (Selemani et al., 2017). Однако, при избыточных концентрациях и повышении температуры возникает эвтрофирование, сопровождающееся появлением гипо- и аноксических зон, что приводит к гибели обитателей водоема и еще большего насыщения его биогенами в результате их разложения. В этих условиях при высокой концентрации бактериальной составляющей происходит интенсивное превращение нитратов в нитриты, из которых могут образовываться токсичные нитрозамины, проявляющие канцерогенную и тератогенную активность (Моисеенко, Руднева, 2008).
Сезонные колебания содержания фосфатов в воде исследуемых объектов отличалась от закономерностей, установленных для азотсодержащих компонентов. Высокая концентрация фосфатов была обнаружена в зимне-весенний период, что, вероятно, связано с поступлением паводковых вод и продуктов жизнедеятельности птиц, обитающих в этот период на озерах. Кроме того, в результате штормов, характерных для этого сезона и перелива морской воды, содержащей фосфаты, они попадают в прибрежные озера. В дальнейшем содержание фосфатов в воде снижалось, или они обнаруживалось в следовых количествах.
Учитывая рассмотренные выше закономерности миграции биогенных элементов в соленых озерах Крыма, особо следует отметить тот критический период, который связан с пересыханием этих водоемов в летне-осенний период. При установлении высокой температуры воздуха и нагревании рапы, при отсутствии атмосферных осадков, нарушении фильтрации морских вод и поступления грунтовых вод озера пересыхают (Поповское, Аирчи, Аджи-Байчи-2 и Галгасс), на поверхности дна выступает соль, или их объем существенно уменьшается (Аджи-Байчи-1), дно покрывается солевым пластом. Совершенно очевидно, что в этих экстремальных условиях биотическая составляющая не функционирует, так как артемия образует цисты, бактерии и микроводоросли – споры. Таким образом, происходит полное “выключение” или блокирование естественного цикла биогенной миграции азота и фосфора в этот экстремальный период. Тем не менее мы можем отметить и другие пути трансформации биогенов в высохших соленых озерах и на прилегающих территориях. Первый возможный путь связан с тем, что в летне-осенний период в этом районе господствуют сильные ветры, которые разносят биогены, аккумулированные на дне высохших озер, на довольно большие расстояния. Одновременно с биогенами с перемещением воздушных масс разносятся соль и те загрязнители, которые осели на дне пересохших водоемов, что представляет непосредственную опасность для здоровья людей, так как вызывает у них аллергические и респираторные заболевания (Akhmedenov, 2020; Tussupova et al., 2020). Второй возможный путь трансформации биогенов на пересохших озерах обусловлен пищевой активностью водоплавающих птиц, которые в качестве корма используют высохшие цисты артемии и ее биомассу, сконцентрированную по берегам. Потребление этого корма в процессе жизнедеятельности птиц также включается в круговорот азота и фосфора. Таким образом, азотистые соединения естественного происхождения (мочевина, мочевая кислота), а также имеющие антропогенное происхождение (пестициды, гербициды, удобрения) также накапливаются и включаются в циклы биогенных элементов (Fisher et al., 2016).
В ходе исследований установлена четкая сезонная зависимость между изменением гидрохимических свойств воды, содержанием биогенов и интенсивностью развития гидробионтов. При достижении пороговых значений минерализации (350‰ и выше) и последующем пересыхании водоемов, биологическая активность экосистемы приближается к нулю, что полностью блокирует циклы миграции биогенов в них или переводит их на другие пути. Это определяет бальнеологические критерии лечебных илов, формирующие их терапевтическую ценность, в том числе содержание органо-минеральных соединений и биогенов.
ЗАКЛЮЧЕНИЕ
Поступление биогенов в соленые озера Крыма происходит за счет естественных источников, к которым следует отнести атмосферные осадки, продукты эрозии, перелив морской воды во время штормов, продукты жизнедеятельности водоплавающих птиц и животных, выпас которых осуществляется на прибрежных территориях, процессов в экосистемах (эвтрофирование, жизнедеятельность гидробионтов), а также азота и фосфора, содержащихся в стоках, попадающих как непосредственно в водные объекты, так и через грунтовые воды, рекреационной нагрузки на берегах озер.
Весной на водоемах обитает большое количество водоплавающих птиц, в том числе совершающих сезонные миграции и гнездящихся по берегам озер, что приводит к росту концентрации нитратов в воде. В конце весны и в начале лета в связи с прогревом воды и созданием оптимальных условий для развития фитопланктона рост концентрации нитратов обусловлен интенсивным развитием микроводорослей. Одновременно возрастает также антропогенная нагрузка по берегам озер и прилегающем морском побережье вследствие рекреации и в результате активизации сельскохозяйственных работ. Это приводит к поступлению большого количества биогенов в экосистемы соленых озер. При этом нельзя исключать вклад азот- и фосфорсодержащих компонентов, входящих в состав косметических средств и средств личной гигиены отдыхающих на прилегающих территориях туристов. При длительном воздействии критических температур воздуха (+30°С и выше) в конце июня–июле озера пересыхают, или объем их сокращается с образованием соляной корки на дне и по берегам. Жизнедеятельность биоты прекращается, биогенная миграция элементов блокируется, так как основные участники процесса не функционируют. В этом случае возможен дополнительный путь миграции биогенов, связанный с переносом аккумулированных на дне соединений ветром на достаточно большие территории. Этот путь представляет опасность для человека и животных, так как разнообразные азот- и фосфорсодержащие соединения могут быть токсичными и вызывать аллергические реакции и заболевания дыхательных путей. Одновременно можно отметить и еще один дополнительный путь миграции биогенов, связанный с питанием птиц и использованием в качестве корма высохшие цисты артемии и ее биомассу, концентрирующуюся по берегам и на дне пересохших водоемов. В октябре-ноябре с началом выпадения атмосферных осадков и восстановлением водоемов, происходящей в них сукцессией наблюдается увеличение содержания нитратов в воде, обусловленное растворением скопившихся на дне азотсодержащих соединений. При положительных оптимальных температурах рапы возможно начало вегетации фитопланктона и бактериопланктона, что можно наблюдать в озерах, в связи с чем повышается уровень нитритов, в образовании которых активно участвуют микроорганизмы. В зимний период концентрация нитратов в рапе снижается, так как поступление из основных источников сокращается: прекращается бурное развитие фито- и зоопланктона, сельскохозяйственная деятельность, отсутствует рекреационная нагрузка, что было отмечено нами ранее для крупных соленых озер Крыма (Руднева и др., 2020).
Миграция фосфорсодержащих соединений в пересыхающих озерах Крыма отличается от годовой динамики содержания азота. Фосфаты обнаружены только в зимне-весенний период, а после пересыхания эти компоненты не отмечены, что может свидетельствовать об образовании нерастворимых соединений и их аккумуляции в донных грунтах пересохших озер. С возобновлением функционирования экосистем после заполнения их водой, в связи с жизнедеятельностью птиц и переливом морской воды в результате штормов происходит насыщение рапы фосфатами, а также частичное растворение в ней аккумулированных на дне компонентов. В результате этого концентрация этих соединений возрастает в зимний период, но к весне падает.
Полное высыхание озер и засоление близлежащих территорий, повторяющееся из года в год, может привести к невозможности использовать эти районы для рекреации и других видов хозяйственного использования. В связи с этим возникает необходимость проведения тщательного мониторинга этих водных объектов и разработки мер для их восстановления после засушливого периода и сохранения их природных ресурсов. Анализ динамики изменения экологического состояния соленых озер, окружающей природной среды и уровня антропогенного влияния на них позволили, с одной стороны, выявить и объективно оценить критические ситуации, возникающие в жаркий период, а также те негативные явления, связанные с этим, а с другой − выработать ряд предложений и рекомендаций по сохранению и оптимальному использованию их ресурсов.
Работа выполнена по теме государственного задания ФГБУН ИМБИ “Функциональные, метаболические и токсикологические аспекты существования гидробионтов и их популяций в биотопах с различным физико-химическим режимом”, номер гос. Регистрации АААА-А18-118021490093-4.
Список литературы
Васенко В.И. (2012) Результаты рекогносцировочного обследования озера Мойнаки. Отчет СГГРЭС, Саки, 2012 г. 49 с.
Гулов О.А. (2006) Комплексное рекогносцировочное обследование крупнейших месторождений лечебных грязей Крыма. Отчет о геоэкологических работах. Саки: ГГРЭС, 190 с.
Гулов О.А. (2007) Экоцид крымских соляных озер. Теория и практика восстановления внутренних водоемов. С.-Пб: Лема, 60-78.
Ежов В.В., Тарасенко Д.Н. 2002. Секреты крымского здоровья, Симферополь: Бизнес-Информ. 256 с.
Иванютин Н.М. (2016) Влияние антропогенной деятельности на подземные воды Крыма. Пути повышения орошаемого земледелия. 3(59), 25-31.
Иванютин Н.М., Подовалова С.В. (2018) Загрязнение водных объектов Крыма сточными водами. Экология и строительство. 1, 4-8.
Массовая концентрация нитратов в водах. Методика выполнения измерений потенциометрическим методом с ионоселективным электродом. РД 52.24.367-2010.
Массовая концентрация фосфатов и полифосфатов в водах. Методика выполнения измерений фотометрическим методом. РД 52.24.382-2006.
Методика измерений массовой концентрации нитрит-ионов в питьевых, поверхностных и сточных водах фотометрическим методом с реактивом Грисса. ПНДФ 14.1:2: 4.3-95. 1995.
Моисеенко Т.И. (2017) Эволюция биогеохимических циклов в современных условиях антрпогенных нагрузок: пределы воздействий. Геохимия. (10), 1-22.
Moiseenko T.I. (2017) Evolution of Biogeochemical Cycles under Anthropogenic Loads: Limits Impacts. Geochem. Int. 55(10), 841-860.
Моисеенко Т.И., Гашкина Н.А. (2010). Формирование химического состава вод озер в условиях изменения окружающей среды. М.: Наука. 268 с.
Моисеенко Т.И., Руднева И.И. (2008) Глобальное загрязнение и функции азота в гидросфере. ДАН. 420(3), 676-680.
Понизовский А.М. (1965) Соляные ресурсы Крыма. Симферополь: Крым, 163 с.
Руднева И.И., Залевская И.Н., Шайда В.Г., Меметлаева Г.Н., Щерба А.В. (2020) Биогенная миграция азота и фосфора в соленых озерах Крыма: сезонные аспекты. Геохимия. 65(10), 984–997.
Rudneva I.I., Zalevskaya I.N., Shaida V.G., Memetlaeva G.N., Scherba A.V. (2020) Biogenic Migration of Nitrogen and Phosphorus in Crimean Hypersaline Lakes: A Seasonal Aspect. Geochem. Int. 58(10), 1123-1134.
Тарасенко В.С. (2014) Экология Крыма. Угрозы устойчивому развитию. План действий. Симферополь: Ариал, 176 с.
Хохлов В.А., Васенко В.И., Чабан В.В. и др. (2019). Геоэкологическое изучение, режим, эксплуатация и горно-санитарная охрана месторождений гидроминеральных ресурсов Республики Крым в зоне действия ГУ НПП РК “Крымская ГГРЭС”. Отчет о научно-практической работе за 2018 г. Саки: ГУ НПП РК “Крымская ГГРЭС”. 251 с.
Akhmedenov K.M. (2020) Tourist and recreational potential of the salt lakes of Western Kazakhstan. GeoJ. Tourism and Geosites. 30(2), 782-787.
Amiri V., Nakhaei M., Lak R., Kholghi M. (2016) Investigating the salinization and freshening processes of the coastal groundwater resources in Urmia aquifer, NW Iran. Environ. Monitor. Assess. 188(4), Article N 233.
Bamba D., Coulibaly M., Robert D. (2017) Nitrogen-containing organic compounds: origins, toxicity and conditions of their photocatalytic mineralization over TiO2, Sci. Total Environ. 580, 1489-1504.
Chapra S.C., Dove A, Warren GT.J. (2012) Long-Term trends of Great Lakes Major ion chemistry. J. Great Lakes Research. 38, 550-560.
Cherekarm N., Pathak A.P. (2016) Chemical assessment of Sambhur Soda Lake, a Ramasar site in India. J. Water Chem. Technol. 38(4), 244-247.
Di Meglio, L.Santos, F.Gomariz, M., Almansa, C., López, C., Antón, J., Nercessian, D. (2016) Seasonal dynamics of extremely halophilic microbial communities in three Argentinian salterns. FERMS Microbiol. Ecol. 92(12), Article fiw184.
Fisher KA, Meisinger JJ, James BR. (2016) Urea hydrolysis rate in soil toposequences as influenced by pH, carbon, nitrogen, and soluble metals. J Environ Qual. 45(1), 349-359.
Geldenhuys Ch., Cotiyane Ph., Rajkaran A. (2016) Understanding the creek dynamics and environmental characteristics that determine the distribution of mangrove and saltmarsh communities at Nahoon Estuary. South African J. Botany. 107, 137-147.
Glibert PM, Mayorga E, Seitzinger S. (2008) Prorocentrum minimum tracks anthropogenic nitrogen and phosphorus inputs on a global basis: Application of spatially explicit nutrient export models. Harmful Algae. 8(1), 33-38.
Golan R., Gavrieli I., Ganor J., Lazarc B. (2016) Controls on the pH of hyper-saline lakes – A lesson from the Dead Sea. Earth Planet. Sci. Lett. 434, 289-297.
Guo L, Zhang JZ, Guéguen C. (2004) Speciation and fluxes of nutrients (N, P, Si) from the upper Yukon River. Global Biogeochem Cycles. 18, 1-12.
Hetzel Y., Pattiaratchi C., Lowe R., Hofmeister R. (2015) Wind and tidal mixing controls on stratification and dense water outflows in a large hypersaline bay. J. Geophys. Res. Oceans. 120(9), 6034-60556.
Huang J., Xu C.-C., Ridoutt B.G., Wang X.-C., Ren P.-A. (2017) Nitrogen and phosphorus losses and eutrophication potential associated with fertilizer application to cropland in China. J. Cleaner Prod. 159, 171-179.
Jellison R., Williams W.D., Timms B., Aladin N.V. (2008) Salt lakes: Values, threats, and future. Aquatic Ecosystems: Trends and global prospects. Cambridge University Press: Cambridge, UK. 94-110.
Lazar V., Iordache (FCurutiu) C., Ditu L.M. Holban A., Gheorghe I., Marinescu F., Ilie M., Ivanov A., Dobre D., Chifiriuc M. (2017) Physico-chemical and microbiological assessment of organic pollution in Play Salty lakes from protected regions. J. Environ. Protect. 8, 1474-1489.
Liu H., Chen Z., Guan Y., Xu S. (2018) Role and application of iron in water treatment for nitrogen removal: a review. Chemosphere. 204, 51-62.
Mantyka-Pringle C.S., Martin T.G., Moffatte D.B., et al. 2016) Prioritizing management actions for the conservation of freshwater biodiversity under changing climate and land-cover. Biol. Conserv. 197, 80-89.
Mitchell S., Boateng I., Couceiro F. (2017) Influence of flushing and other characteristics of coastal lagoons using data from Ghana. Ocean Coast. Manag. 143(1), 26-37.
Pepenel I., Cracium N., Jujea V., Florea A., Pop C.E., Stoian G. (2020) Biochemical parameters of salt lakes sapropelic sludge from Buzau Country protected area, with different degrees of microbiological attrition. Sci. Annals Danube Delta Ins. 25. 101-111.
Ravurmaci M., Ustun A. K. (2016) Assessment of groundwater quality using DEA and AHP: a case study in the Serefkikochisar region in Turkey. Environ. Monitor. Assess. 188(4). Article N 25.
Robert J. Ch., Emerson S. (2000) The acid-bas and oxidation-reduction balances of the Earth. Int. Geophys. 72. 421-436.
Santanu R., Mukherjee J,m Mandai S. (2015) Modelling nitrogen and carbon cycles in Hooghy estuary along with adjacent mangrove ecosystem. Develop. Environ. Model. 27, 289-320.
Selemani J.R., Zhang J., Muzuka A.N.N., Njau K.N., Zhang G., Mzuza M.K., Maggid A. (2018): Nutrients’ distribution and their impact on Pangani River Basin’s ecosystem – Tanzania, Environ. Technol. 39(6), 1-15.
Shadkam S, Ludwig F, van Vliet T.H, Pastor A, Kabat P. (2016) Preserving the world second largest hypersaline lake under future irrigation and climate change. Sci. Total Environ. 559, 317-325.
Tusupova K., Peder Hjorth A., Morave M. (2020) Drying lakes: a review on the apllied restoration strategies and health conditions in contiguous areas. Water. 12(749), 1-21.
Wang Z., Zheng J., Tang J., Wang X., Z. Wu Z. (2016) A pilot-scale forward osmosis membrane system for concentrating low-strength municipal wastewater: performance and implications. Sci. Rep.-UK. 6, Article № 21653.
Wooldridge T.H., Adams J.B., Fernandes M. (2016) Biotic responses to extreme hypersalinity in an arid zone estuary. South Africa J. Botany. 107, 160-169.
Wurtsbaugh W.A., Miller C., Null S.E., DeRose R.J., Wilcock P., Hahnenberger M., Howe F., Moore J. (2017) Decline of the world saline lakes. Nat. Geosci. 10. 816-821.
Дополнительные материалы отсутствуют.