Геология рудных месторождений, 2020, T. 62, № 5, стр. 414-425
Исследование поведения урана, ниобия и тантала в системе гранитный расплав–хлоридный флюид при 750°C, 1000 бар
А. Ф. Редькин a, *, В. И. Величкин b, **
a Институт экспериментальной минералогии им. акад. Д.С. Коржинского РАН
142432 Московская область, Черноголовка, ул. Акад. Осипьяна, 4, Россия
b Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН
119017 Москва, Старомонетный пер., 35, Россия
* E-mail: redkin@iem.ac.ru
** E-mail: vel@igem.ru
Поступила в редакцию 08.10.2019
После доработки 24.04.2020
Принята к публикации 27.04.2020
Аннотация
Основной целью наших исследований был поиск физико-химических условий для мобилизации урана, ниобия и тантала в раствор из кислых расплавов, близких по составу к риолитовым включениям в кварце уникального Mo–U Стрельцовского рудного поля (Восточное Забайкалье). Эксперименты выполнены с модельным гомогенным стеклом лейкогранитного состава (мас. %): 72.18 SiO2, 12.19 Al2O3, 1.02 FeO, 0.2 MgO, 0.33 CaO, 4.78 Na2O, 3.82 K2O, 1.44 Li2O, 2.4 F (LiF, NaF, KF, CaF2, MgF2), синтетической двуокисью урана и природным колумбитом в растворах, содержащих от 1 до 8 моль/кг H2O хлоридов (Na, K, Li) при 750°C, 1000 бар и фугитивности O2 (10–14.98 бар), заданной Ni–NiO буфером. Выбранные ТР-условия и растворы соответствовали гомогенной области и флюидной несмесимости в растворах NaCl–KCl–H2O. Было установлено, что содержание Nb и Ta в Cl–F-растворах, равновесных со F-содержащими расплавами, очень низкое. Содержание U значительно выше и составляет примерно 1 × 10–4 мас. % во флюидной фазе, имеющей низкую плотность, и n·10-3 мас. % в плотной водно-солевой фазе. Содержание урана в стекле составляло десятые доли процента. Несмотря на очень высокие содержания хлора в исследуемых растворах, его содержание в стеклах не превышало 0.5 мас. %. Колумбит в ходе опытов инконгруэнтно растворялся в расплаве стекла с образованием F- и U-содержащих пирохлоров. Проведенные исследования показали, что преимущественно хлоридный флюид при изученных ТР-параметрах не может рассматриваться в качестве активной среды для мобилизации урана из расплавов Li–F-гранитов при формировании уникальных гидротермальных урановых (молибден-урановых) месторождений.
ВВЕДЕНИЕ
Настоящие исследования являются продолжением работ по проблеме источника рудного вещества для уникальных Mo–U-месторождений (Антей, Аргунское, Красный Камень и др.) Стрельцовского рудного поля, расположенного в Восточном Забайкалье. Особый интерес представляет сравнительное поведение урана, ниобия и тантала в гидротермально-магматических системах, поскольку состав рудовмещающих риолитов Mo–U-месторождений (Chabiron et al., 2001) близок к составу Li–F-гранитов танталового месторождения Орловского массива (Баданина и др., 2010), эволюция магматического очага охватывала сравнительно близкий возрастной период (143–127 млн лет); расположены они в 250 км друг от друга по обе стороны стагнированного слэба Монголо-Охотского орогенного пояса (Хомич, Борискина, 2017). Возраст урановых руд на месторождениях Антей и Стрельцовское составляет 135 ± 1 млн лет. Многие исследователи (Г.Л. Падалка (ВСЕГЕИ), Ф.И. Вольфсон (ИГЕМ РАН) и др.) предполагают генетическую связь уранового и редкометального оруденения с магматизмом, т.е. с расплавами, с исходными высокими температурами, давлениями, а также с рудоносными растворами. Высокие содержания хлора (до 25 мас. % NaCl-экв.) во включениях в кварце, обнаруженные на указанных Mo–U-месторождениях (Алешин и др., 2007), свидетельствуют о том, что хлоридные растворы могли играть важную роль в мобилизации урана.
Роль хлора в мобилизации урана, ниобия и тантала высокотемпературными гидротермальными растворами рассматривалась ранее в ряде работ (Calas, 1979, Жариков и др., 1987; Юдинцев, 1986, 1990; Keppler, Wyllie, 1990, 1991; Peiffert et al., 1996; Чевычелов, 1999; Чевычелов и др., 2007). Было показано, что увеличение концентрации хлора в гомогенном растворе сопровождалось ростом содержания хлора в расплаве. Особый случай представляют двухфазовые водно-солевые флюиды. В области несмесимости флюидов изменение валовой концентрации соли приводит к изменению весовой доли одной из флюидных фаз, тогда как химический потенциал хлора (точнее Cl2O–1) остается практически постоянным, как и содержание хлора в расплаве. Принимая во внимание, что главными солевыми компонентами флюида, равновесного с модельным расплавом, являются NaCl, KCl и LiCl, очевидно, что водно-солевой флюид будет вести себя как система первого типа. Присутствие в растворах незначительных концентраций фторидов, которые будут вымываться из лейкогранитного расплава в процессе опытов, не может оказать существенного влияния на фазовые соотношения флюидных фаз. Настоящие исследования направлены на изучение роли высокотемпературных хлоридных флюидов области несмесимости в мобилизации урана из кислых расплавов гранитоидного состава.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты по растворимости U, Nb и Ta в модельном расплаве и хлоридном растворе проводили при температуре 750°С (±5°С) и давлении 1000 (±50) бар в гидротермальных сосудах (УВД-6М). Парциальное давление кислорода (водорода) в системе задавалось металл-оксидными смесями Ni-NiO (NNO) с водой. Материал реактора (сталь марки ЭП-455) также способствовал заданию окислительно-восстановительных условий, близких NNO буферу. В гидротермальный реактор с внутренним диаметром 6–8 мм помещалась только одна Pt ампула и небольшой полуоткрытый контейнер с NNO буфером. В опытах было использовано стекло, полученное плавлением в Pt ампулах при 1300оС тщательно перетертой смеси (мас. %) альбита – 35.66, микроклина – 28.39, SiO2 – 30.34, MgF2 – 0.077, NaF – 0.38, CaF2 – 0.28, LiF – 2.5, Fe2O3 – 1.02. Силикатно-фторидная составляющая в составе стекла выбрана в соответствии с данными анализа расплавных включений в кварце риолитовой магмы, которые, согласно (Chabiron et al., 2001, 2003), могли служить прототипом магматогенного источника урана на Стрельцовском рудном поле (месторождениях Стрельцовское, Тулукуевское и Красный камень). Стекло, прозрачное и гомогенное по составу (на основании микрозондового анализа), перетирали и использовали в опытах. В опытах использовали хлоридные растворы с мольным отношением компонентов 0.576NaCl/0.146KCl/0.018KF/0.181LiCl/ 0.029AlCl3, приготовленные на основе 0.01mHCl. Это соотношение компонентов было установлено в предыдущих опытах (Редькин и др., 2009) при 750°С и 1000 бар в аналогичной системе. Растворы для опытов соответствовали 1, 3, 5 и 8 моль · · кг–1 H2O хлоридов. При снаряжении опытов, содержащих 5 и 8mCl, рассчитанное количество хлорида натрия непосредственно засыпалось в ампулу. В Pt ампулу диаметром 4–5 мм, с толщиной стенок 0.1 мм и длиной 40 мм, одновременно помещали 65 мг стекла, 5–6 мг колумбита (природного из месторождения Улуг Танзек, Восточные Саяны), 5–10 мг UO2, 130 мг раствора и при необходимости твердый NaCl. Закалка реакторов осуществлялась устройством воздушно-капельного охлаждения за 3–5 мин с 750 до 20°С.
Продукты опытов извлекались из Pt ампул и анализировались по методикам, детально описанным нами ранее (Редькин и др., 2009). С целью уменьшить степень разбавления раствора для ICP-анализа отбирали 5 мл раствора первого разбавления (из 8–12 мл), подкисляли 0.25 мл крепкой (20 мас. %), специально перегнанной, HNO3.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Кислородные буферы
Во всех опытах, проведенных на гидротермальной установке при 750°С в реакторах из никельсодержащего сплава, в буферных навесках сохранились оба компонента буфера. Это указывает на то, что окислительно-восстановительные условия опытов соответствовали выбранному NNO буферу.
Раствор
Условия проведения опытов и результаты анализа растворов после опытов при 750оС и давлении 1000 бар представлены в табл. 1. Эксперименты проводились преимущественно в двухфазовой области водно-солевого флюида, поэтому концентрации элементов характеризуют раствор, полученный при смешении V (низкоплотной) и L (плотной) флюидных фаз. Содержание элементов в каждой из сосуществующих фаз может существенно отличаться от концентрации, полученной в результате анализа закаленного раствора. Величины растворимости рудных компонентов, полученные таким методом, соответствуют кажущейся растворимости. Принимая во внимание тот факт, что растворимость хлора в расплаве незначительна, а ошибки при разбавлении раствора могут составлять 10–20%, все результаты химических анализов были нормированы на суммарную концентрацию хлора в исходном растворе с поправкой на растворимость хлора (0.5 мас. %) и воды (4 мас. %) в расплаве.
Таблица 1.
Результаты анализа растворов на катионы ICP-AES- и ICP-MS-методами, хлора и фтора – ион-селективными электродами после опытов при 750°С, 1000 бар, NNO буфере
| № опыта |
m Cl, исходная |
Длительность | lg mi, моль · кг–1 H2O | ||||||
|---|---|---|---|---|---|---|---|---|---|
| моль · кг–1 | сутки | Na | K | Li | Al | Ca | Fe | Mn | |
| 23U | 1.00 | 7 | –0.33 | –0.82 | –0.64 | –1.18 | –3.19 | –3.37 | –4.13 |
| 24U | 1.00 | 7 | –0.29 | –0.81 | –0.61 | –1.35 | –2.36 | –3.39 | –4.06 |
| 31U | 3.00 | 20 | 0.01 | –0.50 | –0.35 | –1.28 | –3.06 | –3.26 | –2.68 |
| 32U | 3.00 | 20 | 0.00 | –0.49 | –0.36 | –1.24 | –3.03 | –3.47 | –2.82 |
| 25U | 5.00 | 7 | 0.40 | –0.08 | –0.09 | –1.03 | –1.99 | –3.02 | –3.55 |
| 28U | 5.00 | 7 | 0.37 | –0.18 | –0.10 | –1.09 | –1.98 | –3.04 | –3.59 |
| 29U | 5.00 | 7 | 0.34 | –0.20 | –0.13 | –1.46 | –2.03 | –3.35 | –3.67 |
| 33U | 7.65* | 20 | 0.12 | –0.41 | –0.32 | –1.17 | –2.22 | –2.50 | –2.16 |
| 26U | 8.00 | 7 | 0.56 | 0.02 | –0.07 | –1.30 | –1.72 | –2.22 | –3.67 |
| 30U | 8.00 | 7 | 0.44 | –0.11 | –0.08 | –1.15 | –1.76 | –2.79 | –3.80 |
| № опыта | lg mi, моль · кг–1 H2O | ||||||||
| U | Nb | Ta | Rb | Cs | Mg | Si | Cl | F | |
| 23U | –5.33 | –6.05 | –7.36 | –3.80 | –5.36 | –3.52 | –1.54 | –0.1 | –0.87 |
| 24U | –4.96 | –5.76 | <–7 | –3.78 | –5.35 | –3.55 | –1.34 | –0.07 | –0.89 |
| 31U | –4.94 | –4.45 | <–7 | –3.67 | –5.92 | –3.36 | –1.53 | 0.58 | –0.92 |
| 32U | –4.97 | –4.70 | <–7 | –3.64 | –5.86 | –3.31 | –1.71 | 0.51 | –0.92 |
| 25U | –4.36 | –5.50 (?) | <–7 | –3.42 | –5.04 | –2.86 | –1.67 | 0.74 | –0.83 |
| 28U | –4.47 | –4.47 | <–7 | –3.46 | –5.11 | –2.86 | –1.44 | 0.74 | –0.85 |
| 29U | –4.58 | –4.49 | <–7 | –3.52 | –5.08 | –2.96 | –1.30 | 0.60 | –1.33 |
| 33U | –4.27 | –4.40 | <–7 | –3.81 | –6.04 | –2.85 | –2.05 | 0.91 | –0.90 |
| 26U | –4.13 | –4.93 | <–7 | –3.39 | –5.08 | –2.80 | –1.47 | 0.88 | –0.99 |
| 30U | –4.02 | –5.61 | <–7 | –3.49 | –5.09 | –2.53 | –1.62 | 0.71 | –0.93 |
На фиг. 1a представлены соотношения Na/K/Li в растворах после опытов по результатам ICP-анализа проб. Видно, что по соотношению щелочных элементов растворы после опытов незначительно (менее 20%) отличаются от исходных (помечены звездочкой). То же самое можно сказать и об Al (фиг. 1б). Вместе с тем, видна явная тенденция к снижению доли Li и Al с повышением общей концентрации хлора в системе при постоянстве Na/K отношения (3.31 ± 0.24). Это указывает на то, что мольная доля Li и Al в плотной солевой фазе (L) ниже, чем в низкоплотной фазе (V).
Несмотря на высокую концентрацию соли в растворе, кажущаяся растворимость рудных компонентов U, Nb и Ta в хлоридных рассолах была незначительной ($ \ll $10–3 моль · кг–1). Растворимость уранинита во флюиде росла с ростом концентрации соли (фиг. 2), и в 31% хлоридном растворе составила 1 × 10–4 моль · кг–1 (0.0018 мас. %). Преобладающий вклад вносили гидроксохлоридные комплексные частицы U(IV): U(OH)3Cl° и, возможно, UOCl+ (Коваленко и др., 2011). Вертикальными линиями (4.9 и 51.8 мас. % Cl) нанесены границы двухфазовой области по данным (Anderko, Pitzer, 1993) для водно-хлоридного флюида NaCl–H2O. По расчетам Х. Палисер и Р. Маккибин (Palliser, McKibbin, 1998), границы двухфазовой области NaCl–H2O флюида соответственно составляют 2.6 и 62 мас. % NaCl. Растворимость уранинита в 5.4 и 14.5% хлоридных растворах была на один порядок ниже, чем ожидаемая концентрация урана в L-фазе. Результаты, представленные на фиг. 2а, б, указывают на то, что фаза V содержала, по-видимому, не 4.9% соли (сплошная вертикальная линия), а 12–15% хлоридов (пунктирная линия). Такое несоответствие с упрощенной NaCl–H2O системой может быть связано с кумулятивным влиянием других компонентов (LiCl, AlCl3, НСl, SiO2aq), которые присутствовали в значительных количествах в исследуемом флюиде и могли оказать влияние на границы несмесимости водно-солевой системы 1-го типа. Так, если KCl способствовал незначительному расширению границ несмесимости, то LiCl (Dubois et al., 1994) и AlCl3, напротив, могли значительно сузить эти границы.
Фиг. 2.
Зависимость моляльной концентрации урана (а) и ниобия (б) в системе Li–F-гранитный расплав-уранинит-колумбит (пирохлор) – водно-солевой раствор от концентрации (мас. %) хлоридов в растворе при 750°С, 1000 бар, NNO буфере. V + L – область несмесимости водно-солевого флюида первого типа.

Концентрация ниобия и тантала в исследуемых растворах контролировалась растворимостью пирохлора (колумбит был неустойчив). В интервале 15–31 мас. % Cl содержание ниобия в растворе уменьшилось в 3 раза с 3 × 10–5 до 1 × 10–5 моль · кг–1 (фиг. 2б). Растворимость богатого натрием пирохлора в хлоридном рассоле должна быть значительно ниже, чем в низкоплотной фазе, содержащей меньшие концентрации натрия. Необычно низкую растворимость Nb в 5.4% растворе можно объяснить тем, что этот раствор был гомогенный и существенно отличался по содержанию летучих компонентов (HCl и, прежде всего, HF) от V-фазы. Согласно некоторым экспериментальным данным (Cygan et al., 1994, Малинин, Куровская, 1996), изменение фазового состояния флюида может сильно изменить растворимость рудных компонентов. Таким образом, в растворе, содержащем 13% хлоридов (V-фаза), содержание Nb в равновесии с пирохлором может достигать (3 ± 1) × 10–5 моль · кг–1. Что касается Ta, то в растворах после опытов он не был обнаружен, несмотря на то, что чувствительность ICP-MS-метода позволяла надежно определить Ta в концентрациях ниже 10–7 моль · кг–1. Можно, конечно, предположить, что тантал выпадал в осадок в виде Ta2O5 при закалке и остался на тонкопористом фильтре (0.02 мкм) при фильтрации под вакуумом. Однако, принимая во внимание данные (Babko et al., 1963, Arana et al., 1995), можно ожидать, что содержание Ta в фильтрате должно превышать 3 × 10–7 моль · кг–1 (с учетом разбавления). Следовательно, мы не могли потерять весь тантал при закалке, а его концентрация в растворе, насыщенном пирохлором при 750°С, 1000 бар, была значительно ниже 10–7 моль · кг–1.
Несмотря на то что модельный расплав содержал около 2 мас. % фтора, в равновесном с ним растворе было всего 0.1 mF, главным образом в виде алюминий-фторидных комплексов. Этим объясняется низкая растворимость ниобия и тантала в исследованных растворах.
В продуктах опытов не обнаруживался флюорит. Кальций из расплава принимал участие в формировании пирохлора и выносился в раствор. Содержание Ca в растворе, содержащем 14.57 мас. % Cl, составляло (3 ± 2) × 10–3 моль/кг H2O, тогда как в 30.3 мас. % растворе – (23 ± 3) × 10–3mCa (фиг. 3). Это указывает на то, что Ca предпочтительно накапливался в L-фазе.
Фиг. 3.
Зависимость концентрации (моляльной) Ca (а) и Mn (б) в системе Li–F-гранит-уранинит-колумбит (пирохлор) – водно-солевой раствор от концентрации (мас. %) хлоридов в растворе при 750°С, 1000 бар, NNO буфере. V + L – область несмесимости водно-солевого флюида первого типа.

Марганец и железо, изначально входившие в состав стекла и колумбита, относительно плохо растворялись в водно-солевом флюиде. Железо, как и кальций, имело положительный тренд от концентрации хлора в растворе. Следовательно, в переносе Ca и Fe принимали участие хлоридные комплексы. Марганец, напротив, не обнаруживал положительного сродства к хлору в растворе в условиях NNO буфера.
Концентрация Mn в растворе, содержащем 14.57 мас. % Cl, не превышала 2 × 10–3 моль · кг–1 и была в 3–5 раз выше концентрации Fe. В 31.3% хлоридном растворе, напротив, содержание Mn было около 0.2·10-3mMn или в десятки раз ниже mFe. Принимая во внимание различные транспортные свойства V и L фаз, можно утверждать, что с V-фазой или на ранних стадиях созревания Li–F-лейкогранитного расплава, в первую очередь выносился Mn, который в зонах гидротермального изменения пород на геохимических барьерах мог осаждаться в виде Mn-содержащих рудных минералов (колумбит, вольфрамит, гюбнерит). На возможность существования в магматической камере высококонцентрированных хлоридных растворов указывали (Kamenetsky et al., 2004). Такие растворы могли избирательно растворять хлорофильные элементы Cu, Fe, но, как оказалось, слабо растворяли интересующие нас U, Nb и Ta.
Расплав
В ходе опытов состав стекол изменился незначительно (табл. 2), несмотря на то что концентрации растворов сильно варьировали. В первую очередь, это связано с тем, что выбранное соотношение компонентов флюида было близким равновесному с модельным расплавом. К сожалению, сканирующим электронным микроскопом не представляется возможным определить содержание лития, но т.к. этот элемент присутствовал только в расплаве и растворе, то его содержание в расплаве можно оценить по балансу масс. Исходная концентрация лития в стекле была 2.5 мас. % LiF – что соответствует 1.44 мас. % Li2O, или 0.67 ат. % Li. Проведенные расчеты показали, что взаимодействие модельного расплава с раствором, содержащим 5.34 мас. % хлоридов, приводило к выщелачиванию 10–20 мас. % Li из расплава в раствор. Во всех остальных экспериментах, с концентрацией хлоридов 14.57, 22.15 и 31.30 мас. %, происходило обогащение расплава литием в 1.3–2.6 раз. Таким образом, концентрация лития в расплавах, взаимодействующих с рассолами, содержащими 31.30% хлоридов, могла составить 1.72 ат. %, что соответствует 3.75 мас. % Li2O.
Таблица 2.
Результаты электронного микроанализа стекол после опытов по распределению U, Nb, Ta между расплавом и хлоридными растворами при 750°С, 1000 бар, NNO буфере (состав стекла п/о нормирован на 94 мас. % из допущения, что в нем 2% Li2O и 4% H2O; в скобках указано количество измерений). Агпаитность = (Na + + K)/Al (в молях)
| Оксиды, элементы |
Расчетный состав стекла | Исходное стекло (11) | Стекло 24U(8) 1mCl |
Стекло 32U(13) 3mCl |
Стекло 33U(6) 3-4mCl |
Стекло 25U(7) 5mCl |
|---|---|---|---|---|---|---|
| Na2O | 4.75 | 4.87 | 4.89 | 4.43 | 4.12 | 4.02 |
| K2O | 4.83 | 3.84 | 4.01 | 4.09 | 3.61 | 3.85 |
| CaO | 0.20 | 0.30 | 0.18 | 0.08 | 0.07 | 0.10 |
| MgO | 0.05 | 0.13 | 0.17 | 0.13 | 0.15 | 0.19 |
| FeO | 0.92 | 1.03 | 0.61 | 0.07 | 0.10 | 0.45 |
| Al2O3 | 12.12 | 12.13 | 12.18 | 12.97 | 12.76 | 12.76 |
| SiO2 | 73.23 | 72.09 | 69.64 | 70.04 | 71.37 | 70.69 |
| MnO | – | – | 0.06 | 0.05 | 0.03 | 0.04 |
| TiO2 | – | – | 0.11 | 0.06 | 0.07 | 0.05 |
| F | 2.4 | 1.82 | 1.44 | 0.99 | 0.99 | 0.80 |
| Cl | – | – | 0.46 | 0.32 | 0.28 | 0.33 |
| Nb2O5 | 0.0 | – | 0.04 | 0.23 | 0.20 | 0.10 |
| Ta2O5* | 0.0 | – | 0.14 | 0.38 | 0.19 | 0.50 |
| UO2 | 0.0 | – | 0.05 | 0.17 | 0.05 | 0.12 |
| Агпаитность | 1.08 | 1.00 | 1.01 | 0.90 | 0.84 | 0.85 |
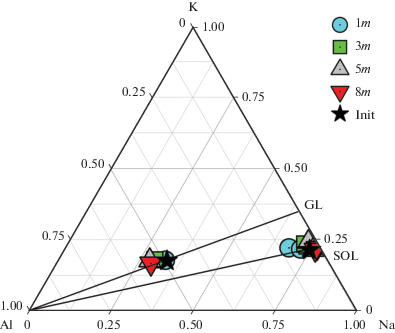
На треугольной диаграмме (фиг. 4) в координатах мольных отношений представлены результаты анализа стекол (GL) в сравнении с растворами (SOL). Видно, что мольная доля алюминия в стеклах незначительно увеличивается, тогда как мольное отношение Na/K остается постоянным (1.71 ± 0.15). Это приводит к тому, что агпаитность расплава понижается от 1.08 в исходном стекле до 0.84 в опытах с концентрацией хлоридов в растворе 31.30 мас. % (опыт 33U). Принимая во внимание, что мольные отношения Na/K в расплавах и растворах меняются незначительно, можно рассчитать средний коэффициент распределения (KD) между Li–F-расплавом (GL) и хлоридным раствором (SOL) для 750°С, 1000 бар:
Фиг. 4.
Изменение мольных соотношений Na/K/Al в стекле (GL) и растворах (SOL) после опытов при 750°С и 1000 бар. Условные обозначения: Init – исходные составы, 1m – после опыта в 1m (5.34 мас. %) растворе хлоридов, 3m – 3.02mCl (14.57%), 5m – 5.04mCl (22.15%), 8m – 8.07mCl (31.30%).
Представленные на фиг. 5 мольные отношения Na/K/Si указывают на то, что взаимодействие раствора с расплавом очень незначительно изменяет эти отношения. Это связано с тем, что растворимость SiO2 в высококонцентрированных водно-солевых растворах при 750°С и 1000 бар незначительна и, по-видимому, не превышает 0.04 моль · кг–1. Нами отмечалось, что результаты анализа растворов на малые концентрации кремнекислоты ICP-AES-методом имеют значительные погрешности и данные лежат в интервале lg mSiO2aq = –1.5 ± 0.2. Принимая во внимание, что массовое отношение раствор/расплав и Na/K оставалось постоянным, данные, представленные на фиг. 5, указывают на то, что вынос SiO2 снижался с ростом концентрации хлоридов. Из этого следует, что растворимость SiO2 в L-фазе должна быть ниже, чем в V-фазе.
Фиг. 5.
Изменение мольных отношений Na/K/Si в стекле (GL) после опытов при 750оС и 1000 бар. Условные обозначения: Init – исходный состав, 1m – после опыта в 1m (5.34%) растворе хлоридов, 3m – 3mCl (14.57%), 5m – 5mCl (22.15%), 8m – 8mCl (31.30%).

Как следует из табл. 2, растворимость урана, ниобия и тантала в расплаве была ниже 1 мас. % и результаты определений на электронном микроскопе были в пределах двукратных ошибок метода ±(0.5–0.9) мас. % для U и Nb, а для Ta – ±1.1 мас. %. Представленные в таблице значения соответствуют средним значениям, но их ошибки превышают эти величины. Для более точных определений необходимы измерения на волновом спектрометре или же методами мокрой химии. Вместе с тем, полученные величины растворимости уранинита в нашем модельном силикатном расплаве находятся между соответствующими значениями, оцененными в работах С.В. Юдинцева, Б.И. Омельяненко (Юдинцев, Омельяненко, 1984) и Ш. Пейферт с соавт. (Peiffert et al., 1996) в близких физико-химических условиях. Согласно данным (Юдинцев, Омельяненко, 1984), растворимость UO2 в гранитном расплаве составляет примерно 0.03 мас. % при 750°С и 2000 бар, тогда как по данным (Peiffert et al., 1996) она зависит от состава раствора и находится в интервале от 0.36 до 1 мас. % UO2 при 770°С, 2000 бар и NNO буфере.
Растворимость оксидов Nb2O5 и Ta2O5 в модельных, не содержащих железо Li–F-гранитных расплавах, по данным (Бородулин и др., 2007, Чевычелов и др., 2007) не превышала 0.3–0.5 мас. % Me2O5 (Me = Nb, Ta). Растворимость Nb2O5 из колумбита в расплавах, содержащих примерно 1% FeO, могла быть ниже. Поэтому концентрации Nb2O5 от 0.1 до 0.2 мас. %, определенные нами вблизи новообразованного пирохлора, представляются нам весьма правдоподобными и соответствующими растворимости пирохлора в модельном расплаве. Значения для Ta2O5 в силикатных стеклах необходимо признать недостоверными ввиду того, что измерения проводились по L-линии, малой интенсивности, т.к. M-линия совпадает с линией Si. В дополнение к этому, концентрация Ta2O5 в расплаве должна быть в 20 раз ниже, чем Nb2O5, т.к. исходный колумбит и новообразованный пирохлор были существенно ниобиевыми (табл. 3).
Таблица 3.
Средние (в скобках указано число определений) составы колумбита (Clb) и пирохлоров (Pcl), образованных в опытах при 750°С, 1000 бар, NNO буфере
| Элементы | Исходный | Опыт 32U- 3mCl | Опыт 29U- 5mCl | Опыт 25U- 5mCl | Опыт 33U | ||
|---|---|---|---|---|---|---|---|
| атомн. % | Clb (3) | Pcl (12) | U-Pcl (3) | Pcl (4) | U-Pcl (4) | U-Pcl (3) | U-Pcl (7) |
| Na | 0.12 | 8.02 | 7.03 | 8.62 | 9.38 | 5.79 | 10.53 |
| Ca | 0.05 | 9.20 | 5.34 | 8.94 | 5.61 | 4.35 | 1.92 |
| Fe | 5.14 | 0.06 | 0.11 | 0.00 | 0.16 | 1.32 | 0.07 |
| Mn | 6.15 | 0.04 | 0.03 | 0.05 | 0.03 | 0.07 | 0.04 |
| Ti | 0.40 | 0.30 | 0.23 | 0.15 | 0.18 | 1.04 | 0.22 |
| Nb | 23.22 | 18.32 | 13.96 | 18.86 | 16.69 | 12.06 | 18.82 |
| Ta | 0.75 | 1.30 | 3.69 | 0.66 | 1.34 | 3.55 | 1.07 |
| U | 0.03 | 0.07 | 1.11 | 0.09 | 2.02 | 1.35 | 4.72 |
| F | 0.18 | 8.99 | 4.82 | 9.30 | 5.39 | 3.44 | 1.13 |
| O | 63.98 | 53.7 | 63.68 | 53.61 | 59.21 | 67.03 | 61.48 |
Твердые фазы
Как было отмечено выше, в продуктах опытов всегда присутствовал уранинит. В ходе опыта наблюдался заметный рост (перекристаллизация) кристаллов уранинита. Несмотря на то что твердые фазы перед опытом перемешивались, большая часть уранинита и колумбита с пирохлором находилась в нижней части стекла. Однако незначительная часть уранинита захватывалась сферическими каплями расплава и оставалась в верхней части ампул.
Колумбит в изучаемой системе был нестабилен и замещался пирохлором. При этом можно выделить две стадии. На начальной стадии (стадия растворения) колумбит инконгруэнтно растворялся в расплаве с образованием пирохлора в непосредственной близости к колумбиту. Этот пирохлор содержал высокие концентрации фтора и низкие урана. Для полного замещения колумбита требовалось время, поэтому даже в опытах длительностью 20 сут, внутри пирохлора все еще сохранялся колумбит. Скорость замещения падала со временем в связи с тем, что доступ Na, Ca, F из расплава к колумбиту и вынос Fe и Mn ухудшались. Диффузия урана в стекле была еще более низкой. Пирохлор плотной корочкой окутывал растворяющийся кристалл колумбита. Поэтому пирохлоры, окаймляющие колумбит, всегда содержали низкие концентрации урана (<0.1 мас. % UO2). На заключительной стадии, которую можно назвать стадией созревания, внешняя часть пирохлоровой корочки (оторочки) претерпевала изменение в опытах длительностью более 7 сут. Из пирохлора выносился фтор и привносился уран (табл. 3). Содержание урана в уран-пирохлоре достигало 8–15 мас. % UO2. Состав уран-пирохлора зависел от состава флюида. В опыте 33U мы случайно изменили соотношение компонентов флюида, введя 1.5-кратный избыток NaCl. Такое нарушение соотношений Na/K/Al/Ca в растворе вызвало незначительные изменения в составе силикатного расплава и в растворимости рудных компонентов, но сильно изменило состав уран-пирохлора. Последний был существенно натриевый, содержал низкие концентрации фтора (0.5 ± 0.2 мас. % F) и высокие урана (29.4 ± 1.0 мас. % UO2).
ГЕОЛОГИЧЕСКОЕ ПРИЛОЖЕНИЕ ПОЛУЧЕННЫХ ДАННЫХ
Имеющиеся термодинамические данные по частицам урана при высоких температурах (Коваленко и др., 2011, Редькин, 2009) не позволяют количественно смоделировать процесс растворения уранинита и алюмосиликатного расплава в хлоридном растворе. Вместе с тем, мы можем рассмотреть зависимость растворимости уранинита от концентрации хлоридов при 750°С. Т.к. при давлении 1000 бар вода представляет собой паровую фазу (steam), то все вычисления выполнены при давлении 1300 бар, когда вода находится в жидком состоянии.
Термодинамические расчеты выполнены с использованием программного комплекса HCh и OptimA (Shvarov, 2015; Шваров, 2008). Базисные частицы заимствованы из базы данных Unitherm. Взаимосогласованные значения свободных энергий Гиббса для частиц урана (IV) взяты из работы (Редькин, 2009). Коэффициенты активности частиц рассчитывались по уравнению Дебая-Гюккеля в первом приближении.
Температура начала процесса уранового гидротермального рудообразования на Стрельцовском месторождении могла достигать 530–500°С, и на начальной (предрудной) стадии происходило образование кварцевых жил с прожилками альбита (Крылова и др., 2008). Тогда, согласно (Hemley, Jones, 1964), отношение mNaCl/mHCl в гидротермальном растворе было выше 200. Т.е. в растворе, содержащем 1 m хлоридов щелочей натрия и калия, концентрация HCl была ниже 0.005 моль · кг–1. Растворимость UO2 в растворе 0.778mNaCl + 0.222mKCl + 0.005mHCl при 500оС и 1000 бар составляет 1.1 × 10–6 моль · кг–1, что в 8 раз ниже растворимости UO2 при 750°С, 1300 бар в этом же растворе (фиг. 6). Следовательно, магматогенный 1m хлоридный раствор, насыщенный уранинитом, при охлаждении с 750 до 500°С может потерять 86% урана.
Фиг. 6.
Влияние m HCl и m раствора (Na0.778K0.222)Cl на растворимость UO2 при 750°С, 1300 бар, f(O2) = 10–14.96 бар. Отмеченные закрашенные области показывают составы растворов, проводящие кварц-альбитовые изменения Al–Si-пород при 500°С, 1000 бар.
Запасы урана на крупнейшем Mo–U-месторождении Стрельцовской кальдеры оцениваются в 276.9 тыс. т. Содержание урана в руде составляет в среднем 0.3%, так что эта масса урана укладываются в куб вмещающих пород со стороной 313 м или шар диаметром 428 м. Месторождения локализованы на участке площадью 220 км2 и приурочены к Аргунской зоне разломов. Если предположить, что все 276.9 тыс. т урана изначально находились в риолитовом расплаве, в котором содержание урана составляло 15–23 г/т, то объем расплава составлял 4–6 км3. Принимая во внимание, что только часть урана могла извлечься из расплава, то объем источника руды мог быть в несколько раз больше. Согласно оценкам, объем расплава риолитов в Стрельцовской кальдере был не менее 31.4 км3 (Chabiron et al., 2003). Собственно, объем самого источника рудоносных растворов мог быть меньше, но общий объем растворов, принимавших участие в выщелачивании урана из риолитового расплава, которые могли генерироваться расплавами измененных гранитов, имеющих объем порядка 570 км3 (Chabiron, Cuney, 2001), был значительно больше.
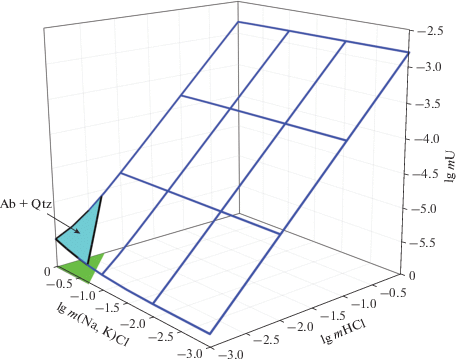
Рассмотрим необходимые для массопереноса объемы раствора. Предположим, что только 10% водного раствора, содержащего, главным образом, хлориды щелочных металлов, могли отделиться от водонасыщенного (4% H2O) гранитного расплава (т.е. состава риолита). Как показано выше (табл. 1), содержание урана в водном 1m хлоридном растворе, равновесном с расплавом риолитового состава, составляет при 750°С 8.1 × × 10–6 моль · кг–1. Для формирования месторождения урана в 276.9 тыс. т необходимо из гранитного расплава выделить 1436 км3 водного раствора, а для этого понадобится 35 909 км3 гранитного расплава. Из этого следует, что сам гранитный (риолитовый) расплав, образовавшийся в результате кристаллической дифференциации гранитоидной магмы и обособившийся в виде линзы или иного тела объемом до 31.4 км3 на глубине 3–5 км, не мог быть достаточным источником ураноносных растворов хлоридного состава при формировании гигантских месторождений. Даже если предположить, что в равновесии с гранитным расплавом находились несколько флюидных фаз, обладающих различной растворяющей способностью в отношении уранинита, то и в этом случае объемы рудогенерирующего расплава должны быть гигантскими. Фиг. 7 показывает, как кислотность растворов (mHCl) влияет на продуктивность риолитовых расплавов. Очевидно, что запасы урана линейно зависят от объема источника урана при прочих постоянных параметрах (pH, T, P, f(O2), …). Расчеты показывают, что магматогенные растворы, вызывающие Qtz-Ab изменения вмещающих пород (заштрихованная область на фиг. 7) и содержащие 0.778mNaCl + 0.222mKCl + 0.05mHCl + + другие компоненты (Si, Al, Ca, Mg), не могут образовать даже мелкое рудопроявление, если объемы расплавов, их генерирующие, не превышают 570 км3. Перспективными для переноса U(IV) и для формирования гигантских урановых месторождений могут рассматриваться растворы, содержащие >0.3 mHCl (+0.778mNaCl + 0.222mKCl), в которых растворимость Urn превышает 5.1 × 10–4 моль · кг–1. Объемы таких рудоносных растворов должны достигать 2.3 км3, а объемы расплавов, из которых они выделились, не превышают 570 км3. Мы не рассматриваем гидроксо-уранильные и уранил-хлоридные формы переноса урана, поскольку обстановка, в которой формировались магматогенные флюиды, была восстановительной. В окислительной обстановке растворимость оксидов и гидроксидов урана даже в воде значительна (>1 × × 10–3 моль · кг–1 при 500°С) (Редькин и др., 1989; Редькин, 2013, 2017), но вероятность такого сценария ничтожно мала.
Фиг. 7.
Влияние кислотности (mHCl) и объема гранитного (риолитового) расплава на максимальную массу урана, аккумулированную в растворе 0.778mNaCl + 0.222mKCl + nmHCl при 750°С, 1300 бар, f(O2) = 10–14.96 бар. Пунктирные линии показывают минимальные и максимальные объемы гранитных расплавов источников урана. Заштрихованная область соответствует растворам, проводящим Qtz-Ab изменения пород.

Полученные результаты моделирования указывают на то, что преимущественно хлоридные растворы или водно-хлоридные флюиды не могут рассматриваться в качестве магматогенных рудоносных растворов при формировании гигантских гидротермальных месторождений урана.
В настоящей работе не рассматривается влияние углекислоты и фторидов на мобилизацию урана из гранитных расплавов. Вместе с тем, имеющиеся экспериментальные данные указывают на существенное влияние CO2 и NaF на растворимость уранинита, особенно в области флюидной несмесимости. Вопрос о причинах мобилизации и формах нахождения урана в карбонатно-хлоридных и фторидных флюидах изучается.
ВЫВОДЫ
Проведенные исследования в двухфазовой области водно-солевого (преимущественно хлоридного) флюида первого типа показали, что растворимость урана не превышает 1–2 × 10–4 моль · кг–1, ниобия – 5 × 10–5m, а тантала – ниже n × 10–7m. Установлено, что расслоение водно-хлоридного раствора на две флюидные фазы оказывает малое влияние на распределение Na и K, но приводит к обогащению V-фазы литием и алюминием.
Результаты термодинамического моделирования показали, что преимущественно хлоридный флюид при изученных ТР-параметрах не может рассматриваться в качестве активной среды для мобилизации урана из расплавов Li–F-гранитов при формировании гигантских гидротермальных урановых (молибден-урановых) месторождений. Таким образом, вопрос о магматогенном источнике урана все еще остается открытым для дискуссии.
Список литературы
Алешин А.П., Величкин В.И., Крылова Т.Л. Генезис и условия формирования месторождений уникального молибден-уранового Стрельцовского рудного поля: Новые минералого-геохимические и физико-химические данные // Геология руд. месторождений. 2007. Т. 49. № 5. С. 446–470.
Баданина Е.В., Сырицо Л.Ф., Волкова Е.В., Томас Р., Трамболл Р.Б. Состав расплава Li-F гранитов и его эволюция в процессе формирования рудоносного Орловского массива в Восточном Забайкалье // Петрология. 2010. Т. 18. № 2. С. 139–167.
Бородулин Г.П., Чевычелов В.Ю., Зарайский Г.П. Распределение Ta и Nb между водным фторидным флюидом и кислыми расплавами с различным содержанием глинозема и щелочей при Т = 650–850°C и Р = 100 МПа // Электронный науч.-инф. журн. Вестник Отделения наук о Земле РАН. 2007. № 1 (25).
Жариков В.А., Иванов. И.П., Омельяненко Б.И., Редькин А.Ф., Юдинцев С.В. Экспериментальное изучение растворимости уранинита в модельных гранитных расплавах и растворах при высоких параметрах // Геология руд. месторождений. 1987. № 4. С. 3–12.
Коваленко Н.И., Рыженко Б.Н., Присягина Н.И., Бычкова Я.В. Экспериментальное исследование растворимости уранинита в водных растворах HCl при 500°C и 1 кбар // Геохимия. 2011. № 3. С. 277–289.
Крылова Т.Л., Алешин А.П., Ломм Т., Величкин В.И., Кюне М. Свидетельства магматогенного происхождения рудообразующих флюидов на Mo-U месторождениях Стрельцовского рудного поля (Вост. Забайкалье, Россия) // Матер. XIII Междунар. конф. по термобарогеохимии и IV симпозиума APIFIS. Москва. 2008. Т. 2. С. 64–67.
Малинин С.Д., Куровская Н.А. Влияние давления на растворимость минералов в водных хлоридных растворах при сверхкритических параметрах состояния // Геохимия. 1996. № 1. С. 51–58.
Редькин А.Ф. Исследование комплексообразования U(IV) в хлоридных растворах при 300–600оС и 1000 бар // Электронный науч.-инф. журн. Вестник Отделения наук о Земле РАН. 2009. № 1(27).
Редькин А.Ф. Исследование растворимости UO2 и гидроксидов U(VI) в воде при высоких температурах и давлении // Материалы научного семинара, посвященного научной деятельности проф., д.х.н. И.Л. Ходаковского. Дубна. 2013. С. 73–79.
Редькин А.Ф. Влияние фугитивности кислорода и температуры на растворимость и устойчивость оксидных соединений урана в системе U–O–H // Труды научного семинара памяти проф., д.х.н. И.Л. Ходаковского: сборник материалов. Ред. П.П. Гладышева. Дубна: Гос. У-нт “Дубна”, 2017. С. 162–168.
Редькин А.Ф., Омельяненко Б.И., Иванов И.П. Экспериментальное изучение растворимости окислов и гидроокислов урана в воде и в кислых хлоридных растворах // Химия урана: сборник научных трудов. Ред. Ласкорин Б.Н., Мясоедов Б.Ф. М.: Наука, 1989. С. 42–54.
Редькин А.Ф., Величкин В.И., Алёшин А.П., Бородулин Г.П. Исследование взаимодействия модельного F-содержащего кислого расплава с хлоридным флюидом, уранинитом и колумбитом при 750°С и 1000–2000 бар для оценки рудогенерирующей способности верхнекорового очага под Стрельцовской кальдерой (Восточное Забайкалье) // Геология руд. месторождений. 2009. Т. 51. № 4. С. 325–341.
Хомич В.Г., Борискина Н.Г. Совершенствование минерагенического районирования Восточного Забайкалья на основе геофизических исследований // Геология и геофизика. 2017. Т. 58. № 7. С. 1029–1046.
Чевычелов В.Ю. О растворимости хлора во флюидонасыщенных магматических расплавах гранитоидного состава: влияние кальция // Геохимия. 1999. № 5. С. 522–535.
Чевычелов В.Ю., Зарайский Г.П., Бородулин Г.П. Экспериментальное исследование влияния щелочности расплава, температуры и давления на растворимость редких металлов (Ta, Nb) в гранитоидном расплаве // Сб.: Щелочной магматизм Земли и его рудоносность: Матер. междунар. совещ. Киев, 2007. С. 259–263.
Шваров Ю.В. HCh: новые возможности термодинамического моделирования геохимических систем, предоставляемые Windows // Геохимия. 2008. № 8. С. 898–903.
Юдинцев С.В. Растворимость уранинита в водонасыщенном гранитном расплаве // Докл. АН СССР. 1986. Т. 287. № 1. С. 205–207.
Юдинцев С.В. Исследование поведения урана в щелочных магмах // Геохимия. 1990. № 4. С. 538–544.
Юдинцев С.В., Омельяненко Б.И. О поведении урана в кристаллизующемся расплаве // Геохимия. 1984. № 4. С. 555–559.
Anderko A., Pitzer K.S. Phase equilibria and volumetric properties of the systems KCl–H2O and NaCl–KCl–H2O above 573 K: Equation of state representation // Geochim. Cosmochim. Acta. 1993. V. 57. P. 4885–4897.
Arana G., Etxebarria N., Fernandez L.A., Madariaga J.M. Hydrolysis of Nb(V) and Ta(V) in aqueous KCl at 25°C. Part II: Construction of a thermodynamic model for Ta(V) // J. Solution Chem. 1995. V. 24. P. 611–622.
Babko A.K., Lukachina V.V., Nabivanets B.I. Solubility and acid-base properties of tantalum and niobium hydroxides // Russ. J. Inorg. Chem. 1963. V. 8. P. 957–961.
Calas G. Etude expérimentale du comportement de l’uranium dans les magmas, états d’oxydation et de coordinance // Geochim. Cosmochim. Acta. 1979. V. 43. P. 1521–1531.
Chabiron A., Alyoshin A.P., Cuney M., Deloule E., Golubev V.N., Velitchkin V.I., Poty B. Geochemistry of the rhyolitic magmas from the Streltsovka caldera (Transbaikalia, Russia): a melt inclusion study // Chem. Geol. 2001. V. 175. P. 273–290.
Chabiron A., Cuney M. Altération de l’allanite dans les granites sous la caldeira de Streltsovka (Transbaïkalie, Russie). Une source possible d’uranium pour les gisements // C.R. Acad. Sci. Paris, Sciences de la Terre et des planets. 2001. № 332. P. 99–105.
Chabiron A., Cuney M., Poty B. Possible uranium sources for the largest uranium district associated with volcanism: the Streltsovka caldera (Transbaikalia, Russia) // Miner. Deposita. 2003. № 38. P. 127–140.
Cygan G.L., Hemley J.J., Doughten M.W. Fe, Pb, Zn, Cu, Au, and HCl partitioning between vapor and brine in hydrothermal fluids–implications for porphyry copper deposits // In: USGS Research on Mineral Deposits. Part A, 9th V.E. McKelvey Forum, USGS Circular. 1994. 1103–A. P. 26–27.
Dubois M., Weisbrod A., Shtuka A. Experimental determination of the two-phase (liquid and vapour) region in water-alkali chloride binary systems at 500 and 600°C using synthetic fluid inclusions // Chem. Geol. 1994. V. 115. P. 227–238.
Hemley J.J., Jones W.R. Chemical aspects of hydrothermal alteration with emphasis on hydrogen metasomatism // Econ. Geol. 1964. V. 59. № 4. P. 538–569.
Kamenetsky V.S., Naumov V.B., Davidson P., van Achterbergh E., Ryan C.G. Immiscibility between silicate magmas and brines in the Omsukchan Granite (NE Russia): melt inclusion probe into magmatic-hydrothermal transition // Chem. Geol. 2004. V. 210 (1–4). P. 73–90.
Keppler H., Wyllie P.J. Role of fluids in transport and fractionation of uranium and thorium in magmatic processes // Nature. 1990. P. 531–533.
Keppler H., Wyllie P.J. Partitioning of Cu, Sn, Mo, W, U, and Th between melt and aqueous fluid in the systems haplogranite–H2O–HCl and haplogranite–H2O–HF // Contrib. Mineral. Petrol. 1991. V. 109. P. 139–150.
Palliser Ch., McKibbin R. A Model for deep geothermal brines, I: T-p-X state-space description // Transport Porous Med. 1998. V. 33. P. 65–80.
Peiffert Ch., Nguyen-Trung Ch., Cuney M. Experimental determination of uranium solubility and fluid-melt partition coefficients in the uranium oxide–haplogranite–H2O–NaX (X = Cl, F) system at 770°C, 2 kbar // Geochim. Cosmochim. Acta. 1996. V. 60. P. 1515–1529.
Shvarov Yu. A suite of programs, OptimA, OptimB, OptimC, and OptimS compatible with the Unitherm database, for deriving the thermodynamic properties of aqueous species from solubility, potentiometry and spectroscopy measurements // Appl. Geochem. 2015. V. 55. P. 17–27.
Дополнительные материалы отсутствуют.
Инструменты
Геология рудных месторождений



