Геология рудных месторождений, 2023, T. 65, № 1, стр. 4-14
Медь в гидротермальных системах: термодинамическое описание компонентов системы Cu(I)–O–H
Н. Н. Акинфиев a, b, *, А. В. Зотов a
a Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН
119017 Москва, Старомонетный пер., 35, Россия
b Российский государственный геологоразведочный университет имени С. Орджоникидзе
117997 Москва, ул. Миклухо-Маклая, 23, Россия
* E-mail: akinfiev@igem.ru
Поступила в редакцию 27.06.2022
После доработки 22.07.2022
Принята к публикации 22.07.2022
- EDN: LARZSH
- DOI: 10.31857/S0016777023010021
Аннотация
Проведена обработка имеющихся в литературе экспериментальных данных по растворимости Cu (мет.) и Cu2O (куприт) в воде в гидротермальных условиях. Проведены ключевые эксперименты по растворимости куприта при 300°C, давлении насыщенного пара H2O в зависимости от pH раствора. В результате получен набор значений термодинамических свойств для 25°С, 1 бар и параметров уравнения моделей НКF (Хелгесон–Киркхэм–Флауэрс) и AD (Акинфиев–Даймонд) для гидроксокомплексов Cu(I), позволяющие описывать их поведение в широком диапазоне температур (0–600°C), давлений (1–3000 бар) и плотностей водного флюида (0.01–1 г см–3). Методами термодинамического моделирования показано, что ион Cu+ является доминирующим в кислой и слабощелочной области водного растворителя во всем исследованном диапазоне температур и давлений. Влияние нейтрального гидроксокомплекса CuOH начинает сказываться в щелочной области при T > 300°C и растет с увеличением температуры. Второй гидроксокомплекс меди ${\text{Cu}}\left( {{\text{OH}}} \right)_{2}^{ - }$ проявляет себя лишь в сильнощелочной области, причем температура практически не влияет на его поведение.
ВВЕДЕНИЕ
Для понимания процессов переноса и осаждения меди при образовании месторождений, в первую очередь медно-порфировых, важно знать термодинамические свойства иона и комплексных соединений меди(I) в гидротермальных растворах. В настоящей работе рассматривается только простейшая система Сu(I)–O–H.
Работа предпринята в связи со значительными расхождениями результатов экспериментов, проведенных Л. Варьяш и др. (1989) и Д.А. Палмером с коллегами (Palmer et al., 2001, 2011). В этих исследованиях различно оценивается устойчивость как иона Cu+, так и нейтрального комплекса Cu(OH)aq.
ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ РАСТВОРИМОСТИ АССОЦИАЦИИ Cu(КР) + Cu2O(КУПРИТ) В ЗАВИСИМОСТИ ОТ pH ПРИ 300°C И ДАВЛЕНИИ НАСЫЩЕННОГО ПАРА
Методика эксперимента
Опыты проведены закалочным методом в автоклавах из титанового слава ВТ‑8, футерованных фторопластом. Внутренний объем автоклавов ~25 мл. Растворимость определялась в воде, растворах борной кислоты (ос. ч.) и буры (х. ч.), а также в 0.002 m растворе NaOH (ос. ч.). Все растворы готовили на деионизированной воде MilliQ. Раствор 0.002 m NaOH (ос. ч.) готовили непосредственно перед опытом разведением высококонцентрированного раствора NaOH водой, предварительно очищенной от углекислоты кипячением с барботированием аргона.
В качестве твердых фаз использовали мелкие (0.2–0.5 мм) кристаллы куприта Cu2O и мелкодисперсную металлическую медь (99.9%). Были использованы кристаллы куприта, полученные Л.Н. Варьяш в автоклавах при гидротермальном окислении меди (Варьяш и др., 1989). В этих опытах куприт образовывал щеточки на кусочках (2–3 мм) меди (х. ч.). Следов присутствия двухвалентной меди (CuO) после опыта рентгеновским методом не обнаружено.
Твердые фазы (смесь куприта и меди) помещали в чашечку, расположенную в верхней части автоклава. Она располагалась выше уровня раствора при комнатной температуре и заполнялась раствором при температуре опыта. На дно автоклава помещали немного (~5 мг) стружки металлического алюминия (99.99%), реагирующего с водой с образованием водорода, тем самым препятствуя возможному окислению меди на начальных этапах опыта. Следов присутствия двухвалентной меди (CuO) в твердых фазах после опыта рентгеновским методом не обнаружено.
Опыты проводили в вертикальной печи при температуре 300 ± 3°С и давлении насыщенного пара H2O. Длительность опыта составляла 14 дней. Кратковременные опыты показали, что 5–7 дней достаточно для достижения равновесия. Величину pH измеряли после опыта при T = 25°С и рассчитывали при Т = 300°С с использованием программного комплекса HCh.
В конце опыта автоклавы закаливали в холодной воде, после чего из каждого автоклава отбирали по две пробы с фильтрацией через 0.05 мкм фильтр Millipore. Концентрация меди в пробах определялась методом атомной абсорбции в пламени на спектрометре фирмы Varian SpectrAA Duo (аналитик Л.Ф. Карташова). Разница концентраций меди, определенных в двух параллельных пробах из одного автоклава, как правило, не превышала 10% (или 0.05 lg m(Cu)). Разница концентраций, обнаруженная в разных автоклавах с одинаковым составом раствора, выше. Погрешность среднего значения растворимости куприта (lg m(Cu)) в воде, рассчитанного для 8 автоклавов, при доверительной вероятности 95% составляет ±0.10 (табл. 1).
Таблица 1.
Растворимость куприта (в присутствии самородной меди) в воде при 300°С и давлении насыщенного пара H2O
| № автоклава | pH(25°С) измер. | lg m(Cu) | lg m(Cu)ср. |
|---|---|---|---|
| 1 | 5.57 | –5.07 | –5.1 |
| –5.12 | |||
| 3 | 5.88 | –5.09 | –5.12 |
| –5.14 | |||
| 4 | 5.72 | –5.14 | –5.14 |
| 5 | 5.49 | –4.97 | –5.0 |
| –5.02 | |||
| 7 | 5.6 | –4.98 | –5.01 |
| –5.04 | |||
| 8 | 5.58 | –4.86 | –4.88 |
| –4.89 | |||
| 9 | 5.51 | –5.19 | –5.19 |
| 10 | 5.49 | –5.2 | –5.2 |
| Среднее | 5.61 | –5.08 | |
| ±(0.95) | 0.10 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Состав исходных растворов и определенные равновесные концентрации меди приведены в табл. 1 и 2. Зависимость равновесных концентраций меди от рассчитанных значений pH растворов показана на фиг. 1. При этом к нашим данным, приведенным в табл. 2, добавлены результаты экспериментов Варьяш и др. (1989) в более щелочных условиях (0.3–1 mNaOH). Символами обозначены экспериментальные данные, линии равновесных концентраций Cu+ и Cu(OH)$_{2}^{ - }$ рассчитаны с использованием программы OptimA (Shvarov, 2015). Приведенным линиям соответствуют значения химического потенциала иона Cu+ и комплекса Cu(OH)$_{2}^{ - }$ +27.777 и –320.081 кДж моль–1 (или –56.225 кДж моль–1 для его HKF эквивалента CuO–). При этом термодинамические свойства B(OH)3 aq, ${\text{B}}({\text{OH}})_{4}^{ - }$ были приняты по (Акинфиев и др., 2006), O2(aq) и H2(aq) – по (Akinfiev, Diamond, 2003), а OH–, Na+ и NaOH(aq) заимствованы из базы термодинамических данных SUPCRT92 (Johnson et al., 1992) и ее дополнений (Sverjensky et al., 1997; Shock et al., 1997). Коэффициенты активности рассчитывались по уравнению Дебая–Хюккеля во 2-м приближении (Helgeson et al., 1981).
Таблица 2.
Растворимость куприта Cu2O (в присутствии самородной меди) при 300°С и давлении насыщенного пара в воде и близнейтральных и щелочных растворах (рН300°С от 6 до 10)
| m(NaOH) | m(Na2B4O7) | m(H3BO3) | pH25°C | pH300°C | lg m(Cu) | Источник |
|---|---|---|---|---|---|---|
| 0 | 0 | 0 | 5.61 | 6.34 | –5.08 ± 0.10 | Наст. работа |
| 0.002 | 0 | 0 | 8.54 | 8.58 | –6.30 ± 0.15 | Наст. работа |
| 0.002 | 0 | 0 | 8.58 | –6.26 ± 0.15 | Наст. работа | |
| 0 | 0.1 | 0 | 9.1 | 9.18 | –5.52 ± 0.15 | Наст. работа |
| 0 | 0.1 | 0 | 9.18 | –6.02 ± 0.15 | Наст. работа | |
| 0 | 0.001 | 0.05 | 7.76 | 7.97 | –6.39 ± 0.15 | Наст. работа |
| 0 | 0.001 | 0.05 | 7.97 | –6.44 ± 0.15 | Наст. работа | |
| 0 | 0 | 0.05 | 5.95 | 6.04 | –4.99 ± 0.20 | Наст. работа |
| 0.3 | 0 | 0 | 10.36 | –4.33 ± 0.25 | Варьяш, 1989 | |
| 1 | 0 | 0 | 10.71 | –3.82 ± 0.30 | Варьяш, 1989 |
Фиг. 1.
Растворимость ассоциации Cu(мет.) + Cu2O(куприт) в зависимости от расчетного значения pH при T = 300°С и давлении насыщенного пара H2O. Символы – эксперимент, линии – расчетные значения растворимости с образованием Cu+ и ${\text{Cu}}({\text{OH}})_{2}^{ - }$ (CuO– в модели HKF) (см. пояснения в тексте).

Наблюдаемая зависимость lg m(Cu) от pH (фиг. 1) определенно указывает на то, что в данных условиях нейтральным комплексом CuOHaq можно пренебречь (m(CuOHaq) < 10–7). Полученная величина растворимости Cu2O за счет иона Cu+ близка к данным Варьяш и др. (1989) и существенно выше, чем по данным Пальмера с коллегами (Palmer et al., 2011). Вместе с тем, устойчивость нейтрального комплекса CuOHaq в работе Варьяш и др. (1989) очень сильно завышена.
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА ВОДНЫХ ЧАСТИЦ В СИСТЕМЕ Cu–O–H В ШИРОКОМ ДИАПАЗОНЕ ТЕМПЕРАТУР И ДАВЛЕНИЙ
Методика расчетов
Для предсказания поведения частиц водных растворов при высоких параметрах состояния в относительно плотных (ρ > 0.35 г см–3) гидротермальных растворах мы используем широко применяемую модифицированную модель HKF (Хелгесон–Киркхэм–Флауэрс) (Helgeson et al., 1981; Tanger, Helgeson, 1988; Shock, Helgeson, 1988; Shock et al., 1989; Sverjensky et al., 1997; Shock et al., 1997).
При более низких плотностях из-за усиления ассоциации электролитов водный флюид содержит преимущественно электронейтральные компоненты. Для расширения возможностей их термодинамического описания на области, включающие и малоплотный водный флюид, в настоящей работе использовано уравнение состояния (УС) AD (Akinfiev, Diamond, 2003; Akinfiev, Plyasunov, 2014). Предложенное УС основано на знании термодинамических свойств компонента в состоянии идеального газа $\mu _{g}^{^\circ }(T)$ и содержит всего 3 эмпирических параметра (ξ, a, b), ответственных за гидратацию этой молекулы. Выражение для химического потенциала компонента в водном окружении $\mu _{{{\text{aq}}}}^{^\circ }(P,T)$ при заданных давлении P и температуре T имеет вид:
(1)
$\begin{gathered} \mu _{{{\text{aq}}}}^{^\circ }(P,T) = \mu _{g}^{^\circ }(T) - RT\ln {{N}_{{\text{w}}}} + \\ + \,\,(1 - \xi )RT\ln f_{1}^{^\circ } + RT\xi \ln \left( {\frac{{10RT}}{{{{M}_{{\text{w}}}}}}\rho _{1}^{^\circ }} \right) + \\ + \,\,RT\rho _{1}^{^\circ }\left[ {a + b{{{\left( {\frac{{{{{10}}^{3}}}}{T}} \right)}}^{{0.5}}}} \right], \\ \end{gathered} $Термодинамические свойства растворителя H2O ($f_{1}^{^\circ }$,$\rho _{1}^{^\circ }$) приняты по (Wagner, Pruß, 2002). Для нелетучих компонентов термодинамические свойства $\mu _{g}^{^\circ }(T)$ рассчитывались методами квантовой химии (DFT B3LYP с набором базовых функций 6-311+G(d,p) для всех атомов) с использованием пакета программ Gaussian 09W, Revision C.01 (Frisch et al., 2009). Термохимическим расчетам предшествовала процедура оптимизации структуры молекулы, при этом все молекулярные структуры были проанализированы на отсутствие мнимых частот с помощью программы GaussView 5.
Знание термодинамических свойств газовой молекулы при стандартных условиях $S_{g}^{^\circ }({{T}_{r}})$ и зависимости теплоемкости от температуры $C_{{p,g}}^{^\circ }(T)$ позволяет рассчитать химический потенциал газовой молекулы при заданной температуре T:
(2)
$\begin{gathered} \mu _{g}^{^\circ }(T) = \mu _{g}^{^\circ }({{T}_{r}}) - S_{g}^{^\circ }({{T}_{r}})(T - {{T}_{r}}) + \\ + \,\,\int\limits_{{{T}_{r}}}^T {C_{{p,g}}^{^\circ }(T)} dT - T\int\limits_{{{T}_{r}}}^T {C_{{p,g}}^{^\circ }(T)} d\left( {\ln T} \right). \\ \end{gathered} $Обработка экспериментальных данных проводилась следующим образом.
1. Сначала с помощью программы OptimA (Shvarov, 2015) рассчитывались значения химических потенциалов Cu-содержащих водных компонентов при заданных в гидротермальном эксперименте давлении и температуре с учетом экспериментальной погрешности. Программа OptimA, совмещенная с расчетным комплексом HCh, дает возможность обрабатывать данные одновременно по нескольким экспериментам, выполненным в одной и той же химической системе (но с разными составами) при одних и тех же условиях (температуре и давлении). Оптимизация значений химических потенциалов проводилась с весами, обратно пропорциональными квадрату экспериментальной погрешности. При этом термодинамические данные “базовых” компонентов (Na+, OH–, Cl–,) и электронейтральных молекул NaCl(aq), NaOH(aq) были заимствованы из базы термодинамических данных SUPCRT92 (Johnson et al., 1992) и ее дополнений (Sverjensky et al., 1997; Shock et al., 1997) без какого-либо пересмотра и уточнения. HKF параметры HCl(aq) были приняты по работе (Tagirov et al., 1997).
Расчеты коэффициентов активности γ проводились по уравнению Дебая–Хюккеля во 2-м приближении (Helgeson et al., 1981):
где m* – сумма моляльных концентраций всех компонентов раствора.2. Имеющиеся в литературе и полученные из эксперимента значения химических потенциалов Cu(I)-содержащих компонентов в ряде PT-точек, обрабатывались затем в помощью программы OptimB, также совмещенной с пакетом HCh (Shvarov, 2015). Назначение этой программы – нахождение параметров модифицированной модели Хелгесона–Киркхама–Флауэрса (HKF) (Tanger, Helgeson, 1988) компонента по экспериментальным значениям свободной энергии частицы, измеренным при различных значениях температуры и давления. Веса значениям химических потенциалов точек w задавались в соответствии с доверительным интервалом химического потенциала σ, вычисленного программой OptimA на предыдущем шаге: w = 1/σ. Величины свободной энергии ${{\Delta }_{f}}G_{{298}}^{^\circ },$ энтропии $S_{{298}}^{^\circ }$ и параметра Борна ω молекулы при стандартных условиях вначале рассчитывались с использованием корреляций по методу, предложенному в (Shock et al., 1997), а затем при необходимости уточнялись в основном теле программы OptimB. Аналогичным образом в процедуру оптимизации были включены параметры c1 и c2 уравнения теплоемкости при условии постоянства Cp,298. Значения параметров a1…a4, характеризующих зависимость мольного объема от температуры и давления, рассчитывались с использованием корреляционных соотношений (Shock et al., 1997).
3. Для CuOH(aq) нейтрального комплекса также имеются экспериментальные данные по его присутствию в малоплотных водных флюидах. В связи с этим для описания его термодинамических свойств во всем диапазоне экспериментальных условий было использовано УС AD. При этом расчет эмпирических параметров модели ($\mu _{g}^{^\circ }({{T}_{r}}),$ ξ, a, b) проводился методом линейной регрессии (уравнение 1) экспериментальных значений химических потенциалов $\mu _{{{\text{aq}}}}^{^\circ }(P,T),$ полученных в OptimA.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Cu+
В процессе оптимизации термодинамических параметров иона были использованы результаты, полученные на основе первичных экспериментальных данных по растворимости твердых фаз (табл. 3). Соответствующие значения химического потенциала Cu+ μ°(Cu+) при экспериментальных значениях температуры и давления представлены в табл. 4 и на фиг. 2. Видно, что значения μ°(Cu+), представленные Palmer (2011), противоречат весьма надежному значению, принятому в сводке Wagman et al. (1982) при стандартных условиях, а при повышенных температурах – данным Варьяш (1989) и настоящей работы. Поэтому в дальнейшем данным Palmer (2011) был придан нулевой статистический вес.
Таблица 3.
Термодинамические свойства твердых фаз, принятые в настоящей работе по Robie, Hemingway (1995)
| Минерал | ${\text{ }}{{\Delta }_{f}}G_{{298}}^{{\text{o}}},$ кДж моль–1 | ${\text{ }}S_{{298}}^{{\text{o}}},$ Дж моль–1 K–1 | V°, см3 моль–1 | ${\text{ }}{{\Delta }_{f}}H_{{298}}^{{\text{o}}}$, кДж моль–1 | $C_{p}^{^\circ }$(T, K) (273–1273 K), Дж моль–1 K–1 |
|---|---|---|---|---|---|
| Cu(кр.) | 0 | 33.14 ± 0.03 | 7.113 | 0 | 60.84 – 2.875 × 10–2T + 3.331 × 105 × × T–2 – 5.671 × 102T–0.5 + 1.420 × 10–5T2 |
| Cu2O(куприт) | –147.8 ± 0.1 | 92.4 ± 0.3 | 23.44 | –170.6 ± 0.1 | 4.26 × 102 – 2.508 × 10–1T + 4.898 × × 106T–2 – 6.078 × 103T–0.5 + 9.244 × 105T2 |
Таблица 4.
Химические потенциалы иона Cu+, μ°(Cu+), в Дж моль–1 , установленные в результате обработки первичных экспериментальных данных по растворимости Cu/Cu2O и результаты расчета с параметрами из табл. 5
| T, °C | P, бар | μ°(Cu+), Дж моль–1 | 2σ, Дж моль–1 | Твердые фазы | Источник | μ°(Cu+)model, Дж моль–1 |
|---|---|---|---|---|---|---|
| 25 | 1 | 49 980 | 200 | Cu2O | Wagman et al., 1982 | 49 980 |
| 19.5 | 1 | 45 685 | 336 | Cu2O | Palmer, 2011 | 50 200 |
| 25 | 1 | 45 526 | 171 | Cu2O | Palmer, 2011 | 49 979 |
| 50 | 1 | 45 509 | 124 | Cu2O | Palmer, 2011 | 48 892 |
| 51.8 | 1 | 45 310 | 311 | Cu2O | Palmer, 2011 | 48 808 |
| 75 | 1 | 45 400 | 133 | Cu2O | Palmer, 2011 | 47 637 |
| 100 | 1.0 | 44 666 | 286 | Cu2O | Palmer, 2011 | 46 204 |
| 150 | 4.8 | 41 618 | 324 | Cu2O | Palmer, 2011 | 42 843 |
| 200 | 15.5 | 39 325 | 362 | Cu2O | Palmer, 2011 | 38 933 |
| 250 | 39.8 | 37 517 | 902 | Cu2O | Palmer, 2011 | 34 648 |
| 300 | 85.9 | 36 097 | 329 | Cu2O | Palmer, 2011 | 30 216 |
| 350 | 165.3 | 36 649 | 716 | Cu2O | Palmer, 2011 | 25 347 |
| 300 | 500 | 26 789 | 1447 | Cu(кр.) | Варьяш, 1989 | 28 917 |
| 350 | 500 | 26 951 | 695 | Cu(кр.) | Варьяш, 1989 | 23 840 |
| 350 | 1000 | 26 829 | 870 | Cu(кр.) | Варьяш, 1989 | 22 324 |
| 450 | 500 | 7785 | 1244 | Cu(кр.) | Варьяш, 1989 | 3928 |
| 450 | 1000 | 17 101 | 1664 | Cu(кр.) | Варьяш, 1989 | 9139 |
| 300 | 85.9 | 27 777 | 4260 | Cu2O + Cu(кр.) | Наст. работа | 30 216 |
Фиг. 2.
Значения химического потенциала иона Cu+ по экспериментальным данным. Залитые точки соответствуют расчетным значениям с параметрами из табл. 5.

Значения энтропии $S_{{298}}^{^\circ }$ иона и его химического потенциала $\mu _{{298}}^{^\circ }$ при стандартных условиях были приняты согласно Wagman et al. (1982) и не участвовали в процессе оптимизации. Параметр Борна ω иона рассчитан, исходя из значения его кристаллохимического радиуса rx = 0.6 Å (Shannon, 1976). Величины теплоемкости Cp,298 и мольного объема V298 иона рассчитаны с использованием корреляционных зависимостей этих термодинамических параметров с энтропией, предложенных в работе Shock et al. (1997). Оптимизированные значения параметров модели HKF иона Cu+ представлены в табл. 5, а сравнение расчета с экспериментом – в табл. 4 и на фиг. 2.
Таблица 5.
Стандартные термодинамические свойства (298.15 K, 1 бар) и HKF параметры компонентов водного раствора, принятые (для OH–) и полученные (для Cu+ и CuO–) в настоящей работе
| Компо-нент | ${{\Delta }_{f}}G_{{298}}^{^\circ }$а | ${{\Delta }_{f}}H_{{298}}^{^\circ }$a | $S_{{298}}^{^\circ }$б | $C_{{p,\,298}}^{^\circ }$б | $V_{{298}}^{^\circ }$в | a1 × 10г | a2 × 10–2а | a3д | a4 × 10–4е | c1б | c2 × 10–4е | ω × 10–5а | Источник |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| OH– | –37 595 | –54 977 | –2.56 | –32.80 | –4.18 | 1.2527 | 0.0738 | 1.8423 | –2.7821 | 4.1500 | –10.346 | 1.7246 | Johnson et al., 1992 |
| Cu+ | 11 945 | 9.70 | 13.66 | –7.99 | 0.9243 | –5.5244 | 7.9213 | –2.5506 | 37.8575 | –8.9250 | 0.6653 | Наст. работа | |
| CuO– | –19 574 | –2.45 | –12.69 | –13.11 | 0.3673 | –6.8845 | 8.4559 | –2.4944 | –55.4517 | 25.7204 | 1.0433 | Наст. работа |
$Cu\left( {OH} \right)_{2}^{ - }$ (CuO–)
В щелочных условиях растворимость куприта определяется вторым гидроксокомплексом меди (I) ${\text{Cu}}\left( {{\text{OH}}} \right)_{2}^{ - }$. В рамках модели HKF этот комплекс принято записывать в виде дегидратированной частицы CuO–, этому формализму мы и будем следовать в дальнейшем.
Значения химического потенциала μ°(CuO–), полученные путем обработки имеющихся экспериментальных данных по растворимости куприта, представлены в табл. 6. Параметр Борна ω(CuO–) был принят по результатам квантово-химического расчета размера полости гидратированного иона ${\text{Cu}}\left( {{\text{OH}}} \right)_{2}^{ - }$ по методу SMD (Marenich et al., 2009), включенного в пакет Gaussian09 (Frisch M.J. et al., 2009). Значения энтропии $S_{{298}}^{{\text{o}}}$ иона CuO– и его химического потенциала $\mu _{{298}}^{{\text{o}}}$ при стандартных условиях, а также параметры с1 и c2 уравнения теплоемкости оптимизировались в программе OptimB (Shvarov, 2015) при некоторых заданных значениях Cp,298 и V298 этого иона. Затем эти последние уточнялись с учетом корреляционных зависимостей с энтропией, предложенных в работе Shock et al. (1997). Следующий итерационный цикл вновь включал оптимизацию $S_{{298}}^{{\text{o}}}$(CuO–) и $\mu _{{298}}^{{\text{o}}}$(CuO–), с1 и c2 с учетом полученных на предыдущем этапе значений Cp,298 и V298. Итерации сходятся довольно быстро, полученные значения параметров модели HKF иона CuO– представлены в табл. 5, а сравнение расчета с экспериментом – в табл. 6 и на фиг. 3.
Таблица 6.
Химические потенциалы иона CuO–, μ°(CuO–), в кДж моль–1, установленные в результате обработки первичных экспериментальных данных по растворимости меди и куприта Cu/Cu2O и результаты расчета с параметрами из табл. 5
| T, °C | P, бар | μ°(CuO–), кДж моль–1 | 2σ, Дж моль–1 | Источник | μ°(CuO–)модель, кДж моль–1 |
|---|---|---|---|---|---|
| 25 | 1 | –87.172 | 5.273 | Palmer, 2011 | –81.899 |
| 50 | 1 | –81.912 | 0.366 | Palmer, 2011 | –81.546 |
| 51.8 | 1 | –79.513 | –1.998 | Palmer, 2011 | –81.511 |
| 75 | 1 | –80.430 | –0.469 | Palmer, 2011 | –80.898 |
| 100 | 1.01 | –82.277 | 2.398 | Palmer, 2011 | –79.878 |
| 200 | 15.55 | –69.573 | –2.016 | Palmer, 2011 | –71.588 |
| 250 | 39.76 | –60.411 | –4.189 | Palmer, 2011 | –64.600 |
| 300 | 87.88 | –52.524 | –2.487 | Palmer, 2011 | –55.010 |
| 350 | 165.29 | –40.162 | –0.018 | Palmer, 2011 | –40.180 |
| 150 | 4.76 | –80.041 | 3.432 | Варьяш, 1989 | –76.609 |
| 200 | 15.55 | –73.655 | 2.066 | Варьяш, 1989 | –71.588 |
| 250 | 39.76 | –69.783 | 5.184 | Варьяш, 1989 | –64.600 |
| 275 | 59.46 | –68.717 | 8.516 | Варьяш, 1989 | –60.202 |
| 300 | 85.88 | –56.217 | 1.207 | Варьяш, 1989 | –55.010 |
| 300 | 85.88 | –56.225 | 1.215 | Наст. работа | –55.010 |
Фиг. 3.
Экспериментальные значения химического потенциала иона CuO– по экспериментальным данным по растворимости куприта. Залитые точки соответствуют расчетным значениям с параметрами из табл. 5.

Нейтральный гидроксокомплекс Cu(OH)(H2O)7 (CuOH,aq)
Существование нейтрального гидроксокомплекса CuOH,aq в плотных водных растворах обнаружено Palmer (2011) лишь при температурах до 100°C. При более высоких температурах его вклад в растворимость куприта нивелируется присутствием ионов Cu+ или CuO–. В малоплотных водных флюидах (${{\rho }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} \leqslant $ 0.2 г см–3) из-за уменьшения диэлектрической проницаемости воды присутствие ионов в растворе существенно снижается, так что в этих условиях растворимость определяется нейтральным комплексом. Экспериментальные данные по растворимости в таких областях плотности водного растворителя можно использовать для установления термодинамических свойств нейтрального гидроксокомплекса CuOH,aq.
В настоящее время имеются две экспериментальные работы, посвященные растворимости куприта в малоплотных флюидах. В работе Pocock, Stewart (1963) изучалась растворимость куприта в сверхкритическом паре H2O при температуре ≈620°C и давлениях 186–310 бар, соответствующих плотностям водного растворителя 0.06–0.09 г см–3. В работе Palmer (2011) исследовалась растворимость куприта при температурах 200–350°С и давлениях ниже давления насыщенного пара H2O (${{\rho }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} \leqslant $ 0.015–0.1 г см–3), а также при сверхкритической температуре 400°C и давлениях 93–190 бар, соответствующих плотностям ${{\rho }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 0.035–0.1 г см–3. Зависимость изотерм растворимости от фугитивности воды при этих температурах (фиг. 4) свидетельствует о существенном влиянии гидратации на растворимость, так что реакцию растворения следует записывать в виде:
Фиг. 4.
Зависимость равновесной моляльной концентрации меди во флюиде от фугитивности воды при растворении куприта Cu2O в сверхкритическом водном паре при 400°C (Palmer, 2011) и 620°C (Pocock, Stewart, 1963).
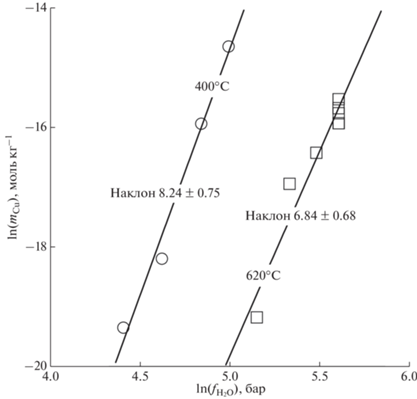
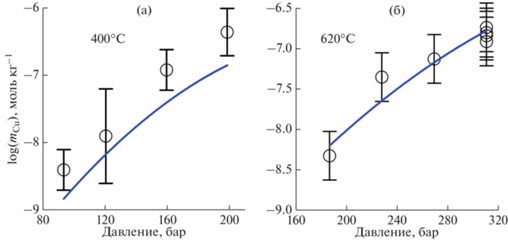
Поскольку имеющиеся экспериментальные данные охватывают весьма широкий диапазон плотностей растворителя, недоступный модели HKF, описание растворимости куприта с образованием нейтрального гидроксокомплекса проводилось на основе уравнения состояния AD. Проведенный анализ показал, что наилучшее описание всего набора экспериментальных данных реализуется при использовании стехиометрии водного комплекса CuOH(H2O)7. Оптимизированные параметры этого комплекса приведены в табл. 7, а сравнение расчета с экспериментом на фиг. 5.
Таблица 7.
Термодинамические свойства нейтрального гидроксокомплекса Cu(I), рассчитанные в настоящей работе
| Компонент | Свойства в состоянии идеального газа | Параметры УС AD | ||||
|---|---|---|---|---|---|---|
| ${{\Delta }_{f}}G_{{298}}^{^\circ },$ кДж моль–1 | $S_{{298}}^{^\circ },$ Дж моль–1 K–1 | Cp, 298, Дж моль–1 K–1 | ξ | a, см3 г–1 | b, см3 K0.5 г–1 | |
| CuOH(H2O)7 | –1818.074 ± 16.9 | 280.5 ± 99.9 | 951 ± 108 | –2.92 ± 0.40 | –50.91 ± 17.28 | 49.45 ± 12.92 |
Фиг. 5.
Растворимость куприта с образованием нейтрального гидроксокомплекса. Точки – эксперимент: а) в малоплотном водном флюиде (${{\rho }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 0.035–0.1 г см–3) при T = 400°C (Palmer, 2011); б) – в малоплотном водном флюиде (${{\rho }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 0.05–0.09 г см–3) при T = 620°C (Pocock, Sewart, 1963). Линии – расчет с использованием данных для CuOH(H2O)7 из табл. 7.
ЗАКЛЮЧЕНИЕ
Рекомендуемые в настоящей статье значения термодинамических параметров для иона Cu+ и гидроксокомплекса ${\text{Cu(OH)}}_{2}^{ - }$ (CuO–) позволяют надежно описывать их термодинамические свойства в широком диапазоне температур (0–600°С) и давлений (1–3000 бар) в рамках модели HKF. Свойства нейтрального комплекса Cu(OH)(H2O)7 определены с использованием модели AD (Akinfiev, Diamond, 2003). Они с достаточной точностью воспроизводят экспериментальные данные в малоплотных флюидах (${{\rho }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 0.01–0.09 г см–3), но для их надежной экстраполяции на высокие давления требуется дополнительное экспериментальное подтверждение.
Фиг. 6 иллюстрирует резкое увеличение растворимости меди (Cuкр) в воде при росте температуры. При этом увеличивается роль иона и снижается влияние второго гидроксокомплекса ${\text{Cu(OH)}}_{2}^{ - }$. Показанные на фигуре соотношения отвечают редокс-буферу Ni–NiO. Увеличение фугитивности кислорода на 4 порядка (примерно соответствующее буферу гематит–магнетит) приводит к увеличению растворимости меди на порядок.
Фиг. 6.
Рассчитанная растворимость металлической меди Cu(мет.) в присутствии редокс-буфера Ni–NiO в зависимости от pH при 300°С, Pнас., 450°C, 1 кбар и 600°C, 1.5 кбар. Пунктиром показано положение точки нейтральности при заданных T, P.

Все приведенные соображения относятся к простой системе Cu–O–H без участия дополнительных лигандов (Cl–, HS– и др.). Их роль рассматривается в статье Рубцовой и др. (2023) этого же номера журнала.
Список литературы
Акинфиев Н.Н, Воронин М.В., Зотов А.В., Прокофьев В.Ю. Экспериментальное исследование устойчивости хлорборатного комплекса и термодинамическое описание водных компонентов в системе B–Na–Cl–O–H до 350°С // Геохимия. 2006. № 9. С. 937–949.
Варьяш Л.Н. Экспериментальное изучение равновесий в системе Cu–Cu2O–H2O в интервале температур 150–450°C // Геохимия. 1989. № 3. С. 412–422.
Рубцова Е.А., Тагиров Б.Р. и др. Совместная растворимость Cu и Ag в хлоридных гидротермальных флюидах (350–650°C, 1000–1500 бар) // Геология руд. месторождений. 2023. В печати.
Akinfiev N.N., Diamond L.W. Thermodynamic description of aqueous nonelectrolytes at infinite dilution over a wide range of state parameters // Geochim. Cosmochim. Acta, 2003. V. 67. №. 4. P. 613–627.https://doi.org/10.1016/s0016-7037(02)01141-9
Akinfiev N.N., Plyasunov A.V. Application of the Akinfiev–Diamond equation of state to neutral hydroxides of metalloids (B(OH)3, Si(OH)4, As(OH)3) at infinite dilution in water over a wide range of the state parameters, including steam conditions. // Geochim. Cosmochim. Acta, 2014. V. 126. P. 338–351.https://doi.org/10.1016/j.gca.2013.11.013
Born, Von M. Volumen und Hydratationswärme der Ionen. // Zeitschr. Physik, 1920. V. 1. P. 45–48.
Frisch M.J. et al. Gaussian 09, Revision C.01. Gaussian, Inc., Wallingford CT, 2009.
Helgeson H.C., Kirkham D.H., Flowers G.C. Theoretical prediction of the thermodynamic behavior of aqueous electrolytes at high pressures and temperatures: IV. Calculation of activity coefficients, osmotic coefficients, and apparent molal and standard and relative partial molal properties to 600°C and 5 kb // Am. Jour. Sci. 1981. V. 291. P. 1249–1516.
Helgeson H.C., Kirkham D.H., Flowers G.C. Theoretical prediction of the thermodynamic behavior of aqueous electrolytes by high pressures and temperatures; IV. Calculation of activity coefficient, osmotic coefficients, and apparent molal and standard and relative partial molal properties to 600°C and 5 KB // Am. Jour. Sci. 1981. V. 291. P. 1249–1516.
Johnson J.W., Oelkers E.H., Helgeson H.C. SUPCRT92: A software package for calculating the standard molal thermodynamic properties of minerals, gases, aqueous species, and reactions from 1 to 5000 bars and 0° to 1000°C // Comp. Geosci. 1992. V. 18. P. 899–947.
Marenich A.V., Cramer C.J., Truhlar D.G. Universal solvation model based on solute electron density and on a continuum model of the solvent defined by the bulk dielectric constant and atomic surface tensions // J. Phys. Chem. B. 2009. V. 113. P. 6378–6396.
Messerly R.A., Yoon T.J., Jadrich R.B., Currier R.P., Maerzke K.A. Elucidating the temperature and density dependence of silver chloride hydration numbers in high-temperature water vapor: A first-principles molecular simulation study // Chem. Geol. V. 594. P. 120766. https://doi.org/10.1016/j.chemgeo.2022.120766
Palmer D.A. Solubility Measurements of Crystalline Cu2O in Aqueous Solution as a Function of Temperature and pH // J. Solution Chem. 2011. V. 40. P. 1067–1093. https://doi.org/10.1007/s10953-011-9699-x
Pocock F. J., Stewart J. F. The Solubility of Copper and Its Oxides in Supercritical Steam // Journal of Engineering for Power, 1963. V. 85. № 1. P. 33–44. https://doi.org/10.1115/1.3675213
Robie R.A., Hemingway B.S. Thermodynamic properties of minerals and related substances at 298.15 and 1 bar (105 pascals) pressure and at high temperatures // U. S. Geol. Surv. Bull. 1995. P. 2131.
Shannon R.D. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides // Acta Cryst. V. A32. P. 751–767.
Shock E.L., Helgeson H C., Sverjensky D.A. Calculation of the thermodynamic properties of aqueous species at high pressures and temperatures: Standard partial molal properties of inorganic neutral species // Geochim. Cosmochim. Acta. 1989. V. 53. P. 2157–2183.
Shock E.L., Helgeson H.C. Calculation of the thermodynamic and transport properties of aqueous species at high pressures and temperatures: Correlation algorithms for ionic species and equation of state predictions to 5 kb and 1000°C // Geochim. Cosmochim. Acta. 1988. V. 52. P. 2009–2036.
Shock E.L., Sassani D.C., Willis M., Sverjensky D.A. Inorganic species in geologic fluids: Correlations among standard molal thermodynamic properties of aqueous ions and hydroxide complexes // Geochim. Cosmochim. Acta. 1997. V. 61. P. 907–950.
Shock E.L., Sassani D.C., Willis M., Sverjensky D.A. Inorganic species in geologic fluids: Correlations among standard molal thermodynamic properties of aqueous ions and hydroxide complexes // Geochim. Cosmochim. Acta. 1997. V. 61. P. 907–950.
Shvarov Yu.V. A suite of programs, OptimA, OptimB, OptimC, and OptimS compatible with the Unitherm database, for deriving the thermodynamic properties of aqueous species from solubility, potentiometry and spectroscopy measurements // Applied Geochemistry. 2015. V. 55. P. 17–27.
Sverjensky D.A., Shock E.L., Helgeson H.C. Prediction of thermodynamic properties of aqueous metal complexes to 1000°C and 5 kb // Geochim. Cosmochim. Acta. 1997. V. 61. P. 1359–1412.
Sverjensky D.A., Shock E.L., Helgeson H.C. Prediction of thermodynamic properties of aqueous metal complexes to 1000°C and 5 kb // Geochim. Cosmochim. Acta. 1997. V. 61. P. 1359–1412.
Tagirov B.R., Zotov A.V., Akinfiev N.N. Experimental study of dissociation of HCl from to 500°C and from 500 to 2500 bars: Thermodynamic properties of HCl(aq) // Geochim. Cosmochim. Acta. 1997. V. 61. P. 4267–4280.
Tanger IV J.C., Helgeson H.C. Calculation of the thermodynamic and transport properties of aqueous species at high pressures and temperatures: Revised equations of state for standard partial molal properties of ions and electrolytes. // Amer. J. Sci., 1988. V. 288. P. 19–98.
Wagman D.D., Evans W.H., et al. The NBS tables of chemical thermodynamic properties // Phys. Chem. Ref. Data. 1982. V. 11. Suppl. №. 2.
Wagner W., Pruß A. The IAPWS formulation for the thermodynamic properties of ordinary water substances for general and scientific use // J. Phys. Chem. Ref. Data. 2002. V. 31. P. 387–535.
Дополнительные материалы отсутствуют.
Инструменты
Геология рудных месторождений


