Геология рудных месторождений, 2023, T. 65, № 1, стр. 15-31
Совместная растворимость меди и серебра в хлоридных гидротермальных флюидах (350–650°С, 1000–1500 бар)
Е. А. Рубцова a, Б. Р. Тагиров a, *, Н. Н. Акинфиев a, В. Л. Реуков a, Л. А. Королёва a, И. Ю. Николаева b, М. Е. Тарнопольская b, В. А. Волчёнкова c
a Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН
119017 Москва, Старомонетный пер., 35, Россия
b МГУ им. М.В. Ломоносова, геологический факультет
119991 Москва, Ленинские горы, д.1, Россия
c Институт металлургии и материаловедения им. А.А. Байкова РАН
119334 Москва, Ленинский пр-т, 49, Россия
* E-mail: boris1t@yandex.ru
Поступила в редакцию 05.05.2022
После доработки 22.08.2022
Принята к публикации 01.09.2022
- EDN: LBEHUE
- DOI: 10.31857/S0016777023010082
Аннотация
Совместная растворимость Cu(к) и Ag(к) измерена в кислых хлоридных растворах при 350°С/1000 бар, 450°С/1000 бар и 653°С/1450 бар в широком диапазоне концентраций хлоридов (0.02m HCl + + (0–15m) NaCl). Опыты выполнены с использованием автоклавной (350, 450°С) и ампульной (653°С) методик, концентрации растворенных металлов определялись после закалки. Получены значения константы реакции совместного растворения металлов, связывающей основные формы переноса меди и серебра: ${\text{C}}{{{\text{u}}}_{{\left( {\text{к}} \right)}}} + {\text{AgCl}}_{2}^{ - } = {\text{A}}{{{\text{g}}}_{{\left( {\text{к}} \right)}}} + {\text{CuCl}}_{2}^{ - }\,\,K_{{{\text{(Cu}} - {\text{Ag)}}}}^{^\circ }\,{\text{.}}$ Рассчитанные значения константы реакции не зависят от содержания хлоридов. Известно, что для серебра в изученном диапазоне концентраций хлоридов доминирует комплекс ${\text{AgCl}}_{2}^{ - }$. Таким образом, основной формой нахождения меди при всех составах растворов, вплоть до 47 мас. % NaCl, является комплекс ${\text{CuCl}}_{2}^{ - }$. Определены следующие значения константы реакции совместного растворения металлов: lg$K_{{{\text{(Cu}} - {\text{Ag)}}}}^{^\circ }$ = 2.65 ± 0.20 (350°С/1000 бар), 2.28 ± 0.10 (450°С/1000 бар), 1.49 ± 0.34 (653°С/1450 бар). Полученные в настоящей работе результаты и литературные данные в интервале температур 200–900°С при давлении до 2000 бар описываются уравнением плотностной модели lg $K_{{{\text{(Cu}} - {\text{Ag)}}}}^{^\circ }$ = 1.066 + + 1.108 × 103T(K)–1 + 3.585lgd(w) – 1.443lg d(w) × 103T(K)–1, где d(w) – плотность воды. Согласно полученным данным, в хлоридных растворах медь существенно более растворима по сравнению с серебром, но разница в растворимости уменьшается с ростом температуры. Надежные литературные данные по константе растворения серебра позволяют рассчитать константу растворения меди: ${\text{C}}{{{\text{u}}}_{{\left( {\text{к}} \right)}}} + {\text{HC}}{{{\text{l}}}_{{({\text{p - p}})}}}{\text{ + C}}{{{\text{l}}}^{ - }} = {\text{CuCl}}_{2}^{ - }{\text{ + 0}}{\text{.5}}{{{\text{H}}}_{{{\text{2}}\left( {{\text{р - р}}} \right){\text{\;}}}}}\,\,\,\,\,\,\,K_{{{\text{(Cu)}}}}^{^\circ }$, lg $K_{{{\text{(Cu)}}}}^{^\circ }$ = 1.39 ± 0.20 (350°С, 1000 бар), 1.91 ± 0.10 (450°С, 1000 бар), 2.06 ± 0.34 (653°С, 1450 бар). Выполнено согласование экспериментальных значений $K_{{{\text{(Cu)}}}}^{^\circ }$ с литературными данными в рамках плотностной модели. Определены параметры уравнения, которое позволяет рассчитывать значения константы реакции растворения меди при температуре до 800°С и давлении до 2000 бар: lg $K_{{{\text{(Cu)}}}}^{^\circ }$ = 6.889 – 3.298 × × 103T(K)–1 + 8.694 lg d(w) – 4.807lgd(w) × 103T(K)–1. Рассчитана растворимость халькопирита в системе с минеральными буферами пирит–гематит–магнетит и калиевый полевой шпат–мусковит–кварц.
ВВЕДЕНИЕ
Порфировые месторождения являются важнейшим источником Cu, обеспечивая около 75% мировой добычи этого металла. Изучение газово-жидких включений позволило установить, что гидротермальные флюиды, которые переносили Cu и другие металлы во флюидно-магматических системах при образовании порфировых месторождений, имели хлоридный состав при преобладающей роли NaCl. Концентрация хлоридов в гомогенном высокотемпературном металлоносном флюиде, отделяющемся от остывающей магмы, составляла 4–10 мас. % экв.-NaCl. При остывании и снижении давления гомогенный флюид “вскипал” с образованием рассола с соленостью 30–70 мас. % экв.-NaCl, сосуществующего с малоплотной паровой фазой (Heinrich et al., 2004; Audetat et al., 2008; Sillitoe, 2010). Помимо порфировых месторождений, существенные количества металлов могут содержаться в линзах плотных рассолов, удерживаемых пористыми породами под действующими вулканами. Такие рассолы рассматриваются в качестве потенциального источника Cu и других металлов (Blundy et al., 2021). Для построения моделей рудообразования в порфировых системах и оценки содержания Cu в рудах гидротермальных месторождений, металлоносных хлоридных флюидах и рассолах необходимы данные по составу и устойчивости растворенных форм Cu.
В настоящее время установлено, что основными формами переноса Сu при высоких (около- и сверхкритических РТ-параметрах) являются хлоридные комплексы (напр., Zotov et al., 1995). Эксперименты по изучению хлоридного комплексообразования Cu в гидротермальных растворах при повышенных температурах выполнены методами растворимости (Crerar, Barnes, 1976; Варьяш, 1991; Xiao et al., 1998; Liu et al., 2001; Alex, Zajacz, 2022), потенциометрии (Николаева и др., 1974) и спектрофотометрии (Liu et al., 2002). Кроме того, получены данные о состоянии Cu в хлоридных гидротермальных растворах с использованием рентгеновской спектроскопии поглощения XAS (Brugger et al., 2007; Schmidt et al., 2018). На основании полученных данных определены параметры модели HKF (Хелгесон–Киркхэм–Флауэрс), позволяющие рассчитывать значения термодинамических свойств хлоридных комплексов Cu при параметрах существования гидротермальных систем (Акинфиев, Зотов, 2001; Liu, McPhail, 2005; Brugger et al., 2007). Экспериментальные данные интерпретированы с использованием комплексов состава CuCl(р-р), ${\text{СuCl}}_{2}^{ - }$ и ${\text{СuCl}}_{3}^{{2 - }}$ в качестве основных форм нахождения Cu при до- и близкритических РТ-параметрах (400°С/600 бар) и составах растворов вплоть до 15.6m NaCl. Результаты опытов по растворимости, выполненных при 900°С/2000 бар (Alex, Zajacz, 2022), интерпретированы с привлечением комплекса NaСuCl2(p-р). Вместе с тем, несмотря на внушительное количество работ, существуют проблемы, нуждающиеся в разрешении. Первая касается количества частиц, необходимых для термодинамического описания растворимости минералов Cu при повышенных температурах и давлениях. Данные, полученные для других элементов подгруппы меди – Au (Zotov et al., 2018; Tagirov et al., 2019) и Ag (Zotov et al., 2020), свидетельствуют о преобладании единственного комплекса состава MeCl$_{2}^{ - }$ при температурах 350°С и выше вплоть до концентрации насыщения NaCl, а для Au – и в безводных хлоридных расплавах. Эта модель находится в противоречии со значимым вкладом комплексов ${\text{СuCl}}_{3}^{{2 - }}$ и NaСuCl2(p-р) в перенос Cu при высоких концентрациях хлоридов. Вторая проблема – отсутствие надежных данных по состоянию Cu в сверхкритических (относительно критических параметров воды) флюидах. Все экспериментальные данные, которые позволяют получить количественную информацию по устойчивости хлоридных комплексов Cu, относятся к докритическим температурам и давлениям. Это не позволяет надежно экстраполировать данные на условия, в которых осуществляется перенос Сu и рудообразование в порфировых системах. Поэтому задачи настоящей работы состояли в (i) определении состава основных форм нахождения Cu в широком диапазоне концентрации хлоридов – от разбавленных растворов до концентраций, близких к насыщению по NaCl, (ii) получении ключевых значений констант устойчивости хлоридных комплексов для около- и сверхкритических РТ-параметров и (iii) описание вновь полученных и надежных литературных данных с использованием уравнения плотностной модели, позволяющей рассчитывать константы реакций в широком диапазоне температур и давлений.
ОБОСНОВАНИЕ ЭКСПЕРИМЕНТАЛЬНОГО МЕТОДА
Реакцию растворения металла 1б подгруппы с образованием комплекса ${\text{MeCl}}_{2}^{ - }$ можно представить в виде
(1)
${\text{М}}{{{\text{е}}}_{{{\text{(к)}}}}} + {\text{HCl}}_{{({\text{p - p)}}}}^{{}} + {\text{C}}{{{\text{l}}}^{ - }} = {\text{МеCl}}_{2}^{ - } + {\text{0}}{\text{.5}}{{{\text{H}}}_{{{\text{2}}\left( {{\text{р - р}}} \right)}}}.$Для надежного определения константы реакции (1) необходимо точно контролировать окислительный потенциал системы (или концентрацию растворенного водорода (m(H2), моль (кг H2O)–1), кислотность экспериментальных растворов (рН или концентрацию ионной пары HCl(р-р)) и активность Cl– (а(Cl–)). Благородные металлы – элементы подгруппы меди (Ag, Au) – слабо растворимы в кислых растворах хлоридов, и растворение металла слабо влияет на окислительный потенциал системы, рН и а(Cl–). Эти параметры, с небольшой поправкой на растворимость металла, могут быть точно рассчитаны исходя из загруженных в экспериментальную систему количеств вещества. Введение в систему известного количества водорода, снижающего растворимость, позволяет повысить точность рассчитанных значений констант реакции. В отличие от благородных металлов, реакция растворения Cu идет “до конца” (до практически полного исчерпания свободной кислоты) даже в восстановительных условиях. Таким образом, простое измерение растворимости Cu не позволяет получить значения константы реакции (1) с точностью, достаточной для термодинамических расчетов, из-за высокой погрешности рассчитанных значений рН и m(HCl(р-р)).
В настоящей работе для определения константы реакции растворения Cu
(2)
$\begin{gathered} {\text{C}}{{{\text{u}}}_{{\left( {\text{к}} \right)}}} + {\text{HCl}}_{{({\text{p - p)}}}}^{{}} + {\text{C}}{{{\text{l}}}^{ - }} = \\ = \,\,{\text{CuCl}}_{2}^{ - } + {\text{0}}{\text{.5}}{{{\text{H}}}_{{{\text{2}}\left( {{\text{р - р}}} \right)}}}\,\,\,\,\,K_{{({\text{Cu)}}}}^{^\circ } \\ \end{gathered} $(3)
${\text{C}}{{{\text{u}}}_{{\left( {\text{к}} \right)}}} + {\text{AgCl}}_{2}^{ - } = {\text{A}}{{{\text{g}}}_{{\left( {\text{к}} \right)}}} + {\text{CuCl}}_{2}^{ - }\,\,\,\,\,\,\,\,K_{{({\text{Cu - Ag)}}}}^{^\circ }{\text{.}}$Из реакции (3) исключены водород, хлорид-ион и соляная кислота. Поскольку взаимная растворимость Cu и Ag при температурах существования гидротермальных систем составляет первые ат. % (Murray, 1984), что находится в пределах погрешности опытов по растворимости, а состав и заряды комплексов в правой и левой частях уравнения совпадают (ΔZ 2 = 0), константу реакции (3) можно записать в виде
(4)
${\text{lg}}\,K_{{{\text{(Cu}} - {\text{Ag)}}}}^{^\circ } = {\text{ lg}}\,m\left( {{\text{CuCl}}_{2}^{ - }} \right)--{\text{lg}}\,m\left( {{\text{AgCl}}_{2}^{ - }} \right).$Таким образом, для определения значения $K_{{({\text{Cu}} - {\text{Ag)}}}}^{^\circ }$ достаточно измерить концентрации растворенных металлов. Устойчивость комплекса ${\text{AgCl}}_{2}^{ - }$ установлена с высокой степенью надежности путем интерпретации данных по растворимости AgCl(к) (Seward 1976; Zotov et al., 1995; Tagirov et al., 1997). Комбинация константы реакции растворения Ag, рассчитаннoй с использованием надежных значений термодинамических свойств комплекса ${\text{AgCl}}_{2}^{ - }$
(5)
${\text{A}}{{{\text{g}}}_{{\left( {\text{к}} \right)}}} + {\text{HCl}}_{{({\text{p - p)}}}}^{{}} + {\text{C}}{{{\text{l}}}^{ - }} = {\text{AgCl}}_{2}^{ - } + {\text{0}}{\text{.5}}{{{\text{H}}}_{{{\text{2}}\left( {{\text{р - р}}} \right)}}}\,\,K_{{({\text{Ag)}}}}^{^\circ }$(6)
$\begin{gathered} {\text{lg}}K_{{{\text{(Ag)}}}}^{^\circ } = {\text{lg}}\,a\left( {{\text{AgCl}}_{2}^{ - }} \right){\text{ + 0}}{\text{.5 lg}}\,a{\text{(}}{{{\text{H}}}_{{{\text{2(}}}}}{{_{{\text{р}}}}_{{{\text{ - р}}}}}_{{\text{)}}}{\text{)}} - \\ - \,\,{\text{lg}}\,a{\text{(HC}}{{{\text{l}}}_{{\text{(}}}}{{_{{\text{р}}}}_{{{\text{ - р)}}}}}{\text{)}} - {\text{lg}}\,а\left( {{\text{C}}{{{\text{l}}}^{ - }}} \right) = {\text{lg}}\,m\left( {{\text{AgCl}}_{2}^{ - }} \right){\text{ + }} \\ {\text{ + }}\,\,{\text{0}}{\text{.5}}\,{\text{lg}}\,m{\text{(}}{{{\text{H}}}_{{{\text{2(}}}}}_{{{\text{р - р)}}}}{\text{)}} - {\text{lg}}\,m{\text{(HC}}{{{\text{l}}}_{{\text{(}}}}_{{{\text{р - р)}}}}{\text{)}} - \\ - \,\,{\text{lg}}\,m\left( {{\text{C}}{{{\text{l}}}^{ - }}} \right){\text{ (в}}\,\,{\text{силу}}\,\,{\text{условия}}\,\,\Delta {{Z}^{{\text{2}}}}{\text{ = 0),}} \\ \end{gathered} $(7)
$\begin{gathered} {\text{lg}}\,K_{{({\text{Cu)}}}}^{^\circ } = {\text{lg}}\,m{\text{(CuCl}}_{2}^{ - }{\text{) + 0}}{\text{.5}}\,{\text{lg}}\,m{\text{(}}{{{\text{H}}}_{{{\text{2}}\left( {{\text{р - р}}} \right)}}}{\text{)}} - \\ - \,\,{\text{lg}}\,m{\text{(HC}}{{{\text{l}}}_{{{\text{(р - р)}}}}}{\text{)}} - {\text{lg}}\,m{\text{(C}}{{{\text{l}}}^{ - }}{\text{) }}{\text{.}} \\ \end{gathered} $Кроме того, в случае, если состав доминирующего комплекса Cu изменится (например, преобладающей частицей станет ${\text{CuCl}}_{3}^{{2 - }}$), рассчитанные значения $K_{{({\text{Cu}} - {\text{Ag)}}}}^{^\circ }$ будут систематически меняться (расти) при увеличении концентрации соли. Таким образом, преобладание комплекса ${\text{CuCl}}_{2}^{ - }$ является условием постоянства значений константы совместного растворения $K_{{({\text{Cu}} - {\text{Ag)}}}}^{^\circ }.$
В настоящей работе было выполнено две серии опытов. Первая являлась методической и заключалась в определении растворимости каждого из металлов в отдельности. Результаты определения содержания Сu и Ag, полученные разными методами, сравнивались между собой, и выбирался оптимальный метод. Для Ag полученные данные сравнивались с надежными литературными с целью обосновать правильность определения растворимости с образованием базовой частицы ${\text{AgCl}}_{2}^{ - }.$ Во второй, основной серии опытов, изучалась совместная растворимость Cu и Ag.
МЕТОДИКА ЭКСПЕРИМЕНТА
Эксперименты выполнены по классической автоклавной методике (350 и 450°С) и ампульной методике (653°С) с определением содержания растворенного компонента после закалки опыта. Для опытов при температуре 350, 450°С и давлении 1000 бар использовались титановые автоклавы (сплав ВТ-8) объемом ∼20 см3. Предварительно внутреннюю поверхность автоклавов пассивировали 10% раствором HNO3 при 450°С и 1000 бар. Растворы для опытов готовили на основе дистиллированной воды из NaCl квалификации “ос. ч.” и фиксаналов 0.1 M HCl. В методических опытах по раздельному растворению металлов в экспериментальную систему вводился водород, который получали непосредственно в автоклаве при реакции навески Al с водой. В верхней части автоклава на титановой перегородке подвешивали кусочки медной полосы и/или Ag-проволоки (99.9% металла). Давление задавали степенью заполнения автоклава раствором, учитывая плотность растворов NaCl при соответствующей температуре (программа SoWat, Driesner, Heinrich, 2007). Автоклавы заполняли при свободном доступе воздуха.
Заполненные автоклавы помещали в заранее разогретую печь. Температура измерялась термопарой нихросил–нисил (ООО “Обнинская термоэлектрическая компания”), откалиброванной на предприятии, и поддерживалась с точностью ±1°С. Длительность экспериментов составляла от нескольких часов до 14 суток. По окончании опыта автоклавы закаливали в холодной воде. Раствор готовили к анализу двумя способами:
1) Сначала из автоклава сливали конденсат, к которому добавляли равный объем теплой царской водки. Пустой автоклав заливали царской водкой и на 0.5–1 час ставили на теплую электрическую плитку. Затем сливали царскую водку из автоклава в отдельную пробирку и разбавляли равным объемом воды. Таким образом получали две пробы на основе 50% царской водки, отвечающие конденсату и смыву;
2) Из автоклава извлекали конденсат. В пустой автоклав заливали раствор, полученный смешением в пропорции 1 : 1 NH4OH 25 мас. % и насыщенного раствора Na2S2O3. Раствор оставляли в автоклаве на 30 минут, после чего добавляли в пробирку с конденсатом. Этот способ использовался для полного переведения серебра в раствор (Seward, 1976).
Опыты при температуре 653°С выполнены с использованием ампульной методики. На дно серебряной ампулы (диаметр 8 мм, длина 40 мм, толщина стенок 0.2 мм) помещался кусочек Cu-пластины и взвешенное количество раствора NaCl + HCl. Масса раствора рассчитывалась исходя из плотности растворов NaCl при параметрах опыта. Загруженные ампулы заваривались аргонодуговой сваркой при охлаждении водой. Ампулы помещались на дно автоклава из стали ЭП-455 с уплотнением по обтюратору с медной прокладкой (изготовлен в ИЭМ РАН). В верхней части автоклава уплотнялся капилляр из нержавеющей стали, соединенный вне печки с тензопреобразователем избыточного давления D250 (верхний предел измеряемого давления 2500 бар). Датчик давления калибровался относительно образцового манометра KELLER, точность измерения давления ± 2 бар. Температура измерялась термопарой нихросил–нисил. Конец термопары закреплялся снаружи автоклава на уровне нижней его трети. Точность измерения температуры ± 2°С. По окончании опыта автоклав закаливался в холодной воде. Из ампул извлекался экспериментальный раствор, кусочек медной пластины, после чего ампулы заполнялись раствором тиосульфата Na и аммиака и выдерживались 10 минут. Конденсат и смыв объединялись.
Концентрации Cu и Ag определяли методами атомно-абсорбционной спектрометрии AAC в пламенном варианте и масс-спектрометрии с индуктивно связанной плазмой ИСП-МС. Анализ методом ААС выполняли на кафедре геохимии геологического факультета МГУ им. М.В. Ломоносова на атомно-абсорбционном спектрометре высокого разрешения с источником сплошного спектра (ксеноновая лампа) ContrAA(r)700 фирмы Analytik Jena, а для экспериментальных растворов опыта, выполненного при 653°С – в Институте металлургии и материаловедения им. А.А. Байкова ИМЕТ РАН (атомно-абсорбционный спектрофотометр iCE 3500, Thermo Fisher Scientific). Для того чтобы избежать систематической ошибки при определении содержаний металлов, в ИМЕТ РАН анализ растворов проводили после сильного разбавления проб, а химический состав стандартных растворов, использованных при построении градуировочной кривой, отвечал составу проб. Пределы обнаружения для обоих элементов – 0.01 ppm, воспроизводимость ±5%. Анализ методом ИСП-МС выполняли в ИГЕМ РАН на приборе NexION 2000C и в МГУ им. М.В. Ломоносова на приборе Element-2 Thermo Scientific. Содержание металлов в конденсате и смыве суммировали и относили к массе воды в автоклаве. Кроме того, растворимость металлов определяли по потере веса проволочек.
Состав твердых фаз (Cu, Ag) после опыта при 653°С определяли методом сканирующей электронной микроскопии СЭМ/ЭДС с использованием микроскопа JSM-5610LV, оснащенного энергодисперсионным спектрометром (ЭДС) X-Max 80.
ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ
В качестве стандартного состояния для воды и твердых фаз принято состояние чистого вещества при PT-параметрах опытов, для компонентов водного раствора – состояние идеального бесконечно разбавленного раствора, имеющего концентрацию 1 моль (кг H2O)–1. Коэффициенты активности нейтральных частиц и ионов в водном растворе рассчитывали согласно уравнению Дебая–Хюккеля во втором приближении
(8)
$\lg \mathop \gamma \nolimits_i = - \frac{{Az_{i}^{2}\sqrt I }}{{1 + 4.5B\sqrt I }} - \lg (1 + 0.018m*),$При моделировании растворения халькопирита и Au(к) в присутствии буферов пирит (FeS2)–гематит (Fe2O3)–магнетит (Fe3O4) и калиевый полевой шпат (KAlSi3O8)–мусковит (KAl3Si3O12H2)–кварц (SiO2) термодинамические свойства халькопирита, пирита, KCl°, КOH° и частиц серы принимали согласно SUPCRT92, оксидов – по (Robie and Hemingway, 1995), силикатов – по (Berman et al., 1988) с поправками (Sverjensky et al., 1997), термодинамические свойства растворенных частиц Au и Сu (кроме ${\text{CuCl}}_{2}^{ - }$) – по (Акинфиев, Зотов, 2001 и 2010).
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА
Методические опыты по раздельному растворению Cu и Ag
Результаты опытов представлены в табл. 1. В целом можно отметить хорошее согласие данных метода потери веса и ИСП-МС. Для Ag максимальное расхождение составляет 0.2 л.е. (один опыт), для остальных опытов согласие находится в пределах 0.1 л.е. Оптимальным реагентом для смыва Ag является раствор тиосульфата и аммиака (обозначен как Т в табл. 1), поскольку смыв царской водкой может привести к выпадению AgCl. Как следует из данных табл. 1, в пробах, приготовленных на основе царской водки, AgCl не образовывался, поскольку определение Ag выполнялось непосредственно вслед за разгрузкой опытов. Вместе с тем, при длительной выдержке таких проб содержание серебра снижалось из-за выпадения AgCl, эти данные отбраковывались.
Таблица 1.
Методическая серия опытов (450°C, 1000 бар): состав экспериментальных растворов, длительность опытов и растворимость меди и серебра. Cравнение результатов опытов с термодинамическим расчетом по литературным данным
| Эксперимент | Расчет | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| m, моль (кг H2O)–1 | время, ч | –lg mметa | $\lg K_{{({\text{Ag}})}}^{^\circ }$б ИСП-МС |
$\lg K_{{({\text{Ag}})}}^{^\circ }$б п/в |
Способ смывав | –lg mметг | Концентрация, m | ||||||||
| Cu | Ag | Cu | Ag | H+ | Cl– | HCl° | |||||||||
| HCl | NaCl | H2 | п/в | ИСП-МС | п/в | ИСП-МС | |||||||||
| 0.10 | 0.93 | 0.45 | 32 | 1.72 | 1.83 | –0.39 | –0.28 | Т | 1.77 | 4.0e–3 | 3.1e–1 | 7.9e–2 | |||
| 0.05 | 1.01 | 0.43 | 32 | 1.99 | 2.07 | –0.36 | –0.28 | Т | 2.04 | 1.9e–3 | 3.3e–1 | 3.9e–2 | |||
| 0.10 | 0 | 0.37 | 32 | 2.91 | 2.94 | –0.29 | –0.26 | Т | 2.91 | 1.9e–2 | 1.7e–2 | 8.0e–2 | |||
| 0.05 | 1.05 | 0.44 | 65 | 2.03 | 1.92 | –0.23 | –0.34 | Ц В | 2.02 | 1.9e–3 | 3.4e–1 | 4.0e–2 | |||
| 0.1 | 1.00 | 0.51 | 65 | 1.72 | 1.53 | –0.09 | –0.28 | Ц В | 1.77 | 3.9e–3 | 3.3e–1 | 7.9e–2 | |||
| 0.10 | 0.93 | 0.46 | 32 | 1.03 | 1.01 | Ц В | 1.00 | 6.0e–5 | 2.7e–1 | 9.7e–4 | |||||
| 0.01 | 0.97 | 0.45 | 32 | 2.01 | 2.01 | Ц В | 2.01 | 3.7e–6 | 3.2e–1 | 7.5e–5 | |||||
| 0.01 | 0.97 | 0.51 | 32 | 1.86 | 2.01 | Ц В | 2.01 | 3.9e–6 | 3.2e–1 | 8.0e–5 | |||||
| Среднее: $\lg K_{{({\text{Ag}})}}^{^\circ }$ = –0.27 ± 0.15 (ИСП-МС); –0.29 ± 0.04 (п/в). $\lg K_{{({\text{Ag}})}}^{^\circ }$ = –0.37 (Акинфиев, Зотов, 2001) | |||||||||||||||
а Метод анализа: п/в – по потере веса, ИСП-МС – масс-спектрометрия с индуктивно связанной плазмой; бK° – термодинамическая константа реакции Ag(к) + HCl(р-р) + Cl– = ${\text{AgCl}}_{2}^{ - }$ + 0.5H2(р-р); в способы смыва: Т – раствор тиосульфат + аммиак, Ц В – царская водка; г расчет по литературным данным: Ag (кроме AgCl°), Cu – (Акинфиев, Зотов, 2001), AgCl° – (Akinfiev, Zotov, 2016). Источник термодинамических данных остальных компонентов дан в тексте.
Для Cu оптимальным раствором для смыва со стенок автоклавов является царская водка, поскольку в растворах тиосульфата при длительной выдержке возможно образование твердой фазы. Концентрации Cu, определенные путем анализа растворов на основе царской водки, прекрасно согласуются с данными потери веса. Отметим, что полученные в этой серии опытов данные не позволяют определить константу реакции растворения Сu ($K_{{({\text{Cu}})}}^{^\circ }$, реакция 2). Это связано с высокой растворимостью металла. Растворимость Cu близка к исходной концентрации соляной кислоты, которая в ходе реакции растворения расходуется почти полностью. Это делает невозможным точный расчет равновесной концентрации HСl(р-р) – одного из компонентов реакции (2).
Константа растворения Ag ($K_{{({\text{Ag}})}}^{^\circ }$, реакция 5), определенная в настоящей работе из потери веса серебряной проволочки (–0.29 ± 0.04) и аналитического определения содержания Ag методом ИСП-МС (–0.27 ± 0.15), в пределах 0.1 л.е. согласуется с результатами термодинамического расчета (–0.37, Акинфиев, Зотов, 2001). Хорошее согласие наших и надежных литературных данных позволяет перейти к основной серии опытов, задачей которой является определение константы совместного растворения металлов.
Опыты по совместному растворению Cu и Ag
Результаты опытов представлены в табл. 2. Концентрации Ag, определенные двумя методами – ИСП-МС и ААС, прекрасно согласуются между собой. Данные метода потери веса для большинства опытов из-за ошибки взвешивания при невысокой растворимости Ag существенно переоценивают содержание этого металла. Для Cu, напротив, метод потери веса и ИСП-МС дают близкие результаты. Для большинства опытов при расчете константы реакции мы использовали результаты анализа методом ИСП-МС, а в опытах, где этот метод давал заниженные концентрации из-за выпадения Cu в растворах тиосульфата, – данные потери веса. Для 653°С для обоих металлов концентрации определялись методом ААС путем анализа аммиачно-тиосульфатных растворов.
Таблица 2.
Состав экспериментальных растворов, длительность опытов по совместному растворению меди и серебра, растворимость Сu(к) и Ag(к), и константа реакции совместного растворения $K_{{({\text{Cu}} - {\text{Ag}})}}^{^\circ }$ (уравнения 3, 4). Жирным шрифтом отмечены данные, использованные при расчете константы реакции
| m, моль (кг H2O)–1 | Время, сутки | –lg mмет | lg $K_{{({\text{Cu}} - {\text{Ag}})}}^{^\circ }$б | Cмывв | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Cuа | Agа | |||||||||
| HCl | NaCl | п/в | ААС | ИСП-МС | п/в | ААС | ИСП-МС | |||
| 350°C/1000 бар | ||||||||||
| 0.02 | 0.99 | 2.7 | 1.76 | 1.76 | 2.75 | 3.83 | 2.08 | Ц В | ||
| 0.02 | 0 | 2.7 | 2.17 | 2.14 | 3.10 | 4.29 | 2.16 | Ц В | ||
| 0.1 | 0 | 2.7 | 1.34 | 1.36 | 2.70 | 3.79 | 2.43 | Ц В | ||
| 0.02 | 2.79 | 2.7 | 1.83 | 1.84 | 2.64 | 4.22 | 2.38 | Ц В | ||
| 0 | 0.20 | 1.8 | 2.55 | 2.59 | 2.92 | 5.18 | 2.47 | Т | ||
| 0 | 0.50 | 1.8 | 2.21 | 2.45 | 3.27 | 5.29 | 2.85 | Т | ||
| 0 | 1.00 | 1.8 | 2.25 | 2.53 | 2.71 | 4.67 | 2.19 | Т | ||
| 0 | 1.00 | 1.8 | 2.37 | 2.50 | 3.10 | 5.42 | 2.88 | Т | ||
| 0 | 2.99 | 1.8 | 2.45 | 2.63 | 2.99 | 5.71 | 3.04 | Т | ||
| 0.01 | 1.01 | 0.6 | 2.07 | 2.56 | 2.69 | 4.74 | 2.67 | Т | ||
| 0.1 | 1.01 | 0.6 | 1.02 | 2.05 | 2.06 | 4.27 | 3.25 | Т | ||
| 0.1 | 0.19 | 2.8 | 1.26 | 1.67 | 2.79 | 3.15 | 2.12 | Т | ||
| 0.1 | 0.51 | 2.8 | 1.23 | 2.75 | 2.49 | 3.65 | 2.64 | Т | ||
| 0.1 | 0.51 | 2.8 | 1.25 | 1.93 | 2.42 | 4.16 | 3.14 | Т | ||
| 0.1 | 1.02 | 2.8 | 1.22 | 1.89 | 2.53 | 3.72 | 2.73 | Т | ||
| 0.1 | 2.94 | 2.8 | 1.25 | 2.94 | 2.27 | 3.75 | 2.73 | Т | ||
| 0.1 | 2.94 | 2.8 | 1.29 | 2.68 | 2.25 | 4.36 | 3.31 | Т | ||
| Cреднее lg $K_{{({\text{Cu}} - {\text{Ag}})}}^{^\circ }$ = 2.65 ± 0.20 | ||||||||||
| 450°C/1000 бар | ||||||||||
| 0.01 | 1.02 | 6 | 1.86 | 2.12 | 1.76 | 2.7 | 3.77 | 3.77 | 2.01 | Ц В |
| 0.01 | 1.02 | 13 | 1.80 | 2.12 | 1.73 | 2.58 | 4.11 | 4.09 | 2.35 | Ц В |
| 0.01 | 1.02 | 2 | 1.87 | 2.13 | 1.81 | 2.75 | 4.1 | 4.11 | 2.3 | Ц В |
| 0.01 | 1.02 | 0.3 | 1.86 | 2.19 | 1.83 | 2.99 | 3.97 | 3.97 | 2.14 | Ц В |
| 0.02 | 2.92 | 7 | 1.03 | 1.41 | 1.04 | 2.28 | 3.23 | 3.50 | 2.46 | Ц В |
| 0.01 | 2.94 | 7 | 1.74 | 2.12 | 1.69 | 2.98 | 3.88 | 3.92 | 2.22 | Ц В |
| 0.02 | 0 | 2.8 | 2.13 | 2.17 | 4.06 | 4.52 | 2.35 | Ц В | ||
| 0.02 | 0 | 2.8 | 1.74 | 1.66 | 2.89 | 3.69 | 2.03 | Т | ||
| 0.02 | 1.91 | 2.8 | 1.68 | 1.74 | 3.70 | 4.09 | 2.35 | Ц В | ||
| 0.02 | 1.91 | 2.8 | 1.70 | 1.67 | 3.09 | 4.14 | 2.48 | Т | ||
| 0.02 | 5.03 | 2.8 | 1.71 | 1.67 | 2.79 | 4.09 | 2.43 | Ц В | ||
| 0.02 | 9.85 | 2.8 | 1.73 | 1.68 | 2.63 | 3.72 | 2.03 | Ц В | ||
| 0.02 | 9.93 | 2.8 | 1.77 | 1.84 | – | 3.86 | 2.02 | Т | ||
| 0.02 | 15.0 | 2.8 | 1.81 | 1.81 | 3.25 | 4.02 | 2.21 | Ц В | ||
| 0.01 | 1.01 | 1.8 | 1.83 | 2.65 | 2.80 | 4.01 | 2.18 | Т | ||
| 0 | 0.20 | 0.6 | 2.24 | 2.54 | 2.56 | 4.56 | 2.27 | Т | ||
| 0 | 1.00 | 0.6 | 1.84 | 2.24 | 2.87 | 4.68 | 2.59 | Т | ||
| 0 | 2.99 | 0.6 | 2.09 | 2.22 | 3.52 | 4.88 | 2.58 | Т | ||
| 0.02 | 4.98 | 2.8 | 1.53 | 1.73 | 2.79 | 3.89 | 2.36 | Т | ||
| 0.02 | 9.98 | 2.8 | 1.43 | 1.65 | 2.62 | 3.59 | 2.16 | Т | ||
| 0.02 | 5.02 | 2.8 | 1.52 | 1.74 | 2.65 | 3.97 | 2.45 | Т | ||
| 0.02 | 10.0 | 2.8 | 1.53 | 1.75 | 2.99 | 3.69 | 2.16 | Т | ||
| Cреднее lg $K_{{({\text{Cu}} - {\text{Ag}})}}^{^\circ }$ = 2.28 ± 0.10 | ||||||||||
| 653°C/1450 бар | ||||||||||
| 0.022 | 0.100 | 0.23 | 1.40 | 2.84 | 1.44 | Т | ||||
| 0.022 | 1.98 | 0.23 | 1.44 | 2.98 | 1.53 | Т | ||||
| 0.0203 | 0.520 | 0.23 | 1.52 | 3.27 | 1.76 | Т | ||||
| 0.0206 | 3.84 | 0.23 | 1.68 | 2.93 | 1.25 | Т | ||||
| Cреднее lg $K_{{({\text{Cu}} - {\text{Ag}})}}^{^\circ }$ = 1.49 ± 0.34 | ||||||||||
а Метод анализа: п/в – по потере веса, ААС – атомно-абсорбционная спектрометрия, ИСП-МС – масс-спектрометрия с индуктивно связанной плазмой; б$K_{{({\text{Cu}} - {\text{Ag}})}}^{^\circ }$ – термодинамическая константа реакции Cu(к) + ${\text{AgCl}}_{2}^{ - }$ = Ag(к) + CuCl2; в способы смыва: Т – раствор тиосульфат+аммик, Ц В – царская водка.
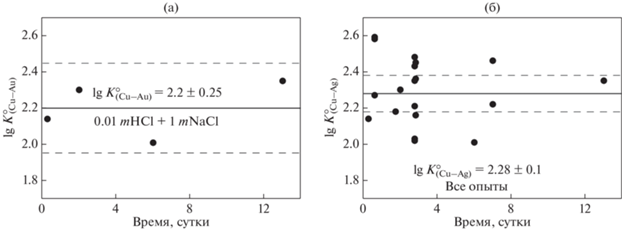
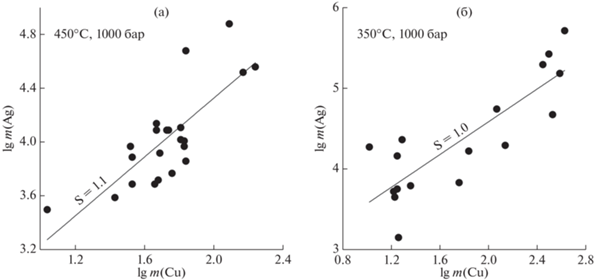
Значения константы реакции обменного растворения $K_{{({\text{Cu}} - {\text{Ag)}}}}^{^\circ }$ показаны на фиг. 1а, б в координатах lg $K_{{({\text{Cu}} - {\text{Ag)}}}}^{^\circ }$ – время. Поскольку константа не зависит от длительности опыта, можно полагать, что равновесная растворимость металлов достигается в течение первых часов, что согласуется с данными по растворимости Ag в хлоридных флюидах (Zotov et al., 2020). На фиг. 2а, б показан результат аппроксимации растворимости Cu и Ag линейной зависимостью для температур 350 и 450°С (данные для 653 °С не приводятся из-за небольшого числа опытов и незначительной вариации концентрации металлов). В логарифмической шкале тангенс угла наклона линий, аппроксимирующих эксперимент, близок к единице, что отвечает стехиометрии реакции совместного растворения Cu и Ag с образованием комплексов ${\text{AgCl}}_{2}^{ - }$ и ${\text{CuCl}}_{2}^{ - }$ (реакция 3). Следует отметить большой разброс экспериментальных данных относительно результатов аппроксимации (фиг. 2а, б) и среднего значения константы (фиг. 1б). В системе Pt–Au, которая была изучена нами ранее аналогичным методом, разброс данных был существенно меньше (см. фиг. 2 в работе Зотов и др., 2017). Больший разброс экспериментальных данных, по-видимому, обусловлен особенностью системы Cu–Ag, в которой растворимость одного из металлов – Сu – настолько высока, что в ходе опыта расходуется вся свободная кислота, что приводит к нейтрализации или даже подщелачиванию раствора.
Фиг. 1.
Рисунок, демонстрирующий независимость константы совместного растворения $K_{{({\text{Cu}} - {\text{Ag}})}}^{^\circ }$ от времени опыта. Температура 450°С, давление 1000 бар. Точки – эксперимент, сплошная линия – усредненное значение, пунктир – доверительный интервал при доверительной вероятности 95%. (a) состав раствора 0.01 mHCl + 1 mNaCl. (б) все опыты.
Фиг. 2.
Линейная аппроксимация зависимости lg m(Ag)–lg m(Cu) при 450°С (a) и 350°С (б), P = 1000 бар. Символы – эксперимент (табл. 2). Рядом с линиями указан их наклон.
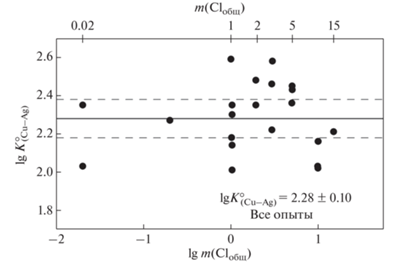
Рассчитанные значения константы $K_{{({\text{Cu}} - {\text{Ag)}}}}^{^\circ }$ не зависят от концентрации хлоридов во всей области составов экспериментальных растворов, от 0.02m HCl до 0.02m HCl + 15m NaCl (47 мас. % NaCl) (фиг. 3). Это подтверждает вывод о преобладающей роли комплекса ${\text{CuCl}}_{2}^{ - }$ как основной формы переноса Cu, поскольку надежно установлено, что основной формой нахождения Ag является комплекс ${\text{AgCl}}_{2}^{ - }$ (Zotov et al., 2020). Отметим, что при расчете значений констант активность металлов принималась равной единице из-за низкой взаимной растворимости Cu и Ag (Murray, 1984). Результаты анализа химического состава металлов после опыта при 653°С методом СЭМ/ЭДС отвечали фазовой диаграмме системы Cu–Ag: для всех опытов содержание примесного металла не превышало 3 мас. %.
Фиг. 3.
Рисунок, демонстрирующий независимость константы совместного растворения $K_{{({\text{Cu}} - {\text{Ag}})}}^{^\circ }$ от общей концентрации хлоридов m(NaCl) + m(HCl). Температура 450°С, давление 1000 бар. Точки – эксперимент, сплошная линия – усредненное значение, пунктир – доверительный интервал при доверительной вероятности 95%.
Для проверки правильности полученной величины константы $K_{{({\text{Cu}} - {\text{Ag)}}}}^{^\circ }$ нами предпринята попытка расчета энергии Гиббса комплекса ${\text{CuCl}}_{2}^{ - }$ из данных по растворимости Cu с помощью программы OptimA. Методика расчета и его результаты приведены в Дополнительных материалах (Приложение ) . Для 450°С/1000 бар этим методом получено значение $\Delta G_{{T,P}}^{^\circ }({\text{CuCl}}_{2}^{ - })$ = –317.45 ± ± 7.27 кДж моль–1, что дает lg$K_{{({\text{Cu}} - {\text{Ag)}}}}^{^\circ }$ = 2.29 ± 0.53. При относительно высокой погрешности эта величина прекрасно согласуется с прямым расчетом константы реакции lg $K_{{({\text{Cu}} - {\text{Ag)}}}}^{^\circ }$ = 2.28 ± 0.10 (табл. 2).
Константа обменного растворения $K_{{({\text{Cu}} - {\text{Ag)}}}}^{^\circ }$
Полученные нами значения $K_{{({\text{Cu}} - {\text{Ag)}}}}^{^\circ }$ сравниваются с рассчитанными по литературным данным (методы обработки экспериментальных данных (Xiao et al., 1998) и (Alex, Zajacz, 2022) приведены в Дополнительных материалах) и модельными расчетами в верхней части табл. 3 и на фиг. 4. По результатам настоящей работы и данным (Xiao et al., 1998) рассчитаны коэффициенты уравнения плотностной модели (Anderson et al., 1991). Это уравнение позволяет с высокой точностью описать константы растворения металлов и ранее было использовано нами при обработке данных для Au при температуре до 1000°С (Zotov et al., 2018) и Pt при температуре до 450°С (Tagirov et al., 2019). Расчет выполнен с учетом статистических весов. Для литературных данных статистический вес значения константы принимался равным 1/(доверит. интервал)2. Значению константы при 450°С/1000 бар был приписан статистический вес, равный максимальному для литературных данных, а статистический вес точек 350°С/1000 бар и 653°С/1450 был снижен в 4 и 11.5 раз соответственно, относительно веса точки 450°С/1000 бар, согласно разнице в погрешности. Результаты расчета имеют вид:
(9)
$\begin{gathered} {\text{\;lg}}\,K_{{{\text{(Сu}} - {\text{Ag)}}}}^{^\circ } = {\text{1}}{\text{.066}} + {\text{1}}{\text{.108}} \times {\text{1}}{{{\text{0}}}^{{\text{3}}}}T\,{{{\text{(K)}}}^{{ - {\text{1}}}}} + \\ {\text{ + }}\,\,{\text{3}}{\text{.585}}\,{\text{lg}}\,d\,{\text{(w)}}--{\text{1}}{\text{.443}}\,{\text{lg}}\,d\,{\text{(w)}}\,\,{{ \times }}\,\,{\text{1}}{{{\text{0}}}^{{\text{3}}}}T\,{{{\text{(K)}}}^{{ - {\text{1}}}}}{\text{,}} \\ \end{gathered} $Таблица 3.
Сравнение констант реакций, определенных из экспериментальных данных, с рассчитанными по уравнениям плотностной модели lg $K_{{({\text{Cu}} - {\text{Ag}})}}^{^\circ }$ = 1.066 + 1.108 × 103T(K)–1 + 3.585 lg d(w) – 1.443 lg d(w) × 103T(K)–1 (уравнение 9), lg $K_{{({\text{Cu}})}}^{^\circ }$ = 6.889 – 3.298 × 103T(K)–1 + 8.694 lg d(w) – 4.807 lg d(w) × 103T(K)–1 (уравнение 11), где d(w) – плотность воды, и с использованием компиляции (Акинфиев, Зотов, 2001)
| Константаа | Температура/давление | lg $K_{{T,P}}^{^\circ }$ | Источник данных | lg $K_{{T,P}}^{^\circ }$б модель | Δв мод-эксп | lg $K_{{T,P}}^{^\circ }$г (Ак/Зот) |
|---|---|---|---|---|---|---|
| $K_{{({\text{Cu}} - {\text{Ag}})}}^{^\circ }$ | 200°С/Рнас | 3.38 ± 0.06 | Gammons et al., 1998 | 3.37 | –0.01 | 3.60 |
| 250°С/Рнас | 3.11 ± 0.04 | Xiaoet al., 1998 | 3.10 | –0.01 | 3.39 | |
| 300°С/Рнас | 2.79 ± 0.08 | Xiao et al., 1998 | 2.84 | 0.05 | 3.20 | |
| 350°С/1000 бар | 2.65 ± 0.20 | Наст. работа | 2.69 | 0.04 | 3.08 | |
| 450°С/1000 бар | 2.28 ± 0.10 | Наст. работа | 2.26 | –0.02 | 2.78 | |
| 653°С/1450 бар | 1.49 ± 0.34 | Наст. работа | 1.54 | 0.05 | 2.28 | |
| 900°С/2000 бард | 1.07 ± 0.13 | Alex, Zajacz, 2022 | 1.00 | –0.07 | 1.93 | |
| $K_{{({\text{Cu}})}}^{^\circ }$ | 40°С/Рнас | –3.57 ± 0.09 | Xiao et al., 1998 | –3.62 | –0.05 | –3.96 |
| 60°С/Рнас | –3.05 ± 0.04 | Xiao et al., 1998 | –2.97 | 0.08 | –3.18 | |
| 100°С/Рнас | –1.61 ± 0.07 | Xiao et al., 1998 | –1.87 | –0.26 | –1.91 | |
| 150°С/Рнас | –0.30 ± 0.23 | Xiao et al., 1998 | –0.80 | –0.50 | –0.71 | |
| 200°С/Рнас | –0.03 ± 0.06 | Xiao et al., 1998 | 0.01 | 0.04 | 0.19 | |
| 250°С/Рнас | 0.63 ± 0.04 | Xiao et al., 1998 | 0.63 | 0 | 0.91 | |
| 300°С/Рнас | 1.13 ± 0.08 | Xiao et al., 1998 | 1.09 | –0.04 | 1.54 | |
| 28°С/Рнас | –4.15 ± 0.08 | Николаева и др., 1974 | –4.05 | 0.10 | –4.48 | |
| 50°С/Рнас | –3.27 ± 0.08 | Николаева и др., 1974 | –3.28 | –0.01 | –3.56 | |
| 70°С/Рнас | –2.56 ± 0.07 | Николаева и др., 1974 | –2.67 | –0.10 | –2.83 | |
| 90°С/Рнас | –2.07 ± 0.07 | Николаева и др., 1974 | –2.12 | –0.06 | –2.19 | |
| 100°С/Рнас | –1.80 ± 0.07 | Николаева и др., 1974 | –1.87 | –0.08 | –1.91 | |
| 125°С/Рнас | –1.30 ± 0.06 | Николаева и др., 1974 | –1.30 | 0 | –1.27 | |
| 150°С/Рнас | –0.94 ± 0.06 | Николаева и др., 1974 | –0.80 | 0.13 | –0.71 | |
| 350°С/1000 бар | 1.39 ± 0.20 | Наст. работа | 1.48 | 0.09 | 1.83 | |
| 450°С/1000 бар | 1.91 ± 0.10 | Наст. работа | 1.90 | –0.01 | 2.41 | |
| 653°С/1450 бар | 2.06 ± 0.34 | Наст. работа | 2.08 | 0.02 | 2.85 | |
| 900°С/2000 бард | 1.79 ± 0.13 | Alex, Zajacz, 2022 | 2.11 | 0.32 | 2.65 |
а Cu(к) + ${\text{AgCl}}_{2}^{ - }$ = Ag(к) + ${\text{CuCl}}_{2}^{ - }$ $K_{{({\text{Cu}} - {\text{Ag}})}}^{^\circ }$ Cu(к) + HCl(р-р) + Cl– = ${\text{CuCl}}_{2}^{ - }$ + 0.5H2(р-р) $K_{{({\text{Cu}})}}^{^\circ }$; б расчет по уравнению плотностной модели (уравнения 9 и 11); в lg K°(модель) – lgK°(экспер.); г (Акинфиев, Зотов, 2001); д рассчитано по данным (Alex, Zajacz, 2022). Эти данные не использовалось при расчете коэффициентов уравнения плотностной модели, приводятся для сравнения с экстраполяцией.
Фиг. 4.
Зависимость константы совместного растворения $K_{{({\text{Cu}} - {\text{Ag}})}}^{^\circ }$ (реакция 3) от температуры. Точки – экспериментальные данные, линии – расчет по уравнению (9) (плотностная модель) и с использованием термодинамической базы данных (Акинфиев, Зотов, 2001).

Константа растворения меди $K_{{{\text{(Cu)}}}}^{^\circ }$ при 25–800 °С и давлении до 2 кбар
Константы реакции растворения меди $K_{{{\text{(Cu)}}}}^{^\circ }$, полученные в настоящей работе и рассчитанные по литературным данным, сведены в табл. 3. Методика обработки литературных данных представлена в Дополнительных материалах. В работе (Николаева и др., 1974) потенциометрическим методом при температуре 28–50°С и давлении насыщенного пара Рнас определена ЭДС реакции:
(10)
${\text{СuCl}}_{2}^{ - } + {\text{0}}{\text{.5}}{{{\text{H}}}_{{{\text{2(}}}}}_{{{\text{р - р)}}}} = {\text{С}}{{{\text{u}}}_{{{\text{(к)}}}}} + {\text{2C}}{{{\text{l}}}^{ - }} + {{{\text{H}}}^{{\text{ + }}}}{\text{.}}$Поскольку измерения были выполнены в 1 М растворе NaCl, мы внесли поправку на ионную силу раствора и рассчитали значения стандартного потенциала реакции (I = 0) и константы $K_{{{\text{(Cu)}}}}^{^\circ }$. (Xiao et al., 1998) измерили растворимость нантокита CuCl(к) при 40–150°С, и Cu(к) + Ag(к) при 200–300°С. В настоящей работе эти данные были обработаны с расчетом констант образования CuCl, ${\text{CuCl}}_{2}^{ - }$ и ${\text{CuCl}}_{3}^{{2 - }}.$
В результате обработки установленных значений константы растворения Cu $K_{{{\text{(Cu)}}}}^{^\circ }$ и литературных данных получено уравнение плотностной модели:
(11)
$\begin{gathered} {\text{lg}}\,K_{{{\text{(Сu)}}}}^{^\circ } = {\text{6}}{\text{.889}}--{\text{3}}{\text{.298}} \times {\text{1}}{{{\text{0}}}^{{\text{3}}}}T{{{\text{(K)}}}^{{ - {\text{1}}}}} + \\ {\text{ + }}\,\,{\text{8}}{\text{.694}}\,{\text{lg}}\,d{\text{(w)}}--{\text{4}}{\text{.807}}\,{\text{lg}}\,d{\text{(w)}} \times {\text{1}}{{{\text{0}}}^{{\text{3}}}}T{{{\text{(K)}}}^{{ - {\text{1}}}}}{\text{.}} \\ \end{gathered} $Рассчитанные значения констант реакции представлены в табл. 3 и показаны на фиг. 5 вместе с экспериментальными данными. Мы полагаем, что это уравнение может быть использовано при температуре до 800°С и давлении до 2000 бар с возможным расширением области PT-параметров до 900°С/5000 бар при снижении точности экстраполяции: разница между значениями $K_{{{\text{(Cu)}}}}^{^\circ }$, полученными для 900°С/2000 бар по уравнению (11) и рассчитанным по данным (Alex, Zajacz, 2022), составляет 0.32 л.е. при погрешности эксперимента 0.13 л.е. (табл. 3, последняя строка) Результат расчета $K_{{{\text{(Cu)}}}}^{^\circ }$ по уравнению (11) представлен в табл. 4, а значения энергии Гиббса комплекса ${\text{CuCl}}_{2}^{ - }$ приведены в табл. 5.
Фиг. 5.
Зависимость константы реакции растворения меди $K_{{({\text{Cu}})}}^{^\circ }$ (реакция 2) от обратной температуры. Точки – экспериментальные данные, линии – расчет по уравнению (11) (плотностная модель) и с использованием термодинамических данных из работ (Акинфиев, Зотов, 2001; Liu, McPhail, 2005).
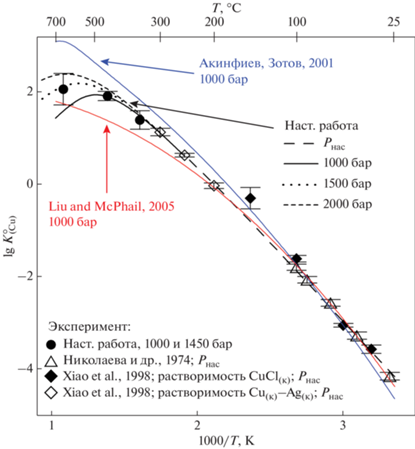
Таблица 4.
Логарифм константы реакции $K_{{({\text{Cu}})}}^{^\circ },$ Cu(к) + + ${\text{HCl}}_{{({\text{р - р}})}}^{{}}$ + Cl– = ${\text{CuCl}}_{2}^{ - }$ + 0.5${\text{H}}_{{2\,({\text{р - р}})}}^{^\circ },$ в зависимости от температуры и давления. Расчет по уравнению (11)
| T, °C | Давление, бар | |||
|---|---|---|---|---|
| Pнас | 500 | 1000 | 2000 | |
| 25 | –4.16 | –4.23 | –4.29 | –4.40 |
| 50 | –3.28 | –3.34 | –3.39 | –3.47 |
| 100 | –1.87 | –1.91 | –1.95 | –2.01 |
| 150 | –0.80 | –0.84 | –0.86 | –0.91 |
| 200 | 0.01 | –0.01 | –0.03 | –0.06 |
| 250 | 0.63 | 0.62 | 0.61 | 0.60 |
| 300 | 1.09 | 1.10 | 1.11 | 1.12 |
| 350 | 1.36 | 1.44 | 1.48 | 1.52 |
| 400 | 1.62 | 1.74 | 1.83 | |
| 450 | 1.52 | 1.90 | 2.06 | |
| 500 | 1.16 | 1.94 | 2.23 | |
| 550 | 1.88 | 2.33 | ||
| 600 | 1.75 | 2.38 | ||
| 650 | 1.60 | 2.39 | ||
| 700 | 1.44 | 2.37 | ||
| 750 | 2.32 | |||
| 800 | 2.26 | |||
Таблица 5.
Энергия Гиббса комплекса ${\text{CuCl}}_{2}^{ - }$ (кДж моль–1) в зависимости от температуры и давления. Расчет выполнен с использованием констант реакции $K_{{({\text{Cu}})}}^{^\circ }$ из табл. 4 и значений энергии Гиббса Cl– (SUPCRT92), HCl(р-р) (Tagirov et al., 1997) и H2(р-р) (Akinfiev, Diamond, 2003). Совместимы с энергией Гиббса NaCl(р-р) и KCl(р-р) из базы данных SUPCRT92
| T, °C | Давление, бар | |||
|---|---|---|---|---|
| Psat | 500 | 1000 | 2000 | |
| 25 | –243.66 | –241.74 | –239.64 | –235.08 |
| 50 | –248.67 | –246.36 | –243.88 | –238.60 |
| 100 | –258.82 | –256.24 | –253.50 | –247.66 |
| 150 | –268.97 | –266.50 | –263.78 | –257.90 |
| 200 | –278.75 | –276.73 | –274.28 | –268.70 |
| 250 | –287.52 | –286.55 | –284.67 | –279.74 |
| 300 | –293.95 | –295.36 | –294.64 | –290.80 |
| 350 | –293.88 | –301.89 | –303.81 | –301.70 |
| 400 | –305.32 | –311.61 | –312.25 | |
| 450 | –293.67 | –317.13 | –322.24 | |
| 500 | –255.80 | –319.16 | –331.44 | |
| 550 | –317.09 | –339.68 | ||
| 600 | –312.04 | –346.87 | ||
| 650 | –306.61 | –353.10 | ||
| 700 | –303.09 | –358.65 | ||
| 750 | –363.81 | |||
| 800 | –368.88 | |||
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ И ГЕОЛОГИЧЕСКОЕ ПРИЛОЖЕНИЕ
Как следует из данных, представленных на фиг. 5, результаты определений устойчивости комплекса ${\text{CuCl}}_{2}^{ - }$, выполненные разными методами – путем измерения растворимости CuCl(к), совместной растворимости Cu и Ag и методом потенциометрии – хорошо согласуются между собой. Помимо экспериментальных данных и результата их обработки с использованием плотностной модели, на фиг. 5 показан результат расчета константы растворения Cu$K_{{{\text{(Cu)}}}}^{^\circ }$ по термодинамическим данным из работ (Акинфиев, Зотов, 2001) и (Liu, McPhail, 2005). В первой работе при расчете термодинамических свойств ${\text{CuCl}}_{2}^{ - }$ использованы данные (Варьяш, 1991) по растворимости меди при 300 и 350°С, Р = 500 бар, а при 15–150°С – компиляция литературных данных (включая работу (Николаева и др., 1974)), также выполненная (Варьяш, 1991). Термодинамическая модель (Liu, McPhail, 2005) основана на экспериментальных данных (Варьяш, 1991; Xiao et al., 1998), данных (Liu et al., 2001) по растворимости куприта Cu2O(к) в растворах NaCH3COO + + NaCl при 50–250°С, результатах спектрофотометрических измерений (Liu et al., 2002) при температуре 100–250°С, и данных для 25°С из работ (Fritz, 1980; Ciavatta, Iuliano, 1998). При низких температурах <150°С обе модели хорошо согласуются между собой и с расчетом по уравнению (11). Как видно из фиг. 5, при температуре выше 300°С расхождение между расчетом по моделям (Акинфиев, Зотов, 2001) и (Liu, McPhail, 2005) начинает расти и при 500°С/1000 бар превышает 1 л.е. Ключевые значения $K_{{{\text{(Cu)}}}}^{^\circ }$, определенные в настоящей работе для 350°С/1000 бар, 450°С/1000 бар и 653°С/1450 бар, позволяют повысить точность экстраполяции на высокие РТ-параметры, при которых происходит перенос Cu в порфировых системах, и точнее определять содержание растворенной меди при параметрах флюидно-магматического взаимодействия.
Еще одним важным результатом настоящей работы является вывод о постоянстве состава основного комплекса Cu в широком диапазоне концентраций хлоридов при высоких РТ-параметрах. По нашим данным, при 450°С/1000 бар комплекс ${\text{CuCl}}_{2}^{ - }$ преобладает при m(Сlобщ) от 0.02 до 15, то есть вплоть до концентраций, близких к насыщению по NaCl. Это противоречит модели (Liu, McPhail, 2005; Brugger et al., 2007), в которой для описания высокотемпературных растворов используется комплекс ${\text{CuCl}}_{3}^{{2 - }}$. Обработка данных (Xiao et al., 1998) (Приложение, табл. П2, фиг. П2) показала, что вклад этого комплекса быстро снижается с ростом температуры, и выше 100°С роль этого комплекса в переносе Сu незначима. Таким образом, модель хлоридного комплексообразования одинакова для всех металлов (Ме) подгруппы меди: основным комплексом, который обеспечивает перенос Cu, Ag и Au при высоких температурах, является ${\text{MeCl}}_{2}^{ - }$, а в разбавленных хлоридных растворах, наряду с гидросульфидными комплексами, следует учитывать вклад нейтрального комплекса MeCl(р-р).
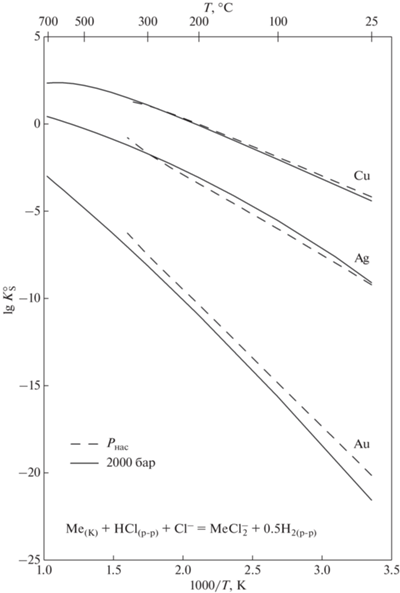
На фиг. 6 показаны константы растворения металлов подгруппы меди. При одинаковых параметрах состояния системы растворимость Cu существенно выше растворимости Ag и Au. Рост температуры приводит к быстрому росту растворимости. Вместе с тем, энтальпия (или температурный ход константы) реакции растворения металлов с образованием комплекса ${\text{MeCl}}_{2}^{ - }$ различается. Наибольший рост константы наблюдается для Au, наименьший – для Cu. Кроме того, для Au зависимость от обратной температуры близка к линейной, а для Cu скорость изменения константы снижается при высоких температурах, что приводит к отклонению зависимости lg $K_{{{\text{(Cu)}}}}^{^\circ }$–1/T от линейной. В результате разница в растворимости металлов становится менее выраженной при высоких температурах.
Фиг. 6.
Константы реакции растворения металлов подгруппы меди (реакция 1) в зависимости от обратной температуры. Данные для Cu получены в настоящей работе (уравнение 11), Ag – по (Акинфиев, Зотов, 2001), Au – по (Zotov et al., 2018).
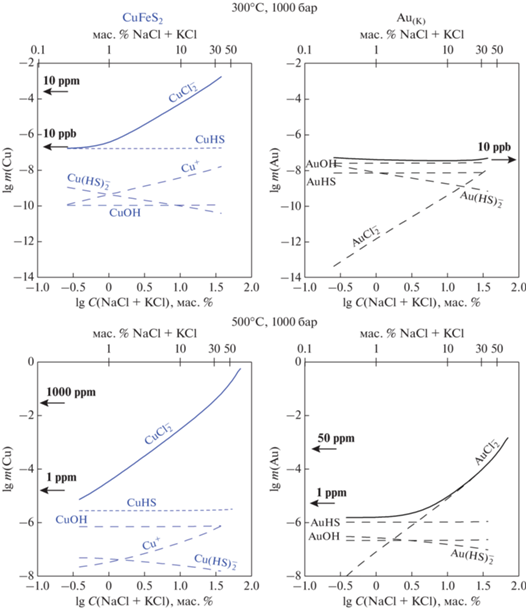
Хорошее соответствие экспериментальных данных уравнению плотностной модели позволяет рассчитывать растворимость минералов меди в диапазоне температур и давлений, при которых существуют природные гидротермальные системы. На фиг. 7 показана растворимость халькопирита и золота в хлоридных растворах при температуре 300 и 500°С, P = 1000 бар. Расчет выполнен для системы с забуференными значениями летучести кислорода и pH (минеральные ассоциации пирит–гематит–магнетит и калиевый полевой шпат–мусковит–кварц). Отношение концентраций KCl/NaCl (мас. %) фиксировалось ~1. Эксперименты по растворимости халькозина Cu2S(к) в растворах сероводорода (Трофимов и др., 2021) показали несоответствие экспериментальных данных и термодинамической модели (Акинфиев, Зотов, 2010) в области преобладания комплекса CuHS(р-р). Поэтому в рассматриваемом интервале РТ-параметров принимаем lg $K_{{{\text{C}}{{{\text{u}}}_{{\text{2}}}}{\text{S}}}}^{^\circ }$ = –4.5 ± ± 0.5 по данным (Трофимов и др., 2021). Согласно фиг. 7, при низких концентрациях хлоридов, в области преобладания MeHS(р-р) и MeOH(р-р), концентрации Cu и Au близки. По мере увеличения концентрации хлоридов растет вклад хлоридного комплекса ${\text{MeCl}}_{2}^{ - }$, что приводит к росту растворимости. Однако для Сu вклад этого комплекса становится значимым при меньших концентрациях соли по сравнению с Au. При 500°С область преобладания хлоридных комплексов Cu и Au расширяется, а содержания металлов в концентрированных хлоридных флюидах достигают ~1 мас. % для Cu и приближаются к 100 ppm для Au.
Фиг. 7.
Растворимость халькопирита и Au(к) в зависимости от концентрации хлоридов. Отношение концентраций NaCl/KCl [мас. %] ~ 1. Окислительный потенциал контролируется буфером пирит–гематит–магнетит, кислотность – буфером калиевый полевой шпат–мусковит–кварц. Сплошные линии – общая концентрация растворенных металлов, пунктир – вклад отдельных комплексов. Концентрация ${\text{CuCl}}_{2}^{ - }$ рассчитана по данным настоящей работы. Энергия Гиббса CuHS(р-р) получена по (Трофимов и др., 2021) полагая, что при температурах 300–500°С, Р = 1000 бар для реакции 0.5Сu2S(к) + 0.5H2S = CuHS(р-р) lgK° = –4.5 ± 0.5. Эта оценка является предварительной. Термодинамические свойства остальных частиц приняты по (Акинфиев, Зотов, 2001, 2010).
Список литературы
Акинфиев Н.Н., Зотов А.В. Термодинамическое описание хлоридных, гидросульфидных и гидроксокомплексов Ag(I), Cu(I) и Au(I) в диапазоне температур 25–500°С и давлений 1–2000 бар // Геохимия. 2001. № 10. С. 1083–1099.
Акинфиев Н.Н., Зотов А.В. Термодинамическое описание водных компонентов системы Cu–Ag–Cu–S–O–H в диапазоне температур 0–600°С и 1–3000 бар // Геохимия. 2010. № 7. С. 761–767.
Зотов А.В., Левин К.А., Котова З.Ю., Волченкова В.А. Экспериментальное исследование устойчивости гидроксохлоридных комплексов серебра в гидротермальных растворах // Геохимия. 1982. № 8. С. 1124–1136.
Зотов А.В., Тагиров Б.Р., Королева Л.А., Волченкова В.А. Экспериментальное моделирование совместного переноса Au и Pt хлоридными гидротермальными флюидами (350–450°С, 500–1000 бар) // Геология руд. месторождений. 2017. Т. 59. № 5. С. 434–442.
Николаева Н.М., Еренбург А.М., Скороход Л.С. Влияние температуры на константы равновесия реакций замещения в галогенидных комплексах меди (I) // Известия Сибирского отделения АН СССР. 1974. № 7. Сер. хим. наук. Вып. 3. С. 44–48.
Трофимов Н.Д. Изучение комплексообразования меди в водном флюиде методом растворимости // Конференция “Ломоносов 2021”, тезисы докладов. Секция “Геохимия”. М.: МГУ, 2021.
Шваров Ю.В. HCh: Новые возможности термодинамического моделирования геохимических систем, предоставляемые Windows // Геохимия. 2008. № 8. 898–903. (Интернет-сайт программы http://www.geol.msu.ru/ deps/geochems/soft/index.html)
Akinfiev N.N., Diamond L.W. Thermodynamic description of aqueous nonelectrolytes at infinite dilution over a wide range of state parameters // Geochim. Cosmochim. Acta. 2003. V. 67. P. 613–627.
Alex A., Zajacz Z. The solubility of Cu, Ag and Au in magmatic sulfur-bearing fluids as a function of oxygen fugacity // Geochim. Cosmochim. Acta. 2022. V. 330. P. 93–115.https://doi.org/10.1016/j.gca.2022.03.036
Anderson G.M., Castet S., Schott J., Mesmer R.E. The density model for estimation of thermodynamic parameters of reactions at high temperatures and pressures // Geochim. Cosmochim. Acta. 1991. V. 55. P. 1769–1779.
Bandura A.V., Lvov S.N. The ionization constant of water over wide ranges of temperature and density // Journal of Physical Chemistry Reference Data. 2006. V. 35. P. 15–30.
Berman R.G. Internally consistent thermodynamic data for minerals in the system Na2O–K2O–CaO–MgO–FeO–Fe2O3–Al2O3–SiO2–TiO2–H2O–CO2 // J. Petrology. 1988. V. 29. P. 445–522.
Blundy J., Afanasyev A., Tattitch B., Sparks S., Melnik O., Utkin I., Rust A. The economic potential of metalliferous sub-volcanic brines // Royal Society Open Science. 2021. V. 8. 202192.
Brugger J. Etschmann B., Liu W., Testemale D., Hazemann J.-L., Emerich H., van Beek W., Proux O. An XAS study of the structure and thermodynamics of Cu(I) chloride complexes in brines up to high temperature (400 °C, 600 bar) // Geochim. Cosmochim. Acta. 2007. V. 71. P. 4920–4941.
Chase M.W., Jr. NIST-JANAF thermochemical tables, fourth edition // Journal of physical and chemical reference data. Monograph No. 9. 1998. American Chemical Society. 1951 p.
Ciavatta L., Iuliano M. Copper(I) chloride complexes in aqueous solution // Annali di Chimica. 1998. V. 88. P. 71–89.
Crerar D.A., Barnes H.L. Ore solution chemistry V. Solubilities of chalcopyrite and chalcocite assemblages in hydrothermal solution at 200 to 300°C // Economic Geology. 1976. V. 71. P. 772–794.
Driesner T., Heinrich C.A. The system H2O–NaCl. I. Correlation formulae for phase relations in temperature-pressure-composition space from 0 to 1000°C, 0 to 5000 bar, and 0 to 1 XNaCl // Geochim. Cosmochim. Acta. 2007. V. 71. P. 4880–4901.
Fritz J.J. Chloride complexes of CuCl in aqueous solution // Journal of Physical Chemistry. 1980. V. 84. P. 2241–2246.
Johnson J.W., Oelkers E.H., Helgeson H.C. SUPCRT92: A software package for calculating the standard molal thermodynamic properties of minerals, gases, aqueous species, and reactions from 1 to 5000 bar and 0 to 1000°C // Computers & Geosciences. 1992. V. 18. P. 899–947.
Liu W., Brugger J., McPhail D.C., Spiccia L. A spectrophotometric study of aqueous copper(I)-chloride complexes in LiCl solutions between 100°C and 250°C // Geochim. Cosmochim. Acta. 2002. V. 66. P. 3615–3633.
Liu W., McPhail D.C. Thermodynamic properties of copper-chloride complexes and copper transport in magmatic-hydrothermal solutions // Chemical Geology. 2005. V. 221. P. 21–39.
Liu W., McPhail D.C., Brugger J. An experimental study of copper(I)–chloride and copper(I)–acetate complexing in hydrothermal solutions between 50°C and 250°C and vapor saturated pressure // Geochim. Cosmochim. Acta. 2001. V. 65. P. 2937–2948.
Murray J.L. Calculations of stable and metastable equilibrium diagrams of the Ag–Cu and Cd–Zn systems // Metallurgical and Materials Transactions A. 1984. V. 15. P. 261–268.
Robie R.A., Hemingway B.S. Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar (105 Pascals) pressure and at higher temperatures // U.S. Geological Survey Bulletin 2131. 1995. U.S. Government Printing Office, Washington.
Schmidt C., Watenphul A., Jahn S., Schäpan I., Scholten L., Newville M.G., Lanzirotti A. Copper complexation and solubility in high-temperature hydrothermal fluids: A combined study by Raman, X-ray fluorescence, and X-ray absorption spectroscopies and ab initio molecular dynamics simulations // Chemical Geology. 2018. V. 494. P. 69–79.
Seward T.M. The stability of chloride complexes of silver in hydrothermal solutions up to 350°C // Geochim. Cosmochim. Acta. 1976. V. 49. P. 1329–1341.
Shvarov Y.A. A suite of programs, OptimA, OptimB, OptimC, and OptimS compatible with the Unitherm database, for deriving the thermodynamic properties of aqueous species from solubility, potentiometry and spectroscopy measurements // Applied Geochemistry. 2015. V. 55. 17–27.
Sverjensky D.A., Hemley J.J., D’Angelo M.D. Thermodynamic assessment of hydrothermal alkali feldspar-mica-aluminosilicate equilibria // Geochim. Cosmochim. Acta. 1991. V. 55. P. 989–1004.
Tagirov B.R., Filimonova O.N., Trigub A.L., Akinfiev N.N., Nickolsky M.S., Kvashnina K.O., Chareev D.A., Zotov A.V. Platinum transport in chloride-bearing fluids and melts: insights from in situ X-ray absorption spectroscopy and thermodynamic modeling // Geochim. Cosmochim. Acta. 2019. T. 254. P. 86–101.
Tagirov B.R., Trigub A.L., Filimonova O.N., Kvashnina K.O., Nickolsky M.S., Lafuerza S., Chareev D.A. Gold transport in hydrothermal chloride-bearing fluids: insights from in situ X-ray absorption spectroscopy and Ab initio molecular dynamics // ACS Earth and Space Chemistry. 2019. V. 3. P. 240–261.
Tagirov B.R., Zotov A.V., Akinfiev N.N. Experimental study of dissociation of HCl from to 500°C and from 500 to 2500 bars: Thermodynamic properties of HCl(aq) // Geochim. Cosmochim. Acta. 1997. V. 61. P. 4267–4280.
Wagner W., Pruss A. The IAPWS formulation 1995 for the thermodynamic properties of ordinary water substance for general and scientific use // Journal of Physical Chemistry Reference Data. 2002. V. 31. P. 387–535
Xiao Z., Gammons C.H., Williams-Jones A.E. Experimental study of copper(I) chloride complexing in hydrothermal solutions at 40 to 300 °C and saturated water vapor pressure // Geochim. Cosmochim. Acta. 1998. V. 62. P. 2949–2964.
Zotov A.V., Diagileva D.R., Koroleva L.A. Silver solubility in supercritical fluids in a wide range of NaCl concentration (0.6–50 wt %) – experimental and thermodynamic description // ACS Earth and Space Chemistry. 2020. V. 4. 2403–2413.
Zotov A.V., Kuzmin N.N., Reukov V.L., Tagirov B.R. Stability of ${\text{AgCl}}_{2}^{ - }$ from 25 to 1000°C at pressures to 5000 bar and consequences for hydrothermal gold mobilization // Minerals. 2018. V. 8. 286.
Zotov A.V., Kudrin A.V., Levin K.A., Shikina N.D., Var’yash L.N. Experimental studies of the solubility and complexing of selected ore elements (Au, Ag, Cu, Mo, As, Sb, Hg) in aqueous solutions // Fluids in the crust. Equilibrium and transport properties; Shmulovich, K.I., Yardley, B.W.D., Gonchar, G.G., Eds. Chapman & Hall. 1995. P. 95–137.
Дополнительные материалы
- скачать ESM.doc
- Приложение 1.
Расчёт энергии Гиббса CuCl2- c помощью программы OptimA
Инструменты
Геология рудных месторождений


