Геология рудных месторождений, 2023, T. 65, № 1, стр. 46-57
Особенности взаимодействия шеелита с растворами HCl при 400 и 500°С, 100 МПа и различных f(O2) (по экспериментальным и расчетным данным)
А. Ф. Редькин a, *, Н. П. Котова a, **
a Институт экспериментальной минералогии им. академика Д.С. Коржинского РАН
142432 Московская область, Черноголовка, ул. Академика Осипьяна, 4, Россия
* E-mail: redkin@iem.ac.ru
** E-mail: kotova@iem.ac.ru
Поступила в редакцию 11.05.2022
После доработки 03.10.2022
Принята к публикации 10.10.2022
- EDN: LBAUFZ
- DOI: 10.31857/S0016777023010070
Аннотация
Проведены экспериментальные исследования по растворимости шеелита в растворах HCl в интервале концентраций от 0.01 до 0.316 моль кг–1 H2O при 400 и 500°С, давлении 100 МПа и фугитивности кислорода (водорода), заданной буферами Cu2O–CuO, Fe3O4–Fe2O3, Ni-NiO и Co-CoO. Установлено, что шеелит в растворах HCl при указанных параметрах растворяется инконгруэнтно. В растворах, содержащих от 0.01 до 0.0316 mHCl, в продуктах опытов, наряду с шеелитом, обнаруживаются незначительные количества оксидов вольфрама WO3 и (или) WO3 –x. В растворах, содержащих от 0.1 до 0.316 mHCl, наблюдается образование кальций-вольфрамовых бронз (CTB) CaxWO3, средний состав которых соответствует формуле Ca0.07WO3. На основе анализа полученных экспериментальных данных рассчитаны свободные энергии образования оксидов вольфрама WO3, WO2.9, шеелита и кальций-вольфрамовой бронзы. С использованием взаимосогласованных термодинамических данных рассчитана растворимость шеелита в растворах HCl, (Na,K)Cl с участием алюмосиликатных буферов. Показано, что шеелит имеет широкую область конгруэнтной растворимости в солевых системах.
ВВЕДЕНИЕ
Шеелит CaWO4 – важнейший рудный минерал, в состав которого входит элемент вольфрам, способный менять свою валентность при переходе из твердой фазы в раствор. Несмотря на большое количество работ, посвященных исследованию растворимости этого минерала (Khodakovskiy, Mishin, 1971; Forster, 1977; Wood, Samson 2000), вопрос о влиянии окислительно-восстановительных условий на растворимость шеелита и валентное состояние вольфрама в гидротермальных условиях ранее никогда не рассматривался. Имеющиеся в литературе экспериментальные данные по растворимости шеелита в воде при низких температурах не отличаются большой точностью, что объясняется невысоким качеством исходного материала и его агрегатным состоянием. В исследованиях, проведенных при высоких температурах и давлениях (Рафальский и др., 1984), также отмечается низкая сходимость результатов по растворимости шеелита в воде и водных растворах KCl. В достаточно кислом, равновесном с шееелитом растворе, происходило образование WO3, что приводило к значительному превышению концентрации кальция над вольфрамом (Рафальский и др., 1984). В работе (Hu et al., 2011) было установлено, что в синтетическом нанокристаллическом шеелите отношение Ca2+ к W6+ составляло 1.2 : 1, что, согласно авторам этой публикации, также могло привести к изменению соотношения ионов металлов в растворе при растворении этой твердой фазы. В связи с вышесказанным, исследование растворимости шеелита в различных растворах представляет интерес для построения моделей формирования гидротермальных рудоносных растворов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В настоящей работе представлены результаты экспериментального исследования влияния фугитивности кислорода f(O2) и кислотности (mHCl) на растворимость шеелита (CaWO4) при 500 и 400°С и 100 МПа. В качестве исходного материала использовали шеелит (Sch), полученный перекристаллизацией химического реактива CaWO4 марки (ч.) в 0.1 mHСl при 500°С, 100 МПа, в течение 20 дней и с последующей сушкой при 100°С (фиг. 1). Опыты проводили в запаянных электродуговой сваркой платиновых ампулах (7 × × 0.2 × 50 мм). В опытах при 400°С и 100 МПа в Pt-ампулу вводили 40 мг шеелита и 0.8 мл раствора HCl, а в опытах при 500°С и 100 МПа – 40 мг шеелита и 0.65 мл раствора HCl. Для контроля возможной потери веса во время проведения экспериментов все ампулы до и после опытов взвешивались на электронных весах с точностью до ±0.01 мг.
Фиг. 1.
Исходный (а) химический реактив CaWO4 и после перекристаллизации (б) в 0.1 mHCl при 500°С, 100 МПа в опыте длительностью 20 суток.

Эксперименты проводили на гидротермальной установке высокого давления в реакторах с внутренним диаметром 30 мм, изготовленных из сплава ЭИ-437Б. Нагрев осуществлялся с помощью двухсекционных печек, имеющих широкую (10 см) безградиентную (±3°С) зону. Температура измерялась бронированными хромель-алюмелевыми термопарами, находящимися внутри реактора на уровне навески в ампуле, с точностью ±2°C. Давление в системе задавалось с помощью гидравлического насоса с мультипликатором по манометру сверхвысокого давления типа СВ-2500 с точностью ±2 МПа.
В реактор одновременно загружали 4 платиновые ампулы с исследуемым веществом и 0.01, 0.0316, 0.1 и 0.316 моляльными растворами HCl. Фугитивность кислорода в реакторах задавалась буферными парами Co/CoO, Ni/NiO, Fe3O4/Fe2O3 и Cu2O/CuO. Цилиндрический негерметичный Ni-контейнер с буферной смесью помещался в реактор под Pt-ампулами. Длительность опытов составляла 14 суток. После опытов реакторы в течение 3–5 мин охлаждались водно-воздушной капельной смесью до комнатной температуры.
Продукты опытов переносили из ампул в градуированные конические полипропиленовые пробирки, вымывая содержимое ампул трижды дистиллированной водой. Доводили общий объем до 4.5 мл и отделяли раствор от твердых фаз центрифугированием при 6000 об./мин. Чистый разбавленный раствор отбирали для анализа. Контроль разбавления проводили на аналитических весах. Содержание кальция в этих растворах определяли методами ICP-AES и AAS, а вольфрама – ICP-MS.
Высушенные при 100°C твердые продукты опытов исследовались методом порошковой рентгеновской дифракции XRD и на электронных сканирующих микроскопах VEGA-TESCAN и Cam Scan MV2300.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Раствор
Жидкая фаза после опытов представляла собой бесцветный раствор, не содержащий коллоидной взвеси. Результаты ICP и AAS анализов растворов после опытов представлены в табл. 1. Согласно полученным данным, солянокислый раствор, равновесный с шеелитом, был обогащен кальцием и содержал относительно низкие концентрации вольфрама.
Таблица 1.
Результаты анализа закаленных растворов на содержание вольфрама (ICP-MS) и кальция (ICP-AES и AAS). Общее давление 100 МПа, длительность опытов 14 суток
| Концентрация, моль/кг H2O | |||||||
|---|---|---|---|---|---|---|---|
| № | Т, °C | Буфер | lg f(O2), Па | HClисх | Caaq ICP-AES |
Caaq AAS |
Waq ICP-MS |
| 1 | 400 | Co–CoO | –23.768 | 0.01 | 3.628E–03 | 2.822E–03 | 1.026E–04 |
| 2 | 400 | Co–CoO | 0.0316 | 1.062E–02 | 9.119E–03 | 1.022E–04 | |
| 3 | 400 | Co–CoO | 0.1 | 4.480E–02 | 3.558E–02 | 1.018E–04 | |
| 4 | 400 | Co–CoO | 0.316 | 1.331E–01 | 1.026E–01 | 2.443E–05 | |
| 8 | 400 | Ni–NiO | –22.423 | 0.01 | 3.454E–03 | 7.243E–03 | 5.577E–05 |
| 7 | 400 | Ni–NiO | 0.0316 | 1.157E–02 | 1.027E–02 | 9.989E–05 | |
| 6 | 400 | Ni–NiO | 0.1 | 5.313E–02 | 4.993E–02 | 7.621E–05 | |
| 5 | 400 | Ni–NiO | 0.316 | 1.275E–01 | 1.081E–01 | 1.999E–05 | |
| 9 | 400 | Fe3O4–Fe2O3 | –18.600 | 0.01 | 4.052E–03 | 3.623E–03 | 2.223E–04 |
| 10 | 400 | Fe3O4–Fe2O3 | 0.0316 | 1.049E–02 | 1.057E–02 | 1.580E–04 | |
| 11 | 400 | Fe3O4–Fe2O3 | 0.1 | 3.729E–02 | 3.816E–02 | 8.746E–05 | |
| 12 | 400 | Fe3O4–Fe2O3 | 0.316 | 1.316E–01 | 1.562E–01 | 2.925E–05 | |
| 25 | 400 | Cu2O–CuO | –6.401 | 0.01 | 1.667E–03 | 3.197E–03 | 4.988E–04 |
| 26 | 400 | Cu2O–CuO | 0.0316 | 8.636E–03 | 9.930E–03 | 2.983E–04 | |
| 27 | 400 | Cu2O–CuO | 0.1 | 3.921E–02 | 3.661E–02 | 3.981E–04 | |
| 28 | 400 | Cu2O–CuO | 0.316 | 1.409E–01 | 1.255E–01 | 1.539E–04 | |
| 13 | 500 | Ni–NiO | –17.706 | 0.01 | 3.644E–03 | 3.341E–03 | 7.036E–04 |
| 14 | 500 | Ni–NiO | 0.0316 | 8.505E–03 | 9.146E–03 | 1.332E–03 | |
| 15 | 500 | Ni–NiO | 0.1 | 2.599E–02 | 3.034E–02 | 1.096E–03 | |
| 16 | 500 | Ni–NiO | 0.316 | 7.740E–02 | 8.690E–02 | 1.944E–03 | |
| 17 | 500 | Co–CoO | –19.089 | 0.01 | 3.883E–03 | 3.102E–03 | 1.231E–03 |
| 18 | 500 | Co–CoO | 0.0316 | 3.804E–03 | 1.032E–02 | 8.731E–04 | |
| 19 | 500 | Co–CoO | 0.1 | 9.913E–03 | 8.941E–04 | ||
| 20 | 500 | Co–CoO | 0.316 | 1.008E–01 | 1.033E–01 | 1.927E–04 | |
| 21 | 500 | Cu2O–CuO | –3.567 | 0.01 | 3.584E–03 | 2.754E–03 | 7.688E–04 |
| 22 | 500 | Cu2O–CuO | 0.0316 | 8.650E–03 | 8.892E–03 | 1.062E–03 | |
| 23 | 500 | Cu2O–CuO | 0.1 | 3.005E–02 | 3.583E–02 | 6.820E–04 | |
Анализы на определение кальция в растворах после опытов методами ICP-AES и AAS показали близкие результаты (табл. 1). Согласно полученным данным, концентрация кальция в закаленных растворах не зависит от окислительно-восстановительных условий (f(O2). Но она увеличивается с ростом концентрации HCl в исходном растворе, причем угол наклона lg mCaaq/mHClinit, близок к 1.0 ± 0.1 при 400 и 500°С (табл. 2) Содержание кальция в исходных растворах 0.01, 0.0316, 0.1 и 0.316 mHCl было незначительно и составляло 3.0, 2.2, 1.9 и 16 ×10–5 моль/кг H2O соответственно.
Таблица 2.
Коэффициенты линейной зависимости концентрации кальция от концентрации соляной кислоты в равновесии с шеелитом: lg mCaaq = a + b lg mHClinit
| 400°C, 100 МПа | 500°C, 100 МПа | |||
|---|---|---|---|---|
| О2 буфер | a | b | a | b |
| Co–CoO | –0.384 ± 0.058 | 1.059 ± 0.042 | –0.503 ± 0.040 | 0.981 ± 0.027 |
| Ni–NiO | –0.347 ± 0.080 | 1.049 ± 0.064 | –0.633 ± 0.033 | 0.923 ± 0.024 |
| Fe3O4–Fe2O3 | –0.347 ± 0.043 | 1.055 ± 0.031 | – | – |
| Cu2O–CuO | –0.268 ± 0.076 | 1.179 ± 0.055 | –0.476 ± 0.046 | 1.025 ± 0.034 |
| Среднее знач. | –0.332 ± 0.035 | 1.091 ± 0.026 | –0.544 ± 0.027 | 0.974 ± 0.019 |
Концентрация вольфрама в растворах после опытов, наоборот, мало зависела от mHClinit, но увеличилась при изменении температуры с 400 до 500°С в среднем на один порядок (в 10 раз). Установлено влияние окислительно-восстановительных условий (f(O2) на mWaq, но оно было неоднозначным.
Твердые продукты опытов
Шеелит, используемый в опытах, изначально белого цвета, в ходе эксперимента претерпел изменения. Если в опытах, содержащих 0.01 mHCl, белый цвет сохранился или появилась бледная желтоватая окраска, то с увеличением концентрации HCl наблюдалось изменение окраски от светло-голубой в 0.0316 mHCl до темно-синей, почти черной, в 0.316 mHCl. Интенсивность темной окраски возрастала с уменьшением f(O2) от Cu2O–CuO до Co–CoO буфера. В 0.1 mHCl растворах в продуктах опытов при 500оС имела место значительная перекристаллизация шеелита в крупные отдельные кристаллы размером более 100 мкм. Здесь же присутствовали новообразованные кристаллы черного цвета, имеющие форму полиэдра, подобную кристаллам шеелита. Количество черных кристаллов в опытах с 0.316 mHCl (при 500оС, буферы Ni–NiO и Co–CoO) намного превышало количество прозрачных кристаллов шеелита.
При исследовании твердых продуктов опытов на сканирующем электронном микроскопе было установлено, что в растворах, содержащих 0.01 mHCl, наряду с шеелитом образовались игольчатые кристаллы WO3, количество которых весьма незначительно. В 0.0316 mHCl растворе вместо тонких иголок образовались столбики и прямоугольные или ромбоэдрические двойниковые сростки кристаллов темно-синего цвета (цвет наблюдался в оптическом микроскопе), содержащие также только W и O (WO3 – x). Черные кристаллы, образовавшиеся в растворах, содержащих 0.1 и 0.316 mHCl, при шлифовании и полировке показали зональное строение: внутри они сложены шеелитом, а снаружи на глубину до 40 мкм покрыты оболочкой кальций-вольфрамовых бронз (СТВ) (фиг. 2). Составы CTB фаз представлены в таблице 3. CTB представляют собой тонковолокнистые текстуры и являются конечным продуктом замещения Sch в кислой среде. Сумма оксидов CaO и WO3 в вольфрамовых бронзах ниже, чем в шеелите. Это указывает на наличие воды в структуре CTB. Вынос кальция из Sch осуществлялся по каналам в структуре CTB, а также по межзерновому пространству, которое образуется на границе Sch–CTB. Обращает на себя внимание тот факт, что происходит очень существенная перекристаллизация кристаллов исходной шихты. Наряду с мелкими кристаллами Sch были обнаружены относительно крупные (до 150 мкм) кристаллы Sch и продукты его замещения.
Фиг. 2.
Шлифованные продукты опыта (№ 16) по растворимости шеелита при 500°С, 100 МПа, Ni–NiO буфере в 0.316 mHCl растворе.
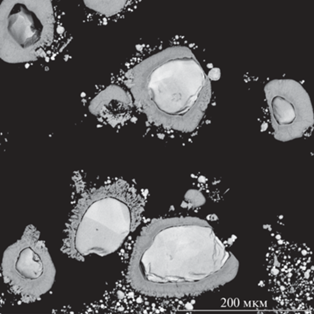
Таблица 3.
Содержание кальция (среднее, молей) в нестехиометрических вольфраматах кальция (кальций-вольфрамовых бронзах – CTB), CaxWO3, образовавшихся в опытах по растворению шеелита в растворах HCl при 500°С, 100 МПа при различных окислительно-восстановительных условиях
| № эксп. | 15 | 16 | 19 | 20 | 23 | 24 |
|---|---|---|---|---|---|---|
| lg f(O2) | Ni–NiO | Ni–NiO | Co–CoO | Co–CoO | CuO–Cu2O | CuO–Cu2O |
| mHCl | 0.1 | 0.316 | 0.1 | 0.316 | 0.1 | 0.316 |
| Выборка | 11 | 8 | 14 | 12 | 11 | 15 |
| Ca | 0.075 ± 0.010 | 0.078 ± 0.007 | 0.064 ± 0.016 | 0.072 ± 0.010 | 0.124 ± 0.019 | 0.059 ± 0.026 |
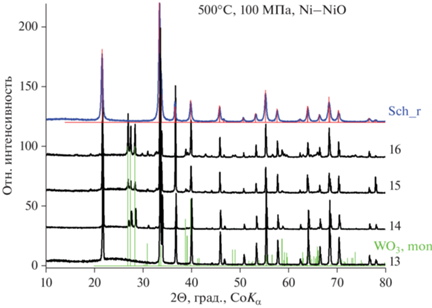
Рентгенограммы твердых продуктов опытов (фиг. 3) указывают на то, что шеелит в 0.01 mHCl остается практически чистым, в 0.0316 mHCl появляются линии, характерные для WO3, а в растворах 0.1 и 0.316 mHCl наблюдается значительный рост рефлексов, близких к 〈002〉 (или 〈001〉), 〈020〉 〈200〉 и изменение их интенсивностей.
Влияние кислородных буферов
Во всех опытах длительностью 2 недели, согласно рентгенофазовому анализу, присутствовали буферные пары Co + CoO, Ni + NiO, Fe3O4 + Fe2O3, Cu2O + CuO, что указывает на то, что в реакторе и проницаемых для водорода платиновых ампулах поддерживалась постоянная фугитивность кислорода (водорода). В продуктах опытов с использованием буфера кобальт-кобальт (II) оксид произошло накопление CoO, а интенсивность линий Co значительно уменьшилась по сравнению с исходной смесью. В никель-бунзенитовом буфере наблюдался незначительный рост интенсивности линий NiO при уменьшении характеристических линий Ni. Куприт-теноритовый буфер изначально содержал практически чистый CuO, а после опытов при 400 и 500°С частично восстановился до Cu2O. В опытах с железо-оксидным буфером при 400оС был использован чистый магнетит (Mgt), который, согласно замыслу, должен был окислиться до гематита (Hem). Однако на рентгенограмме твердых продуктов опытов не были обнаружены линии гематита. Вместе с тем, детальный анализ показал, что кроме линий магнетита на рентгенограмме имеются линии маггемита (Mgh) γ-Fe2O3, и, таким образом, равновесная f(O2) задавалась буфером магнетит-маггемит (Mgt–Mgh).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Очевидно, что шеелит в растворах HCl в изученном интервале концентраций от 0.01 до 0.316 моль · кг–1 H2O растворялся инконгруэнтно. В относительно разбавленных растворах, содержащих от 0.01 до 0.0316 mHCl, в продуктах опытов, наряду с шеелитом, обнаруживаются незначительные количества оксидов вольфрама WO3 и (или) WO3–x. Реакцию растворения Sch с образованием оксидов вольфрама можно представить в виде:
(1)
${\text{CaW}}{{{\text{O}}}_{{\text{4}}}} + {\text{2}}{{{\text{H}}}^{{\text{ + }}}}{\text{ = W}}{{{\text{O}}}_{{{\text{3}}\,\, - \,\,x}}} + {\text{C}}{{{\text{a}}}^{{{\text{2 + }}}}}{\text{ + 0}}{\text{.5}}x{{{\text{O}}}_{{\text{2}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$В растворах, содержащих от 0.1 до 0.316 mHCl, наблюдается образование кальций-вольфрамовых бронз (CTB) CaxWO3, средний состав которых соответствует формуле Ca0.07WO3. Образование CTB идет согласно реакции:
(2)
$x{\text{CaW}}{{{\text{O}}}_{{\text{4}}}}\,\,{\text{ + (1}} - x{\text{)W}}{{{\text{O}}}_{{\text{3}}}} = {\text{C}}{{{\text{a}}}_{x}}{\text{W}}{{{\text{O}}}_{{\text{3}}}} + {\text{0}}{\text{.5}}x{{{\text{O}}}_{{\text{2}}}}.$WO3, образовавшийся по реакции (1), взаимодействуя с Sch, приводит к формированию CTB. То, что в опытах идет расход WO3, видно на снимках образцов. В продуктах опытов, проведенных в растворах, содержащих 0.316 m HCl, оксиды вольфрама практически отсутствуют.
Результаты анализа растворов позволяют оценить количество WO3, образовавшегося при растворении шеелита по реакции (1). Так как на всех этапах проведения опытов проводился весовой контроль реагентов, используя закон действия масс, нетрудно рассчитать выход WO3. Расчеты показали, что раствор 0.01 mHCl, взаимодействуя с Sch, приводит к образованию (1.6 ± 0.8) моль % WO3 при 400 и 500°С. Окислительно-восстановительные условия мало влияют на выход WO3 (или WO3 –x) в этом растворе. Чувствительности рентгенофазового метода анализа недостаточно для идентификации WO3, поэтому на рентгенограммах обнаруживаются линии, присущие только Sch.
Увеличение концентрации HCl, как это и следовало ожидать из данных табл. 1, способствует выходу WO3 (или WO3 – x). Согласно расчетам, в растворе, содержащем 0.0316 mHCl, выход продукта составляет 4.8 ± 1.1 моль %, в растворе 0.1 mHCl – 19.6 ± 6.0, а в 0.316 mHCl – 58.1 ± 15.6. Повышение температуры уменьшает выход WO3, что связано с ростом растворимости этой фазы.
Согласно данным (Cazzanelli et al., 1999), в WO3 фазе имеют место следующие структурные переходы: моноклинная или ε- фаза от 5 до 278 К; триклинная или δ-фаза от 278 до 290–300 K; моноклинная или γ-фаза от 290–300 K до 600 K; орторомбическая β-WO3 от 600 до 1010 K; тетрагональная α-WO3 от 1010 K до температуры плавления 1746 K. Исследуя промышленный, химически чистый WO3, Черкашина с соавторами (Черкашина и др., 2019) пришли к выводу, что триклинная фаза устойчива в интервале температур от 83 до 673 K, рентгенограмма которой имеет большое сходство с моноклинной WO3 фазой. Уточненные данные по структурным переходам даются в работе (Han et al., 2020). В интересующем нас температурном интервале от 673 K до 773 K, согласно (Salje, 1977; Woodward and Sleight, 1997; Voght et al., 1999; Han et al., 2020; Rao, 2013), должна быть устойчива орторомбическая WO3, относящаяся к структурной группе Pmnb (${\text{D}}_{{2{\text{h}}}}^{{16}}$). Орторомбическая структура, согласно EPS-спектрам (Ghosh et al., 2017), имеет, кроме W(VI) (35.8 эВ ∈ W4f7/2, 37.9 эВ ∈ W4f5/2 для частиц W6+), также заметное количество W(V), на что указывают пики при 34.5 и 37.2 эВ, относящиеся к W4f7/2 W4f5/2 колебаниям W5+. Исследования оксидов WO2.97 и WO2.89 (Mews et al., 2016) указывают на наличие W5+ только во второй фазе, тогда как в WO2.97 фазе, согласно EPS-спектрам, присутствует преимущественно W6+.
Рентгенофазовый анализ не позволяет точно идентифицировать структурный тип стехиометрических новообразованных оксидов WO3 и WO3 – x (WO2.9, или W20O58, и WO2.72 или W18O49), устойчивых при параметрах опытов (Wriedt, 1989). В системе W-O термодинамически стабильными являются 3 фазы разного цвета: WO3 (желтый), WO2.9 (темно-синий) и WO2 (темно-коричневый). Метастабильный оксид WO2.72 красно-фиолетового цвета в продуктах опытов не обнаружен. Окислительно-восстановительные условия, даже при Co–CoO буфере, были не достаточны для восстановления WO3 и WO2.9 до WO2. Морфология полученных в опытах оксидов вольфрама связана, прежде всего, с физико-химическими условиями их образования (температурой, давлением, кислотностью раствора, концентрацией кальция, фугитивностью кислорода). Мы не исключаем, что в кристаллах WO3, образовавшихся при 673 и 773 K 100 МПа в опытах длительностью 14 суток, при охлаждении могли произойти структурные переходы: орторомбическая (β-WO3Pmnb) → моноклинная (γ-WO3P2,/n). Возможно также, что при дегидратации гидроксида W(VI), образующегося на начальной стадии растворения шеелита, осаждался метастабильный гексагональный оксид h-WO3, который в режиме опыта переходил в моноклинный γ-WO3 (Lassner, Schubert, 1999). Однако, принимая во внимание относительно крупный размер кристаллов, их окраску, можно прийти к выводу, что в опытах с 0.01 mHCl и Cu2O–CuO буфером в равновесии с раствором был моноклинный γ-WO3. Форма кристаллов – длинные иголки (10–100 мкм) желтого цвета.
Что касается темно-синих кристаллов оксидов вольфрама (TBO) (Lunk et al., 1993), имеющих форму параллелепипедов (близкую к прямоугольникам), то правомерно отнести эти кристаллы к стабильной при 400 и 500°C орторомбической аллотропной модификации WO2.9 (W20O58). Параллелепипедная форма кристаллов могла образоваться в результате реакции дегидратации гидроксидов вольфрама (эльпасалита) – промежуточного продукта инконгруэнтного растворения шеелита (Lassner, Schubert, 1999).
Темно-синие образования на поверхности шеелита – это результат его последовательного замещения метастабильной гексагональной гидроокисью или трехокисью вольфрама (h-WO3), с последующей трансформацией с восстановлением (W6+ → W5+) в гексагональную вольфрамовую бронзу HTB (Lassner, Schubert, 1999). В структуре HTB имеются гексагональные и триангулярные каналы вдоль оси С, через которые могут входить катионы металлов и других частиц с положительным зарядом. Согласно (Lunk et al., 1993), предельный состав HTB, в котором все каналы заполнены катионами А, соответствует формуле A0.33WO3. Принимая во внимание данные анализа на электронном микроскопе, можно утверждать, что состав HTB может изменяться от безводного катион-дефицитного Ca0.07WO3 до предельно-насыщенного (H3O)0.19Ca0.07WO3.
Таким образом, анализ твердых продуктов показал, что:
• в растворах, содержащих 0.01–0.0316 mHCl, при 400–500°C, 100 МПа устойчивы оксиды вольфрама WO3
• в растворах, содержащих 0.1–0.316 mHCl, при 400–500°C, 100 МПа устойчивы гексагональные кальций-вольфрамовые бронзы, в которых мольное отношение в среднем составляет Ca/W = = 0.07.
Формирование WO3 при инконгруэнтном растворении шеелита в кислых растворах ранее отмечалось в работах (Рафальский и др., 1984; Forster, 1977). Согласно данным (Forster, 1977), растворимость шеелита в воде при давлении 100 МПа зависит от температуры и в интервале 265–555°C составляет (4–23) × 10–6 моль кг–1. В растворах сильных электролитов (NaCl, KCl) растворимость шеелита увеличивается с ростом концентрации хлоридов (ионной силы раствора) и кислотности раствора.
Введение хлорида кальция в исследуемый раствор, напротив, снижает растворимость Sch. Согласно (Рафальский и др., 1984), в 1 mNaCl растворе, равновесном с шеелитом, имеющем pH = 3, добавление 0.001 mCaCl2 снижает mW c 5 × × 10–5 моль кг–1 до 3 × 10–6 моль кг–1. Результаты термодинамических расчетов растворимости шеелита в растворах HCl (область pH от 2 до 6), выполненные в цитируемой работе, дают значения mW на 2–2.5 порядка ниже, чем представленные в табл. 1 для 400–500°C, 100 МПа для всех использованных кислородных буферов. Очевидно, что в области инконгруэнтной растворимости содержание вольфрама в растворе будет контролироваться оксидом вольфрама или CTB, а содержание кальция будет определяться равновесием реакции (1). В области концентраций HCl от 0.1 до 0.316 моль кг–1 стабильными фазами являются шеелит и кальций-вольфрамовые бронзы. Если предположить, что состав CTB соответствует формуле Ca0.07WO3 и (или (H3O)0.19Ca0.07WO3), то полученных данных достаточно для уточнения термодинамических свойств CTB.
ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ
Как отмечалось выше, полученные данные указывают на то, что шеелит при 400–500°C, 100 МПа в растворах 0.01–0.316 mHCl растворяется инконгруэнтно. В зависимости от mHCl и f(O2) в ходе опытов образуются WO3, WO2.9 и кальций-содержащие HTB. Эти наблюдения положены в основу термодинамических расчетов.
Очевидно, что при согласовании термодинамических свойств компонентов водного раствора и равновесных с ним твердых фаз необходимо выбрать что-то за основу. Нами в расчетах были использованы следующие частицы водного раствора: H2O, H+, OH–, Cl–, HCl0, Ca2+, CaCl+, ${\text{CaCl}}_{2}^{0},$ CaOH+, ${\text{WO}}_{4}^{{2 - }},$ ${\text{HWO}}_{4}^{ - },$ ${{{\text{H}}}_{{\text{2}}}}{\text{WO}}_{4}^{0}$ (табл. 4) В настоящее время считается, что наилучшие термодинамические данные (константы равновесия) для частиц W(VI) представлены в работе (Wood, Samson, 2000). Для частиц W(V) нами (Redkin, Cygan, 2020) предложены комплексы ${{{\text{W}}}_{{\text{5}}}}{\text{O}}_{{16}}^{{3 - }}$ (при 400°C), ${\text{WO}}_{3}^{ - }$ и ${{{\text{H}}}_{{\text{2}}}}{{{\text{W}}}_{{\text{2}}}}{\text{O}}_{7}^{ - }$ (при 500°C). Для удовлетворительного соответствия расчетов результатам экспериментов необходимо корректировать термодинамические свойства (свободные энергии Гиббса, энтропию) твердых фаз, которые, как правило, имеют значительную погрешность, или вводить новые частицы водного раствора. В любом случае необходим анализ существующих данных и их критический отбор. На результаты расчетов также оказывает влияние выбор модели для описания коэффициентов активности частиц водного раствора. Известно, что повышение температуры расширяет пределы концентраций солей при использовании уравнений Дебая–Гюккеля, хотя против этого мнения существуют многочисленные возражения.
Таблица 4.
Стандартные парциальные моляльные свойства частиц при 298.15 K, 1 бар и HKF параметры, использованные в расчетах
| Частица | ${{\Delta }_{f}}G_{{298}}^{^\circ }$a | $S_{{298}}^{^\circ }$b | a1 × 10 d | a2 × 10–2a | a3e | a4 × 10–4f | c1b | c2 × 10–4f | ω × 10–5a | Ссылка |
|---|---|---|---|---|---|---|---|---|---|---|
| H2WO4(aq) | –22 7742# | 49.050# | 8.1527 | 13.1578 | 1.2439 | –3.7375 | 5.4299 | –4.4806 | –0.4028 | # + Wood & Samson, 2000 |
| ${\text{HWO}}_{4}^{ - }$(aq) | –21 7130# | 52.869# | –18.5862 | 7.1668 | –0.7349 | –2.4827 | –15.4537 | 15.7442 | 0.0347 | # + Wood & Samson, 2000 |
| ${\text{WO}}_{4}^{{2 - }}$(aq) | –21 6210# | 2.128# | –3.8533 | 10.4708 | 4.4891 | –3.2119 | –10.0882 | 68.8178 | 4.0372 | # + Wood & Samson, 2000 |
| CaCl2(aq) | –194 000 | 6.000 | 6.2187 | 7.4058 | 2.8322 | –3.0851 | 23.9610 | 3.2720 | –0.0380 | Sverjensky et al., 1997 |
| CaCl+ | –163 100 | 4.500 | 2.7148 | –1.1497 | 6.1949 | –2.7314 | 20.8839 | 0.5241 | 0.4862 | Sverjensky et al., 1997 |
| CaOH+(aq) | –171 490 | –5.346 | –2.2875 | –13.3704 | 11.0053 | –2.2263 | 14.5527 | 0.1431 | –0.0820 | Akinfiev & Zotov, 1999 |
| Ca2+ | –132 120 | –13.500 | –0.1947 | –7.2520 | 5.2966 | –2.4792 | 9.0000 | –2.5220 | 1.2366 | Johnson et al., 1992 |
| HCl(aq) | –30 410 | 3.200 | 1.2555 | –4.7177 | 7.6043 | –2.5840 | 16.7134 | 2.8727 | –0.7000 | Sverjensky et al., 1991 |
| Cl– | –31 379 | 13.56 | 4.0320 | 4.8010 | 5.5630 | –2.8470 | –4.4000 | –5.7140 | 1.4560 | Johnson et al., 1992 |
| O2(aq) | 3954 | 26.040 | 5.7889 | 6.3536 | 3.2528 | –3.0417 | 35.3530 | 8.3726 | –0.3943 | Johnson et al., 1992 |
| H2(aq) | 4236 | 13.800 | 5.1427 | 4.7758 | 3.8729 | –2.9764 | 27.6251 | 5.0930 | –0.2090 | Johnson et al., 1992 |
Примечание. # Оценены авторами статьи; № a кал моль–1; b кал моль–1 K–1⋅; c см3 моль–1; d кал моль–1 бар–1; e кал K–1 моль–1 бар–1; f кал K–1 моль–1; HKF параметры частиц ${\text{HWO}}_{4}^{ - }$(aq), H2WO4(aq), рассчитаны по значениям Kp (Wood & Samson, 2000). *Термодинамические свойства H2O, H+ и OH– увязаны в программе UNITHERM и используются автоматически.
Расчеты проводились по программе Гиббс (Шваров, 2007). Индивидуальные коэффициенты активности частиц рассчитывались по расширенному уравнению Дебая–Хюккеля во втором приближении (Akinfiev et al., 2020). Размерный параметр (эффективный радиус иона) для всех заряженных частиц принят равным 4.5 Å (Рафальский, 1973). В расчетах были использованы моляльные концентрации частиц Ca и W. Для этого результат моделирования содержания элементов в молях делился на мольную долю воды (активность воды) в растворе.
При выборе термодинамических свойств твердых фаз (оксидов вольфрама, шеелита) был проведен количественный и качественный анализ. В результате исследований установлено, что существующие термодинамические данные по окислительно-восстановительным равновесиям в вольфрам-оксидных системах в интервале температур 300–600°С имеют значительную несогласованность. Поэтому за основу были приняты величины свободных энергий WO3(s) (Han et al., 2020), WO2(s) (Наумов и др., 1971), а $G_{T}^{^\circ }$ для WO2.9 были рассчитаны из констант равновесия реакции
Энтальпия образования шеелита заимствована из данных (Poling et al., 2008), а энтропия и уравнение теплоемкости из работы (Жидикова, Ходаковский, 1984). Расчеты с использованием данных работ (Wood, Samson, 2000) для Sch и (Chase_JANAF, 1998) для WO3 и WO2.9 приводят к результатам, значительно отличающимся от наших экспериментальных данных при 400 и 500°С. Свободная энергия CTB рассчитана по результатам экспериментов при Co–CoO буфере. Было отмечено, что фазы Ca0.07WO3 и или (H3O)0.19Ca0.07WO3 имеют равные значения $\Delta G_{T}^{^\circ }$ и одинаковую растворимость в растворах HCl, несмотря на то, что кажущееся содержание W(V) у них существенно различается – 14 и 33 моль % соответственно. Значения свободных энергий образования твердых фаз, использованные в расчетах, представлены в табл. 5.
Таблица 5.
Свободные энергии образования вольфрам содержащих твердых фаз при Р = 100 МПа, принятые в настоящих расчетах
| T, °C | ${\text{g}}_{T}^{^\circ },$ кДж моль–1 | |||
|---|---|---|---|---|
| CaWO4 | Ca0.07WO3 | WO3 | WO2.9 | |
| 400 | –1592.600 | –849.257 | –802.178 | – |
| 500 | –1599.000 | –859.671 | –820.620 | –798.310 |
Так как в расчетах принимают участие только частицы W(VI), то f(O2) оказывает слабое влияние на содержание кальция и вольфрама в растворе, равновесном с шеелитом. На фиг. 4 представлены результаты термодинамического моделирования инконгруэнтной растворимости шеелита с образованием WO3, WO2.9 и Ca0.07WO3 (или (H3O)0.19Ca0.07WO3) при 400 и 500°С, 100 МПа. Расчеты показали, что в условиях Cu2O–CuO буфера (f(O2) = 3.98 × 10–7 Па) при 400oС область конгруэнтной растворимости шеелита находится при концентрации HCl ниже 4.34 × 10–3 m. При 500°С и фугитивности Cu2O–CuO буфера (f(O2) = = 2.71 × 10–4 Па) область конгруэнтной растворимости шеелита находится при концентрации HCl ниже 4.08 × 10–3m. Растворимость Sch в H2O, согласно расчетам, составляет 2.78 × 10–6 и 2.93 × × 10–6 моль кг–1 H2O. Рост концентрации HCl приводит к осаждению WO3 из раствора. Полное замещение Sch новообразованной фазой WO3 проходит в растворах, содержащих mHCl > 0.42 при 400°С и 0.56 при 500°С.
Фиг. 4.
Влияние mHCl на содержание mW и Ca в растворе, равновесном с шеелитом при 400 и 500°С, Р = 100 МПа и фугитивности кислорода, заданной различными металл-оксидными буферами, по экспериментальным (символы) и расчетным (линии) данным.

В окислительно-восстановительных условиях, соответствующих Fe3O4–Fe2O3 (f(O2) = = 2.51 × 10–19 Па при 400°С), Ni–NiO (f(O2) = = 3.78 × 10–23 Па при 400°С и 1.97 × 10–18 Па при 500°С) и Co–CoO (f(O2) = 1.71 × 10–24 Па при 400°С и 8.16 × 10–20 Па при 500°С) буферам, шеелит растворяется с образованием CTB. Область конгруэнтной растворимости шеелита, так же, как и с Cu2O–CuO буфером, достаточно узкая и ограничена mHCl < 2 × 10–3. В растворах, содержащих mHCl > > 0.36, при заданном соотношении шеелит/раствор = 0.18 моль Sch/1000 г H2O, при 400°С устойчивой фазой является WO3. Согласно расчетам, воздействие растворов, содержащих mHCl > 0.56, на 0.22 моль Sch при 500°С и fO2(Ni–NiO) приводит к образованию WO3, тогда как при Co–CoO буфере устойчив оксид WO2.9.
На фиг. 5 представлены результаты моделирования растворимости Sch в растворах 0.001–1.0 mKCl на линиях гидролизного равновесия микроклина (Mc) с кварцем (Qtz) и мусковитом (Ms):
при 400 и 500°С, P = 100 МПа. В расчетах использованы термодинамические данные (Redkin, Cygan, 2020), взаимосогласованные с экспериментами (Hemley, 1959; Редькин, 1983). Согласно расчетам, растворение Sch при 400 и 500°С в растворах KCl происходит конгруэнтно и фугитивность кислорода (Co/CoO, Ni/NiO и Cu2O/CuO буферы) не оказывает влияния на результаты расчетов. Отмечается удовлетворительное соответствие с экспериментальными данными Фостера (Foster, 1977) при 400 и 500°С, P = 100 МПа. Согласно расчетам, основной вклад в растворимость шеелита вносит частица ${\text{HWO}}_{4}^{ - }$. Рост растворимости шеелита связан, главным образом, с ростом ионной силы раствора (Брызгалин, 1976).Фиг. 5.
Влияние mKCl на содержание mW и Ca в растворе, равновесном с шеелитом в условиях, контролируемых кварц-микроклин-мусковитовым буфером, при 400 и 500°С, 100 МПа и фугитивности кислорода, заданной никель-бунзенитовым (NNO) буфером по экспериментальным ((Foster, 1977) символы: квадратные – 400°С, круглые – 500°С,) и расчетным (линии) данным.

Принимая во внимание, что в природных гидротермальных растворах концентрация солей натрия выше, чем калия, нами выполнены расчеты по растворимости шеелита в растворах NaCl–KCl–HCl. Т.к. состав рудоносных растворов нам не известен, но известно, что они производят кварц-мусковитовое изменение вмещающих пород, то можно ввести граничные условия. Поле ассоциации Qtz + Ms, согласно (Meier, Hemley, 1967), при 500 и 400°С, 100 МПа и mCl = const ограничено следующими нонвариантными точками: Qtz-Ab (альбит)-Mc-Ms, Qtz-Ab-Prg (парагонит)-Ms и Qtz-And (андалузит)-Prg-Ms (при 500°С) или Qtz-Pf (пирофиллит)-Prg-Ms (при 400°С). Термодинамические данные для всех Al–Si фаз, использованные в работе (Redkin, Cygan, 2020), представлены в табл. 6. Очевидно, что если концентрация хлоридов в системе меняется, то нонвариантные точки превращаются в гидролизные равновесия, определяющие отношения mKCl/mHCl и mNaCl/mHCl. Таким образом, растворимость Sch на линиях реакций гидролиза алюмосиликатов будет соответствовать предельным значениям.
Таблица 6.
Стандартные термодинамические свойства Al–Si твердых фаз, принятые в настоящих расчетах.
| Минерал | ${{\Delta }_{f}}G_{{298}}^{^\circ }$ | $S_{{298}}^{^\circ }$ | V298 | $C_{p}^{^\circ }$ = a + bT × 10–3 + + cT–2 × 105 + dT–0.5+ fT2 | Источник | ||
|---|---|---|---|---|---|---|---|
| индекс | Дж моль–1 | Дж моль–1 K–1 | Дж бар–1 | a | b | c | |
| Ab | –3 715 775# | 194.20# | 10.007 | 583.94 | –92.852 | 16.78* | Robie et al., 1978 |
| And | –2 417980# | 93.220 | 4.9900# | 164.42# | 33.594# | –46.078# | Robie et al., 1978 |
| Mc | –3 742 330 | 214.2 | 10.872 | 759.55 | –217.11 | 47.642* | Robie et al., 1978 |
| Ms | –5 600 547# | 245.000# | 14.0810 | 917.70 | –81.11 | 28.34* | Robie et al., 1995 |
| Pf | –5 240 840# | 239.400# | 12.8100 | –87.4007 | 847.683 | –45.1557* | Krupka et al., 1979 |
| Prg | –5 546 450# | 277.82 | 13.253 | 407.647 | 102.508 | –110.625 | Покровский, 1984 |
| Qtz | –856 240 | 41.340 | 2.2688 | 46.940 | 34.31 | –11.30 | Helgeson et al.,1978 |
На фиг. 6 представлены результаты расчета растворимости Sch в растворах (Na, K)Cl в системе, где кислотность растворов и окислительно-восстановительные условия контролируется алюмо-силикатными буферами и металл-оксидными буферами. Расчеты выполнены при 400 и 500°С, давлении 100 МПа. Было показано, что шеелит растворяется конгруэнтно в растворах, контролируемых буферами Qtz-Ab-Mc-Ms, Qtz-Ab-Prg-Ms, и Qtz-And-Prg-Ms при 500°С, Qtz-Ab-Mc-Ms и Qtz-Ab-Prg-Ms при 400°С. Окислительно-восстановительные условия не влияют на концентрацию вольфрама в растворе ввиду того, что в рассматриваемых условиях (500°С, 100 МПа, mKCl, fO2) устойчива единственная твердая фаза, содержащая W(VI): Sch. Содержание вольфрама растет с общей концентрацией хлоридов и с кислотностью Al-Si буфера (фиг. 6).
Фиг. 6.
Влияние концентрации хлоридов (NaCl, KCl) на растворимость шеелита при 400 (а) и 500°C (б), 100 МПа, Cu2O–CuO буферах и кислотности, регулируемой Al–Si ассоциациями Qtz+Ab+Mc+Ms, Qtz+Ab+Ms+Prg, Qtz+Pf+Ms+Prg (при 400°C) и Qtz+And+Ms+Prg (при 500°C). +WO3 – шеелит растворяется инконгруэнтно с образованием трехокиси вольфрама.
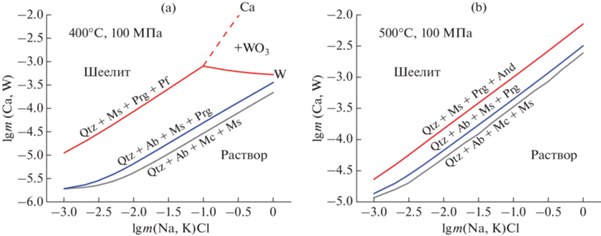
Согласно расчетам, в условиях буфера Qtz-Pf-Prg-Ms при 400°С, 100 МПа в растворах, содержащих mClinit = m(NaCl + KCl)init > 0.094, наряду с Sch устойчив триоксид вольфрама – WO3. Для гидротермальных месторождений вольфрама не характерно одновременное присутствие Sch и WO3. Газово-жидкие включения в минералах на месторождениях вольфрама свидетельствуют о высокой солености высокотемпературных гидротермальных растворов (Wood, Vlassopoulos, 1989). Очевидно, что рудоносные растворы существовали не сами по себе, а были в состоянии, близком к равновесию с вмещающими алюмосиликатными породами, роль которых подобна рассматриваемым буферам. Т.к. из рассмотрения должны быть исключены растворы, в которых образуется WO3, то из этого следует, что кислотность (mH+) вольфрамово-рудных растворов была ниже, чем задается буфером Qtz-Pf-Prg-Ms при 400°С в 0.1 m(Na,K)Cl растворе. В качестве показателя кислотности Al–Si буферной ассоциации может рассматриваться равновесное отношение mNa+/mH+ (или mK+/mH+). Если предположить, что главным механизмом осаждения шеелита из раствора было охлаждение последнего, то можно показать, что растворы, насыщенные шеелитом и равновесные с Qtz-Ab-Mc-Ms и Qtz-Ab-Prg-Ms минеральными ассоциациями при 500°С, 100 МПа, при изменении температуры до 400°С способны отложить 90–92% Sch.
Сравнение данных по растворимости ферберита (Redkin, Cygan, 2020) и шеелита (фиг. 6) в буферных Al–Si системах могут быть использованы для оценки равновесия этих рудных фаз в хлоридной системе. Согласно термодинамическим расчетам, величина mCaaq/(mCaaq + mFeaq) зависит от ионной силы раствора и составляет 0.41 ± 0.03 и 0.78 ± 0.08 при 500 и 400°С, 100 МПа для Qtz-Ab-Mc-Ms и Qtz-Ab-Prg-Ms. Эти величины имеют хорошее соответствие с экспериментальными данными (Коржинская, Зарайский, 1997) по обменному равновесию Ferb + CaCl2 = Sch + FeCl2, изученному в условиях Ni–NiO буфера.
ВЫВОДЫ
Изучена растворимость шеелита в растворах HCl при 400 и 500°С, Робщ = 100 МПа. Установлено, что Sch в растворах HCl от 0.01 до 0.316 m растворяется инконгруэнтно с образованием WO3, WO2.9 и кальций-вольфрамовых бронз, средний состав которых соответствует формуле Ca0.07WO3. Увеличение концентрации HCl способствует выходу WO3 (или WO3 – x). Повышение температуры уменьшает выход WO3, что связано с ростом растворимости этой фазы.
На основе анализа полученных экспериментальных данных рассчитаны свободные энергии образования оксидов вольфрама WO3, WO2.9, шеелита и кальций-вольфрамовой бронзы. Используя взаимосогласованные термодинамические данные, рассчитана растворимость Sch в растворах HCl, (Na,K)Cl с участием алюмо-силикатных буферов. Показано, что шеелит имеет широкую область конгруэнтной растворимости в солевых системах.
Список литературы
Брызгалин О.В. О растворимости вольфрамовой кислоты в водно-солевых растворах при высоких температурах // Геохимия. 1976. № 6. С. 864–870.
Жидикова А.П., Ходаковский И.Л. Термодинамические свойства ферберита, гюбнерита, шеелита и повелита. Физико-химические модели петрогенеза и рудообразования. Новосибирск: Наука, 1984. 156 с.
Коржинская В.С., Зарайский Г.П. Экспериментальное исследование равновесия шеелит-ферберит в хлоридном флюиде при Т = 300–600°C, Р = 1 кбар // Докл. АН. Сер. Геохимия. 1997. Т. 353. № 5. С. 663–666.
Наумов Г.Б., Рыженко Б.Н., Ходаковский И.Л. Справочник термодинамических величин (для геологов). М.: Атомиздат, 1971. 384 с.
Покровский В.А. Исследование минеральных реакций в модельных гидротермальных системах: автореф. дисс. … канд. геол.-минералог. наук. М: МГУ, 1984.
Редькин А.Ф. Экспериментальное и термодинамическое изучение реакций, контролирующих условия образования околорудных березитов: автореф. дисс. … канд. хим. наук. М: ГЕОХИ АН СССР, 1983. 27 с.
Рафальский Р.П., Брызгалин О.В., Федоров П.Л. Перенос вольфрама и отложение шеелита в гиротермальных условиях // Геохимия. 1984. № 5. С. 611–624.
Рафальский Р.П. Гидротермальные равновесия и процессы минералообразования. М.: Атомиздат, 1973. 288 с.
Черкашина Н.И., Павленко В.И., Ястребинский Р.Н. Фазовые переходы и изменение электрофизических свойств WO3 в температурном диапазоне 83–673 К // Известия ВУЗов. Физика. 2019. Т. 62. № 5 (737). С. 126–131.
Шваров Ю.В. О термодинамических моделях реальных растворов // Геохимия. 2007. № 6. С. 670–679.
Akinfiev N.N., Korzhinskaya V.S., Kotova N.P., Redkin A.F., Zotov A.V. Niobium and tantalum in hydrothermal fluids: Thermodynamic description of hydroxide and hydroxofluoride complexes // Geochim. Cosmochim. Acta. 2020. V. 280. P. 102–115.
Akinfiev N., Zotov A. Thermodynamic description of equilibria in mixed fluids (H2O-non-polar gas) over a wide range of temperature (25–700°C) and pressure (1–5000 bars) // Geochim. Cosmochim. Acta. 1999. V. 63 (13/14). P. 2025–2041.
Cazzanelli E., Vinegoni C., Mariotto G., Kuzmin A. and Purans J. Low-temperature polymorphism in tungsten trioxide powders and its dependence on mechanical treatments // J. Solid State Chem. 1999. V. 143. P. 24–32.
Charlu T.V., Kleppa O.J. High-temperature combustion calorimetry 1. Enthalpies of formation of tungsten oxides // J. Chem. Thermodyn. 1973. V. 5. P. 325–330.
Chase Jr. M.W. NIST-JANAF thermochemical tables // Journal of physical and chemical reference data, Monograph;, no. 9. American Chemical Society; Woodbury N.Y. American Institute of Physics for the National Institute of Standards and Technology. 1998. 1961 p.
Foster R.P. Solubility of scheelite in hydrothermal chloride solutions // Chem. Geol. 1977. V. 20(1). P. 7–43.
Johnson J.W., Oelkers E.H., Helgeson H.C. SUPCRT92: A software package for calculating the standard molal thermodynamic properties of minerals, gases, aqueous species, and reactions from 1 to 5000 bar and 0 to 1000°C // Computers & Geosciences. 1992. V. 18 (7). 899–947.
Ghosh K., Roy A., Tripathi S., Ghule S., Singh A.K., Ravishankar N. Insights into nucleation, growth and phase selection of WO3: morphology control and electrochromic properties // J. Mater. Chem. 2017. V. 5. P. 7307–7316.
Han B., Khoroshilov A.V., Tyurin A.V., Baranchikov A.E., Razumov M.I., Ivanova O.S., Gavrichev K.S., Ivanov V.K. WO3 thermodynamic properties at 80–1256 K revisited // J. Therm. Anal. Calorim. 2020. V. 142. P. 1533–1543.
Helgeson H.C., Delany J.M., Nesbitt H.W., Bird D.K. Summary and critique of the thermodynamic properties of rock-forming minerals // Amer. J. Sci. 1978. V. 278-A. 229 p.
Hemley J.J. Some mineralogical equilibria in the system K2O-Al2O3-SiO2-H2O // Amer. J. Sci. 1959. V. 257. P. 241–270.
Hu W., Tong W., Li L., Zheng J., Li G. Cation non-stoichiometry in multi-component oxide nanoparticles by solution chemistry: a case study on CaWO4 for tailored structural properties // Phys. Chem. 2011. V. 13. P. 11634–11643.
Khodokovskiy I.L., Mishin I.V. Solubility products of calcium molybdate and calcium tungstate; ratio of powellite to scheelite mineralization under hydrothermal conditions // Int. Geol. Rev. 1971. V. 13. №. 5. P. 760–768.
Krupka K.M., Robie R.A., Hemingway B.S. High-temperature heat capacities of corundum, periclase, anorthite, CaAl2Si2O8 glass, muscovite, pyrophyllite, KAlSi3O8 glass, grossular, and NaAlSi3O8 glass // Am. Min. 1979. V. 64 (1–2). P. 86–101.
Lassner E., Schubert W.-D. Tungsten: properties, chemistry, technology of the element, alloys, and chemical compounds. Kluwer Academic / Plenum Publishers New York, 1999. 447 p.
Lunk H.-J., Ziemer B., Salmen M., Heidemann D. What is behind ‘tungsten blue oxides? // Proceedings of the 13 International Plansee Seminar, Eds. H. Bildstein and R. Eck, Metallwerk Plansee, Reutte. 1993. V. 1. P. 38–56
Mews M., Korte L., Rech B. Oxygen Vacancies in Tungsten Oxide and Their Influence on Tungsten Oxide/Silicon Heterojunction Solar Cells // Sol. Energy Mater. Sol. Cells. 2016. V. 158. P. 77–83.
Meyer C., Hemley J.J. Wall rock alteration. In: Geochemistry of Hydrothermal Ore Deposits (ed. H.L. Barnes). New York: Holt, Rinehart, and Winston, 1967. P. 166–235.
Poling B.E., Thomson G.H., Friend D.G., Rowley R.L., Wilding W. Section 2. Physical and Chemical Data. Perry’s Chemical Engineers’ Handbook. 8-th Edition. (Don W. Green and Robert P.E. Perry eds.). McGraw-Hill Companies, Inc. New York, NY, 2008. 2728 p. https://doi.org/10.1036/0071511245
Rao M.C. Structure and properties of WO3 thin films for electrochromic device application // J. Non oxide Glasses. 2013. V. 5 (1). P. 1–8.
Redkin A.F., Cygan G.L. Experimental determination of ferberite solubility in the KCl-HCl-H2O system at 400–500°C, and 20–100 MPa // In Advances in Experimental and Genetic Mineralogy (Eds.: Yu. Litvin., O. Safonov). Springer. New York. 2020. Chapter 7. P. 137–162.
Robie R.A., Hemingway B.S., Fisher J.R. Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar (105 Pascals) pressure and at higher temperatures // U.S. Geological Survey Bulletin 1452. Washington. 1978. 456 p.
Robie R.A., Hemingway B.S. Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar (105 Pascals) pressure and at higher temperatures // U.S. Geological Survey Bulletin 2131. Washington. 1995. 461 p.
Salje E. The orthorhombic phase of WO3 // Acta Cryst. B33. 1977. P. 574–577.
Sverjensky D.A., Hemley J.J., and D’Angelo W.M. Thermodynamic assessment of hydrothermal alkali feldspar-mica-aluminosilicate equilibria // Geochim. Cosmochim. Acta. 1991. V. 55. P. 989–1004.
Vogt T., Woodward P. M. and Hunter B. A. The high-temperature phases of WO3 // J. Solid State Chem. 1999. V. 144. P. 209–215.
Wood S. A. and Samson I. M. The hydrothermal geochemistry of tungsten in granitoid environments: I. Relative solubilities of ferberite and scheelite as a function of T, P, pH, and mNaCl // Economic Geology. 2000. V. 95(1), P. 143–182.
Wood S.A. and Vlassopoulos D. Experimental determination of the hydrothermal solubility and speciation of tungsten at 500°C and 1 kbar // Geochim. Cosmochim. Acta. 1989. V. 53. P. 303–312
Wriedt H.A. The O-W (Oxygen-Tungsten) system // Bull. Alloy Phase Diagr. 1989. V. 10(4). P. 368–384.
Дополнительные материалы отсутствуют.
Инструменты
Геология рудных месторождений