Геология рудных месторождений, 2023, T. 65, № 1, стр. 32-45
Кадмий в H2S-содержащих водных растворах: эксперментальное исследование растворимости CdS при 25–80°С
Е. Ф. Базаркина a, А. В. Зотов a, Д. А. Чареев a, b, Л. Трюш c, М. Е. Тарнопольская a
a Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН
119017 Москва, Старомонетный пер., 35, Россия
b Институт экспериментальной минералогии им. академика Д.С. Коржинского РАН
142432 Московская область, Черноголовка,
ул. Академика Осипьяна, 4, Россия
c Université Grenoble Alpes
38041 Grenoble, BP 53, UMR 5275 CNRS, ISTerre, France
Поступила в редакцию 25.07.2022
После доработки 17.10.2022
Принята к публикации 17.10.2022
- EDN: LAUBWE
- DOI: 10.31857/S0016777023010045
Аннотация
Экспериментально исследованы влияние температуры и содержания сульфидной серы на комплексообразование кадмия в восстановительных условиях. Определена растворимость гринокита (CdS) в растворах H2O–H2S–HClO4–NaHS при 25–80°С в зависимости от рН и концентрации серы. На основании измерений в сильно-кислых растворах уточнены стандартные термодинамические свойства гринокита. Рекомендованное значение ${{\Delta }_{f}}G_{{298.15}}^{0}$ (гринокит) = –151.5 ± 0.3 кДж моль–1. Растворимость гринокита выше, чем предполагали на основании прежних литературных данных. Определены константы устойчивости гидросульфидных комплексов кадмия при 80°С: 10–5.65 ± 1.00 для реакции CdS(s) + H+ = CdHS+, 10–6.00 ± 0.40 для CdS(s) + H2S$_{{({\text{aq}})}}^{0}$ = Cd(HS)$_{{2({\text{aq}})}}^{0}$, 10–3.87 ± 0.10 для CdS(s) + H2S$_{{({\text{aq}})}}^{0}$ + HS– = Cd(HS)$_{3}^{ - }$, и 10–3.53 ± 0.20 для CdS(s) + H2S$_{{({\text{aq}})}}^{0}$ + 2HS– = Cd(HS)$_{4}^{{2 - }}$. Моделирование поведения кадмия при температурах от 3 до 200°С показывает, что доля комплексов Cd(HS)$_{n}^{{2\,\, - \,\,n}}$ (n = 1–4) увеличивается с ростом концентрации серы и уменьшается с температурой. В морских условиях при mH2S ≥ 10–5 преобладающей формой кадмия будут не хлоридные, а гидросульфидные комплексы. Эти изменения должны быть учтены при расчетах изотопного фракционирования кадмия. Важнейшим фактором геохимического поведения кадмия является режим серы: высокие концентрации H2S приводят к его мобилизации, а низкие – к осаждению.
ВВЕДЕНИЕ
Понимание процессов мобилизации и накопления кадмия в природе крайне важно из-за очень высокой токсичности этого металла. Болезнью Итай-Итай было названо массовое отравление кадмием в префектуре Тояма (Япония), вызванное добычей кадмий-содержащей руды и связанным с этим загрязнением вод. По данным Всемирной ВОЗ (2011), нижний предел содержания кадмия в питьевой воде составляет всего 3 части на миллиард (ppb), что в 10, 3 и 2 раза ниже, чем урана, свинца и неорганической ртути. По геохимической классификации Гольдшмидта, Cd является халькофильным элементом – имеет низкое сродство к кислороду и предпочитает связываться с серой. Будучи высоко рассеянным элементом в земной коре (среднее содержание 80 частей на миллиард (Rudnick, Gao, 2014), кадмий концентрируется в гидротермальных сульфидных рудах до нескольких мас. % (коэффициент концентрирования около 107). Высокое сродство к восстановленной сере делает гринокит одной из основных твердых фаз кадмия в окружающей среде. При этом существует большой разброс в значениях произведения растворимости гринокита по литературным данным. Растворимость слабо кристаллизованных и тонкодисперсных фаз гринокита на 1–3 порядка выше, чем хорошо кристаллизованных (Daskalakis and Helz, 1992; Wang and Tessier, 1999). Этим, по-видимому, объясняются серьезные расхождения в термодинамических свойствах гринокита, приводимых в разных справочниках (Mills, 1974; Robie, Hemingway, 1995; Lide, 2003). Уточнение стандартных термодинамических свойств гринокита является одной из задач настоящего исследования.
Распределение растворенного кадмия в водной толще и осадках в океане представляет большой научный интерес (Janssen et al., 2014; Little et al., 2015). Как это ни парадоксально, распределение растворенного Cd и фосфата коррелируют друг с другом, что указывает на потенциальную физиологическую роль кадмия в фитопланктоне (Cullen, Maldonado, 2013; Xu, Morel, 2013). Таким образом, кадмий является не только загрязнителем, но и важным косвенным палео-океанографическим показателем (Crea et al., 2013; Janssen et al., 2014).
В эвксинных условиях, когда воды лишены кислорода и содержат H2S, кадмий осаждается в виде CdS, но при литификации осадков может ремобилизоваться, образуя водные гидросульфидные комплексы. Самые крупные современные эвксинии встречаются в Черном море, в бассейне Кариако в Венесуэле и на окраине Перу. Диапазон температур в этих водоемах и их осадках в процессе диагенеза достаточно широк – от 3 до 200°С. Чтобы предсказывать поведение кадмия, необходимо знать стехиометрию и устойчивость его гидросульфидных комплексов. На сегодняшний день имеются лишь редкие данные только для 25°С.
Прямые определения разных комплексов кадмия в природных водах ограничены крайне низкими концентрациями меньше 0.1 ppb (Crea et al., 2013). При комнатных температурах наиболее важным лигандом служит Cl– (Базаркина и др., 2010; Bazarkina et al., 2010; Foti et al., 2011; Powell et al., 2011). Хлоридные комплексы кадмия характеризуются высокой устойчивостью и сильной температурной зависимостью (Базаркина и др., 2010; Bazarkina et al., 2010). Вопрос о возможной роли в транспорте кадмия гидросульфидных комплексов остается открытым из-за недостатка экспериментальных данных. Все предыдущие исследования проводились лишь при комнатных температурах (Ste-Marie et al., 1964; Van Hövell tot Westerflier et al., 1987; Daskalakis and Helz, 1992; Zhang and Millero, 1994; Al-Farawati and Van Den Berg, 1999; Wang and Tessier, 1999). Наиболее обстоятельно последнее исследование (Wang and Tessier, 1999). Его авторы определили константы устойчивости четырех комплексов CdHS+, Cd(HS)$_{{2({\text{aq}})}}^{0}$, Cd(HS)$_{3}^{ - },$ and Cd(HS)$_{4}^{{2 - }}$ из измерений растворимости CdS. Также было показано, что смешанные комплексы типа CdOHS– значения не имеют. Термодинамические данные, предложенные этими авторами, описывают также эксперименты (Daskalakis and Helz, 1992; Al-Farawati and Van Den Berg, 1999). Цель нашего исследования – установить температурную зависимость констант устойчивости гидросульфидных Cd-комплексов.
Наши знания о природном механизме фракционирования стабильных изотопов кадмия основаны на определенных моделях комплексообраования (Zhu et al, 2015). Согласно теоретическим расчетам (Yang et al., 2015), наблюдается тенденция обогащения тяжелым изотопом в порядке: Cd-гидроксиды > Cd-нитраты > Cd-гидраты > Cd-хлориды > Cd-гидросульфиды. При фракционировании гидросульфидные комплексы имеют наиболее легкий изотопный состав Cd. Для интерпретации природных изотопных составов кадмия необходимо знать поля преобладания гидросульфидных комплексов. Цель настоящей работы – пересмотр термодинамических свойств гринокита CdS и определение устойчивости Cd–HS-комплексов посредством измерения растворимости хорошо окристаллизованной синтетической фазы CdS. Новые данные необходимы для моделирования переноса и отложения Cd в различных условиях при температурах 3–200°С.
МАТЕРИАЛЫ И МЕТОДЫ
Опыты по растворимости CdS проведены при 25–80°С и давлении 1 бар в стеклянных ампулах из пирекса с внутренним объемом 50 и 250 см3 и в автоклавах из титанового слава ВТ‑8, футерованных фторопластом (30 и 40 см3). Ампулы использовали в опытах с сильно кислыми (рН 0.3–1.5) растворами, автоклавы – в нейтральных и щелочных условиях. Кристаллы CdS величиной 0.5–3 мм были перекристаллизованы из мелкодисперсного порошка CdS при избытке элементарной серы методом газового потока (Schafer, 1962). Синтез проводили в вакуумированных запаянных кварцевых ампулах при стационарном градиенте (850°С на горячем конце ампулы и 790°С – на холодном), в качестве флюса использовали NH4Cl. Рентгеноструктурный анализ (дифрактометр Rigaku D/Max-2200, CuKα излучение) и сканирующая электронная микроскопия (микроскоп JSM-5610LV, спектрометр INCA-450) показали наличие одной фазы – гексагональной модификации СdS (гринокит), гавлеит (кубический СdS) не обнаружен.
Экспериментальные растворы готовили смешением растворов H2O–HClO4–NaOH как без сероводорода, так и насыщенных H2S. Растворы стандартизированы йодометрически и по величине рН (см. ниже). Во избежание окисления, бидистиллированную воду для приготовления растворов кипятили и продували аргоном во время охлаждения, чтобы удалить следы кислорода. Газообразный сероводород, используемый для насыщения растворов H2O–HClO4–NaOH, получали при взаимодействии Al2S3 с водой. Составы экспериментальных растворов представлены в табл. 1–3, в моль (кг Н2О)–1. Пузырьки газа во всех опытах не превышали 0.1% от общего объема.
Таблица 1.
Растворимость гринокита CdS в растворах HClO4 при 25°С
| Экспе-римент | N, сутки | mHClO4 | pH25°C | mCdexp | mCdcalc |
|---|---|---|---|---|---|
| 101 | 41 | 0.575 | 0.41 | 7.4 × 10–5 | 8.6 × 10–5 |
| 106 | 14 | 0.516 | 0.46 | 7.1 × 10–5 | 7.6 × 10–5 |
| 107 | 14 | 0.516 | 0.46 | 7.6 × 10–5 | 7.6 × 10–5 |
| 110 | 14 | 0.516 | 0.46 | 7.3 × 10–5 | 7.6 × 10–5 |
| 117 | 28 | 0.185 | 0.87 | 2.8 × 10–5 | 2.5 × 10–5 |
| 119 | 28 | 0.185 | 0.87 | 2.0 × 10–5 | 2.5 × 10–5 |
| 112 | 28 | 0.0404 | 1.47 | 5.9 × 10–6 | 5.0 × 10–6 |
| 120 | 28 | 0.0404 | 1.47 | 5.5 × 10–6 | 5.0 × 10–6 |
| Error | ±1% | ±0.05 | ±20% |
Таблица 2.
Растворимость гринокита CdS в растворах HClO4 при 80°C
| Экспе-римент | N, сутки | mHClO4 | pH25°C | pH80°C | mCdexp | mCdcalc |
|---|---|---|---|---|---|---|
| 103 | 41 | 0.575 | 0.41 | 0.43 | 3.5 × 10–4 | 3.9 × 10–4 |
| 105 | 14 | 0.516 | 0.46 | 0.47 | 3.0 × 10–4 | 3.5 × 10–4 |
| 109 | 14 | 0.516 | 0.46 | 0.47 | 2.8 × 10–4 | 3.5 × 10–4 |
| 108 | 14 | 0.516 | 0.46 | 0.47 | 2.5 × 10–4 | 3.5 × 10–4 |
| 111 | 14 | 0.185 | 0.87 | 0.88 | 1.0 × 10–4 | 1.1 × 10–4 |
| 113 | 14 | 0.185 | 0.87 | 0.88 | 9.9 × 10–5 | 1.1 × 10–4 |
| 115 | 14 | 0.185 | 0.87 | 0.88 | 1.1 × 10–4 | 1.1 × 10–4 |
| 114 | 14 | 0.0404 | 1.47 | 1.48 | 2.0 × 10–5 | 2.0 × 10–5 |
| 116 | 14 | 0.0404 | 1.47 | 1.48 | 2.6 × 10–5 | 2.0 × 10–5 |
| 121 | 14 | 0.0404 | 1.47 | 1.48 | 2.4 × 10–5 | 2.0 × 10–5 |
| Error | ±1% | ±0.05 | ±0.05 | ±20% |
Таблица 3.
Растворимость гринокита CdS в H2S-содержащих растворах при 80°C
| Sample | N, days | mHClO4 | mNaHS | ΣmSII | pH25°C | pH80°C | mCd |
|---|---|---|---|---|---|---|---|
| 9 | 5 | 0.575 | 0 | 0.10 | 0.41 | 0.43 | 2.9 × 10–6 |
| 52 | 7 | 0.575 | 0 | 0.10 | 0.41 | 0.43 | 4.0 × 10–6 |
| 53 | 12 | 0.575 | 0 | 0.10 | 0.41 | 0.43 | 2.4 × 10–6 |
| 11 | 41 | 0.575 | 0 | 0.10 | 0.41 | 0.43 | 1.8 × 10–6 |
| 77 | 14 | 0.0141 | 0 | 0.060 | 1.90 | 1.91 | 3.5 × 10–8 |
| 78 | 17 | 0.0141 | 0 | 0.060 | 1.90 | 1.91 | 1.1 × 10–8 |
| 711 | 17 | 0.0141 | 0 | 0.060 | 1.90 | 1.91 | 7.8 × 10–8 |
| 76 | 14 | 0.00296 | 0 | 0.060 | 2.55 | 2.56 | 5.6 × 10–7 |
| 715 | 17 | 0.00296 | 0 | 0.060 | 2.55 | 2.56 | 8.1 × 10–8 |
| 731 | 17 | 0.00296 | 0 | 0.060 | 2.55 | 2.56 | 1.5 × 10–7 |
| 716 | 14 | 0.00101 | 0 | 0.060 | 3.01 | 3.00 | 6.6 × 10–8 |
| 721 | 17 | 0.00101 | 0 | 0.060 | 3.01 | 3.00 | 3.6 × 10–8 |
| 725 | 17 | 0.00101 | 0 | 0.060 | 3.01 | 3.00 | 8.4 × 10–8 |
| 70 | 14 | 0 | 0 | 0.050 | 4.10 | 3.92 | 1.7 × 10–8 |
| 714 | 14 | 0 | 0 | 0.050 | 4.10 | 3.92 | 2.4 × 10–9 |
| 720 | 17 | 0 | 0 | 0.050 | 4.10 | 3.92 | 4.9 × 10–8 |
| 722 | 17 | 0 | 0 | 0.050 | 4.10 | 3.92 | 1.7 × 10–8 |
| 50 | 12 | 0 | 0.0191 | 0.046 | 6.78 | 6.32 | 9.4 × 10–8 |
| 511 | 12 | 0 | 0.0191 | 0.046 | 6.78 | 6.32 | 9.2 × 10–8 |
| 514 | 12 | 0 | 0.0191 | 0.038 | 6.92 | 6.47 | 7.5 × 10–8 |
| 525 | 12 | 0 | 0.0247 | 0.068 | 6.67 | 6.22 | 2.0 × 10–7 |
| 515 | 12 | 0 | 0.0247 | 0.055 | 6.83 | 6.37 | 1.4 × 10–7 |
| 57 | 12 | 0 | 0.0247 | 0.047 | 6.96 | 6.51 | 1.0 × 10–7 |
| 522 | 12 | 0 | 0.0523 | 0.090 | 7.04 | 6.58 | 3.5 × 10–7 |
| 521 | 12 | 0 | 0.0523 | 0.10 | 6.86 | 6.40 | 5.1 × 10–7 |
| 531 | 12 | 0 | 0.0523 | 0.10 | 6.86 | 6.40 | 5.6 × 10–7 |
| 58 | 12 | 0 | 0.0523 | 0.11 | 6.83 | 6.37 | 5.9 × 10–7 |
| 66 | 17 | 0 | 0.0960 | 0.11 | 7.81 | 7.35 | 2.2 × 10–7 |
| 615 | 16 | 0 | 0.0960 | 0.10 | 8.07 | 7.61 | 1.1 × 10–7 |
| 620 | 16 | 0 | 0.0960 | 0.10 | 8.07 | 7.61 | 1.2 × 10–7 |
| 622 | 16 | 0 | 0.466 | 0.50 | 7.93 | 7.45 | 7.8 × 10–6 |
| 625 | 17 | 0 | 0.466 | 0.50 | 7.93 | 7.45 | 8.5 × 10–6 |
| 631 | 16 | 0 | 0.466 | 0.50 | 7.93 | 7.45 | 8.2 × 10–6 |
| 60 | 17 | 0 | 0.753 | 0.81 | 7.87 | 7.39 | 3.8 × 10–5 |
| 611 | 17 | 0 | 0.753 | 0.81 | 7.87 | 7.39 | 3.7 × 10–5 |
| 621 | 17 | 0 | 0.753 | 0.81 | 7.87 | 7.39 | 3.9 × 10–5 |
| Погрешность | ±5% | ±5–20%a | ±0.05 | ±0.05 | ±20% |
Время достижения равновесия в системе CdS–H2O–H2S составляло 7 дней при 25°С и 5 дней при 80°С. Это согласуется с данными (Wang and Tessier, 1999) при 25°С. При более длительных опытах при 80°С (до 41 дня, табл. 3) существенной разницы в концентрации по сравнению с пятисуточными опытами не наблюдалось. После закалки из каждой ампулы отбирали по 2 пробы (по 2 мл) для определения рН и концентрации H2S. Остаток раствора фильтровали (3 мкм) и обрабатывали для анализа на Cd. Измерения рН производили в ячейке из стеклянного рН-электрода и Ag, AgCl/3M KCl-электрода сравнения. Калибровка электродов осуществлялась по NBS буферным растворам. Расчет рН экспериментальных растворов проводили по программе HCh (Шваров, 2008). В большинстве опытов расчетные и измеренные значения рН согласуются в пределах 0.1 ед. рН. Значительные расхождения (0.5 ед. рН) в некоторых опытах, по-видимому, связаны с дегазацией при закалке. Значения рН, приведенные в табл. 1–3, рассчитаны в соответствии с составом системы и измерениями рН перед опытом. Аликвоты для анализа суммарной концентрации сульфидов отбирали в раствор йода, подкисляли HCl до рН ∼ 1 и сразу же титровали тиосульфатом с крахмалом в качестве индикатора. Концентрация гидросульфида в опытах с HClO4 без добавления H2S рассчитывали по растворимости CdS. Пробы для анализа Cd (20–30 мл) подкисляли HCl до рН∼4 и выпаривали при температуре около 50°С. Влажный остаток (0.5 г) растворяли в 4 см3 царской водки, упаривали до 0.3 см3 и разбавляли раствором 1.5%HCl–1.5%HNO3 до 30 см3. Концентрацию Cd измеряли в зависимости от концентрации методами атомной адсорбции, масс- и эмиссионной спектроскопии с индукционно связанной плазмой (ICP-MS и ICP-AES). Особое внимание уделялось содержанию кадмия в холостых опытах, аналогичных по составу и способам обработки экспериментальным растворам из табл. 1–3 (только без CdS). Концентрация Cd во всех холостых пробах ниже 10–9m.
Термодинамический анализ данных по растворимости CdS позволил рассчитать константы устойчивости гидросульфидных комплексов при бесконечном разбавлении. Обработка произведена в рамках модифицированной HKF модели (Oelkers et al., 2009). Коэффициенты активности заряженных частиц считали по уравнению Дебая–Хюккеля во втором приближении, нейтральных молекул и комплексов – с использованием уравнения Сеченова с коэффициентами для ${{{\text{H}}}_{{\text{2}}}}{\text{S}}_{{({\text{aq}})}}^{0}$ (Suleimenov and Krupp, 1994). Расчеты выполнены с использованием программного пакета HCh (Шваров, 2008), включающего OptimA и OptimC программы (Shvarov, 2015).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Растворимость CdS при 25–80°С
Растворимость CdS в сильно кислой HClO4 среде (pH25°C = 0.4–1.5, табл. 1 и 2) описывается реакцией:
(1)
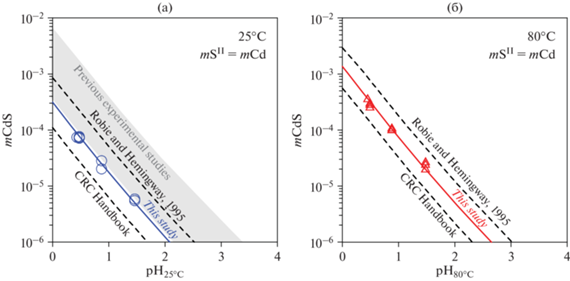
${\text{CdS + 2}}{{{\text{H}}}^{{\text{ + }}}}{\text{ = C}}{{{\text{d}}}^{{{\text{2 + }}}}}{\text{ + }}{{{\text{H}}}_{{\text{2}}}}{\text{S}}_{{({\text{aq}})}}^{0}\,\,\,\,\,\,\,{\text{K}}_{{{\text{s, C}}{{{\text{d}}}^{{2 + }}}}}^{0}{\kern 1pt} .$Роль других кадмиевых комплексов в этих условиях пренебрежимо мала. В координатах lg mCdS–pH растворимость описывается линией с наклоном 1 при доверительной вероятности 0.95 (фиг. 1). Измеренная растворимость сравнивается с литературными данными на фиг. 1.
Фиг. 1.
Растворимость гринокита CdS в растворах HClO4 при 25°C (а) и 80°C (б) в зависимости от pH, измеренная в этом исследовании (точки) и рассчитанная по этому исследованию (сплошные линии), предыдущие экспериментальные исследования (заштрихованная область) и термодинамические компиляции (пунктирные линии) из CRC Handbook (Lide et al., 2003) и (Robbie and Hemingway, 1995).
В растворах HClO4–NaOH–H2O при концентрации сульфидов выше 0.05 m растворимость CdS определяют гидросульфидные комплексы согласно реакциям:
(2)
${\text{Cd}}{{{\text{S}}}_{{({\text{s}})}}}{\text{ + }}{{{\text{H}}}^{{\text{ + }}}}{\text{ = CdH}}{{{\text{S}}}^{ + }}\,\,\,\,\,\,\,{\text{K}}_{{{\text{s, CdH}}{{{\text{S}}}^{ + }}}}^{0},$(3)
${\text{Cd}}{{{\text{S}}}_{{({\text{s}})}}}{\text{ + }}{{{\text{H}}}_{2}}{\text{S}}_{{({\text{aq}})}}^{0}{\text{ = Cd(HS)}}_{{2({\text{aq}})}}^{0}\,\,\,\,\,\,\,{\text{K}}_{{{\text{s, Cd(HS)}}_{2}^{0}}}^{0},$(4)
${\text{Cd}}{{{\text{S}}}_{{({\text{s}})}}}\,\,{\text{ + }}{{{\text{H}}}_{2}}{\text{S}}_{{({\text{aq}})}}^{0} + {\text{H}}{{{\text{S}}}^{ - }}{\text{ = Cd(HS)}}_{3}^{ - }\,\,\,\,\,\,\,{\text{K}}_{{{\text{s, Cd(HS)}}_{3}^{ - }}}^{0},$(5)
${\text{Cd}}{{{\text{S}}}_{{({\text{s}})}}}{\text{ + }}{{{\text{H}}}_{2}}{\text{S}}_{{({\text{aq}})}}^{0} + {\text{2H}}{{{\text{S}}}^{ - }}{\text{ = Cd(HS)}}_{4}^{{2 - }}\,\,\,\,\,{\text{K}}_{{{\text{s, Cd(HS)}}_{4}^{{2 - }}}}^{0}.$В опытах с концентрированными растворами (табл. 3, pH80°C = 6–8 and ΣS = 0.05–0.80 m) зависимости растворимости от рН и концентрации HS– (фиг. 2а) отвечают преобладанию двух комплексов, ${\text{Cd}}\left( {{\text{HS}}} \right)_{3}^{ - }$ и ${\text{Cd}}\left( {{\text{HS}}} \right)_{4}^{{2 - }}.$ Аппроксимация этих данных с использованием программы OptimA (Shvarov, 2015) позволила определить константы устойчивости реакций ${\text{K}}_{{{\text{s, Cd(HS)}}_{3}^{ - }}}^{0}$ (1), ${\text{K}}_{{{\text{s, Cd(HS)}}_{4}^{{2 - }}}}^{0}$ (4) и ${\text{K}}_{{{\text{s, Cd(HS)}}_{4}^{{2 - }}}}^{0}$ (5). Указанная погрешность (табл. 5) учитывает ошибки в определении рН и ΣS, а также погрешности расчета коэффициентов активности.
Фиг. 2.
Сравнение измеренной и рассчитанной растворимости CdS при 80°C в зависимости от активности HS в растворе NaHS–H2S (а) и в зависимости от рН в растворах H2O–HClO4–H2S (б).

При pH80°C = 2–4, разброс экспериментальных данных много больше (табл. 3, фиг. 2б). При ΣS = = ~0.05 m наилучшее согласование получено в случае преобладания ${\text{Cd}}\left( {{\text{HS}}} \right)_{{2({\text{aq}})}}^{0}.$ Исключая из оптимизации точки с наибольшей и наименьшей Cd-концентрацией и приняв вклад Cd2+, ${\text{Cd}}\left( {{\text{HS}}} \right)_{3}^{ - }$ и ${\text{Cd}}\left( {{\text{HS}}} \right)_{4}^{{2 - }}$ согласно определенным значениям ${\text{K}}_{{{\text{s, C}}{{{\text{d}}}^{{2 + }}}}}^{0}$ (1), ${\text{K}}_{{{\text{s, Cd(HS)}}_{3}^{ - }}}^{0}$ (4) и ${\text{K}}_{{{\text{s, Cd(HS)}}_{4}^{{2 - }}}}^{0}$ (5) (табл. 5), для реакции ${\text{K}}_{{{\text{s, Cd(HS)}}_{2}^{0}}}^{0}$ получаем lg ${\text{K}}_{{{\text{s, Cd(HS)}}_{2}^{0}}}^{0}$(3) = –6.00 ± 0.40. Эта константа описывает растворимость при pH80°C = 2–4 в пределах экспериментальной погрешности (фиг. 2б).
Наибольшая неопределенность связана со вкладом комплекса CdHS+ и значения ${\text{K}}_{{{\text{s, CdH}}{{{\text{S}}}^{ + }}}}^{0}$ (2). Максимальная доля этого комплекса (около 50%) достигается в опытах при pH = 0.4 и ΣS = = ~0.1 m. На основании этих данных оценена с высокой погрешностью (1 лог. ед) величина ${\text{K}}_{{{\text{s, CdH}}{{{\text{S}}}^{ + }}}}^{0}$ (2). Термодинамические константы реакций (2)–(5) при 80°С приведены в табл. 5. Независимая оптимизация в OptimA, выполненная одновременно для всех констант с использованием экспериментальных данных при всех pH, дает очень похожие результаты. Описание экспериментальных точек показано на фиг. 2а и 2б. Рассчитанная на основании термодинамических данных, приведенных в табл. 4 и 5, растворимость CdS в зависимости от рН и общей концентрации H2S при 80°С показана на фиг. 3a, распределение комплексов – на фиг. 3б. Значительные концентрации кадмия (выше 1 ppb) могут возникать при концентрации сульфидной серы выше 0.01 m и в слабо-кислых–нейтральных условиях.
Таблица 4.
Произведение растворимости гринокита CdS + 2H+ = Cd2+ + ${{{\text{H}}}_{2}}{\text{S}}_{{({\text{aq}})}}^{0}$
| lg10K25°C | lg10K80°C | Источник |
|---|---|---|
| –8.03 ± 0.05 | –6.86 ± 0.05 | Данная работа |
| –7.83 ± 0.03 | – | (Wang and Tessier, 1999), хорошо раскристаллизованный CdS |
| –7.41 и –7.16 | – | Wang and Tessier (1999), слабо раскристаллизованный CdS |
| –7.37 ± 0.26 | – | (Daskalakis and Helz, 1992) |
| –5.31 | – | (Van Hovell tot Westerflier et al., 1987) |
| –8.04 до –6.05a | – | (Belcher et al., 1969), CdS разного синтеза/обработки |
| –8.15 до –7.93b | – | Расчет из (Wang and Tessier, 1999) по данным (Daskalakis and Helz, 1992) |
| –6.26 до –5.80b | – | Экстраполяция на йонную силу 0 (–5.38I = 1.0, Ste-Marie, 1964) |
| –8.91 | –7.54 | Обзор CRC Handbook (Lide, 2003), (Wagman et al., 1982) |
| –7.09 | –6.06 | Обзор (Robbie and Hemingway (1995) |
Таблица 5.
Константы растворения CdS при 25 и 80°C
| Реакция | Номер реакции | ${{\lg }_{{10}}}{\text{K}}_{{25^\circ {\text{C}}}}^{0}$ | ${{\lg }_{{10}}}{\text{K}}_{{80^\circ {\text{C}}}}^{0}$ |
|---|---|---|---|
| CdS + H+ = CdHS+ | (2) | –7.64 ± 0.68a | –5.65 ± 1.00b |
| CdS + ${{{\text{H}}}_{2}}{\text{S}}_{{({\text{aq}})}}^{0}$ = Cd(HS)$_{{2\,\,({\text{aq}})}}^{0}$ | (3) | –7.58 ± 0.03a | –6.00 ± 0.40b |
| CdS + ${{{\text{H}}}_{2}}{\text{S}}_{{({\text{aq}})}}^{0}$ + HS– = Cd(HS)$_{3}^{ - }$ | (4) | –5.75 ± 0.58a | –3.87 ± 0.10b |
| CdS + ${{{\text{H}}}_{2}}{\text{S}}_{{({\text{aq}})}}^{0}$ + 2HS– = Cd(HS)$_{4}^{{2 - }}$ | (5) | –3.58 ± 0.05a | –3.55 ± 0.20b |
Примечание. a – расчет по (Wang and Tessier, 1999) и свойствам CdS пересмотренным в настоящей работе (Таблица 6); b – определены в настоящей работе.
Произведение растворимости и термодинамические свойства гринокита
Разница в константах равновесия реакции ${\text{K}}_{{{\text{s, C}}{{{\text{d}}}^{{2 + }}}}}^{0}$ (1) при 25°С по литературным данным достигает 2.7 лог. ед. (табл. 4). Наименьшее значение, рекомендованное в CRC Handbook (Lide, 2003), основано на более ранней компиляции (Wagman et al., 1982). Вслед за обзором (Archer, 1998) мы подозреваем ошибки в этих двух источниках. Найденное нами значение константы (табл. 4, фиг. 1а) близко к самым низким значениям (Belcher et al. , 1969; Wang and Tessier, 1999) и к пересчитанному значению (Daskalakis and Helz, 1992). В более ранних работах (Ste-Marie et al., 1964; Van Hövell tot Westerflier et al., 1987) константа завышена на 1.7–2.7 лог. ед. Такие различия, по-видимому, связаны с разной кристалличностью и способом приготовления твердой фазы. Наиболее высокие значения получены для слабо кристаллизованных свежеосажденных фаз, наименьшие – для высокотемпературных синтетических фаз. Кроме того, поправки на водные среды в разных исследованиях могут быть причиной расхождений (см. наши пересчеты в табл. 4). Погрешность также может быть связана с определением концентрации Cd2+ в присутствии разных комплексообразователей (EDTA, DTPA, ${\text{SO}}_{4}^{{2 - }},$ Cl–). В наших опытах (сильно кислые растворы HClO4) единственными значимыми формами являются Cd2+ и H2S(aq). Рекомендованное значение ${\text{K}}_{{{\text{s, C}}{{{\text{d}}}^{{2 + }}}}}^{0}$(K1) описывают наши экспериментальные данные в пределах ±0.2 лог. ед. независимо от размеров кристаллов гринокита – от первых мкм (Wang and Tessier, 1999) до нескольких мм (настоящая работа).
На основании полученного значения ${\text{K}}_{{{\text{s, C}}{{{\text{d}}}^{{2 + }}}}}^{0}$(K1) и стандартных термодинамических свойств Cd2+ и ${{{\text{H}}}_{{\text{2}}}}{\text{S}}_{{{\text{(aq)}}}}^{0},$ рекомендуемых CODATA (Cox et al., 1989), определены ${{\Delta }_{f}}G_{{298.15}}^{0}$ (гринокит) = = –151.5 ± 0.3 кДж моль–1. Это значение хорошо согласуется с характеристикой предварительно обработанных фаз (Belcher et al., 1969; Wang and Tessier, 1999) и электрохимическим определением (Nasar and Shamsuddin, 1992).
Стандартная энтропия гринокита ($S_{{298.15}}^{0}$ = = 72.18 ± 0.26 Дж моль–1 K–1) принята на основании калориметрических измерений при 5–1100 K (Beyer et al., 1983). Это же значение (72.2 Дж моль–1 K–1) рекомендуется в (Robie and Hemingway, 1995), тогда как (Lide, 2003) рекомендует $S_{{298.15}}^{0}$ = 64.9 Дж моль. Наши измерения не позволяют уточнить энтропию гринокита. Используя принятые значения энтропии и энергии Гиббса, определяем стандартное значение энтальпии образования гринокита (${{\Delta }_{f}}H_{{298.15}}^{0}$ = –155.3 ± 0.3 кДж моль–1). Рекомендованное значение энтальпии согласуется с калориметрическими измерениями (Nasar and Shamsuddin, 1992), но отличается от таковых в (Deore and Navrotsky, 2006). Рекомендуемые нами термодинамические свойства гринокита приведены в табл. 6. Они существенно пересмотрены по сравнению с данными термодинамических справочников (Mills, 1974; Robie and Hemingway, 1995; Lide, 2003).
Таблица 6.
Термодинамические функции и параметры модифицированной модели Рыженко–Брызгалина (РБ) для гидросульфидных комплексов кадмия, иона кадмия, водных сероводородных гидросульфидных форм и гринокита CdS
| ${{\Delta }_{f}}G_{{298.15}}^{0},$ кДж моль–1 | ${{\Delta }_{f}}H_{{298.15}}^{0},$ кДж моль–1 | $S_{{298.15}}^{0},$ Дж моль–1 K–1 | $C_{{{\text{p}}\,\,298.15}}^{0},$ Дж моль–1 K–1 | Модель РБ: | ||
|---|---|---|---|---|---|---|
| –lg10β298 | A | |||||
| CdHS+ | –107.88 ± 3.90a | –81.90 ± 3.90б | 171 ± 122б | 47б* | 7.38 ± 0.68a | 1.81 ± 1.30б |
| Cd(HS)$_{{2\,\,({\text{aq}})}}^{0}$ | –136.16 ± 0.20a | –135.70 ± 0.20б | 247 ± 31б | 226б* | 14.43 ± 0.03a | 1.49 ± 0.50б |
| Cd(HS)$_{3}^{ - }$ | –134.60 ± 3.30a | –141.00 ± 3.30б | 403 ± 49б | 139б* | 16.26 ± 0.58a | 2.74 ± 0.13б |
| Cd(HS)$_{4}^{{2 - }}$ | –135.01 ± 0.30a | –225.40 ± 0.30б | 300 ± 18б | 52б* | 18.43 ± 0.05a | 0.82 ± 0.25б |
| Cd2+ | –77.73 ± 0.60c | –75.90 ± 0.60c | –72.8 ± 1.5в | –14.23г | – | – |
| HS– | 11.98д | –16.15д | 68.20д | –86.8д | – | – |
| ${{{\text{H}}}_{2}}{\text{S}}_{{({\text{aq}})}}^{0}$ | –27.92е | –37.66е | 125.5е | 178.66е | – | – |
| CdS | –151.50 ± 0.30б | –155.00±0.30б | 72.18 ± 0.26ж | 47.29 ± 0.03** | – | – |
Примечание. a – расчет по данным (Wang and Tessier, 1999) и термодинамическим свойствам CdS, пересмотренным в данной работе; б – данная работа; б* – оценка на основании допущения ${{\Delta }_{{\text{r}}}}C_{{{\text{p}}\,\,298}}^{0}$ = 0 для реакций (2–5); в – CODATA (Cox and Wagman, 1989); г – (Johnson, 1992); д – расчет по экспериментальным данным (Suleimenov and Seward, 1997), принимая данные для H2S согласно (Schulte et al., 2001); е – (Schulte et al., 2001); ж – (Beyer et al., 1983); ** – $C_{{{\text{p}}\,\,298.15}}^{0}$ = 35.38 + 1.50 × 10–2T – 5.33 × × 105T–2 + 2.36 × 102T–0.5 – 2.40 × 10–6T2 (298–1100 K) (Robbie and Hamingway, 1995); “–“ модель не применялась.
Термодинамические свойства гидросульфидных комплесов кадмия
При расчете термодинамических свойств гидросульфидных комплексов ${\text{Cd}}\left( {{\text{HS}}} \right)_{n}^{{2\,\, - \,\,n}}$ использованы наши результаты по константам реакций (2)–(5) при 80°С, пересмотренные свойства гринокита (табл. 5) и данные (Wang, Tessier, 1999) при 25°C (табл. 5). Стандартные значения энтропии и теплоемкости комплексов оценены из анализа псевдоколумбических (pseudo-isocoulombic) реакций (2)–(5). Предполагается, что для этих реакций ${{\Delta }_{r}}C_{{{\text{p}}\,\,298}}^{0}$ = 0 и зависимость ∆G0 от температуры линейна. Это позволяет определить $S_{{298.15}}^{0}$ комплексов ${\text{Cd}}\left( {{\text{HS}}} \right)_{n}^{{2\,\, - \,\,n}}$ (n = 1–4), используя значения $S_{{298.15}}^{0}$ для ${{{\text{H}}}_{{\text{2}}}}{\text{S}}_{{({\text{aq}})}}^{0},$ HS– (табл. S8 ) и гринокита (табл. 6).
Экстраполяция констант равновесия при 25–80°C на более высокие температуры произведена по электростатической модели Рыженко–Брызгалина (Рыженко и др., 1985; Tagirov, Seward, 2010):
(6)
$ - \lg \,\beta ^\circ \left( {T,P} \right) = - \frac{{298.15}}{T}\,\lg \,\beta _{{298.15,1bar~}}^{^\circ } + f\left( {T,P} \right)A,$ГЕОХИМИЧЕСКИЕ ПРИЛОЖЕНИЯ
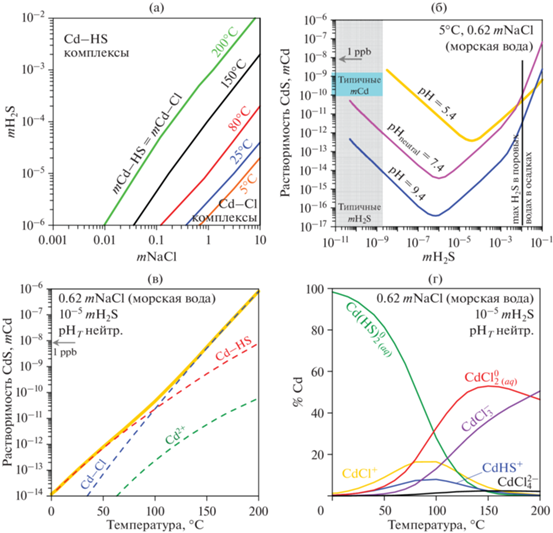
Термодинамические данные, полученные в данной работе, позволяют рассчитывать модели поведения кадмия в водных средах, содержащих H2S в зависимости от температуры (от 0 до ~200°C), значения pH и концентрации серы. Примеры расчета даны на фиг. 3–6. На фиг. 3 растворимость CdS рассчитана в гидротермальном низкотемпературном водном флюиде (80°C) в зависимости от значения pH. Эти условия характерны для некоторых природных гидротермальных рудообразующих систем с высокой активностью серы. При pH ≤ 3 увеличение концентрации серы приводит к осаждению кадмия. Остаточная концентрация серы в растворе при таких условиях не превышает 1 ppb. При pH = 4–8 растворимость CdS увеличивается с увеличением концентрации серы и достигает значений, близких к 1ppm при pH ~ 6.5 и mS 0.3. При pH ≥ 8 и mS = = 10–5–10–2 ожидаемая растворимость CdS ниже 1 ppb. Однако такие сильнощелочные условия остаются слабо изученными. В таких щелочных условиях полимерные лиганды серы (Kamyshny et al., 2007; Wang and Tessier, 2009; Truche et al., 2014; Pokrovski and Dubessy, 2015) могут влиять на поведение Cd. Однако стабильность и термодинамические свойства таких водных лигандов S и возможные водные формы переноса Cd с участием этих лигандов нуждаются в уточнении.
Фиг. 4.
Относительное преобладание комплексов Cd–HS по сравнению с комплексами Cd–Cl: (а) моляльное равенство комплексов обоих типов при разных T при нейтральном pHT, над линией преобладают комплексы Cd–HS при соответствующих T; (б) растворимость CdS в морской воде при нейтральном, кислом и щелочном pH при 5°C; (в) растворимость CdS в морской воде, содержащей 10–5mH2S в зависимости от T; (г) распределение комплексов Cd в морской воде с 10–5mH2S в зависимости от T. Типичные концентрации Cd и максимальные концентрации H2S в бескислородных водах в (б) указаны в соответствии с (Janssen et al., 2014) и (Little et al., 2015) соответственно.
Фиг. 5.
Сравнение водных форм переноса Cd и Zn в морской воде (0.62 mNaCl) в зависимости от концентрации H2S при 5°C и pH5°C = 8.1. (а) растворимость гринокита CdS и сфалерита ZnS (б), соответствующее моляльное отношение Cd/Zn в растворе (в), соотетствующее распределение растворенных форм Cd и Zn (г).

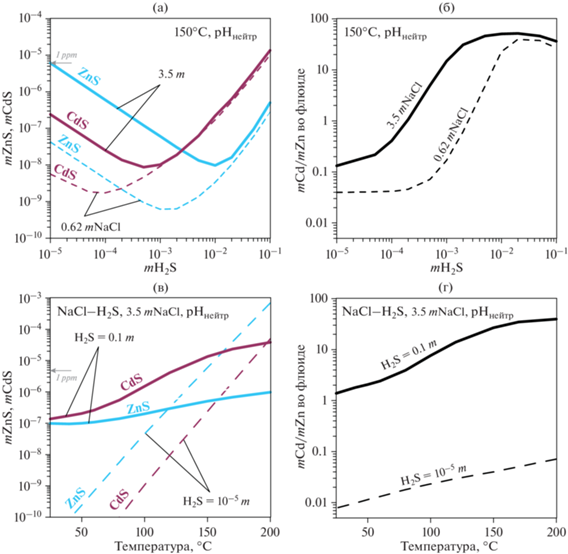
Фиг. 6.
Сравнение подвижностей Cd и Zn в NaCl- и H2S-содержащих гидротермальных флюидах при рН, близком к нейтральному, в модельной системе месторождений типа долины Миссисипи: (а) растворимость гринокита CdS и сфалерита ZnS при 150°C в зависимости от концентрации H2S и соответствующее моляльное отношение Cd/Zn во флюиде (б) и в зависимости от температуры (в) с соответствующим моляльным отношением Cd/Zn во флюиде (г).
В присутствии более распространенных комплексообразующих лигандов (например Cl–, ${\text{HCO}}_{3}^{ - }$) растворенный гидросульфид HS– воздействует на поведение Cd. С одной стороны, CdS является наиболее стабильной минеральной фазой с наименьшей растворимостью. По этой причине, например, H2S может инициировать осаждение CdS. С другой стороны, в средах, богатых сероводородом, CdS может повторно растворяться благодаря образованию комплексов Cd–HS. Роль гидросульфидных и хлоридных лигандов в подвижности Cd и растворимости CdS продемонстрирована на фиг. 4–6. Во многих средах при 5–200°C и почти нейтральном значении pH преобладают комплексы Cd–HS, контролирующие общую концентрацию Cd. Например, в гидротермальных флюидах NaCl–H2S при pH, близком к нейтральному, эти частицы преобладают при T ниже 100°C и концентрации S выше 10–5 m.
Наиболее значимой формой переноса, преобладающей в широком диапазоне рН–mH2S, является электронейтральный комплекс Cd(HS)$_{{2({\text{aq}})}}^{0}$ (см. фиг. 3б для 80°C). Однако с увеличением T область преобладания Cd(HS)$_{{2({\text{aq}})}}^{0}$ сужается, а слабо заряженных частиц (CdHS+ и ${\text{Cd}}\left( {{\text{HS}}} \right)_{3}^{ - }$) расширяется. Роль высокозарядных частиц (Cd2+ и ${\text{Cd}}\left( {{\text{HS}}} \right)_{4}^{{2 - }}$) уменьшается с увеличением T. Это согласуется с общим ослаблением диэлектрической проницаемости воды с увеличением T. Аналогичное уменьшение высокозарядных частиц было описано для комплексов Cd–Cl (Bazarkina et al., 2010a).
Экологические приложения
Типичные концентрации Cd в морской воде очень низки, на уровне ppb (Janssen et al., 2014), что очень близко к насыщению CdS (фиг. 4б). Таким образом, в кислородно-дефицитных или эвксинных морских зонах (соленость 35‰, что соответствует эквиваленту 0.62 mNaCl, mH2S выше 10–5) CdS является наиболее ожидаемой фазой в осадках. Это согласуется с природными наблюдениями (Janssen et al., 2014; Little et al., 2015). Однако при концентрации растворенных сульфидов в поровой воде в этих осадках 10–4–10–2m, Cd может частично ремобилизоваться в виде растворенных форм Cd–HS. Это необходимо учитывать при расчетах баланса Cd в осадках таких бассейнов, как Черное море, бассейн Кариако, Перуанская котловина и Фрамварен-фьорд в Северном море.
Влияние кислотности на состав и токсичность любого металла в морской воде является важным вопросом морской геохимии (Millero et al., 2009; Millero and DiTrolio, 2010; Shi et al., 2016; Stockdale et al., 2016). В условиях, близких к насыщению CdS в морской воде, pH контролирует растворимость CdS и преобладающие водные формы переноса Cd. В морской воде с рН = 8.1 и mH2S ≤ 10–9 преобладают комплексы Cd–Cl. Хлорид является рН-независимым лигандом, но подкисление до рН = 7.4 приводит к увеличению растворимости CdS (т.е. концентрации иона Cd2+ и комплексов Cd–Cl) в ~5 раз. Для иона Cd2+ влияние рН можно описать реакцией ${\text{K}}_{{{\text{s, C}}{{{\text{d}}}^{{2 + }}}}}^{0}$ (1); в случае соединений Cd–Cl можно предложить следующую химическую реакцию:
(7)
${\text{CdS + }}n{\text{C}}{{{\text{l}}}^{ - }}{\text{ + 2}}{{{\text{H}}}^{{\text{ + }}}}{\text{ = CdCl}}_{n}^{{2\,\, - \,\,n}}{\text{ + }}{{{\text{H}}}_{{\text{2}}}}{\text{S}}\,\,\,\,{\text{K}}_{{{\text{s, Cd}} - {\text{Cl}}}}^{0}$Образование водных форм переноса (комплексообразование) оказывает большое влияние на геохимию окружающей среды Cd. Предложено два основных способа выведения Cd из окружающей среды: 1) с помощью химико-физических обработок, таких как адсорбция, фильтрация или осаждение (Carolin et al., 2017); 2) путем биосорбции или биоремедиации микроорганизмами, однако этот путь требует снижения токсичности Cd (Colantonio, Kim, 2016; Chen et al., 2019). Возможное образование водных комплексов Cd–HS и осаждение CdS могут играть определяющую роль в обоих процессах. Сера необходима для роста и развития биоты и связана со стрессоустойчивостью. Некоторые организмы могут снижать токсичность металлов за счет внеклеточной секвестрации на поверхности клеток посредством осаждения сульфидов металлов, тогда как комплексообразование является механизмом внутриклеточной секвестрации (Chen et al., 2019). Интересно, что восстановленная сера участвует в механизмах детоксикации Cd в биоте (Pokrovsky et al., 2008). Знание области стабильности неорганических видов Cd–HS может помочь улучшить как химико-физические, так и биоремедиационные технологии. Основные двухвалентные катионы в морской воде, такие как Ca и Mg, не конкурируют с Cd в комплексообразовании с Cl– или HS–. Однако они влияют на адсорбцию Cd взвешенными частицами (карбонатами, оксидами, силикатами и органическими веществами). Конкуренция между этими ионами за активные центры в твердых телах приводит к снижению сорбции Cd при добавлении Ca и Mg (Paalman et al., 1994). Этот механизм может быть более эффективным при насыщении CdS, когда mH2S увеличивается, потому что mCd2+ уменьшается с увеличением mH2S (см. фиг. S3 ).
Сd–HS комплексы в гидротермальных флюидах в сравнении с Zn
В гидротермальных системах Cl– и HS– могут конкурировать за комплексообразование кадмия. Область преобладания гидросульфидных комплексов сужается с увеличением Т (фиг. 4а). В соленых растворах с нейтральным pH, подобных морской воде с повышенным содержанием H2S (выше 10–5m), T является наиболее важным фактором, контролирующим растворимость CdS. Так, например, увеличение T от 5 до 200°C приводит к увеличению растворимости CdS на 8 порядков (фиг. 4в). В pH-нейтральных растворах, содержащих H2S и NaCl, комплексы ${\text{Cd}}\left( {{\text{HS}}} \right)_{{2\,\,({\text{aq}})}}^{0}{\kern 1pt} {\text{, Cd}}\left( {{\text{HS}}} \right)_{3}^{ - }$, ${\text{CdCl}}_{{2\,\,({\text{aq}})}}^{0}$ и ${\text{CdCl}}_{3}^{ - }$ являются наиболее важными частицами Cd в области температур от 5 до 200°С (фиг. 4г). В гидротермальных условиях комплексы Cd–HS могут переносить высокие концентрации Cd. Так, при 200°С mCd достигает ~10–5 в растворе 0.1 mH2S – 0.01 mNaCl. Для сравнения, эта растворимость (10–5mCd) близка к растворимости CdS в высокосоленых флюидах, бедных H2S когда преобладают комплексы Cd–Cl (5 mNaCl–10—5mH2S). Последнее означает, что комплексы Cd–HS и Cd–Cl могут играть существенную роль в природных гидротермальных рудообразующих флюидах.
Цинк является геохимическим аналогом кадмия. Отношение Cd/Zn было предложено для отслеживания эволюции гидротермальных систем (Urabe, 1977; Гричук, 2005; Schwartz, 2000; Bazarkina et al., 2010а). Растворимость и состав Cd и Zn сравниваются в водных системах, содержащих NaCl и HS, на фиг. 5 и 6. Во многих моделях рудообразующих процессов предполагается, что источником флюидов является морская вода. При низких температурах, типичных для глубоководных условий океана (т.е. около 3–5°С) с концентрацией H2S ниже 10–6 м, растворимость CdS на ~3 порядка ниже, чем растворимость ZnS (фиг. 5а). В таких растворах преобладают комплексы Cd–Cl и свободный ион Zn2+ (фиг. 5в, г). Свободные ионы являются наиболее биологически активными формами металлов. Таким образом, в отсутствие сильных органических лигандов и при низких концентрациях H2S в морской воде биодоступность Zn выше, чем у Cd. Кривые растворимости CdS и ZnS в зависимости от H2S в растворах 0.62 mNaCl имеют сходный вид (фиг. 5). При преобладании свободных ионов металлов или их хлоридных комплексов, растворимость обоих сульфидов уменьшается с увеличением H2S. Это справедливо при концентрациях H2S ниже 5 × 10–7m для Cd и 5 × 10—6mH2S для Zn. Дальнейшее увеличение mH2S приводит к сильному увеличению растворимости сульфидов обоих металлов. При mH2S = ~0.05 m растворимости CdS и ZnS равны. Вопреки распространенному мнению, что гидросульфидные комплексы не играют существенной роли в переносе Cd и Zn, морская вода, содержащая 0.1 mH2S, может переносить большее количество как Cd, так и Zn по сравнению с бескислородной морской водой, содержащей 10–9mH2S (фиг. 5б). В результате количество H2S в морской воде является критическим параметром. В условиях, близких к насыщению, отношение Cd/Zn в растворе зависит от содержания H2S. С увеличением содержания H2S соотношение Cd/Zn в растворе увеличивается (фиг. 5б).
При формировании месторождений гидротермальных сульфидных руд лиганды HS– и Cl– также конкурируют за перенос Cd и Zn. Природные сфалериты (ZnS) из месторождений типа долины Миссисипи (150°C, флюиды NaCl–H2S и близкий к нейтральному pH, контролируемый карбонатными минералами) содержат значительные концентрации кадмия. Эти сфалериты очень часто зональные (Belissont et al., 2014; Bonnet et al., 2016). Вариации содержания кадмия в разных зонах могут быть использованы для более полной реконструкции эволюции гидротермальных систем. Наше моделирование (фиг. 6) показывает, что флюиды, богатые Cd, весьма характерны при высоких концентрациях H2S. Растворимость ZnS во флюидах выше, чем у CdS, только при низких содержаниях H2S. Наибольшее отношение Cd/Zn в гидротермальных флюидах ожидается при температурах 150–200°С при высоком содержании серы.
Фракционирование стабильных изотопов кадмия в серосодержащих средах
Ожидается, что для металлов, не меняющих степень окисления (+2 для Cd), изменение состава и формы нахождения является основным фактором, определяющим фракционирование стабильных изотопов. Так, образование комплексов Cd–HS связано с фракционированием изотопов Cd. Геохимические маркеры, основанные на изотопном составе Cd, были предложены для различения антропогенных, биологических и геологических путей мигрирования Cd (Martinkova et al., 2016; Teng et al., 2017; Zhu et al., 2015, 2018). Наши данные показывают, что наиболее важным комплексом Cd в H2S-содержащих средах является Cd(HS)$_{{2\,\,({\text{aq}})}}^{0}.$ Имеющиеся теоретические расчеты выполнены только для CdHS+ (Yang et al., 2015). Частичное растворение Cd приводит к более тяжелому изотопному составу Cd в остаточных твердых веществах. Этот эффект может быть сильнее, когда состав Cd меняется с Cd–Cl на Cd–HS (см. фиг. 4–6). Частичное растворение гринокита (CdS) в условиях преобладания комплексов Cd–HS может привести к наиболее легкому изотопному составу ремобилизованного Cd. Недавние теоретические расчеты, выполненные для S-содержащих органических комплексов Cd, предсказывают, что S-содержащие органические комплексы обогащены легкими изотопами (Zhao et al., 2021). Для оценки влияния комплексов Cd–HS на изотопный состав Cd и для лучшего использования вариаций изотопного состава Cd, известных для природных вод, необходимы дальнейшие теоретические и экспериментальные исследования, по крайней мере, для Cd(HS)$_{{2\,\,({\text{aq}})}}^{0}.$
ЗАКЛЮЧЕНИЕ
На основании экспериментальных данных по растворимости CdS в растворах H2O–H2S–HClO4–NaHS при 25–80°C в зависимости от pH и концентрации серы изучены термодинамические свойства CdS и водных форм переноса CdHS+, CdCl$_{{2\,\,({\text{aq}})}}^{0},$ ${\text{CdCl}}_{3}^{ - }$ и ${\text{Cd}}\left( {{\text{HS}}} \right)_{4}^{{2 - }}$. Новые данные о комплексах Cd–HS в водных растворах, представленные в этом исследовании, расширяют наши знания о геохимии Cd в природных водах и гидротермальных флюидах от окисленных до восстановленных S-содержащих условий при 5–200°C. Кроме того, они могут помочь интерпретировать данные о биотолерантности Cd при повышенных концентрациях серы в восстановительных условиях (например, в присутствии бактерий, восстанавливающих сульфаты), которые могут применяться для технологий биоремедиации. В глобальном масштабе эти данные открывают новые перспективы для изучения роли серы при переносе Cd в окружающей среде и при образовании гидротермальных рудных месторождений.
Список литературы
Базаркина Е.Ф., Зотов А.В., Акинфиев Н.Н. Устойчивость хлоридных комплексов кадмия в зависимости от давления: потенциометрические измерения при 1–1000 бар и 25°С // Геология руд. месторождений. 2010. Т. 52. № 2. С. 186–197.
Гричук Д.В. Отношение Cd/Zn как индикатор вклада магматических флюидов в питание гидротермальных систем // Новые идеи в науках о Земле: Матер. VII междунар. конф. –М.: МГРИ-РГГРУ. 2005. Т. 2. С. 83.
Рыженко Б.Н., Брызгалин О.В., Артамкина И.Ю., Спасенных М.Ю., Шапкин А.Л. Электростатическая модель электролитической диссоциации растворенных в воде неорганических веществ // Геохимия. 1985. № 6. С. 884–890.
Шваров Ю.В. HCh: новые возможности термодинамического моделирования геохимических систем, предоставляемые Windows // Геохимия. 2008. №8. С. 898 – 903.
Al-Farawati R. and Van Den Berg C.M.G. Metal-sulfide complexation in seawater // Mar. Chem. 1999. V. 63. P. 331–352.
Archer D.J. Thermodynamic properties of import to environmental processes and remediation. I. Previous thermodynamic property values for cadmium and some of its compounds // J. Phys. Chem. Ref. Data. 1989. V. 27. P. 915–946.
Bazarkina E.F., Pokrovski G.S., Zotov A.V. and Hazemann J.-L. Structure and stability of cadmium chloride complexes in hydrothermal fluids // Chem. Geol. 2010. V. 276. P. 1–17.
Belcher R., Townshen A. and Farr J.P.G. Solubility product of cadmium sulphide // Talanta 1969. V. 16. P. 1089–1093.
Belissont R., Boiron M.-C., Luais B. and Cathelineau M. LA-ICP‑MS analyses of minor and trace elements and bulk Ge isotopes in zoned Ge-rich sphalerites from the Noailhac – Saint-Salvy deposit (France): Insights into incorporation mechanisms and ore deposition processes. Geochim. Cosmochim. Acta 126, 518–540.
Beyer R.P., Ferrante M.J. and Mrazek R.V. An automated calorimeter for heat-capacity measurements from 5 to 300 K The heat capacity of cadmium sulfide from 5.37 to 301.8 K and the relative enthalpy to 1103.4 K // J. Chem. Thermodyn. 15, 827–834.
Bonnet J., Mosser-Ruck R., Caumon M.-C., Rouer O., Andre-Mayer A.-S., Cauzid J. and Peiffert C. Trace Element Distribution (Cu, Ga, Ge, Cd, and Fe) IN Sphalerite From the Tennessee MVT Deposits, USA, By Combined EMPA, LA-ICP-MS, Raman Spectroscopy, and Crystallography // Can. Mineral. 54, 1261–1284.
Carolin C.F., Kumar P.S., Saravanan A., Joshiba G. J. and Naushad Mu. Efficient techniques for the removal of toxic heavy metals from aquatic environment: A review // J. Environ. Chem. Eng. 5, 2782–2799.
Chen S.H., Cheow Y.L., Ng S.L. and Ting A.S.Y. Mechanisms for metal removal established via electron microscopy and spectroscopy: a case study on metal tolerant fungi Penicillium simplicissimum // J. Hazard. Mater. 2019. P. 394–402.
Colantonio N. and Kim Y. Cadmium (II) removal mechanisms in microbial electrolysis cells // J. Hazard. Mater. 2016. P. 134–141.
Cox J.D., Wagman D.D. and Medvedev V.A. CODATA Key Values for Thermodynamics., Hemisphere Publishing Corporation, New York.
Crea F., Foti C., Milea D. and Sammartano S. Speciation of Cadmium in the Environment. In Cadmium: From Toxicity to Essentiality Metal Ions in Life Science. Astrid Sigel, Helmut Sigeel, Roland K.O. Sigel. pp. 63–83.
Cullen J.T. and Maldonado M.T. Biogeochemistry of Cadmium and Its Release to the Environment. In Cadmium: From Toxicity to Essentiality Metal Ions in Life Science. Astrid Sigel, Helmut Sigeel, Roland K.O. Sigel. pp. 31–62.
Daskalakis K.D. and Helz G.R. Solubility of cadmium sulfide (greenockite) in sulfidic waters at 25°C // Environ. Sci. Technol. 1992. V. 26. P. 2462–2468.
Deore S. and Navrotsky A. Oxide melt solution calorimetry of sulfides: Enthalpy of formation of sphalerite, galena,greenockite, and hawleyite. Am. Mineral. 2006. V. 91. P. 400–403.
Foti C., Lando G., Millero F.J. and Sammartano S. Experimental study and modelling of inorganic Cd2+ speciation in natural waters // Environ. Chem. 2011. V. 8. P. 320–331.
Janssen D.J., Conway T.M., John S.G., Christian J.R., Kramer D.I., Pedersen T.F. and Cullen J.T. Undocumented water column sink for cadmium in open ocean oxygen-deficient zones // Proc. Natl. Acad. Sci. U. S. A. 2014. V. 19. P. 6888–6893.
Johnson J.W. SUPCRT92: A software package for calculating the standard molal thermodynamic properties of minerals, gases, aqueous species, and reactions from 1 to 5000 bar and 0 to 1000°C // Comput. Geosci. 1992. V. 18. P. 899–947.
Kamyshny A., Gun J., Rizkov D., Voittsekovski T. and Lev O. Equilibrium distribution of polysulfide ions in aqueous solutions at different temperatures by rapid single phase derivatization // Environ. Sci. Technol. 2007. V. 41. P. 2395–2400.
Li M.-L., Liu S.-A., Xue C.-J., Li D. Zinc, cadmium and sulfur isotope fractionation in a supergiant MVT deposit with bacteria // Geochim. Cosmochim. Acta. 2019. V. 265. P. 1–18.
Lide D.R. CRC Handbook of Chemistry and Physics. 84th ed., CRC Press. 2003.
Little S.H., Vance D., Lyons T. and McManus J. Controls on trace metal authigenic enrichment in reducing sediments: insights from modern oxygen-deficient settings // Am. J. Sci. 2015. V. 315. P. 77–119.
Marshall W.L. and Franck E.U. (1981) Ion product of water substance, 0-1000°C, 1-10000 bars. New International Formulation and its background // J. Phys. Chem. Ref. Data. 1981. V. 10. P. 295–304.
Martinkova E., Chrastny V., Francova M., Sipkova A., Curik J., Myska O. and Mizic L. Cadmium isotope fractionation of materials derived from variousindustrial processes // J. Hazard. Mater. 2016. V. 302. P. 114–119.
Millero F. J. and DiTrolio B. Use of thermodynamics in examining the effects of ocean acidification // Elements. 2010. V. 6. P. 299–303.
Millero F. J., Woosley R., DiTrolio B. and Waters J. Effect of ocean acidification on the speciation of metals in seawater // Oceanography. 2009. V. 6. P. 299–303.
Mills K.C. Thermodynamic Data for Inorganic Sulphides, Selenides and Tellurides., Butterworths, London. 1974.
Nasar A. and Shamsuddin M. An investigation of the thermodynamic properties of cadmium sulfide // Thermochim. Acta. 1992. V. 197. P. 373–380.
Oelkers E.H., Bénézeth P. and Pokrovski G.S. Thermodynamic databases for water-rock interaction. In Thermodynamics and Kinetics of Water-Rock Interaction Reviews in Mineralogy and Geochemistry 70. Mineralogical Society of America. 2009. pp. 1–46.
Paalman M.A.A., van der Weijden C.H. and Loch J.P.G. Sorption of Cd on suspended matter under estuarine conditions; competition and complexation with major seawater ions // Water. Air. Soil Pollut. 1994. V. 73. P. 49–60.
Pokrovski G.S. and Dubessy J. Stability and abundance of the trisulfur radical ion S3- in hydrothermal fluids // Earth Planet. Sci. Lett. 2015. V. 411. P. 298–309.
Pokrovsky O.S., Pokrovski G.S. and Feurtet-Mazel A. A structural study of cadmium interaction with aquatic microorganisms // Environ. Sci. Technol. 2008. V. 42. P. 5527–5533.
Powell K.J., Brown P.L., Byrne R.H., Gajda T., Hefter G., Leuz A.-K., Sjoberg S. and Wanner H. Chemical speciation of environmentally significant metals with inorganic ligands. Part 4: The Cd2+ + OH–, Cl–, ${\text{CO}}_{3}^{{2 - }},{\text{ SO}}_{4}^{{2 - }},$ and ${\text{PO}}_{4}^{{3 - }}$ systems (IUPAC Technical Report) // Pure Appl. Chem. 2011. V. 83. P. 1163–1214.
Robie R. A. and Hemingway B. S. Thermodynamic Properties of Minerals and Related Substances at 298.15 K and 1 bar (105 pascals) pressure and at high temperatures, U. S. Geol. Surv. Bull. 1995. P. 2131.
Rudnick R. L. and Gao S. Composition of the continental crust. In Treatise on Geochemistry (2nd Edition) (eds. H.D. Holland and K. K.Turekian). Elsevier, Oxford. 2014. pp. 1–51.
Schafer H. (1962) Chemische Transportreaktionen. Der Transport Anorganischer Stoffe Uber Die Gasphase und Seine Anwendungen., Verlag Chemie, GmbH, Weinheim/Bergstr.
Schulte M.D., Shock E.L. and Wood R.H. The temperature dependence of the standard-state thermodynamic properties of aqueous nonelectrolytes // Geochim. Cosmochim. Acta. 2001. V. 65. P. 3919–3930.
Schwartz M.O. Cadmium in zinc deposits: economic geology of a polluting element // International Geolology Review. 2000. V. 42. P. 445–469.
Shi W., Zhao X., Han Y., Che Z., Chai X. and Liu G. Ocean acidification increases cadmium accumulation in marine bivalves: a potential threat to seafood safety // Sci. Rep. 206. V. 6. P. 20197.
Shvarov Y.V. A suite of programs, OptimA, OptimB, OptimC, and OptimS compatible with the Unitherm database, for deriving the thermodynamic properties of aqueous species from solubility, potentiometry and spectroscopy measurements // Appl. Geochem. 2015. V. 55. P. 17–27.
Ste-Marie J., Torma A.E. and Gubeli A.O. The stability of thiocomplexes and solubility products of metal sulfides I. Cadmium sulfide // Can. J. Chem. 1964. V. 42. P. 662–668.
Stockdale A., Tipping E., Lofts S. and Mortimer R.J.G. Effect of ocean acidification on organic and inorganic speciation of trace metals // Environ. Sci. Technol. 2016. V. 50. P. 1906–1913.
Suleimenov O.M. and Krupp R.E. Solubility of hydrogen sulfide in pure water and in NaCl solutions, from 20 to 320°C and at saturation pressures // Geochim. Cosmochim. Acta. 1994. V. 58. P. 2433–2444.
Suleimenov O.M. and Seward T.M. A spectrophotometric study of hydrogen sulphide ionisation in aqueous solutions to 350°C // Geochim. Cosmochim. Acta. 1997. V. 61. P. 5187–5198.
Tagirov B.R. and Seward T.M. Hydrosulfide/sulfide complexes of zinc to 250 °C and the thermodynamic properties of sphalerite // Chem. Geol. 2010. V. 269. P. 301–311.
Teng F.-Z., Dauphas N. and Watkins J.M. Non-Traditional stable isotopes: Retrospective and perspective // Rev. Mineral. Geochem. 2017. V. 82. P. 1–26.
Truche L., Bazarkina E.F., Barre G., Thomassot E., Berger G., Dubessy J. and Robert P. The role of S3- ion in thermochemical sulphate reduction: geological and geochemical implications // Earth Planet. Sci. Lett. 2014. V. 396. P. 190–200.
Urabe T. Partition of Cadmium and Manganese between Coexisting Sphalerite and Galena from some Japanese Epithermal Deposits // Mineral. Deposita (Berl.) 1997. V. 12. P. 319–330.
Van Hövell tot Westerflier S.W.F.M., Kolar Z., Binsma J.J.M., Stein H.N. and Vandecasteele C. Solubility of particulate cadmium sulfide at pH = 1–14: A radiotracer study // J. Radioanal. Nucl. Chem. 1987. V. 111. P. 305–317.
Wagman D.D., Evans W.H., Parker V.B., Schumm R.H., Halow I., Bailey S.M., Churney K.L. and Nuttall R.L. The NBS tables of chemical thermodynamic properties. Selected values for inorganic and C1 and C22 organic substances in SI units // J. Phys. Chem. Ref. Data. 1982. v. 11.
Wang F. and Tessier A. Cadmium complexation with bisulfide. Environ. Sci. Technol. 1999. V. 33. P. 4270–4277.
Wang F. and Tessier A. Zero-valent sulfur and metal speciation in sediment porewaters of freshwater lakes // Environ. Sci. Technol. 2009. V. 43. P. 7252–7257.
WHO ed. Guidelines for Drinking-water Quality. Fourth edition., WHO Press, Geneva. 2011.
Xu Y. and Morel M.M. Cadmium in Marine Phytoplankton. In Cadmium: From Toxicity to Essentiality Metal Ions in Life Science. Astrid Sigel, Helmut Sigeel, Roland K.O. Sigel. 2013. pp. 509–528.
Yang J., Li Y., Liu S., Tian H., Chen C., Liu J. and Shi Y. Theoretical calculations of Cd isotope fractionation in hydrothermal fluids // Chem. Geol. 2015. V. 391. P. 74–82.
Zhang J.-Z. and Millero F.J. Investigation of metal sulfide complexes in sea water using cathodic stripping square wave voltammetry // Anal. Chim. Acta. 1994. V. 284. P. 497–504.
Zhao Y., Li Y., Matthias W., Jang J., Sarret G., Cheng Q., Liu J. and Shi Y. Theoretical isotope fractionation of cadmium during complexation with organic ligands // Chem. Geol. 2021. V. 571.
Zhu C., Wen H., Zhang Y., Yin R. and Cloquet C. Cd isotope fractionation during sulfide mineral weathering in the Fule Zn-Pb-Cd deposit, Yunnan Province, Southwest China // Sci. Total Environ. 2018. V. 616–617. P. 64–72.
Zhu C., Wen H., Zhang Y., Liu Y., Wei R. Isotopic geochemistry of cadmium: A review // Acta Geol. Sin. 2015. V. 89. P. 2048–2057.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Инструменты
Геология рудных месторождений



