Вопросы ихтиологии, 2019, T. 59, № 1, стр. 39-53
Эмбрионально-личиночное развитие и некоторые особенности репродуктивной биологии Dendrochirus zebra (Scorpaenidae)
А. М. Шадрин 1, *, Н. Г. Емельянова 1
1 Московский государственный университет
Москва, Россия
* E-mail: shadrin-mail@mail.ru
Поступила в редакцию 08.11.2017
После доработки 31.05.2018
Принята к публикации 05.04.2018
Аннотация
Исследовано эмбриональное и личиночное развитие Dendrochirus zebra до перехода на внешнее питание. Зрелые половые продукты получены в результате двукратных гормональных инъекций. Представлено иллюстрированное детальное морфологическое описание раннего развития вида до перехода на внешнее питание. Отмечены изменения пигментации и числа мускульных сегментов после выхода из яйцевых оболочек. Оплодотворённые яйца имеют слегка неправильную сферическую форму, узкое перивителлиновое пространство, гладкую прозрачную неструктурированную оболочку, гомогенный, прозрачный, бесцветный желток, диаметр ~ 0.79 (0.74−0.81) мм. Желток содержит одну жировую каплю диаметром 0.15 (0.146−0.153) мм; она бесцветная или имеет очень слабый желтоватый либо желтовато-розовый оттенок. Продолжительность клеточного цикла периода синхронных делений дробления составляет около 27 мин, инкубационного периода – 25.5 ч. При вылуплении предличинки имеют длину 1.6–1.7 мм. Переход на внешнее питание происходит к началу 5-х сут. после вылупления при длине личинок 2.33–2.42 мм.
Крылатка-зебра Dendrochirus zebra один из пяти видов рода, распространённый в Индо-Вест-Пацифике: на западе ареала от Красного моря и побережья Восточной Африки до Самоа и на север до Южной Японии и о-вов Огасавара и южнее Австралии до о-ва Лорд-Хау (Froese, Pauly, 2016). По Нельсону (Nelson et al., 2016), род Dendrochirus относится к подсемейству Scorpaeninae, входящему наряду с восемью другими подсемействами (Sebastinae, Setarchinae, Neosebastinae, Caracanthinae, Apistinae, Tetraroginae, Synanceiinae, Plectrogeninae) в состав семейства Scorpaenidae, включающему 65 родов и не менее 454 видов.
Хронолого-морфологические особенности раннего развития рыб из разных таксономических групп представляют интерес для многих направлений исследований, в частности, для формирования представлений о закономерностях и эволюции их раннего онтогенеза и решения проблемы таксономической идентификации на ранних стадиях развития. Эти направления предполагают проведение сравнительного анализа деталей строения и изменения морфологических характеристик на разных стадиях в процессе онтогенеза у разных представителей этой самой многочисленной группы позвоночных. Возможности выполнения такого анализа в значительной степени ограничены острым недостатком данных в этой области: до настоящего времени описания развития выполнены лишь для небольшой части современных рыб. В частности, менее чем для 50% видов, обитающих в Индо-Пацифике, известно описание хотя бы одной личиночной стадии и для очень немногих имеется описание более или менее полного ряда их развития. Это касается не самых ранних личиночных стадий, дефицит информации о которых ещё выше, а определение икры и ранних личинок является ещё более сложной задачей (Leis, 2015). До сих пор нет опубликованных данных ни о типе нереста, ни о строении яиц большинства современных рыб. Что касается представителей отряда Scorpaeniformes, то для подсемейства Scorpaeninae, включающего 185 видов и 20 родов, в момент выхода сводки Вашингтона с соавторами (Washington et al., 1984) имелась информация об икре только пяти и личинках только десяти видов, входящих в пять родов. В настоящее время ситуация принципиально не изменилась. Появилось описание развития Scorpaena miostoma (Kimura et al., 1989), фрагментарные данные о раннем онтогенезе Scorpaenopsis possi и Sebastapistes cyanostigma (Павлов, Емельянова, 2007), Parascorpaena mossambica (Connell, 2012), пополнилась информация о развитии Scorpaena scrofa (Dulčić et al., 2007; Maricchiolo et al., 2014) и Scorpaena porcus (Nemeth et al., 2010; Rodriguez et al., 2017). Для представителей трибы Pteroini, включающей пять родов (Brachipterois, Dendrochirus, Ebosia, Parapterois и Pterois), есть данные о раннем онтогенезе только трёх видов. Имеется описание эмбрионального и личиночного развития до перехода на внешнее питание Pterois lunulata (Mito, Uchida, 1958), очень приблизительное описание развития Dendrochirus brachypterus (Fishelson, 1975) и ещё менее информативные данные о Pterois volitans, представленные по собранному в водах Тайваня материалу (Shao et al., 2001). Опубликованных данных об эмбриональном и раннем личиночном развитии D. zebra нет.
Нерест D. zebra парный, происходит при температуре 21–29°C, сопровождается сложным поведением и в подавляющем большинстве случаев происходит после захода солнца. В процессе икрометания вымётываются и оплодотворяются яйца, которые распределены в стенках двух полых образований, сформированных из желатиноподобного материала. Предполагается, что в процессе нереста сперма попадает в их полости и оплодотворение происходит в результате высвобождения ооцитов из толщи слизи или проникновения сперматозоидов сквозь неё (Moyer, Zaiser, 1981). Материал слизевых масс у скорпенид с таким типом нереста продуцируется специализированными секреторными клетками внутреннего эпителия стенки яичника и эпителием стебельков, на которых расположены ооциты (Erickson, Pikitch, 1993; Muñoz et al., 2002). Для D. zebra характерен непрерывный тип оогенеза и многопорционное икрометание, как и у некоторых других тропических представителей семейства Scorpaenidae (Павлов, Емельянова, 2007, 2013).
Известны случаи естественного нереста D. zebra в аквариумных условиях (Myers, 1991). Во многих тропических морях происходит интенсивное изъятие разноразмерных представителей вида в коммерческих целях – для содержания в аквариумах.
Цель работы – исследовать раннее развитие D. zebra до перехода на внешнее питание и выполнить его детальное морфологическое описание, пригодное для проведения сравнительного анализа с развитием других костистых рыб и для идентификации соответствующих стадий этого вида в ихтиопланктонных сборах.
МАТЕРИАЛ И МЕТОДИКА
Исследования выполнены в феврале–апреле 2002 г. на базе Приморского отделения Российско-вьетнамского тропического центра (г. Нячанг, СРВ). Взрослых особей D. zebra покупали у местных рыбаков, отлавливавших их в зал. Нячанг (Южно-Китайское море); время от отлова до доставки рыб в лабораторию составляло несколько часов. Рыб содержали в садках размером 80 × × 80 × 100 см, установленных в бетонных бассейнах объёмом 3м3 с постоянной циркуляцией воды (4–8 м3/ч) через биофильтр. Температура воды в бассейнах составляла 25–27°C, солёность ~33‰.
Для биологического анализа использовали интактных особей; измеряли стандартную длину (SL) до конца чешуйного покрова, полную длину (TL) до заднего края хвостового плавника, массу тела (общую и без внутренностей) и гонад. Для гистологического исследования фрагменты яичников двух особей зафиксировали в смеси Буэна; их обработку проводили общепринятыми методами (Роскин, Левинсон, 1957).
В качестве гормонального препарата для стимуляции созревания использовали сурфагон (LH-RH-a) – синтетический аналог гонадотропного рилизинг-гормона млекопитающих (люлиберина). Инъекции проводили в полость тела под грудным плавником. Препарат вводили двукратно с интервалом между инъекциями 14 ч. Особям одной группы (16 экз.) вводили сурфагон (10 и 20 мкг/кг) в сочетании с нейролептиком эглонилом (10 и 10 мг/кг), активной субстанцией которого является сульпирид – один из антагонистов рецепторов дофамина, ингибирующего выделение люлиберина из гипоталамуса. Особей второй группы (8 экз.) инъецировали только сурфагоном (10 и 25 мкг/кг). В связи с отсутствием полового диморфизма всех особей каждой группы инъецировали по одной схеме.
Овулировавшие ооциты извлекали из брюшной полости посредством вскрытия, так как густой желеобразный секрет, в котором они были распределены, препятствовал их выделению через мочеполовое отверстие при надавливании на брюшко самки. Искусственное осеменение проводили, смешивая желатиноподобную субстанцию, содержащую ооциты, с измельчёнными семенниками нескольких самцов. Через несколько минут полученную смесь заливали морской водой (33‰, 25°C). Из желеобразной массы яйца освобождали с помощью многократных циклов добавления морской воды, перемешивания и фильтрации до полного избавления от слизи. Для оценки влияния слизи на условия развития эмбрионов фрагмент кладки объёмом ~5 см3 после 20-минутного контакта со спермой размещали в ёмкость с морской водой объёмом 500 мл без отмывания и инкубировали в тех же условиях, что и освобождённые от желеобразной массы яйца.
Инкубацию яиц и содержание предличинок и личинок проводили в воде солёностью около 33‰ при температуре 25 ± 1°C. Стеклянные цилиндрические стаканы с диаметром дна 70–80 мм и объёмом 300 мл с исследуемым материалом находились в полупогружённом состоянии в термостатированной ёмкости с водой. В ёмкости, наполненные водой на 50–60% их объёма (150–180 мл), помещали по 100–150 яиц или 50–80 предличинок или личинок. В процессе инкубации икры воду не меняли. После вылупления в течение первых 2–3 ч предличинок пересаживали в сосуд с чистой водой и затем через каждые 8–10 ч заменяли 70–80% объёма воды.
Всего провели четыре серии наблюдений, в которых использована икра, полученная от трёх самок одновременно. Для более детального исследования развития ооциты одной самки раздели на две порции; первую осеменили непосредственно после получения, а вторую порцию и ооциты двух других самок – в разное время в течение 8 ч после получения. Для этого фрагменты слизевых масс с ооцитами и фрагменты семенников хранили в холодильнике при температуре ~5°C.
Ранний онтогенез D. zebra изучали на живом материале. Для определения хронологических характеристик наступающих стадий до этапа начала органогенеза всю пробу (не менее 60–70 яиц) исследовали при малом увеличении под микроскопом МБС-10 (“ЛЗОС”, Россия); для уточнения морфологических характеристик на более поздних стадиях использовали микроскоп МБР-1 (“ЛОМО”, Россия). Зарисовку зародышей и личинок выполняли с использованием рисовального аппарата Карл Цейс (“Carl Zeiss”, Germany) 1938 г. выпуска. Стадией развития считается любой момент развития, обладающий конкретными морфологическими характеристиками, отличающими его от других этапов развития. Временем наступления стадии принималось начало формирования маркерного признака у 70–80% особей в исследованной пробе (60–70 экз.). Ориентирами для определения начала и завершения бластуляции служили результаты исследования Ленца и Тринкауса (Lentz, Trinkaus, 1967). За начало гаструляции принят момент направленных индивидуальных миграций глубоких клеток, приводящих к формированию зародышевого кольца и зародышевого щитка (Ballard, 1973a, 1937b). Возраст стадий приводится в часах и минутах, а также в τ0; τ0 – единица, равная продолжительности одного клеточного цикла периода синхронных делений дробления (Dettlaff, 1964; Детлаф, 1977; Игнатьева, 1979). Размер τ0 определяли по цитотомии в первых четырёх циклах дробления.
РЕЗУЛЬТАТЫ
Некоторые данные о репродуктивной биологии
Биологический анализ половозрелых интактных (до проведения гормональных инъекций) особей показал, что самки несколько мельче самцов (таблица). Число ооцитов, близких к овуляции, у двух особей SL 110 и 120 мм и массой 47 и 49 г составило соответственно 5620 и 7292 (в среднем 6456).
Биологические показатели Dendrochirus zebra
| Пол (число рыб, экз.) | Длина, см | Масса, г | ГСИ, % |
|||
|---|---|---|---|---|---|---|
| TL | SL | W | w | g | ||
| Самки (5) | $\frac{{134 \pm 6.5}}{{125 - 140}}$ | $\frac{{113 \pm 4.7}}{{110 - 120}}$ | $\frac{{49.2 \pm 5.1}}{{45.0 - 58.0}}$ | $\frac{{43.8 \pm 6.1}}{{39.0 - 54.0}}$ | $\frac{{1.84 \pm 1.56}}{{0.6 - 4.5}}$ | $\frac{{4.45 \pm 4.14}}{{1.33 - 11.5}}$ |
| Самцы (4) | $\frac{{158 \pm 26.3}}{{135 - 195}}$ | $\frac{{137 \pm 17.6}}{{120 - 169}}$ | $\frac{{88.5 \pm 36.3}}{{55.0 - 136.0}}$ | $\frac{{83.5 \pm 34.1}}{{53.0 - 128.0}}$ | $\frac{{0.08 \pm 0.05}}{{0.01 - 0.20}}$ | $\frac{{0.095 \pm 0.054}}{{0.011 - 0.156}}$ |
Яичники D. zebra имеют экзовариальную полость. Половые клетки отходят от стромального стержня, расположенного в центре, и крепятся к нему специальными выростами, или стебельками. Крупные вителлогенные ооциты имеют и наиболее длинные выросты. Последние обильно васкуляризованы (рис. 1). Такие ооциты располагаются по периферии герминативной части яичника. Глубже находятся более мелкие вителлогенные и превителлогеннные ооциты.
Рис. 1.
Фрагмент яичника Dendrochirus zebra: 1 − вителлогенный ооцит, 2 − вырост (стебелёк), 3 − кровеносные элементы, 4 − превителлогенный ооцит, 5 − фрагмент стромального стержня. Масштаб: 200 мкм.
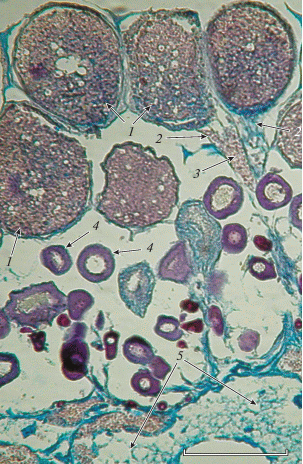
Ооциты овулируют в полость яичника и находятся там в желеобразном секрете. Это произошло одновременно у пяти самок из обеих групп через 11 ч после разрешающей инъекции. Извлечённые из полости тела самки готовые к оплодотворению ооциты были плотно упакованы в желеобразную субстанцию в форме двух агрегатов яйцевидной формы с сужениями, ориентированными в краниальном направлении. Эти образования имели положительную плавучесть: в достаточном объёме воды всплывали и располагались под её поверхностью.
Семенники, извлечённые из самцов, были тонкими, короткими, серо-белыми.
После механического перемешивания желеобразной массы, содержащей ооциты со спермиями, и добавления воды образовывалась густая бесформенная масса, которая относительно легко размывалась при многократном добавлении большого количества морской воды и перемешивании. Процедура полной очистки от слизи занимала не более 20 мин. Желеобразная масса фрагмента кладки объёмом ~5 см3, помещённого в ёмкость с морской водой, без проведения этих манипуляций растворялась в течение 4–5 ч; при этом наблюдалось заметное увеличение вязкости среды.
Эмбриональный период развития
Диаметр оплодотворённых яиц D. zebra после завершения кортикальной реакции и начала процесса агрегации плазмы на анимальном полюсе составляет 0.79 (0.74−0.81) мм. Они имеют слегка неправильную сферическую форму; перивителлиновое пространство узкое; оболочка гладкая, прозрачная, неструктурированная; гомогенный, прозрачный, бесцветный желток содержит одну жировую каплю диаметром 0.150 (0.146−0.153) мм. Жировая капля в яйцах, полученных от одной самки, могла быть бесцветной или иметь очень слабый желтоватый или желтовато-розовый оттенок. С началом формирования цитоплазматического бугорка жировая капля во всех яйцах занимает фиксированное положение под поверхностью желтка в области вегетативного полюса. После оплодотворения и завершения кортикальной реакции начинается процесс агрегации цитоплазмы яйца на анимальном полюсе яйца. Он протекает без образования хорошо выраженных тяжей цитоплазмы по поверхности и из глубины желтка. Результат начавшегося перераспределения цитоплазмы на поверхности желтка в пользу области, прилежащей к анимальному полюсу, становится отчётливо заметным к возрасту 15−20 мин. К 35−40 мин развития цитоплазматический бугорок достигает максимального объёма и высоты. Цитоплазма, входившая в состав этого образования, прозрачная, бесцветная, однородная, почти не содержит включений.
Первая борозда дробления закладывается в возрасте 46 мин. Цитотомия первого деления дробления и полное разделение плазменного диска на два бластомера (рис. 2а) завершается к возрасту 52 мин. Продолжительность клеточного цикла периода синхронных дроблений (τ0) составляет ~27 (26.9) мин.
Рис. 2.
Эмбриональное развитие Dendrochirus zebra; дробление: а − 2 бластомера, возраст 52 мин; б − 16 бластомеров, 2 ч 08 мин; в − 32 бластомера, 2 ч 35 мин; г − 64 бластомера, 3 ч 02 мин; д − 256 бластомеров, 3 ч 50 мин; е − завершение дробления и начало перехода к бластуляции, 5 ч 30 мин. Масштаб здесь и на рис. 4−6: 0.5 мм.
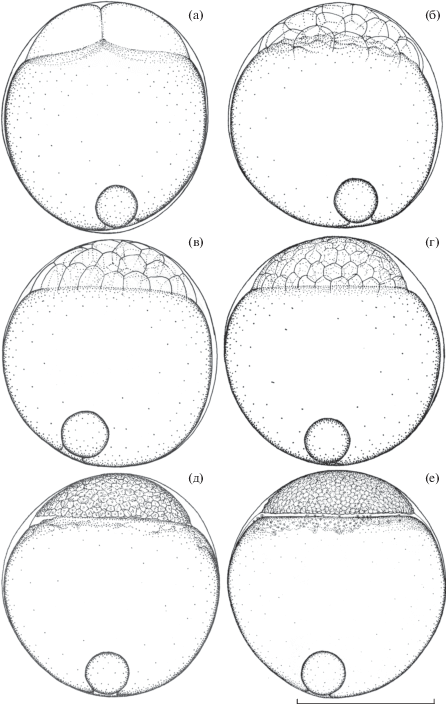
Борозды делений первых четырёх циклов дробления ориентированы в меридиональном направлении и закладываются одновременно с одинаковым интервалом, приводя к формированию стадий 2, 4, 8 и 16 бластомеров (рис. 2б). Эти деления сопровождаются формированием углубления под каждым бластомером, что создаёт в основании диска дробления специфический рельеф, чего на более поздних этапах развития не наблюдается. Следующие борозды, начиная с формирования 32 бластомеров (рис. 2в), закладываются не только в меридиональном, но и в латитудинальном направлении. На стадии 64 бластомеров (рис. 2г) цитоплазма большинства краевых бластомеров нижнего слоя диска дробления, которые Тринкаус (Trinkaus, 1993) назвал открытыми, без отчётливой границы переходит в слой окружающей желток цитоплазмы. За счёт этого перифирическая часть основания диска дробления слегка наплывает на желток.
Возраст 3 ч 50 мин (8.6 τ0) (рис. 2д). После завершения 8-го деления в процессе формирования 256 бластомеров мембраны открытых бластомеров деградировали, дифференцировался желточный синцитиальный слой, или перибласт. Это прозрачный, бесцветный слой, который заполняет просвет между почти плоским основанием диска дробления и желтком и со всех сторон почти равномерно выступает на свободную часть поверхности желтка.
Возраст 5 ч 00 мин−5 ч 20 мин (11.2−12.0 τ0). Происходит последнее относительно синхронное уменьшение размеров бластомеров, связанное, по-видимому, с последним циклом периода синхронных делений дробления и началом перехода к бластуляции.
Возраст 5 ч 30 мин (12.3 τ0) (рис. 2е). Основание бластодиска ровное, плоское. В периферической части слоя сформировавшегося желточного синцития можно наблюдать неразделённые клеточными мембранами отдельные ядра и их группы.
Возраст 5 ч 40 мин (12.6 τ0) (рис. 3а). Плоскость основания бластодиска половины яиц оставалась почти ровной, а у остальных сформировался слабый симметричный прогиб вниз, придающий им форму неравномерной двояковыпуклой линзы. Такая трансформация бластодиска является косвенным свидетельством ослабления адгезивных свойств мембран глубоких клеток, сопровождающего переход к бластуляции (Trinkaus, 1963; Lentz, Trinkaus, 1967). Основной материал желточного синцитиального слоя, заполнявшего обширный просвет между зародышевым диском и желтком, вытеснен на периферию, где образовал мощные наплывы, содержащие множество ядер.
Рис. 3.
Эмбриональное развитие Dendrochirus zebra от бластуляции до начала органогенезов: а − бластула, возраст 5 ч 40 мин; б − начало гаструляции, 7 ч 40 мин; в − гаструляция и начало эпиболии, 8 ч 10 мин; г − эпиболия перидермы ~60%, формирование осевого зачатка, 9 ч 10 мин; д, е − эпиболия перидермы ~70%, формирование первичных отделов центральной нервной системы, 10 ч 25 мин.
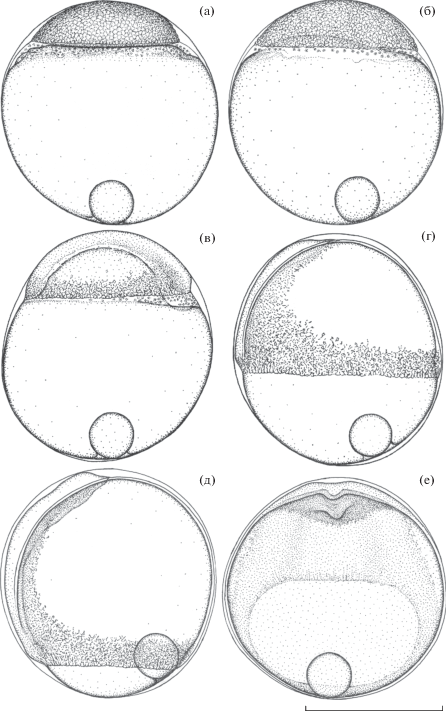
Возраст 7 ч 20 мин (16.4 τ0). Начало гаструляции. Основания всех зародышевых дисков выровнялись.
Возраст 7 ч 40 мин (17.1 τ0) (рис. 3б). Основание зародышевого диска начинает прогибаться вовнутрь. Вершина этого поднятия смещена от центра в вентральный сектор. Это смещение является результатом уже начавшихся центростремительных и конвергентных миграций популяции клеток гипобласта к периферии и в дорсальный сектор зародышевого диска и определяет ось билатеральной симметрии зародыша. В слое перибласта отчётливо видны ядра, плотность распределения которых в кольце, окружающем зародышевый диск, возрастает в направлении дорсального сектора.
Возраст 8 ч 10 мин (18.2 τ0) (рис. 3в). Продолжается перераспределение клеточного материала внутри зародышевого диска. Сформировалось зародышевое кольцо и зародышевый щиток. Усилилась неравномерность распределения ядер желточного синцитиального слоя в пользу дорсального сектора, где образовался мощный наплыв его цитоплазмы. Началась эпиболия перидермы. Под зародышевым диском скрыто около 20% поверхности желтка. Ширина полосы выступающего за границу краевых клеток синцития стала ýже. При этом в дорсальном секторе она шире и плавно сужается в направлении к вентральному.
Возраст 9 ч 10 мин (20.5 τ0) (рис. 3г). Под клеточным материалом зародыша скрыто около 60% поверхности желтка. В результате конвергентных миграций клеток гипобласта в медиальной области зародышевого щитка (дорсальный сектор зародышевого диска) дифференцировалась передняя часть осевого зачатка с отчётливым выделением области формирования головного отдела. При этом происходит заметное обеднение клеточным материалом вентральной области зародыша, не входящей в зародышевое кольцо.
Возраст 10 ч 25 мин (23.2 τ0) (рис. 3д, 3е). Эпиболия перидермы около 70%. Дорсальный и вентральный рельеф головного отдела зародыша определён дифференцировкой трёх первичных отделов головного мозга – переднего, среднего и заднего. На дорсальной поверхности образовалось продольное медиальное углубление, расположенное над средним и передней частью заднего первичных отделов головного мозга. Материал гипобласта формирует слой в основании осевого зачатка, его мощность увеличивается в краниально-медиальном направлении. Вокруг головного отдела и вдоль формирующегося тела зародыша сохраняется большое количество конвергентно мигрирующих клеток. В краниальном отделе эти клетки создают узкий ореол, который переходит в расширяющийся в каудальном направлении шлейф из активно мигрирующих в направлении осевого зачатка клеток. На уровне задней части зачатка шлейф переходит в зародышевое кольцо, охватывающее открытую часть поверхности желтка на вегетативном полюсе, иногда называемую по аналогии с голобластическими яйцами желточной пробкой.
Возраст 12 ч 30 мин (27.9 τ0) (рис. 4а, 4б). Под перидермой скрыто 100% поверхности желтка − завершение эпиболии перидермы. Зародышевое кольцо сомкнулось, образовав на анимальном полюсе наплыв из клеточного материала. Вокруг точки смыкания сохраняется воронка глубиной почти на всю толщину этого клеточного скопления. Продолжается дифференцировка структур осевого комплекса. Заложился зачаток хорды. Его дифференцировка направлена в краниальном и каудальном направлениях. Непосредственно над зачатком хорды расположены задний первичный отдел головного мозга и спинной мозг. Дифференцировались глазные плакоды. Зачаток хорды и расположенные непосредственно над ним отделы центральной нервной системы охватываются с боков агрегатами латеральной мезодермы, достигающими наибольшей высоты и дифференцировки в проксимальных отделах. Началось формирование первых сомитов, их насчитывается от одного до трёх. Процесс направлен в проксимально-дистальном направлении и на начальных стадиях сомитогенеза при наблюдении сбоку границы между сомитами не видны. К дистальным областям боковых закладок осевой мезодермы продолжают подключаться конвергентно мигрирующие по желточному мешку клетки, формирующие по обе стороны от тела зародыша скопления в виде узких полос, переходящих у его заднего отдела в остаток зародышевого кольца.
Рис. 4.
Эмбриональное развитие Dendrochirus zebra от завершения эпиболии до начала обособления хвостовой почки: а, б − завершение эпиболии перидермы, закладка глазных плакод, начало формирования границ первых сомитов в проксимальных частях боковых закладок осевой мезодермы, возраст 12 ч 30 мин; в, г − закладка Купферова пузырька, 13 ч 35 мин; д − полная деградация зародышевого кольца, 16 ч 50 мин; е − обособление хвостовой почки, редукция Купферова пузырька, 20 ч 20 мин.
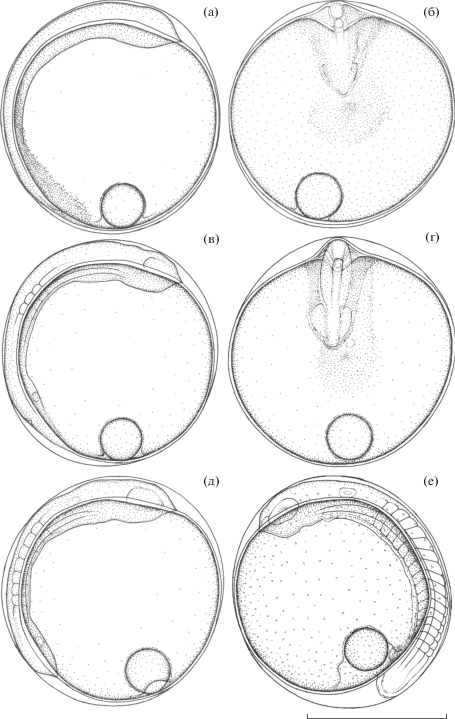
Возраст 13 ч 35 мин (30.3 τ0) (рис. 4в, 4г). В теле большинства зародышей выделились три пары идентифицируемых сбоку сомитов. Кроме этого, в проксимальной части боковых закладок осевой мезодермы начали дифференцироваться границы ещё двух–трёх пар. Скопление клеточного материала остатка зародышевого кольца, который ещё не вошёл в состав тела зародыша, почти слилось с его задним отделом. В области замыкания желточной пробки сохраняется неглубокое воронковидное углубление. У большинства зародышей (70–80%) под задним отделом, немного краниальнее точки смыкания зародышевого кольца, заложился Купферов пузырек.
Возраст 16 ч 50 мин (37.6 τ0) (рис. 4д). В теле зародыша насчитываются семь–восемь пар сомитов. Клеточный материал остатка зародышевого кольца полностью перешёл в состав тела зародыша. На уровне средней части продолговатого мозга заметно относительно рыхлое овальное уплотнение – начало дифференцировки слуховых плакод.
Вода в сосуде, в котором инкубировался фрагмент кладки со слизью, приобрела отчётливо выраженный запах разложения.
Возраст 18 ч 20 мин (40.9 τ0). В боковых закладках осевой мезодермы выделились 11–12 пар сомитов. Началось обособление хвостовой почки, на профиле яйца угол в точке перехода задней части зародыша в желточный мешок стал меньше 90°. Отчётливо дифференцированы слуховые плакоды.
Возраст 20 ч 20 мин (45.4 τ0) (рис. 4е). В теле зародыша выделились 16–17 пар сомитов, почти все они приобрели V-образную форму. У большинства зародышей (~80%) Купферов пузырек редуцирован полностью. У остальных он сохраняется лишь в рудиментарном состоянии. Дифференцировались обонятельные плакоды. Глазные пузыри начали преобразовываться в глазные бокалы с дифференцирующимися внутри них хрусталиковыми плакодами. В слуховых плакодах сформировались полости. В покровном слое появилось множество округлых клеток, особенно отчётливо заметных на желточном мешке, где они распределены почти равномерно по всей площади. Между ними в значительно меньшем количестве располагаются активно мигрирующие клетки преимущественно каплевидной, веретеновидной или треугольной формы.
Возраст 21 ч 30 мин (47.9 τ0) (рис. 5а). В теле зародыша выделились 18–20 пар сомитов. Начало подвижного состояния зародыша. Наблюдаются слабые, едва заметные сокращения стенок зачатка сердца, происходящие с частотой 40–50 раз/мин. Хрусталики в глазных бокалах приобрели шаровидную форму. В обонятельных плакодах сформировались полости. Подвижные клетки со всей поверхности желточного мешка сконцентрировались в области, примыкающей к головному отделу.
Рис. 5.
Эмбриональное развитие Dendrochirus zebra; подвижное состояние зародыша: а − начало пульсации сердца, возраст 21 ч 30 мин; б − эмбрион за 1 ч до вылупления, 24 ч 10 мин.
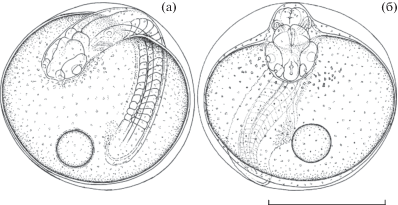
Возраст 22 ч 30 мин (50.2 τ0). В теле зародыша выделились 23–25 пар мускульных сегментов. Мускулатура туловища большинства зародышей начала сокращаться. Частота сердечных сокращений – 50–60 раз/мин.
Возраст 24 ч 10 мин (1 ч до вылупления) (53.9 τ0) (рис. 5б). В теле эмбриона насчитывается 27–28 мускульных сегментов: 12–13 туловищных и 14–15 хвостовых. В слуховых капсулах сформировано по два отолита. На желточном мешке вокруг головного отдела сохраняется присутствие активно мигрирующих клеток.
В возрасте 25 ч 00 мин (55.8 τ0) из яйцевых оболочек вышло ~10% эмбрионов, в возрасте 25 ч 30 мин (56.9 τ0) – ~50% эмбрионов.
Личиночный период развития
Возраст 26 ч 00 мин (57.9 τ0). Завершение процесса вылупления. Осталось не более 5% живых эмбрионов, которые из яйцевых оболочек не вышли и позже погибли. В сосуде, в котором инкубировался фрагмент кладки со слизью, все эмбрионы погибли.
Длина (TL) предличинок через 30 мин после вылупления (п.в.) (рис. 6а) составляет 1.6–1.7 мм. В их теле насчитывается 28–29 сегментов: 12–13 туловищных и 15–17 хвостовых. Диаметр жировой капли за время эмбрионального периода практически не изменился и составляет 0.144–0.151 мм. Под покровным слоем сформирован обширный гидросинус, охватывающий почти все отделы. Практически по всей площади покровного слоя почти равномерно распределено множество округлых клеток, в которые, по-видимому, входят мукозные и разные типы ионных (хлоридных или богатых митохондриями) клеток (Yamashita, 1978; Robinson, 1996). На всех участках желточного мешка присутствуют активно мигрирующие клетки сложной формы, напоминающие меланофоры без пигмента. Пищеварительный тракт представлен трубкой с узким просветом без видимой дифференцировки на отделы. Сердце сокращается с частотой около 110–120 раз/мин. От области, примыкающей к вентрокаудальной части слуховой капсулы, вдоль средней линии тела располагается прорастающая в каудальном направлении часть сенсорного нейрона задней ветви боковой линии. Концевое обширное скопление клеток её мигрирующего зачатка локализовано в области формирования первого невромаста (проневромаста). Предличинки практически неподвижны, располагаются под поверхностной плёнкой воды, касаясь её вентральной частью желточного мешка, и изредка совершают короткие (10–15 мм) перемещения. Реакция на свет отсутствует.
Рис. 6.
Личиночное развитие Dendrochirus zebra: а − предличинка TL 1.6–1.7 мм через 30 мин после вылупления (п.в.); б − предличинка TL 2.11 мм, 27 ч п.в.; в − предличинка TL 2.35 мм, 68 ч п.в.; г − личинка TL 2.41 мм, переход на внешнее питание, 105 ч п.в.
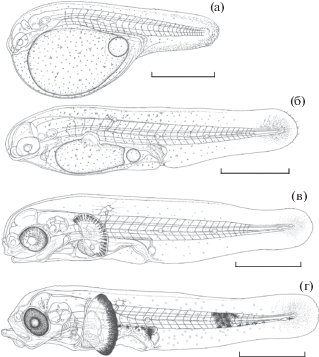
Возраст 16 ч п.в., TL 1.90–2.03 мм. На желточном мешке рядом с телом предличинки на уровне второго–четвёртого сегментов тела в виде скоплений клеточного материала начали дифференцироваться зачатки свободных лопастей грудных плавников. Фототаксис нейтральный. Предличинки малоподвижны, периоды полного покоя (1–2 мин) в состоянии контакта с поверхностной плёнкой воды или парения в 2-сантиметровом подповерхностном слое прерываются одним–двумя бросками на 20–40 мм.
Возраст ~ 27 ч п.в., TL 2.09–2.15 мм (рис. 6б). В теле насчитываются 27–28 мускульных сегментов: 12–13 туловищных и 15–16 хвостовых. Желток резорбирован на ~70% первоначального объёма. Диаметр жировой капли уменьшился примерно на 25% и составляет 0.110–0.120 мм. На уровне задних границ слуховых капсул в виде дугообразных образований дифференцировались зачатки клейтрумов. Локализация зачатков свободных лопастей грудных плавников не изменилась, но они заметно продвинулись в развитии и приобрели форму высоких уплощённых гребней, основания которых расположены на дорсальной поверхности желточного мешка рядом с телом предличинки. Увеличился просвет в пищеварительной трубке, началась её дифференцировка на отделы. Парные выводящие протоки почек впадают в тонкостенный пульсирующий мочевой пузырь. На внутренней поверхности покровов желточного мешка, туловищного и передней части хвостового отделов наблюдается присутствие активно мигрирующих клеток, предположительно меланофоров без меланина.
Возраст 45 ч п.в., TL 2.20–2.28 мм. В теле насчитываются 26–27 мускульных сегментов: 11–12 туловищных и 15–16 хвостовых. Начало меланиновой пигментации: в пигментном слое глаз появился меланин, придающий их периферийным областям слабую дымчатую окраску. Фототаксис нейтральный.
Возраст 68 ч п.в., 2.30–2.36 мм (рис. 6в). В теле насчитываются 23–24 мускульных сегмента: 9–10 туловищных и 14–15 хвостовых. Усилилась дифференцировка пищеварительного тракта. Относительно толстостенный и суженный в каудальном направлении пищевод переходит в расширенный желудок, который после сужения переходит в кишечник. Желток резорбирован почти полностью. Его остаток, содержащий рудимент жировой капли, примыкает сзади к дифференцирующемуся зачатку печени и располагается под входом в желудок. Площадь зачатков грудных плавников значительно увеличилась, их основания расположены на уровне 1–2-го сегментов. Свободные лопасти ориентированы почти перпендикулярно латеральной поверхности тела. По краям плавниковой лопасти появился своеобразный рисунок, сформированный радиально ориентированными скоплениями чёрных меланофоров. Усилилась пигментация глаз, на фоне равномерной дымчатой окраски появилось множество чёрных точечных вкраплений, распределённых преимущественно по периферии глазного бокала. Функционируют гиоидная, мандибулярная и одна жаберная дуга. Циркулирует только лимфа, форменных элементов крови нет. Сформированы четыре пары невромастов задней ветви боковой линии первой волны формирования.
Возраст 82 ч п.в. Основания грудных плавников приняли вертикальное положение. Их свободные лопасти приобрели подвижность. Челюстной аппарат остаётся неподвижным. Несколько окрашенных чёрных или серых меланофоров располагаются по внешней линии границы туловищной мускулатуры и полости тела на уровне четвёртого–восьмого сегментов, формируя неполный нижнебоковой ряд. Группа таких же клеток формирует поясковое скопление в хвостовом отделе в области 16–21-го сегментов. Пигментный слой глаз полостью заполнен чёрным меланином. Подавляющее большинство предличинок начали положительно реагировать на свет.
Возраст 105 ч п.в., 2.33–2.42 мм (рис. 6г). В теле насчитываются 22–23 мускульных сегмента: 8–9 туловищных и 14–15 хвостовых. Функционируют мандибулярные, гиоидные и четыре пары жаберных дуг. Форменные элементы в кровяном русле не циркулируют. Задний отдел пищевода образует слабый изгиб вниз и впадает в расширенную переднюю часть желудка, образующую в этой области слабый изгиб вправо. Далее, сужаясь, пищеварительный тракт направляется в каудальном направлении и после короткого отчётливого сужения расширяется, переходя в кишечник с начавшей приобретать складчатость внутренней поверхностью. Челюстной аппарат подвижен. В стенках желудка и кишечника периодически проходят волны перистальтики. Фактура печени приобрела характерную сегментированность. В дорсальной части печень охватывает сохранившийся рудимент жировой капли. В пигментации принципиальных изменений не произошло. Увеличилась плотность расположения и интенсивность окраски меланофоров, расположенных на свободной лопасти грудного плавника, в области нижнебокового ряда в задней части туловищного отдела и пояскового скопления в хвостовом отделе. Кроме этого, в составе неполного непарного подхвостового ряда появились три–пять меланофоров, которые располагаются от пояскового скопления до терминальной области. Меланин пигментных клеток сосудистой оболочки в проходящем свете придаёт глазам абсолютно чёрную окраску, а появившийся гуанин добавляет им металлический блеск в отражённом свете. Личинки активно плавают во всех слоях воды, совершают броски в сторону взвешенных в воде мелких частиц, иногда пытаясь их захватывать, и демонстрируют хорошо выраженный положительный фототаксис, в течение нескольких минут скапливаясь в более освещённой части сосуда.
ОБСУЖДЕНИЕ
Строение половых желёз самок D. zebra в общих чертах сходно с таковым у других икромечущих представителей семейства Scorpaenidae. Половые клетки расположены в центре яичника на стромальном стержне, к которому они крепятся при помощи удлинённых выростов, или стебельков. Такое строение половых желёз обусловлено особенностями размножения рыб, вымётывающих кладки икры, окружённые желеобразной массой. Расположение ооцитов на выростах является приспособлением, служащим для увеличения объёма генеративных элементов, поскольку яйценосные пластинки отсутствуют, как у D. zebra, или малочисленны, как у некоторых других представителей Scorpaenidae (Fishelson, 1978; Erickson, Pikitch, 1993; Muñoz et al., 2002; Павлов, Емельянова, 2007).
Овулировавшие ооциты нам удалось получить как при использовании только сурфагона, так и при сочетании его с антагонистом дофамина. Изучение механизмов гипоталамического нейросекреторного контроля воспроизводительной функции рыб показало, что помимо рилизинг-гормонов, стимулирующих синтез и выведение гонадотропинов из гипофиза, в гипоталамусе имеется гонадотропин-рилизинг-ингибирующий фактор, подавляющий эти процессы – дофамин (Chang, Peter, 1983; Баранникова, 1984; Годухин, Мотлох, 1992). В связи с этим в практике заводского разведения рыб при использовании синтетических аналогов гонадотропного рилизинг-гормона рыбам вводят вещества, блокирующие выведение дофамина, или антагонисты дофамина (Lam, 1982; Epler, Bieniarz, 1989; Попонов и др., 1990; Glubokov et al., 1991; Глубоков, 1998). Первоначально антагонисты дофамина были использованы в гормональной терапии на пресноводных рыбах, и в настоящее время они применяются главным образом при работе с Cyprinidae и Siluridae (Wen, Lin, 2004). У большинства коммерчески ценных видов морских рыб дофаминергическая регуляция, по-видимому, отсутствует (Copeland, Thomas, 1989; King et al., 1994; Zohar et al., 1995; Prat et al., 2001; Kumakura et al., 2003), за исключением Mugilidae (Aizen et al., 2005). Этим, вероятно, и объясняется возможность овуляции ооцитов D. zebra при использовании только сурфагона.
Зрелые ооциты самок D. zebra, готовых к нересту, заключены в агрегаты слизистой массы так же, как и у многих представителей семейства Scorpaenidae (Moser, 1996; Leis, Carson-Ewart, 2000), в частности, у всех известных икромечущих видов подсемейств Scorpaeninae, Pteroinae и Sebastolobinae (Washington et al., 1984). Значение этих образований в настоящее время достоверно не определено. Существуют разные предположения. В частности, на основании ряда экспериментов было показано (Moyer, Zaiser, 1981), что вещества, входящие в слизь, являются репеллентами для многих рифовых рыб – икорных хищников, обычно присутствующих в местах нереста D. zebra. Наряду с этим указанные выше авторы считают, что объединение больших порций икры в единое образование способствует скорейшей эвакуации потомства из мест нереста с наибольшей концентрацией хищников посредством течений. Также они установили, что в естественных условиях слизь выметанных в процессе нереста агломератов растворяется в течение ~12 ч, что, по нашим данным, соответствует примерно середине инкубационного периода. В наших опытах при температуре 25°C входящие в слизевую массу органические вещества довольно быстро начинали разлагаться, очевидно, отрицательно влияя на выживаемость потомства. В естественных условиях развивающаяся икра относительно быстро освобождается от выполнивших свои защитные функций слизевых масс и вторую половину инкубационного периода находится в типично пелагическом состоянии, что, по-видимому, позволяет ей избежать отрицательного воздействия разлагающейся органики и облегчает реализацию возрастающей по мере приближения к моменту вылупления потребности зародыша в кислороде (Davenport, 1983; Новиков, 2000). Аналогичным образом у некоторых других изученных представителей Scorpaeninae – Scorpaena miostoma (Kimura et al., 1989), S. scrofa (Nemeth et al., 2010; Rodriguez et al., 2017), Scorpaenopsis possi и Sebastapistes cyanostigma (Павлов, Емельянова, 2007) – слизь кладки полностью растворяется до завершения эмбрионального периода развития. У Scorpaena guttata (Orton, 1955) она сохраняется до вылупления и позже, однако складывается впечатление, что структура слизевой оболочки этого вида отличается большей упругостью и, возможно, другими свойствами.
Характеристики яиц, предличинок и ранних личинок D. zebra вполне соответствуют обобщённым представлениям, сформулированным Вашингтоном с соавторами (Washington et al., 1984) для представителей подсемейств Scorpaeninae и Pteroinae, а также данным, представленным в работах, опубликованных позже (Kimura et al., 1989; Dulčić et al., 2007; Павлов, Емельянова, 2007; Nemeth et al., 2010; Connell, 2012; Maricchiolo et al., 2014; Rodriguez et al., 2017). Икра разных видов этих подсемейств имеет очень много общего, но различается по наличию жировой капли. В частности, считается (Washington et al., 1984), что у представителей рода Pterois имеется одна жировая капля, а у видов рода Scorpaena её нет. Со ссылкой на Фишелсона (Fishelson, 1975) в сводке также указано, что у Dendrochirus она также отсутствует. Эта работа посвящена преимущественно нерестовому поведению и репродуктивной биологии трёх видов подсемейства Pteroinae: Dendrochirus brachypterus, Pterois volitans и P. radiata. Наибольшее внимание в ней уделено D. brachypterus, для которого сделана попытка описания раннего развития. Оно, к сожалению, получилось очень кратким и схематичным и не содержит описания яиц исследованного вида. На представленном фото кладки отчётливо видно, что яйца, входящие в её состав, жировой капли не содержат; не изображена она и на рисунках личинок (Fishelson, 1975. Fig. 16, 17A–17C). Однако в описании личинок в возрасте 2 сут. указывается сохранившаяся крупная жировая капля, что позволяет полагать: яйца D. brachypterus её всё же содержат. По-видимому, на фото изображена кладка какого-то другого вида, вероятно, одного из двух изучаемых автором видов рода Pterois. С учётом данных Шао с соавторами (Shao et al., 2001), согласно которым яйца Pterois volitans жировую каплю содержат, можно предположить, что на снимок попала кладка P. radiata. Тогда получается, что из трёх изученных видов рода один не имеет в яйце жировой капли, так как достоверно показано, что яйца P. lunulata её содержат (Mito, Uchida, 1958).
Таким образом, яйца исследованных в настоящее время видов Scorpaeninae имеют форму от слегка неправильной сферической до слегка эллиптической, узкое перивителлиновое пространство, однородный прозрачный желток, гладкую неструктурированную прозрачную яйцевую оболочку. Яйца большинства изученных представителей трибы Pteroini в отличие от других видов подсемейства содержат жировую каплю. Предличинки сразу после вылупления малоподвижны, имеют слабое морфологическое развитие, большой эллиптический желточный мешок, прозрачные непигментированное тело и глаза и закрытое ротовое отверстие. Плавниковая складка и остальная часть покровов образуют гидросинус – балонообразное расширение, охватывающее головной и туловищный отделы. У большинства изученных видов в покровах наблюдается множество отчётливо заметных мукозных и хлоридных клеток, которые дифференцируются ещё в эмбриогенезе. В общем характере развития пигментации имеются некоторые различия, но на фоне определённого сходства в общих чертах. Наиболее характерной особенностью пигментации предличинок является относительно раннее появление меланофоров на свободных складках грудных плавников; при этом в большинстве известных случаев меланофоры концентрируются в дистальных областях их быстро увеличивающихся лопастей. У многих представителей Scorpaeninae к моменту перехода на внешнее питание формируются подхвостовой и нижнебоковой ряды меланофоров. У D. zebra в этом возрасте подхвостовой ряд меланофоров сформирован только частично, но образовалось отчётливое поясковое скопление в средней части хвостового отдела. Пигментация предличинок D. brachypterus предположительно имеет сходный характер, однако признаков наличия меланофоров в нижнебоковом ряду обнаружить не удалось ни в тексте, ни на рисунках, что, возможно, является следствием схематичности представленного в работе описания (Fishelson, 1975).
Размерные и морфологические характеристики яиц, предличинок и ранних личинок P. lunulata (Mito, Uchida, 1958), а также хронологические показатели развития с учётом некоторой разницы в температуре инкубации практически не отличаются от соответствующих показателей D. zebra. Есть небольшие отличия в пигментации. Так, например, подхвостовой ряд меланофоров у P. lunulata начинает формироваться раньше, и к переходу на внешнее питание составляющие его клетки распределены на протяжении почти всего хвостового отдела, а на вентральной стороне каудальной части кишечника имеются крупные меланофоры, которые отсутствуют у D. zebra. В средней части хвостового отдела, где у D. zebra формируется поясковое скопление, у P. lunulata имеется лишь серия меланофоров на дорсальной стороне, однако, возможно, это является промежуточным этапом формирования этого скопления.
Число сегментов в туловищном и хвостовом отделах у предличинок сразу после вылупления и характер дальнейшего изменения этого показателя у обоих видов очень близки. К моменту выхода из яйцевых оболочек число сегментов достигает своего максимального значения – 28–29 (12–13 туловищных и 15–17 хвостовых), а к моменту перехода на внешнее питание в теле личинок насчитывается 23 (8–9 и 14–15) сегмента. Данных о сегментации и числе позвонков у взрослых особей D. zebra обнаружить не удалось, но можно предположить, что, как и у P. lunulata (Mito, Uchida, 1958), к моменту перехода пищеварительной системы в функциональное состояние сформировавшееся число сегментов туловищного отдела соответствует дефинитивному или близко к нему. Очевидно, что описанная динамика связана с дифференцировкой органов полости тела и фиксацией положения её каудальной границы в окончательном положении относительно сегментов тела, а сокращение их общего числа происходит за счёт деградации задних.
Кроме представителей подсемейства Scorpaeninae в настоящее время опубликованы достоверные данные об икре и ранних личиночных стадиях видов из ещё четырёх подсемейств семейства Scorpaenidae: Helicolenus dactylopterus (Sebastinae), Choridactylus natalensis (Synanceiinae), Apistus carinatus (Apistinae), Ablabys binotatus (Tetraroginae) (Connell, 2012) и Inimicus japonicus (Synanceiinae) (Wang et al., 2013). Также описаны эмбриональные, предличиночные и ранние личиночные стадии развития некоторых представителей четырёх других семейств отряда Scorpaenifores: Cocotropus monacanthus (Aploactinidae), Cociella heemstrai, Rogadius portuguesus, Onigocia oligolepis (Platycephalidae), Lepidotrigla faurei, Trigloporus lastoviza africana (Triglidae) (Connell, 2012) и Platicephalus indicus (Platycephalidae) (Hsiao-Wei et al., 1980). Все отмеченные виды, за исключением H. dactylopterus, хорошо отличаются от представителей Scorpaeninae, прежде всего, относительно интенсивной, формирующейся ещё в эмбриогенезе пигментацией тела эмбриона и желточного мешка.
Метод безразмерной характеристики продолжительности ранних периодов развития в относительных единицах с использованием величины τ0, равной длительности одного клеточного цикла периода синхронных делений дробления, был разработан в основном на Amphibia и Acipenseridae (Детлаф Т., Детлаф А., 1960; Dettlaff Т. Dettlaff А., 1961; Детлаф Т., 1977) для решения важнейшей задачи сопоставления хронологических характеристик раннего онтогенеза разных видов пойкилотермных животных и был применён Игнатьевой (1979) на костистых рыбах. Для одноимённых стадий раннего развития восьми исследованных видов она получила достаточно близкие значения. Соответствующие показатели для D. zebra оказались меньше, что несколько расширяет представления о временны́х характеристиках периодов раннего онтогенеза костистых рыб и это не является единственным случаем. В частности, если для всех видов, исследованных Игнатьевой (1979), относительный возраст закладки первой борозды дробления составляет 2 τ0, то у Danio rerio – 3 τ0 (Kimmel et al., 1995), а у Takifugu rubripes – 5.3 (Uji et al., 2011).
Метод безразмерной характеристики продолжительности периодов в раннем развитии может представлять большой интерес для исследований формирования эмбриоадаптаций и гетерохроний в развитии костистых рыб разных таксономических групп или представителей одного вида под воздействием разных условий инкубации. Также представляется интересным возможное выявление закономерностей, связанных с различиями в таксономическом положении или экологии видов. Однако число описаний раннего развития рыб, соответствующих требованиям этого метода, и в настоящее время слишком мало, даже чтобы только оценить степень его пригодности для решения этих задач.
Список литературы
Баранникова И.А. 1984. Гормональная регуляция репродуктивной функции у рыб с различной экологией // Биологические основы рыбоводства. Актуальные проблемы экологической физиологии и биохимии рыб. М.: Наука. С. 178–218.
Глубоков А.И. 1998. Регуляция репродуктивной функции с помощью биологически активных веществ и факторов // Биологические основы марикультуры / Под ред. Душкиной Л.А. М.: Изд-во ВНИРО. С. 205–215.
Годухин О.В., Мотлох Н. 1992. Регуляция гонадотропной функции гипофиза у костистых рыб // Успехи соврем. биологии. Т. 112. Вып. 1. С. 115–129.
Детлаф Т.А. 1977. Некоторые температурно-временные закономерности эмбрионального развития пойкилотермных животных // Проблемы экспериментальной эмбриологии. М.: Наука. С. 269–289.
Детлаф Т.А., Детлаф А.А. 1960. О безразмерных характеристиках продолжительности развития в эмбриологии // ДАН СССР. Т. 134. № 1. С. 199–202.
Игнатьева Г.М. 1979. Ранний эмбриогенез рыб и амфибий (сравнительный анализ временных закономерностей развития). М.: Наука, 175 с.
Новиков Г.Г. 2000. Рост и энергетика развития костистых рыб в раннем онтогенезе. М.: Эдиториал УРСС, 296 с.
Павлов Д.А., Емельянова Н.Г. 2007. Особенности биологии размножения двух видов тропических рыб семейста Scorpaenidae // Вопр. ихтиологии. Т. 47. № 3. С. 347–360.
Павлов Д.А., Емельянова Н.Г. 2013. Переход к живорождению в отряде Scorpaeniformes: краткий обзор // Там же. Т. 53. № 1. С. 69–86.
Попонов С.Ю., Веселовзоров С.И., Мотлох Н.Н., Гончаров Б.Ф. 1990. Дофаминовая регуляция овуляции и спермиации у рыб // Эколого-физиологические и токсикологические аспекты и методы рыбохозяйственных исследований. М.: Изд-во ВНИРО. С. 102–117.
Роскин Г.И., Левинсон Л.Б. 1957. Микроскопическая техника. М.: Сов. наука, 467 с.
Aizen J., Meiri I., Tzchori I. et al. 2005. Enhancing spawning in the grey mullet (Mugil cephalus) by removal of dopaminergic inhibition // Gen. Comp. Endocrinol. V. 142. P. 212–221.
Ballard W.W. 1973a. Morphogenetic movements in Salmo gairdneri Richandson // J. Exp. Zool. V. 184. № 1. P. 27–48.
Ballard W.W. 1973b. A new fate map for Salmo gairdneri // Ibid. V. 184. № 1. P. 49–73.
Chang J.P., Peter K.E. 1983. Effects of pimozide and des Gly10, (D-Ala6) luteinizing hormone-releasing hormone ethylamide on serum gonadotropin concentrations germinal vesicle migration and ovulation in female gold fish, Carassius auratus // Gen. Comp. Endocrinol. V. 52. №. 1. P. 30–37.
Connell A.D. 2012. Marine fish eggs and larvae from the east coast of South Africa. (http://fisheggs-and-larvae.saiab.ac.za/).
Copeland P.A., Thomas P. 1989. Control of gonadotropin release in the Atlantic croaker (Micropogonias undulatus): evidence for lack of dopaminergic inhibition // Gen. Comp. Endocrinol. V. 74. P. 474–483.
Davenport J. 1983. Oxygen and the developing eggs and larva of the lumpfish, Cyclopterus lumpus // J. Mar. Biol. Assoc. UK. V. 63. P. 633–640.
Dettlaff T.A. 1964. Cell divisions, duration of interkinetic states and differentiation in early stages of embryonic development // Adv. Morphogen. V. 3. P. 323–362.
Dettlaff T.A., Dettlaff A.A. I961. On relative dimensionless characteristics of the development duration in embryology // Arch. Biol. (Liege). V. 72. P. l–16.
Dulčić J., Jug-Dujaković J., Bartulović V. et al. 2007. Embryonic and larval development of large scaled scorpionfish Scorpaena scrofa (Scorpaenidae) // Cybium. V. 31. P. 465–470.
Epler P., Bieniarz K. 1989. Gonad maturation and hormonal stimulation of spawning in wels (Silurus glanis L.) // Pol. Arch. Hygrobiol. V. 36. №. 36. P. 417–429.
Erickson D.L., Pikitch E.K. 1993. A histological description of shortspine thornyhead, Sebastolobus alascanus, ovaries: structures associated with the production of gelatinous egg masses // Environ. Biol. Fish. V. 36. P. 273–282.
Fishelson L. 1975. Ethology and reproduction of the pteroid fishes found in the Gulf of Aqaba (Red Sea) especially Dendrochirus brachypterus (Cuvier) Pteroidae (Teleostei) // Publ. Stat. Zool. Napoli. V. 39. P. 635–656.
Fishelson L. 1978. Oogenesis and spawn-formation in the pigmy lion fish Dendrochirus brachypterus (Pteroidae) // Mar. Biol. V. 46. P. 341–348.
Froese R., Pauly D. (eds.). 2016. Dendrochirus zebra (Cuvier, 1829) // FishBase. World Wide Web electronic publication (www.fishbase.org. Version 08/2016).
Glubokov A.I., Motloch N.N., Sedova M.A. 1991. Effect of synthetic LH-PH analogue and dopamine antagonists on the maturation of bream, Abramis brama L. // Aquaculture. V. 95. P. 373–377.
Hsiao-Wei C., He Gueffen S., Liqing S. 1980. A description of the morphological characters of the eggs and larvae of the flathead fish, Platicephalus indicus // Oceanol. Limnol. Sin. V. 11. № 2. P. 161–171.
Kimmel C.B., Ballard W.W., Kimmel S.R. et al. 1995. Stage of embryonic development of the zebrafish // Devel. Dyn. V. 203. P. 253–310.
Kimura S., Tsukamoto Y., Mori K. 1989. Early developmental stages of the scorpaenid fish, Scorpaena miostoma, reared in the laboratory // Jpn. J. Ichthyol. V. 35. № 4. P. 434–439.
King W.V., Thomas P., Harrell R.M. et al. 1994. Plasma levels of gonadal steroids during final oocyte maturation of striped bass, Morone saxatilis L. // Gen. Comp. Endocrinol. V. 95. P. 178–191.
Kumakura N., Okuzawa K., Gen K., Kagawa H. 2003. Effects of gonadotropin-releasing hormone agonist and dopamine antagonist on hypothalamus-pituitary-gonadal axis of pre-pubertal female red seabream (Pagrus major) // Ibid. V. 131. P. 264–273.
Lam T.J. 1982. Application of endocrinology to fish culture // Can. J. Fish Aquat. Sci. V. 13. P. 111–137.
Leis J.M. 2015. Taxonomy and systematics of larval Indo-Pacific fishes: a review of progress since 1981 // Ichthyol. Res. V. 62. № 1. P. 9–28. doi 10.1007/s10228-014-0426-7
Leis J.M., Carson-Ewart B.M. 2000. The larvae of Indo-Pacific coastal fishes: a guide to identification (fauna malesiana handbook 2). Leiden: Brill, 850 p.
Lentz T.L., Trinkaus J.P. 1967. A fine structural study of cytodifferentiation during cleavage, blastula, and gastrula stages of Fundulus heteroclitus // J. Cell Biol. V. 32. P. 121–138.
Maricchiolo G., Casell G., Mancuso M., Genovese L. 2014. Report of spontaneous spawning of captive red scorpionfish, Scorpaena scrofa (Linnaeus, 1758) with special attention on capture and broodstock management // Aquacult. Res. V. 47. № 2. P. 677–680.
Mito S., Uchida K. 1958. On the egg development and hatched larvae of a scorpaenoid fish, Pterois lunulata Temminck et Schlegel // Sci. Bull. Fac. Agr. Kyushu Univ. V. 16. № 3. P. 381–385.
Moser H.G. 1996. Scorpaeniformes: Scorpaenidae // The early stages of fishes in the California Current Region. CalCOFI Atlas № 33 / Ed. Moser H.G. Lawrence, Kansas: Allen Press Inc. P. 733–795.
Moyer J.T., Zaiser M.J. 1981. Social organization and spawning behavior of the pteroine fish Dendrochirus zebra at Miyake-jima, Japan // Jpn. J. Ichthyol. V. 28. P. 52–69.
Muñoz M., Casadevall M., Bonet S. 2002. The ovarian morphology of Scorpaena notata shows a specialized mode of oviparity // J. Fish Biol. V. 61. № 4. P. 877–887.
Myers R.F. 1991. Micronesian reef fishes. Barrigada, Guam: Coral Graphics, 298 p.
Nelson J.S., Grande T.C., Wilson M.V.H. 2016. Fishes of the World. Hoboken, N. J.: John Wiley and Sons, 752 p.
Nemeth S., Budahazi A., Szucs R., Bercsenyi M. 2010. Out of season artificial propagation of the black scorpionfish (Scorpaena porcus L.) in captivity // Mediterr. Aquacult. J. V. 1. № 1. P. 28–35.
Orton G. L. 1955. Early developmental stages of the California scorpionfish, Scorpaena guttata. // Copeia. V. 3. P. 210–214.
Prat F., Zanuy S., Carrillo M. 2001. Effect of gonadotropin-releasing hormone analogue (GnRHa) and pimozide on plasma levels of sex steroids and ovarian development in sea bass (Dicentrarchus labrax L.) // Aquaculture. V. 198. P. 325–338.
Robinson K.P. 1996. The role of the skin of early post-hatch turbot (Scophthalmus maximus L.) in osmoregulation: PhD Thesis. Dept. Biol. Mol. Sci. Univ. Stirling, 172 p.
Rodriguez J.M., Alemany F., Garcia A. 2017. A guide to the eggs and larvae of 100 common Western Mediterranean Sea bony fish species. Rome: FAO, 256 p.
Shao K.T., Yang R.S., Chen K.C., Lee Y.S. 2001. An identification guide of marine fish eggs from Taiwan. Taipei: Inst. Zool. Acad. Sin., 176 p. (http://fishdb.sinica.edu.tw/chi/ fishegg/ fisheggintro_e.php.)
Trinkaus J.P. 1963. The cellular basis of Fundulus epiboly. Adhesivity of blastula and gastrula cells in culture // Devel. Biol. V. 7. P. 513–532.
Trinkaus J.P. 1993. The yolk syncytial layer of Fundulus: its origin and history and its significance for early embryogenesis // J. Exp. Zool. V. 265. P. 258–284.
Uji S., Kurokawa T., Hashimoto H. et al. 2011. Embryogenic staging of fugu, Takifugu rubripes, and expression profiles of aldh1a2, aldh1a3, and cyp26a1 // Devel. Growth Differ. V. 53. P. 715–725.
Wang Y., Li L., Cui G., Lu W. 2013. Ontogenesis from embryo to juvenile and salinity tolerance of Japanese devil stinger Inimicus japonicus during early life stage // Springer Plus. V. 2. № 1. P. 2–13.
Washington B.B., Moser H.G., Laroche W.A., Richards W.J. 1984. Scorpaeniformes: development // Ontogeny and systematics of fishes / Eds. Moser H.G. et al. Spec. Publ. № I. Amer. Soc. Ichthyol. Herpetol. Lawrence: Allen Press. P. 405–528.
Wen H.S., Lin H.R. 2004. Effects of exogenous neurohormone, gonadotropin (GtH) and dopaminergic drugs on the serum GtH content and ovulatory responsiveness of wild catfish, Silurus asorus (Linnaeus, 1758) // Aquacult. Res. V. 35. P. 204–212.
Yamashita K. 1978. Chloride cells in the skin of the larvae red seabream Pagrus major // Jpn. J. Ichthyol. V. 25. № 3. P. 211–215.
Zohar Y., Harel M., Hassin S., Tandler A. 1995. Gilthead sea bream (Sparus aurata) // Broodstock management and egg and larval quality / Eds. Bromage N.R., Roberts R.J. Oxford: Blackwell Sci. P. 94–117.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


