Вопросы ихтиологии, 2019, T. 59, № 4, стр. 405-415
Видовой состав и распределение донных рыб в элиторали северо-западной части Охотского моря в летний период
П. А. Савельев 1, *, Е. А. Метелёв 2, А. С. Сергеев 2, В. С. Данилов 2
1 Национальный научный центр морской биологии Дальневосточного отделения
РАН − ННЦМБ ДВО РАН
Владивосток, Россия
2 Магаданский научно-исследовательский институт рыбного хозяйства
и океанографии − МагаданНИРО
Магадан, Россия
* E-mail: tomthumb@mail.ru
Поступила в редакцию 06.09.2018
После доработки 25.10.2018
Принята к публикации 23.01.2019
Аннотация
На основании материалов траловой съёмки, проведённой на глубинах 81–301 м в северо-западной части Охотского моря в августе–сентябре 2013 г., описывается видовой состав и особенности распределении донных шельфовых рыб. Зарегистрировано 69 видов, в том числе на шельфе 54 вида из 11 семейств, среди которых по числу видов и численности в уловах доминируют Zoarcidae (19 видов), Liparidae (17), Cottidae (7), Pleuronectidae (7) и Cyclopteridae (5). На шельфе выявлены две группировки рыб. Одну составляют виды, предпочитающие экстремально низкие значения температуры западноохотоморской холодовой линзы (ниже –1°C), причём некоторые из них встречаются исключительно в её пределах; в другую входят остальные шельфовые виды, её избегающие. Граница между шельфовыми и батиальными ихтиоценами проходит по изобате 200 м. Глубины 150–250 м заселены экотонным сообществом, в котором наблюдается резкий переход от шельфовых ихтиоценов к батиальным.
Несмотря на продолжительный период исследований, донная ихтиофауна шельфа северо-западной части Охотского моря изучена довольно слабо, что особенно отчётливо заметно в отношении непромысловых видов (Солдатов, Линдберг, 1930; Попов, 1931; Таранец, 1937; Шмидт, 1950; Борец, 1985, 1990; Черешнев и др., 2001; Иванов, 2002; Фёдоров и др., 2003). Первые экспедиции на североохотоморском шельфе, сопровождавшиеся тотальным подсчётом числа и биомассы видов, были проведены более 30 лет назад с целью поиска промысловых запасов рыб (Борец, 1985, 1990; Шунтов и др., 1990). Опубликованные результаты этих траловых съёмок на сегодняшний день так и остаются одним из немногих источников, в которых представлены обобщённые фактические данные о видовом составе донных шельфовых рыб в этом районе (Борец, 1990, 1997). Позднее накопленная информация о рыбах северной части Охотского моря была представлена в виде каталогов (Черешнев и др., 2001; Фёдоров и др., 2003; Воскобойникова и др., 2012), в которых в полной мере невозможно было показать распределение ихтиофауны на шельфе. В других публикациях, освещающих преимущественно запасы рыб дальневосточных морей, множество непромысловых видов рассмотрены в лучшем случае на уровне семейств или же фигурируют в категории прочие. Преимущественно это касается слабо изученных Zoarcidae и Liparidae, преобладающих (после Cottidae) по числу видов и численности в уловах на шельфе Охотского моря (Борец, 1997; Фёдоров и др., 2003; Шунтов, Волвенко, 2016а, 2016б).
Цель данной работы – описать видовой состав и пространственное распределение рыб в элиторали и прилегающей части материкового склона в северо-западной части Охотского моря в летний период 2013 г.
МАТЕРИАЛ И МЕТОДИКА
В основу работы положены материалы, собранные авторами в период гидрологического лета 02.08−27.09.2013 г. в северо-западной части Охотского моря между 142°52′ и 152°50′ в.д. По месту проведения работ траловая съёмка частично совпадает со съёмкой 1988 г. (Борец, 1990), а по срокам проведения полностью ей соответствует, что позволяет сопоставить эти материалы. Выполнено 110 донных тралений в диапазоне глубин 81–301 м, из которых 85 – на шельфе (80–200 м). Траления проводили со средней скоростью 3.0 узла тралом ТД 27.1/24.4, вооружённым мягким грунтропом и мелкоячейной вставкой в кутце (10 мм). Плавучесть верхней подборы обеспечивалась кухтылями. Продолжительность большинства тралений составляла 30 мин, за исключением нескольких, прерванных аварийной остановкой. Улов разбирали по видам. Все виды рыб пересчитывали поштучно и взвешивали. Представителей семейств Stichaeidae, Zoarcidae, Agonidae, Cottidae, Liparidae, Cyclopteridae и Psychrolutidae фиксировали в 10%-ном формалине11.
При расчётах не учитывали пелагические виды, а также минтай Theragra chalcogramma, присутствовавший в массе практически во всех уловах. Группировка рыб по ихтиоценам вертикальной зональности и зоогеографической характеристике принята по Шейко и Фёдорову (2000). Изменение состава фауны оценивается как доля (в %) суммы исчезающих и впервые появляющихся на данной глубине видов от общего числа видов, пойманных на этой глубине. Кластерный анализ проведён в программе Statistica 7.0 методом Уорда с использованием Евклидовой метрики в качестве расстояния. Группировка тралений указанным методом проведена по данным об уловах рыб (экз/ч траления), выровненным путём логарифмирования значений. Биомасса рыб на единицу обловленной площади (т/км2) рассчитана по общепринятой методике для каждой траловой станции (Волвенко, 2001). Для мелких видов непромысловых рыб, а также Gadus macrocephalus, Limanda sakhalinensis, Hippoglossus stenolepis и Reinhardtius hippoglossoides принят коэффициент уловистости 0.3, для остальных – 0.5 (Борец, 1985). Часть тралений проведена за пределами шельфа, однако в целях определения качественного и количественного изменения в батиметрическом распределении ихтиофауны и поиска границы перехода между ихтиоценами рассмотрен весь диапазон исследованных глубин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В период траловой съёмки зарегистрировано 69 видов донных рыб, в том числе на шельфе 54 вида из 11 семейств (табл. 1). Основу фауны составляли Zoarcidae (19), Liparidae (17), Cottidae (7), Pleuronectidae (7) и Cyclopteridae (5). По сравнению с траловой съёмкой 1988 г. (Борец, 1990) за счёт лучшей в настоящее время разработанности некоторых групп уточнён и дополнен список наиболее сложных в таксономическом отношении Zoarcidae и Liparidae. По обоим семействам наши данные сильно расходятся с опубликованными как в отношении числа видов, которых оказалось больше почти в два раза, так и по степени совпадения таксономических списков. На основании расчётов частоты встречаемости в уловах ряд малоизученных редких видов следует рассматривать как обычные или многочисленные – Artediellus aporosus, Artediellina antilope, Icelus armatus, Psychrolutes pustulosus, Eumicrotremus schmidti, E. derjugini, Careproctus furcellus, Bothrocarina nigrocaudata, Gymnelopsis brevifenestrata, G. ochotensis, Lycodes jenseni, L. macrochir, L. usсhakovi, Lycozoarces regani. Это несоответствие отражает неполноту современных представлений о непромысловых составляющих охотоморской ихтиофауны и убеждает в необходимости дифференцированной оценки обилия видов именно в тех диапазонах глубин или ихтиоценах и районах, для которых они наиболее характерны.
Таблица 1.
Видовой состав и частота встречаемости донных рыб на шельфе северо-западной части Охотского моря на глубинах 80–300 м в августе–сентябре 2013 г.
| № | Наименование таксона | ЗГ* | ЭГ* | Обилие* | Глубина лова, м | Частота встречаемости, % | ||
|---|---|---|---|---|---|---|---|---|
| 80–200 м | 201–300 м | 80–300 м | ||||||
| I | Семейство Rajidae | |||||||
| 1 | Bathyraja parmifera (Bean, 1881) | шбт | мб (20–1425) | м | 114–294 | 10.7 | 37.5 | 16.7 |
| 2 | B. violacea (Suvorov, 1935) | шбп | мб (20–1110) | м | 78–158 | 17.9 | 12.5 | 16.7 |
| II | Семейство Gadidae | |||||||
| 3 | Gadus macrocephalus Tilesius, 1810 | пбт | э (0–1280) | м | 118–285 | 4.8 | 4.2 | 4.6 |
| III | Семейство Cottidae | |||||||
| 4 | Artediellus aporosus Soldatov, 1922 | шбп | э (50–200) | р | 116–158 | 32.1 | – | 25.0 |
| 5 | A. antilope (Schmidt, 1937) | вбп | мб (300–615) | р | 241–301 | – | 45.8 | 10.2 |
| 6 | Hemilepidotus papilio (Bean, 1880) | пбт | э (0–320) | м | 112–163 | 61.9 | 45.8 | 58.3 |
| 7 | Icelus armatus (Schmidt, 1916) | вбп | мб (70–900) | р | 148–301 | 6.0 | 66.7 | 19.4 |
| 8 | I. spatula Gilbert et Burke, 1912 | аб | э (12–365) | м | 114–232 | 26.2 | 8.3 | 22.2 |
| 9 | I. spiniger Gilbert, 1896 | вбт | э (31–770) | м | 116–220 | 32.1 | 12.5 | 27.8 |
| 10 | Triglops pingelii Reinhardt, 1837 | аб | эмб (5–745) | м | 82–137 | 2.4 | – | 1.9 |
| IV | Семейство Hemitripteridae | |||||||
| 11 | Blepsias bilobus Cuvier, 1829 | пбт | э (0–250) | м | 85–285 | 1.2 | 20.8 | 5.6 |
| V | Семейство Psychrolutidae | |||||||
| 12 | Dasycottus setiger Bean, 1890 | шбт | мб (15–850) | м | 126–301 | 2.4 | 66.7 | 16.7 |
| 13 | Malacocottus zonurus Bean, 1890 | шбп | мб (27–1980) | м | 214–301 | – | 79.2 | 17.6 |
| 14 | Psychrolutes pustulosus (Schmidt, 1937) | шбп | мб (126–700) | р | 241–294 | – | 20.8 | 4.6 |
| VI | Семейство Agonidae | |||||||
| 15 | Aspidophoroides bartoni Gilbert, 1896 | пбп | э (0–500) | м | 112–158 | 26.2 | – | 20.4 |
| 16 | Percis japonicus (Pallas, 1769) | шбп | э (19–750) | м | 119–301 | 1.2 | 45.8 | 11.1 |
| 17 | Sarritor frenatus (Gilbert, 1896) | шбт | э (14–775) | м | 114–285 | 35.7 | 8.3 | 29.6 |
| VII | Семейство Cyclopteridae | |||||||
| 18 | Aptocyclus ventricosus (Pallas, 1769) | шбт | н (0–1700) | м | 80–272 | 1.2 | 12.5 | 3.7 |
| 19 | Cyclopteropsis bergi Popov, 1929 | вбп | э (82–200) | р | 117–145 | 9.5 | – | 7.4 |
| 20 | Eumicrotremus derjugini Popov, 1926 | аб | э (20–198) | р | 114–192 | 42.9 | – | 33.3 |
| 21 | E. schmidti Lindberg et Legeza, 1955 | вбп | э (20–143) | р | 97–148 | 20.2 | – | 15.7 |
| 22 | E. soldatovi Popov, 1930 | вбп | н (10–350) | м | 85–197 | 63.1 | – | 49.1 |
| VIII | Семейство Liparidae | |||||||
| 23 | Careproctus colletti Gilbert, 1896 | шбп | мб (64–1350) | м | 220–283 | – | 20.8 | 4.6 |
| 24 | C. furcellus Gilbert et Burke, 1912 | шбп | мб (338–950) | р | 154–255 | 1.2 | 33.3 | 8.3 |
| 25 | C. macrodiscus Schmidt, 1950 | шбп | мб (130–780) | м | 157–301 | 6.0 | 70.8 | 20.4 |
| 26 | C. rastrinus Gilbert et Burke, 1912 | шбп | мб (55–913) | м | 116–301 | 42.9 | 83.3 | 51.9 |
| 27 | C. cf. rastrinus Gilbert et Burke, 1912 | н/д | н/д | н/д | 256–283 | – | 20.8 | 4.6 |
| 28 | C. roseofuscus Gilbert et Burke, 1912 | шбп | мб (72–1950) | м | 119–301 | – | 8.4 | 1.9 |
| 29 | C. cf. seraphimae Schmidt, 1950 | вбп | мб (355) | р | 272–301 | – | 2.4 | 1.9 |
| 30 | C. simus Gilbert, 1896 | вбп | мб (380–725) | р | 281–294 | – | 8.3 | 1.9 |
| 31 | Careproctus sp. 1 | н/д | н/д | н/д | 182–214 | 1.2 | 4.2 | 1.9 |
| 32 | Careproctus sp. 2 | н/д | н/д | н/д | 232 | – | 4.2 | 0.9 |
| 33 | Crystallichthys mirabilis Jordan et Gilbert, 1898 | вбп | мб (53–830) | м | 116–158 | 8.3 | – | 6.5 |
| 34 | Elassodiscus cf. obscurus Pitruk et Fedorov, 1993 | шбп | мб (161–1773) | н/д | 175–294 | 1.2 | 12.5 | 3.7 |
| 35 | E. tremebundus Gilbert et Burke, 1912 | шбп | мб (130–1800) | м | 272–301 | – | 20.8 | 4.6 |
| 36 | Liparis latifrons Schmidt, 1950 | шбп | э (0–360) | м | 82–175 | 21.4 | – | 16.7 |
| 37 | L. marmoratus Schmidt, 1950 | вбп | э (96–165) | р | 132–160 | 4.8 | – | 3.7 |
| 38 | L. ochotensis Schmidt, 1904 | шбп | э (0–761) | м | 112–272 | 61.9 | 4.2 | 49.1 |
| 39 | Squaloliparis dentatus (Kido, 1988) | шбп | мб (120–890) | м | 214–283 | – | 20.8 | 4.6 |
| IX | Семейство Zoarcidae | |||||||
| 40 | Bothrocara hollandi (Jordan et Hubbs, 1925) | шбп | мб (140–1950) | м | 154–301 | 2.4 | 45.8 | 12.0 |
| 41 | Bothrocarina microcephala Schmidt, 1938 | шбп | мбб (0–1950) | м | 120–301 | 22.6 | 79.2 | 35.2 |
| 42 | B. nigrocaudata (Suvorov, 1935) | шбп | эмбп (90–881) | р | 227–292 | – | 12.5 | 2.8 |
| 43 | Gymnelopsis brevifenistrata Anderson, 1982 | вбп | э (76–200) | р | 97–150 | 32.1 | – | 25.0 |
| 44 | G. humilis Nazarkin et Chernova, 2003 | вбп | э (153) | р | 126–156 | 10.7 | – | 8.3 |
| 45 | G. ochotensis Popov, 1931 | шбп | эмб (85–780) | р | 116–301 | 2.4 | 41.7 | 11.1 |
| 46 | Lycodes brashnikovi Soldatov, 1918 | шбп | эмб (25–340) | м | 119–290 | 3.6 | 16.7 | 6.5 |
| 47 | L. brevicauda Taranetz et Andriashev, 1935 | вбп | сэмб (10–400) | м | 112–290 | 65.5 | 20.8 | 55.6 |
| 48 | L. jenseni Taranetz et Andriashev, 1935 | вбп | э (126–150) | р | 118–218 | 26.2 | 4.2 | 21.3 |
| 49 | L. macrochir Schmidt in Andriashev, 1937 | вбп | эмб (105–400) | р | 126–301 | 14.3 | 83.3 | 29.6 |
| 50 | L. macrolepis Taranetz et Andriashev, 1935 | шбп | эмб (95–308) | о | 117–156 | 15.5 | – | 12.0 |
| 51 | L. microlepidotus Schmidt, 1950 | вбп | э (100–396) | р | 150–220 | 3.5 | 8.3 | 4.6 |
| 52 | L. pectoralis Toyoshima, 1985 | вбп | мб (143–517) | м | 241–301 | – | 75.0 | 16.7 |
| 53 | L. raridens Taranetz et Andriashev, 1937 | пбп | сэмб (10–400) | о | 116 | 1.2 | – | 0.9 |
| 54 | L. soldatovi Taranetz et Andriashev, 1935 | шбп | эмб (153–1030) | м | 300 | – | 4.2 | 0.9 |
| 55 | L. uschakovi Popov, 1931 | шбп | э (78–270) | р | 112–197 | 60.7 | – | 47.2 |
| 56 | Lycogrammoides schmidti Soldatov et Lindberg, 1928 | шбп | эмбп (30–1440) | м | 227–301 | – | 50.0 | 11.1 |
| 57 | Lycozoarces regani Popov, 1933 | шбп | эмб (50–300) | р | 112–241 | 16.7 | 4.2 | 13.9 |
| 58 | Petroschmidtia albonotata Taranetz et Andrijashev, 1934 | шбп | мб (150–930) | о | 175–290 | 1.2 | 66.7 | 15.7 |
| X | Семейство Stichaeidae | |||||||
| 59 | Anisarchus medius (Reinhardt, 1837) | аб | э (10–300) | м | 114–160 | 20.2 | – | 15.7 |
| 60 | Eumesogrammus praecisus (Kroer, 1837) | аб | э (5–240) | о | 116–290 | 8.3 | 4.2 | 7.4 |
| 61 | Leptoclinus maculatus (Schmidt, 1904) | шбт | э (6–245) | о | 97–163 | 59.5 | 4.2 | 47.2 |
| 62 | Lumpennela longirostris (Everman et Goldsboroug, 1907) | ат | мб (25–1140) | о | 119–301 | 2.4 | 37.5 | 10.2 |
| XI | Семейство Pleuronectidae | |||||||
| 63 | Glyptocephalus stelleri (Schmidt, 1904) | шбп | эмб (8–1600) | м | 228–290 | – | 12.5 | 2.8 |
| 64 | Hippoglossoides robustus Gill et Townsend, 1897 | пб | эмб (0–425) | м | 82–301 | 92.9 | 83.3 | 90.7 |
| 65 | Hippoglossus stenolepis Schmidt, 1904 | пба | эмб (0–1200) | м | 137 | 1.2 | – | 0.9 |
| 66 | Limanda aspera (Pallas, 1815) | пбт | эмб (0–700) | м | 97–116 | 7.1 | – | 5.6 |
| 67 | L. sakhalinensis Hubbs, 1915 | пба | эмб (10–360) | м | 82–160 | 70.2 | 4.2 | 55.6 |
| 68 | Pleuronectes quadrituberculatus Pallas, 1814 | пба | эмб (0–600) | м | 116–134 | 3.6 | – | 2.8 |
| 69 | Reinhardtius hippoglossoides Jordan et Snyder, 1901 | пба | эмб (10–2000) | м | 116–301 | 7.1 | 70.8 | 21.3 |
Примечание. ЗГ – зоогеографическая группировка вида: аб – арктическо-бореальный, ат – атланто-тихоокеанский, вбп – высокобореальный приазиатский, вбт – высокобореальный тихоокеанский, пб – преимущественно бореальный, пба – преимущественно бореальный тихоокеанский, пбп – преимущественно бореальный приазиатский, пбт – преимущественно бореальный тихоокеанский, шбп – широкобореальный приазиатский, шбт – широкобореальный тихоокеанский. ЭГ – экологические группировки (ихтиоцены вертикальной зональности, в скобках − известная глубина обитания, м): мб – мезобентальный, мбб – мезобатибентальный, э – элиторальный, н – неритический, сэмб – сублитоэлитомезобентальный, эмб – элитомезобентальный, эмбп – элитомезобентопелагический. Обилие: р – редкий, о – обычный, м – многочисленный, н/д – нет данных, “–” – вид отсутствует на данной глубине; * по данным: Фёдоров и др., 2003.
Ряд видов, отмеченных ранее в исследованном районе, в наших уловах не встречались, что может быть обусловлено отсутствием тралений на глубинах <80 м (в предшествовавшей съёмке работы велись с глубины 20 м). Отсутствие в уловах некоторых представителей Arhynchobatidae, Cottidae и Agonidae, отмеченных Борцом (1990) в нижней части шельфа (Myoxocephalus, Gymnocanthus) и верхней части материкового склона (Bathyraja aleutica, Enophrys diceraus, Triglops scepticus, Podothecus veternus), вероятно, объясняется межгодовыми различиями в распространении этих видов в зависимости от степени развития холодного промежуточного слоя. Шунтов (1965) отмечает исчезновение в верхней батиали и прилегающем мелководье северной части Охотского моря сравнительно теплолюбивых P. sturioides, Hemilepidotus gilberti, Eumicrotremus asperrimus и Myoxocephalus polyacanthocephalus, замещающихся холодолюбивыми видами. Этот вывод в целом справедлив в отношении Myoxocephalus и Gymnocanthus, которые в северо-западной части Охотского моря в связи с особенностями гидрологического режима вынуждены прижиматься к берегу и присутствуют здесь преимущественно в сублиторали (Борец, 1997; Иванов, 2002).
Основу биомассы донных ихтиоценов на исследованной акватории летом 2013 г. составляли Hippoglossoides robustus (24.6%), Bathyraja parmifera (10.9%), Lycodes brevicauda (9.3%), Limanda sakhalinensis (9.0%), Pleuronectes quadrituberculatus (6.5%), E. soldatovi (4.3%), Hemilepidotus papilio (4.1%), Liparis okhotensis (4.0%), B. violacea (3.9%). Для остальных видов доля по биомассе составляла не более 2.6%, причём для подавляющего большинства (41 вид) не превышала 0.5% (в том числе G. macrocephalus − <0.1%). Треска, довольно многочисленная в этом районе в конце 1980-х гг. (Борец, 1990), в траловых уловах летом 2013 г. встречалась очень редко (4.6%). Такой состав и соотношение доминирующих видов отличаются от обозначенных ранее (Борец, 1990), когда основная биомасса приходилась на G. macrocephalus (19.6%), L. sakhalinensis (12.0%), H. robustus (10.3%), E. soldatovi (9.5%) и молодь Reinhardtius hippoglossoides (6.2%), что не удивительно, учитывая высокую численность трески во всех районах Тихого океана в 1980-е гг. (Шунтов и др., 1990) и, вероятно, уже неоднократно произошедшее изменение в соотношении обилия других видов.
Величина уловов (а), видовое богатство (б) и зональность в распределении донных рыб
(в) на шельфе северо-западной части Охотского моря в августе–сентябре 2013 г.: (—)
– изотермы, (- - -) − изобаты 100 и 200 м; выделенные зоны: (◼) – I, (◻) – II, ( ) – III.
) – III.
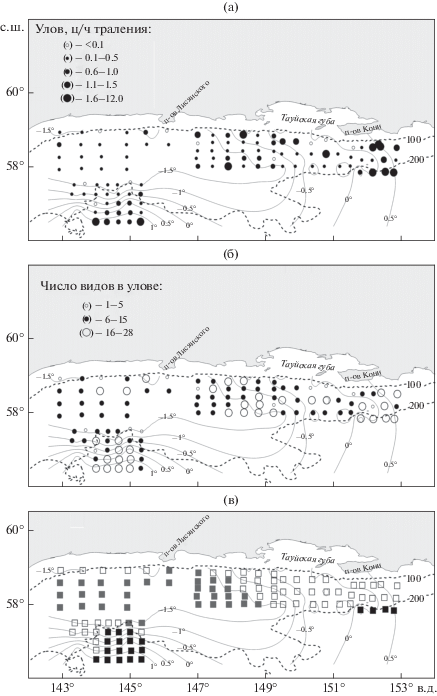
Как и предшествовавшие экспедиции (Борец, 1985, 1990; Иванов, 2002), мы не обнаружили значительных промысловых запасов донных рыб на исследованной акватории. В период проведения траловой съёмки большая часть шельфа была занята водами с отрицательными значениями температуры, повлиявшими на распределение уловов рыб, большая часть которых (66%) оказалась незначительной и не превышала 0.5 ц/ч траления при среднем значении для всего исследованного района ~0.72 ц/ч траления (рисунок, а). Наибольшие уловы получены на шельфе Притауйского района и на материковом склоне к северу от о-ва Ионы. Плотность распределения рыб в среднем по району составляла 1.73 т/км2 при максимальном значении 2.16 т/км2 в Притауйском районе к востоку от 147° в.д., что приближается к ранее сделанной оценке 1.84 т/км2 (Борец, 1990).
Неравномерность распределения видового богатства на обследованной акватории в значительной степени была связана с температурой (рисунок, б). В уловах тралений, выполненных в наиболее холодной северо-западной части Охотского моря, в среднем отмечено меньше видов. Кластерный анализ видового состава и численности рыб в уловах позволяет выделить три зоны (рисунок, в; табл. 2)22. Первая включает материковый склон в Притауйском районе и область к северу от о-ва Ионы с температурой преимущественно выше 0°С и глубинами 215–301 м. Высокой частоты встречаемости и численности здесь в уловах достигали рыбы материкового склона, численность которых повышалась с увеличением глубины обитания и температуры: Aptocyclus ventricosus, Artediellina antilope, Bothrocara hollandi, Bothrocarina nigrocaudata, Careproctus colletti, C. macrodiscus, C. furcellus, C. rastrinus, C. roseofuscus, C. cf. seraphimae, Dasycottus setiger, Elassodiscus sp., E. tremebundus, Glyptocephalus stelleri, Gymnelopsis ochotensis, Icelus armatus, Lumpenella longirostris, Lycodes brashnikovi, L. macrochir, L. pectoralis, L. soldatovi, Lycogrammoides schmidti, Malacocottus zonurus, Percis japonicus, Petroschmidtia albonotata, Psychrolutes pustulosus, Reinhardtius hippoglossoides, Squaloliparis dentatus. Вторая охватывает шельф Притауйского района и западную часть района исследований вокруг холодовой линзы с температурой в основном от –1 до +1°С и глубинами 81–214 м. В уловах здесь численно преобладали виды, встречающиеся как на шельфе, так и в верхней части материкового склона в области околонулевых значений температуры: Anisarchus medius, Artediellus aporosus, Aspidophoroides bartoni, Bathyraja parmifera, B. violacea, Blepsias bilobus, Bothrocarina microcephala, Crystallichthys mirabilis, Eumesogrammus praecisus, G. macrocephalus, Hippoglossus stenolepis, I. spatula, I. spiniger, Leptoclinus maculatus, Limanda aspera, Liparis jenseni, L. raridens, Pleuronectes quadrituberculatus, Sarritor frenatus, Triglops pingeli. Они проникают и в наиболее холодную часть шельфа, но далеко вглубь не заходят и в уловах при температуре ниже –0.5°С малочисленны. В пределах третьей зоны находится шельф западной части обследованного района, который характеризуется наибольшими отрицательными значениями температуры от –1.0 до –1.8°С, с глубинами 114–174 м (ядро холода33). По численности и биомассе здесь преобладали Cyclopteropsis bergi, Eumicrotremus derjugini, E. schmidti, E. soldatovi, G. brevifenestrata, G. humilis, L. sakhalinensis, Liparis latifrons, L. ochotensis, L. marmoratus, L. macrolepis, L. uschakovi, Lycozoarces regani, составляющие охотоморский гляциальный фаунистический комплекс. Обращает на себя внимание присутствие только в этом районе шельфа морских слизней рода Liparis и отсутствие Careproctus. Температурный режим в области обитания этих рыб в полной мере соответствует районам Арктики, лишённым какого бы то ни было прогревания, при температуре, держащейся в течение круглого года ниже –1°С, и заселённым высокоарктической фауной (Зенкевич, 1951). H. robustus, H. papilio и L. brevicauda трудно отнести к любой из групп, поскольку они встречались по всему исследованному району в широком диапазоне температуры. При удалении от материкового склона (зона I) в область холодовой линзы (зона III) доля Liparidae уменьшалась, а Zoarcidae и Cyclopteridae – увеличивалась (табл. 2). При исследовании температурных границ распространения видов, вблизи которых они перестают встречаться, был ранжирован диапазон от –1.5 до +1.0°С с интервалом 0.5°C, которому соответствует ряд значений числа видов 4, 13, 16, 19, 1 и 1 (всего 54 вида, за исключением встреченных единично и эвритермных). В области изотермы –1°С, внешне оконтуривающей ядро холода холодного промежуточного слоя (Фигуркин, 2011), резко возрастает число шельфовых видов, для которых она является ключевой границей распространения, а изотерма 0°С определяет область обитания рыб батиали. Траления в диапазоне –1 … 0°С оказались переходными от одной группы к другой, но благодаря преобладанию в них определённых компонентов фауны были классифицированы наравне с остальными.
Таблица 2.
Зональное распределение донных видов рыб разных экологических групп и семейств на шельфе северо-западной части Охотского моря в августе–сентябре 2013 г. , % общего числа видов
| Группа видов | Зона | ||
|---|---|---|---|
| I | II | III | |
| Ихтиоцен: | |||
| – элиторальный | 22.0 | 40.4 | 47.4 |
| – элитомезобентальный | 26.8 | 23.2 | 26.3 |
| – сублитоэлитомезобентальный | 2.4 | 3.8 | 5.3 |
| – мезобентальный | 46.4 | 28.8 | 18.4 |
| – неритический | 2.4 | 3.8 | 2.6 |
| Семейство | |||
| – Arhynchobatidae | 4.9 | 3.8 | 5.3 |
| – Gadidae | 2.4 | 1.9 | 2.6 |
| – Cottidae | 14.6 | 9.6 | 10.5 |
| – Hemitripteridae | 2.4 | 1.9 | 2.6 |
| – Psychrolutidae | 4.9 | 3.8 | 0.0 |
| – Agonidae | 2.4 | 5.8 | 2.6 |
| – Cyclopteridae | 2.4 | 9.6 | 10.5 |
| – Liparidae | 26.8 | 15.4 | 13.2 |
| – Zoarcidae | 27.0 | 30.9 | 39.5 |
| – Stichaeidae | 2.4 | 7.7 | 5.3 |
| – Pleuronectidae | 9.8 | 9.6 | 7.9 |
| Всего видов | 41 | 52 | 38 |
Величина траловых уловов и их видовой состав варьируют в зависимости от глубины лова вследствие вертикальной зональности (Борец, 1990). Шунтов (1965, 1971) по составу ихтиофауны указывает для северной части Охотского моря достаточно широкую область перехода между шельфом и материковым склоном на глубинах 200–350 м. Борец (1990, 1997) нижнюю границу распространения шельфовых ихтиоценов в северной части Охотского моря проводит по изобате 200 м; по его данным, в диапазоне 200–250 м плотность распределения донных рыб снижается, соотношение шельфовых и батиальных видов по численности выравнивается, по биомассе основу уловов слагают батиальные виды, а глубже преобладание последних лишь усиливается.
Из 54 видов, встреченных в летний период 2013 г. в траловых уловах на шельфе северо-западной части Охотского моря в диапазоне глубин 80–200 м, к элиторальному ихтиоцену относится 53.7% видов, к мезобентальному − 29.6%, элитомезобентальному − 11.1%, сублитоэлитомезобентальному − 3.7%. В диапазоне глубин 80–150 м по частоте встречаемости и биомассе в уловах преобладали виды элиторального ихтиоцена (табл. 3, 4). В нижней части шельфа (150–200 м) происходит первый скачок в изменении состава ихтиофауны, связанный с исчезновением восьми шельфовых и появлением семи батиальных видов. Процесс смены фауны становится ещё более ярко выраженным на глубинах 200–250 м, где доля изменения облика ихтиофауны составляла 52.5%: исчезли 11 шельфовых и впервые появились девять мезобентальных видов. Таким образом, диапазон глубин 150–250 м заселён экотонным сообществом, где наблюдается резкий переход от шельфовых ихтиоценов к батиальным. Вследствие изменения структуры ихтиоценов подавляющее большинство видов имеют здесь низкую биомассу и частоту встречаемости (табл. 3). Вероятно, в этом переходном диапазоне глубин отсутствуют благоприятные условия для формирования высокой численности одновременно представителей как нижнешельфового, так и верхнебатиального ихтиоценов, поскольку высока вероятность формирования межвидовой конкуренции вследствие совместного обитания видов, занимающих сходные экологические ниши каждый в своём ихтиоцене. В связи с периодической адвекцией тихоокеанских вод гидрологический режим на этих глубинах нестабилен, что вынуждает представителей обеих экологических группировок перемещаться вследствие изменяющихся абиотических условий. Глубже 250 м изменение состава фауны происходит преимущественно за счёт дальнейшего исчезновения шельфовых (семь) и незначительного числа появляющихся батиальных (три) видов, преобладание которых становится ещё более очевидным.
Таблица 3.
Батиметрическое распределение донных видов рыб на шельфе северо-западной части Охотского моря в августе–сентябре 2013 г.
| Вид | Диапазон глубин, м | ||||
|---|---|---|---|---|---|
| 80−100 | 101−150 | 151−200 | 201−250 | 251−300 | |
| Limanda aspera | 70.0/69.8 | 30.0/30.2 | –/– | –/– | –/– |
| Eumicrotremus schmidti | 5.6/5.6 | 94.4/94.4 | –/– | –/– | –/– |
| Gymnelopsis brevifenestrata | 3.7/1.7 | 96.3/98.3 | –/– | –/– | –/– |
| Triglops pingelii | 50.0/94.5 | 50.0/5.5 | –/– | –/– | –/– |
| Lycodes raridens | –/– | 100/100 | –/– | –/– | –/– |
| Cyclopteropsis bergi | –/– | 100/100 | –/– | –/– | –/– |
| Hippoglossus stenolepis | –/– | 100/100 | –/– | –/– | –/– |
| Pleuronectes quadrituberculatus | –/– | 100/100 | –/– | –/– | –/– |
| Liparis latifrons | 11.1/10.6 | 72.2/75.8 | 16.7/13.6 | –/– | –/– |
| Eumicrotremus derjugini | –/– | 91.7/98.1 | 8.3/1.9 | –/– | –/– |
| Eumicrotremus soldatovi | –/– | 71.7/89.0 | 28.3/11.0 | –/– | –/– |
| Aspidophoroides bartoni | –/– | 86.4/96.3 | 13.6/3.7 | –/– | –/– |
| Gymnelopsis humilis | –/– | 88.9/97.5 | 11.1/2.5 | –/– | –/– |
| Lycodes macrolepis | –/– | 92.3/98.6 | 7.7/1.4 | –/– | –/– |
| Artediellus aporosus | –/– | 88.9/96.8 | 11.1/3.2 | –/– | –/– |
| Crystallichthys mirabilis | –/– | 71.4/99.2 | 28.6/0.8 | –/– | –/– |
| Anisarchus medius | –/– | 70.6/96.2 | 29.4/3.8 | –/– | –/– |
| Lycodes uschakovi | –/– | 84.3/94.0 | 15.7/6.0 | –/– | –/– |
| Liparis marmoratus | –/– | 50.0/77.8 | 50.0/22.2 | –/– | –/– |
| Leptoclinus maculatus | 2.0/0.2 | 80.3/88.9 | 15.7/9.9 | 2.0/1.0 | –/– |
| Limanda sakhalinensis | 3.3/3.2 | 80.0/84.5 | 15.0/12.0 | 1.7/0.3 | –/– |
| Icelus spiniger | –/– | 53.3/73.4 | 36.7/24.0 | 10.0/2.6 | –/– |
| Icelus spatula | –/– | 91.7/96.1 | –/– | 8.3/3.9 | –/– |
| Lycodes jenseni | –/– | 78.3/82.0 | 17.4/17.3 | 4.3/0.7 | –/– |
| Lycozoarces regani | –/– | 86.7/88.0 | 6.6/9.4 | 6.7/2.6 | –/– |
| Lycodes microlepidotus | –/– | 40.0/32.8 | –/– | 60.0/67.2 | –/– |
| Hippoglossoides robustus | 2.0/0.3 | 58.2/84.2 | 19.4/4.3 | 9.2/4.8 | 11.2/6.4 |
| Liparis ochotensis | –/– | 83.0/89.3 | 15.1/4.2 | –/– | 1.9/6.5 |
| Eumesogrammus praecisus | –/– | 75.0/92.6 | 12.5/3.3 | –/– | 12.5/4.1 |
| Gadus macrocephalus | –/– | 60.0/79.5 | 20.0/19.9 | –/– | 20.0/0.6 |
| Bathyraja parmifera | –/– | 44.4/27.0 | 5.6/0.2 | 11.1/3.5 | 38.9/69.3 |
| Hemilepidotus papilio | –/– | 68.3/87.7 | 14.3/7.1 | 4.8/0.8 | 12.6/4.4 |
| Lycodes brevicauda | –/– | 78.3/82.7 | 13.4/5.2 | 3.3/3.5 | 5.0/8.6 |
| Bathyraja violacea | –/– | 55.6/40.3 | 27.8/19.8 | 11.1/23.6 | 5.5/16.3 |
| Sarritor frenatus | –/– | 68.8/89.7 | 25.0/8.3 | 3.1/1.5 | 3.1/0.5 |
| Careproctus rastrinus | –/– | 41.1/51.7 | 23.2/10.8 | 12.5/9.2 | 23.2/28.3 |
| Aptocyclus ventricosus | –/– | 25.0/12.7 | –/– | 25.0/6.0 | 50.0/81.3 |
| Careproctus roseofuscus | –/– | 22.2/22.7 | –/– | –/– | 77.8/77.3 |
| Bothrocarina microcephala | –/– | 34.2/31.2 | 15.8/10.4 | 21.1/27.4 | 28.9/31.0 |
| Lycodes brashnikovi | –/– | 14.2/28.3 | 28.6/6.8 | 28.6/30.9 | 28.6/34.0 |
| Blepsias bilobus | –/– | 16.7/17.0 | –/– | 66.7/69.4 | 16.6/13.6 |
| Gymnelopsis ochotensis | –/– | 16.7/16.8 | –/– | 33.3/29.7 | 50.0/53.5 |
| Lycodes macrochir | –/– | 6.3/6.4 | 31.2/25.3 | 25.0/35.5 | 37.5/32.8 |
| Reinhardtius hippoglossoides | –/– | 13.0/35.0 | 13.0/3.3 | 30.5/24.0 | 43.5/37.7 |
| Percis japonicus | –/– | 8.3/1.0 | –/– | 33.4/76.4 | 58.3/22.6 |
| Lumpenella longirostris | –/– | 9.1/1.8 | 9.1/0.6 | 27.3/66.2 | 54.5/31.4 |
| Icelus armatus | –/– | 4.8/1.3 | 19.0/6.3 | 19.0/18.2 | 57.2/74.2 |
| Bothrocara hollandi | –/– | –/– | 15.4/0.6 | 23.1/43.6 | 61.5/55.8 |
| Careproctus macrodiscus | –/– | –/– | 22.7/13.8 | 31.8/53.8 | 45.5/32.4 |
| Elassodiscus sp. | –/– | –/– | 25.0/56.8 | –/– | 75.0/43.2 |
| Careproctus furcellus | –/– | –/– | 11.1/14.0 | 44.4/61.1 | 44.5/24.9 |
| Dasycottus setiger | –/– | –/– | 11.1/4.4 | 33.3/16.6 | 55.6/79.0 |
| Petroschmidtia albonotata | –/– | –/– | 5.9/1.6 | 41.2/76.1 | 52.9/22.3 |
| Careproctus sp.1 | –/– | –/– | 50.0/65.2 | 50.0/34.8 | –/– |
| Lycodes pectoralis | –/– | –/– | –/– | 22.2/47.7 | 77.8/52.3 |
| Careproctus sp.2 | –/– | –/– | –/– | 100/100 | –/– |
| Squaloliparis dentatus | –/– | –/– | –/– | 33.3/57.8 | 66.7/42.2 |
| Glyptocephalus stelleri | –/– | –/– | –/– | 33.3/85.2 | 66.7/14.8 |
| Malacocottus zonurus | –/– | –/– | –/– | 36.8/9.6 | 63.2/90.4 |
| Lycogrammoides schmidti | –/– | –/– | –/– | 25.0/13.5 | 75.0/86.5 |
| Bothrocarina nigrocaudata | –/– | –/– | –/– | 33.3/26.2 | 66.7/73.8 |
| Artediellina antilope | –/– | –/– | –/– | 9.1/10.9 | 90.9/89.1 |
| Psychrolutes pustulosus | –/– | –/– | –/– | 20.0/31.4 | 80.0/68.6 |
| Careproctus colletti | –/– | –/– | –/– | 20.0/11.8 | 80.0/88.2 |
| Careproctus cf. seraphimae | –/– | –/– | –/– | –/– | 100/100 |
| Elassodiscus tremebundus | –/– | –/– | –/– | –/– | 100/100 |
| Lycodes soldatovi | –/– | –/– | –/– | –/– | 100/100 |
Таблица 4.
Вертикальная зональность в распределении рыб на шельфе северо-западной части Охотского моря в августе–сентябре 2013 г.
| Показатель | Диапазон глубин, м | ||||
|---|---|---|---|---|---|
| 80−100 | 101−150 | 151−200 | 201−250 | 251−300 | |
| Ихтиоцен: | |||||
| – элиторальный | 87.5/82.9 | 61.7/44.0 | 48.7/41.3 | 27.5/6.7 | 17.9/3.2 |
| – элитомезобентальный | 12.5/17.1 | 12.8/32.7 | 10.3/25.0 | 12.5/28.4 | 12.8/13.0 |
| – сублитоэлитомезобентальный | –/– | 4.3/12.3 | 2.6/7.6 | 2.5/3.3 | 2.6/4.2 |
| – мезобентальный | –/– | 19.1/11.0 | 38.5/26.0 | 55.0/61.5 | 64.1/79.0 |
| – неритический | –/– | 2.1/<0.1 | –/– | 2.5/0.1 | 2.6/0.7 |
| Число видов: | |||||
| – общее | 8 | 47 | 39 | 40 | 39 |
| – впервые появляющихся на данной глубине | – | 39 | 7 | 10 | 7 |
| – исчезающих на данной глубине | – | 0 | 8 | 11 | 3 |
| Изменение состава фауны, % | – | 83.0 | 38.5 | 52.5 | 25.6 |
| Число тралений | 2 | 59 | 22 | 9 | 14 |
Судя по распределению уловов донных рыб, в летний период в северо-западной части Охотского моря нижнюю границу распространения большинства шельфовых видов можно провести по изобате 200 м, что соответствует общепринятой нижней границе шельфа в схеме вертикальной зональности морской донной фауны, обусловленной топографией дна и распределением водных масс (Ушаков, 1953; Виноградова, 1977). Рубеж распространения батиальных и шельфовых видов в северо-западной части Охотского моря определяется областью распространения собственной охотоморской водной массы, сохраняющейся на изобатах 100–200 м почти весь год и проникающей за пределами шельфа на глубины более 200 м (Фигуркин, 2011; Круц, Лучин, 2013). Диапазон 250–300 м считается нижней границей слоя конвективного перемешивания вод в Охотском море (Морошкин, 1966), а слой 250–400 м – ядром тёплой промежуточной охотоморской водной массы (Круц, Лучин, 2013), где уже верхнебатиальные виды преобладают над шельфовыми (табл. 4) (Шунтов, 1965; Борец, 1990).
Список литературы
Борец Л.А. 1985. Состав и биомасса донных рыб на шельфе Охотского моря // Биология моря. № 4. С. 54–59.
Борец Л.А. 1990. Состав и обилие рыб в донных ихтиоценах шельфа северной части Охотского моря // Изв. ТИНРО. Т. 111. С. 162–171.
Борец Л.А. 1997. Донные ихтиоцены российского шельфа дальневосточных морей. Владивосток: Изд-во ТИНРО-центр, 217 с.
Виноградова Н.Г. 1977. Фауна шельфа, материкового склона и абиссали // Океанология. Биология океана. Т. 1 / Под ред. Виноградова М.Е. М.: Наука. С. 178–198.
Волвенко И.В. 2001. Динамика интегральных характеристик биоценотических группировок северной части Охотского моря в конце XX века // Изв. ТИНРО. Т. 128. С. 3–44.
Воскобойникова О.С., Назаркин М.В., Голубова Е.Ю. 2012. Ранние стадии развития рыб северной части Охотского моря. СПб.: Изд-во ЗИН РАН, 108 с.
Зенкевич Л.А. 1951. Фауна и биологическая продуктивность моря. Т. 1. Л.: Сов. наука, 506 с.
Иванов О.А. 2002. Состояние охотоморских ресурсов второстепенно значимых и непромысловых видов рыб донных и придонных биотопов по сборам второй бассейновой экспедиции 2000 г. // Изв. ТИНРО. Т. 130. С. 1079–1096.
Круц А.А., Лучин В.А. 2013. Вертикальная структура толщи вод Охотского моря // Там же. Т. 175. С. 234–253.
Морошкин К.В. 1966. Водные массы Охотского моря. М.: Наука, 67 с.
Попов А.М. 1931. К познанию фауны рыб Охотского моря // Исследование морей СССР. Вып. 14. С. 121–154.
Солдатов В.К., Линдберг Г.У. 1930. Обзор рыб дальневосточных морей // Изв. ТИНРО. Т. 5. 563 с.
Таранец А.Я. 1937. Краткий определитель рыб Советского Дальнего Востока и прилегающих вод // Там же. Т. 11. 200 с.
Ушаков П.В. 1953. Фауна Охотского моря и условия ее существования. М.: Изд-во АН СССР, 459 с.
Федоров В.В., Черешнев И.А., Назаркин М.В. и др. 2003. Каталог морских и пресноводных рыб северной части Охотского моря. Владивосток: Дальнаука, 204 с.
Фигуркин А.Л. 2011. Изменчивость термохалинного состояния придонных вод северной части Охотского моря // Изв. ТИНРО. Т. 166. С. 255–274.
Черешнев И.А., Волобуев В.В., Хованский И.Е., Шестаков А.В. 2001. Прибрежные рыбы северной части Охотского моря. Владивосток: Дальнаука, 197 с.
Шейко Б.А., Федоров В.В. 2000. Глава 1. Класс Cephalaspidomorphi – Миноги. Класс Chondrichthyes – Хрящевые рыбы. Класс Holocephali – Цельноголовые. Класс Osteichthyes – Костные рыбы // Каталог позвоночных Камчатки и сопредельных морских акваторий. Петропавловск-Камчатский: Камчат. печат. двор. С. 7–69.
Шмидт П.Ю. 1950. Рыбы Охотского моря. М.; Л.: Изд-во АН СССР, 370 с.
Шунтов В.П. 1965. Вертикальная зональность в распределении рыб в верхней батиали Охотского моря // Зоол. журн. Т. 44. Вып. 11. С. 1678–1689.
Шунтов В.П. 1971. Некоторые закономерности распределения черного и стрелозубого палтусов в северной части Тихого океана // Изв. ТИНРО. Т. 75. С. 3–36.
Шунтов В.П., Волвенко И.В. 2016а. Дополнения к генерализованным количественным оценкам макрофауны бентали в дальневосточных морях и сопредельных водах Тихого океана. 1. Региональные особенности распределения биомассы рыб // Там же. Т. 186. С. 3–31.
Шунтов В.П., Волвенко И.В. 2016б. Дополнения к генерализованным количественным оценкам макрофауны бентали в дальневосточных морях и сопредельных водах Тихого океана. 2. Региональные и батиметрические особенности распределения биомассы и плотности концентраций рыб и некоторых групп беспозвоночных // Там же. Т. 186. С. 32–60.
Шунтов В.П., Борец Л.А., Дулепова Е.П. 1990. Некоторые результаты экосистемных исследований биологических ресурсов дальневосточных морей // Там же. Т. 111. С. 3–25.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


