Вопросы ихтиологии, 2019, T. 59, № 6, стр. 657-671
Ихтиопланктон южных районов Северной Атлантики. 2. Видовой состав и особенности распределения
Я. Ю. Большакова 1, *, С. А. Евсеенко 1
1 Институт океанологии РАН – ИО РАН
Москва, Россия
* E-mail: yanusrunaa@mail.ru
Поступила в редакцию 24.05.2019
После доработки 24.05.2019
Принята к публикации 24.05.2019
Аннотация
Рассматривается видовой состав ихтиопланктона открытых вод Северной Атлантики на разрезе от 30° с.ш. до экватора, выполненного в 43-м рейсе НИС “Академик Вавилов”. Разрез проходил через центральные и южные периферические воды Северного субтропического антициклонического круговорота, а также пересекал воды Северного тропического антициклонического круговорота. В составе ихтиопланктона обнаружены личинки и мальки 121 таксономической формы. Видовое разнообразие на разрезе увеличивается по направлению с севера на юг: наибольшее число видов отмечено в водах Северного тропического антициклонического круговорота за счёт личинок шельфовых видов. На северных станциях разреза среди представителей Myctophidae обнаружены виды с широкотропическим типом ареала, по мере движения к экватору наряду с ними появляются виды с центральным, центрально-периферическим и экваториально-тропическим типами ареала.
Исследования ихтиопланктона открытых вод Северной Атлантики носят эпизодический характер. Большинство работ касаются ихтиопланктона подводных поднятий в восточной части Центральной Атлантики (Гордина, 1991; Arkhipov et al., 2004; Nellen, Ruseler, 2004; Hanel et al., 2010). Имеется несколько работ по видовому составу ихтиопланктона Северной Атлантики (Evseenko, 1982; Fock, John, 2006). Ихтиопланктон тропической и субтропической части Атлантики изучен недостаточно. Сведения о личинках рыб в тропических водах из открытых районов южной части Атлантики, включая воды Срединно-Атлантического хребта, имеются для широтного разреза по 11° ю.ш. (Йон, Целк, 1998). Ранним стадиям развития рыб из прибрежных вод южной части Бразилии посвящена специальная работа (Bonecker, Castro, 2006). Стоит отметить работу по качественному и количественному составу ихтиопланктона в районе архипелага Св. Павла и Петра (Macedo-Soares et al., 2012). Оливар с соавторами (Olivar et al., 2018) изучили изменения видового состава, численности и вертикального распределения рыб (взрослых и личинок) на разрезе от побережья Бразилии (13° ю.ш.) до Канарских островов.
Предлагаемая работа является продолжением серии статей по ихтиопланктону открытых вод Атлантического океана (Большакова, Евсеенко, 2016а, 2016б, 2019).
МАТЕРИАЛ И МЕТОДИКА
Материалом для данной работы послужили пелагические личинки и мальки рыб из сборов в 43-м рейсе НИС “Академик Вавилов” на разрезе между 30° c.ш и экватором в октябре 2016 г. (рисунок). Ловы ихтиопланктона проводили разноглубинным тралом Айзекса−Кидда в модификации Самышева−Асеева (РТАКСА, длиной 25 м из безузловой дели с ячеёй 5 мм и кутовой вставкой из капронового сита № 15, площадь устья 6 м2) и большой планктонной сетью Богорова−Расса (БР). Всего собрано 18 проб РТАКСА на 18 станциях (ловы 200−0 и 700−0 м) и 30 проб БР на 17 станциях (ловы 200−0, 1000−0, 3000−0, 800−200, 900−200, 1000−200, 1500−800, 1500−900 и 1500−1000 м). Рыбы на ранних стадиях развития встретились во всех пробах РТАКСА и в 8 пробах БР. Пробы фиксировали и хранили в 4%-ном растворе формальдегида.
При рассмотрении состава ихтиопланктона типизация ареалов обнаруженных видов светящихся анчоусов (Myctophidae) приводится по Беккеру (1983).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В составе ихтиопланктона открытых вод Северной Атлантики обнаружены личинки и мальки 121 таксономической формы, из которых 89 определены до вида, 25 – до рода, остальные до семейства (таблица). Ввиду того что разрез проходил через водные массы разного генезиса, а именно: центральные и южные периферические воды Северного субтропического антициклонического круговорота и воды Северного экваториального течения и Северного экваториального противотечения (рисунок), целесообразно рассмотреть видовой состав ихтиопланктона отдельно на перечисленных участках разреза.
Видовой состав и число личинок рыб, пойманных РТАКСА на разрезе, выполненном в 43-м рейсе НИС “Академик Вавилов”
| № | Таксон | Номер станции и горизонт лова, м | ||||||||||||
| 2617 | 2623 | 2624 | 2630 | 2631 | 2631 | 2631* | 2632* | 2633* | 2636* | 2637 | 2638 | 2640* | ||
| 200−0 | 200−0 | 700−0 | 200−0 | 200−0 | 700−0 | 900−200 | 1000−200 | 200−0 | 900−0 | 700−0 | 200−0 | 200−0 | ||
| 1. Albulidae | ||||||||||||||
| 1 | Albula vulpes | |||||||||||||
| 2. Derichthyidae | ||||||||||||||
| 2 | Derichthys serpentinus | 1 | ||||||||||||
| 3. Nemichthyidae | ||||||||||||||
| 3 | Avocettina infans | 1 | 1 | |||||||||||
| 4. Congridae | ||||||||||||||
| 4 | Ariosoma balearicum | |||||||||||||
| 5 | Bathycongrus dubius | |||||||||||||
| 6 | Heteroconger sp. | |||||||||||||
| 7 | Paraconger guanensis | |||||||||||||
| 8 | Xenomystax bidentatus | |||||||||||||
| 9 | Congridae gen. sp. | |||||||||||||
| 5. Moringuidae | ||||||||||||||
| 10 | Neoconger mucronatus | |||||||||||||
| 6. Muraenidae | ||||||||||||||
| 11 | Gymnothorax nigromarginatus | |||||||||||||
| 12 | G. vicinus | |||||||||||||
| 7. Ophichthidae | ||||||||||||||
| 13 | Myrophis sp. 1 | |||||||||||||
| 14 | Ophichthus sp. 1 | |||||||||||||
| 8. Nettastomatidae | ||||||||||||||
| 15 | Nettastomatidae gen. sp. | |||||||||||||
| 9. Cyematidae | ||||||||||||||
| 16 | Cyema atrum | |||||||||||||
| 10. Microstomatidae | ||||||||||||||
| 17 | Microstoma microstoma | |||||||||||||
| 11. Stomiidae | ||||||||||||||
| 18 | Astronestes sp. | |||||||||||||
| 19 | Bathophilus sp. | |||||||||||||
| 20 | Borostomias sp. | |||||||||||||
| 21 | Chauliodus danae? | |||||||||||||
| 22 | C. sloani | 1 | ||||||||||||
| № | Таксон | Номер станции и горизонт лова, м | ||||||||||||
| 2617 | 2623 | 2624 | 2630 | 2631 | 2631 | 2631* | 2632* | 2633* | 2636* | 2637 | 2638 | 2640* | ||
| 200−0 | 200−0 | 700−0 | 200−0 | 200−0 | 700−0 | 900−200 | 1000−200 | 200−0 | 900−0 | 700−0 | 200−0 | 200−0 | ||
| 23 | Echiostoma barbatum | 1 | ||||||||||||
| 24 | Heterophotus ophistoma | |||||||||||||
| 25 | Idiacanthus fasciola | 1 | 1 | |||||||||||
| 26 | Leptostomias sp. | |||||||||||||
| 27 | Photostomias sp. | 1 | ||||||||||||
| 12. Gonostomatidae | ||||||||||||||
| 28 | Cyclothone braueri | |||||||||||||
| 29 | C. microdon | |||||||||||||
| 30 | C. pallida | 1 | ||||||||||||
| 31 | C. parapallida | |||||||||||||
| 32 | C. spp. | |||||||||||||
| 33 | Diplophos taenia | |||||||||||||
| 34 | Gonostoma atlanticum | |||||||||||||
| 35 | Sygmops elongatus | |||||||||||||
| 13. Phosichthyidae | ||||||||||||||
| 36 | Pollichthys mauli | |||||||||||||
| 37 | Vinciguerria attenuata | 1 | ||||||||||||
| 38 | V. nimbaria | 1 | ||||||||||||
| 39 | V. poweriae | |||||||||||||
| 14. Sternoptychidae | ||||||||||||||
| 40 | Argyropelecus affinis | |||||||||||||
| 41 | A. hemigumnus | 1 | ||||||||||||
| 42 | A. sp. | |||||||||||||
| 43 | Sternoptyx diaphana | |||||||||||||
| 44 | S. pseudobscura | |||||||||||||
| 45 | Valenciennellus tripunctulatus | 1 | ||||||||||||
| 46 | Sternoptychidae gen. sp. | |||||||||||||
| 15. Chlorophthalmidae | ||||||||||||||
| 47 | Chlorophthalmus agassizi | |||||||||||||
| 48 | Parasudis truculenta | |||||||||||||
| 16. Evermannelidae | ||||||||||||||
| 49 | Evermannella melanoderma | 1 | 1 | |||||||||||
| 17. Notosudidae | ||||||||||||||
| 50 | Scopelosaurus argenteus | |||||||||||||
| 51 | S. smithii | 1 | ||||||||||||
| № | Таксон | Номер станции и горизонт лова, м | ||||||||||||
| 2617 | 2623 | 2624 | 2630 | 2631 | 2631 | 2631* | 2632* | 2633* | 2636* | 2637 | 2638 | 2640* | ||
| 200−0 | 200−0 | 700−0 | 200−0 | 200−0 | 700−0 | 900−200 | 1000−200 | 200−0 | 900−0 | 700−0 | 200−0 | 200−0 | ||
| 18. Omosudidae | ||||||||||||||
| 52 | Omosudis lowii | 1 | 1 | |||||||||||
| 19. Paralepididae | ||||||||||||||
| 53 | Lestidiops affinis | |||||||||||||
| 54 | L. jayakari | |||||||||||||
| 55 | Lestidium atlanticum | |||||||||||||
| 56 | Magnisudis atlantica | |||||||||||||
| 57 | Stemonosudis sp. | |||||||||||||
| 58 | Sudis atrox | 1 | ||||||||||||
| 20. Scopelarchidae | ||||||||||||||
| 59 | Scopelarchus guentheri | 2 | 1 | |||||||||||
| 60 | S. michaelsarsi | 1 | ||||||||||||
| 21. Synodontidae | ||||||||||||||
| 61 | Trachinocephalus myops | |||||||||||||
| 22. Neoscopelidae | ||||||||||||||
| 62 | Scopelengys tristis | 1 | ||||||||||||
| 23. Myctophidae | ||||||||||||||
| 63 | Bolinichthys supralateralis | 1 | ||||||||||||
| 64 | Centrobranchus nigroocellatus | |||||||||||||
| 65 | Ceratoscopelus warmingii | 1 | 1 | |||||||||||
| 66 | Diaphus brachycephalus | 1 | 1 | |||||||||||
| 67 | Diaphus cf. rafinesquii | |||||||||||||
| 68 | Diaphus sp. 1 | 1 | ||||||||||||
| 69 | Diaphus sp. 2 | |||||||||||||
| 70 | Diodenichthys atlanticus | |||||||||||||
| 71 | Hygophum benoiti | |||||||||||||
| 72 | H. macrochir | |||||||||||||
| 73 | H. cf. taaningi | 1 | 5 | 5 | 3 | 1 | ||||||||
| 74 | Lampadena luminosa | 1 | ||||||||||||
| 75 | Lampanyctus nobilis | |||||||||||||
| 76 | L. tenuiformis | 1 | 1 | 1 | ||||||||||
| 77 | L. sp. | |||||||||||||
| 78 | Lepidophanes guentheri | |||||||||||||
| 79 | Lobianchia gemellarii | |||||||||||||
| 80 | Loweina interrupta | 1 | 1 | |||||||||||
| № | Таксон | Номер станции и горизонт лова, м | ||||||||||||
| 2617 | 2623 | 2624 | 2630 | 2631 | 2631 | 2631* | 2632* | 2633* | 2636* | 2637 | 2638 | 2640* | ||
| 200−0 | 200−0 | 700−0 | 200−0 | 200−0 | 700−0 | 900−200 | 1000−200 | 200−0 | 900−0 | 700−0 | 200−0 | 200−0 | ||
| 81 | L. rara | |||||||||||||
| 82 | Myctophum asperum | |||||||||||||
| 83 | M. nitidulum | 1 | ||||||||||||
| 84 | M. obtusirostre | |||||||||||||
| 85 | M. selenops | 1 | ||||||||||||
| 86 | Nannobrachius atrum | |||||||||||||
| 87 | N. cuprarium | 1 | ||||||||||||
| 88 | Nannobrachium sp. 1 | |||||||||||||
| 89 | Notoscopelus resplendens | |||||||||||||
| 90 | Symbolophorus rufinus | 2 | ||||||||||||
| 91 | Myctophidae gen. spp. | 1 | 2 | |||||||||||
| 24. Bregmacerotidae | ||||||||||||||
| 92 | Bregmaceros atlanticus | 1 | ||||||||||||
| 25. Antennariidae | ||||||||||||||
| 93 | Histrio histrio | |||||||||||||
| 26. Melamphaidae | ||||||||||||||
| 94 | Melamphaes sp. | 1 | ||||||||||||
| 95 | Scopeloberyx sp. | |||||||||||||
| 96 | Melamphaidae gen. sp. | 1 | ||||||||||||
| 27. Holocentridae | ||||||||||||||
| 97 | Myripristis jacobus | |||||||||||||
| 28. Scorpaenidae | ||||||||||||||
| 98 | Scorpaenidae gen sp. 1 | |||||||||||||
| 99 | Pontinus nematophthalmus? | |||||||||||||
| 29. Eleotridae | ||||||||||||||
| 100 | Eleotris sp. | |||||||||||||
| 101 | Dorminator maculatus | |||||||||||||
| 30. Gobiidae | ||||||||||||||
| 102 | Ctenogobius sp. | |||||||||||||
| 103 | Gobioides grahamae? | |||||||||||||
| 104 | Gobionellus oceanicus | |||||||||||||
| № | Таксон | Номер станции и горизонт лова, м | ||||||||||||
| 2617 | 2623 | 2624 | 2630 | 2631 | 2631 | 2631* | 2632* | 2633* | 2636* | 2637 | 2638 | 2640* | ||
| 200−0 | 200−0 | 700−0 | 200−0 | 200−0 | 700−0 | 900−200 | 1000−200 | 200−0 | 900−0 | 700−0 | 200−0 | 200−0 | ||
| 31. Scaridae | ||||||||||||||
| 105 | Cryptotomus roseus | |||||||||||||
| 106 | Sparisoma sp. | |||||||||||||
| 32. Malacanthidae | ||||||||||||||
| 107 | Malacanthus plumieri | |||||||||||||
| 33. Serranidae | ||||||||||||||
| 108 | Pseudogramma gregoryi | |||||||||||||
| 34. Acanthuridae | ||||||||||||||
| 109 | Acanthurus chirurgus | |||||||||||||
| 35. Pomacentridae | ||||||||||||||
| 110 | Stegastes cf. partitus | |||||||||||||
| 36. Scombrolabracidae | ||||||||||||||
| 111 | Scombrolabrax heterolepis | 1 | 3 | |||||||||||
| 37. Gempylidae | ||||||||||||||
| 112 | Diplospinus multistriatus | 1 | 1 | 1 | ||||||||||
| 113 | Gempylus serpens | 1 | ||||||||||||
| 114 | Nesiarchus nasutus | 1 | ||||||||||||
| 38. Chiasmodontidae | ||||||||||||||
| 115 | Chiasmodon sp. | |||||||||||||
| 39. Nomeidae | ||||||||||||||
| 116 | Cubiceps pauciradiatus | 1 | ||||||||||||
| 117 | Cubiceps sp. | 1 | ||||||||||||
| 40. Bramidae | ||||||||||||||
| 118 | Taractichthys longipinnis | 1 | ||||||||||||
| 41. Tetraodontidae | ||||||||||||||
| 119 | Sphoeroides sp. | |||||||||||||
| 42. Bothidae | ||||||||||||||
| 120 | Bothus ocellatus/robinsi | 1 | ||||||||||||
| 43. Paralychthidae | ||||||||||||||
| 121 | Syacium papillosum/gunteri | |||||||||||||
| № | Таксон | Номер станции и горизонт лова, м | ||||||||||||
| 2641* | 2647* | 2647* | 2649-1 | 2649-2 | 2656 | 2657 | 2664 | 2665 | 2668 | 2669 | 2674 | 2675 | ||
| 200−0 | 200−0 | 800−200 | 700−0 | 200−0 | 200−0 | 700−0 | 200−0 | 700−0 | 200−0 | 700−0 | 200−0 | 700−0 | ||
| 1. Albulidae | ||||||||||||||
| 1 | Albula vulpes | 1 | ||||||||||||
| 2. Derichthyidae | ||||||||||||||
| 2 | Derichthys serpentinus | |||||||||||||
| 3. Nemichthyidae | ||||||||||||||
| 3 | Avocettina infans | |||||||||||||
| 4. Congridae | ||||||||||||||
| 4 | Ariosoma balearicum | 2 | 1 | 1 | ||||||||||
| 5 | Bathycongrus dubius | 1 | ||||||||||||
| 6 | Heteroconger sp. | 1 | ||||||||||||
| 7 | Paraconger guanensis | 2 | 4 | |||||||||||
| 8 | Xenomystax bidentatus | 1 | 1 | |||||||||||
| 9 | Congridae gen. sp. | 1 | ||||||||||||
| 5. Moringuidae | ||||||||||||||
| 10 | Neoconger mucronatus | 1 | 2 | |||||||||||
| 6. Muraenidae | ||||||||||||||
| 11 | Gymnothorax nigromarginatus | 1 | 1 | |||||||||||
| 12 | G. vicinus | 1 | ||||||||||||
| 7. Ophichthidae | ||||||||||||||
| 13 | Myrophis sp. 1 | 1 | 2 | 1 | ||||||||||
| 14 | Ophichthus sp. 1 | 3 | 1 | |||||||||||
| 8. Nettastomatidae | ||||||||||||||
| 15 | Nettastomatidae gen. sp. | 1 | ||||||||||||
| 9. Cyematidae | ||||||||||||||
| 16 | Cyema atrum | 1 | ||||||||||||
| 10. Microstomatidae | ||||||||||||||
| 17 | Microstoma microstoma | 1 | 1 | |||||||||||
| 11. Stomiidae | ||||||||||||||
| 18 | Astronestes sp. | 1 | ||||||||||||
| 19 | Bathophilus sp. | 1 | ||||||||||||
| № | Таксон | Номер станции и горизонт лова, м | ||||||||||||
| 2641* | 2647* | 2647* | 2649-1 | 2649-2 | 2656 | 2657 | 2664 | 2665 | 2668 | 2669 | 2674 | 2675 | ||
| 200−0 | 200−0 | 800−200 | 700−0 | 200−0 | 200−0 | 700−0 | 200−0 | 700−0 | 200−0 | 700−0 | 200−0 | 700−0 | ||
| 20 | Borostomias sp. | 1 | ||||||||||||
| 21 | Chauliodus danae? | 3 | ||||||||||||
| 22 | C. sloani | 1 | ||||||||||||
| 23 | Echiostoma barbatum | |||||||||||||
| 24 | Heterophotus ophistoma | 1 | ||||||||||||
| 25 | Idiacanthus fasciola | |||||||||||||
| 26 | Leptostomias sp. | 1 | ||||||||||||
| 27 | Photostomias sp. | |||||||||||||
| 12. Gonostomatidae | ||||||||||||||
| 28 | Cyclothone braueri | 2 | ||||||||||||
| 29 | C. microdon | 1 | ||||||||||||
| 30 | C. pallida | 1 | 1 | |||||||||||
| 31 | C. parapallida | 1 | ||||||||||||
| 32 | C. spp. | 5 | 1 | 6 | ||||||||||
| 33 | Diplophos taenia | 1 | ||||||||||||
| 34 | Gonostoma atlanticum | 1 | ||||||||||||
| 35 | Sygmops elongatus | 1 | ||||||||||||
| 13. Phosichthyidae | ||||||||||||||
| 36 | Pollichthys mauli | 1 | ||||||||||||
| 37 | Vinciguerria attenuata | |||||||||||||
| 38 | V. nimbaria | |||||||||||||
| 39 | V. poweriae | 1 | ||||||||||||
| 14. Sternoptychidae | ||||||||||||||
| 40 | Argyropelecus affinis | 1 | ||||||||||||
| 41 | A. hemigumnus | 1 | ||||||||||||
| 42 | A. sp. | 1 | ||||||||||||
| 43 | Sternoptyx diaphana | 1 | 1 | 1 | 1 | |||||||||
| 44 | S. pseudobscura | 1 | ||||||||||||
| 45 | Valenciennellus tripunctulatus | |||||||||||||
| 46 | Sternoptychidae gen. sp. | 1 | ||||||||||||
| 15. Chlorophthalmidae | ||||||||||||||
| 47 | Chlorophthalmus agassizi | 1 | ||||||||||||
| 48 | Parasudis truculenta | 1 | ||||||||||||
| № | Таксон | Номер станции и горизонт лова, м | ||||||||||||
| 2641* | 2647* | 2647* | 2649-1 | 2649-2 | 2656 | 2657 | 2664 | 2665 | 2668 | 2669 | 2674 | 2675 | ||
| 200−0 | 200−0 | 800−200 | 700−0 | 200−0 | 200−0 | 700−0 | 200−0 | 700−0 | 200−0 | 700−0 | 200−0 | 700−0 | ||
| 16. Evermannelidae | ||||||||||||||
| 49 | Evermannella melanoderma | |||||||||||||
| 17. Notosudidae | ||||||||||||||
| 50 | Scopelosaurus argenteus | 1 | 2 | |||||||||||
| 51 | S. smithii | |||||||||||||
| 18. Omosudidae | ||||||||||||||
| 52 | Omosudis lowii | 1 | ||||||||||||
| 19. Paralepididae | ||||||||||||||
| 53 | Lestidiops affinis | 1 | 1 | 2 | ||||||||||
| 54 | L. jayakari | 1 | ||||||||||||
| 55 | Lestidium atlanticum | 1 | ||||||||||||
| 56 | Magnisudis atlantica | 1 | ||||||||||||
| 57 | Stemonosudis sp. | 1 | ||||||||||||
| 58 | Sudis atrox | |||||||||||||
| 20. Scopelarchidae | ||||||||||||||
| 59 | Scopelarchus guentheri | 1 | 1 | 1 | 1 | 1 | 1 | 2 | ||||||
| 60 | S. michaelsarsi | 1 | ||||||||||||
| 21. Synodontidae | ||||||||||||||
| 61 | Trachinocephalus myops | 1 | ||||||||||||
| 22. Neoscopelidae | ||||||||||||||
| 62 | Scopelengys tristis | |||||||||||||
| 23. Myctophidae | ||||||||||||||
| 63 | Bolinichthys supralateralis | 2 | 1 | |||||||||||
| 64 | Centrobranchus nigroocellatus | 1 | ||||||||||||
| 65 | Ceratoscopelus warmingii | 1 | 2 | 1 | 5 | |||||||||
| 66 | Diaphus brachycephalus | 5 | 4 | |||||||||||
| 67 | Diaphus cf. rafinesquii | |||||||||||||
| 68 | Diaphus sp. 1 | 2 | ||||||||||||
| 69 | Diaphus sp. 2 | 1 | ||||||||||||
| 70 | Diodenichthys atlanticus | 1 | 1 | 1 | 1 | |||||||||
| 71 | Hygophum benoiti | 1 | 3 | |||||||||||
| 72 | H. macrochir | 1 | ||||||||||||
| 73 | H. cf. taaningi | 2 | ||||||||||||
| 74 | Lampadena luminosa | |||||||||||||
| 75 | Lampanyctus nobilis | 1 | ||||||||||||
| № | Таксон | Номер станции и горизонт лова, м | ||||||||||||
| 2641* | 2647* | 2647* | 2649-1 | 2649-2 | 2656 | 2657 | 2664 | 2665 | 2668 | 2669 | 2674 | 2675 | ||
| 200−0 | 200−0 | 800−200 | 700−0 | 200−0 | 200−0 | 700−0 | 200−0 | 700−0 | 200−0 | 700−0 | 200−0 | 700−0 | ||
| 76 | L. tenuiformis | |||||||||||||
| 77 | L. sp. | 1 | ||||||||||||
| 78 | Lepidophanes guentheri | 1 | 3 | |||||||||||
| 79 | Lobianchia gemellarii | 1 | ||||||||||||
| 80 | Loweina interrupta | |||||||||||||
| 81 | L. rara | 1 | ||||||||||||
| 82 | Myctophum asperum | 2 | ||||||||||||
| 83 | M. nitidulum | |||||||||||||
| 84 | M. obtusirostre | 1 | 1 | |||||||||||
| 85 | M. selenops | |||||||||||||
| 86 | Nannobrachius atrum | 1 | ||||||||||||
| 87 | N. cuprarium | |||||||||||||
| 88 | Nannobrachium sp. 1 | 1 | ||||||||||||
| 89 | Notoscopelus resplendens | 1 | ||||||||||||
| 90 | Symbolophorus rufinus | |||||||||||||
| 91 | Myctophidae gen. spp. | 1 | ||||||||||||
| 24. Bregmacerotidae | ||||||||||||||
| 92 | Bregmaceros atlanticus | 1 | ||||||||||||
| 25. Antennariidae | ||||||||||||||
| 93 | Histrio histrio | 1 | ||||||||||||
| 26. Melamphaidae | ||||||||||||||
| 94 | Melamphaes sp. | |||||||||||||
| 95 | Scopeloberyx sp. | 1 | ||||||||||||
| 96 | Melamphaidae gen. sp. | 1 | ||||||||||||
| 27. Holocentridae | ||||||||||||||
| 97 | Myripristis jacobus | 2 | ||||||||||||
| 28. Scorpaenidae | ||||||||||||||
| 98 | Scorpaenidae gen sp. 1 | 1 | ||||||||||||
| 99 | Pontinus nematophthalmus? | 1 | ||||||||||||
| 29. Eleotridae | ||||||||||||||
| 100 | Eleotris sp. | 3 | 1 | 5 | 6 | |||||||||
| 101 | Dorminator maculatus | 4 | 4 | |||||||||||
| 30. Gobiidae | ||||||||||||||
| 102 | Ctenogobius sp. | 4 | 3 | 8 | 37 | 10 | 28 | |||||||
| 103 | Gobioides grahamae ? | 1 | 10 | 11 | 29 | |||||||||
| 104 | Gobionellus oceanicus | 3 | ||||||||||||
| № | Таксон | Номер станции и горизонт лова, м | ||||||||||||
| 2641* | 2647* | 2647* | 2649-1 | 2649-2 | 2656 | 2657 | 2664 | 2665 | 2668 | 2669 | 2674 | 2675 | ||
| 200−0 | 200−0 | 800−200 | 700−0 | 200−0 | 200−0 | 700−0 | 200−0 | 700−0 | 200−0 | 700−0 | 200−0 | 700−0 | ||
| 31. Scaridae | ||||||||||||||
| 105 | Cryptotomus roseus | 2 | ||||||||||||
| 106 | Sparisoma sp. | 1 | 2 | 2 | 5 | |||||||||
| 32. Malacanthidae | ||||||||||||||
| 107 | Malacanthus plumieri | 1 | ||||||||||||
| 33. Serranidae | ||||||||||||||
| 108 | Pseudogramma gregoryi | 1 | ||||||||||||
| 34. Acanthuridae | ||||||||||||||
| 109 | Acanthurus chirurgus | 1 | 1 | |||||||||||
| 35. Pomacentridae | ||||||||||||||
| 110 | Stegastes cf. partitus | 1 | ||||||||||||
| 36. Scombrolabracidae | ||||||||||||||
| 111 | Scombrolabrax heterolepis | |||||||||||||
| 37. Gempylidae | ||||||||||||||
| 112 | Diplospinus multistriatus | |||||||||||||
| 113 | Gempylus serpens | 1 | 1 | 1 | ||||||||||
| 114 | Nesiarchus nasutus | |||||||||||||
| 38. Chiasmodontidae | ||||||||||||||
| 115 | Chiasmodon sp. | |||||||||||||
| 39. Nomeidae | ||||||||||||||
| 116 | Cubiceps pauciradiatus | 1 | ||||||||||||
| 117 | Cubiceps sp. | |||||||||||||
| 40. Bramidae | ||||||||||||||
| 118 | Taractichthys longipinnis | |||||||||||||
| 41. Tetraodontidae | ||||||||||||||
| 119 | Sphoeroides sp. | 1 | ||||||||||||
| 42. Bothidae | ||||||||||||||
| 120 | Bothus ocellatus/robinsi | 2 | 1 | 2 | 3 | 8 | ||||||||
| 43. Paralychthidae | ||||||||||||||
| 121 | Syacium papillosum/gunteri | 2 | ||||||||||||
Схема расположения станций НИС “Академик Сергей Вавилов”, рейс № 43, 12−28.10.2016 г.: (→) − направления основных течений (схема течений дана по: Lumpkin, Garzoli, 2005 с уточнениями по: Stramma et al., 2003).
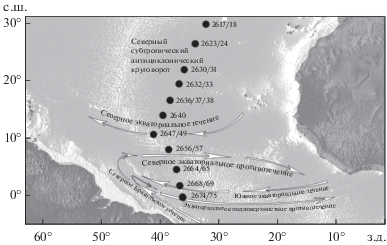
Северный субтропический антициклонический круговорот
Центральные воды – 30°−19° с.ш. 32°−37° з.д. (ст. 2617−2618, 2623−2624, 2630−2633). Качественный состав ихтиопланктона показывает значительную обеднённость. В сборах обнаружены личинки рыб, относящихся к 29 видам из 15 семейств. Большинство личинок принадлежит к обитателям мезо- и батипелагиали: Myctophidae (10 видов), Gonostomatidae (1 вид), Sternoptychidae (1), Evermannelidae (1), Omosudidae (1), Phosichthyidae (2), Scopelarchidae (2), Scopelosauridae (1), Stomiidae (3), Melamphaidae (1),Scombrolabracidae (1), Gempylidae (2), Derichthyidae (1), Nemichthydae (1); личинки рыб эпипелагической группировки представлены Cubiceps pauciradiatus (Nomeidae). Основу качественного состава ихтиопланктона здесь представляют личинки и мальки рыб семейства Myctophidae. В уловах встретились Hygophum taaningi, Ceratoscopelus warmingii, Symbolophorus rufinus, Diaphus brachicephalus, Loweina interrupta и Myctophum nitidulum ранних стадий развития – миктофиды, имеющие широкотропический тип ареала. Представители других семейств встречены единично. Столь бедный в качественном и количественном отношении состав ихтиопланктона свидетельствует о сборе материала в районе низкопродуктивных олиготрофных центральных вод Северного субтропического антициклонического круговорота.
Южные периферические воды – 16°−08° с.ш. 42°−38° з.д. (ст. 2636−2638, 2640, 2649, 2656−2657). В сборах обнаружены личинки 41 вида рыб, принадлежащих 25 семействам, что на треть больше по сравнению с обнаруженными севернее, в центральных водах субтропического антициклонического круговорота; при этом видовой состав несколько изменился. Бóльшую часть сборов составляли личинки мезо- и батипелагических видов: Myctophidae (9), Stomiidae (4), Sternoptychidae (4), Gonostomatidae (2), Phosichthyidae (1), Evermannelidae (1), Scopelarchidae (1), Melamphaidae (1), Scombrolabracidae (1), Cyematidae (1), Neoscopelidae (1), Gempylidae (2), Paralepididae (1), Chiasmodontidae (1), Bregmacerotidae (1), Microstomatidae (1). Наибольшим числом видов, как и на первом участке, представлены миктофиды: обнаружены личинки видов с центральным (Nannobrachium cuprarium, Hygophum benoiti) и центрально-периферическим типами ареалов (Bolinichthys supralateralis, Diogenichthys atlanticus, Loweina rara). Личинки эпипелагических видов рыб представлены тремя семействами: Bramidae (1), Nomeidae (2), Antennariidae (1). Последнее семейство представлено высокоспециализированным видом Histrio histrio – рыба-клоун, ассоциированная со скоплениями саргассов. На самой южной станции этого участка разреза (ст. 2657), прилегающей к Северному экваториальному противотечению, в уловах обнаружены единичные личинки шельфовых рыб семейств Gobiidae (2) и Bothidae (1), по всей вероятности, вынесенные сюда с водами Северного Бразильского течения. Несколько станций (2647, 2649, 2656, 2657) были выполнены непосредственно над Срединно-Атлантическим хребтом. Видовой состав ихтиопланктона здесь не показал увеличения разнообразия за счёт типичных представителей талассной ихтиофауны. В уловах обнаружены единичные личинки семейств Melamphaidae, Congridae и Ophichthidae; лептоцефалы угреобразных рыб, однако, в силу своей длительной личиночной стадии могли быть вынесены сюда из шельфовой зоны Бразилии. Выполненные здесь станции находятся в зоне влияния Северного экваториального течения и противотечения, поэтому отсутствие в уловах личинок видов, ассоциированных с подводными поднятиями, можно связать с действием этих сильных и постоянных течений.
Наблюдаемое увеличение разнообразия рыб на рассматриваемой части разреза указывает на его положение в зоне Северного тропического фронта – раздела между экваториальными и центральными водными массами, обусловливающего здесь повышенную биологическую продуктивность.
Экваториальные и тропические воды Северного экваториального противотечения и Южного экваториального и Северного Бразильского течений
05°−00° с.ш. 37°−36° з.д. (ст. 2664−2665, 2668−2669, 2674−2675). По сравнению со значительно обеднённым составом ихтиопланктона в северной части разреза качественный и количественный состав в районе Южного тропического круговорота показывает кардинально большее разнообразие. На этом участке разреза обнаружены 75 видов из 31 семейства, из них значительная часть (30 видов из 18 семейств) принадлежат прибрежному ихтиоцену. Личинки океанических видов рыб представлены 45 видами из 13 семейств (причём представители эпипелагической группировки среди них отсутствуют): Myctophidae (17), Gonostomatidae (5), Sternoptychidae (4), Stomiidae (4), Scopelarchidae (2), Phosichthyidae (1), Paralepididae (5), Melamphaidae (1), Gempylidae (1), Bregmacerotidae (1), Nettastomatidae (1), Chlorophthalmidae (2), Scopelosauridae (1). В целом список семейств сходен с таковым в северных частях разреза, хотя семейства представлены значительно богаче в видовом отношении, что наиболее хорошо прослеживается на примере светящихся анчоусов. Число видов миктофид на этом участке разреза фактически в два раза больше, чем на участках разреза, проходящих через центральные и периферические воды Северного субтропического антициклонического круговорота. На этом разрезе, который находится в экваториальных водах, обнаружены личинки видов с широкотропическим (Ceratoscopelus warmingii, Diaphus brachycephalus, Lepidophanes guentheri, Lampanyctus nobilis, Hygophum macrochir), центрально-периферическим (Bolinichthys supralateralis, Diogenichthys atlanticus, Centrobranchus nigroocellatus), центральным (Nannobrachium atrum) и экваториально-тропическим типами ареалов (Myctophum asperum, Myctophum obtusirostre). Личинки неритических видов представлены следующими семействами: Albulidae (1), Congridae (6), Moringuidae (1), Muraenidae (2), Ophichthidae (2), Synodontidae (1), Serranidae (1), Holocentridae (1), Gobiidae (3), Scaridae (2), Eleotridae (2), Pomacentridae (1), Scorpaenidae (2), Malacanthidae (1), Acanthuridae (1), Diodontidae (1), Bothidae (1), Paralychthidae (1). Доминирующими по количеству экземпляров в пробах были личинки рыб семейства Gobiidae. Также многочисленными были личинки Scaridae, Eleotridae, Bothidae, Congridae. Наблюдаемое высокое разнообразие личинок шельфовых видов в районе Северного тропического антициклонического круговорота может быть обусловлено их пассивным выносом от побережья Бразилии водами Северного Бразильского течения и Экваториального подповерхностного противотечения. Можно предположить и другой путь: личинки прибрежных видов были вынесены сюда с водами Южного экваториального течения от о-вов Св. Павла и Петра, расположенных на экваторе восточнее (29° з.д.) нашей южной станции (2674/75). Однако, сопоставив видовой состав ихтиопланктона на ст. 2674/75 с таковым вокруг архипелага Св. Павла и Петра (Macedo-Soares et al., 2012), мы склонны исключить этот путь дрейфа личинок, что связано с отсутствием в составе ихтиофауны о-вов Св. Павла и Петра ряда видов, обнаруженных в наших пробах. Отличия наблюдаются в неритической составляющей: например, в водах архипелага обитает единственный вид семейства Gobiidae − Bathygobius soporator (Feitoza et al., 2003; Vaske et al., 2005), тогда как в наших пробах отмечены Ctenogobius sp., Gobioides grahamae, Gobionellus oceanicus, характерные для шельфовых вод Бразилии; то же касается представителей других семейств – Scaridae, Paralychthidae, Acanthuridae, Malacanthidae, Eleotridae.
От стерильного выноса в открытые районы северной части Атлантики личинок прибрежных видов удерживает в какой-то мере Северное экваториальное противотечение, отличающееся большой устойчивостью и скоростью. Возможность возврата личинок шельфовых рыб из Северного тропического круговорота к мелководью Южной Америки зависит от двух факторов: присутствия направленных в сторону шельфа потоков и способности личинок пребывать долгое время в пелагиали, что рассмотрено на примере личинок рыб из района Костариканского Купола (Евсеенко, Штаут, 2005). Хорошо известно о продолжительной личиночной стадии развития у многих камбалообразных, лабрид и других видов (Евсеенко, 1982, 2008). По-видимому, прибрежные личинки имеют возможность пассивно пересекать мощное Бразильское течение благодаря побочным вихрям (по аналогии с изученными в водах Флоридского течения (Limouzy-Paris et al., 1997)). В уловах на ст. 2667, 2668, 2675 отмечены единичные личинки видов, приуроченных к подводным поднятиям, например Chlorophthalmus agassizi. В целом, несмотря на расположение данного участка разреза в районе Северной тропической дивергенции, здесь отмечается значительное повышение разнообразия ихтиопланктона, что связано в наибольшей степени с выносом сюда личинок прибрежных видов.
Суммируя, отметим, что основу видового разнообразия и численности указанных групп рыб в большинстве уловов разноглубинного трала составляют личинки рыб семейства светящихся анчоусов – Myctophidae (29 видов). Следующими по разнообразию форм являются стомиевые (Stomiidae, 10), гоностомовые (Gonostomatidae, 8), стерноптиховые (Sternoptychidae, 7), веретенниковые (Paralepididae, 6) и конгеровые (Congridae, 6). Остальные семейства представлены одним−тремя видами и небольшим числом экземпляров. Кроме массовых групп мезопелагических рыб в уловах отмечены личинки и/или мальки следующих редких видов: Chiasmodon sp. (Chiasmodontidae), Aristostomias sp., Bathophilus sp., Leptostomias sp., Photonectes sp. и другие (Stomiidae).
Анализ разнообразия видов Myctophidae, собранных в ходе рейса, показывает его большую вариабельность в разных исследованных районах. Всего было поймано, по меньшей мере, 29 видов светящихся анчоусов, относящихся к 15 родам. В центральном районе Северного субтропического круговорота преобладают личинки видов с широкотропическим типом ареала. В районе периферических вод этого круговорота наряду с видами, имеющими широкотропический тип ареала, начинают встречаться виды с центральным и центрально-периферическим типами ареалов, а в экваториальных водах Северной Атлантики появляются виды с экваториально-тропическим типом ареала.
Большая часть работ по ихтиопланктону открытых вод Атлантического океана посвящена отдельным подводным поднятиям (Белянина, 1984; Гордина, 1991; Arkhipov et al., 2004; Nellen, Ruseler, 2004; Hanel et al., 2010). Столь крупномасштабные разрезы в Атлантике, сравнимые с нашим, рассматриваются всего в двух работах: по ихтиопланктону на разрезе по 11° ю.ш в тропической Атлантике (Йон, Целк, 1998) и по распределению рыб на разрезе от побережья Бразилии до Канарских о-вов (Olivar et al., 2018). На трансатлантическом разрезе (Йон, Целк, 1998) максимум видового разнообразия и численности ихтиопланктона наблюдался в шельфовой зоне Бразилии и Анголы. Минимальные значения этих параметров отмечались в западной части разреза до района Срединно-Атлантического хребта, над которым численность и разнообразие начали увеличиваться по направлению на восток. На разрезе от побережья Бразилии до Канарских о-вов (Olivar et al., 2018) наименьшее число видов и численность отмечены в начале разреза (13° ю.ш.) на удалении 420 км от берега Бразилии. Севернее экватора видовое разнообразие несколько увеличилось и достигло максимума в районе мыса Бланка (21° с.ш.). На нашем разрезе видовое разнообразие увеличивалось с севера на юг – от центральных вод Северного субтропического круговорота в сторону экватора, достигая максимума на крайних станциях разреза (2674, 2675), расположенных наиболее близко к побережью Бразилии.
Список литературы
Беккер В.Э. 1983. Миктофовые рыбы Мирового океана. М.: Наука, 247 с.
Белянина Т.Н. 1984. Замечания об ихтиопланктоне открытых вод Атлантического океана в районе подводной горы Грейт-Метеор // Вопр. ихтиологии. Т. 24. Вып. 4. С. 672–764.
Большакова Я.Ю., Евсеенко С.А. 2016а. О видовом составе ихтиопланктона Китового хребта (Южная Атлантика) // Там же. Т. 56. № 6. С. 685–697. https://doi.org/10.7868/S0042875216060035
Большакова Я.Ю., Евсеенко С.А. 2016б. О видовом составе ихтиопланктона из вод Срединно-Атлантического хребта (Южная Атлантика) // Там же. Т. 56. № 4. С. 427–438. https://doi.org/10.7868/S0042875216040032
Большакова Я.Ю., Евсеенко С.А. 2019. Ихтиопланктон южных вод северной Атлантики. 1. Морфология малоизученных личинок прибрежных видов // Там же. Т. 59. № 5. С. 556−563. https://doi.org/10.1134/S0042875219050011
Гордина А.Д. 1991. Ихтиопланктон океанических поднятий Атлантического и Индийского океанов. Киев: Наук. думка, 113 с.
Евсеенко С.А. 1982. Эколого-морфологические особенности ранних стадий развития камбал западной части северной Атлантики // Тр. ИО АН СССР. Т. 118. С. 43–84.
Евсеенко С.А. 2008. Распределение и пути дрейфовых миграций личинок трёх видов камбал рода Bothus (Bothidae) в открытых водах северной Атлантики // Вопр. ихтиологии. Т. 48. № 6. С. 825–843.
Евсеенко C.А., Штаут М.И. 2005. О видовом составе и распределении ихтиопланктона и микронектона в зоне Костариканского купола и сопредельных районах тропической восточной Пацифики // Там же. Т. 45. № 4. С. 512–524.
Йон Г.-Х., Целк К. 1998. Численность, видовое разнообразие и зональное распределение личинок рыб на разрезе по 11° ю.ш. в южной тропической Атлантике // Там же. Т. 38. № 2. С. 231–240.
Arkhipov A.G., Sirota A.A, Kozlov D.A., Shnar V.N. 2004. Observation on hydrographic structures, ichthyoplankton and fish populations around seamounts of the central-eastern Atlantic // Arch. Fish. Mar. Res. V. 51. № 1−3. P. 201–214.
Bonecker A.C.T., Castro M.S. 2006. Atlas de larvas de peixes da região central da Zona Econômica Exclusiva brasileira. Rio de Janeiro: Mus. Nacional, 214 p.
Evseenko S.A. 1982. Ichthyoplankton of slope and Gulf Stream waters off Nova Scotia in late autumn 1974 // J. Northw. Atlant. Fish. Sci. V. 3. № 2. P. 127–139. https://doi.org/10.2960/J.v3.a12
Feitoza B., Rocha L.A., Luiz-Junior O.J. et al. 2003. Reef fishes of St. Paul’s Rocks: new records and notes on biology and zoogeography // Aqua. V. 7. № 2. P. 61–82.
Fock H., John H.-Ch. 2006. Fish larval patterns across the Reykjanes Ridge // Mar. Biol. Res. V. 2. P. 191–199. https://doi.org/10.1080/17451000600784159
Hanel R., John H-Ch., Meyer-Klaeden O., Piatkowski U. 2010. Larval fish abundance, composition and distribution at Senghor Seamount (Cape Verde Islands) // J. Plankton Res. V. 32. № 11. P. 1541–1556. https://doi.org/10.1093/plankt/fbq076
Limouzy-Paris C.B., Graber H.C., Jones D.L. et al. 1997. Translocation of larval coral reef fishes via sub-mesoscale spin-off eddies from the Florida Current // Bull. Mar. Sci. V. 60. № 3. P. 966–983.
Lumpkin R., Garzoli S.L. 2005. Near-surface circulation in the tropical Atlantic Ocean // Deep-Sea Res. Pt. I. V. 52. № 3. P. 495–518. https://doi.org/10.1016/j.dsr.2004.09.001
Macedo-Soares L.C.P., Freire A.S., Muelbert J.H. 2012. Small-scale spatial and temporal variability of larval fish assemblages at an isolated oceanic island // Mar. Ecol. Progr. Ser. V. 444. P. 207–222. https://doi.org/10.3354/meps09436
Nellen W., Ruseler S. 2004. Composition, horizontal and vertical distribution of ichthyoplankton in the Great Meteor Seamount area in September 1998 // Arch. Fish. Mar. Res. № 51. № 1−3. P. 132−164.
Olivar M.P., Contreras T., Hulley P.A. et al. 2018. Variation in the diel vertical distributions of larvae and transforming stages of oceanic fishes across the tropical and equatorial Atlantic // Progr. Oceanography. T. 160. C. 83–100. https://doi.org/10.1016/j.pocean.2017.12.00
Stramma L., Fischer J., Brandt P., Schott F. 2003. Circulation, variability and near-equatorial meridional flow in the central tropical Atlantic // Interhemispheric water exchange in the Atlantic Ocean / Eds. Goni G.J., Malanotte-Rizzoli P. Amsterdam: Elsevier. P. 1–22. https://doi.org/10.1016/S0422-9894(03)80141-1
Vaske T. Jr., Lessa R.P., De Nóbrega M. et al. 2005. A checklist of fishes from Saint Peter and Saint Paul Archipelago, Brazil // J. Appl. Ichthyol. V. 21. № 1. P. 75–79. https://doi.org/10.1111/j.1439-0426.2004.00600.x
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


