Вопросы ихтиологии, 2019, T. 59, № 6, стр. 651-656
Размерно-возрастная структура, рост и созревание морского ерша Scorpaena porcus (Scorpaenidae) из вод Юго-Западного Крыма (Чёрное море)
Д. Н. Куцын 1, *, Е. Н. Скуратовская 1, И. И. Чеснокова 1
1 Институт биологии южных морей РАН – ИнБЮМ РАН
Севастополь, Россия
* E-mail: makaira88@gmail.com
Поступила в редакцию 09.01.2019
После доработки 06.02.2019
Принята к публикации 04.03.2019
Аннотация
Проанализированы размерно-возрастные показатели, закономерности роста и созревания морского ерша Scorpaena porcus из прибрежной акватории Юго-Западного Крыма. Средняя длина и масса самок по сравнению с самцами достоверно больше (16.4 см и 93.0 г против 14.9 см и 62.0 г). Максимальный возраст самок в уловах 11 лет, самцов – 12 лет; 50% самок созревают в возрасте 3−4 года при длине 13.9 см, 50% самцов − в возрасте 2−3 года при длине 13.0 см. После достижения половой зрелости темп роста самок замедляется в меньшей степени, чем самцов. Для крымской группировки морского ерша по сравнению со средиземноморскими характерен низкий темп роста.
Морской ёрш Scorpaena porcus − представитель восточноатлантическо-средиземноморского фаунистического комплекса (Виноградов и др., 2017). Это морской прибрежный теплолюбивый демерсальный широко распространённый вид. Его ареал охватывает Атлантический океан у берегов Европы и Африки, от Бискайского залива до южных берегов Великобритании, Канарские и Азорские о-ва, берега Марокко, Средиземное и прилегающие моря. В прибрежных водах Чёрного моря распространён повсеместно, в Азовском известен к северу от Керченского пролива, у м. Казантип и о-ва Бирючий (Световидов, 1964; Hureau, Litvinenko, 1986). Населяет преимущественно каменистые биотопы, где охотится из засады на придонных беспозвоночных и рыб. Активен главным образом в ночное время суток (Пашков и др., 1999). Этот непромысловый вид является объектом любительского рыболовства.
На протяжении всего ареала морской ёрш формирует локальные популяции, различающиеся биологическими особенностями, в частности, возрастной структурой и темпом роста. Возрастная структура, являясь результатом взаимодействия трёх процессов − воспроизводства, роста и элиминации особей, отражает характер взаимодействия популяции организмов и среды. Рост определяет скорость созревания, продолжительность жизни и темп воспроизводства популяции, приспособительно меняясь в зависимости от условий обитания (Никольский, 1974). Сравнительный анализ возрастного состава и роста особей отдельных популяций позволяет выявить основные факторы, оказывающие влияние на их биологию и отбор в пределах всего ареала. Изучение закономерностей роста является ключевой задачей биологии развития, позволяет пролить свет на ряд вопросов экологии и продукционной биологии, что становится особенно актуальным в условиях климатических изменений и увеличения антропогенной нагрузки на экосистемы.
Известны работы, в которых приводятся данные по возрасту и росту черноморского морского ерша (Руднева, Жерко, 2000; Кузьминова, 2006; Скуратовская, 2009; Руднева и др., 2011). Однако в этих исследованиях внимание сфокусировано на проблеме загрязнения морской среды, где морской ёрш выступает в качестве одного из видов-индикаторов. В то же время размерно-возрастной состав и рост черноморского морского ерша заслуживают отдельного и всестороннего исследования.
Цель работы − изучить размерно-возрастной состав, закономерности роста и созревания морского ерша в прибрежной акватории Юго-Западного Крыма.
МАТЕРИАЛ И МЕТОДИКА
Материал собирали в весенне-летний период 2012−2017 гг. донными ловушками с ячеёй 12 мм в прибрежной акватории Юго-Западного Крыма − от бухты Ласпи до мыса Толстый (рис. 1). Всех рыб (1054 экз.) подвергали полному биологическому анализу согласно стандартным методикам (Правдин, 1966). Общую длину (TL) измеряли с точностью до 0.1 см, массу – до 0.1 г. Устанавливали половую принадлежность особей и стадию зрелости гонад по 5-балльной шкале (Holden, Raitt, 1975). Экземпляр считался половозрелым, если к началу нерестового периода (конец мая–начало июня) его гонады находились на III стадии зрелости и выше. Возраст определяли по отолитам, предварительно выдержанным в течение 5−7 сут. в 50%-ном растворе глицерина. Отолиты просматривали в падающем свете. Устанавливали регрессионную зависимость между длиной отолита (OL) и TL (Мина, Клевезаль, 1976).
При анализе линейного и весового роста применяли уравнения Берталанфи (Bertalanffy, 1938; Мина, Клевезаль, 1976; Рикер, 1979): L = L∞[1 – ${{{\text{e}}}^{{ - k}}}^{{(t--{{t}_{0}})}}$] и W = W∞[1 – ${{{\text{e}}}^{{ - k}}}^{{(t--{{t}_{0}})}}$]b, где L∞ − асимптотическая длина, W∞ − асимптотическая масса, k – константа скорости роста, t – возраст, t0 – возраст рыбы, когда её длина и масса в рассматриваемой теоретической модели равны 0, b – показатель степени в зависимости массы от длины (W = aLb). Уравнения Берталанфи верифицировали рекуррентными зависимостями Форда−Уолфорда (Ford, 1933; Walford, 1946): L(t +1) = aLt + b, где Lt – длина в возрасте t, L(t +1) − длина в возрасте t + 1, a и b – коэффициенты регрессии. Рассчитывали индекс роста для линейных и весовых показателей (Pauly et al., 1988): φ = lg k + 2lg L∞ и φ′ = lg k + + (2 lg W∞)/3.
При описании размерно-возрастной структуры использовали следующие статистические критерии: для проверки нормальности распределения − W-критерий Шапиро−Уилка; для оценки различий длины и массы в выборках самок и самцов − U-критерий Манна−Уитни; для анализа соотношения полов − критерий χ2; для анализа качества регрессионных моделей − F-критерий Фишера. Статистический анализ выполнен с применением программных пакетов MS Excel и Statistica 12.
РЕЗУЛЬТАТЫ
Соотношение полов и размерно-возрастная структура. В связи с тем что в отечественной литературе обычно указывается стандартная длина (SL) морского ерша, а в зарубежной полная (TL), возникла необходимость установления зависимости между данными показателями. Полученные зависимости для самок и самцов достоверно (R2 = 0.98) аппроксимируются уравнениями соответственно TL = 1.21SL + 0.82 и TL = 1.23SL + 0.66.
Соотношение самцов и самок морского ерша в уловах составляло 1 : 1.2, отличия от соотношения 1 : 1 недостоверны (χ2-тест, df = 1, p > 0.05).
Длина самок варьировала в пределах 10.3–28.7 см, самцов – 8.1–21.4 см при средних значениях соответственно 16.4 ± 0.1 и 14.9 ± 0.1 см (рис. 2а). Распределение по линейным размерам у самок отличается от нормального (W-критерий, n = 576, p < < 0.001), у самцов – близко к нормальному (W‑критерий, n = 476, p = 0.16). Различия между длиной самок и самцов статистически достоверны (U-критерий, p < 0.001).
Рис. 2.
Размерно-возрастной состав самок (- - -) и самцов (—) морского ерша Scorpaena porcus в выборках из прибрежных вод Юго-Западного Крыма: а – длина (TL), б – масса, в − возраст.
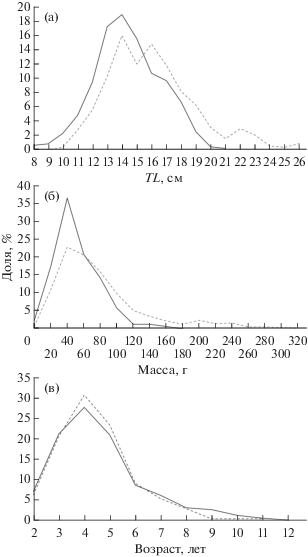
Масса самок составляла 6.4–531.9 (93.0 ± 2.8) г, самцов – 10.8–173.2 (62.0 ± 1.3) г (рис. 2б). Распределение по массе как самок, так и самцов отличается от нормального (W-критерий, nf = 552, nm = 465, p < 0.001). Различия между самками и самцами по массе, как и по длине, статистически достоверны (U-критерий, nf = 576, nm = 476, p < 0.001).
Максимальный возраст самок составляет 11 лет, самцов – 12 лет (рис. 2в). Распределение по возрасту отличается от нормального (W-критерий, nf = 549, nm = 445, p < 0.001). Межполовые различия в возрастном составе статистически недостоверны (U-критерий, p = 0.49).
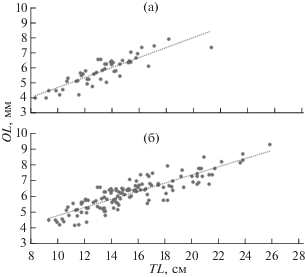
Зависимость длины отолита от длины тела морского ерша аппроксимируется линейной регрессией OL = aTL + b (рис. 3). Полученные уравнения статистически значимы (F-критерий, p < 0.05) и могут использоваться для обратных расчислений. Диаметр годового кольца при этом соответствует OL в искомом возрасте. Доверительные интервалы (p = 0.95) коэффициентов уравнения регрессии у самок (a = 0.27 ± 0.03, b = 1.85 ± 0.49) и самцов (a = = 0.33 ± 0.05, b = 1.34 ± 0.71) перекрываются, что не позволяет сделать вывод о статистически значимых межполовых различиях зависимостей.
Рис. 3.
Зависимости между длиной отолита (OL) и общей длиной (TL) морского ерша Scorpaena porcus из прибрежных вод Юго-Западного Крыма: а − самцы, OL = 0.33TL + 1.34, R2 = 0.76, n = 52; б – самки, OL = = 0.27TL + 1.85, R2 = 0.81, n = 81.
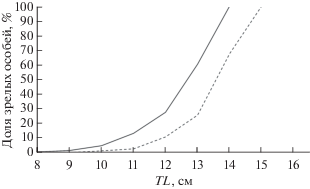
Темп роста и половое созревание. Линейный рост морского ерша характеризуется двумя выраженными этапами, связанными с половым созреванием. На первом этапе, протяжённостью два года, как у самцов, так и у самок происходит быстрый рост, близкий к экспоненциальному; величина абсолютных приростов на первом году жизни составляет 8.0−8.5 см, на втором − 4.0−4.5 см (рис. 4). При достижении TL 8.0 см начинают созревать первые самцы, при TL 14.0 см, к 3−4 годам, заканчивают созревание 90% особей мужского пола (рис. 5), 50% самцов созревают при TL 13.0 см в возрасте 2−3 лет. В этом возрасте наступает замедление роста, знаменуя начало второго этапа, когда ежегодный прирост не превышает 1.5 см и постепенно снижается; на 6−7-м году жизни рост фактически останавливается. Созревание первых самок начинается в возрасте 2 лет при TL 10.3 см, однако более растянуто во времени, чем у самцов: заканчивается в 4−5 лет при TL 15.4 см, 50% самок созревают в возрасте 3−4 года при TL 13.9 см. В этот период начинается второй этап, для которого характерно замедление линейного роста до 1−2 см в год. Последующий рост самок замедляется не так выраженно, как у самцов, в результате чего они достигают больших размеров к концу жизненного цикла.
Рис. 4.
Темп роста самок и самцов морского ерша Scorpaena porcus из прибрежных вод Юго-Западного Крыма, по наблюдённым данным; (I) − доверительный интервал (p = 0.95); ост. обозначения см. на рис. 2.
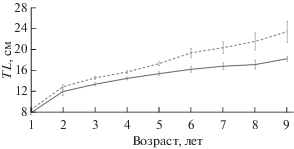
Рис. 5.
Темп полового созревания самок и самцов морского ерша Scorpaena porcus из прибрежных вод Юго-Западного Крыма; обозначения см. на рис. 2.
Зависимость массы от длины хорошо аппроксимируется (R2 > 0.90) следующими уравнениями: самки − W = 0.013TL3.13, самцы − W = 0.024TL2.88. Большее значение показателя степени у самок свидетельствует о более высоком темпе роста массы, что хорошо согласуется с большей интенсивностью генеративного роста по сравнению с самцами.
Результаты анализа рекуррентных зависимостей свидетельствуют о том, что эмпирическая кривая роста достоверно описывается уравнением Берталанфи: самки − L(t +1) = 0.83Lt + 4.68 (R2 = 0.96), самцы − L(t +1) = 0.66Lt + 6.12 (R2 = 0.94). В частности, об этом говорит высокая достоверность аппроксимации (эмпирические значения длины лежат близко к аппроксимирующей прямой) и значения функций в точке пересечения с прямой (L(t +1)= Lt), которые у самок (26.8 см) и самцов (17.9 см) близки к расчётным L∞ (таблица). При большем значении L∞ и W∞ по сравнению с самцами для самок характерно меньшее значение k. Согласно модели, самки достигают 80% предельной длины (L∞ = 19.4 см) в возрасте 6 лет, в то время как самцы (L∞ = 13.7 см) – в 3 года. За счёт значительно большего значения k у самцов межполовые различия индексов линейного (φ) и весового роста (φ′) выражены несущественно. В то же время при сравнении расчётных значений TL самцы характеризуются более низким темпом роста после достижения половой зрелости.
Параметры уравнения Берталанфи и индексы роста морского ерша Scorpaena porcus из Чёрного, Мраморного и Средиземного морей
| Регион | Пол | L∞, см | k, год–1 | W∞, г | b | t0, год | φ | φ′ | Источник информации |
|---|---|---|---|---|---|---|---|---|---|
| Чёрное море, Юго-Западный Крым | Самки | 24.2 | 0.24 | 274 | 3.13 | –0.72 | 2.15 | 1.01 | Наши данные |
| Самцы | 17.1 | 0.47 | 86 | 2.88 | –0.24 | 2.14 | 0.96 | ||
| Оба пола | 19.8 | 0.35 | 175 | 3.03 | –0.48 | 2.14 | 1.04 | ||
| Мраморное море | Самки | 22.2 | 0.20 | – | – | –0.83 | 1.99 | – | Ünsal, Oral, 1996 |
| Самцы | 17.2 | 0.26 | – | – | –0.88 | 1.82 | – | ||
| Оба пола | 24.4 | 0.16 | – | – | –1.19 | 1.98 | – | ||
| Средиземное море, зал. Габес | Самки | 21.9 | 0.17 | – | – | – | 1.92 | – | Bradai, Bouain, 1988 |
| Самцы | 18.2 | 0.20 | – | – | – | 1.82 | – | ||
| Оба пола | 23.1 | 0.16 | – | – | – | 1.93 | – |
ОБСУЖДЕНИЕ
Размерно-возрастная структура популяции и групповой рост – биологические свойства, характеризующиеся высокой лабильностью и саморегулирующиеся в соответствии с наследственными факторами и условиями среды, которые определяют направление и интенсивность отбора (Шмальгаузен, 1961; Никольский, 1974; Шварц, 1980). В этой связи допустимо предположить, что в условиях Чёрного моря в целом и у юго-западного побережья Крыма, в частности, формируются и закрепляются соответствующие этим условиям биологические особенности морского ерша.
У исследуемой группировки морского ерша выявлены межполовые различия по темпу роста. При отсутствии различий в возрастном составе самки достоверно крупнее самцов и растут быстрее после полового созревания. В литературе имеются сведения и о различиях по ряду морфометрических признаков (Manilo, Peskov, 2016). Межполовые различия размеров и роста характерны также для морского ерша из Синопского залива Чёрного моря (Bilgin, Çelik, 2009), Мраморного моря (Ünsal, Oral, 1996) и зал. Габес Средиземного моря (Bradai, Bouain, 1988), однако выражены они в меньшей степени (таблица). Имеются данные о межполовых различиях некоторых морфометрических индексов морского ерша из восточной части Адриатического моря (Ferri et al., 2010), но сведения о росте и популяционных характеристиках приводятся, как правило, без дифференциации по полу в связи с их несущественными различиями (Jardas, Pallaoro, 1992; Mesa et al., 2010).
По всей видимости, развитие межполовых различий в северном направлении обусловлено температурными условиями и может иметь адаптивное значение. Поскольку морской ерш является теплолюбивым видом, принадлежащим к средиземноморскому фаунистическому комплексу, температурные условия северной части Чёрного моря накладывают ограничения как на скорость метаболических процессов, непосредственно влияющих на рост, так и на продолжительность нагульного периода. Развитие половой разнокачественности в таких условиях способствует уменьшению внутривидовой конкуренции и обеспечивает самок бóльшим количеством пищевых ресурсов, необходимых для генеративного роста и поддержания воспроизводительной способности популяции на оптимальном уровне.
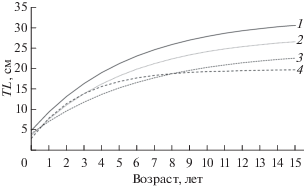
При сравнении теоретических кривых роста морского ерша из разных участков ареала (рис. 6) видно, что в прибрежной акватории Крыма он характеризуется самым низким темпом линейного роста, хотя на ранних этапах онтогенеза его рост сопоставим с наиболее быстрорастущими представителями из Лигурийского и Адриатического морей. Примечательно, что в водах Юго-Западного Крыма ёрш достигает половой зрелости в том же возрасте, что и особи из других участков ареала, но при меньшей длине. Например, в Синопском заливе Черного моря 50% самок и самцов созревают при TL 16.7−17.5 см (Bilgin, Çelik, 2009), в то время как в исследуемой акватории – при TL 13.0−14.0 см. Наиболее правдоподобным объяснением наблюдаемых закономерностей географической изменчивости роста и созревания морского ерша является воздействие гидрометеорологических факторов и, прежде всего, термического режима. Динамика среднегодовых значений температуры поверхностного слоя воды обнаруживает тенденцию снижения при продвижении от Лигурийского моря к Чёрному с 18.2 до 15.4°C, в то время как внутригодовая разница температуры, характеризующая континентальность климата, закономерно растёт с 11.1 до 17.1°C (World Sea Temperature, 2019). Это хорошо согласуется со снижением темпа роста морского ерша в рассматриваемом направлении.
Рис. 6.
Кривые роста (TL) морского ерша Scorpaena porcus из разных участков ареала, смоделированные с помощью уравненений Берталанфи: 1 – Лигурийское море (Silvestri et al., 2002), 2 – Адриатическое море (Mesa et al., 2010), 3 – Мраморное море (Ünsal, Oral, 1996), 4 – Чёрное море, акватория Юго-Западного Крыма (наши данные).
Уменьшение солёности, по всей видимости, не является первостепенным фактором, поскольку для морского ерша характерен широкий диапазон оптимальных значений данного показателя (Hureau, Litvinenko, 1986). В пользу этого предположения свидетельствует и тот факт, что в Синопском заливе морской ёрш растет быстрее, чем в районе Крыма, хотя солёность акваторий сопоставима и составляет ~ 18‰ (Bilgin, Çelik, 2009).
В качестве основной причины замедленного роста некоторых средиземноморских рыб в Чёрном море Алеев (1956) указывает резко выраженную континентальность термического режима. У морского ерша во время значительного понижения температуры воды в зимний период снижается интенсивность питания и замедляется рост. Кроме того, к паузам в росте приводят и выраженные сезонные колебания температуры, когда происходят метаболические перестройки.
У многих видов рыб замедление роста у северных границ ареала сопровождается более поздним созреванием (Никольский, 1974), что выражается в увеличении значений L∞, при снижении k в уравнении Берталанфи. Однако у морского ерша из исследуемого района это не наблюдается в связи с уменьшением длины, при которой наступает половое созревание; при этом, наоборот, уменьшается L∞ и увеличивается k по сравнению с родственными группировками.
В качестве ещё одной возможной причины низкого темпа роста морского ерша в исследуемой акватории следует отметить практически полное отсутствие естественных врагов и селективного промысла, обеспечивающих отбор быстрорастущих особей (Алтухов, 2001).
Для лучшего понимания особенностей биологии морского ерша Чёрного моря необходимо изучить группировки прибрежных акваторий Кавказа и Болгарии. Слабоизученными остаются вопросы воспроизводства и обеспеченности пищей.
Список литературы
Алеев Ю.Г. 1956. О некоторых закономерностях роста рыб // Вопр. ихтиологии. Вып. 6. С. 76−95.
Алтухов Ю.П. 2001. Генетические последствия селективного рыболовства и рыбоводства // Вопр. рыболовства. Т. 2. № 4 (8). С. 562−603.
Виноградов А.К., Богатова Ю.И., Синегуб И.А. и др. 2017. Экологические закономерности распределения морской прибрежной ихтиофауны (Черноморско-Азовский бассейн). Одесса: Астропринт, 416 с.
Кузьминова Н.С. 2006. Оценка токсического действия хозяйственно-бытовых сточных вод на морские организмы: Автореф. дис. … канд. биол. наук. М.: МГУ, 23 с.
Мина М.В., Клевезаль Г.А. 1976. Рост животных. М.: Наука, 291 с.
Никольский Г.В. 1974. Теория динамики стада рыб. М.: Пищ. пром-сть, 448 с.
Пашков А.Н., Шевченко Н.Ф., Овен Л.С. и др. 1999. Распределение, численность и основные популяционные характеристики морского ерша Scorpaena porcus в условиях антропогенного загрязнения Чёрного моря // Вопр. ихтиологии. Т. 39. № 5. С. 661–668.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 391 с.
Рикер У.Е. 1979. Методы оценки и интерпретации биологических показателей популяций рыб. М.: Пищ. пром-сть, 408 с.
Руднева И.И., Жерко Н.В. 2000. Действие полихлорированных бифенилов на антиоксидантную систему и перекисное окисление липидов в гонадах черноморской скорпены Scorpaena porcus // Экология. № 1. С. 70–73.
Руднева И.И., Скуратовская Е.Н., Дорохова И.И. и др. 2011. Биоиндикация экологического состояния морских акваторий с помощью биомаркеров рыб // Вод. ресурсы. Т. 38. № 1. С. 92–97. https://doi.org/10.1134/S0097807811010106
Световидов А.Н. 1964. Рыбы Черного моря. М.: Наука, 550 с.
Скуратовская Е.Н. 2009. Состояние антиоксидантной ферментной системы крови черноморских рыб в условиях комплексного хронического загрязнения: Автореф. дис. … канд. биол. наук. Севастополь: ИнБЮМ НАНУ, 24 с.
Шварц С.С. 1980. Экологические закономерности эволюции. М.: Наука, 278 с.
Шмальгаузен И.И. 1961. Интеграция биологических систем и их саморегуляция // Бюл. МОИП. Отд. биол. Вып. 2. С. 32−38.
Bertalanffy L. Von. 1938. A quantitative theory of organic growth (Inquiries on growth laws II) // Human Biol. V. 10. P. 181−213.
Bilgin S., Çelik E.S. 2009. Age, growth and reproduction of the black scorpionfish, Scorpaena porcus (Pisces, Scorpaenidae), on the Black Sea coast of Turkey // J. Appl. Ichthyol. V. 25. P. 55−60. https://doi.org/10.1111/j.1439-0426.2008.01157.x
Bradai N., Bouain A. 1988. Age et croissance de Scorpaena porcus et Scorpaena scrofa du golfe de Gabes // Bull. Inst. Nat. Sci. Tech. Océanogr. Pêche Salammbô. V. 15. P. 13−38.
Ferri J., Petric M., Matic-Skoko S. 2010. Biometry analysis of the black scorpionfish, Scorpaena porcus (Linnaeus, 1758) from the eastern Adriatic Sea // Acta Adriat. V. 51. № 1. P. 45−53.
Ford E. 1933. An account of the herring investigations conducted at Plymouth during the years from 1924−1933 // J. Mar. Biol. Assoc. UK. V. 19. P. 305−381.
World Sea Temperature. 2019. (https://www.seatemperature.org/mediterranean-sea. Version 01/2019)
Holden M.J., Raitt D.F.S. 1975. Method of resource investigations and their application // Manual of fisheries science. FAO Fish. Tech. Pap. V. 115. P. 1−214.
Hureau J.C., Litvinenko N.I. 1986. Scorpaenidae // Fishes of the North-eastern Atlantic and the Mediterranean. V. 3. Paris: UNESCO. P. 1211−1229.
Jardas I., Pallaoro A. 1992. Age and growth of black scorpionfish, Scorpaena porcus L., 1758 in the Adriatic Sea // Rapp. Comm. Int. Mer Médit. V. 33. P. 296.
Manilo L.G., Peskov V.N. 2016. Comparative morphometric analysis of the smallscaled scorpionfish, Scorpaena porcus (Scorpaenidae, Scorpaeniformes), from the southern coast of the Crimea and eastern part of the Adriatic Sea // Vestnik Zoologii. V. 50. № 6. P. 533−538. https://doi.org/10.1515/vzoo-2016-0060
Mesa M., Scarcella G., Grati F. et al. 2010. Age and growth of the black scorpionfish, Scorpaena porcus (Pisces: Scorpaenidae) from artificial structures and natural reefs in the Adriatic Sea // Sci. Mar. V. 74. № 4. P. 677–685. https://doi.org/10.3989/scimar.2010.74n4677
Pauly D., Moreau J., Prein M. 1988. A comparison of overall growth performance of tilapia in open waters and aquaculture // Proc. 2-nd Int. Symp. Tilapia in Aquaculture. Bangkok, Manila. P. 469–479.
Silvestri R., Voliani A., Zucchi A. 2002. Nota sulla biologia di Scorpaena porcus Linneo, 1758 nel Mar Ligure meridionale // Biol. Mar. Medit. V. 9. P. 813−817.
Ünsal N., Oral M. 1996. A study on the growth and reproduction of black scorpionfish (Scorpaena porcus Linnaeus, 1758) in the Sea of Marmara // Turk. J. Zool. V. 20. P. 303−308.
Walford L.A. 1946. A new graphic method of describing the growth of animals // Biol. Bull. V. 90. № 2. P. 141−147.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии