Вопросы ихтиологии, 2020, T. 60, № 5, стр. 552-561
Предварительная оценка состояния запаса атлантической пеламиды Sarda sarda северо-восточной части Атлантического океана
Н. Г. Петухова *
Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии − ВНИРО
Москва, Россия
* E-mail: ng_petukhova@mail.ru
Поступила в редакцию 10.02.2020
После доработки 10.03.2020
Принята к публикации 24.03.2020
Аннотация
На основе отечественных промыслово-биологических данных предпринята попытка оценить состояние запаса атлантической пеламиды Sarda sarda северо-восточной части Атлантического океана с применением метода оценки коэффициента нерестового потенциала (Length based spawning potential ratio – LBSPR). Рассчитаны значения параметров уравнения Берталанфи для атлантической пеламиды: теоретическая предельная длина особи равна 75.6 см, коэффициент роста – 0.41. Значения длины, при которой доля половозрелых особей в уловах составила 50 и 95%, равны соответственно 44.7 и 57.0 см. Полученная оценка коэффициента нерестового потенциала (0.28) меньше биологического целевого ориентира (0.40) и формально свидетельствует о состоянии перелова запаса.
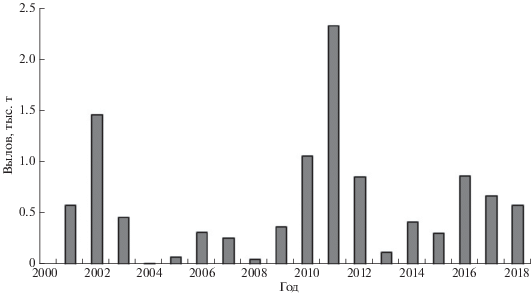
В мировых уловах атлантическая пеламида Sarda sarda составляет наибольшую долю среди остальных представителей малых тунцов11 (рис. 1). Вид является объектом промышленного и кустарного промысла прибрежных государств (Булатов и др., 2019). Отечественный специализированный промысел атлантической пеламиды не ведётся, хотя этот вид встречается в качестве прилова при траловом лове мелких пелагических видов рыб (западноафриканской ставриды Trachurus trecae, скумбрии Scomber colias, круглой сардинеллы Sardinella aurita и др.) в основном в водах Марокко, Мавритании и Сенегала (Нестеров и др., 2017). Прилов пеламиды Россией колебался от 16 т в 2004 г. до 2293 т в 2011 г. (рис. 2).
Рис. 1.
Динамика мировых уловов малых тунцов в 2000−2018 гг., по данным ICCAT (International Comission for the Conservation of Atlantic Tunas: www.iccat.int/en/accesingdb.html. Version 11/2019): 1 − атлантическая пеламида Sarda sarda, 2 − пятнистый тунец Euthynnus alletteratus, 3– макрелевый тунец Auxis thazard, 4 − королевская макрель Scomberomorus cavalla, 5 – золотистая макрель Coryphaena hippurus, 6 – прочие виды (чернопёрый тунец Thunnus atlanticus, скумбриевидный тунец Auxis rochei, одноцветный бонито Orcynopsis unicolor, колючая пеламида Acanthocybium solandri и макрели: бразильская Scomberomorus brasiliensis, западноафриканская S. tritor, испанская пятнистая S. maculatus, западноатлантическая королевская S. regalis).
В настоящее время ИККАТ не регламентирует промысел атлантической пеламиды, как и других представителей группы “малые тунцы”, но не исключает возможность регулирования эксплуатации запасов странами-участницами Комиссии в зоне их юрисдикции. Причиной этому являются определённые сложности, возникающие при оценке состояния запасов вследствие неполноты данных официальной промысловой статистики и недостаточности биологических исследований. В связи с большими пропусками данных о промысловых усилиях в базе данных ИККАТ доступное информационное обеспечение атлантической пеламиды северо-восточной части Атлантического океана не позволяет использовать традиционные модели динамики численности для оценки состояния её запасов.
Рабочая группа ИККАТ по малым тунцам занимается сбором и обобщением оценок параметров их жизненного цикла, полученных по результатам исследований стран-участниц Комиссии, для перехода к оценке запасов отдельных их видов. В связи с тем, что атлантическая пеламида входит в перечень приоритетных видов для дальнейших исследований Рабочей группы (Report …, 2019), в последние годы были предприняты попытки оценить состояние её запасов немодельными методами (Data Limited Methods – DLM) (Baibbat et al., 2015, 2019; Pons et al., 2019).
Цель работы − оценить состояние запаса атлантической пеламиды северо-восточной части Атлантического океана на основе данных, собранных при проведении ресурсных исследований Атлантического филиала ВНИРО (АтлантНИРО) вдоль западного побережья Африки, где этот вид встречался в прилове. Результаты данного исследования планируется представить на рассмотрение Рабочей группе ИККАТ по малым тунцам.
МАТЕРИАЛ И МЕТОДИКА
Материалами для настоящей работы послужили предоставленные автору данные АтлантНИРО, полученные в ходе ресурсных исследований в 2010−2018 г.; они включают дату и район вылова, размерный состав и стадию половой зрелости особей. Всего за этот период было выловлено 5634 экз. атлантической пеламиды. У всех рыб измерена общая длина (TL), из них у 1923 экз. определена также длина по Смитту (FL). В практике исследований ИККАТ принято использовать данные длины по Смитту. По результатам регрессионного анализа в Statistica 8.0: FL = 0.931 TL. В настоящей работе во всех расчётах использована длина по Смитту.
Параметры линейного роста уравнения Берталанфи (Bertalanffy, 1964) для атлантической пеламиды получены с использованием пакета TropFishR ver. 1.6.1 (Mildenberger et al., 2017) в программной среде R. Данный пакет позволяет применить анализ распределения значений длины (Electronic length frequency analysis − ELEFAN) исследуемого объекта (Pauly, Gaschuetz, 1979; Pauly, 1987) для оценки теоретической предельной длины особи (L∞) и коэффициента роста (k). Преимуществом метода является возможность оценить эти параметры при отсутствии данных по возрасту, что характерно для многих запасов малых тунцов, в том числе и для атлантической пеламиды.
Входными данными для процедуры ELEFAN послужила информация о длине выловленных особей в мае, августе, ноябре 2017 г., а также в августе и ноябре 2018 г. Условиями использования ELEFAN помимо прочих являются: 1) объём выборки, полученной за 1 мес., не менее 50 рыб; 2) равный период между выловами исследуемых особей. Для соблюдения этих условий в последующем анализе были использованы выборки, численность которых составила >50 экз., а также были заимствованы данные, полученные в феврале 2015 г. и в феврале и мае 2016 г.
Огива созревания атлантической пеламиды построена на предположении о логистической зависимости с помощью обобщённой линейной модели, реализованной в пакете FSA ver. 0.8.24 (Ogle, 2013; Ogle et al., 2018). Входная информация для построения кривой включала дату вылова, длину, а также стадию и состояние половой зрелости рыб (“зрелый” или “не зрелый” в соответствии с Методическим пособием АтлантНИРО (Алексеев, Алексеева, 1996)) для каждой особи.
Мгновенный коэффициент естественной смертности (M) атлантической пеламиды рассчитан несколькими методами (Рихтер, Ефанов, 1977; Hoenig, 1983; Jensen, 1996; Then et al., 2015). Поскольку оценки возраста рыб отсутствуют, значение предельного возраста атлантической пеламиды северо-восточной части Атлантического океана, используемое в некоторых методах определения мгновенного коэффициента естественной смертности, заимствовано из опубликованных данных (Cayré et al., 1993; Baibbat et al., 2016). Итоговая оценка коэффициента получена путём осреднения результирующих значений.
Краткое описание метода оценки запаса. Анализ состояния запаса атлантической пеламиды выполнен с помощью метода оценки коэффициента нерестового потенциала (Length based spawning potential ratio − LBSPR). Метод относится к III уровню информационного обеспечения расчётов, поскольку в данном подходе используется только биологическая информация (Бабаян и др., 2018).
В области оценки запасов дефицит необходимых знаний об объекте исследования частично восполняется различными гипотезами, которые не только упрощают, но и в какой-то степени идеализируют запас (Бабаян, 2015). Методология LBSPR не является исключением, поэтому в основе его использования также лежит ряд допущений: (Hordyk et al., 2015b): 1) селективность орудий лова описывается асимптотической кривой; 2) рост гидробионтов описывается уравнением Берталанфи; 3) кривая роста одинакова для обоих полов; 4) длина особей в возрасте t имеет нормальное распределение; 5) коэффициент естественной смертности остаётся неизменным для всех возрастных и размерных классов; 6) пополнение является постоянной величиной; 7) темп роста является одинаковым для всех поколений и не меняется со временем.
Данный подход позволяет получить ориентировочную оценку состояния запаса на основе анализа размерного состава уловов и оценки коэффициента нерестового потенциала (Spawning potential ratio – SPR). В международной практике оценки запасов с бедным информационным обеспечением SPR используется в качестве биологического ориентира и отражает изменение общей потенциальной продуктивности популяции, связанное с промысловым изъятием гидробионтов. Значение коэффициента, равное 40% (или 0.4), используется как альтернатива целевого ориентира BMSY (величины биомассы запаса, соответствующей максимальному устойчивому улову) в случаях, когда информация о величине запаса недоступна (Mace, Sissenwine, 1993; Brooks et al., 2010). Стратегия промысла, нацеленная на уровень промысловой смертности, соответствующий SPR 40%, считается эффективной даже для запасов с очень низкой устойчивостью к внешним воздействиям (Clark, 2002).
При SPR < 40% запасы сохраняют способность восполнять свою численность под влиянием промысла, хотя скорость восстановления может существенно снижаться. Значения SPR могут также служить граничными ориентирами. Например, при SPR = 20% запас сохраняет свою численность на текущем уровне с минимальными возможностями для её восстановления. При SPR < 20% в последующие годы эксплуатации ожидается снижение пополнения запаса, а при SPR = 10% нерестовый потенциал считается подорванным. В этой ситуации численность запаса может быстро сократиться и, если своевременно не предпринять меры по управлению промыслом, ситуация может привести к исчезновению эксплуатируемой единицы запаса (Prince et al., 2019).
Величина нерестового потенциала естественным образом зависит от минимального размера вылавливаемых рыб. Если большинство особей вылавливается до достижения половой зрелости, то SPR будет стремиться к нулю. Напротив, при крайне слабом промысловом прессе рыбы будут дорастать приблизительно до теоретического предельного размера (L∞). В этом случае SPR будет стремиться к 100%, так как этому значению соответствует состояние неэксплуатируемых запасов. Метод LBSPR позволяет на основе информации о размерном составе уловов и длине, при которой происходит половое созревание рыб, рассчитать значение SPR и соотношение промысловой и естественной смертности (F/M) (Prince et al., 2019). Результаты сопоставления теоретического равновесного размерного распределения с реально наблюдаемым позволяют получить оценку соотношения F/M и параметров кривой селективности.
Величина SPR рассчитывается как (Hordyk et al., 2015a):
Алгоритм метода LBSPR реализован в пакетах DLMTools и LBSPR в программной среде R. Также применить описанную методологию можно в интерактивных приложениях LBSPR и Simulation Tool на онлайн платформе The Barefoot Ecologist’s Toolbox (Prince et al., 2015b), с помощью которых выполнен анализ состояния запаса атлантической пеламиды в настоящей работе.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оценка параметров жизненного цикла атлантической пеламиды
В литературе имеется множество свидетельств того, что рост атлантической пеламиды достаточно хорошо описывается уравнением Берталанфи (Dardignac, 1962; Rey et al., 1986; Hansen, 1989; Cayré et al., 1993; Santamaria et al., 1998; Zaboukas, Megalofonou, 2007; Ateş et al., 2008; Valeiras et al., 2008; Cengiz, 2013, Yankova, 2015; Baibbat et al., 2016; Kotsiri et al., 2018). Несмотря на то что в силу биологических особенностей пеламиды оценить её возраст достаточно сложно, в некоторых работах всё же приводится размерно-возрастной ключ, благодаря которому оценки параметров уравнения Берталанфи могут считаться более реалистичными. Результаты перечисленных работ дают основание полагать, что рост атлантической пеламиды северо-восточной части Атлантического океана также может быть описан уравнением Берталанфи.
По данным Сениной (1986), двухлетки пеламиды в исследуемом районе в 1980-е гг. достигали FL 32−41 см, а трёхлетки – 53−57 см; кроме того отмечено, что в уловах встречались особи FL 80 см. В последнее десятилетие максимальная зарегистрированная в уловах АтлантНИРО длина пеламиды составила 72.5 см. Отсутствие более крупных особей в уловах можно объяснить либо их способностью избегать попадание в тралы, либо изменением темпа роста пеламиды как следствие адаптации к промысловой нагрузке или каким-либо факторам природного происхождения. Вероятно, в силу этих причин ориентировочные оценки длины возрастных классов, полученные в настоящем исследовании, немного ниже полученных в 1980-е гг. (рис. 3).
Рис. 3.
Кривые роста (· · ·) поколений атлантической пеламиды Sarda sarda, построенные в пакете TropFishR: (◼) − восстановленные частотности длины с положительными значениями, (◻) – то же с отрицательными значениями, 1−5 – возраст, годы.
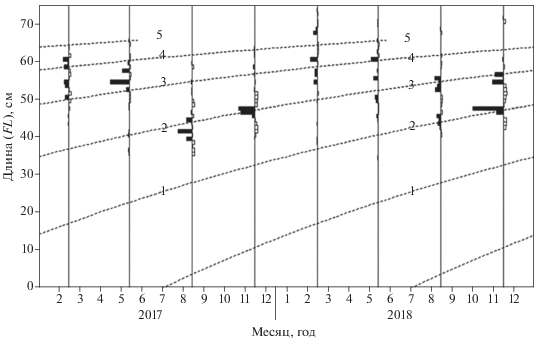
Параметры уравнения Берталанфи, полученные с помощью ELEFAN, составили: L∞ = 75.6 см, k = 0.41. Следует отметить, что рассчитанные значения параметров роста пеламиды не противоречат литературным данным и достаточно хорошо вписываются в диапазоны значений, установленные ранее в разных частях её ареала (табл. 1). Вероятно, небольшие различия в оценках параметров роста пеламиды между разными районами могут быть вызваны различиями условий окружающей среды (температура и солёность воды, кормовая база и др.), селективности орудий лова, числа особей в исследуемых выборках, методах оценки параметров и ряда других факторов.
Таблица 1.
Параметры уравнения Берталанфи атлантической пеламиды Sarda sarda из разных частей ареала
| Район исследования | L∞, см | k, год–1 | Источник информации |
|---|---|---|---|
| Чёрное море (воды Турции) | 81.5 | 0.52 | Nikolsky, 1957 |
| Средиземное море и северо-восточная часть Атлантического океана (воды Марокко) | 80.9 | 0.35 | Rey et al., 1986 |
| Ионическое море (воды Италии) | 80.6 | 0.36 | Santamaria et al., 1998 |
| Чёрное море (воды Болгарии) | 80.4 | 0.67 | Yankova, 2015 |
| Эгейское море и залив Патраикос | 79.9 | 0.26 | Kotsiri et al., 2018 |
| Северо-восточная часть Атлантического океана (воды Марокко) | 73 | 0.31 | Baibbat et al., 2016 |
| Северо-восточная часть Атлантического океана (воды Марокко и Мавритании) | 75.6 | 0.41 | Настоящая работа |
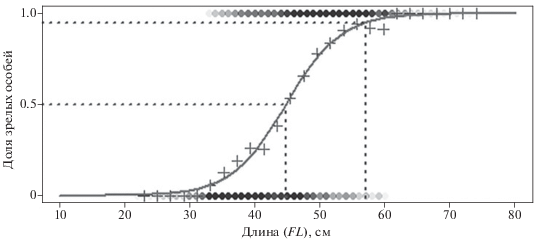
Длина, при которой созревают 50% особей (Lm50), составила 44.7 (доверительный интервал – 44.4−45.0) см; при которой созревают 95% особей (Lm95) – 57.0 (56.3−57.6) см. Полученные оценки являются общими для обоих полов (рис. 4).
Рис. 4.
Огива созревания атлантической пеламиды Sarda sarda: (+) – данные (общие для обоих полов), сгруппированные по размерным классам, цветная тональность точек сверху означает представительность данных о половозрелых особях, снизу – о неполовозрелых.
Найденные значения параметров роста использованы при расчёте мгновенного коэффициента естественной смертности разными методами (табл. 2). Итоговая оценка коэффициента является результатом осреднения полученных значений и равна 0.695 год–1. Такая величина характерна для короткоцикловых видов, к которым относится атлантическая пеламида (Бабаян, 1990).
Таблица 2.
Результаты расчёта мгновенного коэффициента естественной смертности атлантической пеламиды Sarda sarda с помощью разных методов
| № | Формула | Полученная оценка | Авторы метода |
|---|---|---|---|
| 1 | $M = {{3k} \mathord{\left/ {\vphantom {{3k} {\left[ {{\text{exp\;}}\left( {0.25k \times {{t}_{{{\text{max}}}}}} \right) - 1} \right]}}} \right. \kern-0em} {\left[ {{\text{exp\;}}\left( {0.25k \times {{t}_{{{\text{max}}}}}} \right) - 1} \right]}}$ | 0.787 | Рихтер, Ефанов, 1977 |
| 2 | $M = {\text{exp}}\left( {1.44 - 0.982 \times \ln \left( {{{t}_{{{\text{max}}}}}} \right)} \right)$ | 0.869 | Hoenig, 1983 |
| 3 | $M = 1.5 \times k$ | 0.615 | Jensen, 1996 |
| 4 | $M = 4.118 \times {{k}^{{0.73}}} \times L_{\infty }^{{ - 0.333}}$ | 0.509 | Then et al., 2015 |
| Среднее значение | 0.695 |
Примечание. M – мгновенный коэффициент естественной смертности, tmax – максимальный возраст; ост. обозначения см. в табл. 1.
Полученные оценки параметров жизненного цикла атлантической пеламиды, использованные в анализе состояния запаса, в целом близки к значениям аналогичных параметров, применяемых при оценке запаса этого вида странами-участницами ИККАТ (табл. 3).
Таблица 3.
Параметры жизненного цикла атлантической пеламиды Sarda sarda, используемые для оценки её запаса в северо-восточной части Атлантического океана
| Показатель | Полученные оценки | Источник информации | |
|---|---|---|---|
| настоящая работа | данные литературы | ||
| Максимальная длина (FL), см | 72.5 | 80.0 | Сенина, 1986 |
| Теоретическая предельная длина (L∞), см | 75.6 | 73.0 | Baibbat et al., 2016 |
| Коэффициент роста (k), год–1 | 0.41 | 0.31 | Тот же |
| Длина (FL, см), при которой созревают: | |||
| – 50% особей (Lm50) | 44.7 | 42.6 | » |
| – 95% особей (Lm95) | 57.0 | н.д. | |
| Максимальный возраст (tmax ), годы | н.д. | 5 | Cayré et al., 1993 |
| Мгновенный коэффициент естественной смертности (M), год–1 | 0.695 | 0.430, 0.780, 1.110 | Pons et al., 2019 |
Оценка состояния запаса
В связи с тем что сведений о биологических и экологических особенностях атлантической пеламиды мало, а данные по таким показателям, как возраст и численность рыб, и вовсе отсутствуют, при проведении анализа принято, что коэффициент естественной смертности, темп роста рыб и величина пополнения запаса остаются неизменными на протяжении всего периода исследования. Кроме того, продолжительность рассматриваемого периода не столь велика, чтобы можно было ожидать значительных изменений параметров жизненного цикла пеламиды.
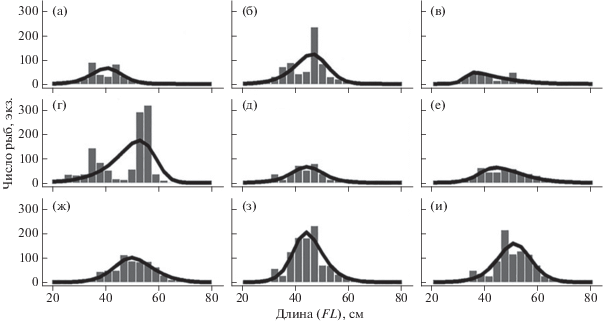
Анализ размерного состава пеламиды в разные годы рассматриваемого периода показал, что в составе улова преобладают особи FL 30−60 см (рис. 5). Минимальная зарегистрированная длина рыб за весь период исследования составила 22.3 см, максимальная – 72.5 см. Ввиду того, что в 2010 и 2012 гг. отмечено асимметричное, а в 2013 г. – бимодальное распределение рыб по длине (что не соответствует требованиям метода LBSPR), в дальнейшем анализе размерного состава использованы данные за 2014−2018 гг.
Рис. 5.
Размерный состав уловов атлантической пеламиды Sarda sarda в разные годы: а – 2010, б – 2011, в – 2012, г – 2013, д – 2014, е – 2015, ж – 2016, з – 2017, и – 2018.
Для сравнения минимального размера выловленных рыб с длиной, при которой они достигают половой зрелости, были построены кривые селективности орудий лова, в которые попадалась атлантическая пеламида, а также рассчитаны значения длины, при которых доступными для орудий лова являются соответственно 50 и 95% облавливаемого скопления рыб. Как видно из рис. 6, огива созревания пеламиды и кривые селективности не совпадают. Расположение кривых селективности левее кривой половозрелости свидетельствует о том, что в большинстве случаев тралами изымались особи, не достигшие половой зрелости. Значения коэффициентов нерестового потенциала, параметров селективности орудий лова и соотношения мгновенных коэффициентов промысловой и естественной смертности представлены в табл. 4.
Рис. 6.
Огива созревания атлантической пеламиды Sarda sarda (1) и кривые селективности разноглубинных тралов в 2014−2018 гг.: 2 – 2014; 3 – 2015, 2016, 2017 (совпадают); 4 – 2018.
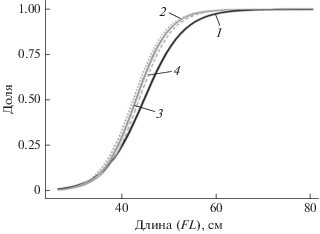
Таблица 4.
Индикаторы состояния запаса атлантической пеламиды Sarda sarda северо-восточной части Атлантического океана
| Год | SPR | SL50, см | SL95, см | F/M |
|---|---|---|---|---|
| 2014 | $\frac{{0.15 \pm 0.045}}{{0.25}}$ | $\frac{{42.08 \pm 2.48}}{{42.39}}$ | $\frac{{53.02 \pm 3.62}}{{52.52}}$ | $\frac{{3.39 \pm 1.21}}{{2.16}}$ |
| 2015 | $\frac{{0.34 \pm 0.125}}{{0.27}}$ | $\frac{{38.34 \pm 3.68}}{{42.47}}$ | $\frac{{47.18 \pm 6.41}}{{52.52}}$ | $\frac{{0.96 \pm 0.49}}{{2.04}}$ |
| 2016 | $\frac{{0.42 \pm 0.070}}{{0.28}}$ | $\frac{{45.57 \pm 2.09}}{{42.95}}$ | $\frac{{56.33 \pm 3.21}}{{53.06}}$ | $\frac{{1.12 \pm 0.37}}{{2.02}}$ |
| 2017 | $\frac{{0.17 \pm 0.025}}{{0.28}}$ | $\frac{{40.37 \pm 0.92}}{{43.18}}$ | $\frac{{48.58 \pm 1.48}}{{53.27}}$ | $\frac{{2.46 \pm 0.40}}{{2.10}}$ |
| 2018 | $\frac{{0.31 \pm 0.055}}{{0.28}}$ | $\frac{{48.74 \pm 1.94}}{{43.68}}$ | $\frac{{60.72 \pm 2.75}}{{53.94}}$ | $\frac{{2.56 \pm 0.69}}{{2.14}}$ |
Примечание. SPR – коэффициент нерестового потенциала; SL50, SL95 – длина тела, при которой доступными для орудий лова являются соответственно 50 и 95% рыб; F – мгновенный коэффициент промысловой смертности; ост. обозначения см. в табл. 1, 2. Над чертой – точечные оценки и их доверительный интервал (р > 0.95), под чертой − оценки, сглаженные с помощью фильтра Калмана.
Метод LBSPR чувствителен к задаваемым значениям M, L∞ и k (Brooks et al., 2010; Hordyk et al., 2015b). В силу методологических проблем оценки коэффициента естественной смертности оказываются наименее надёжными. В этой связи метод LBSPR повторно был реализован при значениях М, определённых разными методами. Из представленных в табл. 5 результатов тестирования следует, что оценки SPR находятся в прямой зависимости от значений М, тем не менее все пять оценок SPR оказываются меньше целевого ориентира (0.4). Только при одном значении естественной смертности, рассчитанном по методу Хёнига (Hoenig, 1983), оценка SPR близка к ориентиру 0.4. Однако при таком значении коэффициента получено завышенное значение соотношения M/k (2.119), не соответствующее биологическим особенностям исследуемого вида.
Таблица 5.
Оценки коэффициента нерестового потенциала атлантической пеламиды Sarda sarda северо-восточной части Атлантического океана, полученные на основе разных значений мгновенного коэффициента естественной смертности
| Метод расчёта M | M | M/k | SPR* | F/M* | F |
|---|---|---|---|---|---|
| 1 | 0.787 | 1.919 | 0.33 | 1.79 | 1.40 |
| 2 | 0.869 | 2.119 | 0.38 | 1.53 | 1.32 |
| 3 | 0.615 | 1.500 | 0.24 | 2.54 | 1.56 |
| 4 | 0.509 | 1.241 | 0.18 | 3.26 | 1.65 |
| Среднее значение | 0.695 | 1.695 | 0.28 | 2.14 | 1.49 |
Примечание. * Приведены сглаженные оценки за 2018 г.; обозначения см. в табл. 1, 2, 4, нумерацию методов – в табл. 2.
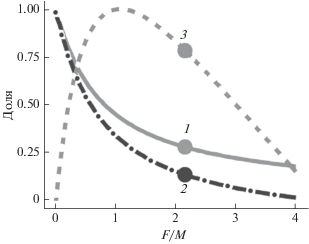
Отношение M/k характеризует возрастную/размерную динамику биомассы отдельных поколений гидробионтов (Holt, 1958). Виды с низким значением M/k (< 1) достигают максимальной длины тела в первые годы жизни, когда численность поколения всё ещё велика. Следовательно, пик биомассы наблюдается в раннем возрасте, после чего она снижается под действием естественной смертности. Обратная ситуация свойственна видам с высоким значением M/k (>2), для которых характерен непрерывный и относительно медленный рост в течение всего жизненного цикла. В этом случае больший вклад в общую биомассу вносят старшие особи, а пик биомассы поколения достигается в старших возрастах (Hordyk et al., 2015a).
У атлантической пеламиды наиболее интенсивный рост наблюдается в первые два года жизни, после чего темп роста существенно замедляется (рис. 3). В этой связи значения M/k в диапазоне 1−2 представляются наиболее соответствующими биологическим особенностям пеламиды. Величина M/k (1.695), рассчитанная с использованием среднего значения M, хорошо согласуется со средней оценкой (1.88), полученной в работе Принса с соавторами (Prince et al., 2015a) для видов, для которых характерна оценка M/k слегка выше средней (1.5). Необходимо отметить, что в указанной работе оценки получены для необлавливаемых популяций.
Таким образом, финальная оценка SPR = 0.28, соответствующая M/k = 1.695, представляется наиболее правдоподобной. Имеющиеся в литературе оценки SPR − 0.23 (Pons et al., 2019) и 0.34 (Baibbat et al., 2019), полученные на основе данных по другим орудиям вылова, отличаются не намного. Все рассчитанные значения находятся ниже уровня целевого ориентира и формально свидетельствуют о состоянии перелова запаса атлантической пеламиды северо-восточной части Атлантического океана.
Результаты имитационного моделирования зависимости SPR, отношения нерестовой биомассы к девственной и относительного улова от промысловой нагрузки (F/M) свидетельствуют, что текущее значение SPR (0.28) не обеспечивает получение максимального возможного вылова (рис. 7). При этом промысловая нагрузка превышает оптимальную, что формально указывает на перелов запаса (Hilborn, 2017). Из результатов анализа следует, что в целях максимизации вылова текущее промысловое усилие должно быть сокращено примерно в два раза. Подобная мера приведёт к росту нерестовой биомассы и, соответственно, к росту коэффициента нерестового потенциала, тем самым способствуя восстановлению запаса. Возможная проблема, впрочем, может заключаться в том, что атлантическая пеламида является приловным видом, и прямые меры регулирования к ней малоприменимы. В связи с этим задача снижения промысловой нагрузки должна решаться опосредованно, за счёт перераспределения промысловых усилий во времени и пространстве или изменения селективных свойств орудий лова.
ЗАКЛЮЧЕНИЕ
В настоящей работе предпринята первая попытка оценить состояние запаса пеламиды северо-восточной части Атлантического океана на основе отечественных данных. Сходство полученных оценок параметров жизненного цикла пеламиды и коэффициента нерестового потенциала с данными литературы свидетельствуют о достаточной представительности российских данных. Имеющаяся первичная информация позволяет использовать только методы оценки запаса, относящиеся к категории немодельных (DLM). Применение подобных методов неизбежно связано с введением некоторых упрощающих предположений о популяционных свойствах анализируемого объекта. Весьма важно продолжать сбор биологических данных о пеламиде в рамках ресурсных исследований, а также при промысле мелких пелагических видов рыб в Атлантическом океане. Несмотря на то что определение возраста малых тунцов, в том числе и атлантической пеламиды, трудновыполнимо, данные по возрастному ключу упростили бы оценивание параметров жизненного цикла исследуемого вида. Это позволило бы расширить спектр применяемых в анализе методов и уточнить полученные в настоящей работе оценки.
Несмотря на дефицит исходной информации, использованный в работе метод LBSPR позволяет сформировать общее представление о состоянии запаса атлантической пеламиды при условии правдоподобности исходных допущений метода. Нарушение тех или иных допущений может приводить к смещённости итоговых оценок. Так, например, по данным Хордика с соавторами (Hordyk et al., 2015b), LBSPR слегка занижает оценку SPR для популяций, облавливаемых тралами или жаберными сетями, кривая селективности которых имеет куполообразную форму. Рассчитанное значение SPR (0.28) формально свидетельствует о перелове запаса и может быть немного заниженным, так как в основе работы лежат данные, полученные в ходе вылова атлантической пеламиды разноглубинными тралами. Однако это не меняет вывода о состоянии перелова запаса. Полученные, хоть и предварительные, результаты являются первым этапом в анализе состояния исследуемого запаса. По мере накопления необходимой информации планируется применять другие, более объективные, подходы к оценке его состояния.
Следует отметить, что рекомендации по регулированию промысловой нагрузки на запас пеламиды приведены в статье в качестве демонстрации возможностей приложения LBSPR и его практической значимости, так как в мировой практике на основе оценок SPR принимаются решения по дальнейшей эксплуатации запасов. В силу того, что пеламида вылавливается отечественными судами только в качестве прилова при промысле мелких пелагических видов рыб, реальные возможности сокращения промысловой нагрузки представляются весьма ограниченными.
Список литературы
Алексеев Ф.Е., Алексеева Е.И. 1996. Определение стадий зрелости гонад и изучение половых циклов, плодовитости, продукции икры и темпа полового созревания у морских промысловых рыб. Калининград: Изд-во АтлантНИРО, 75 с.
Бабаян В.К. 1990. Краткий словарь терминов долгосрочного прогнозирования (промысловые биопрогнозы). М.: Изд-во ВНИРО, 48 с.
Бабаян В.К. 2015. О некоторых особенностях математического моделирования в сырьевых рыбохозяйственных исследованиях // Вопр. рыболовства. Т. 16. № 4. С 428−439.
Бабаян В.К., Бобырев А.Е., Булгакова Т.И. и др. 2018. Методические рекомендации по оценке запасов приоритетных видов водных биологических ресурсов. М.: Изд-во ВНИРО, 312 с.
Булатов О.А., Бандурин К.В., Нестеров А.А., Михайлов А.И. 2019. Промысел и состояние запасов тунцов в зоне действия Комиссии ИККАТ // Вопр. рыболовства. Т. 20. № 4. С. 391−411.
Нестеров А.А., Гулюгин С.Ю., Фёдоров А.П. 2017. Прилов скумбриевых рыб (Scombridae) траулерами России в районе центрально-восточной Атлантики в 2012−2015 годах // Тр. АтлантНИРО. Нов. серия. Т. 1. № 1. С. 137−153.
Рихтер В.А., Ефанов В.Н. 1977. Об одном из подходов к оценке естественной смертности рыбных популяций // Тр. АтлантНИРО. Вып. LXXIII. С. 77–85.
Сенина И.Н. 1986. К биологии атлантической пеламиды в районе центрально-восточной Атлантики // Тез. докл. Всесоюз. совещ. по проблемам тунцового промысла. Калининград. С. 89−91.
Ateş C., Deval C.M., Bök T. 2008. Age and growth of Atlantic bonito (Sarda sarda Bloch, 1793) in the Sea of Marmara and Black Sea, Turkey // J. Appl. Ichthyol. V. 24. № 5. P. 546–550. https://doi.org/10.1111/j.1439-0426.2008.01102.x
Baibbat S., Abid N., Palma C., Kell L. 2015. A length based assessment for Atlantic bonito (Sarda sarda) // Collect. Vol. Sci. Pap. ICCAT. V. 72. № 8. P. 2208−2220.
Baibbat S., Malouli I., Abid N., Benazzouz B. 2016. Study of the reproduction of Atlantic bonito (Sarda sarda) in South Atlantic Ocean of Morocco // AACL Bioflux. V. 9. № 5. P. 954–964.
Baibbat S., Pons M., Chattou E.M.A., Abid N., Bensbai J., Houssa R. 2019. A length-based assessment for Atlantic bonito (Sarda sarda) exploited in the Moroccan Atlantic coast // Collect. Vol. Sci. Pap. ICCAT. V. 76. № 7. P. 174−180.
Bertalanffy L. 1964. Basic concepts in quantitative biology of metabolism // Helgoländer Wiss. Meeresunter. V. 9. P. 5−37. https://doi.org/10.1007/BF01610024
Brooks E.N., Powers J.E., Cortés E. 2010. Analytical reference points for age-structured models: application to data-poor fisheries // ICES J. Mar. Sci. V. 67. № 1. P. 165–175. https://doi.org/10.1093/icesjms/fsp225
Cayré P., Amon Kothias J.B., Diouf T., Stretta J.M. 1993. Biology of tuna // Resources, fishing and biology of the tropical tunas of the Eastern Central Atlantic / Eds. Fonteneau A., Marcille J. FAO Fish. Tech. Pap. № 292. Rome: FAO. P. 147−244.
Cengiz Ö. 2013. Some biological characteristics of Atlantic bonito (Sarda sarda Bloch, 1793) from Gallipoli Peninsula and Dardanelles (northeastern Mediterranean, Turkey) // Turkish J. Zool. V. 37. P. 73−83. https://doi.org/10.3906/zoo-1204-10
Clark W.G. 2002. F 35% revisited ten years later // N. Am. J. Fish. Manag. V. 22. P. 251–257.
Dardignac J. 1962. La bonite du Maroc Atlantique (Sarda sarda Bloch) // Rev. Trav. Inst. Pêches Marit. V. 26. № 4. P. 399–406.
Hansen J.E. 1989. Length growth of the bonito (Pisces, Scombridae, Sarda sarda) // Physis. V. 47. P. 13–19.
Hilborn R. 2017. A Quick Explanation of “Overfished”, “Fully fished” and “Overfishing”. (www.sustainablefisheries-uw.org/a-quick-explanation-of-overfished-fully-fished-and-overfishing/)
Hoenig J. 1983. Empirical use of longevity data to estimate mortality rates // Fish. Bull. № 81. P. 893–903.
Holt S.J. 1958. The evaluation of fisheries resources by the dynamic analysis of stocks, and notes on the time factors involved // ICNAF. Spec. Publ. № 1. P. 77– 95.
Hordyk A.R., Ono K., Sainsbury K.J. et al. 2015a. Some explorations of the life history ratios to describe length composition, spawning-per-recruit, and the spawning potential ratio // ICES J. Mar. Sci. V. 72. № 1. P. 204−216. https://doi.org/10.1093/icesjms/fst235
Hordyk A.R., Ono K., Valencia S.R. et al. 2015b. A novel length-based empirical estimation method of spawning potential ratio (SPR), and tests of its performance, for small-scale, data-poor fisheries // Ibid. V. 72. № 1. P. 217–231. https://doi.org/10.1093/icesjms/fsu004
ICCAT. 2019. Report of the standing committee on research and statistics. Madrid: ICCAT, 454 p.
Jensen A.L. 1996. Beverton and Holt life history invariants result from optimal trade-off of reproduction and survival // Can. J. Fish. Aquat. Sci. V. 53. P. 820−822. https://doi.org/10.1139/f95-233
Kotsiri M., Batjakas I.E., Megalofonou P. 2018. Age, growth and otolith morphometry of Atlantic bonito (Sarda sarda Block, 1793) from the eastern Mediterranean Sea // Acta Adriatica. V. 59. № 1. P. 97−10. https://doi.org/10.32582/aa.59.1.8
Mace P., Sissenwine M. 1993. How much spawning is enough? Risk evaluation and biological reference points for fisheries management // Can. Spec. Publ. Fish. Aquat. Sci. № 120. P. 101–118.
Mildenberger T.K., Taylor M.H., Wolff M. 2017. TropFishR: an R package for fisheries analysis with length-frequency data // Methods Ecol. Evol. V. 8. № 11. P. 1520−1527. https://doi.org/10.1111/2041-210X.12791
Nikolsky G.W. 1957. Spezielle Fischkunde. Berlin: Deutscher Verl. d. Wissenschaften. P. 45−51.
Ogle D.H. 2013. FishR Vignette – Maturity Schedules. (www.derekogle.com/fishR/examples/oldFishRVignettes/Maturity.pdf)
Ogle D.H., Wheeler P., Dinno A. 2018. FSA: Fisheries Stock Analysis. R package version 0.8.22.9000. (www.github.com/ droglenc/FSA)
Pauly D.A. 1987. Review of the ELEFAN system for analysis of length-frequency data in fish and aquatic invertebrates // ICLARM Conf. Proc. № 13. P. 7−34.
Pauly D., Gaschuetz G. 1979. A simple method for fitting oscillating length growth data, with a program for pocket calculators // ICES. CM 1979/G:24. 26 p.
Pons M., Kell L., Rudd M.B. et al. 2019. Performance of length-based data-limited methods in a multifleet context: application to small tunas, mackerels, and bonitos in the Atlantic Ocean // ICES J. Mar. Sci. V. 76. № 4. P. 960−973. https://doi.org/10.1093/icesjms/fsz004
Prince J., Hordyk A., Valencia S. R. et al. 2015a. Revisiting the concept of Beverton–Holt life-history invariants with the aim of informing data-poor fisheries assessment // Ibid. V. 72. № 1. P. 194– 203. https://doi.org/10.1093/icesjms/fsu011
Prince J.D., Victor S., Kloulchad V., Hordyk A.R. 2015b. Length based SPR assessment of eleven Indo-Pacific coral reef fish populations in Palau // Fish. Res. V. 171. P. 42−58. https://doi.org/10.1016/j.fishres.2015.06.008
Prince J.D., Lalavanua W., Tamanitoakula J. et al. 2019. Spawning potential surveys reveal an urgent need for effective management SPC // Fish. Newsletter. V. 158. P. 28−36.
Report of the 2019 ICCAT small tunas species group intersessional meeting. 2019 // Collect. Vol. Sci. Pap. ICCAT. V. 76. № 7. P. 1−80.
Rey J.C., Alot E., Ramos A. 1986. Growth of the Atlantic bonito (Sarda sarda Bloch, 1793) in the Atlantic and Mediterranean area of the Strait of Gibraltar // Inv. Pesq. V. 50. № 2. P. 179−185.
Santamaria N., Sion L., Cacucci M., De Metrio G. 1998. Età ed accrescimento di Sarda sarda (Bloch, 1973) (Pisces, Scombridae) nello Ionio settentrionale // Biol. Mar. Medit. V. 5. P. 721−725.
Then A.Y., Hoenig J.M., Hal N.G., Hewit D.A. 2015. Evaluating the predictive performance of empirical estimators of natural mortality rate using information on over 200 fish species // ICES J. Mar. Sci. V. 72. № 1. P. 82–92. https://doi.org/10.1093/icesjms/fsu136
Valeiras X., Macías D., Gómez M.J. et al. 2008. Age and growth of Atlantic bonito (Sarda sarda) in western Mediterranean Sea // Collect. Vol. Sci. Pap. ICCAT. V. 62. № 5. P. 1649–1658.
Yankova M.H. 2015. Contribution to the knowledge of Atlantic bonito (Sarda sarda Bloch, 1793) from Bulgarian Black Sea coast // Int. J. Fish. Aquat. Stud. V. 2. № 4. P. 213−217.
Zaboukas N., Megalofonou P. 2007. Age estimation of the Atlantic bonito in the eastern Mediterranean Sea using dorsal spines and validation of the method // Sci. Mar. V. 71. № 4. P. 691–698.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии