Вопросы ихтиологии, 2021, T. 61, № 3, стр. 264-272
Таксономический статус четырёх редких чужеродных видов рыб Капчагайского водохранилища (Балхашский бассейн, Центральная Азия)
Н. Ш. Мамилов 1, Т. Г. Конысбаев 1, И. Н. Магда 2, Е. Д. Васильева 3, *
1 Казахский национальный университет − КазНУ
Алма-Ата, Республика Казахстан
2 Институт общей генетики и цитологии − ИОГЦ
Алма-Ата, Республика Казахстан
3 Зоологический музей Московского государственного университета
Москва, Россия
* E-mail: vas_katerina@mail.ru
Поступила в редакцию 30.04.2020
После доработки 06.06.2020
Принята к публикации 08.06.2020
Аннотация
По морфологическим особенностям идентифицированы четыре редких в Капчагайском водохранилище чужеродных вида: Coregonus peled, Parasalmo mykiss, Megalobrama mantschuricus и Oreochromis niloticus. Два последних вида для ихтиофауны Казахстана указываются впервые. Самовоспроизводящиеся популяции P. mykiss известны в бассейне Балхаша с конца 1990-х гг., тогда как интродукция C. peled в бассейн Или в 1968−1969 и 1971 гг. не привела к натурализации вида. Рассматриваются причины большого разнообразия инвазионных видов рыб в Капчагайском водохранилище.
В настоящее время проблема биологических инвазий чужеродных видов стала одной из ключевых в исследованиях различных экосистем. Биологические инвазии признаны одной из основных угроз аборигенным видам и естественным экосистемам, поэтому в ихтиологии большое внимание уделяется вопросам, связанным с распространением рыб за пределы их естественных ареалов (Strayer, 2010; Ricciardi, MacIsaac, 2011; Larranaga et al., 2019). Изучение видов в новых условиях также помогает понять их адаптивные возможности (Горюнова, Серов, 1954; Карпевич, 1975).
Балхашский бассейн − крупная изолированная водная система Азии, где состав ихтиофауны коренным образом изменился во второй половине ХХ в. в результате запланированных и непреднамеренных вселений большого числа чужеродных видов (Митрофанов, Дукравец, 1992б; Терещенко, Стрельников, 1995). Проникновение новых инвазионных видов отмечалось здесь и в последующие годы (Дукравец, 2007; Исмуханов, Скакун, 2008; Исбеков, Жаркенов, 2014; Васильева и др., 2015). Наиболее крупная река бассейна − Или. Она берёт своё начало на территории Китайской Народной Республики (КНР) и впадает в западную часть оз. Балхаш в Республике Казахстан, обеспечивая 73−80% всего поступления воды (с учётом подземных вод) в озеро. Капчагайское (местное название − Капшагайское) водохранилище образовано в среднем течении р. Или в 1970 г.; плотина водохранилища расположена в 75 км к северу от г. Алма-Ата. Длина водохранилища составляет ~140 км, ширина – 22 м.; глубины свыше 10 м – ~48% его площади и расположены в основном вдоль левого берега (Митрофанов, 1975). В публикациях за последние 15 лет упоминалось об обнаружении в этом водохранилище сиговых рыб (Coregonidae), форели Parasalmo mykiss, чёрного леща (определён как Megalobrama sp. или M. terminalis) и тиляпии Oreochromis sp. (Карпов, 2005; Дукравец, 2007, 2013; Исмуханов, Скакун, 2008; Исбеков, Жаркенов, 2014; Абилов и др., 2016; Дукравец и др., 2016), однако какие-либо сведения, подтверждающие правильность идентификации новых для бассейна видов, в них отсутствуют.
Цель настоящей работы – верификация таксономического статуса четырёх редких чужеродных видов Капчагайского водохранилища на основе морфологического анализа и обсуждение их адаптационных возможностей в новом ареале.
МАТЕРИАЛ И МЕТОДИКА
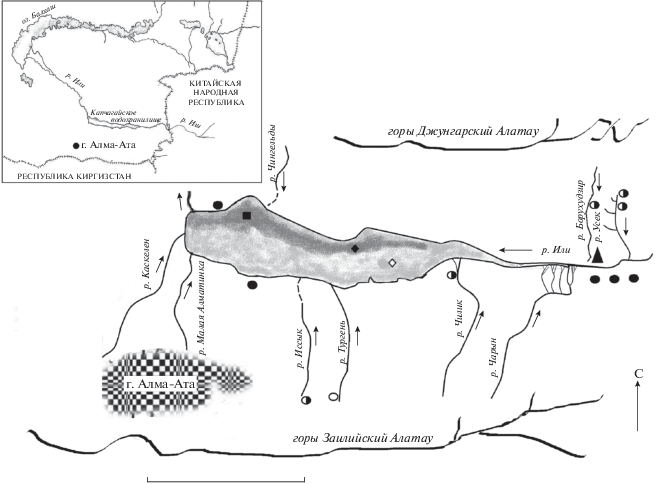
Материал собран в марте и июне−сентябре 2019 г. при изучении состава уловов рыбаков-любителей и шести рыболовных бригад, занимающихся легальным промыслом на разных участках Капчагайского водохранилища (рис. 1).
Рис. 1.
Карта-схема района исследований с указанием мест поимок рассматриваемых видов: (◆) – пелядь Coregonus peled, (◇) – микижа Parasalmo mykiss, (◼) – чёрный лещ Megalobrama mantschuricus, (▲) − нильская тиляпия Oreochromis niloticus; рыбоводные хозяйства: (⚪) − холодноводные, (⚫) – тепловодные, (◑) – выращивают холодноводные и тепловодные виды рыб; (→) − направление течения. Масштаб: 50 км.
Исследования проводили на охлаждённой рыбе, хранившейся на льду не более 3 сут. Для морфологического анализа рыб использовали системы признаков, применяющиеся для идентификации видов в соответствующих отрядах и семействах (Берг, 1948; Решетников, 1980; Васильева, 2004; Kottelat, Freyhof, 2007). В работе приняты следующие обозначения признаков: SL – стандартная длина тела, FL – длина по Смитту (до хвостовой выемки), W – общая масса тела, w – масса тела без внутренностей, ll – число прободённых чешуй в боковой линии; D, А, P, V и С – число лучей соответственно в спинном, анальном, грудном, брюшном и хвостовом плавниках; sp.br. – число жаберных тычинок на 1-й жаберной дуге, r.br. − число жаберных лучей, рс – число пилорических придатков, vert. – общее число позвонков. При подсчёте числа ветвистых лучей спинного и анального плавников два последних луча, причленяющихся к одному птеригофору, учитывали как 1½ (Kottelat, Freyhof, 2007). Возраст рыб определяли по чешуе и последним позвонкам грудного отдела.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Пелядь Coregonus peled. Представители семейства Coregonidae были обнаружены в улове одной сети, установленной в течение 2 сут (17−20 июня) в правобережной части водохранилища (рис. 1): 4 половозрелые особи (3 самки и 1 самец) в возрасте четырёх лет (3+), SL 274–300 мм, W 321–653 г, w 303–585 г. Рыбы характеризовались следующим набором признаков. D III−IV 9½−10, A III−IV 14−15, P I 14−16, V II 11, ll 80−86, sp.br. 54−63, r.br. 7, vert. 57−58. Тело высокое, сжатое с боков, спина за затылком круто поднимается вверх; наибольшая высота тела у одной особи равна примерно ¼ длины тела, у остальных − немного больше. Рот небольшой, конечный. Верхняя челюсть примерно равна или чуть длиннее нижней, почти доходит до вертикали через середину глаза. Носовые отверстия с каждой стороны разделены двойной кожистой перегородкой. Рыло короткое. Спина и верхняя часть головы тёмно-синего цвета, бока и брюхо серебристые (рис. 2а). Все перечисленные особенности соответствуют диагностическим характеристикам пеляди (Берг, 1948; Решетников, 1980, 2002; Васильева, 2004; Kottelat, Freyhof, 2007). В отличие от типичной формы у пойманных в Капчагайском водохранилище рыб не было тёмных пятнышек на теле и чёрных точек на плавниках; чёрный пигмент отмечен только на краях сумок чешуй.
Рис. 2.
Пелядь Coregonus peled из Капчагайского водохранилища: а – самка SL 300 мм; б, в – вскрытые самки с икрой (б − SL 300 мм, в − SL 281 мм).

Естественный ареал пеляди охватывает реки и озёра РФ от Мезени на западе до Колымы на востоке. В результате акклиматизационных работ он значительно расширился: от Монголии до Германии с востока на запад и от Мурманской области до Таджикистана с севера на юг (Решетников, 2002). Предыдущая находка пеляди в Капчагайском водохранилище (также в правобережной части) датируется 15.09.2009 г.: был пойман самец с гонадами IV стадии зрелости, SL 33 см и массой 606 г в возрасте 4+ (Исбеков, Жаркенов, 2014). Авторы предполагали, что пелядь могла попасть в р. Или с территории КНР. Однако и до этого в бассейн р. Или сиговых рыб вселяли неоднократно: в 1933−1935 гг. – сига чудского C. maraenoides и сига-лудогу C. lutokka, в 1960−1961 гг. – рипуса C. albula, в 1968−1969 и 1971 гг. – пелядь (Горюнова, Серов, 1954; Дукравец, Митрофанов, 1992; Горюнова, Данько, 2015). В связи с интенсивным развитием аквакультуры в бассейне р. Или в последнее десятилетие возможен и недавний завоз каких-то сигов. От всех перечисленных выше видов пелядь отличается бόльшим числом жаберных тычинок.
Все изученные нами рыбы были хорошо упитаны, с внутренним жиром. У самок кишечники были наполнены планктоном с примесью детрита. У самца кишечник был пустой, в печени отмечены паразитические круглые черви. Рост рыб в Капчагайском водохранилище примерно такой же, как озёрной и озёрно-речной формы в естественном ареале и в других водоёмах вселения (Новоселов, Решетников, 1988; Шустов, Митрофанов, 1992). К концу июня все рыбы имели зрелые половые продукты (рис. 2б, 2в): у двух самок и самца – на стадии раннего нереста (текучие). В границах естественного ареала пелядь нерестится с сентября по январь на участках с песчаным, галечниковым или каменистым грунтом (Берг, 1948; Решетников, 2002; Kottelat, Freyhof, 2007). Именно на таком участке и были отловлены особи в Капчагайском водохранилище, что позволяет предполагать возможность естественного воспроизводства в данном водоёме. Однако сроки нереста являются необычными. Среди сиговых весенне-летний нерест известен для баунтовского сига C. baunti, сига-лудоги и нескольких видов из озёр Западной Европы (Kottelat, Freyhof, 2007). Смещение сроков нереста пеляди в Капчагайском водохранилище, по-видимому, обусловлено сменой температурного режима и большой экологической пластичностью вида.
Микижа Parasalmo mykiss. Один половозрелый самец лососёвой рыбы (Salmonidae) в возрасте 4+ FL 332 мм, W 564 г, w 524 г был пойман 9 июля на расстоянии примерно 6 км от южного берега водохранилища (рис. 1). У изученной особи D IV 10, A IV 10½, P I 13, V I 10, ll 139, sp.br. 22, vert. 59, r.br. 10, рс 16. Тело прогонистое, голова небольшая. Чешуя сравнительно крупная. Рот большой; верхняя челюсть длинная, заходит за задний край глаза. Спина тёмно-серая, почти чёрная, бока и брюхо серебристые, на боках с каждой стороны посредине проходит светло-розовая продольная полоса. Верхние края спинного и жирового плавников тёмно-серые; грудные и анальный плавники светло-розовые (рис. 3). Представленное описание согласуется с диагностическими характеристиками микижи (Берг, 1948; Дорофеева, 2002; Васильева, 2004; Kottelat, Freyhof, 2007). Следует отметить лишь очень низкое число пилорических придатков у данного экземпляра. Так у 25 экз. микижи FL 21−32 см, вселённой в оз. Урюкты (бассейн р. Чилик, система р. Или) (см. ниже), рс 30−55 (44.3 ± 1.21), а у 19 экз. FL 28−45 см из аборигенной камчатской популяции – 41−56 (48.8 ± 1.23) (Бирюков, 1992); наименьшие значения признака при диапазоне 20−70 приводит Дорофеева (2002).
Широко используемую в аквакультуре пресноводную форму микижи – радужную форель, которую некоторые авторы рассматривают в статусе особого подвида P. mykiss irideus (Сиделева, Тельпуховский, 2004), из хозяйств бывшей Чехословакии неоднократно и в большом количестве в 1964−1970 гг. вселяли в разные притоки р. Или на территории Казахстана и в 1971, 1974 гг. − непосредственно в Капчагайское водохранилище (Дукравец, Митрофанов, 1992; Сидорова, 1992). Оплодотворённую икру камчатской микижи, собранную в 1975−1976 гг. из естественных популяций, инкубировали в Тургенском форелевом хозяйстве, а затем молодь небольшими партиями расселяли в горные и предгорные озёра Юго-Восточного Казахстана. Одно из таких озёр – отмеченное выше оз. Урюкты − в 1988 г. было выплеснуто селевым потоком, в результате чего микижа попала в р. Чилик (Бирюков, 1992) и с тех пор попадается в уловах рыбаков-любителей (Климов, Мамилов, 2012). Попав в дальнейшем в р. Или, микижа смогла распространиться вверх по течению на территорию КНР (Ren et al., 1998). В китайских публикациях этот вид включается в род Oncorhynchus.
В 1971 и 1974 гг. в Капчагайское водохранилище было выпущено более 1.3 млн личинок ещё одного представителя лососёвых − севанской форели гегаркуни Salmo ischchan. Часть рыб смогла дорасти до промысловых размеров, и в течение нескольких последующих лет гегаркуни отмечалась в уловах (Дукравец, Митрофанов, 1992). Форель-гегаркуни отличается от микижи по многим признакам, в том числе небольшим ртом, меньшим числом ветвистых лучей в спинном и анальном плавниках, более крупной чешуёй (до 114 поперечных рядов), бόльшим числом пилорических придатков (50−70) (Берг, 1948). Ранее сообщалось, что гегаркуни в Капчагайском водохранилище не прижилась (Дукравец, Митрофанов, 1992).
У отловленного самца микижи кишечник примерно на ¾ был наполнен зоопланктоном, имелся небольшой запас полостного жира. Таким образом, микижа в Капчагайском водохранилище в летний период продолжает активно питаться, несмотря на высокую для этого вида температуру воды (~22°С на глубине 1.5 м). Ранее была показана возможность успешного существования микижи в проточных и достаточно глубоководных водохранилищах аридной и жаркой зоны США, где, благодаря температурной стратификации, эти рыбы бόльшую часть времени проводят ниже термоклина (Tate et al., 2007). Очевидно, обнаружение микижи в Капчагайском водохранилище не является случайным. Ранее отмечалось, что в 1960-е гг. радужная форель была акклиматизирована и образовала самовоспроизводящиеся популяции в водоёмах бассейна р. Чилик (Дукравец и др., 2016).
Чёрный амурский лещ Megalobrama mantschuricus. Один экземпляр чужеродного представителя семейства карповых (Cyprinidae) был пойман 26−27 июля на приплотинном участке водохранилища (рис. 1). Этот половозрелый самец в возрасте 4+, SL 324 мм, W 564 г, w 524 г характеризуется следующими признаками: D II 7½, A III 29½, P I 16, V I 7½, ll 49, sp.br. 11, vert. 42. Крупная чешуя плотно прилегает к телу. Жаберные тычинки редкие, острые. Глоточные зубы трёхрядные 5 : 3 : 2. Тело высокое, сильно сжато с боков; наибольшая высота тела составляет 47.5% SL. Брюхо от брюшных плавников до анального заострено в виде непокрытого чешуёй киля. Спинной плавник с мощным костным лучом, по заднему краю которого проходит желобок; анальный плавник длинный. Рот маленький (челюсти не достигают заднего края глаза), полунижний. Спина чёрная, по направлению к брюху окраска постепенно светлеет до светло-серой на брюхе (рис. 4). Все перечисленные особенности морфологии и окраски соответствуют диагностическим характеристикам чёрного амурского леща (Васильева, Макеева, 2003; Васильева, 2004), распространённого в бассейне Амура и в ряде речных систем Китая на юг до Янцзы и рек бассейна Южно-Китайского моря (исключая реки Чжу Цзян и Си Цзян) (Bogutskaya et al., 2008). Следует подчеркнуть, что в настоящей работе M. mantschuricus впервые приводится для ихтиофауны Казахстана (Froese, Pauly, 2019).
Чёрного леща в бассейн р. Или целенаправленно не вселяли. Имеются сведения о его пересадках в бассейн Тарима (Митрофанов, Туркия, 1994; Туркия, 1997). Авторы относили этого интродуцента к китайскому чёрному лещу M. terminalis. К этому же виду ранее ошибочно относили чёрных лещей из бассейна Амура (Берг, 1949; Никольский, 1956; Соколов, 2002), а также чёрного леща, обнаруженного ранее в Капчагайском водохранилище (Дукравец и др., 2016). Эта находка 1 экз. в возрасте 7+, TL 515 мм, SL 445 мм, определённого как Megalobrama sp., датируется 1999 г. (Исмуханов, Скакун, 2008). К сожалению, никаких сведений, позволяющих провести видовую идентификацию, в этой публикации не приведено. Предполагается, что лещ в водохранилище мог попасть из Китая (Жаркенов, Исбеков, 2014; Дукравец и др., 2016). В Южном Китае в последние годы разными рыбными хозяйствами распространяется и другой вид рода – M. amblycephala (Novomodny et al., 2004). Однако оба упомянутых вида существенно отличаются от M. mantschuricus более коротким анальным плавником, число ветвистых лучей в котором не превышает 28 (Васильева, Макеева, 2003; Guan et al., 2017; Hagiwara, 2017).
Таким образом, появление в Капчагайском водохранилище чёрного леща нельзя связывать с распространением эндемичных китайских видов M. amblycephala и M. terminalis. Амурский чёрный лещ, скорее всего, мог попасть в водохранилище в результате проводившегося ранее планового расселения по водоёмам Казахстана растительноядных рыб. Зарыбление водоёмов проводилось икрой рыб, личинками, сеголетками и особями разного возраста (Жаркенов, Исбеков, 2014), среди которых могла попадаться и молодь внеплановых вселенцев.
Исследованный экземпляр чёрного амурского леща был хорошо упитан: полостной жир закрывал все внутренние органы. Кишечник был наполнен водорослями.
Нильская тиляпия Oreochromis niloticus. Три особи, относящиеся к семейству цихловых (Cichlidae), были пойманы рыбаками-любителями 29 марта в р. Или (рис. 1). Две из них они использовали на наживку для ловли змееголова Channa argus, а 1 экз. передали нам для морфологического анализа. Это был самец в возрасте 1+, SL 136 мм, W 95.17 г, w 89.12 г. Его признаки: D XVII 14, A III 9, P II 15, V I 5, С 17, sp.br. 29, r.br. 4, vert. 31. С каждой стороны тела по две неполные боковые линии, вдоль середины тела 26 рядов чешуй и ещё три ряда заходят на хвостовой плавник. Тело высокое, сжато с боков. Голова большая. Хвостовой стебель короткий. Рот конечный, небольшой: верхняя челюсть немного не доходит до вертикали через передний край глаза. Большинство зубов с раздвоенной вершиной, расположены в несколько рядов, наружный ряд ровный. Спинной плавник длинный; грудные и брюшные плавники также длинные – немного не доходят до анального плавника. Общий тон окраски серо-голубой, спина почти чёрная, по направлению к брюху окраска светлеет. На спинном и хвостовом плавниках чёрные и белые полосы (рис. 5). Перечисленные особенности соответствуют диагностическим характеристикам O. niloticus (Eccles, 1992; Kottelat, Freyhof, 2007; Genner et al., 2018); этот вид также до сих пор не упоминался в составе ихтиофауны Казахстана (Froese, Pauly, 2019).
Рис. 5.
Нильская тиляпия Oreochromis niloticus из р. Или выше Капчагайского водохранилища SL 136 мм.

Естественный ареал нильской тиляпии ограничен водоёмами западной и восточной частей Африки (бассейн Нила) и Израиля (Kottelat, Freyhof, 2007). Благодаря быстрому росту и половому созреванию, относительной неприхотливости в кормах и качестве воды этот вид получил широкое распространение по всему миру как объект аквакультуры. К началу XXI в. он был интродуцирован уже в 85 странах: в 58% случаев интродукция привела к натурализации, причём отрицательный эффект на окружающую среду был выявлен уже в 14% водоёмов (Vicente, Fonseca-Alves, 2013). В Капчагайском водохранилище тиляпия впервые была обнаружена в 2009 г. (Исбеков, Жаркенов, 2014). В Казахстане и Синьцзян-Уйгурском автономном округе КНР культивируют три вида тиляпий: нильскую, мозамбикскую O. mossambicus и голубую O. aureus, а также их гибридов. Нильская тиляпия хорошо отличается от двух последних видов наличием серых или чёрных поперечных полос на хвостовом плавнике (Kottelat, Freyhof, 2007). Имеется опыт успешного выращивания нильской тиляпии в термальных источниках и в летний период в прудах в районе Капчагайского водохранилища (Асылбекова и др., 2019). Очевидно, что из этих хозяйств тиляпия постоянно сбегает в р. Или и в Капчагайское водохранилище.
Изученный самец имел гонады V стадии зрелости: парные семенники в виде толстых белых тяжей занимали ~1/3 полости тела. Рыба была хорошо упитана: полостной жир закрывал кишечник, наполненный водорослями, среди которых попалось и несколько личинок ручейника. Несмотря на низкую для этого вида температуру воды (~15°С), тиляпия продолжала активно питаться: рыбаки поймали её на наживку из хлебного мякиша.
Факторы, способствующие натурализации инвазионных видов. Изученные и идентифицированные в настоящей работе четыре чужеродных вида пополняют список ихтиофауны р. Или в районе Капчагайского водохранилища, в настоящее время целиком состоящий из инвазионных видов, разнообразие которых постоянно увеличивается (Карпов, 2005; Дукравец, 2007; Исмуханов, Скакун, 2008; Исбеков, Жаркенов, 2014; Васильева и др., 2015). К видам умеренной зоны из бассейнов Каспийского и Аральского морей и р. Амур добавились типично холодноводные представители отряда лососеобразных и такой термофильный вид, как тиляпия. Можно указать несколько причин большого разнообразия инвазионных видов рыб в Капчагайском водохранилище.
1. Капчагайское водохранилище расположено в предгорной зоне на стыке Тянь-Шанской и Джунгарской палеозойских складчатых областей с большими запасами подземной воды − соответственно Илийский артезианский бассейн и Джунгарский гидрогеологический массив, в результате чего на одних и тех же участках, но на разной глубине могут быть расположены артезианские бассейны с холодной (12−16°С) и горячей (25−47°С) водой, местами происходит их самоизлив (Каменский и др., 1959; Леонов, Загайнов, 1963). Выходы холодных и горячих подземных вод есть вблизи и на дне Капчагайского водохранилища. Вероятно, они могут служить стациями переживания для видов со специфическими температурными предпочтениями.
2. Существенное влияние на состав ихтиофауны оказывает промысел. В 2017 г. для водохранилища были отмечены максимальные за последнее десятилетие показатели рыболовного усилия: промысел вели 92 бригады рыбаков из 19 организаций, используя 3645 сетей, 22 невода, 244 лодки. Однако было выловлено лишь 816 т рыбы − намного меньше максимума в 1129 т в 2010 г. Из-за явного перелова в 2018 г. был установлен лимит всего в 640 т (Абилов и др., 2019). В то же время государственные хозяйства (Казахская производственно-акклиматизационная станция и Капчагайское нересто-выростное хозяйство), занимавшиеся воспроизводством карпа, сазана Cyprinus carpio и белого амура Ctenopharyngodon idella, были приватизированы и потеряли своё значение для воспроизводства этих видов, а большое изъятие массовых видов рыб (леща Abramis brama, жереха Aspius aspius, сома Silurus glanis, змееголова, судака Sander lucioperca, сазана, белого толстолобика Hypophthalmichthys molitrix, белого амура) без соответствующего пополнения значительно ослабляет межвидовую конкуренцию и даёт редким видам возможность увеличить численность.
3. В водохранилищах как в искусственных экосистемах гидрологический режим непредсказуем для гидробионтов, намного изменчивее физико-химические показатели воды и содержание биогенных элементов и соответственно нестабильна кормовая база. Поэтому водохранилища дают значительные преимущества чужеродным видам по сравнению с аборигенными (Havel et al., 2005; Han et al., 2008).
4. В последние годы в районе водохранилища были пробурены дополнительные скважины, вода из которых используется для выращивания овощей или рыбы. Поступающая из разных скважин вода разной температуры позволяет выращивать в некоторых хозяйствах на небольшой площади одновременно форель, тиляпию и другие виды рыб (например, хозяйства “Рыболовная база Чиликский карп ”, “Tengry Fish”, “Halyk Balyk”). Другие хозяйства специализируются только на холодноводных (Тургенское форелевое хозяйство) или тепловодных (Капшагайское НВХ-1973, “Kaz Organic Product”) видах рыб (рис. 1). Поэтому чужеродные виды могут получать пополнение за счёт рыб, сбежавших из рыбоводных предприятий.
Выше уже отмечалось, что радужная форель образовала самовоспроизводящиеся популяции в водоёмах бассейна р. Чилик (Дукравец и др., 2016), сообщалось также о натурализации в оз. Урюкты (бассейн Чилика) камчатской микижи (Бирюков, 1992; Митрофанов, Дукравец, 1992а). В то же время интродукция в бассейн оз. Балхаш пеляди, проводившаяся в 1968−1969 и 1971 гг., оказалась неудачной (Митрофанов, Дукравец, 1992а, 1992б). Сведения о размножении в Капчагайском водохранилище чёрного амурского леща и нильской тиляпии отсутствуют. По мнению Жаркенова и Исбекова (2014), чёрный лещ, пелядь и тиляпия (а также змееголов) появились здесь только в последние годы и могут считаться занесёнными случайно по р. Или с территории КНР. Несомненно, для оценки влияния чужеродных видов на экосистему Капчагайского водохранилища и р. Или необходим регулярный мониторинг ихтиофауны и инвазионного процесса.
Список литературы
Абилов Б.И., Баракбаев Т.Т., Аблайсанова Г.М. 2016. Формирование промысловой ихтиофауны Капшагайского водохранилища // Изв. НАН РК. Сер. биол. мед. № 5 (317). С. 94–98.
Абилов Б.И., Касымбеков Е.Б., Жаркенов Д.К. 2019. Динамика вылова промысловых видов рыб на водохранилище Капшагай // Вестн. науки КазАГТУ. № 1 (100). С. 12–22.
Асылбекова С.Ж., Исмуханов Х.К., Пазылбеков М.Ж. 2019. Тиляпия (Tilapia) – один из перспективных объектов товарного рыбоводства Казахстана // Состояние водных биологических ресурсов и аквакультуры Казахстана и сопредельных стран. Алматы: Изд-во КазНУ. С. 494–501.
Берг Л.С. 1948. Рыбы пресных вод СССР и сопредельных стран. Ч. 1. М.; Л.: Изд-во АН СССР, 466 с.
Берг Л.С. 1949. Рыбы пресных вод СССР и сопредельных стран. Ч. 2. М.; Л.: Изд-во АН СССР. С. 469–926.
Бирюков Ю.А. 1992. Salmo mykiss Walbaum – микижа // Рыбы Казахстана. Т. 5. Акклиматизация, промысел. Алма-Ата: Гылым. С. 119–125.
Васильева Е.Д. 2004. Популярный атлас-определитель. Рыбы. М.: Дрофа, 399 с.
Васильева Е.Д., Макеева А.П. 2003. Таксономический статус чёрного амурского леща и некоторые замечания по поводу проблем таксономии родов Megalobrama, Sinibrama (Cyprinidae, Cultrinae) // Вопр. ихтиологии. Т. 43. № 5. С. 607–623.
Васильева Е.Д., Мамилов Н.Ш., Магда И.Н. 2015. Новые виды карпообразных рыб (Cypriniformes) в фауне Балхаш-Илийского бассейна Казахстана // Там же. Т. 55. № 4. С. 379–385. https://doi.org/10.7868/S0042875215040177
Горюнова А.И., Данько Е.К. 2015. Степные озера Северного Казахстана. Saarbrucken: LAP Lambert Acad. Publ., 291 с.
Горюнова А.И., Серов Н.П. 1954. Акклиматизация рыб в Казахстане // Тр. совещ. “Проблемы акклиматизации рыб и кормовых беспозвоночных”. М.: Изд-во АН СССР. С. 109–113.
Дорофеева Е.А. 2002. Parasalmo mykiss (Walbaum, 1792) – микижа // Атлас пресноводных рыб России. Т. 1 / Под ред. Решетникова Ю.С. М.: Наука. С. 92–95.
Дукравец Г.М. 2007. Новые чужеродные виды в ихтиофауне Балхаш-Илийского бассейна (Республика Казахстан) // Матер. Междунар. науч.-практ. конф. “Состояние, охрана, воспроизводство и устойчивое использование биологических ресурсов внутренних водоёмов”. Волгоград: Изд-во Волгогр. отд. ГосНИОРХ. С. 95–96.
Дукравец Г.М. 2013. О чужеродных видах рыб в Республике Казахстан // Изв. НАН РК. Сер. биол. мед. № 5 (299). С. 32–37.
Дукравец Г.М., Митрофанов В.П. 1992. История акклиматизации рыб в Казахстане // Рыбы Казахстана. Т. 5. Акклиматизация, промысел. Алма-Ата: Гылым. С. 6–44.
Дукравец Г.М., Мамилов Н.Ш., Митрофанов И.В. 2016. Рыбы Казахстана: аннотированный список, исправленный и дополненный (по состоянию на 31 декабря 2016 г.) // Selevinia. Т. 24. С. 47–71.
Жаркенов Д.К., Исбеков К.Б. 2014. Проблема биологических инвазий в водоемах Балхаш-Илийского бассейна // Матер. докл. II Всерос. конф. “Современное состояние биоресурсов внутренних вод”. Т. 1. М.: Полиграфплюс. С. 177–183.
Исбеков К.Б., Жаркенов Д.К. 2014. Чужеродные виды рыб в водоемах бассейна реки Или и проблема биологических инвазий // Изв. НАН РК. Сер. биол. мед. № 1. С. 12–19.
Исмуханов Х.К., Скакун В.А. 2008. Современное состояние биоразнообразия трансграничной реки Или и Капшагайского водохранилища, влияние мигрирующих чужеродных видов на их экосистему // Экология и гидрофауна водоемов трансграничных бассейнов Казахстана. Алматы: Бастау. С. 273–280.
Каменский Г.Н., Толстихина М.М., Толстихин Н.И. 1959. Гидрогеология СССР. М.: Госгеолтехиздат, 366 с.
Карпевич А.Ф. 1975. Теория и практика акклиматизации организмов. М.: Пищ. пром-сть, 432 с.
Карпов В.Е. 2005. Список видов рыб и рыбообразных Казахстана // Рыбохозяйственные исследования в Республике Казахстан: история и современное состояние. Алматы: Бастау. С. 152–168.
Климов Ф.В., Мамилов Н.Ш. 2012. Современный состав ихтиофауны р. Шелек в горной и предгорной зонах // Вестн. КазНУ. Сер. экол. № 1 (33). С. 85–88.
Леонов Г.М., Загайнов В.И. 1963. Подземные воды и минеральные источники // Илийская долина, её природа и ресурсы / Под ред. Ломоновича М.И. Алма-Ата: Изд-во АН КазССР. С. 174–189.
Митрофанов В.П. 1975. Физико-географический очерк среднего течения р. Или и Капчагайского водохранилища // Биол. науки. Вып. 9. С. 5–8.
Митрофанов В.П., Дукравец Г.М. 1992а. История акклиматизации рыб в Казахстане // Рыбы Казахстана: Т. 5. Акклиматизация, промысел. Алма-Ата: Гылым. С. 6–44.
Митрофанов В.П., Дукравец Г.М. 1992б. Некоторые теоретические и практические аспекты акклиматизации рыб в Казахстане // Там же. С. 329–371.
Митрофанов В.П., Туркия А. 1994. Ихтиофауна бассейна Тарима и ее значение в ихтиогеографии // Selevinia. № 4. С. 18–21.
Никольский Г.В. 1956. Рыбы бассейна Амура. Итоги Амурской ихтиологической экспедиции 1945−1949 гг. М.: Изд-во АН СССР, 551 с.
Новоселов А.П., Решетников Ю.С. 1988. Пелядь в новых местах обитания // Биология сиговых рыб. М.: Наука. С. 78–114.
Решетников Ю.С. 1980. Экология и систематика сиговых рыб. М.: Наука, 300 с.
Решетников Ю.С. 2002. Coregonus peled (Gmelin, 1789) – пелядь // Атлас пресноводных рыб России. Т. 1 / Под ред. Решетникова Ю.С. М.: Наука. С. 149–151.
Сиделева В.Г., Тельпуховский А.Н. 2004. Инвазионные виды рыб в озере Байкал и Байкальском регионе // Биологические инвазии в водных и наземных экосистемах / Под ред. Алимова А.Ф., Богуцкой Н.Г. М.: Т-во науч. изд. КМК. С. 171–186.
Сидорова А.Ф. 1992. Salmo gairdneri Richardson – радужная форель, жилая форма стальноголового лосося // Рыбы Казахстана. Т. 5. Акклиматизация, промысел. Алма-Ата: Гылым. С. 56–119.
Соколов Л.И. 2002. Megalobrama terminalis (Richardson, 1846) – черный амурский лещ // Атлас пресноводных рыб России. Т. 1 / Под ред. Решетникова Ю.С. М.: Наука. С. 281–282.
Терещенко В.Г., Стрельников А.С. 1995. Анализ перестроек в рыбной части сообщества озера Балхаш в результате интродукции новых видов рыб // Вопр. ихтиологии. Т. 35. № 1. С. 71–77.
Туркия А. 1997. Ихтиофауна водоемов Синцзяня и ее изменения в результате акклиматизации: Автореф. дис. … канд. биол. наук. Алматы: Ин-т зоол. и генофонда животных МН−АН РК, 23 с.
Шустов А.И., Митрофанов В.П. 1992. Материалы по морфологии и биологии сиговых (Coregonidae) в водоемах Казахстана // Рыбы Казахстана. Т. 5. Акклиматизация, промысел. Алма-Ата: Гылым. С. 316–328.
Bogutskaya N.G., Naseka A.M., Shedko S.V. et al. 2008. The fishes of the Amur River: updated check-list and zoogeography // Ichthyol. Explor. Freshwat. V. 19. № 4. P. 301–366.
Eccles D.H. 1992. FAO species identification sheets for fishery purposes. Field guide to the freshwater fishes of Tanzania. Rome: FAO, 143 p.
Froese R., Pauly D. (eds.). 2019. FishBase. World Wide Web electronic publication. (www.fishbase.org. Version 12/2019).
Genner M.J., Turner G.F., Ngatunga B.P. 2018. A guide to the tilapia fishes of Tanzania. (https://martingenner.weebly.com/uploads/1/6/2/5/16250078/tanzania_tilapia_gui-de_edition1_2018.pdf. Version 12/2018).
Guan W., Zheng G., Wu Ch. et al. 2017. Comparative analysis of growth and morphological variations among Megalobrama amblycephala, M. terminalis, Parabramis pekinensis and their hybrids // J. Fish. Sci. China. V. 24. № 1. P. 31–39. https://doi.org/10.3724/SP.J.1118.2017.16100
Hagiwara T. 2017. Records of the non-indigenous Wuchang bream Megalobrama amblycephala (Cyprinidae) in Lake Kasumigaura, Ibaraki Prefecture, Japan // Izunuma-Uchinuma Wetland Res. V. 11. P. 75–81. https://doi.org/10.20745/izu.11.0_75
Han M., Fukushima M., Fukushima T. 2008. Species richness of exotic and endangered fishes in Japan’s reservoirs // Environ. Biol. Fish. V. 83. P. 409–416. https://doi.org/10.1007/s10641-008-9362-6
Havel J.E., Lee C.E., Vander Zanden M.J. 2005. Do reservoirs facilitate invasions into landscapes? // BioScience. V. 55. P. 518–525.https://doi.org/10.1641/0006-3568(2005)055[0518:DRFI-IL]2.0.CO;2
Kottelat M., Freyhof J. 2007. Handbook of European freshwater fishes. Cornol; Berlin: Kottelat and Freyhof, 646 p.
Larranaga N., Wallerius M.L., Guo H. et al. 2019. Invasive brook trout disrupts the diel activity and aggregation patterns of native brown trout // Can. J. Fish. Aquat. Sci. V. 76. P. 1052–1059. https://doi.org/10.1139/cjfas-2018-0110
Novomodny G., Sharov P., Zolotukhin S. 2004. Amur fish: wealth and crisis. Bлaдивocтoк: Aпeльcин, 51 c.
Ren M., Guo Y., Zhang Q. et al. 1998. Fisheries resources and fishery of River Yili. Harbin: Heilongjiang Sci. Tech. Press, 345 p.
Ricciardi A., MacIsaac H.J. 2011. Impacts of biological invasions on freshwater ecosystems // Fifty years of invasion ecology: the legacy of Charles Elton / Ed. Richardson D.M. Chichester; Hoboken: Wiley-Blackwell. P. 211–224. https://doi.org/10.1002/9781444329988.ch16.
Strayer D. 2010. Alien species in fresh waters: ecological effects, interactions with other stressors, and prospects for the future // Freshwat. Biol. V. 55. Suppl. 1. P. 152–174. https://doi.org/10.1111/j.1365-2427.2009.02380.x
Tate K.W., Lancaster D.L., Lile D.F. 2007. Assessment of thermal stratification within stream pools as a mechanism to provide refugia for native trout in hot, arid rangelands // Environ. Monit. Ass. V. 124. P. 289–300. https://doi.org/10.1007/s10661-006-9226-5
Vicente I.S.T., Fonseca-Alves C.E. 2013. Impact of introduced Nile tilapia (Oreochromis niloticus) on non-native aquatic ecosystems // Pakistan J. Biol. Sci. V. 16. № 3. P. 121–126. https://doi.org/10.3923/pjbs.2013.121.126
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии




