Вопросы ихтиологии, 2021, T. 61, № 3, стр. 326-336
Изменчивость морфобиологических характеристик в арктических и тихоокеанских популяциях тихоокеанской сельди Clupea pallasii
А. Н. Строганов 1, *, А. В. Семенова 1, М. О. Рыбаков 2, А. А. Смирнов 3, 4
1 Московский государственный университет
Москва, Россия
2 Полярный филиал Всероссийского научно-исследовательского института рыбного хозяйства
и океанографии – ПИНРО
Мурманск, Россия
3 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии – ВНИРО
Москва, Россия
4 Северо-Восточный государственный университет – СВГУ
Магадан, Россия
* E-mail: andrei_str@mail.ru
Поступила в редакцию 22.06.2020
После доработки 05.08.2020
Принята к публикации 07.08.2020
Аннотация
Проведён сравнительный анализ биологических и морфометрических характеристик тихоокеанской сельди Clupea pallasii из разных частей ареала от Белого до Жёлтого моря. Показано, что формирование современного ареала вида, охватывающего акватории арктической, бореальной, субтропической зоогеографических зон, обусловлено системой адаптаций, выработанных в ходе длительной эволюции в специфических условиях Северной Пацифики. Результаты многомерного дискриминантного анализа указывают на относительно невысокую степень отличий по комплексу меристических признаков выборок тихоокеанского региона от выборок Арктики и Северо-Восточной Атлантики.
Тихоокеанская сельдь Clupea pallasii на обширном ареале, включающем акватории морей Северного Ледовитого, Атлантического и Тихого океанов (Световидов, 1952; Андрияшев, Чернова, 1994; Парин и др., 2014), образовала разнообразное по экологическим чертам сообщество. Группировки тихоокеанской сельди различаются местами и условиями нереста, сроками, продолжительностью и направлением миграций, особенностями роста и морфологии, продолжительностью жизни. В Беринговом, Охотском и Японском морях сельдь представлена тремя экологическими формами – морской, прибрежной и озёрно-лагунной, относимыми к 34 популяциям (Науменко, 2001). На основании морфобиологических особенностей среди морской сельди северной части Охотского моря выделяют несколько стад: охотское, гижигинско-камчатcкое, тауйское; по азиатскому побережью Берингова моря обитают корфо-карагинское и анадырское стада сельди (Науменко, 2001; Смирнов и др., 2005; Панфилов, Черешнев, 2006). Несомненно, представляется интересным и важным рассмотрение механизмов, обеспечивших тихоокеанской сельди возможности формирования современного ареала, охватывающего акватории арктической, бореальной и субтропической зоогеографических зон.
Анализ современной литературы, посвящённой изучению процессов формообразования, популяционной структурированности, демонстрирует приоритет применения генетических методов, получивших в текущем столетии стимул и возможности интенсивного развития (Картавцев, Рыбникова, 1999; Grant et al., 2012; Семенова и др., 2014, 2018; Semenova et al., 2015; Курносов и др., 2016). Так, показано, что сельдь северо-западной части Тихого океана относится к одной митохондриальной гаплогруппе (Liu et al., 2011; Горбачев и др., 2012). На основе результатов исследования полиморфизма митохондриальной и ядерной ДНК выявлена дифференциация выборок тихоокеанской сельди из морских и озёрных акваторий (Orlova et al., 2019). К сожалению, активное развитие генетических методов создаёт подчас непреодолимые трудности в сравнении и обобщении полученных данных в силу разнообразия применяемых маркеров и способов статистической оценки.
Цель работы − изучить изменчивость биологических характеристик тихоокеанской сельди в акваториях Северо-Восточной Атлантики (СВА), Арктики и Северной Пацифики. Мы использовали традиционные ихтиологические подходы, способствующие изучению процессов формообразования, их механизмов и динамики в группировках тихоокеанской сельди на ареале от Белого до Жёлтого морей.
МАТЕРИАЛ И МЕТОДИКА
Материалом для исследования послужили выборки тихоокеанской сельди акваторий Белого, Баренцева, Карского, Чукотского, Берингова, Охотского морей и моря Лаптевых, собранные в экспедициях МГУ, ВНИРО и его филиалов – Полярного (ПИНРО, СевПИНРО) и Магаданского (МагаданНИРО) – и предоставленные сотрудниками Усть-Ленского заповедника, а также характеристики группировок сельди южной части Охотского, Японского и Жёлтого морей из источников литературы (табл. 1).
Таблица 1.
Характеристика анализируемого материала
| Выборки | Место и время взятия выборок | Координаты | Число рыб, экз. | |
|---|---|---|---|---|
| с.ш. | долгота | |||
| Белое море | ||||
| WSiv | – Великая Салма, июль 2017 г. | 66°34′ | 33°08′ в.д. | 85 |
| WSeg | – Великая Салма, сентябрь 2014 г. | 66°34′ | 33°08′ в.д. | 25 |
| WSeg1 | – губа Чупа, апрель 2008 г. | 66°16′ | 33°03′ в.д. | 100 |
| BS | Баренцево море, Чешско-Печорская губа, октябрь 2008 г. | 70°01′ | 54°21′ в.д. | 32 |
| Карское море | ||||
| KS | – Усть-Кара, август 2008 г. | 67°55′ | 67°37′ в.д. | 11 |
| KS1 | – 23.09.2019 г. | 72°48′ | 67°54′ в.д. | 16 |
| KS2 | – 27.09.2019 г. | 69°52′ | 64°14′ в.д. | 50 |
| SL | Море Лаптевых, б. Тикси, 1964, 1998, 2000, 2002, 2003, 2006 г. | 71°39′ | 129°10′ в.д. | 12 |
| Chuk | Чукотское море, август 2019 г. | 69°03′ | 171°28′ з.д. | 56 |
| Берингово море | ||||
| BerS1 | – Западно-беринговоморская промысловая зона (ЗБПЗ), июнь–июль 2014 г. | 61°08′ | 178°07′ з.д. | 29 |
| BerS2 | – ЗБПЗ, октябрь–ноябрь 2013 г. | 59°42′ | 170°20′ в.д. | 15 |
| BerS3 | – Карагинская подзона, июль 2019 г. | 60°17′ | 167°42′ в.д. | 50 |
| BerS4 | – ЗБПЗ, август 2019 г. | 61°47′ | 179°02′ в.д. | 50 |
| Охотское море | ||||
| ОSt | – Тауйская губа, май 2012 г. | 59°34′ | 151°14′ в.д. | 32 |
| OS1 | – май 2004 г. | 45°18′ | 143°21′ в.д. | 36 |
| PacO1 | Северо-западная часть Тихого океана, май 2005 г. | 42°21′ | 145°33′ в.д. | 34 |
| PacO12, * | Северо-западная часть Тихого океана, сахалино-хоккайдская сельдь | |||
| JS1 | Японское море, февраль 2005 г. | 44°15′ | 140°20′ в.д. | 17 |
| JS13, * | Японское море, зал. Петра Великого | |||
| YS1 | Жёлтое море, март 2004 г. | 37°30′ | 123°30′ в.д. | 40 |
| YS12, * | Жёлтое море | |||
На акваториях Берингова моря, Арктики, Баренцева моря выборки взяты из траловых уловов; на акватории Белого моря и моря Лаптевых − из уловов ставных сетей и удебных снастей; в Тауйской губе Охотского моря сельдь отлавливали ставным неводом. Несмотря на различия в использовавшихся орудиях лова, объёмах выборок и времени их получения, по размерно-возрастным характеристикам выборки из разных акваторий ареала тихоокеанской сельди демонстрируют определённое сходство. Исключение составляет выборка из Чукотского моря, представленная в основном младшими возрастными группами (при сравнении морфометрических характеристик эту выборку не использовали).
Всего обработано 563 свежевыловленных и замороженных экземпляра малопозвонковой сельди. Часть данных получена на основе выполненных по фото промеров, а также с привлечением материалов из источников литературы.
В процессе биологического анализа определяли пол, стадию зрелости, возраст, массу тела. У всех экземпляров по чешуе определяли возраст. Чешую брали выше боковой линии под передней частью спинного плавника. Так как у сельди легко спадающая чешуя, в случае её отсутствия или повреждения возраст определяли по отолитам (sagitta). Возрастные группы выделяли, учитывая число годовых колец без прироста следующего года (Чугунова, 1959).
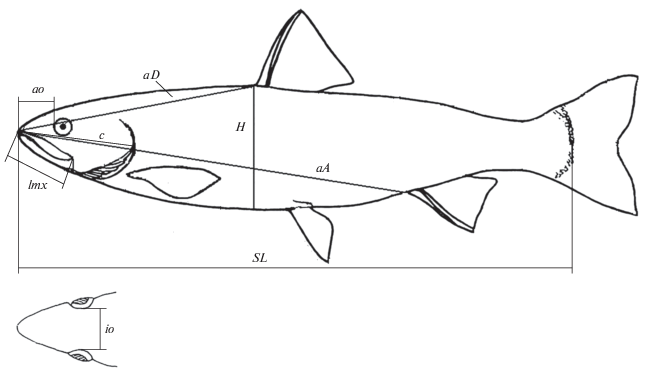
При измерении пластических признаков использовали схему Правдина (1966) с модификациями (рис. 1); промеры проводили с точностью до 1 мм. Анализировали изменчивость четырёх меристических признаков − число позвонков (vert.), лучей в спинном (D) и анальном (А) плавниках, тычинок на 1-й жаберной дуге (sp.br.) − и семи пластических признаков − длина головы (c), длина рыла (ao), длина верхней челюсти (lmx), межглазничное пространство (io), наибольшая высота тела (H), антеанальное (aA) и антедорсальное (aD) расстояния. Пластические признаки выражены в индексах − относительно стандартной длины (SL) и длины головы (Алеев, 1963; Павлов и др., 2001). При сравнительном анализе полученных результатов привлекали эколого-биологические характеристики сельди.
Рис. 1.
Схема измерения пластических признаков тихоокеанской сельди Clupea pallasii: SL – стандартная длина, с − длина головы, aо – длина рыла, lmx − длина верхней челюсти, io – межглазничное расстояние, H − наибольшая высота тела, aD – антедорсальное расстояние, aA − антеанальное расстояние.
Статистический анализ проводили по стандартным методикам (Урбах, 1963; Ивантер, Коросов, 2003). Уровень и достоверность различий морфометрических индексов оценивали в программных пакетах Excel, Statistiсa на основе критерия Стьюдента, одномерного (one-way ANOVA) и многомерного дискриминантных анализов.
РЕЗУЛЬТАТЫ
Биологические характеристики. Соотношение полов в большинстве исследованных выборок близко к равному (табл. 2). В качестве исключения можно отметить две выборки из Белого моря и две выборки из Берингова моря. Видимо, это связано с тем, что облавливались нагульные группировки, соотношение полов в которых было смещено; это происходит, например, при разном режиме отхода с нерестилищ самок и самцов (Чепракова, 1966; Моисеев и др., 1985). Возрастной состав выборок различается. Особи максимального возраста выявлены в выборках из Берингова (BerS4) и Охотского моря – соответственно 12 и 10 лет. Минимальный предельный возраст отмечен в выборке из Карского моря − 3 года. В выборке из Охотского моря модальная группа представлена 6-годовиками, из Чукотского – годовиками; в выборках из остальных районов − 3−4-годовиками. Наибольшей средней массой отличаются особи из Берингова моря (302−388 г), наименьшей – из Белого (егорьевская сельдь) и Карского и Чукотского морей (38−50 г).
Таблица 2.
Характеристика группировок тихоокеанской сельди Clupea pallasii из разных районов ареала
| Выборка | Самцы : самки, % | Возрастной состав, годы | Средний возраст, годы | Стадии зрелости | Масса, г | ||
|---|---|---|---|---|---|---|---|
| мода (доля особей, %) | lim | мода (доля особей, %) | lim | ||||
| WSiv | 9 : 91 | 3 (50) | 2−6 | 3.0 | II (77) | II−III | $\frac{{118\left( {82} \right)}}{{23 - 355}}$ |
| WSeg | 23 : 77 | 3 (48) | 2−4 | 2.9 | $\frac{{48\left( {24} \right)}}{{22 - 118}}$ | ||
| WSeg1 | 60 : 40 | 4 (37) | 2−8 | 4.5 | V (47) | III−VI | $\frac{{38\left( {11} \right)}}{{14 - 76}}$ |
| BS | 57 : 43 | 4 (23) | 2−7 | 4.1 | V−VI (70) | III−VI | $\frac{{67\left( {49} \right)}}{{23 - 170}}$ |
| KS | 36 : 64 | 4 (64) | 3−5 | 3.8 | II (91) | II−III | $\frac{{57\left( 8 \right)}}{{45 - 72}}$ |
| KS1 | 44 : 56 | 3 (93) | 2−3 | 2.9 | II (100) | II | $\frac{{46\left( {13} \right)}}{{26 - 68}}$ |
| KS2 | 36 : 64 | 3 (60) | 3−6 | 3.8 | III (74) | II−III | $\frac{{88\left( {41} \right)}}{{35 - 194}}$ |
| Chuk | 44 : 56 | 1 (78) | 1−5 | 1.8 | II (75) | II−VI | $\frac{{50\left( {72} \right)}}{{5 - 270}}$ |
| BerS1 | 23 : 77 | $\frac{{388\left( {79} \right)}}{{230 - 530}}$ | |||||
| BerS2 | 47 : 53 | 3 (67) | 2−4 | 3.1 | IV (100) | IV | $\frac{{343\left( {52} \right)}}{{269 - 457}}$ |
| BerS3 | 81 : 19 | 3 (98) | 3−4 | 3.0 | II (66) | II−III | $\frac{{86\left( {21} \right)}}{{45 - 150}}$ |
| BerS4 | 58 : 42 | 5 (42) | 4−12 | 6.5 | VI (62) | III−VI | $\frac{{302\left( {77} \right)}}{{180 - 495}}$ |
| ОSt | 47 : 53 | 6 (50) | 6−10 | 7.1 | V (53) | IV−V | $\frac{{224\left( {43} \right)}}{{164 - 312}}$ |
Сельдь из тихоокеанских акваторий отличается от особей того же возраста из прибрежных акваторий бассейна Северного Ледовитого океана и СВА бóльшими размерами (табл. 3). Сравнительно низкий темп линейного роста, видимо, обусловлен температурным режимом, характерным для вод арктической зоогеографической зоны, к которым относят воды Белого моря, юго-восточной части Баренцева моря, прибрежных арктических морей и северной части Охотского моря (Шмидт, 1950; Расс, 1979; Жирков, 2017). Соответственно, среди тихоокеанских выборок наименьшую длину имеет сельдь из северной части Охотского моря.
Таблица 3.
Средняя длина (SL, мм) особей тихоокеанской сельди Clupea pallasii разного возраста из разных районов ареала
| Выборка | Возраст, годы | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | |
| WSiv | 145 | 171 | 218 | 241 | 273 | ||||||
| WSeg | 137 | 150 | 152 | 163 | |||||||
| WSeg1 | 121 | 154 | 157 | 162 | 167 | 168 | 172 | ||||
| BS | 143 | 164 | 171 | 211 | 229 | 175 | |||||
| KS | 164 | 178 | 176 | ||||||||
| KS1 | 128 | 166 | |||||||||
| KS2 | 179 | 193 | 221 | 241 | |||||||
| SL | 229 | 237 | 256 | ||||||||
| Chuk | 108 | 157 | 115 | 230 | 245 | ||||||
| BerS2 | 265 | 282 | 295 | ||||||||
| BerS3 | 202 | 217 | |||||||||
| BerS4 | 274 | 288 | 283 | 317 | 329 | 319 | 334 | ||||
| ОSt | 259 | 268 | 274 | 288 | 283 | ||||||
| PacO1 | 133 | 198 | 228 | 258 | 285 | 298 | 309 | 318 | 327 | 335 | |
| JS1 | 139 | 214 | 261 | 290 | 311 | 326 | 338 | ||||
| YS1 | 165 | 241 | 269 | 284 | 292 | 301 | |||||
Меристические признаки. Число позвонков у тихоокеанской сельди варьирует в широких пределах: от 47 до 57 (Световидов, 1952). Наши выборки охватывают евроазиатскую часть ареала тихоокеанской сельди, однако диапазон изменения значений этого признака немного меньше − 48−56 (табл. 4). Наибольший размах выявлен в выборках из арктических акваторий (vert. 48−56); в тихоокеанских выборках пределы варьирования vert. были уже от 50−55 до 53−55. Средние значения в разных регионах варьируют в гораздо меньших пределах (vert. 52.1−53.7). В выборках из прибрежных акваторий бассейна Северного Ледовитого океана и СВА средние значения vert. меньше, чем в тихоокеанских выборках. Исключение составила выборка летненерестующей сельди Белого моря (WSiv), которая от выборок сельди Японского и Жёлтого морей не отличается на достоверном уровне (one-way ANOVA: p > 0.05). Диапазон варьирования числа лучей в спинном плавнике в исследованных выборках несколько шире, чем известно из литературы, – 11−19 против 15−19 (Световидов, 1952). Наименьшие средние значения отмечены в выборках весенненерестующей сельди Белого моря и сельди Тауйской губы Охотского моря (соответственно D 14.8 и 15.2). Число лучей в анальном плавнике варьирует в пределах 12−20. В выборке летненерестующей сельди Белого моря (WSiv) среднее значение больше, чем в других выборках (А 16.5 против 14.6−16.0). Число тычинок на 1-й жаберной дуге в исследованных выборках варьирует в пределах 36−72. Средние значения этого признака в выборках сельди Белого моря достоверно больше (p < 0.05), чем в выборках из арктических и тихоокеанских вод.
Таблица 4.
Меристические признаки тихоокеанской сельди Clupea pallasii в разных районах ареала
| Выборка | vert. | D | А | sp.br. |
|---|---|---|---|---|
| WSiv | $\frac{{53.2\left( {1.1} \right)}}{{51 - 55}}$ | $\frac{{16.8\left( {0.6} \right)}}{{16 - 18}}$ | $\frac{{16.5\left( {0.5} \right)}}{{16 - 17}}$ | $\frac{{61.6\left( {5.9} \right)}}{{50 - 72}}$ |
| WSeg | $\frac{{52.3\left( {1.7} \right)}}{{49 - 56}}$ | |||
| WSeg1 | $\frac{{51.7\left( {2.2} \right)}}{{46 - 56}}$ | $\frac{{14.8\left( {1.8} \right)}}{{11 - 18}}$ | $\frac{{14.6\left( {1.6} \right)}}{{11 - 17}}$ | $\frac{{60.2\left( {3.4} \right)}}{{51 - 69}}$ |
| BS | $\frac{{52.2\left( {0.6} \right)}}{{48 - 55}}$ | $\frac{{16.5\left( {0.3} \right)}}{{13 - 19}}$ | $\frac{{15.0\left( {0.2} \right)}}{{12 - 17}}$ | $\frac{{53.6\left( {2.9} \right)}}{{43 - 59}}$ |
| KS | $\frac{{52.1\left( {2.3} \right)}}{{48 - 56}}$ | $\frac{{17.6\left( {0.7} \right)}}{{16 - 18}}$ | $\frac{{14.8\left( {1.7} \right)}}{{14 - 20}}$ | $\frac{{54.2\left( {1.4} \right)}}{{52 - 55}}$ |
| BerS1 | $\frac{{16.1\left( {0.9} \right)}}{{14 - 17}}$ | |||
| BerS2 | $\frac{{52.5\left( {1.7} \right)}}{{50 - 55}}$ | |||
| ОSt | $\frac{{15.2\left( {1.3} \right)}}{{13 - 17}}$ | |||
| ОS | $\frac{{53.7\left( {0.8} \right)}}{{51 - 56}}$ | $\frac{{17.0\left( {0.7} \right)}}{{15 - 18}}$ | $\frac{{16.0\left( {0.7} \right)}}{{15 - 17}}$ | $\frac{{44.8\left( {1.7} \right)}}{{41 - 48}}$ |
| PacO | $\frac{{53.7\left( {0.6} \right)}}{{53 - 55}}$ | $\frac{{16.8\left( {0.7} \right)}}{{15 - 18}}$ | $\frac{{15.9\left( {0.8} \right)}}{{15 - 17}}$ | $\frac{{42.3\left( {3.0} \right)}}{{36 - 47}}$ |
| JS | $\frac{{53.1\left( {0.8} \right)}}{{51 - 54}}$ | $\frac{{17.5\left( {0.6} \right)}}{{16 - 18}}$ | $\frac{{15.7\left( {0.9} \right)}}{{15 - 18}}$ | $\frac{{43.5\left( {2.2} \right)}}{{38 - 46}}$ |
| YS | $\frac{{53.3\left( {0.9} \right)}}{{51 - 54}}$ | $\frac{{16.3\left( {0.5} \right)}}{{16 - 17}}$ | $\frac{{14.9\left( {0.6} \right)}}{{14 - 16}}$ | $\frac{{41.6\left( {1.9} \right)}}{{39 - 46}}$ |
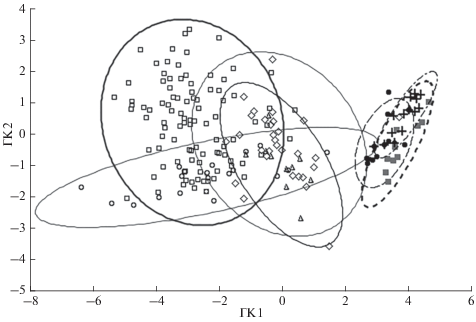
Сравнение выборок сельди Жёлтого, Японского, Охотского, Карского, Баренцева и Белого морей по четырём меристическим признакам (vert., А, D, sp.br.) на основе многомерного дискриминантного анализа представлено на рис. 2. Степень наложения полей рассеяния в рамках выявленных 1-й и 2-й дискриминантными функциями иллюстрирует относительно невысокую степень отличий по комплексу меристических признаков выборок из тихоокеанского региона от выборок из Арктики и СВА. При этом проверка значимости различий в средних объединённых групп выборок на основе анализа дисперсий с использованием критерия наименьшей значимости (LSD test or planned comparison) показала достоверность различий (p < 0.05) по каждому рассматриваемому признаку.
Рис. 2.
Диаграмма рассеяния исследуемых выборок тихоокеанской сельди Clupea pallasii Жёлтого (+), Японского ( ), Охотского (⚫), Карского (△), Баренцева (◇) и Белого (⚪, ◻) морей в пространстве
наиболее значимых главных компонент (ГК) для канонических значений (95%-ный уровень)
по четырём меристическим признакам (число позвонков, лучей в спинном и анальном плавниках,
тычинок на 1-й жаберной дуге). Выборки: (+) – YS, (
), Охотского (⚫), Карского (△), Баренцева (◇) и Белого (⚪, ◻) морей в пространстве
наиболее значимых главных компонент (ГК) для канонических значений (95%-ный уровень)
по четырём меристическим признакам (число позвонков, лучей в спинном и анальном плавниках,
тычинок на 1-й жаберной дуге). Выборки: (+) – YS, ( ) – JS, (⚫) – OS, (△) – KS, (◇) – BS, (⚪) – WSiv, (◻) − WSeg1; индексы выборок см.
в табл. 1.
) – JS, (⚫) – OS, (△) – KS, (◇) – BS, (⚪) – WSiv, (◻) − WSeg1; индексы выборок см.
в табл. 1.
Пластические признаки. Мы использовали характеристики, по мнению Световидова (1952) и Алеева (1963), влияющие на эффективность движения и питания – индексы aD, aA, H, c, ao, lmx, io (табл. 5). Анализ первых четырёх индексов охватывает выборки со всего ареала, так как удалось привлечь данные из источников литературы для южной части Охотского моря, Жёлтого и Японского морей.
Таблица 5.
Пластические признаки тихоокеанской сельди Clupea pallasii в разных районах ареала
| Выборка | aA/SL | aD/SL | с/SL | H/SL | ao/c | lmx/c | io/c | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| M | SD | M | SD | M | SD | M | SD | M | SD | M | SD | M | SD | |
| WSiv | 0.76 | 0.02 | 0.51 | 0.02 | 0.22 | 0.02 | 0.76 | 0.02 | 0.20 | 0.01 | 0.32 | 0.03 | 0.19 | 0.02 |
| WSeg | 0.75 | 0.04 | 0.51 | 0.04 | 0.25 | 0.01 | 0.19 | 0.01 | 0.36 | 0.02 | 0.47 | 0.02 | 0.17 | 0.01 |
| BS | 0.50 | 0.02 | 0.23 | 0.01 | 0.21 | 0.02 | 0.34 | 0.02 | 0.43 | 0.05 | ||||
| KS | 0.40 | 0.02 | 0.23 | 0.01 | 0.21 | 0.01 | 0.34 | 0.03 | 0.44 | 0.05 | ||||
| BerS1 | 0.76 | 0.01 | 0.52 | 0.01 | 0.20 | 0.01 | 0.25 | 0.01 | 0.31 | 0.02 | 0.46 | 0.03 | 0.21 | 0.03 |
| BerS2 | 0.52 | 0.01 | 0.23 | 0.01 | 0.27 | 0.02 | 0.31 | 0.03 | 0.48 | 0.04 | 0.19 | 0.02 | ||
| ОSt | 0.77 | 0.01 | 0.52 | 0.01 | 0.22 | 0.01 | 0.23 | 0.01 | 0.29 | 0.02 | 0.47 | 0.03 | 0.22 | 0.02 |
| ОS | 0.74 | 0.01 | 0.52 | 0.01 | 0.24 | 0.01 | 0.20 | 0.01 | ||||||
| PacO | 0.74 | 0.01 | 0.51 | 0.01 | 0.23 | 0.01 | 0.20 | 0.01 | ||||||
| JS | 0.76 | 0.01 | 0.50 | 0.02 | 0.20 | 0.01 | 0.22 | 0.01 | ||||||
| YS | 0.76 | 0.02 | 0.50 | 0.01 | 0.22 | 0.01 | 0.21 | 0.01 | ||||||
Значения индекса aA/SL в выборках варьируют в пределах 0.74−0.77 (табл. 5). Выборки, относящиеся к разным акваториям Охотского моря, различаются достоверно. Выборка из Жёлтого моря достоверно (p < 0.05) отличается от выборок Охотского моря, но значимо не отличается от беломорских выборок. Значения индекса aD/SL находятся в пределах 0.40−0.52. Наименьшее значение выявлено для выборки из устьевой зоны р. Кара (KS). Эта выборка, а также другая с низким значением aD/SL из прибрежья Чёшско-Печорской губы (BS) достоверно (p < 0.05) отличаются от других выборок. Высокое значение индекса в беринговоморских выборках предположительно может быть связано с высокой миграционной активностью данной группировки тихоокеанской сельди (Алеев, 1963; Науменко, 2001).
Существуют представления о связи взаимного положения спинного и анального плавников сельди с уровнем миграционной активности (Световидов, 1952). В результате анализа собственных и литературных данных (табл. 5) значительные изменения относительного положения D и А не выявлены: разница между значениями индексов aA/SL и aD/SL составляет от 0.22 до 0.26.
Индекс с/SL имеет значения в пределах от 0.20 в выборке из Берингова моря до 0.25 в выборке весенненерестующей беломорской сельди (табл. 5). Индекс H/SL варьирует в пределах 0.19−0.27; наиболее высокие его значения отмечены в выборках из Берингова моря. Самые низкие значения индекса lmx/c выявлены в выборках из Карского моря и юго-восточной части Баренцева моря (различия между ними недостоверны); более высокие значения в выборах из Белого, Баренцева и Охотского морей (различия между этими выборками также недостоверны). Индекс io/c определяли для менее половины выборок. Наиболее высокое значение индекса (0.22) отмечено для выборки из северной части Охотского моря; существенно ниже значения индекса в выборках из Белого моря. Наиболее высокое значение индекса ao/c присуще выборке весенненерестующей беломорской сельди. Низкие значения (0.29 и 0.31) отмечены в выборках из Берингова и Охотского морей (различия между этими выборками недостоверны).
ОБСУЖДЕНИЕ
Исследования особенностей популяционной структурированности тихоокеанской сельди по морфобиологическим показателям проводятся с первой половины прошлого века. На основе полученных данных выделены отдельные в определённой степени репродуктивно самостоятельные группировки в разных частях ареала. Например, сельди заливов Белого моря (Световидов, 1952; Лапин, 1978), сельди тихоокеанских акваторий (Шунтов, 1985; Науменко, 2001), получившая статус расы карская сельдь (Есипов, 1938, 1952) и другие. Для сельди, а также для других представителей ихтиофауны выявлена роль факторов среды в формировании морфологических характеристик (Световидов, 1944, 1948, 1952; Алеев, 1963).
В Тихом океане сельдь появилась в результате плиоценового расселения предковой формы атлантической сельди C. harengus в Северную Пацифику при формировании Берингова пролива 4.5–3.5 млн лет назад (Grant, 1986). При этом длительная раздельная эволюция сельди в Атлантике и Пацифике не привела к формированию значительных морфологических различий (кроме числа позвонков, в связи с чем атлантическую сельдь относят к многопозвонковым, а тихоокеанскую – к малопозвонковым сельдям). Это способствовало тому, что длительное время атлантическая и тихоокеанская сельди рассматривались как два сестринских подвида океанической сельди (Световидов, 1952). Применение генетических методов окончательно подтвердило видовой статус атлантической и тихоокеанской сельдей (Grant, 1986). Необходимо отметить, что при большой степени морфологического сходства атлантическая и тихоокеанская сельди различаются по биологическим характеристикам, что наиболее ярко проявляется в нерестовый период. Дело в том, что атлантическая сельдь, в плиоцене проникнув в северотихоокеанские акватории, столкнулась с другой структурой океанского ложа. Если в Северной Атлантике присутствует обширный материковый шельф с глубинами 200 м и больше, каменисто-песчаные грунты которого атлантическая сельдь использует в качестве нерестового субстрата (икра в приклеенном состоянии развивается на глубинах преимущественно 100−200 м при стабильных термохалинных условиях (2−6°С, 33−34‰)), то в Северной Пацифике узкий материковый шельф за небольшим исключением переходит в глубоководный жёлоб (глубина 6000 м и более). Так как формирование высокой численности требует для представителя субстратофильной экологической группы обширных нерестовых площадей, сельдь в Тихом океане вынуждена была выработать новую нерестовую стратегию. Тихоокеанская сельдь нерестится в прибрежье на небольших глубинах (от 3 до 15 м) на растительный, скальный, каменистый субстрат (Световидов, 1952), в том числе в прибрежных озёрах лагунного типа. Все это привело к тому, что производители и развивающиеся в икринке эмбрионы сельди адаптировались к значительным колебаниям температуры и солёности (Науменко, 2001). Это даёт тихоокеанской сельди определённые преимущества по отношению к атлантической сельди при освоении прибрежных арктических вод, в том числе характеризующихся изменчивостью термохалинных условий в разные сезоны года. В отличие от атлантической тихоокеанская сельдь в послеледниковый период через открывшийся Берингов пролив вышла из Северной Пацифики в арктические воды и стала расселяться, в том числе вдоль арктического побережья Евразии, сформировав различного объёма группировки в Чукотском море, море Лаптевых, Карском море, юго-восточной части Баренцева моря, в Белом море (Парин и др., 2014). Послеледниковая трансгрессия океана способствовала не только формированию акваторий в северной части Охотского моря (Тауйская губа, зал. Шелихова), но и образованию акватории Жёлтого моря. Эти новообразованные акватории также были заселены тихоокеанской сельдью.
В связи с вышеизложенным условия обитания тихоокеанской сельди в разных районах ареала рассматривались с акцентом на нерестовый период. Показано, что условия обитания и нереста сельди в разных акваториях в сильной степени различаются (табл. 6). Так, Тауйская губа Охотского моря характеризуется различной степенью распреснения (5−28‰) (Галкина, 1960; Панфилов, Черешнев, 2006) и отрицательной температурой вод в весенний период, которая формируется на фоне относительно небольших глубин и воздействия зимних муссонов, приносящих переохлаждённый воздух с суши. Такие условия стимулируют более поздний нерест сельди в Тауйской губе Охотского моря, главным образом, в конце мая–начале июня при оптимальной температуре 2−6°С (Овчинников и др., 2018). Жёлтое море лежит на границе субтропической зоны (Микулин, 2003) и характеризуется высокой летней температурой, особенно в мелководной прибрежной зоне. В связи с этим нерест сельди приходится на раннюю весну (март−апрель) при температуре 0−6°С (Hay et al., 2001). Данные по морям арктического шельфа свидетельствуют в пользу того, что нерест проходит при сходных значениях температуры (3−6°С). При этом такая степень прогрева вод в северных акваториях достигается в разное время. В связи с этим различаются и сроки нереста сельди: в море Лаптевых (б. Тикси) и в Карском море – август–сентябрь, в Чёшской губе Баренцева моря − конец мая–июнь, в Белом море – май−июнь. При этом в качестве исключения необходимо отметить существование в Кандалакшском заливе Белого моря весенненерестующей группировки (егорьевская сельдь), нерест которой проходит при отрицательной температуре в марте−апреле. Такая адаптация (Семенова и др., 2006; Озернюк, 2006) возникла в условиях расширения возможностей освоения на ранних этапах развития кормовых ресурсов (наиболее мощная вспышка численности зоопланктона в Кандалакшском заливе приходится на весенний период) (Прыгункова, 1987; Перцова, Кособокова, 2006).
Таблица 6.
Биологические показатели тихоокеанской сельди Clupea pallasii из разных районов ареала
| Море: группировка, стадо |
Максимальные размеры | Возраст, годы | Индивиду-альная плодови-тость, тыс. икринок | Период нереста, месяцы | Условия нереста | Источник информации | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| длина (SL), см | масса, г |
max | достижения половой зрелости | температура, °С |
солёность, ‰ |
глубина, м |
||||
| Белое: | ||||||||||
| – егорьевская | 25.0 | 100 | 6−7 | 2−3 | 2–21 | IV–VI | 1.5−2.0 | 20−24 | 1−5 | 2 |
| – ивановская | 40.0 | 600 | 6−7 | 2−3 | 2–21 | IV–VI | 6.0−8.0 | 20−24 | 1−5 | 2 |
| Жёлтое море | 30.5 | 300 | 6 | 2 | 19–78 | II–III | 0–6.0 | 30 | 3−7 | 7, 8, 9 |
| Берингово | 35.0 | 580 | 18−20 | 4−7 | II–VII | 4.0−11.0 | 34 | 5−15 | 5, 7, 9, 15, 18 | |
| Охотское: | ||||||||||
| – охотское | 34.0 | 237 | 16 | 5−6 | 34.5 | V–VI | 2.0−9.0 | 5−28 | 2−15 | 3, 4, 5, 12, 13, 14, 16, 17, 18 |
| – гижигинско-камчатское | 37.2 | 585 | 16 | 5−6 | 46.0 | V–VI | 2.0−9.0 | 5−28 | 2−15 | То же |
| – тауйское | 35.0 | 430 | 12 | 5−6 | 45.5 | V–VI | 2.0−9.0 | 5−28 | 2−15 | » |
| Карское | 31.5 | 173 | 12 | VIII–IX | 4.0−5.0 | 22−24 | 5−15 | 1, 6 | ||
| Лаптевых | 8 | 4 | 40 | VIII–IX | 3.5−5.5 | 17−20 | 3−5 | 4, 6 | ||
| СЗТО | 40.0 | 18 | 4−6 | V–VI | 4.0−6.0 | 34 | 0.5−4.0 | 4, 9, 10, 11, 15 | ||
Примечание. max – максимальное значение, СЗТО – северо-западная часть Тихого океана. Источники информации: 1 – Есипов, 1952; 2 − Алтухов и др., 1958; 3 – Галкина, 1960; 4 − Кириллов, 1972; 5 – Тюрнин, 1975; 6 − Добровольский, Залогин, 1982; 7 – Hay, 1985; 8 − Jin, 1996; 9 − Hay et al., 2001; 10 – Науменко, 2001; 11 – Яржомбек, 2002; 12 – Кащенко, 2004; 13 – Фархутдинов, 2005; 14 – Панфилов, Черешнев, 2006; 15 − Промысловые рыбы России, 2006; 16 – Смирнов, 2009; 17 – Смирнов, 2014; 18 – Овчинников и др., 2018.
Диапазоны нерестовой температуры тихоокеанской сельди сходны на широтах от субтропиков до Арктики (в пределах 2−6°С). То есть сельдь без значительных физиологических преобразований за счёт нерестовых миграций в послеледниковый период эффективно освоила акватории СВА, Арктики, Пацифики.
Как следствие, выбор группировками сельди арктических, бореальных, субтропических акваторий оптимальных температурных условий путём изменения сроков нерестового периода (Алтухов и др., 1958; Кириллов, 1972; Hay et al., 2001), с одной стороны, содействовало успешному освоению акваторий разных зоогеографических зон, а с другой стороны, способствовало поддержанию относительно невысокой изменчивости морфологических характеристик. Так, например, по комплексу меристических признаков мы выявили относительно невысокую степень отличия выборок тихоокеанского региона от выборок Арктики и СВА.
Темп роста особей в субтропической зоне выше, чем в арктической. При этом наиболее высокий темп роста отмечен в бореальной зоне, что согласуется с представлениями о наиболее высоких показателях роста при оптимальных значениях факторов среды (Бретт, 1983). Видимо, этому соответствует и высокое значение индекса высоты тела (H/SL) в беринговоморских выборках.
Для выборки сельди из северных акваторий Охотского моря (Тауйская губа) отмечены высокие значения индексов ao/c, lmx/c, а также наибольшее относительно других выборок значение индекса io/c. Учитывая фундаментальные исследования Алеева (1963) в области оценки функциональности внешнего строения у рыб разных систематических групп, такое строение головы тихоокеанской сельди из Тауйской губы (Панфилов, Черешнев, 2006; Смирнов, 2009) обеспечивает более высокую эффективность питания в прибрежных акваториях при невысоком уровне миграционной активности.
Таким образом, анализ биологических и морфологических характеристик тихоокеанской сельди с использованием как собственных данных, так и материалов литературы показал, что формирование современного ареала этого вида, охватывающего акватории арктической, бореальной, субтропической зоогеографических зон, обусловлено в том числе системой адаптаций, выработанных в ходе длительной эволюции в специфических условиях Северной Пацифики. Невысокая изменчивость морфологических характеристик в группировках тихоокеанской сельди из разных акваторий её широкого ареала при кардинальной изменчивости факторов среды связана в том числе с тем, что раннее развитие проходит при сходных температурных условиях, это достигается путём смещения сроков нерестового периода на зиму−раннюю весну в субтропической зоне, на конец лета–раннюю осень в арктическом регионе.
На основе данных многомерного дискриминантного анализа выявлена относительно невысокая степень отличий по комплексу меристических признаков выборок тихоокеанского региона от выборок Арктики и СВА. При этом наиболее высокий темп роста характерен для сельди бореальной зоны (в частности, Берингова моря) при оптимальных значениях факторов среды.
Список литературы
Алеев Ю.Г. 1963. Функциональные основы внешнего строения рыб. М.: Изд-во АН СССР, 247 с.
Алтухов К.А., Михайловская А.А., Мухомедияров Ф.Б. и др. 1958. Рыбы Белого моря. Петрозаводск: Госиздат Карел. АССР, 162 с.
Андрияшев А.П., Чернова Н.В. 1994. Аннотированный список рыбообразных и рыб морей Арктики и сопредельных вод // Вопр. ихтиологии. Т. 34. № 4. С. 435−456.
Бретт Дж.Р. 1983. Факторы среды и рост // Биоэнергетика и рост рыб / Под ред. Хоара У. и др. М.: Лег. и пищ. пром-сть. С. 275−345.
Галкина Л.А. 1960. Размножение и развитие охотской сельди // Изв. ТИНРО. Т. 46. С. 3–40.
Горбачев B.В., Черноиванова Л.А., Панфилова П.Н. и др. 2012. Филогеография тихоокеанской сельди (Clupea pallasii) некоторых морей Евразии // Генетика. Т. 48. № 9. С. 1091−1097.
Добровольский А.Д., Залогин Б.С. 1982. Моря СССР. М.: Изд-во МГУ, 192 с.
Есипов В.К. 1938. О малопозвонковых сельдях Карского и Баренцева морей // Тр. ПИНРО. Вып. 1. С. 149−159.
Есипов В.К. 1952. Рыбы Карского моря. М.: Изд-во АН СССР, 146 с.
Жирков И.А. 2017. Био-география. Общая и частная: суши, моря и континентальных водоёмов. М.: Т-во науч. изд. КМК, 568 с.
Ивантер Э.В., Коросов А.В. 2003. Введение в количественную биологию. Петрозаводск: Изд-во ПетрГУ, 304 с.
Картавцев Ю.Ф., Рыбникова И.Г. 1999. Генетическое и морфобиологическое исследование популяций тихоокеанской сельди Clupea pallasi из Японского и Охотского морей // Генетика. Т. 35. № 8. С. 1093–1103.
Кащенко Е.В. 2004. Биологическая характеристика и промысел нерестовой сельди Тауйской губы по результатам исследований 2002−2003 гг. // Сб. науч. тр. МагаданНИРО. Вып. 2. С. 173−188.
Кириллов Ф.Н. 1972. Рыбы Якутии. М.: Наука, 359 с.
Курносов Д.С., Орлова С.Ю., Смирнова М.А. 2016. Генетическая изменчивость тихоокеанской сельди (Clupea pallasii Val.) Охотского моря и озера Айнского по микросателлитным локусам // Изв. ТИНРО. Т. 187. С. 116−121.
Лапин Ю.Е. 1978. Общая характеристика сельди Белого моря // Экология рыб Белого моря. М.: Наука. С. 37−52.
Микулин А.Е. 2003. Зоогеография рыб. М.: Изд-во ВНИРО, 436 с.
Моисеев П.А., Карпевич А.Ф., Романычева О.Д. и др. 1985. Морская аквакультура. М.: Агропромиздат, 253 с.
Науменко Н.И. 2001. Биология и промысел морских сельдей Дальнего Востока. Петропавловск-Камчатский: Камчат. печат. двор, 330 с.
Овчинников В.В., Смирнов А.А., Волобуев В.В. и др. 2018. Основные промысловые рыбы Магаданской области: биология, экология, запасы, уловы. М.: Изд-во ВНИРО, 209 с.
Озернюк Н.Д. 2006. Адаптации к низким температурам у пойкилотермных организмов // Тр. ББС МГУ. Т. 10. С. 117−119.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2001. Тихоокеанские благородные лососи и форели Азии. М.: Науч. мир, 200 с.
Панфилов А.М., Черешнев И.А. 2006. Тихоокеанская сельдь // Ландшафты, климат и природные ресурсы Тауйской губы Охотского моря. Владивосток: Дальнаука. С. 418−425.
Парин Н.В., Евсеенко С.А., Васильева Е.Д. 2014. Рыбы морей России: аннотированный каталог. М.: Т-во науч. изд. КМК, 733 с.
Перцова Н.М., Кособокова К.Н. 2006. Сезонная динамика состава и биомассы зоопланктона прибрежных и открытых районов Белого моря по многолетним данным // Тр. ББС МГУ. Т. 10. С. 139−145.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 376 с.
Промысловые рыбы России. 2006. Т. 1 / Под. ред. Гриценко О.Ф. и др. М.: Изд-во ВНИРО, 540 с.
Прыгункова Р.В. 1987. Пространственно-временные изменения структуры и количества зоопланктона Кандалакшского залива Белого моря в летний период // Морской и пресноводный планктон. Л.: Изд-во ЗИН АН СССР. С. 68−82.
Расс Т.С. 1979. Биогеографическая основа районирования рыбопродуктивных зон Мирового океана // Биологические ресурсы Мирового океана. М.: Наука. С. 48–83.
Световидов А.Н. 1944. О чертах сходства и различия в распространении, экологии и некоторых других особенностях между треской и океанической сельдью // Зоол. журн. Т. 23. Вып. 4. С. 146−155.
Световидов А.Н. 1948. Фауна СССР. Рыбы. Т. 9. Вып. 4. Трескообразные. М.; Л.: Изд-во АН СССР, 221 с.
Световидов А.Н. 1952. Фауна СССР. Рыбы. Т. 2. Вып. 1. Сельдевые (Clupeidae). М.; Л.: Изд-во АН СССР, 331 с.
Семенова А.В., Андреева А.П., Карпов А.К. и др. 2006. Генетическая дифференциация весенне- и летненерестующих малопозвонковых сельдей рода Clupea в Кандалакшском заливе Белого моря // Тр. ББС МГУ. Т. 10. С. 187−195.
Семенова А.В., Строганов А.Н., Смирнов А.А. и др. 2014. Генетическая изменчивость сельдей Clupea pallasii Охотского моря по микросателлитным маркерам // Генетика. Т. 50. № 2. С. 197−202. https://doi.org/10.7868/S0016675813120102
Семенова А.В., Строганов А.Н., Афанасьев К.И. и др. 2018. Микросателлитная изменчивость тихоокеанской сельди Clupea pallasii Valenciennes 1847 Охотского и Берингова морей // Там же. Т. 54. № 3. С. 349−360.https://doi.org/10.7868/S0016675818030086
Смирнов А.А. 2009. Гижигинско-камчатская сельдь. Магадан: Изд-во МагаданНИРО, 149 с.
Смирнов А.А. 2014. Биология, распределение и состояние запасов гижигинско-камчатской сельди. Магадан: Изд-во МагаданНИРО, 170 с.
Смирнов А.А., Марченко С.Л., Кащенко Е.В. 2005. Оценка популяционного статуса сельди Тауйской губы Охотского моря по результатам морфометрического анализа 2001–2002 гг. // Тез. докл. VI науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловк-Камчатский: Камчатпресс. С. 253–255.
Тюрнин Б.В. 1975. Структура нерестовой популяции сельди северо-западной части Охотского моря, ее динамика и биологические основы прогнозирования улова: Автореф. дис. … канд. биол. наук. Владивосток: ТИНРО, 23 с.
Урбах В.Ю. 1963. Математическая статистика для биологов и медиков. М.: Изд-во АН СССР, 324 с.
Фархутдинов Р.К. 2005. Экология воспроизводства, динамика численности и состояние запасов охотской сельди: Автореф. дис. … канд. биол. наук. Дмитров: ВНИИПРХ, 22 с.
Чепракова Ю.И. 1966. Биологическая характеристика мелкой малопозвонковой сельди Кандалакшского залива и особенности размножения // Закономерности динамики численности рыб Белого моря и его бассейна. М.: Наука. С. 12−16.
Чугунова Н.И. 1959. Руководство по изучению возраста и роста рыб. М.: Изд-во АН СССР, 164 с.
Шмидт П.Ю. 1950. Рыбы Охотского моря. М.; Л.: Изд-во АН СССР, 370 с.
Шунтов В.П. 1985. Биологические ресурсы Охотского моря. М.: Агропромиздат, 224 с.
Яржомбек А.А. 2002. Справочные материалы по росту рыб: сельдевые и миктофиды. М.: Изд-во ВНИРО, 96 с.
Grant W.S. 1986. Biochemical genetic divergence between Atlantic, Clupea harengus, and Pacific, C. pallasi, herring // Copeia. № 3. P. 714−719.
Grant W.S., Liu M., Gao T., Yanagimoto T. 2012. Limits of Bayesian skyline plot analysis of mtDNA sequences to infer historical demographies in Pacific herring (and other species) // Mol. Phylogen. Evol. V. 65. P. 203–212. .https://doi.org/10.1016/j.ympev.2012.06.006
Hay D.E. 1985. Reproductive biology of Pacific herring (Clupea harengus pallasi) // Can. J. Fish. Aquat. Sci. V. 42. P. 111–126.
Hay D.E., Toresen R., Stephenson R. et al. 2001. Taking stock: an inventory and review of World herring stocks in 2000 // Herring: expectations for a New Millennium. Alaska Sea Grant College Program. AK-SG-01-04. P. 381−454.
Jin X. 1996. Variations in fish community structure and ecology of major species in the Yellow/Bohai Sea: Ph. D. Thesis. Bergen: Univ. Bergen, 47 p.
Liu M., Wang Y.J., Gao T.X. et al. 2007. Morphological comparison of Pacific herring Clupea pallasii in China and Japan // J. Ocean Univ. China. V. 37. P. 131−136.
Liu M., Gao T., Sakurai Y. et al. 2011. Mitochondrial DNA control region diversity and population structure of Pacific herring (Clupea pallasii) in the Yellow Sea and the Sea of Japan // Chinese J. Oceanol. Limnol. V. 29. P. 317–325.
Orlova S.Y., Kurnosov D.S., Chikurova E.A., Shchepetov D.M. 2019. Genetic relationship between lake and marine forms of Pacific herring Clupea pallasii // J. Ichthyol. V. 59. № 6. P. 843–852.https://doi.org/10.1134/S0032945219060080
Semenova A.V., Stroganov A.N., Afanasiev K.I., Rubtsova G.A. 2015. Population structure and variability of Pacific herring (Clupea pallasii) in the White Sea, Barents and Kara Seas revealed by microsatellite DNA analyses // Polar. Biol. V. 38. № 7. P. 951–959 .https://doi.org/10.1007/s00300-015-1653-8
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


