Вопросы ихтиологии, 2022, T. 62, № 6, стр. 701-720
Особенности биологии массовых рыб в российских водах Чукотского моря. 3. Семейства сельдевые Clupeidae, корюшковые Osmeridae, лососёвые Salmonidae
А. В. Датский 1, *, Е. В. Ведищева 1
1 Всероссийский научно-исследовательский институт
рыбного хозяйства и океанографии – ВНИРО
Москва, Россия
* E-mail: adatsky@vniro.ru
Поступила в редакцию 22.09.2021
После доработки 22.02.2022
Принята к публикации 24.03.2022
- EDN: IDMEJZ
- DOI: 10.31857/S0042875222060078
Аннотация
На основе исследований 1995–2020 гг. выделены массовые и потенциально промысловые рыбы российских вод Чукотского моря. Из 72 видов, отмеченных в траловых уловах, 16 видов из шести семейств являлись массовыми, среди которых корюшковые (Osmeridae), лососёвые (Salmonidae) и сельдевые (Clupeidae) составляли в среднем соответственно 1.5, 0.2 и 0.1% всей промысловой биомассы морских рыб. Для видов проанализированных семейств рассмотрены размерно-возрастные и весовые характеристики, особенности линейного и весового роста, сроки, масштабы и условия нереста. Проведено сравнение биологических показателей рыб из Чукотского и Берингова морей, прочих водоёмов. Навага Eleginus gracilis, корюшка Osmerus mordax dentex, треска Gadus macrocephalus, чёрный палтус Reinhardtius hippoglossoides, некоторые виды керчаков представлены преимущественно молодью и неполовозрелыми особями, появление старшевозрастных рыб отмечено в климатически тёплые годы. Для минтая G. chalcogrammus, тихоокеанских лососей, желтобрюхой Pleuronectes quadrituberculatus и звёздчатой Platichthys stellatus камбал свойственно присутствие старшевозрастных особей. У сайки Boreogadus saida, северной палтусовидной Hippoglossoides robustus, желтопёрой Limanda aspera, сахалинской L. sakhalinensis, хоботной L. proboscidea камбал, сельди Clupea pallasii, мойвы Mallotus villosus catervarius, бородавчатого керчака Myoxocephalus verrucosus в пределах чукотского шельфа зарегистрированы меньшие размеры тела, нежели в Беринговом море.
В двух первых сообщениях (Вопросы ихтиологии. 2022. Т. 62. № 4. С. 387–412. № 5. С. 572–591) представлены многолетние материалы по промысловой биомассе морских рыб и особенностям биологии представителей семейств тресковые Gadidae, камбаловые Pleuronectidae и рогатковые Cottidae в пределах российских вод Чукотского моря. Для массовых видов этих семейств проанализированы размерно-возрастные, весовые характеристики рыб, особенности их линейного и весового роста, сроки, масштабы и условия нереста в исследованном водоёме и прилегающей к нему акватории северо-западной части Берингова моря. В данной статье приведены аналогичные данные по отдельным видам семейств сельдевые Clupeidae, корюшковые Osmeridae и лососёвые Salmonidae, а также итоговое заключение об особенностях биологии рыб российских вод Чукотского моря и перспективах их промыслового использования.
Информация о материале и методике, а также о промысловой биомассе массовых рыб в целом приведена в первом сообщении (Датский и др., 2022). Отметим, что основой послужили материалы девяти комплексных траловых съёмок с 1995 по 2020 гг., проведённых на научно-исследовательских судах Базы исследовательского флота ВНИРО (до 2018 г. БИФ ТИНРО), в ходе которых выполнено 366 тралений. В целом в летне-осенний период исследованиями была охвачена значительная акватория российского сектора Чукотского моря, за исключением его прибрежной мелководной части с глубинами < 26 м. Траловые съёмки в 2003, 2007, 2008 гг. были пелагическими, в прочие годы – донными. Полученные данные по биологии рыб чукотского шельфа сопоставляли с материалами траловых съёмок в северо-западной части Берингова моря, опубликованными ранее (Датский, Андронов, 2007; Datsky, 2015а; Датский, Мазникова, 2017), а также с прочими акваториями.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Семейство сельдевые (Clupeidae)
Тихоокеанская сельдь Clupea pallasii – пелагическая рыба, при этом в период суточных миграций образующая значительные скопления и у дна. Достигает длины тела по Смитту (FL) 46 см, массы – 1.09 кг, предельного возраста – 18 лет (Науменко, 2001; Mecklenburg et al., 2016). Однако продолжительность жизни особей в большинстве популяций не превышает 14 лет, основная масса рыб в период нереста имеет возраст 4–9 лет и FL 25–32 см (Качина, 1986; Нагульная сельдь …, 2001, 2004). Отличительной особенностью вида в северной части ареала является уменьшение размеров тела рыб с юга на север, обусловленное различием в скорости роста, на который влияют обилие, доступность и состав корма, а также температурные условия в период миграционной активности сельди (Качина, 1986; Науменко, 2001; Лобода, Жигалин, 2017). В Чукотском море сельдь не столь многочисленна, как в Беринговом и Охотском морях, однако может формировать локальные промысловые скопления (Датский и др., 2022. Табл. 2).
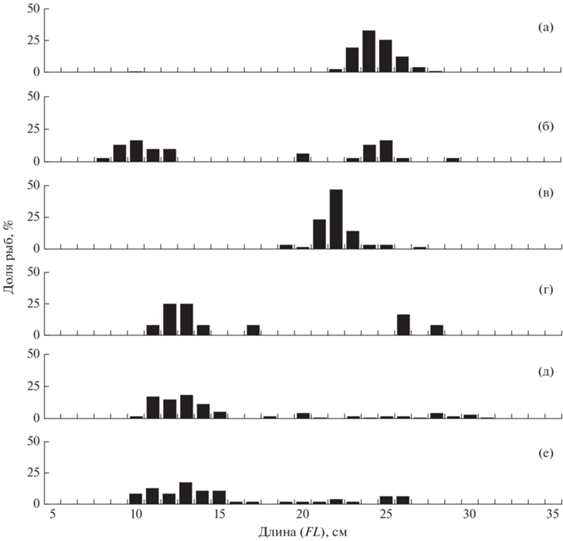
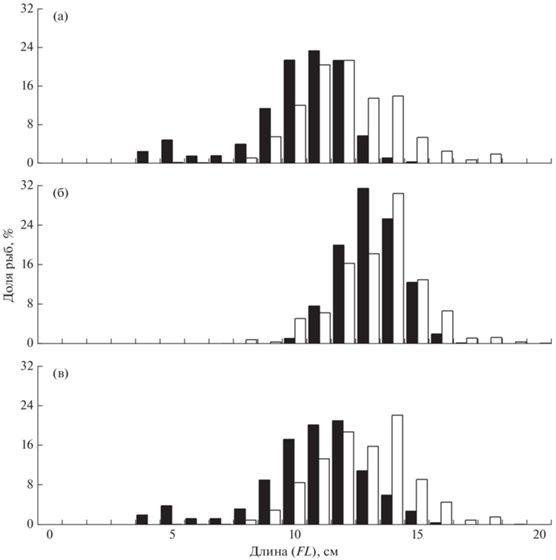
На чукотском шельфе сельдь была представлена особями FL 8–31 см. Основу скоплений составляли рыбы FL 9–15 см и 21–26 см. В пелагиали, в отличие от придонных слоёв, сельдь имела бо́льшие размеры. В первом случае доминировали особи FL 23–26 см с незначительным присутствием годовиков FL 9–12 см, во втором, наоборот, уловы в основном состояли из рыб FL 10–15 см, а особи FL > 21 см встречались в меньших количествах (рис. 1). Так же хорошо заметно присутствие в акватории Чукотского моря в тёплые по гидрологическим параметрам годы (2018–2020) более рослой молоди. Данный факт может быть обусловлен смещением сельди в этот период в северном направлении и соответствующим изменением рациона питания (Andrews et al., 2016; Yasumiishi et al., 2020).
Рис. 1.
Размерный состав сельди Clupea pallasii в траловых уловах в российских водах Чукотского моря: а – август 2007 г. (M = 24.4 см, n = 442 экз.), б – сентябрь 2008 г. (M = 16.7 см, n = 30 экз.), в – сентябрь 2010 г. (M = 22.0 см, n = 55 экз.), г – сентябрь 2018 г. (M = 16.4 см, n = 12 экз.), д – август 2019 г. (M = 16.2 см, n = 86 экз.), е – август–сентябрь 2020 г. (M = 15.6 см, n = 46 экз.).
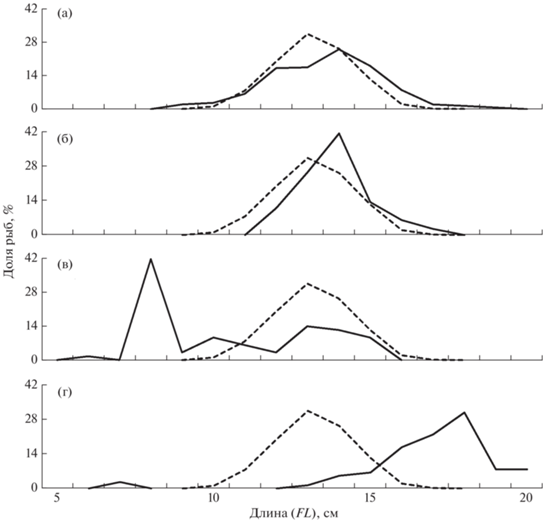
Сельдь с чукотского шельфа имеет существенно меньшие размеры тела, нежели рыбы из северо-западной части Берингова моря, где основу запасов составляли особи FL 30–34 см, а молодь практически не отмечена. Особенно велики различия в размерах между представителями вида в придонных слоях (рис. 2). Рыбы с наибольшими размерами тела обитали в Корякском районе, где велика вероятность присутствия нагульной корфо-карагинской сельди, отличающейся от других группировок наибольшими размерами тела (Науменко, 2001; Датский, 2017). Особенностью этого района является также примыкание к наваринскому шельфу глубоководных участков материкового склона, что благоприятствует обитанию старшевозрастных рыб в придонных слоях. В мелководной северной части Анадырского залива доля такой сельди снижалась, преобладали рыбы FL 29–32 см, отмечено появление в уловах молоди. Ещё значительнее уменьшались размеры рыб по направлению к Берингову проливу, в бассейне Чирикова (рис. 3). Здесь и в Анадырском заливе, по-видимому, доминирует половозрелая сельдь, пришедшая на нагул из восточной части Берингова моря (Датский, Андронов, 2007; Лобода, Жигалин, 2017). Предположительно, восточноберинговоморская сельдь совершает миграции и на чукотский шельф (Науменко, Джагильдин, 1987; Mecklenburg et al., 2016), а присутствие здесь молоди обусловлено её выносом течениями из северной части Анадырского залива или близлежащих к району исследований заливов и лагун северной части Берингова моря, где вид может образовывать местные локальные группировки. Подтверждает единое нагульное пространство и встречаемость сельди по всей пелагиали северной части Берингова и восточной части Чукотского морей в пределах американских вод по данным 2012–2013 гг., при этом размеры рыб в целом были наибольшими в южной части Чукотского моря, уменьшаясь к северу моря и в акватории южнее Берингова пролива (De Robertis et al., 2017).
Рис. 2.
Размерный состав сельди Clupea pallasii морей в пелагических (а), донных (б) и смешанных (в) траловых уловах в российских водах Чукотского (◼) и Берингова (⬜) морей в 2001–2020 гг.
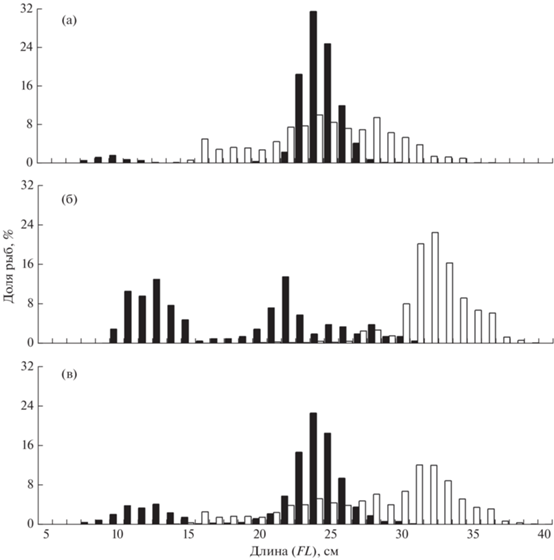
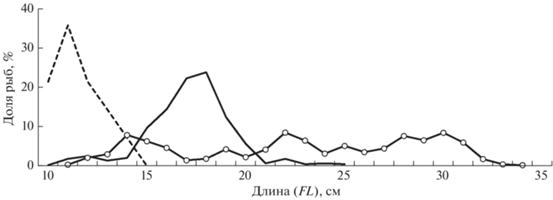
Рис. 3.
Размерный состав сельди Clupea pallasii в траловых уловах в российских водах в 2001–2020 гг.: (‑ ‑) – Чукотское море (M = 18.1 см, n = 208 экз.); (—) – Берингово море: а – бассейн Чирикова (M = 24.0 см, n = 180 экз.), б – северная часть Анадырского залива (M = 28.3 см, n = 622 экз.), в – Корякский район (M = 34.3 см, n = 1766 экз.).
Длина тела неполовозрелых рыб в районе исследований составляла 8–15 см, масса – 2–32 г. Самки были меньше самцов: 15–30 см и 32–265 г против 19–30 см и 55–260 г (табл. 1). С увеличением длины рыб на каждые 5 см, начиная с 10 см и заканчивая 30 см, масса возрастала соответственно на 25, 38, 98 и 95 г. При этом наибольший прирост массы отмечен у рыб FL 24–25, 29–30 и 20–21 см (соответственно 39, 33 и 29 г). Размеры тела сельди близки к таковым для восточноберинговоморской сельди, рассчитанным ранее (Датский, Андронов, 2007). Зависимость массы (W, г) от длины (FL, см) сельди в российской части Чукотского моря описывается уравнением: W = = 0.0022FL3.4778 (r = 0.98, n = 5133 экз.).
Таблица 1.
Длина, масса и соотношение полов у сельди Clupea pallasii из уловов в российских водах Чукотского моря
| Сроки работ (месяц, год) | n, экз. | Длина (FL), см | Масса, г | Соотношение самки : самцы | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Неполовозрелые | Половозрелые | Неполовозрелые | Половозрелые | |||||||
| самки | самцы | оба пола | самки | самцы | оба пола | |||||
| 08–09.1997 | 9 | $\frac{{}}{{9.0}}$ | $\frac{{23.0{\kern 1pt} --{\kern 1pt} 28.0}}{{26.0}}$ | $\frac{{24.0{\kern 1pt} --{\kern 1pt} 28.0}}{{26.4}}$ | $\frac{{23.0{\kern 1pt} --{\kern 1pt} 28.0}}{{26.2}}$ | $\frac{{}}{{19.0}}$ | $\frac{{140{\kern 1pt} --{\kern 1pt} 210}}{{170}}$ | $\frac{{150{\kern 1pt} --{\kern 1pt} 260}}{{194}}$ | $\frac{{140{\kern 1pt} --{\kern 1pt} 260}}{{185}}$ | 1.0 : 1.7 |
| 08.2003 | 5 | $\frac{{}}{{8.7}}$ | $\frac{{25.8{\kern 1pt} --{\kern 1pt} 26.6}}{{26.2}}$ | $\frac{{23.0{\kern 1pt} --{\kern 1pt} 26.5}}{{24.7}}$ | $\frac{{23.0{\kern 1pt} --{\kern 1pt} 26.6}}{{25.4}}$ | $\frac{{}}{{6.0}}$ | $\frac{{220{\kern 1pt} --{\kern 1pt} 229}}{{225}}$ | $\frac{{138{\kern 1pt} --{\kern 1pt} 222}}{{180}}$ | $\frac{{138{\kern 1pt} --{\kern 1pt} 229}}{{202}}$ | 1.0 : 1.0 |
| 08.2007 | 119 | $\frac{{7.7{\kern 1pt} --{\kern 1pt} 13.4}}{{10.0}}$ | $\frac{{22.0{\kern 1pt} --{\kern 1pt} 26.9}}{{23.6}}$ | $\frac{{21.5{\kern 1pt} --{\kern 1pt} 27.0}}{{23.9}}$ | $\frac{{21.5{\kern 1pt} --{\kern 1pt} 27.0}}{{23.8}}$ | $\frac{{2{\kern 1pt} --{\kern 1pt} 18}}{{7.7}}$ | $\frac{{102{\kern 1pt} --{\kern 1pt} 189}}{{129}}$ | $\frac{{97{\kern 1pt} --{\kern 1pt} 190}}{{133}}$ | $\frac{{97{\kern 1pt} --{\kern 1pt} 190}}{{131}}$ | 1.0 : 1.1 |
| 09.2010 | 45 | – | $\frac{{20.2{\kern 1pt} --{\kern 1pt} 24.2}}{{21.9}}$ | $\frac{{19.2{\kern 1pt} --{\kern 1pt} 27.0}}{{21.8}}$ | $\frac{{19.2{\kern 1pt} --{\kern 1pt} 27.0}}{{21.9}}$ | – | $\frac{{90{\kern 1pt} --{\kern 1pt} 150}}{{111}}$ | $\frac{{75{\kern 1pt} --{\kern 1pt} 230}}{{115}}$ | $\frac{{75{\kern 1pt} --{\kern 1pt} 230}}{{113}}$ | 1.0 : 1.6 |
| 08.2019 | 53 | $\frac{{10.0{\kern 1pt} --{\kern 1pt} 14.5}}{{12.1}}$ | $\frac{{17.6{\kern 1pt} --{\kern 1pt} 29.8}}{{24.5}}$ | $\frac{{19.5{\kern 1pt} --{\kern 1pt} 29.7}}{{24.7}}$ | $\frac{{17.6{\kern 1pt} --{\kern 1pt} 29.8}}{{24.6}}$ | $\frac{{5{\kern 1pt} --{\kern 1pt} 32}}{{12.1}}$ | $\frac{{35{\kern 1pt} --{\kern 1pt} 256}}{{146}}$ | $\frac{{55{\kern 1pt} --{\kern 1pt} 270}}{{156}}$ | $\frac{{35{\kern 1pt} --{\kern 1pt} 270}}{{150}}$ | 1.1 : 1.0 |
| 08–09.2020 | 13 | $\frac{{9.6{\kern 1pt} --{\kern 1pt} 13.4}}{{11.5}}$ | $\frac{{15.4{\kern 1pt} --{\kern 1pt} 25.5}}{{22.5}}$ | $\frac{{21.1{\kern 1pt} --{\kern 1pt} 26.4}}{{24.4}}$ | $\frac{{15.4{\kern 1pt} --{\kern 1pt} 26.4}}{{23.2}}$ | $\frac{{8{\kern 1pt} --{\kern 1pt} 26}}{{17.0}}$ | $\frac{{32{\kern 1pt} --{\kern 1pt} 215}}{{137}}$ | $\frac{{96{\kern 1pt} --{\kern 1pt} 251}}{{185}}$ | $\frac{{32{\kern 1pt} --{\kern 1pt} 251}}{{154}}$ | 1.4 : 1.0 |
Примечание. Здесь и в табл. 3, 5: над чертой – пределы варьирования показателя, под чертой – среднее значение; здесь и в табл. 3, 5, 6: “–” – данные отсутствуют; здесь и в табл. 2–5: n – число рыб.
Линейный рост сельди характеризуется наибольшими показателями в первые три года жизни при постепенном уменьшении годовых приростов по мере увеличения возраста рыб. Материалы по линейному и весовому росту отдельных группировок вида, собранные до 2000-х гг., показали, что восточноберинговоморская и анадырская сельди в пределах северной части Берингова моря относятся к среднесозревающим, а рыбы зал. Коцебу в Чукотском море – к медленносозревающим (Науменко, 2001). Более поздние исследования (Строганов и др., 2020), которые охватывали и арктические моря, выявили средние показатели роста сельди в пределах российского шельфа Чукотского моря, а также в море Лаптевых и у летненерестующей (ивановской) сельди Белого моря. Относительно слабый рост показали рыбы Баренцева и Карского морей − весенненерестующая (егорьевская) сельдь Белого моря. При этом наиболее высокий темп роста особей вида отмечен в бореальной зоогеографической зоне (Берингово, Охотское моря, тихоокеанские воды), что согласуется с представлениями о наиболее высоких показателях роста при оптимальных температурных значениях (Бретт, 1983). Необходимо отметить, что приращение длины и массы тела рыб многих сельдей, в том числе и восточноберинговоморской, тесно связано с численностью поколений (Науменко, 2001). Если исходить из доминирующих размеров рыб в районе исследований (рис. 1), которые присущи определённым возрастным группам, то они близки к показателям группировок северной части Берингова моря (анадырской, восточноберинговоморской).
Соотношение полов у сельди по годам исследований различалось, что, вероятно, связано с разным количеством собранного материала (табл. 1). В отдельные годы преобладали самцы (1997, 2007 и 2010), в другие – самки (2019, 2020). В целом для вида характерно незначительное преобладание самок, самцы обычно созревают раньше и быстрее выходят из нерестового запаса. Массовое созревание особей восточноберинговоморской группировки происходит на 2–3-м году жизни при FL 17–20 см (Качина, 1986).
Тихоокеанская сельдь – весенненерестующая рыба, в различных широтах Берингова моря её размножение проходит с мая по июль. Нерестится вид в узкой прибрежной зоне (от уреза воды до глубины 5–10 м) при температуре воды 3–9°С (Науменко, 2001). В Чукотском море и прилегающих водах места размножения сельди не обнаружены, как и не выявлено наличия икры и личинок (Logerwell et al., 2020). В то же время, учитывая отсутствие здесь большого числа производителей, можно предположить незначительные масштабы нереста в бухтах и заливах Чукотского п-ова (Колючинская губа, Нешканская лагуна, заливы Лаврентия, Мечигменский, Ткачен, бухты Пэнгигнгэй, Аболишева). На недавнее окончание нереста указывают данные 2019 г., когда до 88% самок и 29% самцов находились в посленерестовом состоянии (стадия зрелости гонад VI–II). В большинстве же своём сельдь в конце лета–начале осени формировала новые половые продукты с ускоренным их созреванием у самцов (табл. 2).
Таблица 2.
Распределение сельди Clupea pallasii по стадиям зрелости гонад в российских водах Чукотского моря в августе–сентябре 1997–2020 гг., %
| Месяц, год | Пол | Стадия зрелости гонад | n, экз. | ||||
|---|---|---|---|---|---|---|---|
| II | III | IV | V | VI–II | |||
| Август, 1997 | Самки | 100 | 0 | 0 | 0 | 0 | 3 |
| Самцы | 20.0 | 80.0 | 0 | 0 | 0 | 5 | |
| Август, 2003 | Самки | 0 | 50.0 | 50.0 | 0 | 0 | 2 |
| Самцы | 0 | 50.0 | 50.0 | 0 | 0 | 2 | |
| Август, 2007 | Самки | 100 | 0 | 0 | 0 | 0 | 54 |
| Самцы | 93.1 | 6.9 | 0 | 0 | 0 | 58 | |
| Сентябрь, 2010 | Самки | 35.3 | 64.7 | 0 | 0 | 0 | 17 |
| Самцы | 7.1 | 92.9 | 0 | 0 | 0 | 28 | |
| Август, 2019 | Самки | 22.2 | 0 | 0 | 0 | 77.8 | 9 |
| Самцы | 14.3 | 57.1 | 0 | 0 | 28.6 | 7 | |
| Август, 2020 | Самки | 28.6 | 71.4 | 0 | 0 | 0 | 7 |
| Самцы | 0 | 100 | 0 | 0 | 0 | 4 | |
Семейство корюшковые (Osmeridae)
Мойва Mallotus villosus catervarius принадлежит к числу мелкоразмерных видов рыб с коротким жизненным циклом: в пределах дальневосточных морей её наибольшие длина и масса составляют 22 см и 70 г, а возраст – 7 лет (Mecklenburg et al., 2016; Великанов, 2018). Размеры мойвы изменяются в зависимости от района обитания, по направлению к северным границам ареала её длина уменьшается, достигая минимума в Чукотском море (Науменко, 1986; De Robertis et al., 2017). При этом у арктического побережья Канады отмечены рыбы максимальной FL 25 см (Coad, Reist, 2004). В Чукотском море этот вид корюшковых рыб в отдельные годы может формировать локальные промысловые скопления (Датский и др., 2022. Табл. 2).
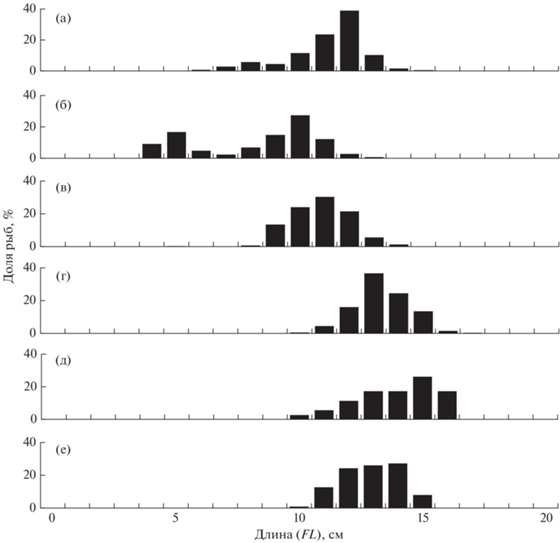
По данным траловых съёмок 2003–2020 гг., длина мойвы на чукотском шельфе варьировала в пределах 4–17 см, при этом наибольшие размеры рыб отмечены у дна в 2018–2020 гг., наименьшие – в пелагиали в 2003, 2007 и 2008 гг. (рис. 4). В первом случае преобладали особи FL 12–15 см (в основном в возрасте 3+), во втором – 9–12 см (2+). Присутствие мойвы в разных горизонтах, включая придонные слои, а также тот факт, что у дна она имеет бо́льшие размеры тела, подтверждается и исследованиями из других районов (Науменко, 1996; Арсенов, Датский, 2004, 2017; Ormseth, 2019). Необходимо отметить, что исключительно в толще воды встречались годовалые особи FL 4–8 см (рис. 4а–4в), которые в основном предпочитают мелководные участки шельфа (Датский, Андронов, 2007).
Рис. 4.
Размерный состав мойвы Mallotus villosus catervarius в траловых уловах в российских водах Чукотского моря: а – август 2003 г. (M = 11.2 см, n = 748 экз.), б – август 2007 г. (M = 8.3 см, n = 716 экз.), в – сентябрь 2008 г. (M = 10.8 см, n = 1131 экз.), г – сентябрь 2018 г. (M = 13.3 см, n = 354 экз.), д – август 2019 г. (M = 13.9 см, n = 34 экз.), е – август–сентябрь 2020 г. (M = 12.9 см, n = 242 экз.).
В целом мойва в российских водах Чукотского моря уступает по размерам рыбам, живущим в северо-западной части Берингова моря, причём это заметно по разным горизонтам обитания вида (рис. 5). Разница в средних размерах рыб была незначительна в придонных скоплениях (13.2 против 13.4 см), достигая 2 см в пелагических (10.2 против 12.1 см). Акустические исследования северной и южной акваторий Чукотского и северной части Берингова морей в американских водах также подтверждают увеличение длины тела мойвы в южном направлении: её модальные размеры составили соответственно 5, 8 и 10 см (De Robertis et al., 2017). При этом наибольший средний показатель рыб зафиксирован в зал. Петра Великого в Японском море – 17.0 см (Великанов, 2018).
Рис. 5.
Размерный состав мойвы Mallotus villosus catervarius в пелагических (а), донных (б) и смешанных (в) уловах в российских водах Чукотского (◼) и Берингова (◻) морей в 2001–2020 гг.
Мойва Чукотского моря менее всего отличалась от рыб из северной и центральной частей Анадырского залива, что, вероятно, обусловлено сходными рельефом дна и гидрологическими условиями (рис. 6). Меньшие по размерам особи, по сравнению с чукотским шельфом, встречались в западной части залива, где значительное присутствие молоди объясняется близостью этой акватории к местам массового нереста вида (Арсенов, Датский, 2004). Наибольшие различия в длине тела мойвы зарегистрированы при сравнении рыб с самыми большими особями из акватории юго-западнее м. Наварин. Отметим, что на размерно-возрастные ряды данного вида значительное влияние оказывает появление урожайных поколений, хорошо заметных в отдельные годы (Великанов, 1986; Датский, 2017).
Рис. 6.
Размерный состав мойвы Mallotus villosus catervarius в траловых уловах в российских водах в 2001–2020 гг.: (‑ ‑) – Чукотское море (M = 13.2 см, n = 652 экз.); (—) – Берингово море: а–в – соответственно северная (M = 13.6 см, n = 316 экз.), центральная (M = 13.9 см, n = 82 экз.) и западная (M = 10.6 см, n = 65 экз.) части Анадырского залива; г – Корякский район (M = 17.0 см, n = 78 экз.).
Молодь мойвы в пределах чукотского шельфа имела FL 6–12 см и массу 1–10 г. Самцов от самок отличали бо́льшие предельные параметры тела, однако в отдельные годы средние показатели последних были выше (табл. 3). Максимальное увеличение массы отмечено у рыб FL 12–16 см, когда на каждый сантиметр длины масса тела увеличивалась на 4–6 г. Зависимость длина–масса для мойвы описывается уравнением: W = 0.0008FL3.7653 (r = 0.97, n = 8312 экз.).
Таблица 3.
Длина, масса и соотношение полов у мойвы Mallotus villosus catervarius из уловов в российских водах Чукотского моря
| Сроки работ (месяц, год) | n, экз. | Длина (FL), см | Масса, г | Соотношение самки : самцы | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Неполо- возрелые | Половозрелые | Неполо- возрелые | Половозрелые | |||||||
| самки | самцы | оба пола | самки | самцы | оба пола | |||||
| 08.2003 | 175 | $\frac{{8.4{\kern 1pt} --{\kern 1pt} 12.1}}{{9.7}}$ | $\frac{{9.3{\kern 1pt} --{\kern 1pt} 14.8}}{{11.3}}$ | $\frac{{8.8{\kern 1pt} --{\kern 1pt} 16.3}}{{11.5}}$ | $\frac{{8.8{\kern 1pt} --{\kern 1pt} 16.3}}{{11.3}}$ | $\frac{{2{\kern 1pt} --{\kern 1pt} 10}}{{4.5}}$ | $\frac{{3{\kern 1pt} --{\kern 1pt} 22}}{{7.8}}$ | $\frac{{2{\kern 1pt} --{\kern 1pt} 34}}{{8.8}}$ | $\frac{{2{\kern 1pt} --{\kern 1pt} 34}}{{8.2}}$ | 1.0 : 2.0 |
| 08.2007 | 265 | $\frac{{6.1{\kern 1pt} --{\kern 1pt} 10.5}}{{8.2}}$ | $\frac{{8.0{\kern 1pt} --{\kern 1pt} 15.2}}{{10.3}}$ | $\frac{{8.0{\kern 1pt} --{\kern 1pt} 13.0}}{{10.1}}$ | $\frac{{8.0{\kern 1pt} --{\kern 1pt} 15.2}}{{10.1}}$ | $\frac{{1{\kern 1pt} --{\kern 1pt} 6}}{{2.8}}$ | $\frac{{2{\kern 1pt} --{\kern 1pt} 20}}{{5.7}}$ | $\frac{{1{\kern 1pt} --{\kern 1pt} 13}}{{5.2}}$ | $\frac{{1{\kern 1pt} --{\kern 1pt} 20}}{{5.3}}$ | 1.0 : 1.0 |
| 08–09.2018 | 276 | – | $\frac{{10.0{\kern 1pt} - {\kern 1pt} 14.8}}{{13.0}}$ | $\frac{{10.2{\kern 1pt} --{\kern 1pt} 15.7}}{{13.0}}$ | $\frac{{10.0{\kern 1pt} --{\kern 1pt} 15.7}}{{13.0}}$ | – | $\frac{{4{\kern 1pt} --{\kern 1pt} 22}}{{13.3}}$ | $\frac{{4{\kern 1pt} --{\kern 1pt} 26}}{{13.3}}$ | $\frac{{4{\kern 1pt} --{\kern 1pt} 26}}{{13.3}}$ | 1.0 : 1.6 |
| 08–09.2020 | 242 | $\frac{{10.4{\kern 1pt} --{\kern 1pt} 10.7}}{{10.5}}$ | $\frac{{11.1{\kern 1pt} --{\kern 1pt} 15.4}}{{13.0}}$ | $\frac{{10.3{\kern 1pt} --{\kern 1pt} 15.2}}{{12.7}}$ | $\frac{{10.3{\kern 1pt} --{\kern 1pt} 15.4}}{{12.8}}$ | $\frac{{4{\kern 1pt} --{\kern 1pt} 6}}{{5.3}}$ | $\frac{{6{\kern 1pt} --{\kern 1pt} 22}}{{13.4}}$ | $\frac{{5{\kern 1pt} --{\kern 1pt} 22}}{{12.4}}$ | $\frac{{4{\kern 1pt} --{\kern 1pt} 22}}{{12.7}}$ | 1.0 : 1.5 |
Для младшевозрастных классов мойвы характерно преобладание самок, созревающих в массе на втором году жизни. В возрасте 4 года и более соотношение полов сдвигается в пользу самцов, которые доминируют по причине повышенной смертности рано созревающих самок (Науменко, 1990). В нашем случае, за исключением 2007 г., когда соотношение полов было равным, самки преобладали в 1.5–2.0 раза над самцами. Следует отметить, что на нерестилищах мойвы обычно доминируют самцы (Коростелев и др., 2008; Великанов, 2018), однако соотношение полов в течение нерестового хода не является постоянным: количество самок увеличивается к разгару хода и затем снижается до минимального. Полученные данные о биологическом состоянии вида на чукотском шельфе − большинство рыб имели гонады на стадии покоя и начала созревания (табл. 4) − свидетельствуют об отсутствии недавнего нереста и активном нагуле мойвы. Лишь в августе 2003 г. часть самок была в посленерестовом состоянии, что может указывать на возможность более позднего нереста мойвы в арктических морях (Черешнев, 2008).
Таблица 4.
Распределение мойвы Mallotus villosus catervarius по стадиям зрелости гонад в российских водах Чукотского моря в августе–сентябре 1997–2020 гг., %
| Месяц, год | Пол | Стадия зрелости гонад | n, экз. | ||||
|---|---|---|---|---|---|---|---|
| II | III | IV | V | VI–II | |||
| Август, 1997 | Самки | 100 | 0 | 0 | 0 | 0 | 2 |
| Самцы | 100 | 0 | 0 | 0 | 0 | 1 | |
| Август, 2003 | Самки | 98.1 | 0 | 0 | 0 | 1.9 | 53 |
| Самцы | 100 | 0 | 0 | 0 | 0 | 109 | |
| Август, 2007 | Самки | 100 | 0 | 0 | 0 | 0 | 125 |
| Самцы | 100 | 0 | 0 | 0 | 0 | 130 | |
| Сентябрь, 2018 | Самки | 56.1 | 42.1 | 1.8 | 0 | 0 | 107 |
| Самцы | 68.0 | 31.4 | 0.6 | 0 | 0 | 169 | |
| Август, 2020 | Самки | 87.5 | 12.5 | 0 | 0 | 0 | 96 |
| Самцы | 88.1 | 11.9 | 0 | 0 | 0 | 143 | |
В прибрежной зоне северо-западной части Берингова моря мойва размножается с конца июня до середины июля при температуре воды 4.0–8.0°С (Науменко, 1990). Обычные места массового нереста мойвы здесь – Анадырский лиман, бухты Эгвекинот, Угольная, Гавриила, Ушакова; прибрежные участки у р. Хатырка и Мейныпыльгинской озерно-речной системы (Арсенов, Датский, 2004), б. Провидения (Барсуков, 1958). Севернее, включая Чукотское море, её нерестилища не обнаружены, но, как и у сельди, можно предположить прохождение нереста в бухтах и заливах Чукотского п-ова. Косвенным подтверждением этого можно считать присутствие в августе–сентябре личинок данного вида в восточной части Чукотского моря (Logerwell et al., 2020).
Азиатская зубастая корюшка Osmerus mordax dentex была обнаружена лишь в двух траловых съёмках (в 2007 и 2020 гг.) в Чукотском море. Объясняется это тем, что, несмотря на широкую встречаемость зубастой корюшки вдоль тихоокеанского и арктического побережий (Черешнев, 2008; Chernova, 2011), она попадается большей частью на мелководных участках шельфа, и на большие глубины, где проводят траловые исследования, практически не выходит. При этом в тёплые годы (а к таким можно отнести 2020-й – именно в этом году были отмечены наибольшие поимки корюшки) рыбы совершают более обширные нагульные миграции, уходя дальше от берегов (Ormseth, 2019). Ещё одна особенность этого вида корюшек – нерестовые миграции половозрелых особей в реки в мае–июне, тогда как молодь остаётся нагуливаться на мелководье, где позднее к ним в конце лета–начале осени присоединяются отнерестившиеся рыбы (Василец, 2000; Бугаев, Амельченко, 2019).
Среди корюшек этот вид выделяется довольно крупными размерами: достигает FL 36 см, массы 430 г и возраста 10 лет. Основу уловов составляют 3−8-годовики FL 17−25 см, модальную группу (в зависимости от орудия лова, возрастного состава популяции, места и времени промысла) − 4−6-годовики (Василец, 2000; Бугаев и др., 2014). В северо-западной части Берингова моря зубастая корюшка массово встречается в приустьевых участках р. Хатырка, Анадырском лимане, зал. Креста, Мечигменских заливе и губе, лагуне Нэскэнпильгын, Колючинской и Чаунской губах. В водах Анадырского лимана её длина и возраст варьируют в пределах 13−31 см и 3−9 лет, преобладают 4−6-летние рыбы FL 17−22 см (Арсенов, 2003; Черешнев, 2008).
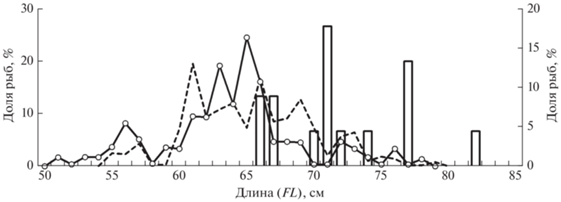
На чукотском шельфе обитала самая мелкая корюшка, зафиксированная по данным траловых съёмок в северной части её ареала (рис. 7). В уловах отмечены рыбы FL 10–14 см с доминированием модальной группы 10–12 см (до 79% уловов). По-видимому, возраст такой корюшки составлял 2+, если исходить из анализа рыб прилегающих акваторий (Василец, 2000; Арсенов, 2003). В Анадырском заливе отлавливали более крупных представителей вида FL 10–25 см с преобладанием размерной группы 15–20 см (88%). Ещё более крупная корюшка встречалась в траловых уловах в пределах корякского шельфа – до 34 см, при этом преобладание тех или иных размерных групп, вероятно, свидетельствует об облове различных группировок рыб, нагуливающихся и нерестящихся в реках корякского побережья. Как показывают исследования, размеры корюшек в этих группировках могут значительно различаться (Голубь и др., 2012; Датский, 2017). Также можно отметить снижение с возрастом темпа прироста длины и массы у рыб в северном направлении: от р. Хатырка (Олюторско-Наваринский район) до р. Чаун (арктическое побережье Восточно-Сибирского моря) (Голубь и др., 2012).
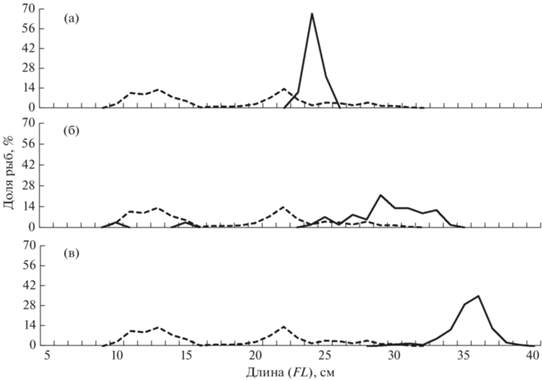
Рис. 7.
Размерный состав азиатской зубастой корюшки Osmerus mordax dentex, по данным донных траловых съёмок 1996–2020 гг. на российском шельфе: (‑ ‑) – Чукотское море (M = 11.5 см, n = 14 экз.); Берингово море: (—) – Анадырский залив (M = 17.2 см, n = 445 экз.), (–⚪–) – Корякский район (M = 22.8 см, n = 408 экз.).
В северо-западной части Берингова моря самки корюшки в среднем немного крупнее самцов: разница между самками и самцами в размерной группе 19−20 см достигает 1.4 см и 20 г, у крупных рыб она ещё больше возрастает в пользу первых. В период нагула отмечено незначительное преобладание самок, в осенний период они созревают быстрее самцов (Датский, 2017). По чукотскому шельфу не удалось собрать аналогичные данные, так как все промеренные особи были неполовозрелыми.
После достижения половой зрелости при FL 16–18 см на 3–4-м году жизни у данного вида существенно проявляются сезонные и межгодовые изменения массы тела, что объясняется формированием половых продуктов, которые у самок достигают более 20% массы рыб (Василец, 2000; Черешнев, 2008). В северной части ареала (Чаунская губа Восточно-Сибирского моря) созревание рыб происходит при бо́льших параметрах тела, причём сходные по размерам (19.2–19.6 см) половозрелые самцы и самки в среднем на 10.8 и 16.4 г тяжелее неполовозрелых (Черешнев, 2008). Наличие крупных незрелых рыб в популяции чаунской корюшки свидетельствует либо о длительном периоде созревания, либо о пропуске ежегодного нереста, что несвойственно виду в других районах его ареала (McPhail, Lindsey, 1970; Черешнев и др., 2002).
В водоёмах Чукотского п-ова в пределах Чукотского моря и прилегающих вод экология размножения зубастой корюшки не изучена (Черешнев, 2008). Места нереста не обнаружены, но, учитывая отсутствие здесь большого числа производителей, можно предположить незначительные масштабы нереста в бухтах и заливах Чукотского п-ова (Колючинская губа, Нешканская лагуна, заливы Лаврентия, Мечигменский, Ткачен, бухты Пэнгигнгэй, Аболишева). При этом нахождение молоди в траловых уловах в районе исследований может быть как следствием выноса рыб из северной части Берингова моря через Берингов пролив, так и их нагульных миграций на чукотский шельф из мелководных бухт и лагун Чукотского моря.
Семейство лососёвые (Salmonidae)
Тихоокеанские лососи бóльшую часть нагульного времени проводят в приалеутских водах Тихого океана (Бирман, 1985; Шунтов, Темных, 2011; The ocean ecology …, 2018). В ходе преднерестовых миграций они, помимо акваторий Охотского, Японского морей и тихоокеанских вод, формируют значительные скопления на внутреннем шельфе Берингова моря (Шунтов и др., 2007; Бугаев, 2015), встречаясь и в арктических водах (Черешнев, 2008; Шунтов, Темных, 2011). К примеру, в пределах чукотского шельфа лососи (преимущественно кета Oncorhynchus keta, в меньшей степени чавыча O. tshawytscha и нерка O. nerka) отмечены в траловых уловах в значительных количествах (Датский и др., 2022. Табл. 2). Немаловажно также отметить, что в западной части Берингова моря (возможно, и в районе исследований) кроме стад лососей, размножающихся в его бассейне, нагуливаются представители многих популяций из других азиатских (особенно японская искусственная кета) и американских (нерка, чавыча, кижуч O. kisutch, частично кета) группировок (Шунтов, Темных, 2011).
На азиатском побережье абсолютно доминирует горбуша O. gorbuscha, уловы которой на порядок превышают уловы прочих лососей (Шунтов и др., 2017; Датский и др., 2021). Кета – второй по численности вид тихоокеанских лососей, который в северной части ареала (северо-западная часть Берингова моря) наряду с неркой и в меньшей степени чавычой играет немаловажную роль в нектонных сообществах. Наибольшее присутствие кеты здесь отмечается в июле–сентябре, нерки – в августе–октябре, чавычи – в июле–августе. В начале–середине лета, как правило, преобладают половозрелые рыбы, которые тяготеют к шельфовым прибрежным участкам, к концу лета и осенью, с их заходом в реки, основу нагульных скоплений представляют уже неполовозрелые особи, а также скатившаяся из рек молодь (Глебов, 2007а, 2007б; Заволокина, Заволокин, 2007).
Кета – относительно крупный вид тихоокеанских лососей, достигающий FL 102 см, массы 9.8 кг и возраста 10 лет (Coad, Reist, 2004; Рыбы …, 2010). Преданадромные миграции кеты, как и прочих лососей, на север Берингова и юго-западную часть Чукотского морей обусловлены воздействием Центрально-Беринговоморского течения, дающего начало тёплому Наваринскому течению. Последнее вдоль корякского побережья следует в сторону Анадырского залива и через прол. Чирикова направляется к Берингову проливу. Благодаря этому течению южная часть залива заполняется трансформированными тихоокеанскими водами положительных температур, способствующими накоплению и развитию кормовой базы лососей (Хен, Заволокин, 2015). По данным траловых съёмок 2003–2008 гг., у корякского побережья отмечено присутствие кеты FL 50–75 см с доминированием особей FL 61–66 см (~60%). В Анадырском заливе отлавливали рыб FL 55–79 см с модальной группой 61–69 см (71%). Поимки этого вида на чукотском шельфе характеризовались ещё бо́льшими размерами рыб: соответственно 66–82 и 70–72 см (рис. 8). Учитывая, что кета FL > 52 см имеет возраст 3+ и старше (Заволокина, Заволокин, 2007), основу скоплений лососей летом и в начале осени на севере ареала представляют преимущественно старшевозрастные особи (Заволокина, Глебов, 2006; Заволокина, Заволокин, 2007). При этом в Чукотском море зарегистрированы наибольшие по размерам представители вида (за период проведения съёмок в 2003, 2007, 2008 гг. промерено 15 экз.), которые встречались только в пелагиали, что вполне объяснимо, учитывая их преимущественное обитание в поверхностном слое до 40 м (Шунтов и др., 2007).
Рис. 8.
Размерный состав половозрелой кеты Oncorhynchus keta, по данным пелагических траловых съёмок 2003–2008 гг. на российском шельфе: (◻) – Чукотское море (слева, M = 71.1 см, n = 15 экз.); Берингово море (справа): (‑ ‑) – Анадырский залив (M = 65.3 см, n = 1464 экз.), (–⚪–) – Корякский район (M = 63.8 см, n = 4486 экз.).
Длина тела самок кеты в районе исследований варьировала от 66 до 82 см (в среднем 72 см), масса – от 5288 до 7100 г при среднем показателе 5465 г (табл. 5). Самцы были несколько меньше самок (FL 66–77, в среднем 71 см) при большей массе тела (4206–7938, в среднем 5580 г) и незначительно преобладали над самками: соотношение 1.3 : 1.0. Зависимость длина–масса кеты в пределах чукотского шельфа следующая: W = 0.0063FL3.1979 (r = = 0.92, n = 15 экз.).
Таблица 5.
Длина, масса и соотношение полов у кеты Oncorhynchus keta из уловов в российских водах Чукотского моря
| Сроки работ (месяц, год) | n, экз. | Длина (FL), см | Масса, г | Соотношение самки : самцы | ||||
|---|---|---|---|---|---|---|---|---|
| Самки | Самцы | Оба пола | Самки | Самцы | Оба пола | |||
| 08.2003 | 7 | $\frac{{70.5{\kern 1pt} --{\kern 1pt} 76.5}}{{72.5}}$ | $\frac{{66.9{\kern 1pt} --{\kern 1pt} 77.1}}{{72.9}}$ | $\frac{{66.6{\kern 1pt} --{\kern 1pt} 77.1}}{{72.7}}$ | $\frac{{5288{\kern 1pt} --{\kern 1pt} 6466}}{{5702}}$ | $\frac{{4576{\kern 1pt} --{\kern 1pt} 7938}}{{6408}}$ | $\frac{{4576{\kern 1pt} --{\kern 1pt} 7938}}{{6105}}$ | 1.0 : 1.3 |
| 08.2007 | 3 | – | $\frac{{66.2{\kern 1pt} --{\kern 1pt} 71.8}}{{68.1}}$ | – | – | $\frac{{4206{\kern 1pt} --{\kern 1pt} 4876}}{{4477}}$ | – | – |
| 09.2008 | 5 | $\frac{{66.0{\kern 1pt} --{\kern 1pt} 82.0}}{{72.4}}$ | – | – | $\frac{{3700{\kern 1pt} --{\kern 1pt} 7100}}{{5322}}$ | – | – | – |
Полученные данные по кете из района исследований указывают на бо́льшие параметры тела рыб при сравнении их с представителями вида из низовьев рек Амгуэма и Чегитун, впадающих в Чукотское море. Так, в первом водоёме длина самок в возрасте 3+ составляла 60.5–70.0 (в среднем 65.8) см, масса – 2300–3780 (3040) г. Самцы этого же возраста имели предельные и средние значения длины и массы соответственно 62.0–74.5 (68.3) см и 3000–5500 (3804) г. Во втором водоёме кета в возрасте 4+ была ещё мельче: самки – 60.0 см и 2740 г, самцы – 62.0 см и 3100 г (Черешнев, 2008). В бассейнах рек Чукотского п-ова в пределах северо-западной части Берингова моря (Сеутакан, Аччен, Хатырка, Туманская и другие) рыбы также имели меньшие размеры, нежели особи из морских сборов, за исключением анадырской кеты в пределах Анадырского лимана (Макоедов и др., 1999, 2009; Черешнев, 2008; Голубь, Голубь, 2010).
Созревание кеты каждой возрастной группы происходит при достижении определённых размеров, при этом если при плохих условиях нагула рыба не достигает размеров, характерных для конкретного возраста, то она не нерестится и приходит размножаться на следующий год. Размерные границы для трёхлеток составляют ~ 50 см, четырёхлеток – 53 см, для пятилеток – 60 см (Заволокина, Заволокин, 2007). В нашем случае все рыбы были длиной FL > 65 см и за исключением одной особи имели гонады III–IV стадий развития (у шести самок и трёх самцов гонады были на стадии развития III, у двух самок и трёх самцов – на IV). У одного самца FL 67 см и массой 4576 г половые продукты были незрелыми.
Помимо рек бассейна Анадырского лимана, основного нерестового района в северо-западной части Берингова моря, и второстепенных водоёмов беринговоморского побережья кета заходит на нерест в реки арктического побережья Чукотки (Раучуа, Пегтымель, Эквыватап, Амгуэма, Ванкарем, Кымъынейвеем) и Колючинской губы – Чегитун и Кооленьваам (Черешнев, 2008; Голубь Е., Голубь А., 2010). В большинстве водоёмов она встречается единично, только в реках Амгуэма, Пегтымель и впадающих в лагуну Ванкарем её численность достигает нескольких сотен экземпляров. Не исключено, что многие рыбы, встреченные в водоёмах арктического побережья, а также в акватории Чукотского моря, не принадлежат к устойчивым местным популяциям, а являются “блуждающими”. На это указывают неоднократные поимки кеты с текучими половыми продуктами на значительном расстоянии от потенциально пригодных для нереста мест или вообще в непригодных для размножения водоёмах, например в устье лагуны Пынгопыльгин и в море у м. Ванкарем (Голубь Е., Голубь А., 2010). Производители кеты заходят в реки с начала июля до середины сентября, нерест начинается в первой половине августа и продолжается до ноября (Макоедов и др., 2009).
Чавыча – самый крупный из тихоокеанских лососей вид, достигающий длины, массы и возраста в российских водах соответственно 126 см, 45 кг и 10 лет (Черешнев, 2008; Рыбы …, 2010). У арктического побережья Канады вид достигает FL 160 см (Coad, Reist, 2004). По азиатскому побережью чавыча распространена от южной части Чукотского п-ова до лимана р. Амур. В Северной Америке этот вид более многочислен, чем в Азии, и встречается к югу от м. Барроу и зал. Коцебу до р. Вентура в Калифорнии (Scott, Crossman, 1973; Черешнев и др., 2002; The ocean ecology …, 2018). По причине более высокой численности американские стада этого лосося проникают на значительно бо́льшие расстояния на запад (особенно заметно это в Беринговом море), нежели азиатские представители вида на восток (Шунтов и др., 2010; Шунтов, Темных, 2011).
Чавыча имеет сложный возрастной состав: продолжительность жизни молоди в пресной воде составляет 1–3 года, нагульный морской период занимает от 1 до 5 лет. Относительно высокая её численность в море достигается только благодаря многовозрастной структуре морского стада молоди. Половозрелая чавыча раньше остальных лососей начинает преданадромные миграции и уже в конце мая–начале июня начинает заходить в реки, незначительно встречаясь в траловых съёмках прибрежных районов вплоть до августа. По этой причине основу траловых уловов составляет нагульная неполовозрелая молодь преимущественно (до 90%) в возрасте 1.1 и 1.2 (Бугаев, 2007а). Для западной части Берингова моря данный факт отражается в снижении к осени доли крупноразмерных особей и доминировании рыб FL 25–51 см, которые в массе мигрируют в мелководный Анадырский залив и севернее (судя по поимкам чавычи в Чукотском море). Нахождение её здесь также зависит от развития Центрально-Беринговоморского течения, при этом вид менее зависим от температуры поверхностного водного слоя и может перемещаться на бо́льшие глубины (встречаясь в придонных горизонтах), нежели другие виды тихоокеанских лососей (Глебов, 2007а).
По данным летне-осенних пелагических съёмок 2003–2008 гг., в северо-западной части Берингова моря встречалась чавыча FL 30–93 см с преобладанием размерной группы 34–46 см (~68%). Старшевозрастные рыбы FL > 51 см второго и третьего морских лет жизни не превышали 20% всех траловых уловов. На чукотском шельфе в эти же годы отмечены особи FL 45, 60 и 70 см, массой соответственно 1343, 2194 и 4300 г (рис. 9а), т.е. преимущественно крупные рыбы. Две первые особи были самками, последняя – самцом, все рыбы имели гонады в стадии покоя. Учитывая сроки их поимок (август–начало сентября), можно предположить, что это нагуливающаяся неполовозрелая молодь, которая с осенним выхолаживанием водных масс уйдёт в более южные районы, в акватории зимнего нагула.
Рис. 9.
Размерный состав неполовозрелой чавычи Oncorhynchus tshawytscha (а) и половозрелой нерки O. nerka (б), по данным пелагических траловых съёмок 2003–2008 гг. в российских водах: (◻) – Чукотское море (слева), (–○–) – Берингово море (справа).
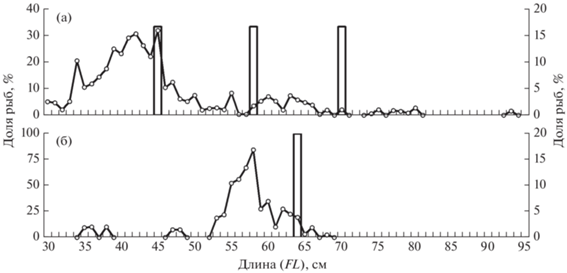
В водоёмах Чукотского п-ова чавыча в незначительных количествах встречается в начале июля–конце августа. В зал. Креста, оз. Аччен, реках Сеутакан, Чегитун длина тела таких самцов и самок находилась в пределах 43.5–125.5 и 63.0–97.0 см, масса – соответственно 1190–22500 и 3420–19950 г (Черешнев, 2008). В Анадырском лимане текучие особи отмечены в конце сентября, на востоке Чукотки – в середине августа–первой декаде сентября (Макоедов и др., 2000). Так же как и кета, чавыча, вероятно, заходит для нереста в небольшие по протяжённости водоёмы арктического побережья, однако такие миграции рыб единичны и, вероятно, нехарактерны для вида. Из таких северных нерестовых водоёмов известны следующие: реки Эквыватап, Амгуэма, Ванкарем, реки Колючинской губы – Чегитун и Кооленьваам (Черешнев, 2008).
Нерка – ещё один массовый представитель лососёвых рыб, доживающий до 8 лет при максимальных длине и массе 85 см и 8 кг (Coad, Reist, 2004; Черешнев, 2008). Этот вид в западной части Берингова моря представлен половозрелыми рыбами, совершающими преднерестовые миграции в реки, неполовозрелой нагульной молодью и выходящими из прибрежья покатниками. Основные подходы производителей нерки к побережью Восточной Камчатки и Чукотки заканчиваются к концу июля–первым числам августа (Бугаев, 1995, 2011; Голубь, 2007), в этот период в эпипелагиали начинает преобладать неполовозрелая молодь (Глебов, 2007б). В целом распространение нерки, в отличие от кеты, в северном направлении значительно менее интенсивное, к осени её встречаемость и уловы на севере ареала снижаются (Бугаев, 2007б; Глебов, 2007б), однако именно в этот период часть рыб выходит в район Берингова пролива (Шунтов и др., 2007) и в Чукотское море. Из-за общего потепления водных масс северо-западной части Берингова моря с начала 2000-х гг. наметилось и общее увеличение присутствия вида в этой акватории (Датский, 2019). Есть упоминания о расширении ареала молоди кеты и особенно нерки, как наиболее чувствительной к потеплению, и в исследованиях по восточной части моря (Yasumiishi et al., 2020).
Размеры половозрелой нерки в июне–июле в пелагиали северо-западной части Берингова моря находились в пределах 35–68 см с модальной группой 55–60 см (64.3%). Учитывая, что в морских уловах смешиваются рыбы в возрасте до трёх пресноводных и четырёх морских лет (Бугаев, 2007б), можно предположить присутствие особей с одним (FL 35–38 см), двумя (47–48 см) и тремя (>53 см) морскими годами жизни (рис. 9б). Из доминирующей последней размерной группы была и нерка из пелагических уловов на чукотском шельфе в 2008 г. Самка FL 64 см (рис. 9б) имела массу 3434 г. Гонады у этой сравнительно крупной рыбы находились на IV стадии развития. И, вероятно, с учётом проведения траловой съёмки в начале сентября рыбы должны были заходить на нерест именно в водоёмы арктического побережья. Длительное нахождение половозрелых особей в море вполне возможно для нерки (Бугаев, 1995, 2011; Глебов, 2007б), а в данном случае обусловлено длинным миграционным путём в Чукотское море и меньшим прогревом водных масс здесь по сравнению с южными акваториями.
В водоёмах беринговоморского побережья Чукотки нерестовая миграция нерки начинается в конце июня и продолжается до конца сентября–ноября. По наиболее близкому к району исследований оз. Аччен известно (Макоедов и др., 2000; Бугаев, Кириченко, 2008), что средняя длина и масса тела самцов были 70.6 см и 4867 г, самок – 63.3 см и 3533 г (при максимальных длине и массе самцов – 78.0 см и 6550 г, самок – 70.0 см и 4950 г). К северу от оз. Аччен, заходы этого вида отмечены в реки Амгуэма, Чегитун, Кооленьваам (оз. Коолень), Гэтлянгэн, Курупкан (Черешнев, 2008), однако данные по биологии рыб отсутствуют.
Северная мальма Salvelinus malma. Среди лососёвых рыб в траловых пелагических уловах 2003 г. был встречен один представитель гольцов рода Salvelinus – северная мальма. Это был неполовозрелый самец FL 26 см и массой 198 г. Учитывая, что вид достигает FL 128 см, массы тела – 12 кг и возраста 17 лет (Coad, Reist, 2004; Черешнев, 2008; Рыбы …, 2010), можно предположить нагульные миграции такой молоди в район исследований из близлежащих рек, принимая во внимание характерный для вида абсолютный хоминг (Черешнев, 2008). По причине единичных поимок мальмы в траловых съёмках (а эту рыбу можно отнести к массовым только при расширении исследований на мелководье) подобные миграции, вероятно, не превышают глубин 30–40 м, хотя вид может выходить в море на десятки и сотни километров вдоль побережий.
Действительно, в водоёмах Чукотского п-ова мальма представлена популяциями, ведущими преимущественно диадромный образ жизни, т.е. после нескольких лет жизни в пресных водах по достижении средних размеров 14–18 см начинает совершать ежегодные нагульные миграции в море в начале лета, а в конце его возвращается в пресные воды для размножения или зимовки. Продолжительность её пребывания в море варьирует от 1.0–1.5 до 2–3 мес. Анадромная миграция в реки проходит с начала июля до конца сентября с пиком хода в августе. Первыми с чукотского шельфа уходят крупные зрелые рыбы, которые будут нереститься в этот же год, в середине миграции преобладают незрелые и пропускающие нерест гольцы средних размеров, завершают её мелкие незрелые гольцы, один раз побывавшие в море. На арктическом побережье мальма встречается в реках Колючинской губы (Чегитун, Уттывеем, Кооленьваам), реках Пегтымель, Эквыватап, Амгуэма, Ванкарем, Кымъынейвеем (Черешнев, 2008).
В водоёмах Чукотского п-ова этот вид имеет самые большие предельные размеры по сравнению с более южными популяциями вида, в том числе среди рыб с одинаковой структурой возраста. Это обусловлено сочетанием двух особенностей её биологии – более ранний возраст первого ската в море, но более позднее (в среднем на 1 год) созревание особей, что значительно (на 2–3 года) увеличивает продолжительность соматического роста гольцов. Например, у мальмы из р. Чегитун возраста 3.3+ средняя длина тела составляет 48.0 см, средняя масса – 1174 г, что заметно больше, чем у мальмы из р. Яма (Охотское море) такого же возраста – 38.4 см и 600 г; такой же размах различий наблюдается и при сравнении из этих рек рыб возраста 4.3+: 47.8 см, 1122 г против 39.0 см, 633 г (Черешнев и др., 2002).
ЗАКЛЮЧЕНИЕ
Чукотское море является одним из арктических морей, что априори вызывает ассоциации о скудности ихтиофауны и низкой рыбопродуктивности его акватории. На первый взгляд, действительно, российские воды сопредельных Чукотского и Берингова морей значительно различаются таксономическим разнообразием рыбных сообществ. Если в водах Чукотского моря обнаружено присутствие 110 видов рыб и рыбообразных, то при приближении к юго-западной части Берингова моря их число возрастает до 296 видов, достигая в целом по его западной части 344 видов (Datsky, 2015а, 2015b). Соответственно и перспективы промыслового использования сырьевой базы морских рыб Чукотского моря также существенно ниже (Datsky, 2016). В то же время среди шести арктических морей, омывающих Россию, Чукотское море (за исключением Баренцева), наиболее богато по числу представителей рыбного населения и ресурсному потенциалу (Datsky, 2015а, 2015b). Этому в значительной степени способствует уникальное расположение этого водоёма. С юга его водные массы подпитывают через Берингов пролив тёплые и солёные, насыщенные биогенами и биопродуцентами (бактерии, зелёные растения, фито- и зоопланктон) течения северной части Берингова моря, с севера и северо-запада заходят холодные воды Северного Ледовитого океана и приходящие через прол. Лонга распреснённые воды Восточно-Сибирского моря (Думанская, 2017; Андронов, Датский, 2019а, 2019б; Фильчук и др., 2019; Danielson et al., 2020). Взаимодействие разнообразных водных масс и течений и приводит к формированию в пределах чукотского шельфа в летне-осенний период благоприятных условий для нагула разнообразных представителей морской ихтиофауны.
Современные научные данные, полученные на основе регулярных траловых исследований последних лет в российской акватории Чукотского моря, показали высокие промысловые запасы морских рыб, достигающие в отдельные годы 446 тыс. т. В среднемноголетнем плане основу биомассы составляли тресковые рыбы (до 92.6%), остальные семейства значительно им уступали: камбаловые – 4.8%, корюшковые, рогатковые, лососёвые и сельдевые – соответственно 1.5, 0.9, 0.2 и 0.1%. Среди 16 массовых видов наибольшая биомасса приходилась на минтая Gadus chalcogrammus, сайку Boreogadus saida и северную палтусовидную камбалу Hippoglossoides robustus, в сумме формирующих 97.3% всех промысловых запасов рыб.
Биомасса массовых видов рыб во многом зависит от климато-океанологических перестроек, происходящих в последние годы. Так, появление в 2018–2020 гг. промысловых скоплений старшевозрастного минтая в российских водах Чукотского моря явилось следствием климатических и океанологических изменений в Беринговом и Чукотском морях в эти годы (Плотников и др., 2020; Baker et al., 2020; Basyuk, Zuenko, 2020; Danielson et al., 2020; Siddon et al., 2020). Общее потепление воздуха и морских вод, снижение площади морского льда и сроков его таяния, изменение циркуляций течений и состава кормовой базы способствовали перераспределению части запасов минтая в северную часть Берингова моря и миграциям вида через Берингов пролив и в юго-западную часть Чукотского моря (Орлов и др., 2019; Eisner et al., 2020; Nishio et al., 2020; Baker, 2021; Orlov et al., 2021). Повышение миграционной активности в северном направлении в пределах Берингова моря в конце 2010-х гг. помимо минтая отмечено и для трески Gadus macrocephalus, сельди, горбуши, мойвы, молоди нерки (Eisner et al., 2020; Farley et al., 2020; Yasumiishi et al., 2020; Датский, Самойленко, 2021).
Изменение климата последнего десятилетия в целом привело к существенным перестройкам в морских экосистемах, включая рыбные сообщества, что в значительной мере отразилось на распределении ресурсов рыб, их биомассе и биологии. Вышеуказанное смещение части рыб в северном направлении (в том числе и в Чукотское море) обусловлено их поисками температурного оптимума и кормовой базы в условиях меняющейся среды обитания. Все сказанное выше способствовало тому, что в конце 2010-х гг. в Чукотском море отмечен аномальный рост запасов тресковых рыб, в основном за счёт минтая. В 2018–2020 гг. в пределах российского шельфа моря помимо минтая увеличилось присутствие трески, наваги Eleginus gracilis, камбаловых рыб, зубастой корюшки; в отдельные годы уловы некоторых из них достигали промысловых величин. Напротив, с конца 1990-х гг. наметилось значительное снижение численности такого холодолюбивого вида, как сайка.
Биология массовых видов рыб в Чукотском море характеризуется важными особенностями (табл. 6). Одни виды представлены здесь преимущественно молодью и неполовозрелыми особями (навага, корюшка, треска, чёрный палтус Reinhardtius hippoglossoides, некоторые виды керчаков), появление старшевозрастных рыб отмечено только в климатически тёплые годы. Для других представителей ихтиофауны свойственно присутствие в большей степени половозрелых особей (минтай, тихоокеанские лососи, желтобрюхая Pleuronectes quadrituberculatus и звёздчатая Platichthys stellatus камбалы), что, вероятно, объясняется лучшей физиологической приспособленностью таких рыб к протяжённым нагульным миграциям. Также надо отметить у отдельных видов (сайка, северная палтусовидная, желтопёрая Limanda aspera, сахалинская L. sakhalinensis, хоботная L. proboscidea камбалы, сельдь, мойва, бородавчатый керчак Myoxocephalus verrucosus) в пределах чукотского шельфа меньшие размеры тела, нежели в смежном Беринговом море. Последнее, вероятно, обусловлено суровыми условиями обитания для многих рыб, для которых акватория Чукотского моря является северной границей ареала со всеми вытекающими характеристиками (продолжительный холодный период года, низкие температуры воздуха и водных масс, сложная ледовая обстановка, малый период для развития кормовой базы, отсутствие благоприятных условий для нереста).
Таблица 6.
Особенности биологии морских рыб и тренды их запасов в российских водах Чукотского моря, по данным траловых съёмок в 1995–2020 гг.
| Семейство, вид | Длина (FL), см | Глубина обитания, м | Особенности биологии | Период (годы) | |
|---|---|---|---|---|---|
| максимальной биомассы | минимальной биомассы | ||||
| Gadidae | |||||
| Gadus chalcogrammus | 5–82 | 27–270 | Присутствуют молодь FL < 22 см, массово крупноразмерные особи FL > 44 см, нет рыб FL 22–44 см | 2018–2020 | До 2018 |
| Boreogadus saida | 3–29 | 34–267 | Мельче, чем в Беринговом море | 1997, 2003 | 2007–2020 |
| Eleginus gracilis | 5–25 | 43–68 | Присутствует в основном молодь FL < 20 см | 2019, 2020 | До 2019 |
| Gadus macrocephalus | 6–78 | 43–279 | Присутствуют молодь FL < 19 см, единично крупноразмерные особи FL > 54 см, нет рыб FL 19–54 см | 2018, 2020 | До 2018 |
| Pleuronectidae | |||||
| Hippoglossoides robustus | 5–45 | 35–267 | Мельче, чем в Беринговом море | 1997, 2018–2020 | 2010 |
| Pleuronectes quadrituberculatus | 19–45 | 43–62 | Крупнее, чем в Беринговом море | 2010, 2018, 2020 | До 2010 |
| Limanda aspera | 14–37 | 43–56 | Присутствуют в основном среднеразмерные рыбы FL 19–28 см. Мельче, чем в Беринговом море | 2018, 2020 | До 2018 |
| Platichthys stellatus | 24–45 | 54 | Присутствуют крупноразмерные особи | 2020 | До 2020 |
| Limanda sakhalinensis | 13–24 | 44–57 | Мельче, чем в Беринговом море | 2018, 2020 | До 2010 |
| Limanda proboscidea | 18 | 43 | То же | 2018 | До 2018 |
| Reinhardtius hippoglossoides | 6–44 | 42–140 | Присутствуют молодь FL < 23 см, единично FL 25–44 см | 2010, 2018, 2020 | До 2010 |
| Osmeridae | |||||
| Mallotus villosus catervarius | 4–17 | 34–192 | Мельче, чем в Беринговом море | 2003, 2008 | 1997, 2010, 2019 |
| Osmerus mordax dentex | 10–14 | 48–57 | Присутствует только молодь | 2020 | До 2020 |
| Cottidae | |||||
| Myoxocephalus verrucosus | 6–50 | 40–57 | Мельче, чем в Беринговом море | 1997, 2010 | 2018–2020 |
| Myoxocephalus polyacanthocephalus | 7–27 | 43–57 | Присутствуют только неполовозрелые рыбы | 2007 | – |
| Gymnocanthus tricuspis | 5–20 | 27–172 | Крупнее, чем в Беринговом море | 2018–2020 | – |
| Gymnocanthus galeatus | 6–19 | 45–57 | Присутствуют только неполовозрелые рыбы | 2010 | – |
| Hemilepidotus papilio | 3–19 | 36–54 | То же | 2008 | – |
| Hemilepidotus jordani | 11–16 | 46–56 | “–” | – | – |
| Salmonidae | |||||
| Oncorhynchus keta | 66–82 | 42–55 | Миграции крупноразмерных рыб | 2008 | 2003, 2007 |
| Oncorhynchus tshawytscha | 45–70 | 42–54 | То же | То же | То же |
| Oncorhynchus nerka | 64 | 47–49 | “–” | “–” | “–” |
| Salvelinus malma | 26 | 47 | Нагул неполовозрелых рыб в августе | 2003 | – |
| Clupeidae | |||||
| Clupea pallasii | 8–31 | 41–186 | Присутствуют молодь FL < 19 см и рыбы FL 20–31 см. Мельче, чем в Беринговом море | 2010, 2019 | 2003–2008, 2018, 2020 |
В целом представленная в нашем исследовании информация об особенностях биологии морских рыб российских вод Чукотского моря несёт в себе базовые знания о возможных перспективах промыслового использования водных биоресурсов этого арктического водоёма. Результатом этого обобщения уже явились включение в перечень используемых объектов промысла минтая и корректировка вылова сайки. В то же время удалённость Чукотского моря, его суровые климато-океанологические условия, финансовая затратность экспедиционных работ и от этого их нерегулярность оставляют множество нерешённых вопросов в отношении биологии рыб и возможного их освоения. Дальнейшее изучение биоресурсной составляющей этой акватории необходимо расширить за счёт вовлечения в исследования мелководной (бухты, лагуны, устья рек) и глубоководной частей моря, расширения сроков работ, установления мест и сроков нереста рыб, использования различных типов судов и орудий лова.
Список литературы
Андронов П.Ю., Датский А.В. 2019а. Бентос // Экосистемы Берингова пролива и факторы антропогенного воздействия. М.: Всемир. фонд дикой природы (WWF). С. 101−111.
Андронов П.Ю., Датский А.В. 2019б. Планктон // Там же. С. 93−101.
Арсенов А.К. 2003. Некоторые черты биологии азиатской корюшки Анадырского лимана Берингова моря // Тез. докл. Всерос. конф. молодых ученых. Владивосток: Изд-во ТИНРО-центр. С. 7−9.
Арсенов А.К., Датский А.В. 2004. Распределение, биология, состояние запасов мойвы в Анадырском заливе Берингова моря и причины, обуславливающие изменения ее биомассы // Вопр. рыболовства. Т. 5. № 3 (19). С. 439–457.
Барсуков В.В. 1958. Рыбы бухты Провидения и сопредельных вод Чукотского полуострова // Тр. ЗИН АН СССР. Т. 25. С. 130−163.
Бирман И.Б. 1985. Морской период жизни и вопросы динамики стада тихоокеанских лососей. М.: Агропромиздат, 208 с.
Бретт Дж.Р. 1983. Факторы среды и рост // Биоэнергетика и рост рыб. М.: Лег. и пищ. пром-сть. С. 275–345.
Бугаев А.В. 2007а. Популяционно-биологические исследования по программе BASIS. Ч. 3. Чавыча Oncorhynchus tschawytscha // Изв. ТИНРО. Т. 151. С. 188–205.
Бугаев А.В. 2007б. Популяционно-биологические исследования по программе BASIS. Ч. 2. Нерка Oncorhynchus nerka // Там же. Т. 151. С. 153–187.
Бугаев В.Ф. 1995. Азиатская нерка (пресноводный период жизни, структура локальных стад, динамика численности). М.: Колос, 464 с.
Бугаев В.Ф. 2011. Азиатская нерка–2 (биологическая структура и динамика численности локальных стад в конце ХХ – начале ХХI вв.). Петропавловск-Камчатский: Камчатпресс, 380 с.
Бугаев А.В. 2015. Преднерестовые миграции тихоокеанских лососей в экономической зоне России. Петропавловск-Камчатский: Изд-во КамчатНИРО, 416 с.
Бугаев А.В., Амельченко Ю.Н. 2019. Основные закономерности формирования пространственной структуры промысловых скоплений корюшки азиатской зубастой Osmerus mordax западной Камчатки в весенне-летний период // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. № 55. С. 59–71. https://doi.org/10.15853/2072-8212.2019.55.59-71
Бугаев В.Ф., Кириченко В.Е. 2008. Нагульно-нерестовые озера азиатской нерки (включая некоторые другие водоемы ареала) // Петропавловск-Камчатский: Камчатпресс, 280 с.
Бугаев А.В., Амельченко Ю.Н., Липнягов С.В. 2014. Азиатская зубастая корюшка Osmerus mordax dentex в шельфовой зоне и внутренних водоемах Камчатки: состояние запасов, промысел и биологическая структура // Изв. ТИНРО. Т. 178. С. 3–24. https://doi.org/10.26428/1606-9919-2014-178-3-24
Василец П.М. 2000. Корюшки прибрежных вод Камчатки: Автореф. дис. … канд. биол. наук. Петропавловск-Камчатский: КамчатНИРО, 20 с.
Великанов А.Я. 1986. Тихоокеанская мойва // Биологические ресурсы Тихого океана. М.: Наука. С. 135–146.
Великанов А.Я. 2018. Дальневосточная мойва: распределение, особенности биологии, динамика биомассы, проблемы и перспективы промыслового освоения // Вопр. рыболовства. Т. 19. № 3. С. 300–326.
Глебов И.И. 2007а. Распределение и миграции чавычи (Oncorhynchus tshawytscha) в летне-осенний период 2002–2006 гг. в западной части Берингова моря // Изв. ТИНРО. Т. 151. С. 83–95.
Глебов И.И. 2007б. Распределение и миграции нерки (Oncorhynchus nerka) в летне-осенний период 2002–2006 гг. в западной части Берингова моря // Там же. Т. 151. С. 75–82.
Голубь Е.В. 2007. Нерка Oncorhynchus nerka Чукотки: биология, распространение, численность: Автореф. дис. … канд. биол. наук. Владивосток: ТИНРО-центр, 24 с.
Голубь Е.В., Голубь А.П. 2010. Кета второстепенных чукотских стад // Бюл. № 5 реализации “Концепции дальневосточной бассейновой программы изучения тихоокеанских лососей”. Владивосток: Изд-во ТИНРО-центр. С. 113−122.
Голубь Е.В., Батанов Р.Л., Голубь А.П. 2012. Материалы по биологии азиатской корюшки Osmerus mordax dentex (Osmeridae) из водоемов Чукотки // Вестн. СВНЦ ДВО РАН. № 2. С. 50−62.
Датский А.В. 2017. Особенности биологии массовых рыб в Олюторско-Наваринском районе и прилегающих водах Берингова моря. 2. Семейства Долгохвостовые (Macrouridae), Сельдевые (Clupeidae), Корюшковые (Osmeridae) // Вопр. ихтиологии. Т. 57. № 1. С. 66–81. https://doi.org/10.7868/S0042875217010039
Датский А.В. 2019. Сырьевая база рыболовства и её использование в российских водах Берингова моря. 2. Межгодовая динамика прогнозируемого и фактического вылова водных биологических ресурсов на современном этапе и в исторической перспективе // Тр. ВНИРО. Т. 177. С. 70–122.
Датский А.В., Андронов П.Ю. 2007. Ихтиоцен верхнего шельфа северо-западной части Берингова моря. Магадан: Изд-во СВНЦ ДВО РАН, 261 с.
Датский А.В., Мазникова О.А. 2017. Особенности биологии массовых рыб в Олюторско-Наваринском районе и прилегающих водах Берингова моря. 3. Семейство камбаловые (Pleuronectidae) // Вопр. ихтиологии. Т. 57. № 2. С. 154–181. https://doi.org/10.7868/S0042875217020072
Датский А.В., Самойленко В.В. 2021. Сырьевая база водных биологических ресурсов в российских водах Берингова моря и ее стоимость // Вопр. рыболовства. Т. 22. № 1. С. 64–99. https://doi.org/10.36038/0234-2774-2021-22-1-64-99
Датский А.В., Кулик В.В., Датская С.А. 2021. Динамика обилия массовых промысловых рыб дальневосточных морей и прилегающих районов открытой части Тихого океана и влияющие на неё факторы // Тр. ВНИРО. Т. 186. № 4. С. 31–77. https://doi.org/10.36038/2307-3497-2021-186-31-77
Датский А.В., Ведищева Е.В., Трофимова А.О. 2022. Особенности биологии массовых рыб в российских водах Чукотского моря. 1. Промысловая биомасса рыб. Семейство тресковые Gadidae // Вопр. ихтиологии. Т. 62. № 4. С. 387–412. https://doi.org/10.31857/S0042875222040075
Думанская И.О. 2017. Ледовые условия морей азиатской части России. М.: Обнинск: ИГ-СОЦИН, 640 с.
Заволокина К.А., Глебов И.И. 2006. Возрастная структура кеты в западной части Берингова моря в 2002–2006 гг. // Бюл. № 1 реализации “Концепции бассейновой программы изучения лососей”. Владивосток: Изд-во ТИНРО. С 155–161.
Заволокина Е.А., Заволокин А.В. 2007. Распределение, динамика обилия, возрастной и размерный состав кеты в западной части Берингова моря и сопредельных тихоокеанских водах в 2002–2006 гг. // Изв. ТИНРО. Т. 151. С. 35−60.
Качина Т.Ф. 1986. Тихоокеанская сельдь // Биологические ресурсы Тихого океана. М.: Наука. С. 146–156.
Коростелев С.Г., Наумова Т.Н., Владимирова О.А. 2008. Современное состояние запасов мойвы восточной части Охотского моря // Вопр. рыболовства. Т. 9. № 3 (35). С. 654–662.
Лобода С.В., Жигалин А.Ю. 2017. Результаты исследований тихоокеанской сельди в северо-западной части Берингова моря в 2010–2015 гг. // Изв. ТИНРО. Т. 188. С. 125–139. https://doi.org/10.26428/1606-9919-2017-188-125-139
Макоедов А.Н., Мясников В.Г., Куманцов М.И. и др. 1999. Биоресурсы внутренних водоемов Чукотки и прилегающих вод Берингова моря. М.: Экономика и информатика, 220 с.
Макоедов А.Н., Куманцов М.И., Коротаев Ю.А., Коротаева О.Б. 2000. Промысловые рыбы внутренних водоемов Чукотки. М.: УМК “Психология”, 208 с.
Макоедов А.Н., Коротаев Ю.А., Антонов Н.П. 2009. Азиатская кета. Петропавловск-Камчатский: Изд-во КамчатНИРО, 356 с. https://doi.org/10.13140/2.1.1422.8163
Нагульная сельдь – 2001 (путинный прогноз). 2001. Владивосток: Изд-во ТИНРО-центр, 80 с.
Нагульная сельдь – 2004 (путинный прогноз). 2004. Владивосток: Изд-во ТИНРО-центр, 83 с.
Науменко Е.А. 1986. Биология, состояние запасов и перспектива промысла мойвы Берингова моря: Автореф. дис. … канд. биол. наук. Владивосток: Дальневост. науч. центр, 23 с.
Науменко Е.А. 1990. Биологическая характеристика мойвы северо-западной части Берингова моря // Биологические ресурсы шельфовых и окраинных морей Советского Союза. М.: Наука. С. 155–162.
Науменко Е.А. 1996. Многолетние изменения в распределении и численности анадырской мойвы // Изв. ТИНРО. Т. 119. С. 215–223.
Науменко Н.И. 2001. Биология и промысел морских сельдей Дальнего Востока: монография. Петропавловск-Камчатский: Камчат. печат. двор, 330 с.
Науменко Н.И., Джагильдин Ч.А. 1987. Распределение планктона и некоторых видов рыб в южной части Чукотского моря // Биологические ресурсы Арктики и Антарктики. М.: Наука. С. 224–238.
Орлов А.М., Бензик А.Н., Ведищева Е.В. и др. 2019. Рыбохозяйственные исследования в Чукотском море на НИС “Профессор Леванидов” в августе 2019 г.: некоторые предварительные результаты // Тр. ВНИРО. Т. 178. С. 206–220. https://doi.org/10.36038/2307-3497-2019-178-206-220
Плотников В.В., Вакульская Н.М., Мезенцева Л.И. и др. 2020. Изменчивость ледовых условий в Чукотском море и их связь с арктической осцилляцией // Изв. ТИНРО. Т. 20. № 1. С. 155–167. https://doi.org/10.26428/1606-9919-2020-200-155-167
Рыбы в заповедниках России. 2010. Т. 1. Пресноводные рыбы. М.: Т-во науч. изд. КМК, 627 с.
Строганов А.Н., Семенова А.В., Рыбаков М.О., Смирнов А.А. 2020. О влиянии факторов среды на формирование изменчивости тихоокеанской сельди на ареале от Белого до Жёлтого морей // Тр. ВНИРО. Т. 181. С. 69–83. https://doi.org/10.36038/2307-3497-2020-181-69-83
Фильчук К.В., Кулаков М.Ю., Дымов В.И. и др. 2019. Гидрологические условия // Экосистемы Берингова пролива и факторы антропогенного воздействия. М.: Всемир. фонд дикой природы (WWF). С. 50−69.
Хен Г.В., Заволокин А.В. 2015. Перемена в циркуляции вод и ее значение в распределении и обилии лососей в западной части Берингова моря в начале 21-го столетия // Изв. ТИНРО. Т. 181. С. 95–115. https://doi.org/10.26428/1606-9919-2015-181-95-115
Черешнев И.А. 2008. Пресноводные рыбы Чукотки. Магадан: Изд-во СВНЦ ДВО РАН, 324 с.
Черешнев И.А., Волобуев В.В., Шестаков А.В., Фролов С.В. 2002. Лососевидные рыбы северо-востока России. Владивосток: Дальнаука, 496 с.
Шунтов В.П., Темных О.С. 2011. Тихоокеанские лососи в морских и океанических экосистемах. Т. 2. Владивосток: Изд-во ТИНРО-центр, 473 с.
Шунтов В.П., Темных О.С., Глебов И.И. 2007. Некоторые аспекты российского вклада в реализацию международной программы BASIS (2002–2006 гг.) // Изв. ТИНРО. Т. 151. С. 3–34.
Шунтов В.П., Волвенко И.В., Темных О.С. и др. 2010. К обоснованию экологической ем-кости дальневосточных морей и субарктической Пацифики для пастбищного выращивания тихоокеанских лососей. 1. Нагульные акватории тихоокеанских лососей // Изв. ТИНРО. Т. 160. С. 149–184.
Шунтов В.П., Темных О.С., Иванов О.А. 2017. об устойчивости стереотипов в представлениях о морской экологии тихоокеанских лососей (Oncorhynchus spp.) // Изв. ТИНРО. Т. 188. С. 3–36. https://doi.org/10.26428/1606-9919-2017-188-3-36
Andrews A.G. III, Strasburger W.W., Farley E.V.Jr. et al. 2016. Effects of warm and cold climate conditions on capelin (Mallotus villosus) and Pacific herring (Clupea pallasii) in the eastern Bering Sea // Deep-Sea Res. II. Top. Stud. Oceanogr. V. 134. P. 235–246. https://doi.org/10.1016/j.dsr2.2015.10.008
Baker M.R. 2021. Contrast of warm and cold phases in the Bering Sea to understand spatial distributions of Arctic and sub‑Arctic gadids // Polar Biol. V. 44. № 6. P. 1083–1105. https://doi.org/10.1007/s00300-021-02856-x
Baker M.R., Kivva K.K., Pisareva M.N. et al. 2020. Shifts in the physical environment in the Pacific Arctic and implications for ecological timing and conditions // Deep-Sea Res. II. Top. Stud. Oceanogr. V. 177. Article 104802. https://doi.org/10.1016/j.dsr2.2020.104802
Basyuk E., Zuenko Y. 2020. Extreme oceanographic conditions in the northwestern Bering Sea in 2017–2018 // Ibid. V. 181–182. Article 104909. https://doi.org/10.1016/j.dsr2.2020.104909
Chernova N.V. 2011. Distribution patterns and chorological analysis of fish fauna of the Arctic region // J. Ichthyol. V. 51. № 10. P. 825–924. https://doi.org/10.1134/S0032945211100043
Coad B.W., Reist J.D. 2004. Annotated list of the Arctic Marine Fishes of Canada. Can. MS Rep. Fish. Aquat. Sci. 2674. iv + 112 p.
Danielson S.L., Ahkinga O., Ashjian C. et al. 2020. Manifestation and consequences of warming and altered heat fluxes over the Bering and Chukchi Sea continental shelves // Deep-Sea Res. II: Top. Stud. Oceanogr. V. 177. Article 104781. https://doi.org/10.1016/j.dsr2.2020.104781
Datsky A.V. 2015a. Ichthyofauna of the Russian exclusive economic zone of the Bering Sea: 1. Taxonomic diversity // J. Ichthyol. V. 55. № 6. P. 792–826. https://doi.org/10.1134/S0032945215060065
Datsky A.V. 2015b. Fish fauna of the Chukchi Sea and perspectives of its commercial use // Ibid. V. 55. № 2. P. 185–209. https://doi.org/10.1134/S0032945215020022
Datsky A.V. 2016. Fish Fauna of the Bering Sea (within Russian Waters). Communication 3: Perspectives of Commercial Fishery // Ibid. V. 56. № 2. P. 217–234. https://doi.org/10.1134/S0032945216020028
De Robertis A., Taylor K., Wilson C.D., Farley E.V. 2017. Abundance and distribution of Arctic cod (Boreogadus saida) and other pelagic fishes over the U.S. Continental Shelf of the Northern Bering and Chukchi Seas // Deep-Sea Res. II. Top. Stud. Oceanogr. V. 135. P. 51–65. https://doi.org/10.1016/j.dsr2.2016.03.002
Eisner L.B., Zuenko Y.I., Basyuk E.O. et al. 2020. Environmental impacts on walleye pollock (Gadus chalcogrammus) distribution across the Bering Sea shelf // Ibid. V. 181–182. Article 104881. https://doi.org/10.1016/j.dsr2.2020.104881
Farley E.V. Jr., Murphy J.M., Cieciel K. et al. 2020. Response of Pink salmon to climate warming in the northern Bering Sea // Ibid. V. 177. Article 1048030. https://doi.org/10.1016/j.dsr2.2020.104830
Logerwell E.A., Busby M., Mier K.L. et al. 2020. The effect of oceanographic Variability on the distribution of larval fishes of the northern Bering and Chukchi seas // Ibid. V. 177. Article 104784. https://doi.org/10.1016/j.dsr2.2020.104784
McPhail J.D., Lindsey C.C. 1970. Freshwater fishes of Northwestern Canada and Alaska // Bull. Fish. Res. Board Can. № 173. 381 p.
Mecklenburg C.W., Mecklenburg T.A., Sheiko B.A., Steinke D. 2016. Pacific Arctic Marine Fishes. Conservation of Arctic Flora and Fauna. Akureyri: CAFF Internat. Secretariat, 406 p.
Nishio S., Sasaki H., Waga H., Yamamura O. 2020. Effects of the timing of sea ice retreat on demersal fish assemblages in the northern Bering and Chukchi Seas // Deep-Sea Res. II. Top. Stud. Oceanogr. V. 181–182. Article 104910. https://doi.org/10.1016/j.dsr2.2020.104910
Orlov A.M., Rybakov M.O., Vedishcheva E.V. et al. 2021. Walleye pollock Gadus chalcogrammus, a species with continuous range from the Norwegian Sea to Korea, Japan, and California: new records from the Siberian Arctic // J. Mar. Sci. Eng. V. 9. № 10. Article 1141. https://doi.org/10.3390/jmse9101141
Ormseth O.A. 2019. Status of forage species in the Bering Sea and Aleutian Islands region. Seattle: AFSC, 46 p. Available: https://apps-afsc.fisheries.noaa.gov/refm/docs/2019/BSAIforage.pdf
Scott W.B., Crossman E.J. 1973. Freshwater fishes of Canada // Bull. Fish. Res. Board Can. № 184. 966 p.
Siddon E.C., Zador S.G., Hunt G.L., Jr. 2020. Ecological responses to climate perturbations and minimal sea ice in the northern Bering Sea // Deep-Sea Res. II. Top. Stud. Oceanogr. V. 181–182. Article 104914. https://doi.org/10.1016/j.dsr2.2020.104914
The Ocean Ecology of Pacific Salmon and Trout. 2018. Bethesda: AFS, xii + 1147 p. https://doi.org/10.47886/9781934874455
Yasumiishi E.M., Cieciel K., Andrews A.G. et al. 2020. Climate-related changes in the biomass and distribution of small pelagic fishes in the eastern Bering Sea during late summer, 2002–2018 // Deep-Sea Res. II. Top. Stud. Oceanogr. V. 181–182. Article 104907. https://doi.org/10.1016/j.dsr2.2020.104907
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


