Вопросы ихтиологии, 2022, T. 62, № 6, стр. 721-736
Жизненный цикл двух видов рода Carassius (Cyprinidae) в условиях симпатрии
Д. А. Павлов *
Московский государственный университет
Москва, Россия
* E-mail: dimi-pavlov@yandex.ru
Поступила в редакцию 18.11.2021
После доработки 18.01.2022
Принята к публикации 25.01.2022
- EDN: AUGOGQ
- DOI: 10.31857/S0042875222060285
Аннотация
Исследованы структура популяций и особенности полового созревания серебряного Carassius gibelio и золотого C. carassius карасей, обитающих в небольшом (площадь 588 м2) естественном пруду. Численность особей первого вида в 2.4 раза выше, чем второго. Соотношение полов (самки : самцы) составляет соответственно 80.0 : 1.0 и 0.8 : 1.0. Серебряный карась представлен гиногенетической формой. Популяции обоих видов имеют близкую возрастную структуру, особи достигают полового созревания в возрасте 2–3 года, но темп роста серебряного карася существенно выше, чем золотого; последний является мелкой (длина тела в среднем 55 мм) педоморфной формой. В водоёме особи обоих видов занимают преимущественно разные экологические ниши, что ослабляет межвидовую конкуренцию.
В эволюции семейства Cyprinidae дупликация генома, содержащего в диплоидном состоянии у гипотетических предковых форм ~48 хромосом, сопровождалась последующей редиплоидизацией; многие современные диплоидные представители семейства, включая род Carassius, имеют ~100 хромосом (Leggatt, Iwama, 2003; Li, Guo, 2020; Przybył et al., 2020). Дупликация генома способствовала генетическим инновациям, одна из которых обусловила устойчивость к дефициту кислорода у видов рода Carassius вследствие возникновения нового механизма блокирования ацидоза путём превращения накапливающейся анаэробным путём молочной кислоты в этанол, выделяемый жабрами в воду (Fagernes et al., 2017). Другая адаптация видов рода Carassius (C. gibelio и C. auratus) – гиногенез (размножение вследствие активации яиц спермой самцов других видов карповых рыб); при этом даже в пределах одной популяции могут присутствовать бисексуальные (гонохористы) и моносексуальные (размножающиеся гиногенетически) особи (Zhou et al., 2000; Li, Guo, 2020; Przybył et al., 2020).
Род Carassius, до последнего времени включающий семь видов, имеет естественное распространение от Центральной Европы до Японии, достигая в южном направлении Центрального Вьетнама и рек, впадающих в Тонкинский залив. Новый вид C. praecipuus недавно впервые описан за пределами Восточной и Северной Азии и Европы – из бассейна Меконга в Центральном Лаосе (Kottelat, 2017). Некоторые виды, включая широко известную золотую рыбку C. auratus, интродуцированы или случайно завезены во многие регионы Европы и Азии. Серебряный карась распространён от Восточной Европы до Северо-Восточного Китая и имеет прежнее название Carassius auratus gibelio (Богуцкая, Насека, 2004). Сравнительно недавно описан неотип, названный C. gibelio (Cg) (Kalous et al., 2012), но тем не менее Cg включает по меньшей мере два вида, гибридные популяции и формы разной плоидности, представляя проблему для таксономии (Васильева, 1990; Васильева, Васильев, 2000; Kalous et al., 2012; Rylková et al., 2013; Kottelat, 2017). Триплоидные формы Cg имеют 141–166 хромосом, а также микрохромосомы. Триплоиды представлены преимущественно самками, но могут продуцировать гаметы разной плоидности с образованием триплоидных самцов. В отличие от других позвоночных триплоиды способны как к гиногенезу, так и к бисексуальному размножению – гонохоризму (Zhou et al., 2000; Knytl, Kalous, 2009; Boroń et al., 2011; Вехов, 2013; Zhang et al., 2015; Przybył et al., 2020).
До 1990-х гг. большинство европейских популяций Cg состояло из триплоидных (3n) самок, размножающихся гиногенетически. Впоследствии обнаружены популяции разных типов: 1) только самки 3n, размножающиеся преимущественно с самцами других видов рода Carassius или карпа Cyprinus carpio; 2) только особи обоих полов 2n; 3) особи обоих полов 3n и 2n; 4) популяции, включающие особей 3n и 4n обоих полов (Вехов, 2013; Przybył et al., 2020). Резкое увеличение численности Cg c 1990-х гг. и увеличение доли самцов в популяциях наблюдается в Турции (Erdogan et al., 2014), Армении (Барсегян и др., 2017), Грузии (Japoshvili et al., 2017) и в странах Восточной Европы (Lusková et al., 2010; Boroń et al., 2011; Przybył et al., 2020). В Восточной Украине и в Южной России диплоидные популяции постепенно вытеснили триплоидные (Liasko et al., 2011). В Цимлянском вдхр. (р. Дон) до 1986 г. популяция Cg была представлена гиногенетической формой с числом самцов ≤ 1.2–2.0%, в то время как в 1990 г. доля 3n самок, 2n самок и 2n самцов составила соответственно 20.8, 51.4 и 27.8% (Абраменко, 2012). В Среднем Поволжье увеличение численности Cg наблюдается с середины 1980-х годов, в некоторых водохранилищах этот вид приобрёл промысловое значение (Монахов и др., 2020), а в Цимлянском вдхр. стал основным промысловым объектом (Абраменко, 2012). В целом, являясь пищевым конкурентом для местной ихтиофауны и обладая сравнительно невысокой хозяйственной ценностью, Cg рассматривается как нежелательный вселенец.
Наряду с вытеснением хозяйственно-ценных карповых рыб инвазия Cg привела к значительному сокращению численности или полному исчезновению аборигенного вида – золотого карася C. carassius (Сс). Резкое снижение численности Сс отмечено в водоёмах России (Ручин, 2014; Artaev, Ruchin, 2016). На Дону серебряный карась полностью вытеснил золотого (Витковский, Богачев, 2005). В республике Татарстан Сс встречается гораздо реже, чем в XIX–XX вв.: из ~119 обследованных водоёмов только Cg обнаружен в 88, только Сс – в 14 и Cg + Сс – в 17 (Монахов и др., 2020. Рис. 9). Аналогичная ситуация наблюдается в Англии, где Сс вытесняется дикой формой золотой рыбки и рассматривается как вид, находящийся под угрозой (Tarkan et al., 2009; Jeffries et al., 2017).
На протяжении последних десятилетий структура популяций Cg исследована главным образом в сравнительно крупных водоёмах, а оценка взаимоотношений Cg и Сс при совместном обитании почти полностью отсутствует. Некоторые данные о биологии популяций Cg и Сс в небольшом пруду Курьково, расположенном в Рузском р-не Московской обл. в районе Глубокого озера приведены Дмитриевой (1957). Проанализирована изменчивость формы тела Cg и Сс из симпатрических популяций двух озёр Южного Урала с разной степенью загрязнения техногенными радионуклидами (Баранов, Васильев, 2018). Описаны особенности роста особей C. auratus в небольших прудах в окрестностях г. Лондон (Англия) в условиях аллопатрии и симпатрии (обитающих совместно с Сс) (Tarkan et al., 2010). Исследование жизненного цикла симпатрических популяций Cg и Сс позволит лучше понять взаимоотношения этих видов и причины повсеместного снижения численности и исчезновения золотого карася.
Цель работы – исследовать структуру популяций и особенности биологии рыб, обитающих в небольшом лесном пруду, населённом почти исключительно Cg и Сс. Таким образом, влияние каких-либо других видов рыб исключено. Отсутствует и антропогенное воздействие: пруд удалён от населённых пунктов, а мелкие особи не представляют интереса для рыбаков.
МАТЕРИАЛ И МЕТОДИКА
Характеристика водоёма. Безымянный пруд, названный нами Лесной, расположен в Большемурашкинском р-не Нижегородской обл. (55°43′37.7′′ с.ш. 44°38′21.5′′ в.д.) на расстоянии ~1 км от д. Медвежий Лог (рис. 1). Пруд (площадь 588 м2, периметр 207 м) образован в результате возведения дамбы на ручье (по-видимому, в 1950-х годах) и в настоящее время является, по существу, естественным водоёмом. Пруд расположен в ложбине, с северо-восточной стороны ограничен лугом с крутым подъёмом, переходящим в поле (выше зеркала воды на 5 м), а с остальных сторон окружён лесом и кустарниками, вплотную подступающими к воде. Наибольшая глубина (в юго-восточной части) составляет 1.5 м, средняя глубина ~0.5 м, дно илистое, но под слоем ила обнаружены конгломераты каолина (размером до 0.7 см), которые часто попадают в верши. Питание пруда за счёт осадков и частично грунтовых вод; в юго-восточной части вытекает ручей, часто полностью пересыхающий в середине лета. После засухи 2021 г. в течение трёх летних месяцев уровень воды существенно понизился, и граница зеркала воды в разных местах водоёма отступила на 3–7 м от обычной. По береговой линии восточной части водоёма – заросли тростника южного Phragmites australis, дно полностью покрыто густым ковром роголистника погружённого Ceratophyllum demersum, и лишь в небольшом прибрежном восточном участке водоёма обнаружена элодея канадская Elodea canadensis. В течение 5 лет сбора материала (2017–2021) помимо двух видов рода Carassius в водоёме отловлены один экземпляр линя Tinca tinca длиной тела по Смитту (FL) 157 мм (28.06.2020 г.; самка, IV–V стадия зрелости гонад) и сеголетки окуня Perca fluviatilis (июль–август 2020 г.; FL 39–54 мм, n = 12). Особи линя в пруду, очевидно, единичны, а личинки окуня, по-видимому, проникли из другого водоёма вследствие обильного паводка весной 2020 г.; окунь полностью исчез после суровой зимы 2021 г. Кроме рыб в водоёме отмечен обыкновенный тритон Lissotriton vulgaris, а ранней весной размножаются представители бесхвостых земноводных (Anura); головастики достигают высокой численности и не покидают водоём до начала июля.
Рис. 1.
Место сбора материала: а – географическое положение пруда Лесной; б – общий вид пруда с восточной стороны, 08.06.2019. Масштаб: 10 м.

Сбор материала и биологический анализ. Рыб отлавливали поплавочной удочкой и вершами с размером ячеи 3–8 мм. Верши устанавливали на расстоянии ~4 м от берега на 3–5 ч; внутрь помещали прикормку, предназначенную для ужения карповых рыб. Для отлова сеголеток использовали подъёмную сеть и сачок (размер ячеи 3–5 мм). Рыб живыми доставляли в лабораторию, где содержали в аквариумах не более 2 сут. Свежих наркотизированных особей фотографировали цифровой камерой Olympus SP-350, определяли пол и стадию зрелости гонад по шкале Макеевой (1992), измеряли длину (полную (TL), стандартную (SL) и FL), массу тела (W), массу тела без внутренностей (w) и массу гонад (g). Для получения изображений мелких объектов (яичники и семенники ювенильных особей, фрагменты гонад, структура чешуи и отолитов) использовали микроскоп YEGREN TXB2-D7-DG (Китай), соединённый с цифровой камерой SKT-ML500C-125A и компьютером; измерения выполнены с применением программы ImageJ.
Диаметр ооцитов (>50 мкм) измеряли на изображениях фрагментов яичников. Абсолютную плодовитость определяли посредством подсчёта общего числа ооцитов лидирующей порции или числа таких ооцитов во фрагменте яичника с определением его массы и последующим пересчётом на массу яичников.
Возраст сеголеток оценивали по дате поимки, ориентируясь на даты массового нереста (10–15 июня). Предприняты попытки определения возраста особей более старшего возраста по чешуе, взятой в области тела под спинным плавником. Кроме этого, у рыб извлекали отолиты (астерискусы, а в некоторых случаях – лапиллусы) и определяли зоны роста в отражённом свете, направленном сбоку. Для более точной оценки возраста (десятые доли года) использовали заднюю область астерискуса, определяя соотношение между расстоянием от границы последнего зимнего прироста до края отолита и шириной предыдущего годового прироста, измеренных вдоль радиуса, проведённого от примордиума к краю отолита.
Оценка плоидности. Для оценки плоидности определяли площадь ядер эритроцитов у 22 особей Cg в соответствии с описанным ранее методом (Flajšhans, 1997). Для сравнения измеряли площадь ядер 11 особей Cc из того же водоёма. Мазки крови из сердца наркотизированных особей наносили на предметные стёкла и высушивали на воздухе в течение 10 мин. Мазки фиксировали, покрывая стёкла тонким слоем 96%-ного этанола и высушивая; окраску препаратов не применяли. Изображения клеток крови получали под микроскопом Nikon Optiphot, соединённым с цифровой камерой. Площадь ядер эритроцитов определяли посредством инструмента Elliptical selections в программе ImageJ; по меньшей мере 100 ядер измеряли у каждой особи.
Анализ данных. Соотношение между массой (W, г) и длиной тела (FL, см) аппроксимировали, используя степенную функцию W = a(FL)ᵇ (Sparre, Venema, 1998). Сравнение линейных зависимостей длина–масса тела в логарифмической системе координат проводили с применением критерия Фишера. Коэффициент упитанности (K) рассчитывали по унифицированной формуле (Мурза, Христофоров, 2009): K = W × 100/FL3. Гонадосоматический индекс (ГСИ) рассчитан по формуле: ГСИ = g/w × 100. Параметрические и непараметрические критерии использовали для сравнения групп после оценки отличия распределения значений от нормального (тест Д’Агостино–Пирсона). Статистические расчёты выполнены в программе GraphPad Prism 5.03.
РЕЗУЛЬТАТЫ
Идентификация видов, относительная численность, соотношение полов. Особи обоих видов близкого размера представлены на рис. 2. Наиболее чётко Cg отличается от Cc по следующим альтернативным признакам. 1) Серебристо-коричневая окраска тела с преобладанием серого оттенка, плавники без розоватого пигмента против серебристо-коричневой окраски тела с преобладанием золотистого оттенка, грудные, брюшные плавники и особенно анальный плавник у большинства особей имеют розоватый пигмент. 2) На хвостовом стебле отсутствует поперечный тёмный пигментный поясок — поперечный тёмный пигментный поясок на хвостовом стебле занимает два–три вертикальных ряда чешуй и ограничен от начала хвостовой лопасти двумя–тремя вертикальными рядами чешуй без чёрного пигмента. 3) Перитонеум чёрный — перитонеум светлый с отдельными меланофорами. 4) Число жаберных тычинок на первой жаберной дуге 46–47 — число жаберных тычинок на первой жаберной дуге 24–28. Во многих случаях особей Cg и Cc не удаётся различить по следующим признакам: 5) верхний край спинного плавника слегка вогнутый или прямой — верхний край спинного плавника слегка выпуклый; 6) число чешуй вдоль боковой линии 30–32 — число чешуй вдоль боковой линии 32–33.
Рис. 2.
Особи двух видов рода Carassius: а – C. gibelio (самка FL 71 мм, II стадия зрелости гонад); б – C. carassius (самец FL 55 мм, V). Масштаб: 10 мм.

Из 674 особей Cg число самок с яичниками от II до IV–V стадии зрелости – 622; самцов с семенниками от II до IV–V стадии зрелости – 8; ювенильных особей, пол которых не определяли, – 38; стерильных особей FL 102–146 мм с неразвитыми гонадами – 5, гермафродит – 1. Таким образом, соотношение полов особей Cg (самки : самцы) составило ~ 80 : 1. Из 128 особей Cc число самок (яичники от II до IV–V стадии зрелости) – 50; самцов (семенники от II до V стадии зрелости) – 61; ювенильных особей, пол которых не определяли – 17. Соотношение полов Cc (0.8 : 1.0) значимо не отличается от 1 : 1 (точный критерий Фишера, p = 0.493).
Число рыб обоих видов (Cg и Cc) FL < 86 мм в уловах вершами составило соответственно 312 и 128 особей. Доминирование Cg (в 2.4 раза), очевидно, отражает реальное соотношение численности обоих видов.
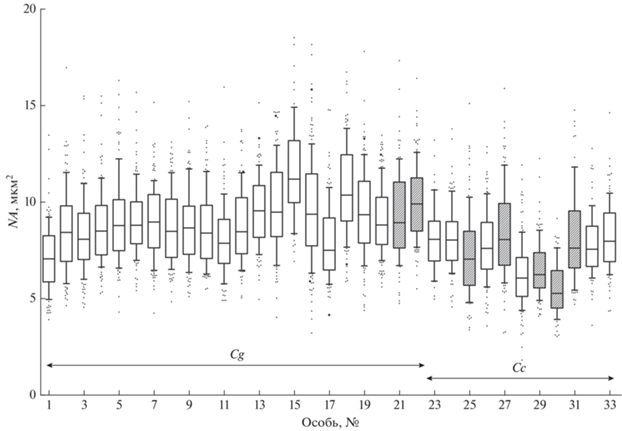
Плоидность. Площадь ядер эритроцитов 22 особей Cg и 11 особей Cc составила в среднем соответственно 9.1 (σ = 2.2, n = 2632) и 7.5 (σ = 2.1, n = = 1150) мкм2 (рис. 3). Таким образом, соотношение между площадью ядер эритроцитов особей Cg и Cc равно 1.2. Средняя площадь ядер эритроцитов самок и самцов Cg – 9.0 (σ = 2.2, n = 2391) и 9.7 (σ = 2.1, n = 241) мкм2; самок и самцов Cc – 7.6 (σ = 1.9, n = 615) и 7.3 (σ = 2.3, n = 535) мкм2. Различия между значениями этого параметра у самок и самцов статистически значимы (U-критерий Манна–Уитни: p < 0.0001) для каждого вида. Соотношение полов Cg свидетельствует, что рыбы размножаются преимущественно посредством гиногенеза и, по-видимому, имеют триплоидный набор хромосом (см. Обсуждение).
Рис. 3.
Площадь ядра эритроцита (NA) у особей Carassius gibelio (Cg) и C. carassius (Cc). Каждый бокс включает пять горизонтальных линий, которые обозначают 10, 25, 50 (медиана),
75 и 90% данных (от 25 до 75% данных заключены в прямоугольник); все значения за пределами
10 и 90% данных воспроизведены в виде точек; (◻) – самки, ( ) – самцы.
) – самцы.
Размерно-возрастная структура. Сеголетки Cg FL 33.3–39.8 мм (n = 4) и FL 42.2 и 45.7 мм (n = 2) имели возраст соответственно ~1.5 и 5 мес.; сеголетки Cc в уловах отсутствовали.
На чешуе заметны сравнительно широкие склериты, число которых составляет 47 у особи Cg FL 95 мм (рис. 4а) и 18 – у особи Cc FL 43 мм (рис. 4б); годовые зоны, включающие суженные и расширенные склериты, у большинства экземпляров не прослеживаются. В связи с этим возраст рыб определяли по отолитам.
Рис. 4.
Чешуя двух видов рода Carassius: а – C. gibelio, самка FL 95 мм, IV–V стадия зрелости гонад, возраст, определённый по астерискусу, – 3.2 года; б – C. carassius, самка FL 43 мм, II, 1.4. Масштаб: 1 мм (линейка общая).

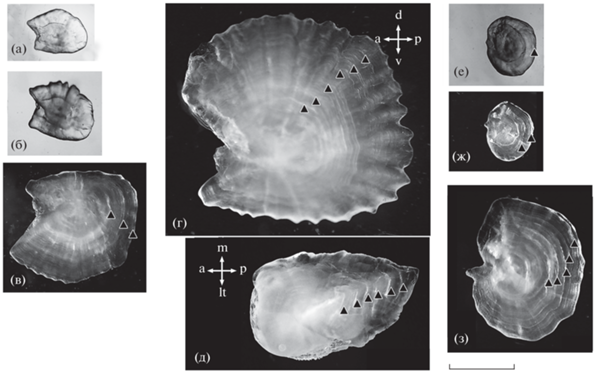
Форма астерискуса различается у Cg (рис. 5а–5г) и Cc (рис. 5е–5з); анализ формы отолитов не входил в задачу данной работы и будет проведён в дальнейшем. У сеголетки Cg, отловленной 5 августа, астерискус имеел длину (в переднезаднем направлении) и высоту (в дорсовентральном направлении) соответственно 0.95 и 0.70 мм (рис. 5а). Соответствующие промеры астерискуса у сеголетки, отловленной 11 сентября, составляют 1.46 и 1.31 мм (рис. 5б). На медиальной стороне астерискуса сеголетки находится медиальный овальный гребень (crista medial) диаметром 0.6–0.7 мм; эта структура просвечивает через латеральную сторону отолита в проходящем свете. Расстояние в переднезаднем направлении от примордиума до внешней границы зоны узких зимних приростов (радиус первого годового кольца) составляет ~0.8 мм; последующие годовые зоны значительно ýже (рис. 5в). Особь максимального возраста (6.7 лет) отловлена 20 августа – это самка с яичниками III–IV стадии зрелости. Она имела сравнительно высокий ГСИ (3.7%), а задержка икрометания до второй половины августа, очевидно, связана с десинхронизацией процесса созревания половых продуктов. Годовые приросты этой особи (а также части других особей Cg) заметны как на астерискусе, так и на лапиллусе (рис. 5г, 5д). У особей Cc радиус первого годового кольца варьирует и составляет 0.37–0.54 мм (рис. 5е–5з), что отражает значительную изменчивость темпа начального роста. Максимальный возраст Cc составил 6.5 лет: самка FL 71 мм, III стадия зрелости яичников, ГСИ 4.7%. Эта особь отловлена 20 августа и таким образом, как и у самки Cg максимального возраста, у неё наблюдается задержка икрометания.
Рис. 5.
Отолиты Carassius gibelio (а–д) и C. carassius (е–з): а–г, е–з – левые астерискусы, вид с латеральной стороны; д – левый лапиллус, вид снизу. а – juv. (ювенильная особь) FL 39.8 мм, возраст ~1.5 мес.; б – juv. FL 45.7 мм, ~5 мес.; в – самец FL 82 мм, IV–V стадия зрелости гонад, возраст 3.1 г.; г – самка FL 180 мм, III–IV, 6.7; д – лапиллус той же особи; е – самка FL 39 мм, II, 1.4; ж – juv. FL 37 мм, 2.1; з – самка FL 72 мм, IV–V, 5.1. a, d, lt, m, p, v – соответственно передняя, верхняя, латеральная, медиальная, задняя и вентральная стороны; (▲) – границы годовых колец. Масштаб: 1 мм (линейка общая).
В связи с тем что в литературных источниках указывается разная длина тела (SL, FL или TL), соотношение между промерами приведено в табл. 1. Предельные значения длины и массы тела самок Cg и особей обоих полов Cc представлены в табл. 2. Длина и масса тела самцов Cg (n = 8) составили 48–152 мм и 3.7–66.6 г.
Таблица 1.
Коэффициенты линейного уравнения (y = mx + k), аппроксимирующего соотношение между FL (x), SL и TL (мм) у Carassius gibelio (Cg) и C. carassius (Cc)
| Параметр | m | k | R2 | n |
|---|---|---|---|---|
| Cg | ||||
| SL | 0.8805 | –1.4666 | 0.997 | 682 |
| TL | 1.0486 | 2.0046 | 0.997 | 682 |
| Cc | ||||
| SL | 0.8578 | –0.1569 | 0.981 | 128 |
| TL | 1.0462 | 0.7706 | 0.991 | 128 |
Примечание. Здесь и в табл. 2: R2 – коэффициент детерминации, n – число особей, экз.
Таблица 2.
Длина (FL), масса тела, параметры (a и b) уравнения соотношения между этими показателями и коэффициент упитанности (K) Carassius gibelio (Cg) и C. carassius (Cc)
| Параметр | Cg | Cc | |
|---|---|---|---|
| Самки (n = 622) |
Самки (n = 50) |
Самцы (n = 61) |
|
| FL, см | 4.0–21.9 (8.4) | 3.8–7.4 (5.5) | 4.1–8.6 (5.5) |
| Масса, г | 1.1–231.7 (14.3) | 0.7–7.4 (3.1) | 1.3–10.4 (2.7) |
| a | 0.0151 | 0.0155 | 0.0315 |
| b | 3.0418 | 3.0484 | 2.5894 |
| R2 | 0.99 | 0.94 | 0.89 |
| K | 1.00–2.45 (1.66) | 1.25–2.03 (1.70) | 1.07–2.27 (1.60) |
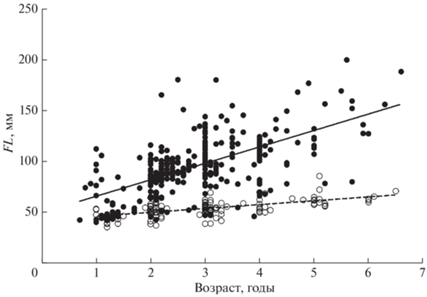
Распределение особей Cg по длине тела характеризуется значительной положительной асимметрией: сравнительно крупные рыбы редки (рис. 6а), а особи в возрасте 1+–3+ в уловах преобладают (рис. 6б). Особи Cc имели значительно меньший размер (рис. 6в); их распределение по длине тела имеет менее выраженную положительную асимметрию, но статистически значимо отличается от нормального (критерий Д’Агостино–Пирсона, p = 0.026). Распределение Cc по возрастным группам существенно не отличается от такового в выборке Cg (рис. 6г). По достижении возраста 1 год молодь Cg и Cc имеет близкую длину тела (FL ~ 50 мм), но в процессе последующего развития темп линейного роста особей обоих видов существенно различается, составляя в среднем соответственно 16.2 и 3.8 мм/год (рис. 7).
Рис. 6.
Длина тела (FL) и возраст Carassius gibelio (а, б) (n = 671 и 333) и C. carassius (в, г) (n = 128 и 121). Здесь и на рис. 9: каждый интервал включает значения, > его нижней и ≤ верхней границы.
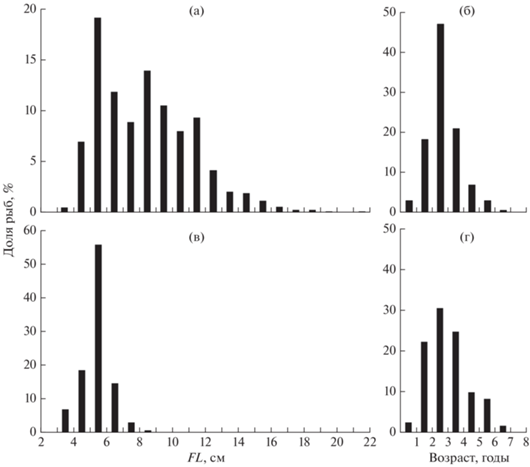
Рис. 7.
Длина тела (FL) Carassius gibelio и C. carassius в зависимости от возраста: (⚫) – C. gibelio, y = 16.16x + 49.395, R2 = 0.39, n = 333; (⚪) – C. carassius, y = 3.795x + 42.121, R2 = 0.35, n = 121.
Параметры уравнений соотношения между длиной и массой тела обоих видов приведены в табл. 2. Сравнение линейных зависимостей длина–масса тела в логарифмической системе координат показало, что по наклону прямых имеются значимые различия между самками и самцами Cc (критерий Фишера, p = 0.007): темп роста массы тела у самок выше. Между самками Cg и самками Cc отсутствуют значимые различия по наклону прямых (p = 0.925), но интерсепты значимо различаются (p = 0.015). Коэффициент упитанности самок Cc выше, чем у самцов своего вида (критерий Стьюдента, p = 0.015) (табл. 2). По этому показателю самки Cg значимо отличаются от самок и самцов Cc (критерий Манна–Уитни: p = 0.012 и p = 0.026 соответственно.
Развитие гонад и половое созревание (рис. 8, 9). У ювенильных самок Cg FL ≥ 40 мм по достижении возраста более года завершается цитологическая дифференциация гонад. Левый и правый яичники расположены по обе стороны от дорсальной части задней камеры плавательного пузыря и соединены с последним посредством брыжеек (рис. 8а). Диаметр превителлогенных ооцитов не превышает 160 мкм. Правая гонада единственной особи-гермафродита с гонадами II стадии зрелости представлена нормальным яичником, в то время как левая содержит преимущественно ткань семенника, но в её каудальной части имеются превителлогенные ооциты (рис. 8б). У самки FL 50 мм с яичниками II–III стадии зрелости единичные вителлогенные ооциты диаметром 162–320 мкм (M = 236 мкм, σ = 53, n = 17) менее прозрачны, чем более мелкие превителлогенные ооциты. У самок с яичниками IV и IV–V стадий зрелости диаметр наиболее крупных ооцитов достигает 1400 мкм (рис. 8в). Распределение ооцитов по диаметру свидетельствует, что превителлогенные ооциты доминируют, а порция ооцитов диаметром свыше 1000 мкм для текущего икрометания формируется незадолго до овуляции (рис. 8в, 9а). В связи с растянутым нерестом (с начала июня до середины августа) и наибольшим числом ооцитов в первой порции ГСИ самок Cg с гонадами III и IV–V стадий зрелости варьирует в широких пределах. Так, с 10.05 по 20.08.2017 г. их ГСИ составил 0.9–21.6% (M = 6.9%, σ = 4.1, n = 77), а ГСИ самца Cg FL 82 мм с семенниками IV–V стадии зрелости – 0.4%.
Рис. 8.
Строение гонад Carassius gibelio (а–в) и C. carassius (г): а – самка FL 58 мм, II стадия зрелости гонад; б – гермафродит FL 52 мм, II; в – самка FL 118 мм, IV–V; г – самец FL 45 мм, II. 1 – задняя камера плавательного пузыря, 2 – превителлогенные ооциты, 3 – семенник, 4 – вителлогенный ооцит, 5 – ооцит перед овуляцией, 6 – жировая ткань. Масштаб: 1 мм (линейка общая).
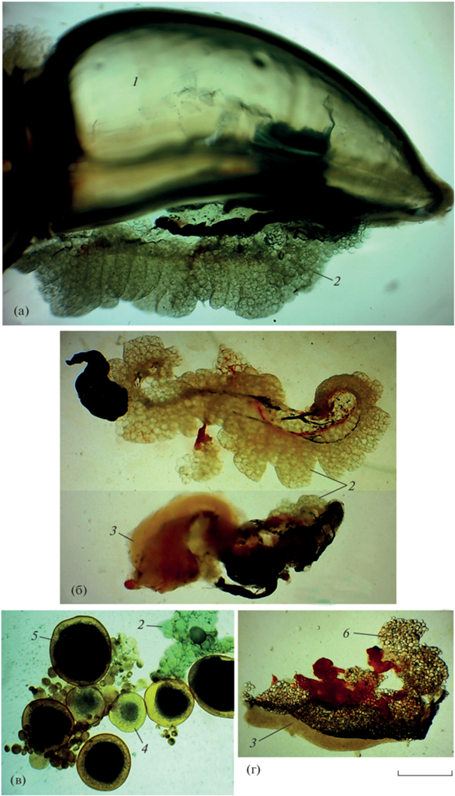
У молоди Cc FL ≥ 38 мм по достижении возраста более года завершается цитологическая и анатомическая дифференциация гонад (рис. 8г). Распределение ооцитов по диаметру в гонадах IV и IV–V стадий зрелости в основном не отличается от такового у самок Cg, но диаметр ооцитов лидирующей порции несколько меньше (≥900 мкм) (рис. 9б). ГСИ самок Cc с гонадами IV–V стадии зрелости составил 3.5–13.9% (M = 9.7%, σ = 3.13, n = 10), ГСИ самцов с гонадами IV и V стадий зрелости – 0.4–9.6% (M = 4.6%, σ = 2.6, n = 34).
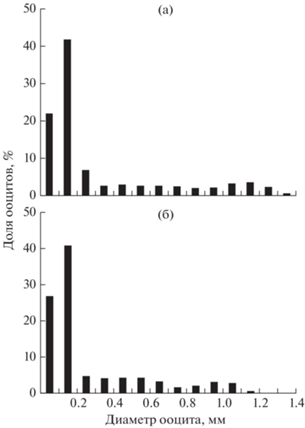
Рис. 9.
Размерный состав ооцитов: а – Carassius gibelio FL 118 мм, IV–V стадия зрелости гонад, n = 643; б – C. carassius FL 62 мм, IV–V, n = 680.
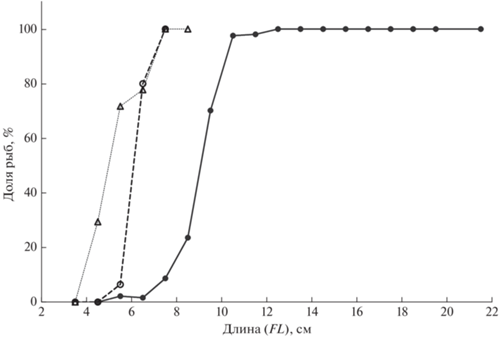
При достижении полового созревания (в начале нерестового сезона гонады на стадии зрелости III и на более продвинутых стадиях) длина тела 50 и 100% особей имеет следующие значения (рис. 10). Cg самки: FL50 = 91, FL100 = 125 мм; Cc самки: FL50 = = 62, FL100 = 75 мм; Cc самцы: FL50 = 50, FL100 = 75 мм.
Рис. 10.
Доля особей, достигших половой зрелости: (⚫) – самки Carassius gibelio, n = 492; (–⚪–), (··△··) – соответственно самки и самцы C. carassius, n = 128.
Перед началом размножения (02–12 июня) число ооцитов первой порции диаметром > 1000 мкм у самок Cg FL 88–124 мм с яичниками IV–V стадии зрелости составило 209–678 (M = 422, n = 8). Число ооцитов первой порции впервые нерестующей самки Cg FL 68 мм – 70. Число ооцитов первой порции диаметром > 900 мкм у самок Cc FL 51–72 мм – 30–204 (M = 100, n = 10). Относительная плодовитость самок обоих видов ~270 ооцитов/год.
ОБСУЖДЕНИЕ
По свидетельству местных жителей, в исследуемом водоёме мелкий карась обитает по меньшей мере в течение 35 лет, но относительная численность особей каждого вида в течение этого срока остаётся неизвестной. Плотность популяции Cg высока и, по-видимому, близка к отмеченной в некоторых водоёмах Чехии: 45–84 особей SL 35–50 мм на 1 м береговой линии (Lusková et al., 2010). Наши наблюдения свидетельствуют, что Cg доминирует как по численности (~ в 2.4 раза), так и по биомассе, а Cc является низкотелой тугорослой формой (C. carassius morpha humilis Heckel, 1840). Представители этой формы, названной степным карасём и обычно обитающей в небольших водоёмах, часто перед спинным плавником имеют “горб” (Кесслер, 1856, Берг, 1949 – цит. по: Дмитриева, 1957), которого в наших уловах не наблюдали. По мнению Дмитриевой (1957), степной карась – форма, остановившаяся в росте на одном из этапов развития. Она отличается от классической (озёрной) меньшим размером, менее продвинутой формой тела и меньшим возрастом достижения полового созревания. В соответствии с классификацией гетерохроний (Gould, 1977; McNamara, 1986) такое изменение онтогенеза является скорее не карликовым состоянием (см., например: Szczerbowski et al., 1997), а педоморфозом; среди модусов педоморфоза – прогенезом. Наличие поперечного тёмного пигментного пояска на хвостовом стебле взрослых особей Cc в пруду Лесной можно также рассматривать как признак ювенилизации: у мальков классической формы SL 28–40 мм этот поясок хорошо выражен, но он полностью исчезает у особей SL 170–240 мм (Дмитриева, 1957). Дифференциация Cc на две формы (крупную классическую озёрную и мелкую прудовую) определяется размером и экологическими особенностями водоёма, наличием или отсутствием хищников и плотностью популяции (Holopainen et al., 1997). В настоящее время золотой карась классической формы практически исчез из типичных мест обитания: из 35 водоёмов бассейна средней Волги с золотым карасём лишь в пяти озёрах обнаружена классическая форма (Монахов и др. 2020).
Начиная с ювенильного периода развития Cg питается в толще воды и у поверхности, в то время как Cc ведёт придонный образ жизни в мелководных зарослевых участках водоёма и питается, добывая организмы со дна (Дмитриева, 1957). По наблюдениям Дмитриевой (1957. С. 127), в оз. Джаркуль (Наурзумский заповедник, Казахстан) Cc “придерживается нижних слоёв воды, движения его медленны и ленивы с частыми остановками и резким опусканием головы вниз”. Чёткое разделение мест обитания особей обоих видов отмечено и нами: все уловы Cc – из установленных на дне верш, и ни одна особь не попалась на крючок, как правило, расположенный непосредственно над поверхностью дна. В то же время подавляющее большинство особей Cg отловлено на крючковые снасти. Можно предположить, что Cg полностью вытесняет Cc лишь в тех водоёмах, где экологическая ниша, необходимая для второго вида, слабо выражена.
В водоёмах Европы, в которых подтверждено совместное обитание диплоидных и триплоидных особей Cg, соотношение самок и самцов не превышает 4.8 : 1.0 (Przybył et al., 2020. Table 2). Нерест видов рода Carassius описан лишь в единичных работах (Сабанеев, 1911; Дмитриева, 1957), и до настоящего времени остаётся неясным, какое соотношение полов необходимо для успешного осеменения ооцитов. Вместе с тем очевидно, что в пруду Лесной при соотношении полов 80 : 1 самки Cg участвуют в нересте с самцами Cc с последующим получением гиногенетического потомства. При минимальном числе собственных самцов не исключено, что самки Cg могут размножаться не только с самцами Cc (гиногенез), но и с собственными самцами (гонохоризм), обеспечивая тем самым определённый уровень генетической изменчивости и максимальную воспроизводительную способность популяции.
Соотношение площадей ядер эритроцитов Cg и Cc в пруду Лесной составило в среднем 1.2. Представители второго вида являются диплоидными (2n = 100) (Knytl et al., 2013). Соотношение площадей ядер эритроцитов триплоидных и диплоидных особей Cg обычно составляет 1.3–1.5 (Черфас, 1987; Kalous et al., 2012); по данным цитоморфологического анализа с оценкой количества ДНК в ядрах эритроцитов, оно равно ~1.35 (Апаликова, 2008). В двух работах, посвящённых оценке плоидности Cg в искусственных водоёмах Турции, на основе соотношения площадей ядер эритроцитов разных особей, превышающего 1.35, сделан вывод о присутствии триплоидов, но оценки проведены на небольшом числе рыб: на четырёх (Emiroglu et al., 2010) и десяти особях (Başkurt et al., 2020). Результаты не подтверждены цитологическими данными, а обнаруженная индивидуальная изменчивость может быть не связана с плоидностью. В оз. Акгол (Турция), где совместно обитают два вида карася, соотношение площадей ядер эритроцитов четырёх особей Cg и трёх особей Cc составило в среднем 1.5 (Emiroglu et al., 2012). Учитывая значения этого параметра, известные для триплоидных и диплоидных особей Cg из двух других водоёмов Турции, авторы полагают, что особи Cg оз. Акгол являются диплоидными, а площадь ядер эритроцитов диплоидных особей Cg существенно превышает таковую у Cc. Следует отметить, что эти выводы основаны на сопоставлении промеров клеток крови, выполненных разными авторами у небольшого числа особей. Сравнение абсолютных значений площади ядер эритроцитов по опубликованным данным не является корректным: этот параметр зависит от методики фиксации и окраски клеток крови в каждом конкретном случае. Учитывая соотношение полов Cg в пруду Лесной, с наибольшей вероятностью можно предположить, что популяция представлена триплоидными особями, размножающимися посредством гиногенеза. Гиногенез у диплоидных самок Cg возможен (Abramenko, 2001; Абраменко, 2006), но встречается чрезвычайно редко. Исходя из приведённых выше данных, площадь ядер эритроцитов гипотетической диплоидной формы Cg должна составить ~6.7 (9.1/1.35) мкм2. Таким образом, площадь ядер эритроцитов диплоидных Cg несколько меньше, чем у особей Cc (в среднем соответственно 6.7 и 7.5 мкм2), что противоречит выводам цитированной выше работы (Emiroglu et al., 2012). Исходя из наших данных, единичные самцы, обнаруженные в популяции Cg пруда Лесной, так же как и самки, очевидно, являются триплоидными. Самцы Cg обычно имеют диплоидный набор хромосом (Васильева, 1990; Васильева, Васильев, 2000; Lusková et al., 2010; Liasko et al., 2011), но присутствие триплоидных самцов отмечено в ряде популяций (Przybył et al., 2020), а один из возможных путей их появления – гормональное переопределение пола в раннем онтогенезе, возможность которого подтверждается обнаружением в пруду Лесной гермафродитной особи. Уровень плоидности Cg существенно не влияет как на морфологические признаки (Васильева, 1990; Васильева, Васильев, 2000; Boroń et al., 2011; Rylková et al., 2013; Барсегян и др., 2017; Горюнова и др., 2017), так и на темп роста рыб (Васильева, Васильев, 2000; Liasko et al., 2011; Przybył et al., 2020): больший размер клеток полиплоидных форм компенсируется их меньшим числом и меньшим отношением площади поверхности клетки к её объёму (Leggatt, Iwama, 2003).
По данным ряда авторов (Вехов, 2013; Artaev, Ruchin, 2016; Przybył et al., 2020), уменьшение численности и исчезновение Cc после вселения Cg может быть связано с гибридизацией между этими видами. Несмотря на высокую численность обоих видов в пруду Лесной, гибридные особи (на основе морфологических признаков, окраски рыб и цвета перитонеума) не обнаружены. В целом достоверных данных об образовании естественных гибридов между обоими видами сравнительно немного. По данным микросателлитного анализа рыб в бассейне р. Тайа (Чехия), из 634 особей (Cg представлен преимущественно диплоидной формой) обнаружено около 2.4% гибридных рыб F1 (самки Cg × самцы Cc), морфологически различающихся исключительно по числу жаберных тычинок (Papoušek et al., 2008). На основе молекулярного анализа гибридные особи отмечены также в водоёмах Западной Балтики (Швеция) (Wouters et al., 2012). Из небольшого пруда Финляндии, предположительно населённого исключительно Cc, описана триплоидная самка, морфологически не отличающаяся от Cc, но имеющая два гаплоидных набора Cg и один Cc (Knytl et al., 2018). Гибридизация обоих видов и формирование самовоспроизводящихся популяций гибридных форм отмечены в бассейне Азовского моря (Подушка, 2004 – цит. по: Artaev, Ruchin, 2016) и в периодически высыхающих озёрах Казахстана (Горюнова и др., 2017), но эти сообщения требуют подтверждения с применением генетического анализа. По данным последней работы, доля гермафродитных особей гибридной формы достигает 25%, а о наличии стерильных рыб не сообщается. Среди Cg пруда Лесной доля таких рыб составила соответственно ~ 0.2 и 0.8%. В связи с тем, что ооциты гиногенетической формы Cg избирательно реагируют на сперматозоиды с образованием исключительно клональных форм при осеменении спермой другого вида (Zhang et al., 2015), формирование большого числа гибридных особей вряд ли возможно. Тем не менее, при увеличении доли диплоидных самцов Cg в популяции и их гибридизации с самками Cc можно ожидать появления нежизнеспособного или стерильного потомства, что, по-видимому, является одной из причин постепенного исчезновения популяций последнего вида в условиях симпатрии.
В пруду Лесной Cg и Cc имеют близкую возрастную структуру, у обоих видов максимальный возраст достигает 6+, половое созревание большинства особей наблюдается в возрасте 2+–3+, но темп роста Cg существенно выше (рис. 7). Рост Cg и Cc в небольшом пруду Курьково в районе Глубокого озера Московской области прослежен Дмитриевой (1957). В этом водоёме из сотен особей Cg не обнаружено ни одного самца, из чего можно заключить, что популяция была представлена особями, размножающихся гиногенетически. Автором указан чрезвычайно низкий темп роста особей обоих видов на первом году жизни (табл. 3). Эта оценка может быть неточной, поскольку, по данным Дмитриевой (1957), сеголетки в уловах отсутствовали, а возраст рассчитан методом обратного расчисления по передней части чешуи (на задней части чешуи годовые кольца были мало заметны). В пруду Курьково последующий темп роста Cg был несколько выше, чем темп роста Cc.
Таблица 3.
Показатели темпа роста (средние значения длины тела в разном возрасте и при достижении полового созревания) и возраст (при достижении полового созревания и максимальный) Carassius gibelio (Cg) и C. carassius (Cc) в некоторых водоёмах
| Водоём | Обозначение длины | Длина, мм | Возраст, годы | Источник информации | |||
|---|---|---|---|---|---|---|---|
| 1 год | 3 года | mat | mat | max | |||
| Cg | |||||||
| Пруд Лесной (Нижегородская область) (RU)* | SL | 48 | 86 | 78 | 2–3 | 6 | Данная работа |
| Пруд Курьково (Московская область) (RU)* | То же | 17 | 75 | 99 | 4 | 4–5 | Дмитриева, 1957 |
| Озёра и пруды 9 популяций Европы и Азии (RU, UZ) | » | 35–66 | 102–181 | 150 | 4–5 | ≤8 | Дмитриева, 1957. Табл. 15 |
| Цимлянское вдхр. (р. Дон) (RU) | » | – | 135–170 | – | – | 19 | Абраменко, 2012 |
| Оз. Большой Пелис (зал. Петра Великого) (RU) | TL | ≥60 | 90–230 | 90–130 | 3 | 14 | Маркевич, 2020 |
| Озёра и водохранилища (TR) | FL | 64–95 | 180–260 | – | – | 6–9 | Erdogan et al., 2014 |
| Cc | |||||||
| Пруд Лесной (Нижегородская область) (RU)* | SL | 40 | 46 | 43–53 | 2–3 | 6 | Данная работа |
| Пруд Курьково (Московская область) (RU)* | То же | 17 | 64 | 80–90 | 3–4 | 5 | Дмитриева, 1957 |
| Озёра и пруды Башкирии, Урала и Ленинградской области (RU) | » | 31–51 | 84–165 | 97–167 | 4–5 | ≤9 | Дмитриева, 1957. Табл. 6 |
| Оз. Глубокое (Московская область) (RU)* | » | 19 | 77 | 104–133 | 4–5 | 9 | Дмитриева, 1957 |
| Пруд в лесу (Ольштын) (PL) | TL | 35 | 59 | 48 | 2 | 8 | Szczerbowski et al., 1997 |
| Пруд Hermanninlampi (FI) | То же | 38 | 83 | 84–110 | 3–4 | 13 | Holopainen, Pitkänen, 1985 |
| Пруд Kuikkalampi (FI) | » | 37 | 65 | – | – | 8 | Holopainen, Pitkänen, 1985 |
| 4 небольших пруда (Лондон) (GB) | SL | 29–50 | 71–101 | 40–60 | 1–2 | 6–7 | Tarkan et al., 2009 |
В прудах Англии темп линейного роста C. auratus в симпатрии с Cc был выше, а коэффициент упитанности ниже, чем в аллопатричных популяциях (Tarkan et al., 2010). По мнению авторов, эти различия в темпе роста могут быть связаны как с конкурентными взаимоотношениями между видами в условиях симпатрии, так и с разными пищевыми ресурсами исследованных водоёмов. В пруду Лесной темп роста Cg выше, чем в пруду Курьково, но ниже, чем в сравнительно крупных водоёмах, где популяции представлены бо́льшим числом возрастных групп. В то же время темп роста педоморфной формы Cc в пруду Лесной на протяжении первых лет жизни ниже, чем в пруду Курьково, но примерно такой же, как в малых водоёмах Европы (табл. 3).
Таким образом, в пруду Лесной Cg и педоморфная форма Cc обладают низким темпом роста, представлены сравнительно небольшим числом возрастных групп и характеризуются ранним достижением половой зрелости, что связано с ограниченными пищевыми ресурсами и низкой вероятностью выживания крупных особей, отмечаемой для небольших водоёмов (Ylikarjula et al., 1999). Симпатрия обоих видов, очевидно, широко распространена в малых водоёмах Центральной России, но данные о наличии мелкой педоморфной формы Cc немногочисленны. По нашим наблюдениям, оба вида обитают совместно в прудах Церковное (55°45′04.7′′ с.ш. 44°48′40.4′′ в.д.; 1.62 га) и Большое (55°44′55.6′′ с.ш. 44°48′57.8′′ в.д.; 4.54 га) деревни Малое Мурашкино (~10 км от пруда Лесной). В этих водоёмах высокой численности достигает верховка Leucaspius delineatus, Cg представлен почти исключительно самками и существенно крупнее, чем Cc. Во втором, более крупном водоёме, популяция Cg сравнительно разрежена вследствие любительского рыболовства, а популяция Cc включает большое число возрастных групп: отловлена особь FL 130 мм в возрасте 9.7 лет. При симпатрии темп роста Cg, очевидно, всегда выше, чем темп роста педоморфной формы Cc, причём экологические ниши обоих видов разобщены, а рост особей вряд ли определяется совместным или раздельным обитанием обоих видов. Следует отметить, что данные о симпатрии и взаимоотношениях Cg и классической формы Cc практически отсутствуют, и эта форма, по-видимому, может полностью исчезать из водоёмов вследствие пищевой конкуренции с Cg. Обзор жизненных циклов обеих форм Cc в разных условиях свидетельствует об их экологической пластичности и возможности взаимной трансформации (Holopainen et al., 1997), но можно предположить, что многолетнее воспроизводство мелкой педоморфной формы способствует накоплению генетических изменений, препятствующих её преобразованию в классическую. Дальнейшие исследования взаимоотношений Cg и Cc в водоёмах с разными экологическими характеристиками необходимы для охраны и восстановления популяций последнего вида.
Список литературы
Абраменко М.И. 2006. К вопросу об естественном диплоидном гиногенезе в популяциях серебряного карася Азовского бассейна // Вестн. ЮНЦ РАН. Т. 2. № 1. С. 61–64.
Абраменко М.И. 2012. Эколого-генетические механизмы динамики численности популяции серебряного карася (Carassius auratus gibelio (Bloch, 1782)) Цимлянского водохранилища // Биология внутр. вод. № 4. С. 68–76.
Апаликова О.В. 2008. Филогенетический анализ двух форм серебряного карася Carassius auratus gibelio Bloch на основе изменчивости митохондриальной ДНК: Автореф. дис. … канд. биол. наук. Владивосток: ИБМ ДВО РАН, 24 с.
Баранов В.Ю., Васильев А.Г. 2018. Морфологическое разнообразие и изменчивость симпатрических популяций серебряного и золотого карасей в загрязнённых радионуклидами озёрах Южного Урала // Экология. № 1. С. 45–53. https://doi.org/10.7868/S0367059718010055
Барсегян Н.Э., Варданян Т.В., Степанян И.Э., Габриелян Б.К. 2017. Экологическая и цитогенетическая характеристика структуры популяции серебряного карася (Carassius auratus gibelio, Bloch, 1782) озера Севан (Армения) // Вестн. АГТУ. Сер. Рыб. хоз-во. Т. 2017. № 2. С. 105–116. https://doi.org/10.24143/2073-5529-2017-2-105-116
Богуцкая Н.Г., Насека А.М. 2004. Каталог бесчелюстных и рыб пресных и солоноватых вод России с номенклатурными и таксономическими комментариями. М.: Т-во науч. изд. КМК, 389 с.
Васильева Е.Д. 1990. О морфологической дивергенции гиногенетической и бисексуальной форм серебряного карася Carassius auratus (Cyprinidae, Pisces) // Зоол. журн. Т. 69. № 11. С. 97–110.
Васильева Е.Д., Васильев В.П. 2000. К проблеме происхождения и таксономического статуса триплоидной формы серебряного карася Carassius auratus (Cyprinidae) // Вопр. ихтиологии. Т. 40. № 5. С. 581–592.
Вехов Д.А. 2013. Некоторые проблемные вопросы биологии серебряного карася Carassius auratus s. lato // Науч.-техн. бюл. лаб. ихтиологии ИНЭНКО. Вып. 19. С. 5–38.
Витковский А.З., Богачев А.Н. 2005. Распространение инвазионных видов рыб в Азово-Донском бассейне // Тез. докл. II Междунар. симпозиума по изучению инвазийных видов “Чужеродные виды в Голарктике (Борок – 2)”. Борок: Изд-во ИБВВ РАН. С. 139–140.
Горюнова А.И., Исбеков К.Б., Асылбекова С.Ж., Данько Е.К. 2017. О карасях периодически высыхающих степных озёр Северного Казахстана в свете современных отечественных и зарубежных исследований // Тр. ВНИРО. Т. 165. С. 27–42.
Дмитриева Е.Н. 1957. Морфо-экологический анализ двух видов карася // Тр. ИМЖ АН СССР. Вып. 16. С. 102–170.
Макеева А.П. 1992. Эмбриология рыб. М.: Изд-во МГУ, 216 с.
Маркевич А.И. 2020. Изменения в структуре популяции серебряного карася Carassius gibelio пресноводного озера на острове Большой Пелис (залив Петра Великого Японского моря) // Изв. ТИНРО. Т. 200. № 2. С. 321–333. https://doi.org/10.26428/1606-9919-2020-200-321-333
Монахов С.П., Аськеев А.О., Аськеев И.В. и др. 2020. Прошлое и настоящее видов рода Carassius Средневолжского региона // Вопр. рыболовства. Т. 21. № 1. С. 5–19.
Мурза И.Г., Христофоров О.Л. 2009. Об унификации расчёта коэффициента упитанности у лососевых рыб // Матер. XXVIII Междунар. конф. “Биологические ресурсы Белого моря и внутренних водоёмов Европейского Севера”. Петрозаводск: Изд-во КарНЦ РАН. С. 376–380. http://ib.krc.karelia.ru/publ.php?plang=e&id=7222
Ручин А.Б. 2014. К распространению двух видов карасей (Carassius auratus s. lato, C. carassius (Linnaeus, 1758)) в бассейне реки Суры // Актуал. проблемы гуманитар. и естеств. наук. № 2–1. С. 22–27.
Сабанеев Л.П. 1911. Рыбы России: жизнь и ловля (уженье) наших пресноводных рыб. М.: Изд-е А.А. Карцева, 1062 с.
Черфас Н.Б. 1987. Гиногенез у рыб // Генетика и селекция рыб. Л.: Наука. С. 309–335.
Abramenko M.I. 2001. Possibility of existence of natural diploid gynogenesis in Russian populations of silver crucian carp Carassius auratus gibelio // Chromosome Res. V. 9 Suppl. 1. P. 61.
Artaev O.N., Ruchin A.B. 2016. Prussian and crucian carp: confindness to various types of waters and co-inhabiting species in water bodies within the Mid-volga region // Ecol. Environ. Conserv. V. 22. № 3. P. 505–510.
Başkurt S., Vatan P.Ö., Emiroğlu Ö., Aksu S. 2020. Gynogenetic reproduction potential of invasive Carassius gibelio in Ula Pond // Int. J. Nat. Eng. Sci. V. 14. № 1. P. 8–10. https://www.ijnes.org/index.php/ijnes/article/view/576
Boroń A., Szlachciak J., Juchno D. et al. 2011. Karyotype, morphology, and reproduction ability of the Prussian carp, Carassius gibelio (Actinopterygii: Cypriniformes: Cyprinidae), from unisexual and bisexual populations in Poland // Acta Ichthyol. Piscat. V. 41. № 1. P. 19–28. https://doi.org/10.3750/AIP2011.41.1.04
Emiroglu O., Uyanoglu M., Canbek M., Baskurt S. 2010. Erythrocyte sizes of Carassius gibelio species in Porsuk Dam Lake (Eskisehir/Turkey) // J. Anim. Vet. Adv. V. 9. № 24. P. 3077–3082. https://doi.org/10.3923/javaa.2010.3077.3082
Emiroglu O., Uyanoglu M., Baskurt S. 2012. Comparison of the erythrocyte sizes of Carassius gibelio and Carassius carassius species living together in Akgöl (Adapazari/Turkey) // Asian J. Anim. Vet. Adv. V. 7. № 9. P. 876–883. https://doi.org/10.3923/ajava.2012.876.883
Erdogan Z., Koc H.T., Gungor S., Ulunehir S. 2014. Age, growth and reproductive properties of an invasive species Carassius gibelio (Bloch, 1782) (Cyprinidae) in the Ikizcetepeler Dam Lake (Balikesir), Turkey // Period. Biol. V. 116. № 3. P. 285–291. https://hrcak.srce.hr/135187
Fagernes C.E., Stensløkken K.O., Røhr Å.K. et al. 2017. Extreme anoxia tolerance in crucian carp and goldfish through neofunctionalization of duplicated genes creating a new ethanol-producing pyruvate decarboxylase pathway // Sci. Rep. V. 7. Article 7884. https://doi.org/10.1038/s41598-017-07385-4
Flajšhans M. 1997. A model approach to distinguish diploid and triploid fish by means of computer-assisted image analysis // Acta Vet. Brno. V. 66. № 2. P. 101–110. https://doi.org/10.2754/avb199766020101
Gould S.U. 1977. Ontogeny and Phylogeny. Cambridge: Belknap Press, 675 p.
Holopainen I.J., Pitkänen A.K. 1985. Population size and structure of crucian carp (Carassius carassius (L.)) in two small, natural ponds in Eastern England // Ann. Zool. Fennici. V. 22. № 4. P. 397–406.
Holopainen I.J., Tonn W.M., Paszkowski C.A. 1997. Tales of two fish: the dichotomous biology of crucian carp (Carassius carassius (L.)) in northern Europe // Ibid. V. 34. P. 1–22.
Japoshvili B., Mumladze L., Murvanidze L. 2017. The population of Carassius gibelio (Bloch, 1782) and its parasites in Madatapa Lake (South Georgia) // Iran. J. Fish. Sci. V. 16. № 2. P. 793–799. Available: http://jifro.ir/article-1-2749-en.html
Jeffries D.L., Copp G.H., Maes G.E. et al. 2017. Genetic evidence challenges the native status of a threatened freshwater fish (Carassius carassius) in England // Ecol. Evol. V. 7. № 9. P. 2871–2882. https://doi.org/10.1002/ece3.2831
Kalous L., Bohlen J., Rylková K., Petrtýl M. 2012. Hidden diversity within the Prussian carp and designation of a neotype for Carassius gibelio (Teleostei: Cyprinidae) // Ichthyol. Explor. Freshw. V. 23. № 1. P. 11–18.
Knytl M., Kalous L. 2009. Mystery of chromosome number of silver Prussian carp (Carassius gibelio) // Proc. Workshop Animal Biodiversity. Praha: ČZU. P. 68–69.
Knytl M., Kalous L., Ráb P. 2013. Karyotype and chromosome banding of endangered crucian carp, Carassius carassius (Linnaeus, 1758) (Teleostei, Cyprinidae) // Comp. Cytogen. V. 7. № 3. P. 205–213. https://doi.org/10.3897/compcytogen.v7i3.5411
Knytl M., Kalous L., Rylková K. et al. 2018. Morphologically indistinguishable hybrid Carassius female with 156 chromosomes: A threat for the threatened crucian carp, C. carassius L. // PLoS ONE. V. 13. № 1. Article e0190924. https://doi.org/10.1371/journal.pone.0190924
Kottelat M. 2017. Carassius praecipuus, a dwarf new species of goldfish from the Mekong drainage in central Laos (Teleostei: Cyprinidae) // Rev. Suisse Zool. V. 124. № 2. P. 323–329. https://doi.org/10.5281/zenodo.893541
Leggatt R.A., Iwama G.K. 2003. Occurrence of polyploidy in the fishes // Rev. Fish Biol. Fish. V. 13. № 3. P. 237–246. https://doi.org/10.1023/B:RFBF.0000033049.00668.fe
Li X., Guo B. 2020. Substantially adaptive potential in polyploid cyprinid fishes: evidence from biogeographic, phylogenetic and genomic studies // Proc. R. Soc. B. V. 287. № 1920. Article 20193008. https://doi.org/10.1098/rspb.2019.3008
Liasko R., Koulish A., Pogrebniak A. et al. 2011. Influence of environmental parameters on growth pattern and population structure of Carassius auratus gibelio in Eastern Ukraine // Hydrobiologia. V. 658. № 1. P. 317–328. https://doi.org/10.1007/s10750-010-0502-6
Lusková V., Lusk S., Halačka K., Vetešník L. 2010. Carassius auratus gibelio – the most successful invasive fish in waters of the Czech Republic // Rus. J. Biol. Invasions. V. 1. № 3. P. 176–180. https://doi.org/10.1134/S2075111710030069
McNamara K.J. 1986. A guide to the nomenclature of heterochrony // J. Paleontol. V. 60. № 1. P. 4–13.
Papoušek I., Vetešník L., Halačka K. et al. 2008. Identification of natural hybrids of gibel carp Carassius auratus gibelio (Bloch) and crucian carp Carassius carassius (L.) from lower Dyje River floodplain (Czech Republic) // J. Fish Biol. V. 72. № 5. P. 1230–1235. https://doi.org/10.1111/j.1095-8649.2007.01783.x
Przybył A., Przybylski M., Spóz A. et al. 2020. Sex, size and ploidy ratios of Carassius gibelio from Poland // Aquat. Invasions. V. 15. № 2. P. 335–354. https://doi.org/10.3391/ai.2020.15.2.08
Rylková K., Kalous L., Bohlen J. et al. 2013. Phylogeny and biogeographic history of the cyprinid fish genus Carassius (Teleostei: Cyprinidae) with focus on natural and anthropogenic arrivals in Europe // Aquaculture. V. 380–383. P. 13–20. https://doi.org/10.1016/j.aquaculture.2012.11.027
Sparre P., Venema C.S. 1998. Introduction to tropical fish stock assessment. Part I: Manual. FAO Fish. Tech. Pap. Rev. № 306. Rome: FAO, 407 p.
Szczerbowski A., Łuczyński M.J., Zakęś Z., Szkudlarek M. 1997. Dwarf crucian carp (Carassius carassius L.) population in a forest pond // Arch. Ryb. Pol. V. 5. № 1. P. 155–166.
Tarkan A.S., Copp G.H., Zięba G. et al. 2009. Growth and reproduction of threatened native crucian carp Carassius carassius in small ponds of Epping Forest, southeast England // Aquat. Conserv: Mar. Freshw. Ecosyst. V. 19. № 7. P. 797–805. https://doi.org/10.1002/aqc.1028
Tarkan A.S., Cucherousset J., Zięba G. et al. 2010. Growth and reproduction of introduced goldfish Carassius auratus in small ponds of southeast England with and without native crucian carp Carassius carassius // J. Appl. Ichthyol. V. 26. № S2. P. 102–108. https://doi.org/10.1111/j.1439-0426.2010.01506.x
Wouters J., Janson S., Lusková V., Olsén K.H. 2012. Molecular identification of hybrids of the invasive gibel carp Carassius auratus gibelio and crucian carp Carassius carassius in Swedish waters // J. Fish Biol. V. 80. № 7. P. 2595–2604. https://doi.org/10.1111/j.1095-8649.2012.03312.x
Ylikarjula J., Heino M., Dieckmann U. 1999. Ecology and adaptation of stunted growth in fish // Evol. Ecol. V. 13. № 5. P. 433–453. https://doi.org/10.1023/A:1006755702230
Zhang J., Sun M., Zhou L. et al. 2015. Meiosis completion and various sperm responses lead to unisexual and sexual reproduction modes in one clone of polyploid Carassius gibelio // Sci. Rep. V. 5. Article 10898. https://doi.org/10.1038/srep10898
Zhou L., Wang Y., Gui J.F. 2000. Genetic evidence for gonochoristic reproduction in gynogenetic silver crucian carp (Carassius auratus gibelio Bloch) as revealed by RAPD assays // J. Mol. Evol. V. 51. № 5. P. 498–506. https://doi.org/10.1007/s002390010113
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


