Вопросы ихтиологии, 2022, T. 62, № 6, стр. 737-757
Рост, гаметогенез и закономерности формирования разнообразия типов жизненной стратегии кунджи Salvelinus leucomaenis (Salmonidae) реки Коль (Западная Камчатка)
К. В. Кузищин 1, *, А. Г. Буш 2, М. А. Груздева 1, А. М. Малютина 1, Е. Д. Павлов 2, Д. С. Павлов 1, 2
1 Московский государственный университет
Москва, Россия
2 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
* E-mail: KK_office@mail.ru
Поступила в редакцию 18.05.2022
После доработки 14.06.2022
Принята к публикации 14.06.2022
- EDN: DNDXML
- DOI: 10.31857/S0042875222060182
Аннотация
Изучена структура популяции и особенности формирования типов жизненной стратегии у кунджи Salvelinus leucomaenis (Pallas, 1814) р. Коль (Западная Камчатка). Локальная популяция представляет собой систему внутрипопуляционных группировок, включающих в себя мелких оседлых карликовых самцов, более крупных речных реодромных самцов и самок, а также анадромных рыб. Установлено, что дифференциация в поколении кунджи проходит в нерестовых притоках в несколько этапов и растянута на 3–4 года. Процесс начинается в первое лето жизни, когда самые быстро растущие сеголетки скатываются из нерестового притока в основное русло реки, где достигают половой зрелости к 5–6 годам жизни, формируя речной реодромный тип жизненной стратегии. Второй этап дифференциации в поколении кунджи происходит в возрасте 3+ и обусловлен различиями в темпе роста особей. Быстро растущие самцы созревают и становятся карликовыми, медленнее растущие самцы и самки смолтифицируются и формируют анадромный тип жизненной стратегии. Завершающий этап дифференциации происходит в возрасте 4+ и аналогичен таковому в возрасте 3+. Выявлено, что карликовые самцы кунджи на Камчатке размножаются только один раз в жизни. Установлено, что определяющая роль в дифференциации поколения кунджи принадлежит процессу неравномерного темпа роста отдельных рыб в разном возрасте.
Для лососёвых рыб характерно высокое разнообразие на внутривидовом уровне организации. Оно выражается в совместном существовании в популяциях симпатричных группировок, различающихся своими биологическими характеристиками и типом жизненной стратегии, обеспечивая виду устойчивость в нестабильных условиях существования (Evolution …, 2004; Quinn, 2005; Павлов, Савваитова, 2008; Schindler et al., 2010; Chapman et al., 2011, 2012; Moore et al., 2014). В связи с этим важным представляется анализ путей формирования внутрипопуляционных группировок, различающихся по степени выраженности анадромии и резидентости (Liedvogel et al., 2011; Moore et al., 2014; Baerwald et al., 2015). Изученность особенностей и закономерностей внутривидовой дифференциации у разных видов лососёвых рыб неодинакова. Наибольшее внимание уделяется атлантическому лососю Salmo salar и кумже S. trutta (Thorpe, 1987, 1994; Черницкий, 1993; Elliott, 1994; Marschall et al., 1998; Thorpe et al., 1998; Bohlin et al., 2001; Kallio-Nyberg et al., 2009; Marco-Rius et al., 2012), в меньшей степени изучены сима Oncorhynchus masou (Груздева и др., 2013) и микижа Parasalmo mykiss (Sloat et al., 2014; Kendall et al., 2015; Кузищин и др., 2020). У гольцов рода Salvelinus – рыб с весьма сложной структурой вида – закономерности формирования внутривидового разнообразия все ещё остаются малоизученными. В водоёмах Северной Пацифики разные виды гольцов демонстрируют необычайно высокий адаптивный потенциал, образуя множество географических форм и экологических группировок – жилые, полупроходные и проходные, быстро- и медленнорастущие, “крупные” и карликовые и так далее (Савваитова, 1989; Черешнев и др., 2002; Behnke, 2002; Павлов, Савваитова, 2008; Klemetsen, 2010, 2013; Hutchings, 2011; Есин, Маркевич, 2017).
Высокое разнообразие гольцов создаёт весьма сложную, запутанную и мозаичную картину их внутривидовой структуры в азиатской части Северной Пацифики (Савваитова, 1989; Гриценко, 2002; Черешнев и др., 2002; Рыбы …, 2012; Есин, Маркевич, 2017). В то же время взаимоотношения между группировками, причины и пути их формирования на уровне отдельных популяций гольцов, роль эндогенных и экзогенных факторов остаются до конца невыясненными.
Ранее процессы внутривидовой дифференциации в роде Salvelinus были изучены нами у мальмы S. malma на примере локальной популяции р. Коль (Груздева и др., 2017). Было установлено, что разнообразие типов жизненной стратегии определяется кумулятивным действием факторов флуктуирующей среды обитания. У кунджи S. leucomaenis Камчатки (Черешнев и др., 2002; Есин, Маркевич, 2017) и, в частности, в р. Коль (Кузищин и др., 2022), так же как и у мальмы, установлено существование проходной и пресноводных компонент в рамках одной популяции. Однако у кунджи процессы дифференциации в поколении и закономерности формирования разнообразия типов жизненной стратегии на популяционном уровне организации не изучены. В связи с этим цель нашего исследования – на основании анализа особенностей распределения, роста и гаметогенеза выявить закономерности формирования разнообразия типов жизненной стратегии кунджи на примере популяции р. Коль.
МАТЕРИАЛ И МЕТОДИКА
Материал собран в бассейне р. Коль с 2002 по 2008 гг. Работой охвачена бо́льшая часть бассейна реки, включая притоки и водоёмы придаточной системы (Кузищин и др., 2022). Река Коль берёт начало в отрогах Срединного Камчатского хребта и впадает в Охотское море. Её длина по основному руслу составляет 133 км, коэффициент развития речной сети 0.61 км/км2, средний расход воды в устье в межень 56 м3/с. Река представляет собой разветвлённую систему параллельных русел, имеет много коротких (длиной 3–8 км, расход воды в устье 0.03–0.30 м3/с) притоков горного типа в верховьях и среднем течении. Притоки тундрового типа длиной 8–32 км и расходом воды в межень 0.88–1.78 м3/с расположены преимущественно в среднем и нижнем течении (Павлов и др., 2009; Кузищин и др., 2010).
Структура популяции кунджи и подробная характеристика (описание, морфометрия, биологические особенности) внутрипопуляционных группировок приведены в предыдущих работах (Павлов и др., 2009; Кузищин и др., 2022). В настоящем исследовании мы используем оригинальный материал, уточнённые и дополненные данные.
Рыб для анализа отлавливали в основном русле, притоках тундрового и горного типов, в водоёмах придаточной системы и в приустьевых зонах моря и русла реки закидным неводом, набором жаберных сетей (шаг ячеи 20–75 мм) и удебными снастями.
Оценки встречаемости и плотности молоди, карликовых самцов и производителей проводили с применением электролова Smith-Root 24L (“Smith-Root”, США) в щадящем режиме (Bird, Cowx, 1993) с переменным импульсным током, напряжением 350–400 В, частотой 40–60 Гц, длительностью импульса 2 мс. После отлова всех особей обездвиживали растворами MS-222 или гвоздичного масла (Kouřil et al., 2009; Микодина и др., 2011). Для оценки плотности молоди использовали метод трёхкратного облова (Zippin, 1956), показатели плотности и биомассы молоди рыб определяли для участков площадью не менее 150 м2 каждый. Сбор материала (>600 обловов) провели на 51 участке водной системы (основное русло, боковые протоки, притоки, водоёмы придаточной системы). Всего проанализировано > 21 тыс. экз. разновозрастной молоди всех видов лососёвых рыб.
Для всех рыб (>6000 экз. половозрелых рыб и молоди) выполнен биологический анализ (Правдин, 1966), включая определение пола рыб и стадии зрелости гонад (Сакун, Буцкая, 1968; Персов, 1975; Мурза, Христофоров, 1991; Макеева, 1992; Чмилевский, 2003). Для проведения гистологического анализа фрагменты гонад фиксировали в 4%-ном растворе формальдегида. Конкретные объёмы выборок по разным видам анализа указаны в соответствующих таблицах и на рисунках.
Возраст рыб определяли по отолитам (сагитта). Для обратного расчисления роста рыб определяли радиус отолита (R), ширину приростов отолита, на основе которых рассчитывали l1, l2, l3 … l+ – расчисленные длины тела в 1-й, 2-й, 3-й … и в текущий годы жизни. Обратное расчисление длины тела рыб в разном возрасте проводили по формуле Ли (Busaker et al., 1990): li − c = ri/R(FL − c), где li – вычисляемая длина тела особи в i-том возрасте, ri – радиус i-того годового кольца на отолите, R – полный радиус отолита, FL – наблюдённая длина по Смитту, с – свободный член, вычисляемый по уравнению связи радиуса отолита с длиной рыбы: ln FL = c + ln R, при этом коэффициент корреляции составил более 0.95.
Определение типа жизненной стратегии проводили, оценивая величину годовых приростов на отолитах (Гудков, 1991; Тиллер, 2007) и учитывая результаты параллельного анализа соотношения ионов Sr/Ca в отолитах (Павлов и др., 2013, 2014): пестряток (n = 15), карликовых самцов (n = 11) и резидентных особей (n = 8).
Данные биологического анализа обрабатывали с помощью стандартного унивариантного метода статистического анализа (Лакин, 1990) и метода главных компонент многомерной статистики (James, McCulluch, 1990). При анализе главных компонент проведена стандартизация оценок признаков, использована вариационно-ковариационная матрица, длину собственного вектора приравнивали к корню квадратному из его собственного значения (Rohlf, 1993).
Гистологические препараты половых желёз изготавливали по стандартным методикам (Ромейс, 1953) с использованием полуавтоматического гистологического оборудования (“Medite”, Германия): гистопроцессор TPC-15, заливочная станция TES-99, микротом Meditome M530. Срезы гонад толщиной 3–5 мкм последовательно окрашивали гематоксилином Эрлиха и эозином. Фотографии срезов половых желёз сделаны с применением микроскопа Keyence Biorevo BZ-9000 (“Keyence”, Япония). Степень развития ооцитов гонад II стадии зрелости оценивали по ядерно-цитоплазматическому отношению, рассчитанному как отношение площади ядра к площади цитоплазмы клетки на срезе, прошедшем вблизи её центральной части. Меньшее значение этого отношения соответствует более интенсивному росту клетки (Павлов и др., 2014; Груздева и др., 2017). Измерения величины годовых приростов отолитов и определение ядерно-цитоплазматического отношения проводили с использованием программного обеспечения Image J ver. 1.50i. Статистическую обработку материала выполняли по индивидуальным и обобщённым показателям, совокупность значений в выборках соответствует нормальному распределению (p > 0.05, критерий Колмогорова–Смирнова). Использовали однофакторный дисперсионный анализ и коэффициент корреляции Пирсона r.
РЕЗУЛЬТАТЫ
Фенетическое и экологическое разнообразие кунджи в бассейне р. Коль
На основании изучения размерного, возрастного и полового состава, оценки численности и анализа сезонного распределения рыб в речной системе и устьевой зоне реки установлено, что популяция кунджи имеет неравномерное мозаичное распределение, сложную структуру и состоит из недифференцированной молоди и внутрипопуляционных группировок рыб, различающихся типом жизненной стратегии и биологическими параметрами (табл. 1, рис. 1). Пресноводная компонента популяции кунджи р. Коль представлена разновозрастной речной молодью с ювенильным типом окраски (пестрятками) и мигрирующей в море покатной молодью на разных этапах серебрения (смолтами). В речном бассейне обнаружены особи, достигающие половой зрелости в реке – карликовые самцы и речные реодромные самцы и самки.
Таблица 1.
Важнейшие биологические особенности внутрипопуляционных группировок кунджи Salvelinus leucomaenis р. Коль (по: Кузищин и др., 2022; с дополнениями)
| Параметр | Группировка | ||||
|---|---|---|---|---|---|
| пестрятки | смолты | карликовые самцы | речные реодромные | анадромные | |
| Локализация в речной системе | Подавляющее большинство в небольших притоках. В основном русле редки | Смолтификация в притоках. Покатная миграция в конце июня–начале июля. Русло реки – транзитная зона | Только в небольших притоках | В летнее время на больших глубоких плёсах в основном русле реки. Нерест в притоках. После нереста скат в основное русло | В устьевой зоне реки. Анадромная миграция в августе. Нерест в притоках в сентябре. Зимовка в основном русле |
| Биотоп | Плёсы и подперекатные ямки, придонный слой воды или участки с противотечениями. Предпочитают дно, сложенное галькой и валунами | В притоках перед выходом в основное русло –плёсы. В реке – скат вдоль пологих берегов, обособлены от покатников других видов | Наиболее глубокие участки плёсов, под подмытыми берегами, с укрытиями “крыша над головой” | Только среди завалов и заломов древесного материала, с укрытиями «крыша над головой». Ведут одиночный и скрытный образ жизни | Придонные слои воды в морском прибрежье устья реки. Во время хода из моря двигаются по самым глубоким участкам, также в придонном слое воды |
| Относительная численность | В притоках – до 30% по отношению к молоди других видов. В основном русле <0.1% | Невысокая, в среднем из притока скатывается ~500 экз. | Невысокая. Плотность: 1 экз/150–180 м русла притока | Невысокая. На плёсе при одном завале одна, редко две особи | Составляет большинство репродуктивной части популяции |
| Особенности питания | Потребляют крупный корм. Хищники с первого лета жизни (5% рациона), с возраста 1+ доля рыбной пищи ~30% | Во время покатной миграции >90% рациона – рыбная пища (покатная молодь лососёвых рыб) | Хищники, >70% рациона – сеголетки и пестрятки мальмы и кижуча | Хищники, >85% рациона – сеголетки и пестрятки лососёвых рыб. Реже – крупные ручейники и икра тихоокеанских лососей | Хищники, до 90% рациона – молодь камбал, рогатковых, наваги, колюшки. Реже – морские мизиды |
| Плодовитость самок | ~800 (350–1250) | ~2230 (1470–3250) | |||
Примечание. Здесь и в табл. 2, 5, 7: перед скобками – среднее значение, в скобках – пределы варьирования показателя.
Расположение нерестилищ в речной системе. Размножение
Нерестилища кунджи обнаружены только в небольших притоках (горных и тундровых) или в верхней части крупных притоков, где ширина русла ручьёв 0.8–1.5 м, средняя площадь поперечного сечения 0.98–1.77 м2, расход воды в створе 0.07–0.09 м3/с, средняя скорость течения 25–28 см/с, максимальная скорость – 35–41 см/с (усреднённые данные по 22 нерестовым участкам четырёх притоков). Воспроизводство локальной популяции кунджи осуществляется преимущественно за счёт анадромных самок (табл. 1), некоторая роль принадлежит самкам с речной реодромной жизненной стратегией, однако их доля не превышает 5% всех самок. В то же время в популяции наблюдается высокий уровень разнообразия самцов (рис. 1). Анадромные и речные реодромные особи (самцы и самки) и карликовые самцы размножаются совместно. На нерестилищах в период нереста они образуют смешанные группы производителей – икру одной самки могут осеменять несколько самцов. По данным наблюдений >60 случаев нереста, на одну анадромную самку приходится один анадромный, один речной реодромный и один, редко два, карликовых самца; на одну реодромную самку – один речной реодромный или один мелкий анадромный и один карликовый самец. По нашим наблюдениям, анадромные самцы принимают участие в нересте с одной самкой, тогда как речные реодромные и карликовые самцы могут принимать участие в нересте с несколькими самками (по: Кузищин и др., 2022; с дополнениями).
Распределение и биологические особенности группировок кунджи в бассейне р. Коль
По данным обловов разных участков речной системы, неполовозрелая молодь (пестрятки) встречается в подавляющем большинстве в притоках (табл. 1, 2). Наибольшие плотности молоди кунджи приурочены к среднему и верхнему течению притоков, где расположены нерестилища вида. В основном русле реки молодь кунджи редка, и только на удалении > 50 км от устья её доля увеличивается и в ряде мест может достигать > 11%. Карликовые самцы кунджи в бассейне р. Коль вне нерестовых притоков не обнаружены. Они немногочисленны, ведут одиночный и скрытный образ жизни, выбирая укрытые биотопы. Речные реодромные особи кунджи обитают в основном русле реки и крайне редко – в крупных боковых протоках. На плёсах они строго приурочены к завалам и заломам, ведут одиночный и скрытный образ жизни. В целом численность речных реодромных особей невелика (рис. 1). Анадромные особи в период нагула приурочены к морской зоне вблизи речного устья. В р. Коль кунджа – хищник, переход на питание рыбной пищей происходит в возрасте сеголетка; у половозрелых особей (карликовых самцов, речных реодромных и анадромных) рыба является доминирующим компонентом питания (табл. 1). Таким образом, важнейшими участками речной системы, где проходят процессы воспроизводства и дифференциации кунджи в поколении, являются небольшие притоки горного и тундрового типов.
Таблица 2.
Относительная численность, распределение и возрастной состав пресноводной части популяции кунджи Salvelinus leucomaenis в бассейне р. Коль (первая половина сентября, среднемноголетние показатели за 2003–2008 гг.)
| Участок речной системы | Расстояние от устья, км | Доля молоди кунджи, % | Возрастной состав (пестрятки/карликовые самцы, %) | Доля карликовых самцов, % | ||||
|---|---|---|---|---|---|---|---|---|
| 0+ | 1+ | 2+ | 3+ | 4+ | ||||
| Основное русло | 3 | 0 | –/– | –/– | –/– | –/– | –/– | 0 |
| То же | 13 | 0.6 (0.5–0.8) | –/– | 100/– | –/– | –/– | –/– | 0 |
| Боковая протока | 14 | 0.8 (0.6–1.0) | –/– | 100/– | –/– | –/– | –/– | 0 |
| Основное русло | 16 | 1.1 (0.8–1.3) | –/– | 93.2/– | 6.8/– | –/– | –/– | 0 |
| То же | 20 | 1.3 (0.9–1.6) | –/– | 92.4/– | 7.6/– | –/– | –/– | 0 |
| Боковая протока | 21 | 2.8 (2.4–3.3) | 1.1/– | 93.4/– | 5.5/– | –/– | –/– | 0 |
| Основное русло | 44* | 9.2 (8.3–10.6) | 28.4/– | 62.9/– | 8.7/– | –/– | –/– | 0 |
| Боковая протока | ~44 | 8.7 (8.2–9.5) | 1.8/– | 91.3/– | 6.9/– | –/– | –/– | 0 |
| То же | 50 | 3.5 (2.8–5.6) | 1.2/– | 87.3/– | 11.5/– | –/– | –/– | 0 |
| » | ~52 | 4.4 (3.6–5.8) | 2.8/– | 86.8/– | 8.8/– | 1.6/– | –/– | 0 |
| » | 69 | 5.4 (4.9–6.7) | 5.3/– | 82.3/– | 10.2/– | 2.2/– | –/– | 0 |
| » | 76 | 6.8 (5.8–8.4) | 5.5/– | 79.1/– | 10.2/– | 5.2/– | –/– | 0 |
| » | 90* | 11.4 (10.3–12.5) | 44.3/– | 33.7/– | 13.2/– | 8.8/– | –/– | 0 |
| » | 91 | 9.4 (9.1–9.7) | 8.6/– | 71.5/– | 16.8/– | 3.1/– | –/– | 0 |
| Притоки: | ||||||||
| Р. Нилкинка | 15** | 28.8 (20.3–33.4) | 63.8/– | 18.3/– | 9.5/– | 5.7/23.5 | 2.7/76.5 | 8.7 |
| Р. Красная | 2 | 14.3 (11.3–16.7) | 77.3/– | 12.4/– | 8.3/– | 2.0/– | –/– | 0 |
| То же | 21** | 36.9 (31.2–43.4) | 58.2/– | 20.7/– | 9.8/– | 7.9/24.3 | 3.4/75.7 | 9.8 |
| Руч. Глинистый | 3 | 24.6 (22.3–26.3) | 64.3/– | 22.3/– | 10.6/– | 2.8/– | –/– | 0 |
| То же | 6** | 38.8 (35.3–40.7) | 59.4/– | 18.2/– | 10.8/– | 9.1/11.5 | 2.5/88.5 | 6.8 |
| Руч. Сквичик | 3 | 23.4 (19.2–25.7) | 63.2/– | 23.3/– | 11.1/– | 2.4/– | –/– | 0 |
| То же | 8** | 33.5 (31.2–36.5) | 57.2/– | 18.8/– | 10.8/– | 9.4/19.4 | 3.8/80.6 | 9.5 |
| Руч. Симовый | 3 | 35.7 (33.2–38.7) | 62.2/– | 22.4/– | 11.7/– | 3.7/– | –/– | 0 |
| То же | 6** | 36.5 (33.3–39.1) | 55.5/– | 20.8/– | 10.7/– | 8.8/26.5 | 4.2/73.5 | 10.2 |
| Руч. Увальный | 1 | 37.2 (35.6–38.8) | 60.3/– | 21.2/– | 12.1/– | 6.4/– | –/– | 0 |
| Руч. Цепкий | 1 | 30.2 (27.6–32.8) | 62.3/– | 20.2/– | 13.4/– | 4.1/– | –/– | 0 |
Перераспределение и миграции в речной системе
По результатам анализа покатной миграции, смолтификация кунджи происходит в притоках (р. Красная, ручьи Глинистый, Сквичик, Симовый; два года наблюдений), откуда смолты скатываются в основное русло и далее – в море. В основное русло реки покатная молодь выходит на разных стадиях серебрения, преимущественно на стадии “серебристой пестрятки” (по: Кузищин и др., 2002; Pavlov et al., 2005). Скат смолтов кунджи из притоков проходит позже остальных видов – с 24–28 июня при прогреве воды более 12°С – и продолжается до конца первой недели июля. Период ската у кунджи короче, чем у остальных видов лососёвых рыб, – 7–10 сут (данные по четырём притокам, два года наблюдений по одному притоку, четыре года наблюдений).
Помимо ската смолтов из нерестовых притоков уходит несмолтифицированная молодь, преимущественно сеголетки. Выход сеголеток из нерестового притока приурочен к осеннему паводку, который в бассейне р. Коль происходит в первой половине сентября. По данным обловов, после завершения осеннего паводка в основном русле ниже устья притоков появляются сеголетки кунджи, которые отсутствовали на этих участках до паводка (табл. 3). По-видимому, выход сеголеток кунджи из притоков ассоциирован с осенними паводками – в годы с сильными дождями и высоким подъёмом уровня воды в притоке количество сеголеток на контрольных участках ниже устья притока больше, чем в годы со слабым осенним паводком (у = = −83.24 + 0.3044х, R2 = 0.72 ± 0.042, р < 0.01).
Таблица 3.
Плотность (среднее значение и его ошибка) сеголеток кунджи Salvelinus leucomaenis в нерестовом притоке и сопредельных участках основного русла р. Коль до (15–25 августа) и после (15–20 сентября) осеннего паводка, экз/м2, усреднённые данные за 4 года
| Период | Р. Коль вниз по течению |
Нерестовый приток | |||||
|---|---|---|---|---|---|---|---|
| устье | вверх по течению | ||||||
| Удаление от устья притока, км | |||||||
| 0.5 | 0–0.2 | 1 | 3 | 5 | 7 | 9 | |
| Ручей Глинистый | |||||||
| 15–20.08 | 0 | 0.55 ± 0.02 | 0.76 ± 0.05 | 1.01 ± 0.04 | 3.65 ± 0.10 | 1.36 ± 0.08 | 0 |
| 15–20.09 | 0.36 ± 0.02 | 0.72 ± 0.08 | 1.33 ± 0.05 | 1.79 ± 0.08 | 2.88 ± 0.11 | 1.04 ± 0.09 | 0 |
| Река Красная | |||||||
| 20–25.08 | 0 | 0.21 ± 0.04 | 0.36 ± 0.04 | 0.79 ± 0.06 | 2.02 ± 0.09 | 2.29 ± 0.08 | 3.04 ± 0.1 |
| 15–20.08 | 0.31 ± 0.02 | 0.69 ± 0.07 | 0.82 ± 0.09 | 1.02 ± 0.09 | 2.75 ± 0.11 | 2.83 ± 0.10 | 2.89 ± 0.1 |
| Ручей Симовый | |||||||
| 20–25.08 | 0 | 0.79 ± 0.05 | 0.88 ± 0.06 | 1.95 ± 0.06 | 2.33 ± 0.09 | 3.97 ± 0.11 | 0 |
| 17–20.09 | 0.76 ± 0.03 | 1.10 ± 0.07 | 1.37 ± 0.08 | 2.02 ± 0.08 | 2.45 ± 0.10 | 3.61 ± 0.12 | 0 |
Длина тела сеголеток, скатившихся из притока в основное русло, достоверно больше, чем у особей, оставшихся в притоке (табл. 4). Распределение наблюдённых значений длины у сеголеток, оставшихся в притоке, асимметрично и смещено влево (коэффициент асимметрии отрицательный), тогда как у сеголеток, выловленных в основном русле ниже устья притока, распределение также асимметрично, однако смещено в сторону бóльших значений – коэффициент асимметрии имеет положительное значение и превышает пороговый уровень. Это указывает на то, что из притоков в русло реки выходят наиболее крупные особи-сеголетки кунджи в поколении.
Таблица 4.
Длина тела (FL, мм) сеголеток кунджи Salvelinus leucomaenis в притоках и основном русле р. Коль на участке ниже их устья в сентябре
| Приток (участок основного русла реки ниже впадения притока), расстояние от его устья, м | Приток | Русло | Оценки различий | |
|---|---|---|---|---|
| tst | U-тест | |||
| Р. Красная, 550 | $\frac{{83.3 \pm 1.88{\text{ }}(61{\kern 1pt} --{\kern 1pt} 98)}}{{ - 0.402{\kern 1pt} *[115]}}$ | $\frac{{99.2 \pm 2.14\,\,(93{\kern 1pt} --{\kern 1pt} 105)}}{{0.593{\kern 1pt} *[83]}}$ | 5.43 | 0.0012 |
| Руч. Глинистый, 200 | $\frac{{82.7 \pm 1.94\,\,(60{\kern 1pt} --{\kern 1pt} 98)}}{{ - 0.422\,\,[85]}}$ | $\frac{{101.1 \pm 2.20\,\,(93{\kern 1pt} --{\kern 1pt} 108)}}{{0.605{\kern 1pt} *[77]}}$ | 6.27 | 0.0010 |
| Руч. Сквичик, 150 | 81.8 ± 1.88 (61–96) −0.357* [181] |
$\frac{{103.4 \pm 2.31\,\,(93{\kern 1pt} --{\kern 1pt} 108)}}{{0.515{\kern 1pt} *[82]}}$ | 7.02 | 0.0010 |
| Руч. Симовый, 450 | $\frac{{82.5 \pm 1.74\,\,(62{\kern 1pt} --{\kern 1pt} 97)}}{{ - 0.315{\kern 1pt} *[344]}}$ | $\frac{{102.9 \pm 2.43\,\,\left( {94{\kern 1pt} --{\kern 1pt} 109} \right)}}{{0.533{\kern 1pt} *{\kern 1pt} *[136]}}$ | 6.41 | 0.0010 |
| Руч. Увальный, 250 | $\frac{{81.7 \pm 1.89\,\,(60{\kern 1pt} --{\kern 1pt} 96)}}{{ - 0.421\,\,[85]}}$ | $\frac{{100.3 \pm 2.25\,\,(94{\kern 1pt} --{\kern 1pt} 106)}}{{0.588*[54]}}$ | 6.32 | 0.0011 |
Примечание. Над чертой – среднее значение показателя и его ошибка, в скобках – пределы варьирования; под чертой – коэффициент асимметрии (значим при: * p < 0.05; ** p < 0.01), в квадратных скобках – число рыб, экз; tst – значение критерия Стьюдента (для всех значений: p < 0.01), U-тест– критерий Манна–Уитни (отличия достоверны во всех случаях).
Перераспределение речных реодромных рыб в реке связано с нерестом: половозрелые особи в начале сентября заходят в притоки, а после нереста, уже в середине месяца, скатываются обратно в основное русло и занимают новые русловые биотопы. Таким образом, речная реодромная кунджа в бассейне р. Коль является типичным русловым хищником, приуроченным к просторным (широким и глубоким) участкам реки.
Анадромная миграция кунджи из моря в сторону нерестовых притоков проходит в августе. При движении вверх по реке анадромные и речные реодромные особи могут образовывать совместные группы. В нерестовый приток анадромные и речные реодромные особи заходят одновременно.
Возрастной, размерный и весовой состав кунджи из р. Коль
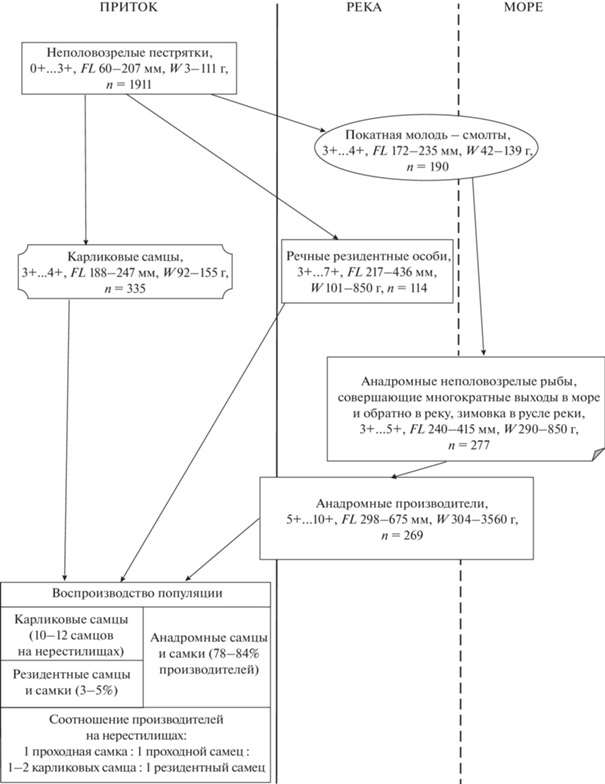
Возрастной состав и возраст полового созревания самцов и самок кунджи с разными типами жизненной стратегии различен (рис. 2). Карликовые самцы в поколении кунджи созревают первыми. В притоках они представлены особями двух возрастных классов, 3+ и 4+, чаще созревание карликовых самцов происходит в пятилетнем возрасте (табл. 2). Речные реодромные и анадромные самцы становятся половозрелыми начиная с шестилетнего возраста (5+). Среди речных реодромных самцов эта возрастная группа составляет бо́льшую часть, у анадромных самцов модальным возрастным классом являются рыбы в возрасте 6+. Самки речной реодромной и анадромной кунджи также впервые созревают в возрасте 5+. Наибольшую долю среди речных реодромных самок составляют особи в возрасте 6+, среди анадромных самок – рыбы в возрасте 7+. Анадромные самцы и самки достигают половой зрелости после двух выходов в море. Продолжительность жизни речных реодромных самцов, как правило, не превышает семи лет и единично (n = 5, 2003–2008 гг.) обнаружены восьмилетние особи. Анадромные самцы и самки доживают до одиннадцатилетнего возраста.
Рис. 2.
Возрастной состав производителей кунджи Salvelinus leucomaenis р. Коль: а – самцы, б – самки, (◼) – карликовые самцы (351 экз.), ( ) – речные реодромные особи (соответственно 64 и 31 экз.), (◻) – анадромные рыбы (104
и 112 экз.).
) – речные реодромные особи (соответственно 64 и 31 экз.), (◻) – анадромные рыбы (104
и 112 экз.).
Пестрятки кунджи разного пола одного возраста имеют сходные длину и массу тела, достоверных различий между самцами и самками не выявлено во всех возрастных классах (табл. 5). Длина и масса тела смолтов достоверно (p < 0.001) больше, чем у неполовозрелой молоди (возрастной класс 3+ – tst = 4.33 и 5.02). Карликовые самцы имеют достоверно (р < 0.001) бóльшую по сравнению со смолтами и пестрятками длину (3+ – tst = 4.87 и 6.02) и массу (3+ – tst = 5.21 и 6.12) тела. Речные реодромные особи в одновозрастных классах имеют достоверно бо́льшие длину и массу тела по сравнению с пестрятками, смолтами и карликовыми самцами. Половозрелые анадромные рыбы в одновозрастных классах по длине и массе тела существенно больше речных реодромных особей, в некоторых случаях пределы варьирования признаков даже не перекрываются.
Таблица 5.
Длина и масса тела молоди, карликовых самцов, речных реодромных и анадромных рыб в популяции кунджи Salvelinus leucomaenis бассейна р. Коль
| Пол, возраст, лет | Число рыб, экз | Длина (FL), мм | Масса, г |
|---|---|---|---|
| Пестрятки из притоков (август–сентябрь) | |||
| Самцы, 0+ | 582 | 81.6 (60–98) | 7.9 (2.8–14.6) |
| Самки, 0+ | 577 | 82.3 (61–97) | 7.9 (2.8–14.2) |
| Самцы, 1+ | 202 | 102.8 (81–133) | 15.8 (5.6–31.2) |
| Самки, 1+ | 216 | 101.7 (80–123) | 14.1 (5.0–21.4) |
| Самцы, 2+ | 118 | 136.1 (100–170) | 35.6 (11.3–80.1) |
| Самки, 2+ | 124 | 133.2 (98–164) | 30.2 (9.9–70.2) |
| Самцы, 3+ | 58 | 171.8 (118–207) | 63.1 (26.1–111.3) |
| Самки, 3+ | 34 | 172.3 (116–202) | 63.3 (21.4–100.4) |
| Смолты – покатные особи из притоков (июль) | |||
| Самцы, 3+ | 39 | 185.5 (172–195) | 64.8 (41.6–82.9) |
| Самки, 3+ | 71 | 186.8 (174–197) | 65.6 (44.3–93.6) |
| Самцы, 4+ | 14 | 218.5 (196–235) | 115.7 (80.0–134.2) |
| Самки, 4+ | 66 | 222.4 (200–235) | 119.3 (94.5–139.0) |
| Карликовые самцы из притоков (сентябрь) | |||
| 3+ | 179 | 198.5 (188–217) | 103.6 (92–131) |
| 4+ | 156 | 232.8 (223–247) | 134.5 (105–155) |
| Речные реодромные рыбы в летнюю межень (август) и в период нереста (начало сентября) | |||
| Самцы, 3+* | 18 | 237.3 (217–304) | 162.8 (101–317) |
| Самки, 3+* | 5 | 233.4 (220–279) | 150.2 (107–280) |
| Самцы, 4+* | 26 | 272.6 (237–321) | 225.8 (164–340) |
| Самки, 4+* | 12 | 279.7 (242–310) | 230.1 (170–324) |
| Самцы, 5+ | 18 | 285.4 (257–374) | 260.5 (250–500) |
| Самцы, 6+ | 24 | 322.3 (285–400) | 353.8 (284–704) |
| Самки, 6+ | 4 | 331.4 (302–394) | 394.4 (300–700) |
| Самцы, 7+ | 5 | 396.2 (380–425) | 605.2 (455–803) |
| Самки, 7+ | 2 | 422.0 (408–436) | 678.0 (506–850) |
| Анадромные особи** в нерестовый период (начало сентября) | |||
| Самцы, 5+ | 29 | 371.1 (298–486) | 493.7 (304–1050) |
| Самки, 5+ | 36 | 388.2 (311–475) | 523.3 (330–930) |
| Самцы, 6+ | 22 | 444.7 (386–581) | 797.8 (445–1550) |
| Самки, 6+ | 26 | 487.5 (422–590) | 1051.8 (692–2000) |
| Самцы, 7+ | 29 | 523.7 (448–550) | 1447.9 (955–1800) |
| Самки, 7+ | 44 | 521.5 (430–564) | 1458.8 (933–2200) |
| Самцы, 8+ | 18 | 564.8 (545–603) | 1880.6 (1450–2150) |
| Самки, 8+ | 31 | 563.2 (521–626) | 1969.2 (1388–2813) |
| Самцы, 9+ | 8 | 593.6 (531–656) | 2243.6 (1350–2955) |
| Самки, 9+ | 21 | 610.1 (570–650) | 2441.0 (1700–3010) |
| Самцы, 10+ | 1 | 688.0 | 3850.0 |
| Самки, 10+ | 4 | 651.3 (625–675) | 3213.1 (1825–3560) |
Рост
Самцы и самки пестряток и смолтов одного возраста сходны по расчисленным длинам тела в возрасте 1+ и 2+ (табл. 6). По сравнению с пестрятками для смолтов того же возраста в год, предшествующий скату (оценка по возрастному классу 2+), характерны достоверно бóльшие значения вычисленной длины тела (tst = 3.54 для самцов и tst = 3.33 для самок, p < 0.01). Расчисленные длины тела l1 карликовых самцов ещё больше, чем у пестряток и смолтов (tst = 1.98 и 1.99, p < 0.05). Для речных реодромных особей характерен наиболее высокий рост начиная уже с первого лета жизни – расчисленная длина тела у них наибольшая (tst = = 3.56 и 3.63 соответственно при сравнении с пестрятками и смолтами, p < 0.01). В дальнейшем для речных реодромных рыб характерен самый высокий темп роста внутри речной компоненты.
Таблица 6.
Расчисленные длины тела (FL) у молоди, карликовых самцов и речной реодромной кунджи Salvelinus leucomaenis р. Коль
| Пол, возраст, лет | Число рыб, экз. |
Расчисленная длина, мм | |||
|---|---|---|---|---|---|
| l1 | l2 | l3 | l4 | ||
| Пестрятки | |||||
| Самцы, 1+ | 125 | $\frac{{89.3 \pm 2.21}}{{71.2{\kern 1pt} --{\kern 1pt} 98.4}}$ | |||
| Самки, 1+ | 125 | $\frac{{91.3 \pm 3.57}}{{78.8{\kern 1pt} --{\kern 1pt} 100.1}}$ | |||
| Самцы, 2+ | 42 | $\frac{{91.4 \pm 2.30}}{{72.6{\kern 1pt} --{\kern 1pt} 100.2}}$ | $\frac{{121.5 \pm 3.39}}{{105.3{\kern 1pt} --{\kern 1pt} 131.1}}$ | ||
| Самки, 2+ | 31 | $\frac{{90.8 \pm 2.88}}{{70.3{\kern 1pt} --{\kern 1pt} 101.2}}$ | $\frac{{122.3 \pm 3.81}}{{100.3{\kern 1pt} --{\kern 1pt} 132.5}}$ | ||
| Смолты | |||||
| Самцы, 3+ | 32 | $\frac{{88.8 \pm 3.03}}{{73.5{\kern 1pt} --{\kern 1pt} 100.1}}$ | $\frac{{138.7 \pm 3.47}}{{117.2{\kern 1pt} --{\kern 1pt} 133.6}}$ | ||
| Самки, 3+ | 50 | $\frac{{86.5 \pm 2.77}}{{74.0{\kern 1pt} --{\kern 1pt} 101.6}}$ | $\frac{{139.8 \pm 3.61}}{{119.4{\kern 1pt} --{\kern 1pt} 135.4}}$ | ||
| Самцы, 4+ | 10 | $\frac{{87.4 \pm 2.21}}{{72.8{\kern 1pt} --{\kern 1pt} 100.1}}$ | $\frac{{123.2 \pm 2.56}}{{102.2{\kern 1pt} --{\kern 1pt} 132.1}}$ | $\frac{{178.5 \pm 4.08}}{{168.1{\kern 1pt} --{\kern 1pt} 187.7}}$ | $\frac{{202.3 \pm 4.11}}{{188.5{\kern 1pt} --{\kern 1pt} 211.2}}$ |
| Самки, 4+ | 44 | $\frac{{86.6 \pm 2.64}}{{73.7{\kern 1pt} --{\kern 1pt} 100.2}}$ | $\frac{{122.8 \pm 3.62}}{{100.5{\kern 1pt} --{\kern 1pt} 84.4}}$ | $\frac{{177.6 \pm 3.8}}{{168.2{\kern 1pt} --{\kern 1pt} 188.3}}$ | $\frac{{201.8 \pm 3.87}}{{196.1{\kern 1pt} --{\kern 1pt} 210.3}}$ |
| Карликовые самцы | |||||
| 3+ | 25 | $\frac{{96.3 \pm 2.15}}{{80.1{\kern 1pt} --{\kern 1pt} 103.6}}$ | $\frac{{141.9 \pm 3.13}}{{120.3{\kern 1pt} --{\kern 1pt} 179.5}}$ | $\frac{{191.5 \pm 3.38}}{{173.3{\kern 1pt} --{\kern 1pt} 205.4}}$ | |
| 4+ | 25 | $\frac{{95.4 \pm 2.27}}{{81.5{\kern 1pt} --{\kern 1pt} 104.2}}$ | $\frac{{138.6 \pm 3.47}}{{121.3{\kern 1pt} --{\kern 1pt} 181.2}}$ | $\frac{{187.1 \pm 4.05}}{{172.2{\kern 1pt} --{\kern 1pt} 206.4}}$ | $\frac{{219.2 \pm 4.35}}{{202.6{\kern 1pt} --{\kern 1pt} 234.7}}$ |
| Речные реодромные рыбы | |||||
| Самцы, 3+ | 9 | $\frac{{106.2 \pm 3.03}}{{96.3{\kern 1pt} --{\kern 1pt} 110.5}}$ | $\frac{{189.3 \pm 3.54}}{{172.2{\kern 1pt} --{\kern 1pt} 202.4}}$ | $\frac{{224.4 \pm 3.77}}{{204.5{\kern 1pt} --{\kern 1pt} 246.8}}$ | |
| Самки, 3+ | 4 | $\frac{{108.1 \pm 4.02}}{{94.1{\kern 1pt} --{\kern 1pt} 122.2}}$ | $\frac{{195.5 \pm 4.32}}{{170.5{\kern 1pt} --{\kern 1pt} 210.0}}$ | $\frac{{227.8 \pm 4.73}}{{205.4{\kern 1pt} --{\kern 1pt} 244.5}}$ | |
| Самцы, 4+ | 16 | $\frac{{108.6 \pm 4.55}}{{96.3{\kern 1pt} --{\kern 1pt} 120.4}}$ | $\frac{{197.3 \pm 6.22}}{{173.9{\kern 1pt} --{\kern 1pt} 209.6}}$ | $\frac{{225.2 \pm 7.17}}{{205.6{\kern 1pt} --{\kern 1pt} 245.4}}$ | $\frac{{259.4 \pm 8.02}}{{238.2{\kern 1pt} --{\kern 1pt} 289.6}}$ |
| Самки, 4+ | 8 | $\frac{{110.2 \pm 3.86}}{{95.7{\kern 1pt} --{\kern 1pt} 118.3}}$ | $\frac{{189.5 \pm 4.65}}{{172.3{\kern 1pt} --{\kern 1pt} 205.8}}$ | $\frac{{226.1 \pm 5.82}}{{203.4{\kern 1pt} --{\kern 1pt} 240.2}}$ | $\frac{{262.3 \pm 7.15}}{{233.4{\kern 1pt} --{\kern 1pt} 288.4}}$ |
| Самцы, 5+ | 14 | $\frac{{108.3 \pm 2.76}}{{95.5{\kern 1pt} --{\kern 1pt} 120.3}}$ | $\frac{{187.5 \pm 4.04}}{{173.4{\kern 1pt} --{\kern 1pt} 204.6}}$ | $\frac{{225.4 \pm 5.57}}{{202.6{\kern 1pt} --{\kern 1pt} 238.7}}$ | $\frac{{260.4 \pm 5.20}}{{234.4{\kern 1pt} --{\kern 1pt} 290.3}}$ |
| Самки, 5+ | 13 | $\frac{{107.4 \pm 2.82}}{{93.5{\kern 1pt} --{\kern 1pt} 119.5}}$ | $\frac{{188.1 \pm 3.87}}{{170.5{\kern 1pt} --{\kern 1pt} 207.3}}$ | $\frac{{226.8 \pm 4.19}}{{204.3{\kern 1pt} --{\kern 1pt} 238.1}}$ | $\frac{{261.3 \pm 5.10}}{{234.3{\kern 1pt} --{\kern 1pt} 293.3}}$ |
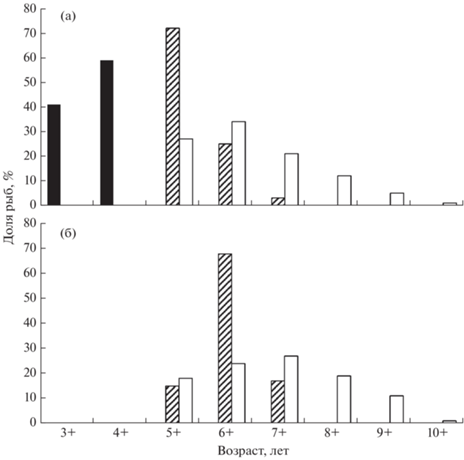
Таким образом, в поколении кунджи наблюдаются значительные различия в темпе роста (рис. 3). Речные реодромные рыбы (группа, которую мы в данной работе условно называем самыми быстро растущими особями в поколении) после ската из нерестового притока в конце первого лета жизни существенно опережают по приростам длины тела всех рыб, оставшихся в притоках. Среди рыб, оставшихся в притоке, спустя два года после первой дифференциации и ухода части сеголеток в русло реки, с третьего лета жизни (возраст 2+) вновь происходит расхождение по темпу роста. В этом возрасте формируются три группы рыб. Первую образуют особи-самцы с умеренно высоким темпом роста, которые на следующий год, в возрасте 3+, достигают половой зрелости в притоке и становятся карликовыми самцами. Вторую группу формируют смолты, у которых, как и у карликовых самцов, наблюдается ускорение темпа роста в год, предшествующий скату, – умеренно растущие особи (рис. 4). Третью группу представляют неполовозрелые пестрятки с самым низким темпом роста – медленно растущие особи. Их окончательная дифференциация на карликовых самцов и смолтов произойдёт на следующий год, в возрасте 4+.
Рис. 3.
Рост рыб внутрипопуляционных группировок кунджи Salvelinus leucomaenis из бассейна р. Коль по расчисленным значениям (данные для руч. Симовый): 1 – речные реодромные особи (△), n = 26; 2 – карликовые самцы (◼), n = = 23; 3 – смолты (⚫), n = 22; 4 – пестрятки (○), n = 86.
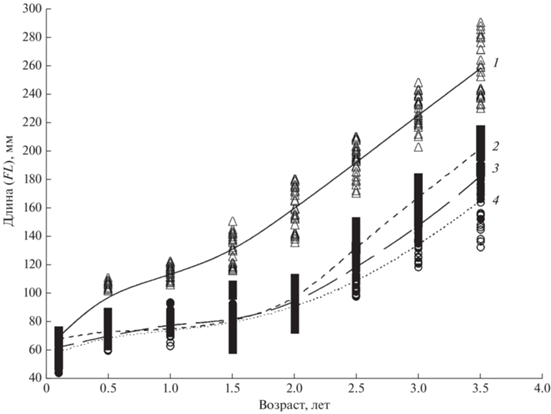
Рис. 4.
Фенетические отношения внутрипопуляционных группировок кунджи Salvelinus leucomaenis р. Коль, оценённые методом главных компонент по совокупности 11 признаков, характеризующих рост (длина и масса тела, радиус отолита, ширина 1-й, 2-й, 3-й годовых зон и зоны прироста текущего года, расчисленная длина тела в возрасте 1, 2, 3 года и в текущий год), возраст 3+: (◻) – пестрятки, (⚫) – смолты, (△) – карликовые самцы, (◼) – речные реодромные особи.
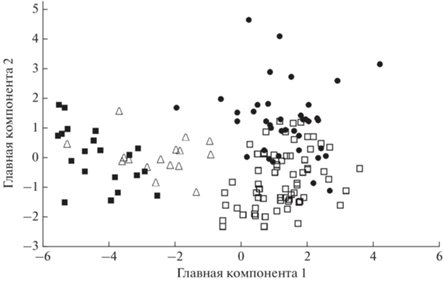
Оценка параметров роста пестряток, смолтов, карликовых самцов и резидентных особей кунджи р. Коль с использованием метода главных компонент показала наличие выраженной групповой изменчивости (рис. 4). Факторные области, соответствующие пестряткам и смолтам, в значительной степени перекрываются. Наиболее обособленное положение занимают факторные области речных реодромных рыб и карликовых самцов, вплоть до появления дискретности от первых двух группировок. Положение речных резидентных рыб и карликовых самцов отражает их более высокий, по сравнению с неполовозрелыми рыбами, темп роста, который проявляется с самого раннего возраста.
Особенности гаметогенеза
Все самки-пестрятки в возрасте 1+…3+ имели гонады II стадии зрелости, половые клетки представлены ооцитами периода превителлогенеза, для которых характерны крупное ядро и цитоплазма, имеющая гомогенную структуру (рис. 5а). По периферии ядер клеток на срезах видны 1–10 (в среднем 5) ядрышек на срез. Диаметр превителлогенных ооцитов в гонадах пестряток зависит (однофакторный дисперсионный анализ, p < 0.001) от их возраста (табл. 7). Размеры ооцитов периода превителлогенеза коррелируют (корреляция r-Пирсона) с длиной (r = 0.72 при p < 0.001) и массой (r = 0.80 при p < 0.001) пестряток и их расчисленной длиной (l1) в первый год жизни (r = 0.34 при p < 0.05).
Рис. 5.
Строение половых желёз кунджи Salvelinus leucomaenis р. Коль: а–г: самки: а – пестрятка 2+, июль, ооциты периода превителлогенеза; б – речная реодромная особь 6+, июнь, начало вакуолизации цитоплазмы ооцитов; в – анадромная особь 8+, июль, накопление в ооцитах гранул желтка (→); г – анадромная особь 6+, сентябрь, яичник после нереста; д–з: самцы: д – пестрятка 1+, август; е – пестрятка 4+, август; ж, з – карликовый самец 3+, сентябрь. 1 – сперматогоний, 2 – сперматоциты 1-го порядка, 3 – сперматоциты 2-го порядка, 4 – сперматиды, 5 – сперматозоиды. Масштаб: а, б – 400; в, г – 1000; д–з – 100 мкм.
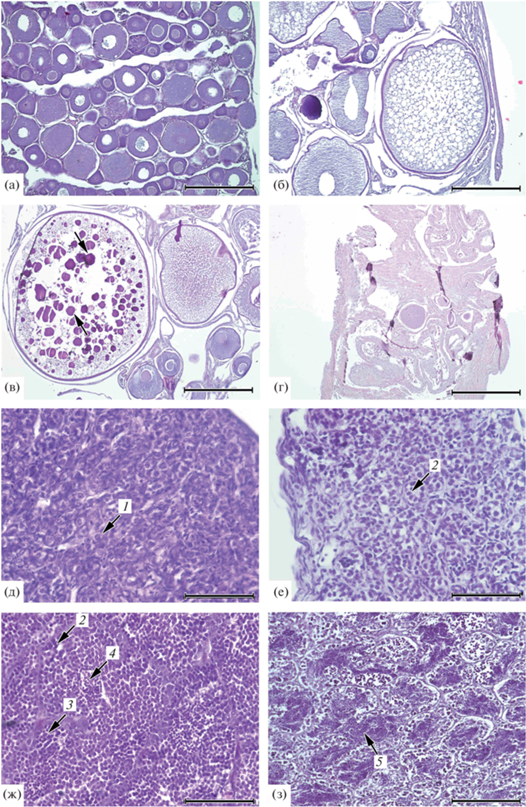
Таблица 7.
Диаметр ооцитов периода превителлогенеза у пестряток кунджи Salvelinus leucomaenis разного возраста
| Параметр | Возраст, лет | ||
|---|---|---|---|
| 1+ | 2+ | 3+ | |
| Диаметр ооцитов, мкм | 84.5 (69.1–103.4) | 121.3 (111.6–131.1) | 130.8 (120.2–140.2 |
| Число рыб, экз | 32 | 25 | 18 |
Гонады речных реодромных самок (возраст 6+) находились на III стадии зрелости, содержали превителлогенные ооциты диаметром 207 (86‒398) мкм и вителлогенные ооциты диаметром 657 (483‒792) мкм (рис. 5б). Степень вакуолизации ооцитов периода вителлогенеза высокая ‒ бóльшая часть цитоплазмы таких клеток целиком заполнена вакуолями.
Половые железы анадромных самок в возрасте 5+…10+ были на IV (n = 15), V (n = 9) и VI–II (n = 4) стадиях зрелости. Гонады IV стадии зрелости содержали немногочисленные превителлогенные ооциты диаметром 277 (198‒469) мкм, вакуолизированные ооциты вителлогенеза диаметром 1003 (607‒1248) мкм, а также крупные ооциты диаметром 1436 (1157‒1661) мкм с отдельными гранулами желтка размером ~10 мкм (рис. 5в). Оболочка ооцита с гранулами желтка состояла из сформированной лучистой оболочки, слоя фолликулярных клеток и двухслойной теки. Яичники V стадии зрелости имели крупные ооциты с гомогенным желтком. Одна анадромная самка к моменту поимки в сентябре уже отнерестилась, её гонады состояли преимущественно из соединительной ткани с единичными ооцитами ‒ VI стадия зрелости (рис. 5г).
Самцы-пестрятки кунджи в возрасте 1+ имели гонады II стадии зрелости, представленные сперматогониями, находящимися ещё в процессе митотического деления, сперматоциты 1-го порядка единичны (рис. 5д). В семенниках пестряток в возрасте 2+ и 3+ появляются сперматоциты I порядка, вступившие в профазу-I мейоза (II поздняя стадия зрелости гонад). Пестрятки в возрасте 4+, пойманные в июле, имели семенники III стадии зрелости, содержащие помимо сперматоцитов 1-го порядка (число которых увеличилось) клетки меньшего размера ‒ сперматоциты 2-го порядка (рис. 5е). Вполне вероятно, что такие особи могли созреть в сентябре и стать карликовыми самцами.
Карликовые самцы. У четырёх самцов в возрасте 3+ гонады находились на IV стадии зрелости, помимо сперматогониев в генеративной ткани появляются сперматоциты 1-го и 2-го порядков и сперматиды (рис. 5ж). Наличие в генеративной ткани сперматид свидетельствует о начале спермиогенеза. Для сперматид характерны ещё более мелкие размеры по сравнению со сперматоцитами II порядка, они интенсивнее воспринимают гематоксилиновый лак – темнее окрашены. Три особи того же возраста имели семенники IV стадии зрелости, содержащие семенные канальцы со сперматозоидами и немногочисленные клетки раннего состояния ‒ сперматоциты и сперматиды (рис. 5з). Сперматозоиды отличаются от других половых клеток самцов меньшими размерами, более продолговатой формой и наличием жгутика. Гонады самцов возраста 3+, пойманных в конце августа, находились на IV стадии зрелости, содержали сперматоциты, сперматиды и небольшое количество сперматозоидов. Однако у зрелых карликовых самцов не выявлены случаи, чтобы в ткани семенников были большие просветы семенных канальцев. Это указывает на то, что все карликовые самцы кунджи в бассейне р. Коль являются впервые созревающими рыбами.
Речные реодромные самцы. Гонады резидентных самцов в возрасте 3+ … 4+ находились на II (4 экз.), в возрасте 5+ – на III (4 экз.), в возрасте 6+ и старше – на IV (16 экз.) стадиях зрелости. Для семенников рыб в возрасте 6+ и старше характерны большие просветы семенных канальцев, не отмеченные у раносозревающих особей. Такое состояние семенников ‒ признак того, что для пойманных резидентных особей это уже не первый нерест. Семенники со II по III стадии зрелости не имели других заметных цитологических различий с гонадами раносозревающих самцов. Для строения половых желёз III поздней стадии зрелости у четырёх резидентных самцов кунджи было характерно более свободное расположение сперматозоидов в просветах семенных канальцев и их меньшее число.
Анадромные самцы. Семенники анадромной кунджи в возрасте 4+…5+ находились на III (5 экз., пойманные в июне‒июле), в возрасте 6+…9+ – на IV и V стадиях зрелости (6 экз., сентябрь). В семенниках анадромных рыб в возрасте более 7+ отмечены просветы семенных канальцев, что указывает на их повторный нерест.
ОБСУЖДЕНИЕ
Результаты нашего исследования показывают, что локальная популяция кунджи р. Коль представляет собой сложную систему, включающую в себя взаимосвязанные внутрипопуляционные группировки с разными типами жизненной стратегии и различной локализацией в речной системе. Эти группировки интегрированы за счёт совместного нереста и перекрёстного скрещивания в период размножения (Кузищин и др., 2022).
Процесс дифференциации в поколении у кунджи проходит в ранний период пресноводной фазы жизненного цикла. Он обусловлен сложными процессами индивидуального роста рыб в поколении, как это было установлено и для других видов лососёвых рыб (Gross, 1987; Hutchings, 1993, 1996; Thorpe, 1994; Klemetsen et al., 2003; Evolution …, 2004; Arai et al., 2005; Johnson et al., 2010; Груздева и др., 2013, 2017; Кузищин и др., 2020).
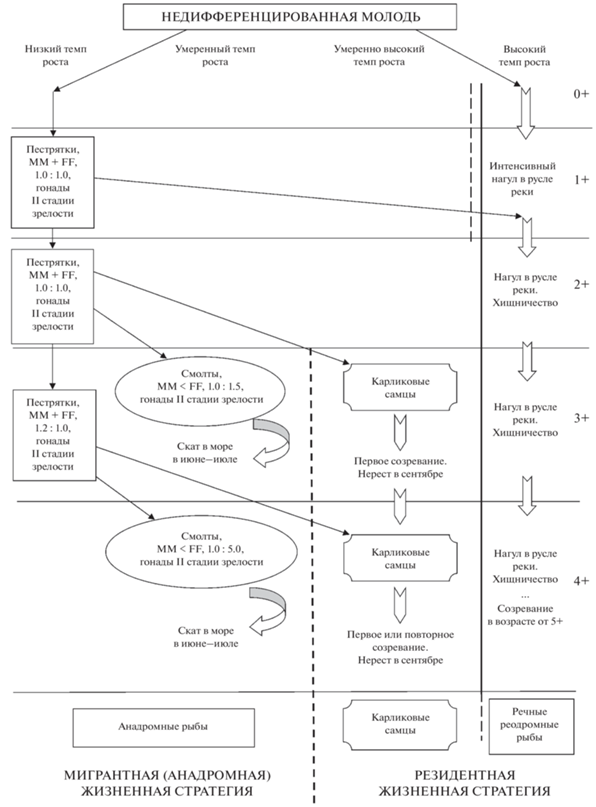
В бассейне р. Коль дифференциация кунджи в поколении проходит в нерестовых притоках в несколько этапов и растянута на 3–4 года. Первый этап процесса начинается уже в первое лето жизни и определяется различиями индивидуального роста молоди (рис. 6). К концу лета среди сеголеток наблюдается существенная разница по длине и массе тела – выделяется группа самых быстро растущих рыб (табл. 6; рис. 3, 6). В начале осени такие рыбы, самцы и самки, с гонадами II стадии зрелости совершают денатантную миграцию – покидают нерестовый приток, скатываясь в основное русло р. Коль. В последующие годы, обитая в основном русле реки, они сохраняют высокий темп роста и достигают половой зрелости к 6-му году жизни (возрастной класс 5+), что подтверждается данными анализа размерного состава и обратного расчисления темпа роста.
Рис. 6.
Схема дифференциации поколения кунджи Salvelinus leucomaenis р. Коль: ММ – самцы, FF – самки.
По нашим наблюдениям, выход сеголеток кунджи из нерестовых притоков приурочен ко времени осеннего паводка. Ранее для сеголеток лососёвых рыб было показано, что увеличение скорости потока приводит к увеличению интенсивности покатной миграции (Павлов и др., 2009, 2010, 2016). Также отмечалось, что паводки приводят к сносу более мелких или менее сформированных сеголеток, которые в меньшей степени способны противостоять сильному потоку (Павлов и др., 2010, 2016). В данном случае наблюдается обратная картина – расселительную миграцию и смену биотопа совершают наиболее крупные особи в поколении. В связи с этим весьма вероятно, что наиболее быстрорастущие особи стремятся отыскать и занять более просторные и глубокие участки речной системы, чем имеют небольшие нерестовые притоки. Известно, что в реках о-ва Хоккайдо более крупные особи в одновозрастных классах почти всегда выбирают более глубоководные биотопы (Nakano, 1995; Yagyu, 2009; Nakamura, 2011; Miyamoto, Araki, 2019). По-видимому, в бассейне р. Коль резкий подъём уровня воды в притоке во время осеннего паводка и увеличение скорости потока являются стимулом для активной смены биотопа и фактором, обеспечивающим расселительную миграцию быстро растущих сеголеток кунджи.
Важнейшей особенностью, влияющей на дифференциацию молоди в возрасте сеголетки и дальнейшее формирование резидентного типа жизненной стратегии, является хищный образ жизни кунджи. Как было показано ранее, из всех видов лососёвых рыб, обитающих в р. Коль, молодь кунджи имеет наиболее выраженную тенденцию к потреблению рыбной пищи, причём эта особенность проявляется уже в возрасте сеголетки (Кузищин и др., 2015, 2022). Предпочтение молодью кунджи добычи более крупного размера по сравнению с одноразмерной молодью других видов лососёвых рыб и питание рыбной пищей отмечено у кунджи и из южных участков ареала (Nakano et al., 1999; Morita, 2001; Miyasaka et al., 2003). Есть все основания полагать, что способность сеголеток кунджи потреблять широкий спектр кормов, включая добычу крупного размера, уже к концу первого лета жизни приводит к разнокачественности поколения по длине и массе тела.
Таким образом, наиболее быстрый рост части молоди к концу первого лета жизни и взаимосвязанный с ростом выход из нерестового притока лежат в основе механизма формирования речной реодромной жизненной стратегии у кунджи, что согласуется c данными для некоторых популяций кунджи из рек Японских о-вов (Morita, Morita, 2002; Arai et al., 2005). При этом темп развития и состояние половых желёз, по-видимому, не имеют определяющего значения на первом этапе дифференциации поколения, так как созревание этих рыб происходит много позже, начиная с возраста шести лет, и связано с достижением длины тела не менее 300 мм.
Выявленная закономерность хорошо согласуется с данными для других видов лососёвых рыб – факт формирования резидентного типа жизненной стратегии из наиболее быстрорастущих рыб в поколении ранее был показан на примере симы Камчатки и Японских о-вов (Arai et al., 2005; Груздева и др., 2013), северной мальмы (Груздева и др., 2017) и микижи (Кузищин и др., 2020).
Второй этап дифференциации в поколении начинает происходить в возрасте 2+ (рис. 3, 6). Уже к концу третьего лета жизни у пестряток в притоках наблюдается разнокачественность по длине и массе тела, которая на четвёртом году жизни (3+) приводит к формированию трёх групп особей. Первая группа – наиболее медленно растущая часть пестряток – остаётся в притоках и продолжает вести образ жизни, характерный для неполовозрелой молоди. Вторая группа – самцы, для которых характерен наиболее быстрый рост и у которых начинается активный сперматогенез, в результате к осени такие особи достигают полового созревания, становятся карликовыми самцами и могут принимать участие в нересте (рис. 6). Третья часть молоди – самцы и самки с характерным умеренно высоким темпом роста – претерпевают смолтификацию и в первой половине лета скатываются в море. При этом половые железы смолтов остаются без активного развития – все без исключения смолты в наших уловах имели семенники и яичники II стадии зрелости. Дальнейший гаметогенез начинается только после 1–3, чаще 2–3 лет интенсивного роста в море, при достижении рыбами крупных размеров и высокой плодовитости самок (Morita, Takashima, 1998; Morita, 2001; Morita, Morita, 2002). Полученные данные указывают на то, что высокий темп роста молоди в разном возрасте имеет разные последствия. Если в возрасте сеголетки быстрый рост приводит к активному выходу из нерестовых притоков в основное русло реки, то в более позднем возрасте – к созреванию части самцов в нерестовом притоке или смолтификации.
Третий, завершающий, этап дифференциации происходит в возрасте 4+ и сопровождается аналогичными процессами, как и на втором этапе (рис. 6). Однако в возрасте 4+ в нерестовых притоках уже не остаётся недифференцированной молоди – часть рыб, претерпев смолтификацию, скатывается в море, другая часть, а именно некоторые наиболее быстро растущие самцы, созревают и становятся карликовыми самцами. Тем самым процесс дифференциации в поколении у кунджи р. Коль завершается в возрасте пятилеток (возрастной класс 4+).
Обращает на себя внимание судьба карликовых самцов после их полового созревания и первого нереста в бассейне р. Коль. Для другого вида гольцов – северной мальмы – установлено, что после созревания в раннем возрасте и достижения стадии “карликовый самец” в дальнейшем они созревают повторно (Груздева и др., 2017). В случае кунджи анализ строения семенников созревших карликовых самцов показывает, что структур, указывающих на возможность их повторного созревания, нет. Тем самым, на сегодняшний день можно констатировать, что для карликовых самцов кунджи на севере ареала вида характерен однократный в жизни нерест. Так как в течение ряда лет нам ни разу не удалось установить факт выхода карликовых самцов кунджи из нерестового притока в русло реки, а весной и в первой половине лета зрелые карликовые самцы с признаками прошлогоднего нереста в притоках тоже не обнаружены, есть все основания полагать, что после нереста жизнь карликовых самцов заканчивается зимой в нерестовом притоке. Наши данные соответствуют результатам исследований в реках о-ва Хоккайдо: установлено, что по сравнению с проходными особями для карликовых самцов кунджи характерна весьма высокая посленерестовая смертность – >60% (Morita, Yokota, 2002).
В южной части ареала для карликовых самцов кунджи характерно повторное созревание и многократный (до трёх раз) нерест в течение жизни (Morita, Morita, 2002; Kikko et al., 2011; Futamura et al., 2022). Полученные данные по карликовым самцам кунджи в целом соответствуют результатам анализа жизненного цикла карликовых самцов симы: на юге ареала, в реках бассейна Японского моря, они могут созревать повторно (Utoh, 1976, 1977; Иванков и др., 1977, 1981; Kubo, 1980; Семенченко и др., 2003), тогда как на севере ареала, на Камчатке, карликовые самцы симы строго моноцикличны, их повторное созревание невозможно (Груздева и др., 2013).
По мнению ряда исследователей, для карликовых самцов кунджи характерна существенно более низкая, по сравнению с анадромными производителями, эффективность осеменения икры: считается, что нерестовая тактика “подкрадывания” (sneaking), успешно применяемая карликовыми самцами других лососёвых видов рыб (сима, мальма), в случае кунджи практически не реализуется (Maekawa et al., 2001; Hasegawa, Yamamoto, 2010; Futamura et al., 2022). Есть мнение, что в реках южной части ареала крупные проходные самцы имеют преимущество при спаривании с самками любого размера, тогда как карликовые самцы являются малозначимым дополняющим элементом структуры популяции (Maekawa et al., 2001; Morita, Morita, 2002; Hasegawa, Yamamoto, 2010; Futamura et al., 2022). Тем не менее созревание части особей-самцов даже карликовых, несмотря на их относительно низкий вклад в воспроизводство, рассматривается как важный элемент структуры популяции кунджи, позволяющий виду адаптироваться к резким изменениям условий существования (Morita et al., 2000; Morita, 2001; Morita, Morita, 2002).
Выявленные у кунджи р. Коль особенности формирования покатной молоди и карликовых самцов имеют черты сходства с популяциями из южной части ареала, на Японских о-вах. Так, в популяциях, состоящих из анадромных и резидентных особей, смолтификация происходит в возрасте 2+…4+, бóльшая часть смолтов скатывается в море в возрасте 3+, карликовые самцы могут созревать в более широком возрастном диапазоне – 1+…4+ (Yamamoto et al., 1996; Maekawa et al., 2001; Morita, Morita, 2002; Kikko et al., 2011). На севере ареала, в р. Коль, разделение поколения на смолтов и карликовых самцов происходит в одном и том же возрасте. Процессы дифференциации в поколении кунджи р. Коль, по сравнению с южными регионами, проходят на фоне замедленного темпа гаметогенеза – созревание небольшой части самцов, ведущих оседлый образ жизни, наступает только на 3–4-м году жизни.
Полученные данные показывают важнейшую роль небольших притоков реки для существования локальной популяции кунджи: именно в таких водоёмах происходят все этапы дифференциации в поколении и формирование разнообразия типов жизненной стратегии. Основное русло р. Коль играет роль либо транзитной зоны (для покатников-смолтов и двигающихся вверх–вниз половозрелых анадромных производителей), либо как место постоянного обитания для речных реодромных рыб. В свою очередь численность и встречаемость последних определяется наличием специфических биотопов, то есть геоморфологическим строением речной системы. Фактор строения речной системы (размер, глубина, соотношение плёсов и перекатов и другие параметры) рассматривается как критический для самого существования популяций кунджи во всём их разнообразии (Morita et al., 2000, 2019; Morita, Yokota, 2002; Hasegawa, Maekawa, 2008; Morita, Morita, 2002; Yamamoto et al., 2015; Miyamoto, Araki, 2019).
Полученные результаты показывают, что важнейшие этапы дифференциации в поколении и закономерности формирования разнообразия типов жизненной стратегии у разных видов лососёвых рыб (сима, мальма, микижа, кунджа) имеют выраженный видоспецифический характер (Груздева и др., 2013, 2017; Кузищин и др., 2020). В то же время имеются и некоторые общие черты. Так, речной реодромный тип жизненной стратегии у трёх из четырёх изученных видов лососёвых рыб (кунджа, мальма, микижа) формируется из наиболее быстро растущих рыб в самом раннем возрасте, что даёт основание сделать утверждение об универсальности этого механизма у полиморфных лососёвых рыб в экосистемах рек Камчатки. Однако дальнейшая дифференциация имеет выраженные видовые отличия. Так, для симы и мальмы дифференциация и бифуркация существенно различаются у самцов и самок и находятся под контролем взаимосвязанных процессов роста и гаметогенеза. Для микижи и кунджи первоочередное значение имеют процессы соматического роста, миграционной активности в раннем возрасте и, как следствие, внутриречное распределение. Важнейшее значение для дифференциации поколения у кунджи и микижи имеет геоморфология рек – для обоих видов доля речных реодромных рыб выше в сложных, разветвлённых предгорных реках (Павлов и др., 2008; Кузищин, 2010).
Имеющиеся данные по трём видам (р. Коль) – кундже, мальме и симе – дают основания утверждать, что в основе формирования разнообразия типов жизненной стратегии лежит адаптивная пластичность, обусловленная особенностями индивидуального роста рыб. Тем самым кунджа и другие виды лососёвых рыб на популяционном уровне организации обладают способностью последовательно формировать в поколении разнообразные экологические группировки, направленные на пространственную дифференциацию в речной системе и в море, выбор непересекающихся биотопов и снижение внутривидовой конкуренции (Jonsson et al., 1984; Roff, 1984; Hutchings, 1993; Mangel, 1996). Как результат, в популяции кунджи из поколения в поколение воспроизводится и реализуется динамичная система локальных адаптаций. Она направлена на снижение рисков для существования, обеспечивает популяционный фитнесс и эффективную подстройку в изменчивых условиях существования на севере ареала вида.
Список литературы
Гриценко О.Ф. 2002. Проходные рыбы острова Сахалин. М.: Изд-во ВНИРО, 248 с.
Груздева М.А., Малютина А.М., Кузищин К.В. и др. 2013. Закономерности формирования жизненной стратегии у симы Oncorhynchus masou реки Коль (западная Камчатка) в связи с процессами роста и полового созревания // Вопр. ихтиологии. Т. 53. № 5. С. 587–602. https://doi.org/10.7868/S0042875213050056
Груздева М.А., Кузищин К.В., Павлов Е.Д. и др. 2017. Морфофизиологические закономерности формирования жизненных стратегий мальмы Salvelinus malma Камчатки // Там же. Т. 57. № 5. С. 534–552. https://doi.org/10.7868/S0042875217050101
Гудков П.К. 1991. Материалы по биологии кунджи Salvelinus leucomaenis Охотского моря // Там же. Т. 31. № 6. С. 898–909.
Есин Е.В., Маркевич Г.Н. 2017. Гольцы рода Salvelinus Азиатской части Северной Пацифики: происхождение, эволюция и современное разнообразие. Петропавловск-Камчатский: Камчатпресс, 188 с.
Иванков В.Н., Падецкий С.Н., Чикина В.С. 1977. О посленерестовых неотенических самцах симы Oncorhynchus masu (Brevoort) // Вопр. ихтиологии. Т. 17. Вып. 4. С. 753–757.
Иванков В.Н., Падецкий С.Н., Флоряк В.С. и др. 1981. Неотенические самки симы Oncorhynchus masu (Brevoort) из реки Кривая (Южное Приморье) // Там же. Т. 21. Вып. 5. С. 938–942.
Кузищин К.В. 2010. Формирование и адаптивное значение внутривидового экологического разнообразия у лососёвых рыб (семейство Salmonidae): Автореферат дис. … докт. биол. наук. М.: МГУ, 49 с.
Кузищин К.В., Пустовит О.П., Павлов Д.С., Савваитова К.А. 2002. Морфобиологические особенности покатной молоди микижи Parasalmo mykiss из некоторых рек западной Камчатки в связи со смолтификацией // Вопр. ихтиологии. Т. 42. № 6. С. 751–762.
Кузищин К.В., Груздева М.А., Савваитова К.А., Павлов Д.С. 2010. Сезонные расы кеты Oncorhynchus keta (Walb.) и их взаимоотношения в реках Камчатки // Там же. Т. 50. № 2. С. 202–215.
Кузищин К.В., Малютина А.М., Груздева М.А. 2015. Сезонная динамика питания и пищевые отношения молоди лососёвых рыб (семейство Salmonidae) в бассейне реки Коль (западная Камчатка) // Там же. Т. 55. № 3. С. 323–350. https://doi.org/10.7868/S0042875215020162
Кузищин К.В., Семёнова А.В., Груздева М.А., Павлов Д.С. 2020. Закономерности формирования разнообразия жизненных стратегий и генетическая изменчивость камчатской микижи Parasalmo mykiss (Walbaum) на уровне локальной популяции // Там же. Т. 60. № 6. С. 636–654. https://doi.org/10.31857/S004287522006003X
Кузищин К.В., Груздева М.А., Малютина А.М., Павлов Д.С. 2022. “Пресноводные компоненты” в популяциях кунджи Salvelinus leucomaenis (Salmonidae) на севере ареала вида (Камчатка) // Там же. Т. 62. № 5 С. 000–000. https://doi.org/10.31857/S0042875222050125
Лакин Г.Ф. 1990. Биометрия. М.: Высш. шк., 347 с.
Макеева А.П. 1992. Эмбриология рыб. М.: Изд-во МГУ, 216 с.
Микодина Е.В., Седова М.А., Пьянова С.В. и др. 2011. Руководство по применению анестетика “гвоздичное масло” в аквакультуре. М.: Изд-во ВНИРО, 64 с.
Мурза И.Г., Христофоров О.Л. 1991. Определение степени зрелости гонад и прогнозирование возраста достижения половой зрелости у атлантического лосося и кумжи. Л.: Изд-во ГосНИОРХ, 102 с.
Павлов Д.С., Саваитова К.А. 2008. К проблеме анадромии и резидентности у лососёвых рыб (Salmonidae) // Вопр. ихтиологии. Т. 48. № 6. С. 810–824.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2008. Разнообразие жизненных стратегий и структура популяций камчатской микижи Parasalmo mykiss (Walb.) в экосистемах малых лососевых рек разного типа // Там же. Т. 48. № 1. С. 42–49.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2009. Состояние и мониторинг биоразнообразия лососёвых рыб и среды их обитания на Камчатке (на примере территории заказника “Река Коль”). М.: Т-во науч. изд. КМК, 156 с.
Павлов Д.С., Кириллова Е.А., Кириллов П.И. 2010. Покатная миграция молоди лососёвых рыб в р. Утхолок и её притоках (Северо-Западная Камчатка). 1. Покатная миграция молоди первого года жизни // Изв. ТИНРО. Т. 163. С. 3–44.
Павлов Д.С., Кузищин К.В., Груздева М.А. и др. 2013. Разнообразие жизненной стратегии мальмы Salvelinus malma (Walbaum) (Salmonidae, Salmoniformes) Камчатки: онтогенетические реконструкции по данным рентгенофлуоресцентного анализа микроэлементного состава регистрирующих структур // Докл. РАН. Т. 450. № 2. С. 240–244. https://doi.org/10.7868/S0869565213150267
Павлов Д.С., Поляков М.П., Кузищин К.В. и др. 2014. Вариации проходного образа жизни мальмы Salvelinus malma и кунджи Salvelinus leucomaenis реки Коль (западная Камчатка) по данным соотношения ионов Sr2+/Ca2+ в отолитах // Тез. докл. XV Междунар. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 349–352.
Павлов Д.С., Кириллов П.И., Кириллова Е.А. и др. 2016. Состояние и мониторинг биоразнообразия рыб, рыбообразных и среды их обитания в бассейне реки Утхолок. М.: Т-во науч. изд. КМК, 197 с.
Персов Г.М. 1975. Дифференцировка пола у рыб. Л.: Изд-во ЛГУ, 148 с.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищепромиздат, 322 с.
Ромейс Б. 1953. Микроскопическая техника. М.: Изд-во иностр. лит-ры, 719 с.
Рыбы Курильских островов. 2012. М.: Изд-во ВНИРО, 384 с.
Савваитова К.А. 1989. Арктические гольцы (структура популяционных систем, перспективы хозяйственного использования). М.: Агропромиздат, 224 с.
Сакун О.Ф., Буцкая Н.А. 1968. Определение стадий зрелости и изучение половых циклов рыб. Мурманск: Изд-во Главрыбвод, 47 с.
Семенченко А.Ю., Крупянко Н.И., Гавренков Ю.И. 2003. Экологические формы самцов симы Oncorhynchus masou из бассейнов рек Приморья // Вопр. ихтиологии. Т. 43. № 4. С. 483–489.
Тиллер И.В. 2007. Проходная мальма (Salvelinus malma) Камчатки // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. № 9. С. 79–95.
Черешнев И.А., Волобуев В.В., Шестаков А.В., Фролов С.В. 2002. Лососевидные рыбы Северо-Востока России. Владивосток: Дальнаука, 496 с.
Черницкий А.Г. 1993. Миграция и переход в морскую воду молоди лососей рода Salmo при естественном и искусственном воспроизводстве: Автореф. дис. … докт. биол. наук. М.: ВНИРО, 33 с.
Чмилевский Д.А. 2003. К вопросу о периодизации оогенеза у костистых рыб (обзор) // Вопр. ихтиологии. Т. 43. № 3. С. 375–387.
Arai T., Kotake A., Kitamura T. 2005. Migration of anadromous white-spotted charr Salvelinus leucomaenis, as determined by otolith strontium : calcium ratios // Fish. Sci. V. 71. № 4. P. 731–737. https://doi.org/10.1111/j.1444-2906.2005.01022.x
Baerwald M.R., Meek M.H., Stephens M.R. et al. 2015. Migration-related phenotypic divergence is associated with epigenetic modifications in rainbow trout // Mol. Ecol. V. 25. № 8. P. 1785–1800. https://doi.org/10.1111/mec.13231
Behnke R.J. 2002. Trout and salmon of North America. N.Y.: Free Press, 359 p.
Bird D.J., Cowx I.G. 1993. The selection of suitable pulsed currents for electric fishing in fresh waters // Fish. Res. V. 18. № 3–4. P. 363–376. https://doi.org/10.1016/0165-7836(93)90163-2
Bohlin T.L., Pettersson J., Deregman E. 2001. Population density of migratory and resident brown trout (Salmo trutta) in relation to altitude: evidence for a migration cost // J. Anim. Ecol. V. 70. № 1. P. 112–121. https://doi.org/10.1111/j.1365-2656.2001.00466.x
Busaker G.P., Adelman I.K., Goolish E.M. 1990. Growth // Methods for fish biology. V. 1. Bethesda: Am. Fish. Soc. P. 363–387. https://doi.org/10.47886/9780913235584.ch11
Chapman B.B., Brönmark C., Nilsson J.-A., Hansson L.-A. 2011. The ecology and evolution of partial migration // Oikos. V. 120. № 12. P. 1764–1775. https://doi.org/10.1111/j.1600-0706.2011.20131.x
Chapman B.B., Skov C., Hulthen K. et al. 2012. Partial migration in fishes: definitions, methodologies and taxonomic distribution // J. Fish Biol. V. 81. № 2. P. 479–499. https://doi.org/10.1111/j.1095-8649.2012.03349.x
Elliott J.M. 1994. Quantitative ecology and the brown trout. Oxford: Oxford Univ. Press, 286 p.
Evolution illuminated. Salmon and their relatives. 2004. N.Y.: Oxford Univ. Press, 510 p.
Futamura R., Morita K., Araki K. et al. 2022. Occurrence of mature male white-spotted charr (Salvelinus leucomaenis) in spring, an unusual season // Ichthyol. Res. V. 69. № 1. P. 194–196. https://doi.org/10.1007/s10228-021-00823-4
Gross M.R. 1987. Evolution of diadromy in fishes // Proc. Int. Symp. 1 “Common strategies of anadromous and catadromous fishes”. Bethesda: Am. Fish. Soc. P. 14–25.
Hasegawa K., Maekawa K. 2008. Potential of habitat complexity for mitigating interference competition between native and non-native salmonid species // Can. J. Zool. V. 86. № 5. P. 386–393. https://doi.org/10.1139/z08-015
Hasegawa K., Yamamoto S. 2010. The effect of flow regime on the occurrence of interference and exploitative competition in a salmonid species, white-spotted char (Salvelinus leucomaenis) // Can. J. Fish. Aquat. Sci. V. 67. № 11. P. 1776–1781. https://doi.org/10.1139/f10-100
Hutchings J.A. 1993. Adaptive life histories effected by age-specific survival and growth rate // Ecology. V. 74. № 3. P. 673–684. https://doi.org/10.2307/1940795
Hutchings J.A. 1996. Adaptive phenotypic plasticity in brook trout, Salvelinus fontinalis, life histories // Ecoscience. V. 3. № 1. P. 25–32. https://doi.org/10.1080/11956860.1996.11682311
Hutchings J.A. 2011. Old wine in new bottles: reaction norms in salmonid fishes // Heredity. V. 106. P. 421–437. https://doi.org/10.1038/hdy.2010.166
James F.C., McCulluch C.E. 1990. Multivariate analysis in ecology and systematic: panacea or Pandora’s box? // Ann. Rev. Ecol. Syst. V. 21. № 1. P. 129–166. https://doi.org/10.1146/annurev.es.21.110190.001021
Jonsson B., Hindar K., Northcote T.G. 1984. Optimal age at sexual maturity of sympatric and experimentally allopatric cutthroat trout and Dolly Varden charr // Oecologia. V. 61. № 3. P. 319–325. https://doi.org/10.1007/BF00379628
Johnson J.R., Baumsteiger J., Zydlewski J. et al. 2010. Evidence of panmixia between sympatric life history forms of coastal Cutthroat trout in two lower Columbia River tributaries // N. Am. J. Fish. Manag. V. 30. № 3. P. 691–701. https://doi.org/10.1577/m09-055.1
Kallio-Nyberg I., Jutila E., Koljonen M.-L. et al. 2009. Can the lost migratory Salmo trutta stocks be compensated with resident trout stocks in coastal rivers? // Fish. Res. V. 102. № 1–2. P. 69–79. https://doi.org/10.1016/j.fishres.2009.10.011
Kendall N.W., McMillan J.R., Sloat M.R. et al. 2015. Anadromy and residency in steelhead and rainbow trout Oncorhynchus mykiss: a review of the processes and patterns // Can. J. Fish. Aquat. Sci. V. 72. № 3. P. 319–342. https://doi.org/10.1139/cjfas-2014-0192
Kikko T., Kataoka Y., Nishimori K. et al. 2011. Size at maturity of fluvial white-spotted charr, Salvelinus leucomaenis, around the Lake Biwa water system varies with habitat size // Ichthyol. Res. V. 58. № 4. P. 370–376. https://doi.org/10.1007/s10228-011-0229-z
Klemetsen A. 2010. The char problem revisited: exceptional phenotypic plasticity promotes ecological speciation in postglacial lakes // Freshwat. Rev. V. 3. № 1. P. 49–74. https://doi.org/10.1608/FRJ-3.1.3
Klemetsen A. 2013. The most variable vertebrate on Earth // J. Ichthyol. V. 53. № 10. P. 781–791. https://doi.org/10.1134/S0032945213100044
Klemetsen A., Amundsen P.-A., Dempson J.B. et al. 2003. Atlantic salmon Salmo salar L., brown trout Salmo trutta L. and Arctic charr Salvelinus alpinus L., a review of aspects of their life histories // Ecol. Freshwat. Fish. V. 1. № 2. P. 1–59. https://doi.org/10.1034/j.1600-0633.2003.00010.x
Kouřil J., Mikodina E., Mikulin A. et al. 2009. Different sensitivity between adult salmonids fish species and grayling to an anaesthetic clove oil // Abstr. Int. Conf. “Aquaculture Europe 2009”. Trondheim: EAS. P. 89.
Kubo T. 1980. Studies on the life history of “masu” salmon (Oncorhynchus masou) in Hokkaido // Sci. Rept. Hokkaido Salmon Hatchery. V. 34. P. 1–95.
Liedvogel M., Akesson S., Bensch S. 2011. The genetics of migration on the move // Trends Ecol. Evol. V. 26. № 11. P. 561–569. https://doi.org/10.1016/j.tree.2011.07.009
Maekawa K., Koseki Y., Iguchi K., Kitano S. 2001. Skewed reproductive success among male white-spotted charr land-locked by an erosion control dam: Implications for effective population size // Ecol. Res. V. 16. № 4. P. 727–735. https://doi.org/10.1046/j.1440-1703.2001.t01-1-00429.x
Mangel M. 1996. Life history invariants, age at maturity and the ferox trout // Evol. Ecol. V. 10. № 3. P. 249–263. https://doi.org/10.1007/BF01237683
Marco-Rius F., Caballero P., Moran P., de Leaniz C.G. 2012. And the last shall be first: heterochrony and compensatory marine growth in Sea trout (Salmo trutta) // PLoS ONE. V. 7. № 10. Article e45528. https://doi.org/10.1371/journal.pone.0045528
Marschall E.A., Quinn T.P., Roff D.A. et al. 1998. A framework for understanding Atlantic salmon (Salmo salar) life history // Can. J. Fish. Aquat. Sci. V. 55. Suppl. 1. P. 48–58. https://doi.org/10.1139/d98-007
Miyamoto K., Araki H. 2019. Effects of water depth and structural complexity on survival and settlement of white-spotted charr (Salvelinus leucomaenis) // Hydrobiologia. V. 840. № 1. P. 103–112. https://doi.org/10.1007/s10750-019-3887-x
Miyasaka H., Nakano S., Furukawa-Tanaka T. 2003. Food habit divergence between white-spotted charr and masu salmon in Japanese mountain streams: circumstantial evidence for competition // Limnology. V. 4. № 1. P. 1–10. https://doi.org/10.1007/s10201-002-0088-4
Moore J.W., Yeakel J.D., Peard D. et al. M. 2014. Life-history diversity and its importance to population stability and persistence of a migratory fish: steelhead in two large North American watersheds // J. Anim. Ecol. V. 83. № 5. P. 1035–1046. https://doi.org/10.1111/1365-2656.12212
Morita K. 2001. The growth history of anadromous white-spotted charr in northern Japan: a comparison between river and sea life // J. Fish Biol. V. 59. № 6. P. 1556–1565. https://doi.org/10.1006/jfbi.2001.1793
Morita K., Morita S.H.M. 2002. Rule of age and size at maturity: individual variation in the maturation history of resident white-spotted charr // Ibid. V. 61. № 5. P. 1230–1238. https://doi.org/10.1006/jfbi.2002.2138
Morita K., Takashima Y. 1998. Effect of female size on fecundity and egg size in white-spotted charr: comparison between sea-run and resident forms // Ibid. V. 53. № 5. P. 1140–1142. https://doi.org/10.1111/j.1095-8649.1998.tb00471.x
Morita K., Yokota A. 2002. Population viability of stream-resident salmonids after habitat fragmentation: a case study with white-spotted charr (Salvelinus leucomaenis) by an individual-based model // Ecol. Model. V. 155. № 1. P. 85–94. https://doi.org/10.1016/S0304-3800(02)00128-X
Morita K., Yamamoto S., Hoshino N. 2000. Extreme life history change of white-spotted char (Salvelinus leucomaenis) after damming // Can. J. Fish. Aquat. Sci. V. 57. № 6. P. 1300–1306. https://doi.org/10.1139/f00-050
Morita K., Sahashi G., Miya M. et al. 2019. Ongoing localized extinctions of stream-dwelling white-spotted charr populations in small dammed-off habitats of Hokkaido Island, Japan // Hydrobiologia. V. 840. № 1. P. 207–213. https://doi.org/10.1007/s10750-019-3891-1
Nakamura T. 2011. Relationships between physical characteristics of pools and the residency of stream-dwelling white-spotted charr // Aquac. Sci. V. 59. № 3. P. 427–433. https://doi.org/10.11233/aquaculturesci.59.427
Nakano S. 1995. Competitive interactions for foraging microhabitats in a size-structured interspecific dominance hierarchy of two sympatric stream salmonids in a natural habitat // Can. J. Zool. V. 73. № 10. P. 1845–1854. https://doi.org/10.1139/z95-217
Nakano S., Miyasaka H., Kuhara N. 1999. Terrestrial-aquatic linkage: riparian arthropod inputs alter trophic cascades in a stream food web // Ecology. V. 80. № 7. P. 2435–2441. https://doi.org/10.1890/0012-9658(1999)080[2435:TALRAI]2.0.CO;2
Pavlov D.S., Kuzishchin K.V., Kirillov P.I. et al. 2005. Downstream migration of juveniles of Kamchatkan mykiss Parasalmo mykiss from tributaries of the Utkholok and Kol rivers (Western Kamchatka) // J. Ichthyol. V. 45. Suppl. 2. P. S185–S198.
Quinn T.P. 2005. The behavior and ecology of Pacific salmon and trout. Bethesda: Am. Fish. Soc., 378 p.
Roff D.A. 1984. The evolution of life history parameters in teleosts // Can. J. Fish. Aquat. Sci. V. 41. № 6. P. 989–1000. https://doi.org/10.1139/f84-11
Rohlf J.F. 1993. BNSYS-pc numerical taxonomy and multivariate analysis system. N.Y.: Exeter Softw. Press, 264 p.
Schindler D.E., Hilborn R., Chasco B. et al. 2010. Population diversity and the portfolio effect in an exploited species // Nature. V. 465. № 7298. P. 609–612. https://doi.org/10.1038/nature09060
Sloat M.R., Fraser D.J., Dunham J.B. et al. 2014. Ecological and evolutionary patterns of freshwater maturation in Pacific and Atlantic salmonines // Rev. Fish Biol. Fish. V. 24. № 3. P. 689–707. https://doi.org/10.1007/s11160-014-9344-z
Thorpe J.E. 1987. Smolting versus residency developmental conflicts in salmonids // Proc. Int. Symp. 1 “Common strategies of anadromous and catadromous fishes”. Bethesda: Am. Fish. Soc. P. 244–252.
Thorpe J.E. 1994. Reproductive strategies in Atlantic salmon Salmo salar L. // Aquacult. Res. V. 25. № 1. P. 77–87. https://doi.org/10.1111/j.1365-2109.1994.tb00668.x
Thorpe J.E., Mangel M., Metcalf N.B., Huntingford F.A. 1998. Modelling the proximate basis of salmonid life-history variation, with application to Atlantic salmon, Salmo salar L. // Evol. Ecol. V. 12. № 5. P. 581–599. https://doi.org/10.1023/A:1022351814644
Yagyu M. 2009. Foraging microhabitat of Japanese charr, Salvelinus leucomaenis, in a mountain stream // Jpn. J. Ichthyol. V. 56. № 2. P. 111–118. https://doi.org/10.11369/jji.56.111
Yamamoto S., Takahashi Y., Kitano S., Goto A. 1996. Residual female parr in an anadromous population of white-spotted charr, Salvelinus leucomaenis, in southern Hokkaido, Japan // Ibid. V. 43. № 2. P. 101–104 (in Japanese). https://doi.org/10.11369/jji1950.43.101
Yamamoto S., Kubota H., Hasegawa K., Nakamura T. 2015. Census and effective population sizes of white-spotted charr (Salvelinus leucomaenis) in a fragmented landscape // Ecol. Freshwat. Fish. V. 25. № 4. P. 612–621. https://doi.org/10.1111/eff.12239
Utoh H. 1976. A study of mechanism of differentiation between the stream resident form and seaward migration form of masu salmon Oncorhynchus masou (Brevoort). I. Growth and sexual maturity of precocious masu salmon parr // Bull. Fac. Fish. Hokkaido Univ. V. 26. P. 321–326.
Utoh H. 1977. A study of mechanism of differentiation between the stream resident form and seaward migration form of masu salmon Oncorhynchus masou (Brevoort). II. Growth and sexual maturity of precocious masu salmon parr // Ibid. V. 28. P. 66–73.
Zippin C. 1956. An evaluation of the removal method of estimation animal populations // Biometrics. V. 12. № 2. P. 163–189. https://doi.org/10.2307/3001759
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии