Вопросы ихтиологии, 2022, T. 62, № 6, стр. 758-769
Размерно-весовая характеристика высокоширотных пелагических рыб атлантического сектора Южного океана
А. М. Орлов 1, 2, *, А. В. Мишин 1, Д. В. Артеменков 3, С. А. Мурзина 4
1 Институт океанологии РАН – ИО РАН
Москва, Россия
2 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
3 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии – ВНИРО
Москва, Россия
4 Институт биологии Карельского научного центра РАН – ИБ КарНЦ РАН
Петрозаводск, Россия
* E-mail: orlov@vniro.ru
Поступила в редакцию 25.03.2022
После доработки 11.04.2022
Принята к публикации 12.04.2022
- EDN: MSLWHX
- DOI: 10.31857/S004287522206025X
Аннотация
Мезопелагические рыбы, обладая колоссальной биомассой и участвуя в переносе энергии и органического вещества между различными трофическими уровнями, играют важную экологическую роль в экосистемах Мирового океана, но остаются при этом малоизученными. Антарктическая серебрянка Pleuragramma antarcticum – ключевой вид пелагиали высокоширотной зоны Антарктики. Для четырёх видов наиболее массовых пелагических рыб (антарктический батилаг Bathylagus antarcticus, антарктическая серебрянка, антарктическая электрона Electrona antarctica и гимноскопел Брауэра Gymnoscopelus braueri) из вод атлантического сектора Южного океана к югу от Антарктической конвергенции представлены новые данные о размерном составе и размерно-весовых зависимостях, которые могут быть использованы при изучении их роста, расчётах отдельных популяционных параметров и в популяционных исследованиях.
Мезопелагические рыбы в Мировом океане обладают огромной биомассой и являются неотъемлемой составляющей функционирования океанических экосистем (Gjøsaeter, Kawaguchi, 1980; Pakhomov et al., 1996; Radchenko, 2007; Irigoien et al., 2014; Anderson et al., 2019), представляя собой потенциально важный и неэксплуатируемый рыбопромысловый ресурс, который может быть использован для производства жира, муки, кормов, биологически активных добавок, пищевой и фармацевтической продукции (Orlov, Rabazanov, 2019; Lauritano et al., 2020; Paoletti et al., 2021; Pauly et al., 2021). При этом они остаются одним из наименее изученных компонентов морских экосистем как на глобальном, так и региональном уровнях (St. John et al., 2016; Курносова и др., 2022). Антарктическая серебрянка Pleuragramma antarcticum является ключевым видом пелагиали высокоширотной зоны Антарктики (La Mesa et al., 2010). Пелагические рыбы Южного океана являются неотъемлемой частью пищевых сетей и основными потребителями зоопланктона, включая антарктического криля Euphausia superba (Pakhomov et al., 1996; Pusch et al., 2004; Shreeve et al., 2009; Saunders et al., 2018), а также служат пищей многим хищникам высшего трофического уровня, таким как морские млекопитающие, околоводные птицы, кальмары и крупные хищные рыбы (Rodhouse et al., 1992; Reid, Arnould, 1996; Olsson, North, 1997; Cherel et al., 2002; Collins et al., 2007).
Ихтиофауна Южного океана характеризуется низким видовым разнообразием и высоким уровнем эндемизма (Greely et al., 1999). Четверть всех известных видов рыб данного региона обитает в пределах мезо- и батипелагиали (Kock, 1992). Наиболее многочисленными мезопелагическими видами в водах Антарктики являются представители семейств Myctophidae, Bathylagidae, Paralepididae и Gonostomatidae (Andriashev, 1965; Hempel, 1985; Kock, 1985; Christiansen et al., 2018), на которых в районе море Уэдделла–море Скотия приходится > 95% биомассы рыб верхнего километрового слоя (Lancraft et al., 1989), а также антарктическая серебрянка – единственный представитель семейства Nototheniidae, который весь жизненный цикл проводит в пелагиали (Gon, Heemstra, 1990; Vacchi et al., 2017).
Несмотря на важную экологическую роль и значительный объём исследований мезопелагических рыб Южного океана и антарктической серебрянки в частности, они продолжают оставаться довольно слабо изученными (Rowedder, 1979; Linkowski, 1985; Greely et al., 1999; Collins et al., 2008; Saunders et al., 2017). Это объясняется преимущественно тем, что эти виды являются слабо и нерегулярно эксплуатируемым ресурсом рыболовства (Харенко, 2019; Pauly et al., 2021), в связи с чем их запасы не нуждаются в регулярной оценке и мониторинге. Кроме того, сборы мезопелагических рыб траловыми орудиями лова в репрезентативном пространственно-временнóм масштабе представляют определённые сложности (Saunders et al., 2019).
Данные о зависимостях длина–масса рыб (length-weight relationship – LWR) используются при изучении роста, расчётах отдельных популяционных параметров, а также в популяционных исследованиях при сравнении информации, полученной в разных частях видовых ареалов (Santos et al., 2002; Dutta et al., 2021). В управлении водными биологическими ресурсами основным инструментом ведения ответственного рыболовства является принцип экосистемного подхода (Nicholson, Jennings, 2004; Shin et al., 2005; Иванов, 2017), учитывающий как для промысловых, так и для не эксплуатируемых промыслом видов рыб их биомассу, для расчёта которой на основании имеющейся информации о размерном составе могут быть использованы данные LWR (Orlov, Binohlan, 2009).
Между тем информация о размерном составе и LWR пелагических рыб Южного океана к югу от Антарктического полярного фронта (АПФ) остаётся фрагментарной и довольно ограниченной. Наиболее хорошо изучен размерный состав антарктической электроны Electrona antarctica (Myctophidae) в районе Антарктического п-ова и прилегающих к нему акваторий (Rowedder, 1979; Liu, Chen, 1995; Pusch et al., 2004; Collins et al., 2008; Saunders et al., 2019). Существенно меньше опубликовано сведений о размерном составе антарктической серебрянки (Hubold, Ekau, 1987; Liu, Chen, 1995) и гимноскопела Брауэра Gymnoscopelus braueri (Myctophidae) (Pusch et al., 2004; Collins et al., 2008). Данные о LWR антарктической электроны представлены в нескольких публикациях (Greely et al., 1999; Kock et al., 2000; Artigues et al., 2003), однако сведения о различиях данной зависимости у самцов и самок до сих пор отсутствовали. Заметно меньше публикаций по LWR антарктической серебрянки (Kunzmann, 1986; Artigues et al., 2003), а подобные сведения для гимноскопела Брауэра имеются только из вод у о-вов Южная Георгия и Южные Сандвичевы (Saunders et al., 2019). Полностью отсутствует в литературе информация о размерном составе и LWR антарктического батилага Bathylagus antarcticus (Bathylagidae).
Цель сообщения – представить новые данные о размерном составе и размерно-весовых зависимостях четырёх видов высокоширотных пелагических рыб из вод атлантического сектора Южного океана к югу от АПФ: антарктической электроны, антарктического батилага, гимноскопела Брауэра и антарктической серебрянки.
МАТЕРИАЛ И МЕТОДИКА
Материалом послужили сборы пелагических рыб с 22.01 по 12.02.2022 г. в 87-м рейсе (АМК-87) научно-исследовательского судна (НИС) “Академик Мстислав Келдыш” в атлантическом секторе Южного океана: в проливах Брансфилда и Антарктическом (Антарктик-Саунд), бассейне Пауэлла моря Уэдделла и в районе Южных Оркнейских о-вов (рис. 1). Сборы осуществляли двумя орудиями лова: разноглубинным тралом Айзекса−Кидда в модификации Самышева–Асеева (РТАКСА) и двойной квадратной планктонной сетью (double square net – DSN). РТАКСА – незамыкающееся орудие лова с площадью устья 6 м2, длиной сетной части 25 м из безузловой дели с ячеёй 6 мм и вставкой в кутце из капронового сита № 15 (0.67 мм) (Kobyliansky et al., 2010). DSN – планктонная сеть с площадью входных отверстий 1 м2 и фильтрующим конусом из газа с ячеей 0.5 мм (Bouchard et al., 2016), оснащённая счётчиком потока воды и крыловидным заглубителем массой 24 кг (оба – “Hydrobios”, Германия). Глубину погружения обоих орудий лова определяли на основе показания датчика давления зонда Senti DT (“StarOddi”, Исландия). Косые ловы выполняли от максимальных глубин 600 (DSN) и 1980 м (РТАКСА) до поверхности на скорости судна соответственно 2 и 3 узла.
Рис. 1.
Места сбора материалов пелагических рыб в рейсе научно-исследовательского судна “Академик Мстислав Келдыш” (АМК-87) 22.01–12.02.2022 г.: (◇) – ловы двойной квадратной планктонной сетью (DSN), (⚪) – траления разноглубинным тралом Айзекса−Кидда в модификации Самышева–Асеева (РТАКСА).
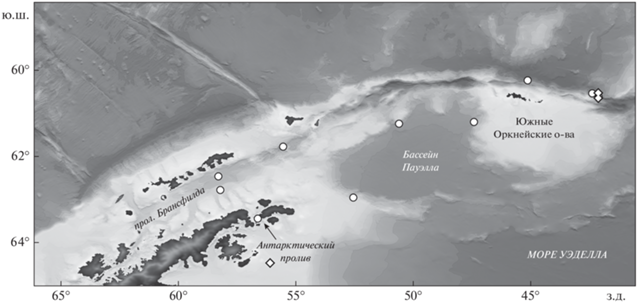
У пойманных рыб сразу после вылова измерительной линейкой определяли стандартную длину тела (SL) с точностью до 1 мм и с использованием электронных весов – общую массу тела с точностью до 0.1 г. У антарктической электроны, кроме того, перед измерениями визуально определяли пол, который хорошо различается по положению каудальных светящихся желёз у самцов и самок (Беккер, 1983; Gon, Heemstra, 1990). Длина тела измерена у 155 особей электроны, 28 – серебрянки, 98 – батилага и 44 – гимноскопела. LWR получены на основании измерений длины и массы тела соответственно 155 (в том числе 28 самцов и 63 самки), 28, 86 и 41 экз. Данные по размерному составу из опубликованных источников, представленные в графическом виде, трансформированы в цифровой формат и наряду с нашими данными LWR представлены в табличном виде для того, чтобы они были доступны для занесения в базу данных FishBase (Froese, Pauly, 2022) и использования в последующих исследованиях.
Зависимость массы тела (W, г) от SL (см) описывали уравнением: W = aSLᵇ (Le Cren, 1951; Винберг, 1971; Мина, Клевезаль, 1976; Froese, 2006), где a – интеграционная константа, коэффициент b – показатель степени. Также были рассчитаны 95%-ные доверительные интервалы (CI) для параметра b и коэффициент детерминации (R2). Показатель степени (коэффициент b) использовали для описания трёхмерного роста, который характеризовали как изометрический при b = 3.0, отрицательный аллометрический (гипоаллометрический) – при b < 3.0, положительный аллометрический (гипераллометрический) – при b > 3.0 (Froese et al., 2011).
При проведении межвидовых сравнений данные по самцам и самкам одного вида объединяли (Froese et al., 2011; Froese, Pauly, 2022). При этом уравнения степенной зависимости преобразовывали логарифмически в линейные регрессии (Le Cren, 1951; Ricker, 1973; Froese, 2006), имевшие вид: Ln W = ln a + b ln SL. Для сравнения полученных результатов по изученным видам с другими представителями их семейств использовали базу данных FishBase (Froese, Pauly, 2022), применяя сведения о коэффициентах a и b степенного уравнения LWR четырёх видов семейства Bathylagidae (7 выборок), 15 видов семейства Nototheniidae (55 выборок) и 26 видов семейства Myctophidae (34 выборки).
Достоверность статистических отличий значений b от 3.0 оценивали по t-критерию Стьюдента при уровне значимости p ≤ 0.05 (Sokal, Rohlf, 1987). Расчёты проводили с использованием компьютерной программы Excel (“Microsoft”, США) и статистического языка R (R Core Team, 2016) в составе программных пакетов FSA и rfishBase (Ogle, 2011; Boettiger et al., 2012).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Антарктическая электрона – антарктический циркумполярный вид, ареал которого расположен преимущественно к югу от АПФ, где она является наиболее массовым видом. По отдельным находкам известна также много севернее АПФ (Беккер, 1983; Gon, Heemstra, 1990). Встречается до глубины 2000 м, днём населяет верхний 250-метровый слой, ночью к самой поверхности не понимается, сосредотачиваясь на глубинах 50–100 м. Максимальная известная стандартная длина тела ~ 100 мм, масса – 15 г, при этом самцы мельче самок: максимальные размеры составляют соответственно 82 и 103 мм (Беккер, 1983; Gon, Heemstra, 1990; Artigues et al., 2003).
Наши уловы были представлены особями SL 3.0–10.3 (в среднем 7.28 ± ошибка среднего 0.13) см. При этом самки были несколько длиннее самцов, их максимальная длина составила соответственно 10.3 и 9.7 см при среднем значении 7.39 ± 0.19 против 7.09 ± 0.23 см (табл. 1). Сравнение наших данных по размерному составу рассматриваемого вида с ранее опубликованными (Rowedder, 1976; Pusch et al., 2004; Collins et al., 2008) показывает, что в различных районах атлантического сектора Южного океана он довольно сходен, не подвержен межгодовой динамике, и на него не оказывает влияние селективность различных орудий лова. И, хотя средняя длина в уловах варьировала в пределах 7.28–8.08 см, их основу во все годы во всех районах независимо от орудия лова составляли особи SL 5.6–10.0 см. Сведения по максимальному возрасту антарктической электроны весьма противоречивы: по одним данным он составляет 11 лет (Linkowski, 1987), по другим – не превышает 4 лет (Greely et al., 1999). Поскольку результаты последнего исследования основаны на учёте суточных приростов, нам они представляются более надёжными. Возможными причинами стабильности размерного состава антарктической электроны могут быть её небольшая продолжительность жизни, высокие темпы роста и наличие в популяции всего нескольких размерно-возрастных классов.
Таблица 1.
Сведения об условиях поимки антарктической электроны Electrona antarctica и гимноскопела Брауэра Gymnoscopelus braueri в атлантическом секторе Южного океана и распределение особей в уловах по размерным классам, %
| Показатель | Electrona antarctica | Gymnoscopelus braueri | ||||||
|---|---|---|---|---|---|---|---|---|
| Район | ЮГ, ЮС | ЮШ | ЮГ | ПБ, АП, БП, ЮО | ЮШ | ЮГ | ЮГ, ЮО | ПБ, АП, БП, ЮО |
| Год | 1976 | 1996 | 2004 | 2022 | 1996 | 2004 | 2004 | 2022 |
| Орудие лова (ячея в кутце, мм) | Различные тралы (–) | PT-1088 (12) | RMT25 (5), IYGPT (12) | DSN (0.5), РТАКСА (0.67) | PT-1088 (12) | RMT25 (5), IYGPT (12) | RMT25 (5) | DSN (0.5), РТАКСА (0.67) |
| n | 307 | 582 | 250 | 155 | 187 | 391 | 584 | 44 |
| Источник информации | Rowedder, 1979 | Push et al., 2004 | Collins et al., 2008 | Наши данные | Push et al., 2004 | Collins et al., 2008 | Saunders et al., 2019 | Наши данные |
| Размерный класс, см: | ||||||||
| 3.0–3.5 | – | – | 0.4 | 1.9 | – | – | – | – |
| 3.6–4.0 | 1.0 | – | 1.6 | 1.9 | – | – | 1.5 | – |
| 4.1–4.5 | 2.3 | 0.3 | 0.8 | 1.3 | – | 0.5 | 10.6 | – |
| 4.6–5.0 | 1.6 | 0.7 | 0.8 | 1.9 | 0.5 | 0.5 | 6.6 | – |
| 5.1–5.5 | 6.8 | 2.1 | 2.0 | 6.5 | 0.5 | 2.6 | 2.0 | – |
| 5.6–6.0 | 6.2 | 4.3 | 6.2 | 11.0 | 0.5 | 1.5 | 4.2 | – |
| 6.1–6.5 | 4.6 | 8.9 | 5.3 | 11.6 | 2.7 | 4.1 | 4.4 | – |
| 6.6–7.0 | 7.2 | 13.1 | 9.5 | 7.1 | 5.3 | 2.6 | 6.4 | 6.8 |
| 7.1–7.5 | 13.0 | 13.9 | 14.6 | 10.4 | 8.6 | 4.3 | 4.6 | 9.2 |
| 7.6–8.0 | 13.0 | 17.1 | 11.5 | 14.2 | 9.1 | 3.8 | 6.6 | 13.7 |
| 8.1–8.5 | 16.9 | 12.9 | 13.0 | 7.7 | 10.7 | 7.4 | 8.2 | 6.8 |
| 8.6–9.0 | 14.7 | 7.6 | 9.4 | 7.7 | 10.2 | 7.2 | 8.4 | 6.8 |
| 9.1–9.5 | 9.1 | 8.1 | 10.7 | 10.4 | 12.3 | 9.8 | 7.1 | 2.3 |
| 9.6–10.0 | 2.6 | 6.7 | 9.0 | 5.8 | 11.2 | 8.7 | 5.5 | 6.8 |
| 10.1–10.5 | 1.0 | 3.1 | 4.4 | 0.6 | 10.2 | 13.1 | 6.1 | 6.8 |
| 10.6–11.0 | – | 1.2 | 0.4 | – | 9.1 | 9.0 | 6.4 | 4.5 |
| 11.0–11.5 | – | – | 0.4 | – | 4.3 | 7.7 | 4.2 | 6.8 |
| 11.6–12.0 | – | – | – | – | 2.1 | 9.2 | 3.5 | 15.9 |
| 12.1–12.5 | – | – | – | – | 1.6 | 5.7 | 2.2 | 4.5 |
| 12.6–13.0 | – | – | – | – | 1.1 | 1.5 | 1.3 | 4.5 |
| 13.1–13.5 | – | – | – | – | – | 0.8 | – | 2.3 |
| 13.6–14.0 | – | – | – | – | – | – | 0.2 | – |
| 14.1–14.5 | – | – | – | – | – | – | – | 2.3 |
| M ± SE | 7.53 ± 0.95 | 7.75 ± 1.33 | 8.08 ± 0.78 | 7.28 ± 0.13 | 9.03 ± 0.60 | 9.81 ± 0.74 | 8.24 ± 0.69 | 9.85 ± 2.03 |
Примечание. PT-1800 – пелагический трал, RMT25 – 25-метровый прямоугольный разноглубинный трал, IYGPT – международный пелагический трал для молоди тресковых, DSN – двойная квадратная сеть, РТАКСА – разноглубинный трал Айзекса−Кидда в модификации Самышева−Асеева. Здесь и в табл. 2, 3: ПБ – пролив Брансфилда, АП – Антарктический пролив, БП – бассейн Пауэлла, ЮО – Южные Оркнейские о-ва, n – число рыб, экз.; “–” – нет данных; указана стандартная длина (SL) особей, пол которых не определён. Здесь и в табл. 2: ЮГ – о. Южная Георгия, ЮС – Южные Сандвичевы о-ва. Здесь и в табл. 3: ЮШ – Южные Шетландские о-ва, M ± SE – среднее значение и ошибка среднего, серым цветом выделены наиболее многочисленные размерные классы.
Согласно полученным нами данным по LWR, электрона характеризуется положительным аллометрическим ростом (табл. 2). При этом коэффициенты b в уравнении рассматриваемой зависимости от 3.0 достоверно отличаются для совокупности всех особей и недостоверно – для самцов и самок по отдельности. В предшествующих публикациях у рассматриваемого вида отмечен как положительный (Greely et al., 1999), так и отрицательный аллометрический рост (Kock et al., 2000; Artigues et al., 2003). При этом данные Кока с соавторами (Kock et al., 2000) признаются некорректными (Froese, Pauly, 2022). Несмотря на различные периоды сбора материалов (лето 2022 г. в Южном полушарии − наши данные; весна 1983 г. и осень 1986 г. − Greely et al., 1999), коэффициенты b уравнения LWR в обоих случаях оказались близки друг к другу. В отличие от них рассматриваемый индекс в исследованиях 1996–2000 гг. (Artigues et al., 2003) оказался существенно меньше 3.0.
Таблица 2.
Сведения о массовых высокоширотных пелагических видов рыб атлантического сектора Южного океана
| Показатель | Electrona antarctica | Gymnoscopelus braueri | Bathylagus antarcticus | Pleuragramma antarcticum | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Район | МС, МУ | ПБ, МУ | ЮО | ПБ, АП, БП, ЮО | ЮГ, ЮС | ПБ, АП, БП, ЮО | ПБ, АП, БП, ЮО | МУ | ПБ, МУ | ПБ, АП, БП, ЮО | ||
| Период | 1983, 1986 | 1996–2000 | 1999 | 2022 | 2004–2009 | 2022 | 2022 | 1984–1985 | 1996–2000 | 2022 | ||
| Орудие лова (ячея в кутце, мм) | OCMTT (1) | BPN (12) | HBST (40) | DSN (0.5), РТАКСА (0.67) | RMWT (5) | DSN (0.5), РТАКСА (0.67) | DSN (0.5), РТАКСА (0.67) | ДТ, ТА, КТ (–) | BPN (12) | DSN (0.5), РТАКСА (0.67) | ||
| Пол | U | U | U | F | M | F + M + U | U | U | U | U | U | U |
| Тип длины | SL | TL | TL | SL | SL | SL | SL | SL | SL | SL | TL | SL |
| Длина, см | ||||||||||||
| – минимальная | 2.3 | 7.5 | 6.5 | 5.0 | 5.2 | 3.0 | 3.4 | 6.9 | 3.2 | 4.0 | 5.2 | 10.1 |
| – максимальная | 10.3 | 11.2 | 10.5 | 10.3 | 9.7 | 10.3 | 14.0 | 13.1 | 19.0 | 19.5 | 26.6 | 20.5 |
| – средняя | – | 9.7 | – | 7.4 | 7.1 | 7.3 | – | 9.7 | 9.8 | – | 17.5 | 15.2 |
| Масса, г | ||||||||||||
| – минимальная | – | 4.3 | – | 2.0 | 1.5 | 0.3 | 0.3 | 2.7 | 0.1 | 0.4 | 0.5 | 10.5 |
| – максимальная | – | 15.0 | – | 15.7 | 14.3 | 15.7 | 19.5 | 22.0 | 89.0 | 70.0 | 120.5 | 100.0 |
| – средняя | – | 10.4 | – | 6.5 | 5.2 | 6.2 | – | 9.5 | 15.2 | – | 35 | 37.2 |
| a | 3.99 × 10–6 | 1.59 × 10–2 | 2.04 × 10–1 | 9.70 × 10–3 | 6.90 × 10–3 | 9.70 × 10–3 | 4.33 × 10–6 | 6.10 × 10–3 | 2.30 × 10–3 | 4.47 × 10–3 | 1.81 × 10–3 | 5.50 × 10–3 |
| b | 3.270 | 2.836 | 1.960 | 3.176 | 3.318 | 3.173 | 3.123 | 3.173 | 3.574 | 3.250 | 3.400 | 3.217 |
| 95% CI (b) | – | – | – | 2.968–3.383 | 3.000–3.636 | 3.063–3.283 | – | 2.949–3.398 | 3.464–3.684 | – | – | 2.903–3.554 |
| R2 | 0.957 | 0.916 | – | 0.939 | 0.933 | 0.955 | 0.952 | 0.955 | 0.980 | – | 0.975 | 0.933 |
| n | 107 | 28 | 199 | 63 | 28 | 155 | 888 | 41 | 86 | 27 | 930 | 28 |
| Рост | +A | −A | −A | +A | +A | +A | +A | +A | +A | +A | +A | +A |
| Источник информации | Greely et al., 1999 | Artigues et al., 2003 | Kock et al., 2000 | Наши данные | Saunders et al., 2019 | Наши данные | Наши данные | Kunzmann, 1986 | Artigues et al., 2003 | Наши данные | ||
Примечание. МС – море Скотия, OCMTT – замыкающийся модифицированный трал Такера, BPN – бентопелагический трал, HBST – трал для промысла на жёстких грунтах, ДТ – донный трал, ТА – трал Агассица, КТ – крилевый трал, F – самки, M – самцы, U – пол не определён, TL – общая длина, SL – стандартная длина, R2 – коэффициент детерминации, −А – отрицательный аллометрический рост, +А – положительный аллометрический, CI – доверительный интервал, a – интеграционная константа уравнения зависимости длина–масса (LWR), b – показатель степени уравнения LWR. Серым цветом выделены ячейки со значениями, превышающими известные литературные. Полужирным шрифтом выделены статистически значимые отличия показателя степени b от 3.0. Здесь и в табл. 3: МУ – море Уэдделла, RMWT – прямоугольный разноглубинный трал.
Эти и наши исследования были проведены практически в одном и том же районе, на сходных глубинах и в близкие сроки. Нерест данного вида приурочен к осенне-зимнему периоду в Южном полушарии с пиком в конце ноября–декабре (Gon, Heemstra, 1990; Moteki et al., 2017) и, следовательно, сборы в обоих случаях пришлись на нагульный период и с большой долей вероятности состояли из рыб в близком физиологическом состоянии. Поэтому описанные различия мы можем связать только с разными диапазонами длины и массы тела изученных особей.
Отдельно следует отметить бóльшие, в сравнении с опубликованными, полученные нами данные по максимальной длине самцов (9.7 см) и максимальной массе тела (15.7 г) антарктической электроны.
Гимноскопел Брауэра – антарктический циркумполярный вид, встречающийся обычно южнее АПФ и известный по редким находкам к северу от него. Распространён между континентальным побережьем Антарктиды и 33° ю.ш. Наряду с антарктической электроной – наиболее массовый вид антарктических светящихся анчоусов. Минимальные глубины вылова – 100–150 м, ночью обитает в верхнем 200-метровом слое (Беккер, 1983; Gon, Heemstra, 1990). Максимальная известная стандартная длина тела – 139 мм, масса – 19.5 г (Saunders et al., 2019).
Гимноскопел в наших уловах был представлен особями SL 6.9–14.2 (в среднем 9.85 ± 0.31) см (табл. 1). В отличие от электроны его размерный состав не отличался однообразием. Наиболее мелкие особи (средняя SL 8.24 ± 0.69 см, доминирующие размерные группы – 4.1–5.0 и 7.6–9.5 см) отмечены в 2004 г. в районе о-вов Южная Георгия и Южные Оркнейские (Saunders et al., 2019), что, вероятно, отчасти связано с меньшим размером ячеи (5 мм) использованного трала. В остальных случаях, включая наши исследования, размерный состав рассматриваемого вида был довольно схож: средняя длина варьировала незначительно (9.03–9.85 см), а основу уловов составляли рыбы SL 6.6–12.0 см.
В сравнении с антарктической электроной размерный ряд гимноскопела Брауэра был представлен бо́льшим числом размерных классов, что, вероятно, обусловлено большей его продолжительностью жизни, которая составляет 6 лет (Saunders et al., 2019).
Опубликованные данные по LWR гимноскопела Брауэра до сих пор были ограничены единственным недавним исследованием в водах о‑вов Южная Георгия и Южные Сандвичевы (Saunders et al., 2019). Его размерно-весовые характеристики в наших исследованиях оказались близкими к таковым предшествующего (табл. 2), несмотря на то что последнее было проведено в совершенно другие сроки (март–апрель 2004 и 2009 гг., октябрь–декабрь 2006). Точное время нереста рассматриваемого вида неизвестно, но предполагается, что в Южном полушарии оно приходится на весну (сентябрь–октябрь) (Saunders et al., 2019). Поскольку сборы в обоих исследованиях были представлены нагульными особями, находящимися, вероятно, в сходном физиологическом состоянии (особи со зрелыми гонадами в наших сборах отсутствовали), их размерно-весовые характеристики оказались близкими. Отдельно стоит упомянуть максимальную массу тела особей рассматриваемого вида в наших исследованиях (22.0 г), которая заметно превосходит ранее известную (Saunders et al., 2019).
Антарктическая серебрянка – антарктический циркумполярный вид, единственный представитель семейства нототениевых, жизненный цикл которого полностью проходит в пелагиали (Gon, Heemstra, 1990; Vacchi et al., 2017). Распространена преимущественно в районах, прилежащих к шельфу Антарктиды и островам вблизи Антарктического п-ова (Fisher, Hureau, 1985; Gon, Heemstra, 1990). В водах восточной части Антарктического п-ова встречается совместно с антарктической электроной и гимноскопелом Брауэра, с которыми имеет сходный характер вертикального распределения (Vacchi et al., 2017). Обитает на глубинах ≤ 900 м, при этом в процессе онтогенеза отмечается изменение глубин обитания: молодь SL 3.5–11 см населяет верхний 400-метровый слой, рыбы SL 11–19.5 см встречаются глубже 400 м (Hubold, Ekau, 1987), самые крупные особи обитают на глубинах 400–700 м (La Mesa, Eastman, 2011). В дневные часы сосредотачивается на глубинах 400–800 м, ночью мигрирует в поверхностные слои. В открытых районах Южного океана обитает преимущественно на глубинах > 500 м, над шельфом и материковым склоном Антарктиды – в диапазоне 300–500 м (Vacchi et al., 2017). Достигает общей длины 266 мм и массы 200 г (Kailola et al., 1993; Artigues et al., 2003).
Размерный ряд серебрянки в сравнении с таковыми двух выше рассмотренных видов миктофид отличался наличием заметно большего числа размерных классов (табл. 3). В наших уловах она была представлена особями SL 10.1–20.5 (в среднем 15.17 ± 0.40) см при преобладании (67.9%) размерной группы 14.1–17.0 см. Сравнение с ранее опубликованными данными (Hubold, Ekau, 1987; Liu, Chen, 1995) показывает, что размерный состав данного вида в разные годы значительно варьирует как по величине средней длины (6.15–15.17 см), так и по преобладающим размерным классам. Наиболее мелкая серебрянка (средняя SL 6.15 ± 0.23 см) с преобладанием (68.4%) размерных классов 2.1–3.0 и 3.1–4.0 см отмечена в декабре 1988–марте 1989 гг. (Liu, Chen, 1995) в районе, практически совпадающем с таковым в наших исследованиях. В то же время её размерный состав в наших уловах заметно отличался от такового в море Уэдделла в 1985 г. (Hubold, Ekau, 1987).
Таблица 3.
Сведения об условиях поимки антарктической серебрянки Pleuragramma antarcticum и антарктического батилага Bathylagus antarcticus в атлантическом секторе Южного океана и распределение особей в уловах по размерным классам, %
| Показатель | Pleuragramma antarcticum | Bathylagus antarcticus | ||
|---|---|---|---|---|
| Район | МУ | ЮШ, ПБ, МУ | ПБ, АП, БП, ЮО | ПБ, АП, БП, ЮО |
| Период | 1985 | 1988–1989 | 2022 | 2022 |
| Орудие лова (ячея в кутце, мм) | Различные тралы (–) | RMWT (4.5) | DSN (0.5), РТАКСА (0.67) | DSN (0.5), РТАКСА (0.67) |
| n | 995 | 411 | 28 | 98 |
| Источник информации | Hubold, Ekau, 1987 | Liu, Chen, 1995 | Наши данные | Наши данные |
| Размерный класс, см: | ||||
| 1.1–2.0 | – | 0.9 | – | – |
| 2.1–3.0 | – | 35.7 | – | – |
| 3.1–4.0 | 0.9 | 32.7 | – | 3.1 |
| 4.1–5.0 | 8.9 | 0.9 | – | 2.0 |
| 5.1–6.0 | 1.0 | – | – | 7.1 |
| 6.1–7.0 | 2.5 | – | – | 14.4 |
| 7.1–8.0 | 4.2 | 0.9 | – | 11.2 |
| 8.1–9.0 | 7.6 | – | – | 11.2 |
| 9.1–10.0 | 23.9 | 0.9 | – | 7.1 |
| 10.1–11.0 | 16.8 | 4.5 | 3.6 | 6.1 |
| 11.1–12.0 | 1.7 | 10.7 | 7.1 | 4.1 |
| 12.1–13.0 | 1.0 | 6.5 | 3.6 | 3.1 |
| 13.1–14.0 | 1.1 | 3.4 | 7.1 | 7.1 |
| 14.1–15.0 | 3.3 | 2.0 | 21.4 | 3.1 |
| 15.1–16.0 | 6.4 | 0.9 | 17.9 | 5.1 |
| 16.1–17.0 | 7.7 | – | 28.6 | 10.2 |
| 17.1–18.0 | 6.9 | – | 7.1 | 2.0 |
| 18.1–19.0 | 2.9 | – | – | 3.1 |
| 19.1–20.0 | 2.0 | – | – | – |
| 20.1–21.0 | 0.6 | – | 3.6 | – |
| 21.1–22.0 | 0.4 | – | – | – |
| 22.1–23.0 | 0.1 | – | – | – |
| 23.1–24.0 | 0.1 | – | – | – |
| M ± SE | 11.25 ± 1.02 | 6.15 ± 0.23 | 15.17 ± 0.40 | 10.36 ± 0.42 |
Обнаруженные различия можно было бы отчасти объяснить разной уловистостью использованных орудий лова, но наиболее мелкая серебрянка была поймана тралом с ячеёй большего размера в сравнении с нашими орудиями лова. Учитывая, что особи рассматриваемого вида по мере роста смещаются в более глубокие горизонты (Hubold, Ekau, 1987; La Mesa, Eastman, 2011), можно было бы предположить связь поимок мелкой серебрянки (Liu, Chen, 1995) с обловом меньших глубин. Однако данные по глубине ловов в последней публикации отсутствуют.
Одной из наиболее реалистичных причин обсуждаемых различий представляется сложный жизненный цикл серебрянки со сменой биотопов в процессе онтогенеза. Сведения по её максимальному возрасту весьма противоречивы. По данным различных авторов, он составляет от 7 до 33 лет (Kock, 1992; Kailola et al., 1993; Radtke et al., 1993; La Mesa, Vacchi, 2001). Видам с высокой продолжительностью жизни и комплексной размерно-возрастной структурой, как правило, не свойственны существенные межгодовые колебания численности. Однако специфические условия окружающей среды, в которых протекает жизненный цикл серебрянки, обусловливают значительные флуктуации численности пополнения (Vacchi et al., 2017), что могло оказаться одной из причин преобладания молоди в уловах в декабре 1988 – марте 1989 гг. (Liu, Chen, 1995).
Несмотря на различия в диапазонах длины и массы тела серебрянки, вовлечённой в анализ LWR в разные годы, параметры уравнения рассматриваемой зависимости в наших и предшествующих исследованиях (Kunzmann, 1986; Artigues et al., 2003) оказались довольно близки (табл. 2), что, вероятно, объясняется теми же причинами, что и в отношении гимноскопела Брауэра.
Антарктический батилаг – антарктический циркумполярный вид, который распространён также в южных частях Атлантического, Индийского и Тихого океанов (Лисовенко и др., 1986; Gon, Heemstra, 1990). Наряду с антарктической электроной и гимноскопелом Брауэра является доминирующим видом среди антарктических мезопелагических рыб (Collins et al., 2012). Встречается на глубинах ≤ 4000 м. Максимальная численность отмечается глубже 300 м (White, Piatkowski, 1993), по другим данным, наиболее обычен на глубине > 500 м (Donnelly et al., 2004). Доминирует в пелагических сообществах на глубинах 200–2000 м (Moteki et al., 2009) или 400–1000 м (Collins et al., 2012). Максимальная известная стандартная длина самцов – 14 см, самок – 17 см (Gon, Heemstra, 1990), данные о массе тела в литературе отсутствуют.
Антарктический батилаг в наших уловах характеризовался довольно растянутым размерным рядом (табл. 3). Длина рыб варьировала в пределах 3.2–19.0 (в среднем 10.36 ± 0.42) см. Основу уловов составляли три размерные группы: 5.1–10.0 см (50.9%), 13.1–14.0 см (7.1%) и 16.1–17.0 см (10.2%), на которые совокупно пришлось 68.2% общей численности особей. Данные по размерному составу данного вида в литературе отсутствуют, что не позволяет провести какое-либо сравнение.
По коэффициенту b уравнение LWR для антарктического батилага (3.574) заметно выделяется среди других видов рыб (табл. 2), что характеризует специфическую форму его массивного тела, особенно у крупных особей. Максимальное зарегистрированное нами значение длины тела (19.0 см) существенно превышает известное из опубликованных источников (Gon, Heemstra, 1990). Данные по максимальной массе тела (89.0 г) представлены впервые.
Межвидовые сравнения с близкородственными видами
Нормальный диапазон значений b для рыб обычно находится в пределах 2.5–3.5 (Carlander, 1969). Диаграммы взаимосвязей линейного (a) и степенного (b) коэффициентов показывают (рис. 2), что их значения для исследованных видов мезопелагических рыб вод Антарктики не выходят за пределы известных данных (Binohlan, Pauly, 2000) для морских рыб разных частей Мирового океана.
Рис. 2.
Сравнение коэффициентов размерно-весовых зависимостей для: а – антарктического батилага Bathylagus an-tarcticus и 4 видa семейства Bathylagidae (7 выборок), б – антарктической серебрянки Pleuragramma antarcticum и 15 видов семейства Nototheniidae (55 выборок); в, г – соответственно антарктической электроны Electrona antarctica и гимноскопела Брауэра Gymnoscopelus braueri и видов семейства Myctophidae (26 видов, 34 выборки). (◇) – данные FishBase (Froese, Pauly, 2022), число прозрачных кружков соответствует числу выборок, один вид в анализе может быть представлен несколькими выборками; (◆) – наши данные, (- - -) – усреднённая линия точек пересечения коэффициентов a и b уравнения зависимости длина–масса рыб (LWR) для видов каждого семейства.
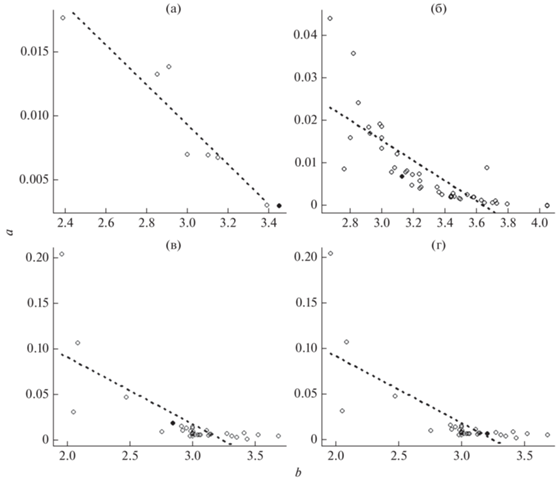
Значения коэффициентов a и b для антарктического батилага и гимноскопела Брауэра, по нашим данным, оказались выше тренда, представляющего усреднённую для этих коэффициентов линию на основе значений из базы данных FishBase соответственно для представителей семейств Bathylagidae и Myctophidae. В то же время рассчитанные нами индексы для антарктической электроны и антарктической серебрянки оказались ниже тренда, основанного на усреднённых данных для видов семейств Myctophidae и Nototheniidae. Дисперсия коэффициента a для конкретного коэффициента b в значительной степени зависит от формы тела рыбы (Kulbicki et al., 2005; Froese, 2006): если значение выше среднего, то форма тела рыбы стремится к сферической, если ниже среднего – к угревидной. Таким образом, исследованные нами особи антарктического батилага и гимноскопела Брауэра в сравнении со своими сородичами имеют более округлую форму, а экземпляры антарктической электроны и антарктической серебрянки – более вытянутую.
ЗАКЛЮЧЕНИЕ
Приходится констатировать, что, несмотря на циркумполярное распространение в водах Антарктики, высокую численность и доминирующее положение в пелагических рыбных сообществах региона, данные о размерно-весовых характеристиках антарктической электроны, гимноскопела Брауэра и антарктической серебрянки остаются фрагментарными, ограничены атлантическим сектором Южного океана (преимущественно водами в районе Антарктического п-ова) и отсутствуют для других частей их обширных видовых ареалов. Подобные сведения в отношении антарктического батилага до сих пор отсутствовали, как, впрочем, и для многих других представителей семейства Bathylagidae, которое в Мировом океане представлено 23 видами в восьми родах (Froese, Pauly, 2022). Следует отметить, что для рыб этого семейства данные о размерно-весовых характеристиках имеются только для четырёх наиболее массовых видов из западной части Берингова моря (Orlov, Binohlan, 2009) и полностью отсутствует информация о росте и возрасте. Отрывочные сведения имеются лишь для личинок и молоди двух северотихоокеанских видов – охотского батилага Lipolagus ochotensis и серебрянки Leuroglossus schmidti – широко распространённых и многочисленных в Северо-Западной Пацифике мезопелагических рыб (Beamish et al., 1999; Orlov, Tokranov, 2019), для которых данные о росте основаны на изучении сезонных изменений длины тела (Mason, Phillips, 1985; Miya, 1995).
Сравнение данных LWR исследованных видов с опубликованными сведениями показало существенные различия как на внутривидовом, так и межвидовом уровнях. Эти различия могут быть связаны с принадлежностью рыб к разным популяциям, особенностями их физиологического состояния в разные сезоны года, степенью наполнения желудка и зрелостью гонад, полом и наличием заболеваний (Li et al., 2013; Hossain et al., 2015; Tobes et al., 2016).
Отсутствие или ограниченность сведений о размерном и весовом составах, возрасте и росте многих видов морских рыб (Froese, Pauly, 2022), включая большинство мезопелагических, даже доминирующих в разных районах Мирового океана, препятствует их достоверной количественной оценке, расчётам различных популяционных характеристик, изучению внутривидовой организации и, в конечном счёте, получению целостного представления об их роли и месте в морских экосистемах.
Список литературы
Беккер В.Э. 1983. Миктофовые рыбы Мирового океана. М.: Наука, 247 с.
Винберг Г.Г. 1971. Линейные размеры и масса тела животных // Журн. общ. биологии. Т. 32. № 6. С. 714–723.
Иванов О.А. 2017. Смена парадигм в управлении рыболовством: от концепции к реализации? // Изв. ТИНРО. Т. 190. С. 3–17. https://doi.org/10.26428/1606-9919-2017-190-75-81
Курносова А.С., Сомов А.А., Канзепарова А.Н. и др. 2022. Мезопелагический микронектон и макропланктон и условия его обитания в северо-восточной Пацифике // Океанология. Т. 62. № 1. С. 85–97. https://doi.org/10.31857/S0030157422010075
Лисовенко Л.А., Андрианов Д.П., Кобылянский С.Г. 1986. Восстановление валидности и материалы по размножению Bathylagus gracilis Lönnberg (Bathylagidae, Salmoniformes) // Тр. ИО АН СССР. Т. 121. С. 215–227.
Мина М.В., Клевезаль Г.А. 1976. Рост животных. М.: Наука, 291с.
Харенко Е.Н., Сопина А.В., Гриценко Е.А. 2019. Освоение запасов мезопелагиали – долгий путь исследований и поиска // Тр. ВНИРО. Т. 176. С. 41–50.
Anderson T.R., Martin A.P., Lampitt R.S. et al. 2019. Quantifying carbon fluxes from primary production to mesopelagic fish using a simple food web model // ICES J. Mar. Sci. V. 76. № 3. P. 690–701. https://doi.org/10.1093/icesjms/fsx234
Andriashev A.P. 1965. A General Review of the Antarctic Fish Fauna // Biogeography and Ecology in Antarctica. Dordrecht: Springer. P. 491–550. https://doi.org/10.1007/978-94-015-7204-0_15
Artigues B., Morales-Nin B., Balguerías E. 2003. Fish length-weight relationships in the Weddell Sea and Bransfield Strait // Polar Biol. V. 26. № 7. P. 463–467. https://doi.org/10.1007/s00300-003-0505-0
Beamish R.J., Leask K.D., Ivanov O.A. et al. 1999. The ecology, distribution, and abundance of midwater fishes of the Subarctic Pacific gyres // Prog. Oceanogr. V. 43. № 2–4. P. 399–442. https://doi.org/10.1016/S0079-6611(99)00017-8
Binohlan C., Pauly D. 2000. The length–weight table // FishBase 2000: concepts, design and data sources. Manila: ICLARM. P. 131–134.
Boettiger C., Lang D.T., Wainwright P.C. 2012. rfishbase: exploring, manipulating and visualizing FishBase data from R // J. Fish Biol. V. 81. № 6. P. 2030–2039. https://doi.org/10.1111/j.1095-8649.2012.03464.x
Bouchard C., Mollard S., Suzuki K. et al. 2016. Contrasting the early life histories of sympatric Arctic gadids Boreogadus saida and Arctogadus glacialis in the Canadian Beaufort Sea // Polar Biol. V. 39. № 6. P. 1005–1022. https://doi.org/10.1007/s00300-014-1617-4
Carlander K.D. 1969. Handbook of freshwater fishery biology. V. 1. Life history data on freshwater fishes of the United States and Canada, exclusive of the Perciformes. Ames: ISU Press, 752 p.
Cherel Y., Bocher P., Trouve C., Weimerskirch H. 2002. Diet and feeding ecology of blue petrels Halobaena caerulea at Iles Kerguelen, Southern Indian Ocean // Mar. Ecol. Prog. Ser. V. 228. P. 283–299. https://doi.org/10.3354/meps228283
Christiansen H., Dettai A., Heindler F.M. et al. 2018. Diversity of mesopelagic fishes in the Southern Ocean – a phylogeographic perspective using DNA barcoding // Front. Ecol. Evol. V. 6. Article 120. https://doi.org/10.3389/fevo.2018.00120
Collins M.A., Ross K.A., Belchier M., Reid K. 2007. Distribution and diet of juvenile Patagonian toothfish on the South Georgia and Shag Rocks Shelves (Southern Ocean) // Mar. Biol. V. 152. № 1. P. 135–147. https://doi.org/10.1007/s00227-007-0667-3
Collins M.A., Xavier J.C., Johnston N.M. et al. 2008. Patterns in the distribution of myctophid fish in the northern Scotia Sea ecosystem // Polar Biol. V. 31. № 7. P. 837–851. https://doi.org/10.1007/s00300-008-0423-2
Collins M.A., Stowasser G., Fielding S. et al. 2012. Latitudinal and bathymetric patterns in the distribution and abundance of mesopelagic fish in the Scotia Sea // Deep-Sea Res. II: Top. Stud. Oceanogr. V. 59–60. P. 189–198. https://doi.org/10.1016/j.dsr2.2011.07.003
Donnelly J., Torres J.J., Sutton T.T., Simoniello C. 2004. Fishes of the eastern Ross Sea, Antarctica // Polar Biol. V. 27. № 11. P. 637–650. https://doi.org/10.1007/s00300-004-0632-2
Dutta S., Orlov A., Hazra S. 2021. Population biology and exploitation status of four commercially important marine fishes of the northern Bay of Bengal, India // Iran. J. Fish. Sci. V. 20. № 1. P. 62–83. https://doi.org/10.22092/ijfs.2021.123477
Fisher W., Hureau J.C. (eds.). 1985. FAO species identification sheets for fisheries purposes. Southern Ocean (Fishing areas 45, 58 and 88). Prepared and published with the support of the Commission for the Conservation of Antarctic Marine Living Resources. V. 2. Rome: FAO. P. 233–470.
Froese R. 2006. Cube law, condition factor and weight–length relationships: history, meta-analysis and recommendations // J. Appl. Ichthyol. V. 22. № 4. P. 241–253. https://doi.org/10.1111/j.1439-0426.2006.00805.x
Froese R., Pauly D. (eds.) 2022. FishBase. World Wide Web electronic publication. (www.fishbase.org. Version 02/2022).
Froese R., Tsikliras A.C., Stergiou K.I. 2011. Editorial note on weight-length relations of fishes // Acta Ichthyol. Piscat. V. 41. № 4. P. 261–263. https://doi.org/10.3750/AIP2011.41.4.01
Gjøsaeter J., Kawaguchi K. 1980. A review of the world resources of mesopelagic fish // FAO Fish. Tech. Pap. № 193. 151 p.
Gon O., Heemstra P.C. (eds.). 1990. Fishes of the Southern Ocean. Grahamstown: J.L.B. Smith Inst. Ichthyol., 462 p.
Greely T.M., Gartner J.V. Jr., Torres J.J. 1999. Age and growth of Electrona antarctica (Pisces: Myctophidae), the dominant mesopelagic fish of the Southern Ocean // Mar. Biol. V. 133. № 1. P. 145–158. https://doi.org/10.1007/s002270050453
Hempel G. 1985. Antarctic marine food webs // Antarctic Nutrient Cycles. Berlin: Springer. P. 266–276.
Hossain M.Y., Sayed S.R.M., Mosaddequr R.M. et al. 2015. Length-weight relationships of nine fish species from the Tetulia River, southern Bangladesh // J. Appl. Ichthyol. V. 31. № 5. P. 967–969. https://doi.org/10.1111/jai.12823
Hubold G., Ekau W. 1987. Midwater fish fauna of the Weddell Sea, Antarctica // Proc. 5th Congress of European Ichthyologists. Stockholm: Swedish Mus. Nat. Hist. P. 391–396.
Irigoien X., Klevjer T.A., Rostad A. et al. 2014. Large mesopelagic fishes biomass and trophic efficiency in the open ocean // Nat. Commun. V. 5. Article 3271. https://doi.org/10.1038/ncomms4271
Kailola P.J., Williams M.J., Stewart P.C. et al. 1993. Australian fisheries resources. Canberra: Bureau of Resource Sciences, 422 p.
Kobyliansky S.G., Orlov A.M., Gordeeva N.V. 2010. Composition of deepsea pelagic ichthyocenes of the Southern Atlantic, from waters of the range of the Mid-Atlantic and Walvis Ridges // J. Ichthyol. V. 50. № 10. P. 932–949. https://doi.org/10.1134/S0032945210100036
Kock K.-H. 1985. Antarctic fish // Key environments. Oxford: Pergamon Press. P. 173–192.
Kock K.-H. 1992. Antarctic Fish and Fisheries. Cambridge: CUP, 359 p.
Kock K.-H., Jones C.D., Wilhelms S. 2000. Biological characteristics of the Antarctic fish stocks in the Southern Scotia arc region // CCAMLR Sci. V. 7. P. 1–41.
Kulbicki M., Guillemot N., Amand N. 2005. A general approach to length–weight relationships for New Caledonian lagoon fishes // Cybium. V. 29. P. 235–252.
Kunzmann A. 1986. Kiemenmorphometrie von zwei antarktischen fischarten Pleurogramma antarcticum and Notothenia gibberifrons. Ph.D. thesis. Kiel: Kiel Univ., 84 p. (in German).
La Mesa M., Vacchi M. 2001. Age and growth of high Antarctic notothenioid fish // Antarct. Sci. V. 13. № 3. P. 227–235. https://doi.org/10.1017/S0954102001000335
La Mesa M., Eastman J.T. 2011. Antarctic silverfish: life strategies of a key species in the high-Antarctic ecosystem // Fish Fish. V. 13. № 3. P. 241–266. https://doi.org/10.1111/j.1467-2979.2011.00427.x
La Mesa M, Catalano B., Russo A. et al. 2010. Influence of environmental conditions on spatial distribution and abundance of early life stages of Antarctic silverfish, Pleuragramma antarcticum (Nototheniidae), in the Ross Sea // Antarct. Sci. V. 22. № 3. P. 243–254. https://doi.org/10.1017/S0954102009990721
Lancraft T.M., Torres J.J., Hopkins T.L. 1989. Micronekton and macrozooplankton in the open waters near Antarctic Ice Edge Zones (AMERIEZ 1983 and 1986) // Polar Biol. V. 9. № 4. P. 225–233. https://doi.org/10.1007/BF00263770
Lauritano C., Martínez K.A., Battaglia P. et al. 2020. First evidence of anticancer and antimicrobial activity in Mediterranean mesopelagic species // Sci. Rep. V. 10. Article 4929. https://doi.org/10.1038/s41598-020-61515-z
Le Cren E.D. 1951. The length-weight relationship and seasonal cycle in gonad weight and condition in the perch (Perca fluviatilis) // J. Anim. Ecol. V. 20. № 2. P. 201–219. https://doi.org/10.2307/1540
Li Q., Xu R., Huang J. 2013. Length-weight relations for 20 fish species from the Pearl River, China // Acta Ichthyol. Piscat. V. 43. № 1. P. 65–69. https://doi.org/10.3750/AIP2013.43.1.09
Linkowski T.B. 1985. Population biology of the myctophid fish Gymnoscopelus nicholsi (Gillbert, 1911) from the western South Atlantic // J. Fish Biol. V. 27. № 6. P. 683–689. https://doi.org/10.1111/j.1095-8649.1985.tb03213.x
Linkowski T.B. 1987. Age and growth of four species of Electrona (Teleostei, Myctophidae) // Proc. 5th Congress of European Ichthyologists. Stockholm: Swedish Mus. Nat. Hist. P. 435–442.
Liu Q., Chen D.-G. 1995. Length frequency analysis of Pleuragramma antarcticum, Electrona antarctica, Protomyctophum bolini // Chin. J. Ocean. Limnol. V. 13. № 4. P. 380–384. https://doi.org/10.1007/BF02889475
Mason J.C., Phillips A.C. 1985. Biology of the bathylagid fish, Leuroglossus schmidti, in the Strait of Georgia, British Columbia, Canada // Can. J. Fish. Aquat. Sci. V. 42. № 6. P. 1144–1153. https://doi.org/10.1139/f85-141
Miya M. 1995. Some aspects of the biology of Bathylagus ochotensis (Pisces: Bathylagidae) in Sagami Bay, central Japan // Bull. Mar. Sci. V. 56. № 1. P. 173–184.
Moteki M., Horimoto N., Nagaiwa R. et al. 2009. Pelagic fish distribution and ontogenetic vertical migration in common mesopelagic species off Lützow-Holm Bay (Indian Ocean sector, Southern Ocean) during austral summer // Polar Biol. V. 32. № 10. P. 1461–1472. https://doi.org/10.1007/s00300-009-0643-0
Moteki M., Fujii K., Amakasu K. et al. 2017. Distributions of larval and juvenile/adult stages of the Antarctic myctophid fish, Electrona antarctica, off Wilkes Land in East Antarctica // Polar Sci. V. 12. P. 99–108. https://doi.org/10.1016/j.polar.2017.02.004
Nicholson M.D., Jennings S. 2004. Testing candidate indicators to support ecosystem-based management: the power of monitoring surveys to detect temporal trends in fish community metrics // ICES J. Mar. Sci. V. 61. № 1. P. 35–42. https://doi.org/10.1016/j.icesjms.2003.09.004
Ogle D.H. 2011. FSA: fisheries stock analysis. R package version 0.4.30 (http://www.rforge.net/FSA. Version 03/2022).
Olsson O., North A.W. 1997. Diet of the King Penguin Aptenodytes patagonicus during three summers at South Georgia // Ibis. V. 139. № 3. P. 504–512. https://doi.org/10.1111/j.1474-919X.1997.tb04666.x
Orlov A., Binohlan C. 2009. Length-weight relationships of deep-sea fishes from the western Bering Sea // J. Appl. Ichthyol. V. 25. № 2. P. 223–227. https://doi.org/10.1111/j.1439-0426.2009.01215.x
Orlov A.M., Rabazanov N.I. 2019. Past, present and future of deep-sea fisheries in the global oceans // Mod. App. Ocean. Pet. Sci. V. 3. № 2. P. 255–257. https://doi.org/10.32474/MAOPS.2019.03.000157
Orlov A.M., Tokranov A.M. 2019. Checklist of deep-sea fishes of the Russian northwestern Pacific Ocean found at depths below 1000 m // Prog. Oceanogr. V. 176. Article 102143. https://doi.org/10.1016/j.pocean.2019.102143
Pakhomov E.A., Perissinotto R., McQuaid C.D. 1996. Prey composition and daily rations of myctophid fishes in the Southern Ocean // Mar. Ecol. Prog. Ser. V. 134. P. 1–14. https://doi.org/10.3354/meps134001
Paoletti S., Nielsen J.R., Sparrevohn C.R. et al. 2021. Potential for mesopelagic fishery compared to economy and fisheries dynamics in current large scale Danish pelagic fishery // Front. Mar. Sci. V. 8. Article 720897. https://doi.org/10.3389/fmars.2021.720897
Pauly D., Piroddi C., Hood L. et al. 2021. The biology of mesopelagic fishes and their catches (1950–2018) by commercial and experimental fisheries // J. Mar. Sci. Eng. V. 9. № 10. Article 1057. https://doi.org/10.3390/jmse9101057
Pusch C., Hulley P.A., Kock K.-H. 2004. Community structure and feeding ecology of mesopelagic fishes in the slope waters of King George Island (South Shetland Islands, Antarctica) // Deep-Sea Res. I: Oceanogr. Res. Pap. V. 51. № 11. P. 1685–1708. https://doi.org/10.1016/j.dsr.2004.06.008
R Core Team. 2020. R: A language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, Austria. (http://www.r-project.org/index.html. Version 03/2022).
Radchenko V.I. 2007. Mesopelagic fish community supplies “biological pump” // Raffles Bull. Zool. Suppl. 14. P. 265–271.
Radtke R.L., Hubold G., Folsom S.D., Lenz P.H. 1993. Otolith structural and chemical analyses: the key to resolving age and growth of the Antarctic silverfish, Pleuragramma antarcticum // Antarct. Sci. V. 5. № 1. P. 51–62. https://doi.org/10.1017/S0954102093000082
Reid K., Arnould J.P.Y. 1996. The diet of Antarctic fur seals Arctocephalus gazella during the breeding season at South Georgia // Polar Biol. V. 16. № 2. P. 105–114. https://doi.org/10.1007/BF02390431
Ricker W.E. 1973. Linear regressions in fishery research // J. Fish. Res. Bd. Canada. V. 30. № 3. P. 409–434. https://doi.org/10.1139/f73-072
Rodhouse P.G., White M.G., Jones M.R.R. 1992. Trophic relations of the cephalopod Martialia hyadesi (Teuthoidea: Ommastrephidae) at the Antarctic Polar Front, Scotia Sea // Mar. Biol. V. 114. № 3. P. 415–421. https://doi.org/10.1007/BF00350032
Rowedder U. 1979. Some aspects of the biology of Electrona antarctica (Günther, 1878) (Family Myctophidae) // Meeresforsch. V. 27. P. 244–251.
Santos M.N., Gaspar M.B., Vasconcelos P., Monteiro C.C. 2002. Weight–length relationships for 50 selected fish species of the Algarve coast (southern Portugal) // Fish. Res. V. 59. № 1–2. P. 289–295. https://doi.org/10.1016/S0165-7836(01)00401-5
Saunders R.A., Collins M.A., Stowasser G., Tarling G.A. 2017. Southern Ocean mesopelagic fish communities in the Scotia Sea are sustained by mass immigration // Mar. Ecol. Prog. Ser. V. 569. P. 173–185. https://doi.org/10.3354/meps12093
Saunders R.A., Collins M.A., Shreeve R. et al. 2018. Seasonal variation in the predatory impact of myctophids on zooplankton in the Scotia Sea (Southern Ocean) // Prog. Oceanogr. V. 168. P. 123–144. https://doi.org/10.1016/j.pocean.2018.09.017
Saunders R.A., Lourenço S., Vieira R.P. et al. 2019. Age and growth of Brauer’s lanternfish Gymnoscopelus braueri and rhombic lanternfish Krefftichthys anderssoni (Family Myctophidae) in the Scotia Sea, Southern Ocean // J. Fish Biol. V. 96. № 2. P. 364–377. https://doi.org/10.1111/jfb.14206
Shin Y.-J., Rochet M.-J., Jennings S. et al. 2005. Using size-based indicators to evaluate the ecosystem effects of fishing // ICES J. Mar. Sci. V. 62. № 3. P. 384–396. https://doi.org/10.1016/j.icesjms.2005.01.004
Shreeve R.S., Collins M.A., Tarling G.A. et al. 2009. Feeding ecology of myctophid fishes in the northern Scotia Sea // Mar. Ecol. Prog. Ser. V. 386. P. 221–236. https://doi.org/10.3354/meps08064
Sokal R.R., Rohlf F.J. 1987. Introduction to Biostatistics. Mineola: Dover Publ., 363 p.
St. John M.A., Borja A., Chust G. et al. 2016. A dark hole in our understanding of marine ecosystems and their services: Perspectives from the mesopelagic community // Front. Mar. Sci. V. 3. Article 31. https://doi.org/10.3389/fmars.2016.00031
Tobes I., Miranda R., Pino-del-Carpio A. et al. 2016. Length-weight relationships of freshwater fishes of the Alto Madre de Dios River (Manu Biosphere Reserve, Peru) // J. Appl. Ichthyol. V. 32. № 6. P. 1256–1258. https://doi.org/10.1111/jai.13172
Vacchi M., Pisano E., Ghigliotti L. (eds.). 2017. The Antarctic silverfish: a keystone species in a changing ecosystem. Cham: Springer Int. Publ., 314 p. https://doi.org/10.1007/978-3-319-55893-6
White M.G., Piatkowski U. 1993. Abundance, horizontal and vertical distribution of fish in eastern Weddell Sea micronekton // Polar Biol. V. 13. № 1. P. 41–53. https://doi.org/10.1007/BF00236582
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


