Известия РАН. Серия биологическая, 2019, № 1, стр. 31-37
Общие и специфические черты организации желточного синцитиального слоя Teleostei на примере Gasterosteus aculeatus
Е. А. Кондакова a, *, В. И. Ефремов a, В. В. Козин a
a Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: 23eak@mail.ru
Поступила в редакцию 14.05.2018
После доработки 31.07.2018
Принята к публикации 31.07.2018
Аннотация
Гистологическими методами изучена структура желточного синцитиального слоя (ЖСС) поздних зародышей и личинок трехиглой колюшки Gasterosteus aculeatus. Показано, что организация ЖСС этого вида характеризуется чертами, как общими для костистых рыб (структурная регионализация, крупные полиморфные ядра, окружение жировых капель ЖСС), так и специфическими, связанными с процессом усвоения желтка. Обобщены собственные и опубликованные данные о многообразии организации ЖСС костистых рыб. Сопоставлены ЖСС и другие структуры, осуществляющие метаболизм желтка у зародышей разных групп животных.
Желточный синцитиальный слой (ЖСС) – это провизорная структура зародышей и личинок животных с меробластическим типом развития (головоногих моллюсков, миксин, хрящевых рыб, панцирникообразных и костистых рыб). Ассимилирующие желток системы можно подразделить на несколько типов: желточные синцитии (включая ЖСС), вителлофаги (находящиеся в толще желтка клетки или энергиды, “желточные ядра”, которые в ходе развития целлюляризуются), желточная энтодерма (имеется у анамний с голобластическим типом развития и рептилий, но различается по способу образования и структуре), желточный эпителий. Они могут иметь энтодермальную, реже мезодермальную природу или формироваться до образования зародышевых листков. Многие из этих структур состоят из клеток, имеющих более одного ядра (желточный эпителий птиц и питающая энтодерма), имеют полиплоидные ядра (вителлофаги). Симпласт с полиплоидными ядрами – один из наиболее распространенных вариантов организации “внезародышевой” системы, выполняющей трофическую функцию (Кнорре, 1971; Pétavy, 1985; Иванова-Казас, 1995; Baud et al., 2002; Kimble et al., 2002; Stewart et al., 2012; Karadge, Elinson, 2013; Elinson, Stewart, 2014; Kondakova et al., 2016; Powers, Blackburn, 2017).
ЖСС костистых рыб формируется на стадии бластулы вследствие исключения цитокинеза у краевых клеток бластодермы и регрессии их предсуществующих мембран (Chu et al., 2012; Takesono et al., 2012). ЖСС представляет собой симпласт с многочисленными ядрами различных форм и уровней плоидности, расположенный в виде слоя на периферии желточной сферы (yolk sphere) и содержащий также тонкий желточный цитоплазматический слой, собственно желток и жировые капли (если представлены) (Fuentes, Fernández, 2010). После завершения эпиболии совокупность ЖСС, желтка и жировых капель, на наш взгляд, правомерно называть “желточным комплексом” (yolk complex), поскольку его форма во многих случаях отличается от сферической. Желточный мешок (ЖМ) костистых рыб лишен энтодермального эпителия, а желточный комплекс не является компонентом пищеварительной системы, хотя между ЖСС и печенью на относительно поздних стадиях развития происходит интенсивное взаимодействие (Kunz, 2004; Kondakova et al., 2016, 2017a; Кондакова и др., 2017).
В развитии костистых рыб ЖСС выполняет трофическую (метаболизм желтка, транспорт ионов и низкомолекулярных соединений из желтка) и морфогенетическую функции: участок ЖСС функционирует как центр Ньюкупа, ЖСС необходим для спецификации энтодермы и вентролатеральной мезодермы, развития пищеварительной и сердечно-сосудистой систем и других структур. ЖСС активно участвует в эпиболии. В ЖСС синтезируются некоторые участники реакций врожденного иммунитета.
Костистые рыбы – многочисленная и наиболее разнообразная группа позвоночных животных (не менее 30 тыс. видов), обитающая в пресных и соленых водах всех климатических зон. Одна из предпосылок этого эволюционного успеха – пластичность структуры обособленно-желтковых яиц, обусловливающая меробластический тип развития. У представителей этой группы варьируют процессы образования одних и тех же структур, что определяет разнообразие особенностей анатомии и физиологии. Опубликованные данные свидетельствуют о вариациях в организации ЖСС у различных видов. В связи с этим возникает вопрос о консерватизме и разнообразии организации ЖСС у костистых рыб, принадлежащих к разным систематическим группам и обитающих в разных условиях. Эти вопросы связаны с проблемой разнообразия провизорных систем, процессы развития и морфология которых могут быть значительно более вариабельными, чем таковые у развивающихся дефинитивных органов (Соин, 1981; Иванова-Казас, 1995; Long, Ballard, 2001; Enders, 2009; Carvalho, Heisenberg, 2010; Finn, Fyhn, 2010; Lepage, Bruce, 2010; Broughton et al., 2013; Glasauer, Neuhauss, 2014; Godard et al., 2014; Bruce, 2016; Kondakova et al., 2016). Ранее нами была исследована организация ЖСС на гистологическом уровне у представителей карпообразных и сиговых рыб (у Danio rerio также на ультраструктурном уровне) (Kondakova, Efremov, 2014a, b; Kondakova et al., 2016, 2017a, b; Кондакова и др., 2017).
Трехиглая колюшка Gasterosteus aculeatus (сем. Gasterosteidae) рассматривается как новый модельный объект многих областей биологии; активно используется в экологических работах, исследованиях в областях генетики популяций и эволюционной биологии (Kiefer, 2006; Terekhanova et al., 2014). В связи с этим важно охарактеризовать особенности морфологии в нормальном развитии представителей этого вида.
Цель работы – изучение желточного комплекса у поздних зародышей и в начале личиночного периода G. aculeatus в рамках сравнительно-морфологического исследования ЖСС костистых рыб.
МАТЕРИАЛЫ И МЕТОДЫ
Икра G. aculeatus была собрана в окрестностях Морской биологической станции СПбГУ (Кандалакшский зал., Белое море) на литорали островов Большой Горелый и Кереть в конце июня–начале июля 2015 г. Икра и личинки развивались при 10–18°С. Поздних зародышей (со стадии 22 (Swarup, 1958)) и личинок (n = 12, где n – число индивидов) фиксировали жидкостью Буэна. Материал отмывали от фиксатора в 70-градусном этиловом спирте, обезвоживали в спиртах восходящей концентрации и заливали в парапласт (Leica, Германия, температура плавления 56°C) в соответствии со стандартной процедурой. Серийные поперечные, парасагиттальные и фронтальные срезы толщиной 5–7 мкм были получены с помощью санного микротома в ресурсном центре “Развитие молекулярных и клеточных технологий” (РМиКТ) СПбГУ. Срезы окрашивали гематоксилином Карацци с эозином. Фотографирование препаратов осуществлялось в РЦ РМиКТ СПбГУ с помощью микроскопа Leica DMI6000 (Leica, Германия). Для обработки изображений была использована программа Adobe Photoshop 7.0.
Для морфометрии срезы фотографировали с помощью микроскопa Leica DMI6000 в РЦ РМиКТ СПбГУ. Для измерений применяли программы Leica LAS Core и Fiji (Schindelin et al., 2012). Диаметры или длины ядер ЖСС (n = 84, где n – число ядер) и диплоидных ядер (ядра клеток кишечного эпителия, n = 200) измеряли на парасагиттальных и сагиттальных срезах. Чтобы минимизировать риск повторного измерения одного ядра между измеряемыми срезами оставляли не менее 10 срезов. Все данные представлены как среднее ± стандартная ошибка среднего.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В развитии G. aculeatus сетью сосудов покрывается вся поверхность ЖМ. Пульсация сердца, эритроцитарное кровообращение и циркуляция крови в сосудах ЖМ начинаются на стадии 21 эмбрионального развития (Swarup, 1958).
Гистологическое исследование выявило общие для всех костистых рыб и специфические черты организации ЖСС G. aculeatus. Для желточной сферы G. aculeatus характерны жидкий желток и жировые капли. В передней области желточного комплекса G. aculeatus имеется несколько жировых капель разного размера, в том числе крупных (рис. 1 и 2а–г). Каждая из них окружена ЖСС; в цитоплазматической прослойке между массой желтка и жировой каплей можно видеть ядра. Некоторые участки цитоплазмы ЖСС, окружающей жировые капли, а также на границе между областями вокруг жировых капель и желтка, выглядят исчерченными (рис. 1). Подобная, но более выраженная поперечная исчерченность отмечена у сиговых (Kondakova et al., 2017a) и Hypomesus olidus (Yamada, 1959).
Рис. 1.
Организация желточного синцитиального слоя (ЖСС) поздних зародышей Gasterosteus aculeatus. Окраска гематоксилином Карацци с эозином; поперечные срезы. а – крупная жировая капля (ЖК), отделенная ЖСС от желтка; б – ЖК, отделенная ЖСС от желтка; в – крупная и небольшая (звездочка) ЖК. Наконечники стрелок – поперечная исчерченность цитоплазмы ЖСС. С ЖСС контактируют кровеносные сосуды, сеть которых покрывает ЖМ. Желточные включения в цитоплазме ЖСС редки. Ж – желток, ЖВ – желточное включение, КС – кровеносный сосуд, Я – ядро ЖСС. Масштаб: 200 (а) и 100 мкм (б, в).
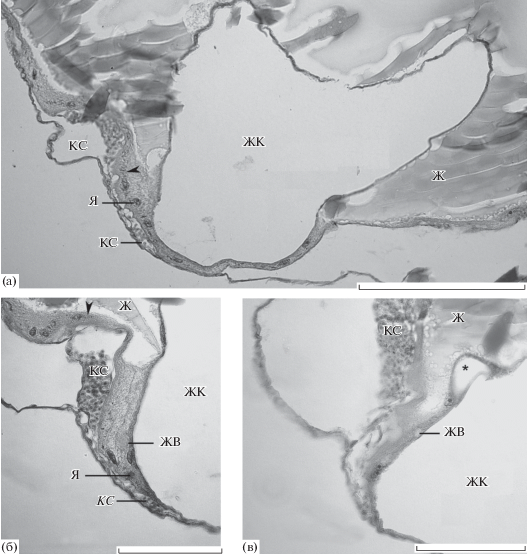
Рис. 2.
Организация желточного синцитиального слоя (ЖСС) личинок Gasterosteus aculeatus. Окраска гематоксилином Карацци с эозином. а – передняя область желточного комплекса личинки; фронтальный срез; жировые капли (ЖК) разного размера, окруженные цитоплазмой ЖСС. б – передняя область желточного комплекса личинки; парасагиттальный срез; две крупные ЖК, отделенные от желтка. в, г – передняя область желточного комплекса личинки; парасагиттальные срезы на двух уровнях. д – вентральная область ЖСС личинки; ассимиляция желтка. Наконечник стрелки – слабо окрашенные фрагменты желтка. Ж – желток, КС – кровеносный сосуд, ПК – передняя кишка, ПЧ – печень, С – сердце, Я – ядро ЖСС. Масштаб: 100 (а, б, д) и 200 мкм (в, г).
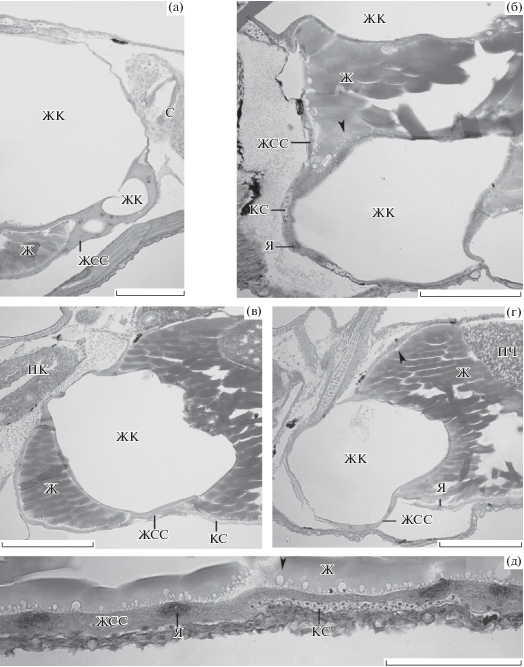
У G. aculeatus поглощение и метаболизм желтка происходят своеобразно. Множество отделившихся от единой эозинофильной массы желтка округлых фрагментов, контактирующих с базальной поверхностью ЖСС, окрашиваются эозином очень слабо (рис. 2б, г, д). Большое количество таких фрагментов прилежит к вентральной области ЖСС (рис. 2д). Количество эозинофильных желточных включений в цитоплазме ЖСС минимально (рис. 1). У других видов фрагменты желтка и желточные включения остаются эозинофильными. Наблюдаемые картины позволяют предположить, что стадии лизиса желтка, которые у других видов рыб проходят в цитоплазме ЖСС, у G. aculeatus – в основном на границе желтка и ЖСС. Апикобазальная поляризация ЖСС не отмечена.
Подразделение желточного комплекса на два компартмента, когда ЖСС образует прослойку между желтком и запасом липидов, было описано у зародышей и личинок рыб, например Stizostedion lucioperca, имеющих в массе желтка крупную жировую каплю. У муксуна на стадиях сомитогенеза жировые капли распределены в массе желтка. ЖСС окружает те из них, которые прилежат к нему. В ходе развития сиговых большинство жировых капель сливается в одну, расположенную в передней части желточного комплекса. Цитоплазматическая прослойка между массой желтка и жировой каплей, по всей вероятности, остается незамкнутой (Mani-Ponset et al., 1994, 1996; Poupard et al., 2000; Ostaszewska, 2005; Kondakova et al., 2016, 2017a; Кондакова и др., 2017).
Таким образом, для ЖСС G. aculeatus характерна структурная регионализация, связанная с разделением функций между его участками (метаболизм желтка и метаболизм липидов). Всем исследованным видам костистых рыб свойственны различия в структуре отдельных участков ЖСС. Они обусловлены организацией яиц и взаимодействием с прилежащими к ЖСС структурами. На личиночных стадиях это, в первую очередь, кровеносные сосуды желточного мешка. Согласно собственным и опубликованным данным структурная регионализация наблюдается, начиная с ранних стадий развития (бластула), и выражается в различиях по распределению желточных включений, длине и густоте микроворсинок апикальной поверхности, особенностям и распределению органелл (например, у Pleuronectes platessa), некоторым морфологическим характеристикам цитоплазмы, таким как исчерченность и апикобазальная зональность (Skjarven, et al., 2003; Kondakova, Efremov, 2014a, b; Kondakova et al., 2016, 2017a, b).
Желточный комплекс личинок G. aculeatus смещен латерально по отношению к кишке (рис. 3а) и имеет сложную форму с небольшими выростами, проникающими между соседними органами (рис. 2в, г). Между ЖСС и печенью находится тонкий слой соединительной ткани. Как и у большинства других изученных видов, толщина ЖСС G. aculeatus неодинакова в разных участках ЖСС вдоль переднезадней и дорсовентральной осей. Она минимальна в области, прилежащей к кишке, что характерно для личинок всех исследованных нами костистых рыб: D. rerio, Cyprinus carpio (Cyprinidae) и четырех видов Coregonidae (Kondakova, Efremov, 2014a; Kondakova et al., 2016, 2017a; Кондакова и др., 2017).
Рис. 3.
Особенности желточного синцитиального слоя (ЖСС) личинок Gasterosteus aculeatus. Окраска гематоксилином Карацци с эозином. а – положение желточного комплекса личинки; поперечный срез. б – полиморфные светлые ядра с заметными ядрышками в задней области ЖСС; парасагиттальный срез. Ж – желток, К – кишка, КС – кровеносный сосуд, М – меланофор, СМ – спинной мозг, Х – хорда, Я – ядро ЖСС. Масштаб: 200 (а) и 20 мкм (б).
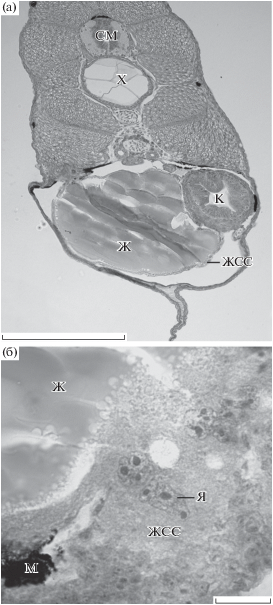
Ядра ЖСС G. aculeatus полиморфные с очень заметными крупными ядрышками (рис. 3б). Ядер исключительно сложных форм и гигантских размеров (>100 мкм длиной) (Кондакова и др., 2018; неопубликованные данные), как у сиговых рыб, на исследованных стадиях нами отмечено не было. Средняя длина ядер ЖСС личинок G. aculeatus составляет 15.57 ± 0.4 мкм, тогда как длина ядер клеток кишечного эпителия – 5.99 ± 0.05 мкм. Длина измеренных ядер ЖСС не превышала 32 мкм. ЖСС G. aculeatus, как и ЖСС представителей всех изученных нами видов, свойственны очень светлые ядра и ядра, содержащие большее количество гетерохроматина.
Наши и опубликованные данные свидетельствуют о фундаментальном единстве организации ЖСС костистых рыб: он представляет собой симпласт с полиморфными крупными ядрами, расположенный на периферии желточного комплекса. Как отмечено выше, аналогичные структуры возникали в процессе эволюции несколько раз, в том числе у беспозвоночных (головоногие моллюски). Распространенность организации провизорной системы, утилизирующей желток, в виде ЖСС свидетельствует о высокой эффективности этого типа структур. Тем не менее в строении ЖСС костистых рыб имеются вариабельные черты, в том числе видоспецифические.
ЗАКЛЮЧЕНИЕ
Охарактеризованы особенности структуры ЖСС G. aculeatus на поздних эмбриональных и личиночных стадиях развития. Для морфологии ЖСС G. aculeatus характерны консервативные, общие для большинства изученных костистых рыб черты: структурная регионализация ЖСС, неравномерность его толщины вдоль дорсовентральной и переднезадней осей, крупные полиморфные ядра. Окружение ЖСС жировых капель отмечается у зародышей и личинок рыб, принадлежащих к разным систематическим группам. Отличительная черта организации ЖСС G. aculeatus – способ утилизации желтка.
Исследование разнообразия организации ЖСС необходимо как для изучения биологии представителей отдельных таксонов, так и для понимания многих процессов и закономерностей, связанных с образованием и функционированием провизорных систем.
Авторы благодарят РЦ РМиКТ СПбГУ за возможность использования оборудования и УНБ Беломорская (МБС СПбГУ).
Работа выполнена при финансовой поддержке РФФИ (грант 16-34-00391) и СПбГУ (Мероприятие 4. “Модернизация материально-технического оснащения кафедры эмбриологии для изучения клеточных и молекулярных основ эмбрионального и постэмбрионального развития животных”).
Список литературы
Иванова-Казас О.М. Эволюционная эмбриология животных. СПб.: Наука, 1995. 565 c.
Кнорре А.Г. Эмбриональный гистогенез. Л.: Медицина, 1971. 432 с.
Кондакова Е.А., Богданова В.А., Ефремов В.И. Структура желточного синцитиального слоя Coregonus muksun на эмбриональных и личиночных стадиях развития // Лососевые рыбы. Биология, охрана и воспроизводство. Матер. междунар. конф. 18–22 сентября 2017 г. Петрозаводск: 2017. С. 85.
Кондакова Е.А., Ефремов В.И., Назаров В.А., Козин В.В., Неклюдова И.В., Богданова В.А. Характеристика ядер ЖСС в развитии костистых рыб // Сборник тезисов VI молодежной конференции по молекулярной и клеточной биологии Института цитологии РАН. СПб.; ИНЦ РАН, 2018. С. 57–58.
Соин С.Г. Новая классификация строения зрелых яиц рыб по соотношению количества желтка и ооплазмы // Онтогенез. 1981. Т. 12. № 1. С. 21–26.
Baud A., Barthélémy R.M., Nival S., Brunet M. Formation of the gut in the first two naupliar stages of Acartia clausi and Hemidiaptomus roubaui (Copepoda, Calanoida): comparative structural and ultrastructural aspects // Can. J. Zool. 2002. V. 80. № 2. P. 232–244.
Broughton R.E., Betancur R.R., Li C., Arratia G., Ortí G. Multi-locus phylogenetic analysis reveals the pattern and tempo of bony fish evolution // PLoS Curr. 2013. V. 5.
Bruce A.E.E. Zebrafish epiboly: Spreading thin over the yolk // Dev. Dyn. 2016. V. 245. № 3. P. 244–258.
Carvalho L., Heisenberg C.-P. The yolk syncytial layer in early zebrafish development // Trends Cell Biol. 2010. V. 20. № 10. P. 586–592.
Chu L.T., Fong S.H., Kondrychyn I., Loh S.L., Ye Z., Korzh V. Yolk syncytial layer formation is a failure of cytokinesis mediated by Rock1 function in the early zebrafish embryo // Biol. Open. 2012. V. 1. № 8. P. 747–753.
Elinson R.P., Stewart J.R. The corn snake yolk sac becomes a solid tissue filled with blood vessels and yolk-rich endodermal cells // Biol. Lett. 2014. V. 10. № 1. P. 20130870.
Enders A.C. Reasons for diversity of placental structure // Placenta. 2009. V. 30. P. 15–18.
Finn R.N., Fyhn H.J. Requirement for amino acids in ontogeny of fish // Aquac. Res. 2010. V. 41. № 5. P. 684–716.
Fuentes R., Fernández J. Ooplasmic segregation in the zebrafish zygote and early embryo: pattern of ooplasmic movements and transport pathways // Dev. Dyn. 2010. V. 239. P. 2172–2189.
Glasauer S.M.K., Neuhauss S.C.F. Whole–genome duplication in teleost fishes and its evolutionary consequences // Mol. Genet. Genom. 2014. V. 289. № 6. P. 1045–1060.
Godard B.G., Coolen M., Le Panse S., Gombault A., Ferreiro-Galve S., Laguerre L., Lagadec R., Wincker P., Poulain J., Da Silva C., Kuraku S., Carre W., Boutet A., Mazan S. Mechanisms of endoderm formation in a cartilaginous fish reveal ancestral and homoplastic traits in jawed vertebrates // Biol. Open. 2014. V. 3. № 11. P. 1098–1107.
Karadge U., Elinson R.P. Characterization of the nutritional endoderm in the direct developing frog Eleutherodactylus coqui // Dev. Genes Evol. 2013. V. 223. № 6. P. 351–362.
Kiefer J. C. Emerging developmental model systems // Dev. Dyn. 2006. V. 235. №. 10. P. 2895–2899.
Kimble M., Coursey Y., Ahmad N. Behavior of the yolk nuclei during embryogenesis, and development of the midgut diverticulum in the horseshoe crab Limulus polyphemus // Invert. Biol. 2002. V. 121. № 4. P. 365–377.
Kondakova E.A., Efremov V.I. Morphofunctional transformations of the yolk syncytial layer during zebrafish development // J. Morphol. 2014a. V. 275. P. 206–216.
Kondakova E.A., Efremov V.I. The ultrastructure of the larval zebrafish YSL // Book of abstracts, Heart of Europe: Zebrafish Meeting. 17–19 Sept. 2014, Warsaw. Warsaw: Int. Inst. Mol. Cell Biol., 2014b. P. 25.
Kondakova E.A., Efremov V.I., Bogdanova V.A. Structure of the yolk syncytial layer in the larvae of whitefishes: A histological study // Russ. J. Dev. Biol. 2017a. V. 48. № 3. P. 176–184.
Kondakova E.A., Efremov V.I., Nazarov V.A. Structure of the yolk syncytial layer in Teleostei and analogous structures in animals of the meroblastic type of development // Biol. Bull. 2016. V. 43. № 3. P. 208–215.
Kondakova E., Neklyudova I., Efremov V. The yolk syncytial layer of loach, Misgurnus fossilis (Teleostei) during early development // Zygote. 2017b. V. 25. № 4. P. 489–497.
Kunz Y.W. Developmental biology of Teleost fishes. Dublin: Springer, 2004. 636 p.
Lepage S.E., Bruce A.E. Zebrafish epiboly: mechanics and mechanisms // Int. J. Dev. Biol. 2010. V. 54. P. 1213–1228.
Long W.L., Ballard W.W. Normal embryonic stages of the longnose gar, Lepisosteus Osseus // BMC. Dev. Biol. 2001. V. 1:6.
Mani-Ponset L., Diaz J.P., Schlumberger O., Connes R. Development of yolk complex, liver and anterior intestine in pike-perch larvae, Stizostedion lucioperca (Percidae), according to the first diet during rearing // Aquat. Liv. Res. 1994. V. 7. № 3. P. 191–202.
Mani-Ponset L., Guyot E., Diaz J.P., Connes R. Utilization of yolk reserves during post-embryonic development in three teleostean species: the sea bream Sparus aurata, the sea bass Dicentrarchus labrax and the pike-perch Stizostedion lucioperca // Mar. Biol. 1996. V. 126. P. 539–547.
Ostaszewska T. Developmental changes of digestive system structures in pike-perch (Sander lucioperca L.) // Electron. J. Ichthyol. 2005. V. 2. P. 65–78.
Pétavy G. Origin and development of the vitellophags during embryogenesis of the migratory locust, Locusta migratoria L. (Orthoptera: Acrididae) // Int. J. Insect Morphol. Embryol. 1985. V. 14. № 6. P. 361–379.
Poupard G., André M., Durliat M. Apolipoprotein E gene expression correlates with endogenous lipid nutrition and yolk syncytial layer lipoprotein synthesis during fish development // Cell Tiss. Res. 2000. V. 300. № 2. P. 251–261.
Powers K.G., Blackburn D.G. Morphological specializations of the yolk sac for yolk processing in embryonic corn snakes (Pantherophis guttatus: Colubridae) // J. Morphol. 2017. V. 278. № 6. P. 768–779.
Schindelin J., Arganda-Carreras I., Frise E., Kaynig V., Longair M., Pietzsch T., Preibisch S., Rueden C., Saalfeld S., Schmid B., Tinevez J.Y., White D.J., Hartenstein V., Eliceiri K., Tomancak P., Cardona A. Fiji: an open–source platform for biological-image analysis // Nat. Methods. 2012. V. 9. № 7. P. 676–682.
Skjarven, K.H., Finn R.N., Kryvi H., Fyhn H.J. Yolk resorption in developing plaice (Pleuronectes platessa) // The big fish bang. Proceedings of the 26th annual larval fish conference. Bergen: Inst. Mar. Res. 2003. P. 193–209.
Stewart J.R., Russell K.J., Thompson M.B. Development of yolk sac and chorioallantoic membranes in the Lord Howe Island skink, Oligosoma lichenigerum // J. Morphol. 2012. V. 273. № 10. P. 1163–1184.
Swarup H. Stages in the development of the stickleback Gasterosteus aculeatus (L.) // Development. 1958. V. 6. № 3. P. 373–383.
Takesono A., Moger J., Farooq S., Cartwright E., Dawid I.B., Wilson S.W., Kudoh T. Solute carrier family 3 member2 (Slc3a2) controls yolk syncytial layer (YSL) formation by regulating microtubule networks in the zebrafish embryo // Proc. Natl Acad. Sci. USA. 2012. V. 109. № 9. P. 3371–3376.
Terekhanova N.V., Logacheva M.D., Penin A.A., Neretina T.V., Barmintseva A.E., Bazykin G. A., Kondrashov A.S., Mugue N.S. Fast evolution from precast bricks: genomics of young freshwater populations of threespine stickleback Gasterosteus aculeatus // PLoS Genet. 2014. V. 10. № 10. P. e1004696.
Yamada J. The structure of the yolk–sac and the absorption of the yolk in the pond smelt fry // Bull. Faculty Fish. Hokkaido Univ. 1959. V. 10. № 3. P. 196–204.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


