Известия РАН. Серия биологическая, 2019, № 2, стр. 181-188
Анализ распространения горных кольцехвостых агам рода Paralaudakia Baig, Wagner, Ananjeva et Böhme, 2012 (Agamidae: Sauria, Reptilia): опыт использования программы Maxent
Н. Б. Ананьева 1, *, Е. А. Голынский 1, С. С. Хоссейниан Юзефхан 2
1 Зоологический институт РАН
199034 Санкт-Петербург, Университетская наб. 1, Россия
2 Young Researchers and Elite Club, Islamic Azad University
Shirvan, Shirvan branch, Iran
* E-mail: nananjeva09@gmail.com
Поступила в редакцию 31.07.2017
После доработки 14.05.2018
Принята к публикации 09.02.2018
Аннотация
Изучены особенности и потенциальное распространение кольцехвостых агам рода Paralaudakia; проведены сравнительный анализ четырех видов этого рода с помощью программы Maxent и анализ их экологических ниш по 19 переменным биоклиматическим (Bio 1–19) и 8 солярным (Bio 10–27) параметрам с минимальным разрешением 10 арк-минут. В анализе биоклиматических факторов учтены географические координаты мест находок из видовых ареалов P. caucasia (Eichwald, 1831), P. erythrogaster (Nikolsky, 1896), P. lehmanni (Nikolsky, 1896), P. microlepis (Blanford, 1874). Установлено, что значительный вклад в моделирование распространения изученных видов вносят осадки самой теплой и самой холодной четвертей года.
На географическое распространение и характер ареала эктотермных животных, в частности пресмыкающихся, оказывают влияние многочисленные переменные, в том числе влажность, температура, солнечная радиация и высота над уровнем моря (Buckley et al., 2012). Анализ экологических параметров, определяющих это влияние, оказывается полезным инструментом в фундаментальной и прикладной зоологии для понимания процессов формирования и изменения ареалов и выработки природоохранных стратегий. Последняя задача приобретает все бόльшую актуальность, поскольку многие виды ландшафтов в настоящее время испытывают значительный и все усиливающийся антропогенный пресс, в результате которого повсеместно сокращается территория естественных местообитаний.
В последние годы проблема анализа и прогнозирования ареалов горных азиатских агам рода Paralaudakia (Ананьева, Голынский, 2013; Hosseinian Yousefkhani et al., 2013; Ananjeva et al., 2014) привлекает все большее внимание исследователей. К роду горных кольцехвостых агам Laudakia Gray, 1845, который в течение долгого времени входил в состав сборного рода Agama Daudin, 1802, относили и ~20 видов, распространенных в горно-скалистых ландшафтах аридной зоны от Греции и дельты р. Нила на западе через Малую, Переднюю и Среднюю Азию до большой излучины р. Брахмапутры на востоке и до Гобийского Алтая на северо-востоке (Ананьева и др., 2004). Все эти виды объединены приуроченностью к аридным горным системам, а также комплексом морфологических и экологических петробионтных адаптаций. Анализ митохондриального генома (Macey et al., 2000) выявил полифилию рода Laudakia, что вместе с анализом морфологических признаков стало основой для таксономической ревизии рода. Род Laudakia был разделен на три самостоятельных рода: Laudakia Gray, 1845, Stellagama Baig, Wagner, Ananjeva et Böhme, 2012 и Paralaudakia Baig, Wagner, Ananjeva et Böhme, 2012. В состав рода Paralaudakia входят среднеазиатские виды P. badakhshana (Anderson et Leviton, 1969), P. bochariensis (Nikolsky, 1897), P. сaucasia (Eichwald, 1831), P. еrythrogaster (Nikolsky, 1896), P. himalayana (Steindachner, 1867) с ареалом обитания в северо-восточной части Афганистана, Северном Пакистане, Северной Индии, пограничных районах Непала и Китая, P. lehmanni (Nikolsky, 1896), P. microlepis (Blanford, 1874) из Южного Ирана, Пакистана и Афганистана, а также центрально-азиатский вид P. stoliczkana (Baig et al., 2012).
Цель исследования – моделирование и прогнозирование потенциального распространения четырех видов рода Paralaudakia из Западной Азии, Иранского плато и Центральной Азии с привлечением всех имеющихся данных, а также сравнительный анализ пространственного компонента экологических ниш изучаемых видов.
МАТЕРИАЛЫ И МЕТОДЫ
Материалами для данного исследования послужили коллекции исследуемых видов из Зоологического института РАН (Санкт-Петербург), Зоологического музея МГУ им. М.В. Ломоносова (Москва), Зоологического музея им. Н.Н. Щербака Национального научно-природоведческого музея НАН Украины (Киев), Харьковского государственного университета им. В.И. Каразина (Украина), материалы собственных полевых исследований, проведенных в 1980–2003 гг., а также опубликованные данные и сведения о коллекционных экземплярах из базы данных VertNet (http://portal.vertnet.org/search). Массив данных включал в себя 167 местонахождений P. caucasia, а также 33, 35 и 71 местонахождений P. microlepis, P. erythrogaster и P. lehmanni соответcтвенно. Использовались только коллекционные материалы с точной локализацией местообитаний и подтвержденные видовые определения.
Определение географических (десятичных) координат в полевых условиях по возможности проводилось с помощью GPS-навигатора (Garmin, США); при работе с музейными каталогами и литературными источниками использовали интерактивные карты (www.wikimapia.org) и www.maps.google.ru, а также географический справочник (http://www.fallingrain.com/world/index.html). Географические координаты местонахождений определялись с точностью до четвертого знака после запятой. При построении моделей использовались 27 биоклиматических параметров, из которых 19 отражают данные по температурной и осадковой сезонности, остальные восемь – по солнечной радиации (табл. 1), которая позволяет провести интерполяцию наблюдаемых данных с 1950 по 2000 г. Эти данные были получены из ресурсов Worldclim (http://www.worldclime.org) и CliMond: Global Climatologies for Bioclimatic Modelling (https://www.climond.org) в разрешении 30 арк-секунд (arc-seconds) и 10 арк-минут (arc-minutes), при окончательном анализе использовались слои с более грубым разрешением (~18 км/пиксель), в связи с тем что слои с солярными параметрами в более высоком разрешении отсутствуют в открытом доступе. Мы не использовали высотный параметр, принимая положение о том, что он в значительной степени линейно связан с температурным фактором (Harris et al., 2013). Построение моделей осуществлялось в программе Maxent ver. 3.3.3k. Алгоритм программы использует наложение географических координат на слои с параметрами среды с установлением диапазона предпочитаемых значений последних. На начальном этапе при построении первичной модели оценивалась значимость биоклиматических параметров, а впоследствии исключались малозначимые и коррелирующие между собой параметры. В результате этих действий оставалась группа из 3–4 наиболее значимых параметров, на основе которых строились окончательные модели. Достоверность модели оценивалась с использованием встроенной функции построения кривой AUC, отражающей чувствительность вида к параметрам и его специфичность. Значения индекса AUC > 0.75 и близкое к единице свидетельствуют о высокой степени достоверности построенной модели (Swets, 1988; Elith, 2002). Окончательная визуализация построенной модели проводилась в программе DIVA-GIS.
Таблица 1.
Биоклиматические параметры, использованные для построения модели
| Параметр | № параметра |
|---|---|
| Средняя годовая температура | BIO1 |
| Средняя дневная разница температур | BIO2 |
| Изотермальность | BIO3 |
| Температурная сезонность | BIO4 |
| Максимальная температура самой теплой недели | BIO5 |
| Минимальная температура самой холодной недели | BIO6 |
| Среднегодовой температурный перепад | BIO7 |
| Средняя температура четверти года | |
| самой влажной | BIO8 |
| самой сухой | BIO9 |
| самой теплой | BIO10 |
| самой холодной | BIO11 |
| Среднее значение осадков | BIO12 |
| Осадки самого влажного месяца | BIO13 |
| Осадки самой сухой недели | BIO14 |
| Сезонность осадков | BIO15 |
| Осадки четверти года | |
| самой влажной | BIO16 |
| самой сухой | BIO17 |
| самой теплой | BIO18 |
| самой холодной | BIO19 |
| Средняя годовая радиация | BIO20 |
| Недельная радиация | |
| самая высокая | BIO21 |
| самая низкая | BIO22 |
| Радиационная сезонность | BIO23 |
| Радиация четверти года | |
| самой влажной | BIO24 |
| самой сухой | BIO25 |
| самой теплой | BIO26 |
| самой холодной | BIO27 |
При анализе хорологии ящериц была использована программа Maxent ver. 3.3.3k, которая признана одной из наиболее эффективных программ для построения карт потенциального распространения и выявления факторов, определяющих границы распространения вида (наряду с DIVA-GIS) (Bernardes et al., 2013; Ficetola et al., 2013; Hosseinian Yousefkhani et al., 2013; Barabanov, Litvinchuk, 2015). С ее помощью на основании 27 переменных биоклиматических показателей (табл. 1) была построена карта наиболее вероятной области распространения ящериц и был определен вклад каждого фактора в построение модели. В результате были построены карты реального и потенциального распространения, на которых с помощью градаций цвета обозначена вероятность нахождения вида в конкретной точке. Окончательная обработка карты происходила с помощью программы DIVA-GIS 7.5.0. Также была оценена чувствительность метода и была определена степень влияния отдельных биоклиматических параметров на формирование карты ареала. Для оценки перекрывания экологических ниш использовали индекс Шенера (Schoener, 1968), вычисляемый в приложении программы Maxent ENMTools, значение которого статистически измеряется от нуля в случае полного отсутствия перекрывания экологических ниш до единицы в случае идентичных экологических ниш.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Была использована информация по 308 точкам находок. Среди исследованных видов один широкоареальный западно-азиатский вид P. caucasia и три узкоареальных вида (два из них приурочены к Иранскому плато, а один – к горным аридным районам юго-восточной части Средней Азии). Сконструированные модели потенциального распространения и распределения определяющих биоклиматических факторов достаточно производительны и подтверждают приуроченность распространения горных агам к аридному поясу Евразии.
Ареал кавказской агамы P. caucasia, характеризующейся наиболее широким распространением среди изученных нами видов, простирается от восточных и южных районов Кавказа, северо-восточной части Турции и северной части Ирана через Ирак и Афганистан до северо-западной части Пакистана на юг Средней Азии. Среднеазиатская часть ареала в основном находится в Туркменистане, где эта агама населяет Красноводское плато, Мешед-Мессрианскую равнину, Большой и Малый Балханы, Копетдаг и Бадхыз (Атаев, 1985). На востоке ареала в Средней Азии этот широкоареальный вид распространен до Чубека в южной части Таджикистана (Ананьева и др., 2004). На территории России вид встречается в предгорных и горных районах Дагестана; его распространение в мозаике разнообразных ландшафтов значительно шире, чем предполагалось ранее (Mazanaeva, Ananjeva, 2016). Это соответствует результатам анализа биоклиматических факторов (рис. 1а). Созданная модель достаточно достоверна (AUC = 0.975 при дисперсии 0.007). Согласно полученному прогнозу на большей части южных горных систем Ирана и регионов между Ираном и Афганистаном для P. caucasia нет подходящих условий обитания (рис. 1а), определяемых комбинацией биоклиматических факторов (Hosseinian Yousefkhani et al., 2013).
Рис. 1.
Модели потенциального распространения Paralaudakia caucasia (а), P. microlepis (б), P. lehmanni (в), P. erythrogaster (г), созданные c использованием программы Maxent 3.3.3k. Белыми точками отмечены местонахождения агам, рассматриваемые в анализе. 1–3 – 100–72, 72–55 и 55–37% соответственно.
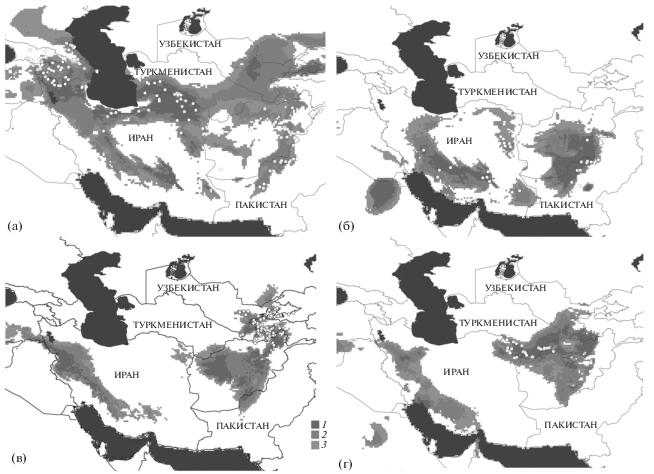
Узкоареальный вид мелкочешуйной агамы P. microlepis распространен в южных, центральных и восточных частях Иранского плато на территории Ирана; эта агама встречается также в горных районах на юго-западе Афганистана и провинции Белуджистан на северо-западе Пакистана. Cконструированная модель достаточно производительна (AUC = 0.972 при дисперсии 0.003). Она демонстрирует фрагментарный характер распространения агамы, состоящий из двух основных кластеров. Первый кластер – центральные и восточные районы горной системы Загрос в провинциях Фарс, Керман и Западный Исфаган в Иране, а также Южный Хорасан – наиболее пригоден для обитания хорасанской агамы в Иране (рис. 1б). Второй кластер наиболее пригодных местообитаний P. microlepis выявлен в пограничных горных районах Афганистана и Пакистана. Согласно полученной модели (Ананьева, Голынский, 2013) в бóльшей части более северных районов Ирана, Афганистана, как и в прилежащих районах Туркменистана и Таджикистана нет подходящих биоклиматических условий для P. microlepis (рис. 1б), а сам ареал вида по существу ограничен Иранским нагорьем. Картина потенциального распространения позволяет предполагать подходящие местообитания за пределами известного ареала на северо-западе Ирана и на более обширных территориях Афганистана, откуда к настоящему времени получены достоверные данные о находках в центральных, восточных и западных районах (Sindaco, Jeremchenko, 2008; Wagner et al., 2016).
Ареал туркестанской агамы P. lehmanni ограничен горными аридными районами юго-восточной части Средней Азии: на севере до Ферганской долины, на юге до Северного Афганистана, на западе до гор и предгорий юго-восточного Туркменистана (Кугитангтау) и до хр. Нуратау на северо-востоке, а на востоке до Дарвазского хребта. Туркестанская агама обычна в восточной части Узбекистана, западной части Таджикистана и в соседних районах Киргизии. Северная граница ареала проходит по предгорьям хр. Моголтау в Ферганской долине, западная – по хребтам Нуратау (северо-западное продолжение Туркестанского хребта) и Кугитангтау, а восточная ограничена Дарвазским хребтом. Есть отдельные находки в северной части Афганистана, на территории которого прогнозируется наличие подходящих местообитаний.
Сам рисунок ареала состоит из двух почти полностью разделенных частей, что свидетельствует о его фрагментации на северную и южную части (рис. 1в). Граница между ними проходит по Гиссарскому и Зеравшанскому хребтам. В настоящий момент северная и южная части ареала почти полностью изолированы одна от другой географически, обмен между ними возможен на южной оконечности Гиссарского хребта (как в Сурхандарьинской, так и в Кашкадарьинской областях Узбекистана есть указания на находки). Созданная модель выявленного распространения достаточно производительна (AUC = 0.990 при дисперсии 0.004) и подтверждает мнение о том, что распространение агамы не заходит на восток далее пос. Тавиль-Дара и не простирается на Западный Памир (Чернов, 1959).
Модель демонстрирует высокую степень совпадения с представлениями о распространении туркестанской агамы в районах предгорий на востоке Узбекистана, западе Таджикистана и в соседних районах Киргизии, которые представляют собой регионы с наиболее подходящими для P. lehmanni местообитаниями. Согласно нашим данным о прогнозируемом ареале на северо-западе Пакистана не следует ожидать находок этого вида (рис. 1в), тогда как довольно обширная часть территории Афганистана может рассматриваться как зона потенциального распространения туркестанской агамы. Отсутствие находок объясняется малой изученностью этой территории, а также ее слабой доступностью для исследователей. К настоящему времени известны достоверные находки в северных и северо-восточных районах страны (Sindaco, Jeremchenko, 2008; Wagner et al., 2016).
Построенная модель выявленного распространения хорасанской агамы P. erythrogaster достаточно производительна (AUC = 0.995 при нулевой дисперсии). Согласно полученной ГИС-карте ядро ареала расположено в основном в юго-восточной части Туркменистана. Рисунок ареала выглядит непрерывным, объединяющим части ареала на северо-востоке Ирана, юго-востоке Туркменистана и северо-востоке Афганистана. Отдельные изолированные фрагменты потенциального ареала располагаются в южной части Афганистана, пограничных с Афганистаном районах Таджикистана и в пограничных с Туркменистаном районах южной части Узбекистана. Созданная модель (рис. 1г) подтверждает известные представления о распространении вида в предгорьях Копетдаг-Хорасанской горной провинции (Копетдаг) по обе стороны границы Ирана и Туркменистана, а также в Бадхызском холмогорье как северной части предгорий Парапамиза по обе стороны границы Туркменистан–Афганистан. В то же время обширная часть территории северо-востока Афганистана согласно созданной модели может рассматриваться как зона потенциального распространения хорасанской агамы. Находки в этой стране были отмечены в северной и северо-западной частях Афганистана к северу от Центрального массива горной системы Гиндукуш и к югу до Пагмана (Anderson, 1999; Sindaco, Jeremchenko, 2008; Wagner et al., 2016). Отсутствие других находок объясняется малой изученностью этой территории, а также ее слабой доступностью для исследователей.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
К проблеме анализа и прогнозирования ареалов имеет непосредственное отношение проблема симпатрических видов, которая особенно интересна при рассмотрении видов комплекса caucasia–erythrogaster–microlepis (Macey et al., 1998). Известно, что у симпатрических видов рода Paralaudakia существуют высотные и биотопические различия, определяющие параметры экологических ниш этих видов. У горных агам отмечены лишь небольшие совпадения ареалов, а число видов этих ящериц в условиях симпатрии не превышает двух (Ананьева, 1981). Интересны биотопические особенности хорасанской агамы в условиях ее симпатрии и предполагаемой гибридизации с кавказской агамой, встречающейся как в Иране, так и в Туркменистане (Anderson, 1999; Panov, Zykova, 2016). В случаях совместного обитания P. erythrogaster занимает биотопы в предгорных участках на более низких высотных отметках, чем P. caucasia, которая также на определенном участке своего ареала симпатрична с близким видом P. microlepis (рис. 1а, б, г). P. lehmanni, характеризующаяся восточным распространением в ареале рода, ведет полудревесный образ жизни, населяет сады и кустарники в оврагах и на выположенных террасах в предгорьях и не встречается в условиях симпатрии с указанными выше видами. Ее взаимоотношения с симпатриантами P. bocharienis и P. himalayana в зонах совпадения ареалов были описаны ранее (Ananjeva, Tuniyev, 1994).
Проводимый анализ и прогнозирование распространения симпатрических видов агам позволяют обогатить сведения о характере их ареалов и выделить биоклиматические параметры, как общие для видов рода, так и определяющие их отличия, а также определить уровень дивергенции экологических ниш горных агам. Нами оценена роль биоклиматических факторов в формировании ареалов четырех сравниваемых видов (P. caucasia, P. erythrogaster, P. microlepis, P. lehmanni). Биоклиматические параметры влажности и осадков оказались существенными для всех исследованных видов Paralaudakia (табл. 2), при этом самые высокие значения осадков самой холодной четверти годы характерны для туркестанской и кавказской агам. Значения этих осадков также входят в ряд определяющих для малочешуйной и хорасанской агам. Фактор осадков самой теплой четверти года достигает высокого процентного значения при анализе ареала хорасанской агамы; это второй по значению фактор для мелкочешуйной агамы и третий – для кавказской. Важность факторов влажности, вероятно, связана с относительной аридностью территории обитания видов, которая имеет значение для этих палеарктических агамовых ящериц (Ananjeva, Tuniyev, 1994). Мы также можем предположить влияние влажности на растительность и ее связь с сезонной фитофагией в рационе питания горных агам. В целом значительный вклад в моделирование распространения изученных видов рода Paralaudakia (табл. 2) вносят осадки самой теплой четверти года (кавказская, мелкочешуйная, хорасанская агамы) и самой холодной четверти года (все четыре изученных вида), температурная сезонность и средняя температура самой холодной четверти года (кавказская агама). Анализ выявил относительную значимость температурной сезонности и максимальной недельной радиации для мелкочешуйной агамы, имеющей самое южное распространение (рис. 1б). Отметим, что такие результаты получаются в разных вариантах анализа при разрешении как 30 арк-секунд, так и 10 арк-минут.
Таблица 2.
Относительное значение вклада (в %) основных биоклиматических переменных, использованных при построении модели Maxent
| № параметра | Параметр | Виды рода Paralaudakia | |||
|---|---|---|---|---|---|
| lehmanni | caucasia | microlepis | erythrogaster | ||
| BIO4 | Температурная сезонность | – | 23.9 | 15.5 | – |
| Средняя температура четверти года | |||||
| BIO9 | самой сухой | 7.6 | – | – | – |
| BIO11 | самой холодной | – | 28.7 | – | – |
| BIO13 | Осадки самого влажного месяца | – | – | – | 16.6 |
| BIO14 | самого сухого месяца | 43.6 | – | – | – |
| BIO18 | самой теплой четверти года | 22.3 | 39.4 | 65.9 | |
| BIO19 | самой холодной четверти года | 48.7 | 25.1 | 21.1 | 17.5 |
| BIO22 | Максимальная недельная радиация | – | – | 24 | – |
Таблица 3.
Значения индекса Шенера при попарном сравнении видов рода Paralaudakia
| Виды | P. erythrogaster | P. lehmanni | P. microlepis |
|---|---|---|---|
| P. caucasia | 0.24 | 0.26 | 0.32 |
| P. erythrogaster | – | 0.39 | 0.47 |
| P. lehmanni | – | – | 0.33 |
При рассмотрении вопроса о симпатрии горных агам важна полученная в результате применения программы Maxent информация о потенциальных ареалах и возможном перекрывании экологических ниш, что может иметь отношение к межвидовым конкурентным отношениям. Полученные данные (табл. 1в) дают представления о пространственном измерении экологических ниш и опосредованно через параметры температуры и влажности о временнóм и трофическом измерениях. Перекрывание ниш минимально для кавказской агамы со всеми изученными видами, с которыми по данным моделей она может быть парапатрична или симпатрична. Максимальное перекрывание экологических ниш отмечено для обитающих симпатрично мелкочешуйной и хорасанской агам (0.47), а также у пространственно разобщенных пар видов: туркестанской и хорасанской агам (0.39) и туркестанской и мелкочешуйной (0.33).
Авторы благодарны Н.Л. Орлову, С.Н. Литвинчуку и И.В. Доронину за консультации, В.И. Петроченко за данные по Нуратинскому заповеднику Узбекистана, сотрудникам Зоологического музея МГУ В.Ф. Орловой и Национального научно-природоведческого музея НАН Украины (Киев) Е.М. Писанцу и Е.Б. Доценко за предоставленные данные о коллекциях кольцехвостых агам.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант 18-04-00040) и в рамках гостемы Зоологического института РАН № АААА-А17-117030310017-8.
Список литературы
Ананьева Н.Б. К изучению симпатрических видов (на примере рептилий) // Проблемы новейшей истории эволюционного учения. Л.: Наука, 1981. С. 15–26.
Ананьева Н.Б., Голынский Е.А. Анализ распространения горной кольцехвостой туркестанской агамы Paralaudakia lehmanni (Nikolsky, 1896): использование программы Максент // Тр. Зоол. ин-та РАН. 2013. Т. 317. № 4. С. 54–84.
Ананьева Н.Б., Орлов Н.Л., Халиков Р.Г., Даревский И.С., Рябов С.А., Барабанов А.В. Атлас пресмыкающихся Северной Евразии (таксономическое разнообразие, географическое распространение и природоохранный статус). СПб.: Зоол. ин-т РАН, 2004. 232 с.
Атаев Ч. Пресмыкающиеся гор Туркменистана. Ашхабад: Ылым, 1985. 344 с.
Чернов С.А. Фауна Таджикской ССР. Т. 18: Пресмыкающиеся. Сталинабад: Изд-во АН ТаджССР, 1959. 202 с.
Ananjeva N.B., Tuniyev B.S. Some aspects of historical biogeography of Asiatic rock agamids // Russ. J. Herpetol. 1994. V. 1. № 1. P. 42–53.
Ananjeva N.B., Golynsky E.A., Hosseinian Yousefkhani S.S., Masroor R. Distribution and environmental suitability of the smallscaled rock agama, Paralaudakia microlepis (Sauria: Agamidae) in the Iranian Plateau // Asian Herpetol. Res. 2014. V. 5. № 3. P. 161–167.
Anderson S.C. The lizards of Iran. Oxford; Ohio: SSAR, 1999. 442 p.
Baig K.J., Wagner P., Ananjeva N.B., Bőhme W. A morphology-based taxonomic revision of Laudakia Gray, 1845 (Squamata: Agamidae) // Verte Zoo. 2012. V. 62. № 2. P. 37–60.
Barabanov A.V., Litvinchuk S.N. A new record of the Kurdistan newt (Neurergus derjugini) in Iran and potential distribution modeling for the species // Russ. J. Herpetol. 2015. V. 22. № 2. P. 107–115.
Bernardes M., Rödder D., Nguyen T.T., Pham C.T., Nguyen T.Q., Ziegler T. Habitat characterization and potential distribution of Tylototriton vietnamensis in northern Vietnam // J. Nat. History. 2013. V. 47. № 17–18. P. 1161–1175.
Buckley L.B., Hurlbert A.H., Jetz W. Broad-scale ecological implications of ectothermy and endothermy in changing environments // Glob. Ecol. Biogeogr. 2012. V. 21. P. 873–885.
Elith J. Quantitative methods for modeling species habitat: comparative performance and an application to Australian plants // Quantitative methods for conservation biology. N.Y.: Springer, 2002. P. 39–58.
Ficetola G.F., Bonardi A., Sindaco R., Padoa-Schioppa A. Estimating patterns of reptile biodiversity in remote regions // J. Biogeogr. 2013. V. 40. P. 1202–1211.
Harris R.M., McQuillan P., Hughes L. A test of the thermal melanism hypothesis in the wingless grasshopper Phaulacridium vittatum // J. Insect Sci. 2013. V. 13. № 51. P. 1–18.
Hosseinian Yousefkhani S.S., Ficetola G.F., Rastegar-Pouyani N., Ananjeva N.B., Eskandar Rastegar-Pouyani E., Rafaqat Masroor R. Environmental suitability and distribution of the caucasian rock agama, Paralaudakia caucasia (Sauria: Agamidae) in Western and Central Asia // Asian Herpetol. Res. 2013. V. 4. № 3. P. 207–213.
Macey J.R., Schulte J.A. II, Ananjeva N.B., Larson A., Rastegar-Pouyani N., Shammakov S.M., Papenfuss T.J. Phylogenetic relationships among agamid lizards of the Laudakia caucasia species group: testing hypotheses of biogeographic fragmentation and an area cladogram for the Iranian Plateau // Mol. Phylogenet. Evol. 1998. V. 10. № 1. P. 118–131.
Macey J.R., Schulte J.A., Kami H.G., Ananjeva N.B., Larson A., Papenfuss T.J. Testing hypotheses for vicariant separation in the agamid lizard Laudakia caucasia from mountain ranges of the Northern Iranian Plateau // Mol. Phylogenet. Evol. 2000. V. 14. № 3. P. 479–483.
Mazanaeva L., Ananjeva N. New data on habitats and distribution of the Caucasian agama, Paralaudakia caucasia (Eichwald, 1831) in Dagestan // Russ. J. Herpetol. 2016. V. 23. № 4. P. 293–304.
Panov E.N., Zykova L.Yu. Rock Agamas of Eurasia. M.: KMK, 2016. 302 p.
Sanchooli N. Modeling the potential distribution of Ablepharus bivittatus (Ménétriés, 1832) in Iran // Herpetozoa. 2016. V. 29. № 1–2. P. 63–68.
Schoener T. W. Anolis lizards of Bimini: resource partitioning in a complex fauna // Ecology. 1968. V. 49. P. 704–726.
Sindaco R., Jeremcenko V.K. The reptiles of the Western Palearctic. Italy: Latina. Edizioni Belvedere, 2008. 579 p.
Swets K. Measuring the accuracy of diagnostic systems // Science. 1988. № 240. P. 1285–1293.
Wagner P., Bauer A.M., Leviton A.E., Böhme W. A Checklist of the Amphibians and Reptiles of Afghanistan – exploring herpetodiversity using biodiversity archives // Proc. California Acad. Sci. 2016. Ser. 4. V. 63. № 13. P. 457–565.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


