Известия РАН. Серия биологическая, 2019, № 2, стр. 154-161
Генетическое разнообразие популяций щуки обыкновенной Esox lucius L. из рек северо-востока России
Л. Т. Бачевская , *, В. В. Переверзева , Г. А. Агапова , С. И. Грунин
Институт биологических проблем Севера ДВО РАН
685000 Магадан, ул. Портовая, 18, Россия
* E-mail: gekki54@mail.ru
Поступила в редакцию 05.04.2017
После доработки 07.08.2018
Принята к публикации 07.08.2018
Аннотация
Впервые получены данные о строении и изменчивости нуклеотидной последовательности гена цитохрома b мтДНК щуки обыкновенной Esox lucius L. из рек Колымского бассейна. Обнаружено, что на долю межгрупповой подразделенности приходится 59.38% изменчивости, что свидетельствует о четкой дифференциации популяций щуки Колымского и Анадырского бассейнов, несмотря на общность их происхождения. Проведена оценка эволюционного возраста митохондриального генофонда этого вида из изученных локальностей. Предположено, что разделение предковой популяции щуки обыкновенной могло произойти в раннем плейстоцене, а экспансия филогенетической группы А, объединяющей все обнаруженные гаплотипы гена cytb мтДНК, произошла в позднем плейстоцене, который характеризовался благоприятными климатическими условиями.
Щука обыкновенная Esox lucius L. имеет циркумполярное распространение. Она широко представлена в водоемах Евразии и Северной Америки и обладает способностью адаптироваться к весьма разнообразным условиям обитания. Такая экологическая пластичность – важный биологический фактор, способствующий миграции и широкому географическому расселению вида. Проведенные ранее исследования показали, что экологическая пластичность может быть обусловлена не только фенотипическими, но и генетическими различиями. Генетические исследования щуки обыкновенной интенсивно развивались, при этом вначале они охватывали исключительно североамериканские популяции (Healy, Mulcahy, 1980; Seeb et al., 1987; Miller, Kapuscinski, 1996, 1997; Senanan, Kapuscinski, 2000; Miller, Senanan, 2003). Популяционно-генетическая структура этого вида, широко распространенного в реках Европы, до недавнего времени была слабо изучена (Hansen et al., 1999). Исследование изменчивости щуки обыкновенной, обитающей в реках северо-западной части Европы, показало чрезвычайно низкий уровень генетического разнообразия популяций этого вида (Nicod et al., 2004).
На основании результатов изучения полиморфизма микросателлитов щуки из европейских и североамериканских популяций было отмечено, что для них характерен низкий уровень генетического разнообразия. В то же время был обнаружен высокий уровень их дифференциации (Hansen et al., 1999; Senanan, Kapuscinski, 2000). С использованием вариации в двух участках последовательности мтДНК (гена цитохрома b (cytb) и D-петли) у щуки из рек Северной Европы выделены три четко определенные эволюционные линии, одна из которых предположительно имеет трансконтинентальное рассредоточение из одного рефугиума. Отмечена также необходимость дальнейшего детального филогенетического исследования этого вида на обширном ареале (Skog et al., 2014).
На северо-востоке России и в Чукотском автономном округе (ЧАО) щука обыкновенная населяет целый ряд водоемов, среди которых отмечены бассейны рек Колымы и Анадыря. Биология и экология вида, обитающего в них, хорошо изучена (Берг, 1949; Новиков, 1966; Кириллов, 1972; Черешнев и др., 2001; Грунин, Бакланов, 2004; Грунин, 2005, 2014; Хохлов, Хохлова, 2006; Черешнев, 2008; Грунин, Шестаков, 2011). Показано, что щука обыкновенная из рек Колымо-Индигирского бассейна и Анадыря имеет существенные морфологические отличия (Черешнев, 1996). Экологическая приуроченность щуки к пресным водам и особенности ее распространения на северо-востоке России и в ЧАО позволяют использовать этот вид как биогеографический индикатор существовавших в прошлом палеогеографических связей между смежными речными бассейнами (Черешнев, 2008). Важнейшую роль в определении палеогеографических и филогеографических связей играют генетические исследования, которые до настоящего времени не охватывали популяции щуки из рек северо-востока России.
Цель исследования – определение полиморфизма гена cytb мтДНК щуки обыкновенной, сравнительный анализ генетического разнообразия популяций этого вида.
МАТЕРИАЛЫ И МЕТОДЫ
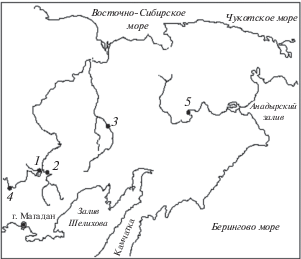
Биологический материал (164 особи) был собран в 2015–2016 гг. Карта-схема с указанием речных систем и точек сбора проб у щуки обыкновенной приведена на рис. 1. Выделение и очистку тотальной ДНК проводили модифицированным методом Флеминга–Кука (Fleming, Cook, 2002). Амплификация нуклеотидной последовательности гена cytb мтДНК щуки проводилась с использованием праймеров LCbEluc14263 gtc ata att ctt act cgg act cta acc и RCbEluc15503 cct cca act tcc gga tta caa aac cgg cgc tc, которые были подобраны в процессе эксперимента, равно как и условия полимеразной цепной реакции: денатурирующая стадия 95°С – 5 мин; затем 32 цикла: 95°С – 45 с, 50°С – 30 с, 70°С – 2 мин 30 с; заключительная стадия – 72°С – 7 мин. Амплифицированный участок мтДНК очищался и подготавливался к секвенированию по стандартной методике с применением набора реагентов DiatomTM DNA Clean-Up (Лаборатория Изоген, г. Москва). Определение нуклеотидных последовательностей амплифицированного участка мтДНК было проведено по стандартной методике с использованием наборов для циклического секвенирования ДНК Big Dye Terminator (Applied Biosystems, v. 3.1) и генетического анализатора ABI Prism 3130 (Applied Biosystems, США). Обнаруженные нуклеотидные последовательности были депонированы в GenBank. Их выравнивание и анализ проводили с использованием пакета программ MEGA 6.0.2.74 (Tamura et al., 2013) и ARLEQUIN ver. 3.5 (Excoffier et al., 2005).
Рис. 1.
Карта-схема района сбора материала. 1 – р. Эльген, 2 – р. Буюнда, 3 – р. Омолон, 4 – Колымское водохранилище, 5 – р. Анадырь.
Соответствие характера нуклеотидных замен гипотезе нейтральности (для исследованного маркера) в выборках щуки обыкновенной устанавливали с помощью D-теста Таджимы (Tajima, 1989). Для построения медианных сетей применяли алгоритм MJ (Median-Joining) программы Network 4.5.1.0 (Bandelt et al., 1999). Филогеографический анализ проводили с применением метода “ближайшего соседа” (NJ-анализ) и двухпараметрической модели Кимуры (Tamura et al., 2013), для чего были привлечены сведения о строении нуклеотидных последовательностей гена cytb мтДНК щуки обыкновенной из GenBank, представленных в нескольких публикациях (Grande et al., 2004; Skog et al., 2014). В качестве внешней группы была использована последовательность нуклеотидов гена cytb мтДНК амурской щуки Esox reichertii, GenBank, AY497444 (Ishiguro et al., 2003). Для оценки времени дивергенции эволюционного возраста линий мтДНК щуки использовали число мутаций в гене cytb, соблюдая условие, что скорость накопления мутаций в исследованном гене составляла 1–2% дивергенции (для транзиций и трансверсий) за 1 млн лет (Brown et al., 1979).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изученный ген cytb мтДНК щуки обыкновенной содержит 1140 пар нуклеотидов (п.н.) и соответствует положению c 14341–15477 п. н. полного генома мтДНК щуки обыкновенной E. lucius L, GenBank, NC004593 (Ishiguro et al., 2003). Анализ полученных нами нуклеотидных последовательностей гена cytb мтДНК щуки из рек Эльген, Буюнда, Омолон, Анадыря и из верхней части Колымского водохранилища позволил выявить шесть вариантов (Есb1–Есb6) гена cytb, которые депонированы в GenBank (KT203375–KT203379, KU659805). Результаты сравнения их с полученными ранее (Grande et al., 2004; Skog et al., 2014) нуклеотидными последовательностями гена cytb щуки обыкновенной, представленными в базе данных GenBank (AY497452, КM281460, КM281461, КM281464–КM281466, КM281469, КM281470, КM281476), приведены на рис. 2.
Рис. 2.
Нуклеотидные последовательности гена цитохрома b мтДНК обыкновенной щуки из рек северо-востока России и варианты, депонированные в GenBank. Сайты замен показаны от начала гена cytb мтДНК.

Необходимо отметить, что р. Эльген – левосторонний, а реки Омолон и Буюнда – правосторонние притоки р. Колымы. При этом следует подчеркнуть, что устья рек Буюнда и Эльген удалены от р. Омолон не менее чем на 150 км. Несмотря на то что все исследованные выборки щуки из бассейна р. Колымы оказались мономорфными, обращает на себя внимание следующий факт: выборки из рек Буюнда, Эльген и из водохранилища представлены особями-носителями гаплотипа KT203375, Ecb1 гена cytb мтДНК (табл. 1). У щуки из р. Омолон обнаружен мономорфизм совсем по другому варианту (KU659805, Ecb6) указанного гена. В табл. 1 показано, что этот гаплотип встречается только в омолонской популяции щуки. В анадырской выборке (по использованному маркеру) выявлено пять (табл. 1) из шести гаплотипов, встречающихся в исследованных популяциях щуки обыкновенной. Изменчивость молекулярных маркеров характеризуется такими параметрами, как гаплотипическая изменчивость (h), определяющая число и частоту встречаемости различных гаплотипов используемого маркера независимо от различий по числу отличающихся сайтов, и нуклеотидная изменчивость (π), учитывающая дивергенцию между отдельными особями в популяции на основе различий в нуклеотидных последовательностях сиквенсов независимо от общего числа гаплотипов.
Таблица 1.
Частота распределения гаплотипов гена cytb мтДНК в популяциях щуки обыкновенной из водоемов северо-востока России
| № GenBank, гаплотип | Водоем (число особей) | ||||
|---|---|---|---|---|---|
| р. Эльген (29) | р. Буюнда (42) | Колымское водохранилище (30) | р. Омолон (14) | р. Анадырь (49) | |
| KT203375, Ecb1 | 1 | 1 | 1 | 0 | 0.6667 |
| KT203376, Ecb2 | 0 | 0 | 0 | 0 | 0.1667 |
| KT203377, Ecb3 | 0 | 0 | 0 | 0 | 0.0417 |
| KT203378, Ecb4 | 0 | 0 | 0 | 0 | 0.0417 |
| KT203379, Ecb5 | 0 | 0 | 0 | 0 | 0.0833 |
| KU659805, Ecb6 | 0 | 0 | 0 | 1 | 0 |
Для исследованных нами популяций были рассчитаны указанные параметры. Анадырская выборка характеризовалась относительно высокими значениями гаплотипического разнообразия (h = 0.5204 ± 0.0763) и низкими значениями нуклеотидного разнообразия (π = 0.000519 ± 0.00047). Подобное сочетание параметров характерно для популяций с быстрым ростом численности от небольшого числа основателей, в случае когда прошло достаточное время для восстановления гаплотипической изменчивости вследствие мутационного процесса, но недостаточное для того, чтобы накопились значительные различия между нуклеотидными последовательностями. Выборки из рек Колымского бассейна в целом характеризуются низкими значениями обоих параметров (h = = 0.2157 ± 0.0462, π = 0.00019 ± 0.000255), что свойственно более молодым популяциям.
Отмеченный факт весьма интересен, так как принято считать, что щука обыкновенная из р. Колымы переселилась в р. Анадырь (Черешнев, 1986). При расселении вида возможно снижение генетического разнообразия. Однако мы наблюдаем в выборке анадырской щуки более высокие значения гаплотипической и нуклеотидной изменчивости по сравнению с таковыми в колымских выборках. По-видимому, щука обыкновенная из р. Колымы утратила генетическое разнообразие в процессе становления этого бассейна, который, как известно, имел очень сложную историю формирования (Баранова, Бискэ, 1964; Байрон и др., 1977). Восстановить генетическое разнообразие за счет мигрантов из сибирских рек было невозможно. В период регрессий с конца плиоцена и, вероятно, до позднечетвертичного времени обмен фаунами между реками Восточной Сибири и Колымо-Индигирской низменности был затруднен, так как существовал водораздел, образованный Новосибирскими островами (Баранова, Бискэ, 1964). Отмеченное своеобразие генетического облика популяций щуки Колымского бассейна, вероятно, в значительной мере было предопределено серьезным снижением численности (эффект “горлышка бутылки”) в истории их формирования (Nei, 1987).
В период становления популяций от небольшого числа особей за счет стохастических процессов (дрейф генов) могла произойти утрата ряда гаплотипов, что привело к существенному снижению генетического разнообразия. Полученные данные анализировали с использованием программы AMOVA Analysis of Molecular Variance (Excoffier et al., 2005). В первую группу включили все нуклеотидные последовательности гена cytb мтДНК щуки обыкновенной из рек Колымского бассейна, а во вторую – все гаплотипы, характеризующие выборку этого вида из р. Анадыря. Результаты показывают, что при таком варианте объединения доля внутрипопуляционной генетической изменчивости составляет 52.81%, а доля межгрупповой – 59.38%.
Возможно, отмеченный факт не случаен и обусловлен рядом причин, связанных со спецификой некоторых природных процессов, происходивших в геологическом прошлом этого региона. Следы четвертичных оледенений в верховьях р. Колымы широко распространены. Эти оледенения были достаточно интенсивными и продвигались в район Яно-Оймяконского и Верхнеколымского нагорий (Хворостова, 1970). Ледники спускались с гор к их подножиям и продвигались по долинам рек (Васьковский, 1959; Баранова, Бискэ, 1964; Марков и др., 1965). Таким образом, оледенения оказали существенное влияние, но в основном лишь на верховья рек и горные притоки крупных речных бассейнов, вытесняя горную и предгорную фауну. Определяющую роль в изменении сложившегося бореально-равнинного комплекса сыграли трансгрессии океана, уничтожавшие пресноводную фауну в равнинных участках рек, и регрессии, способствующие вторичному ее расселению из убежищ. Во время максимальной (пред-предпоследней) трансгрессии, по-видимому, были затоплены долины целого ряда рек, в том числе Омолона и Колымы, что привело к утрате биологического разнообразия их пресноводной фауны. В то же время предполагается, что в плиоцен-раннечетвертичную эпоху в пределах Среднесибирского плоскогорья существовала низкая равнина с широким развитием озерно-болотной аккумуляции (Жуков и др., 1966). В результате на этой территории образовался обширный пресноводный водоем, который и служил надежным убежищем для водной равнинной фауны (Лунсгерсгаузен, 1961).
Принято считать, что бассейн р. Анадыря (один из самых крупных бассейнов рек Чукотки) сложился только в конце плиоцена за счет перестройки системы палео-Белой (Дорт-Гольц, Терехова, 1976). Древние речные системы восстанавливались неоднократно в четвертичном периоде, но их протяженность и конфигурация менялись в зависимости от уровня моря, мощности ледниковых покровов и тектонических движений земной коры. В то же время пути расселения пресноводных рыб пролегали не только через единые древние шельфовые речные системы Берингии. В определенные периоды интенсивного вулканизма и сейсмической активности возникали перехваты близкорасположенных смежных верховьев рек, благодаря которым происходило проникновение видов в новые речные бассейны (Черешнев, 2008). Предположительно в позднем плиоцене щука вселилась в р. Анадырь из р. Колымы через перехваты их верховьев (Черешнев, 1986). В дальнейшем щука расселялась через Берингию (Сычевская, 1975, 1976) и была обнаружена в Северной Америке в ископаемом состоянии только в плейстоцене (Яковлев, 1964). В более поздний период щука не могла проникать в р. Анадырь, так как связи р. Колымы с реками Чукотки и Аляски прекратились (восточнее м. Биллингса) и более не возобновлялись.
По-видимому, обнаруженная нами значительная доля межгрупповой изменчивости щуки обыкновенной из исследованных локальностей обусловлена длительным периодом их изоляции. В то же время преобладание одного общего гаплотипа Ecb1 гена cytb мтДНК в выборках щуки из рек Колымского бассейна и Анадыря свидетельствует о том, что они имеют общность происхождения. В истории становления популяции из Колымского бассейна в целом большое значение, по-видимому, имело такое событие, как постледниковая реколонизация из небольшого числа убежищ от ограниченного числа основателей.
Отмеченное нами низкое генетическое разнообразие в выборках из Колымского бассейна, вероятно, еще более усиливается демографическими особенностями щук, которые, как и многие другие хищники, имеют низкий эффективный размер популяции (Miller, Kapuscinski, 1997). Рассчитан популяционный параметр изменчивости (ϴk), который отражает эффективный размер популяций (Excoffier et al., 2005). Полученные данные показывают, что анадырская и колымская локальности щуки обыкновенной отличаются по этому параметру практически на порядок (ϴk = 1.187 и 0.198 соответственно). Вычислен показатель D-статистики Таджимы для выборок из исследованных популяций. В отличие от колымской выборки щуки обыкновенной у анадырской отмечено достоверно отрицательное значение этого показателя (D = –0.776; sD р-value = 0.25), что может свидетельствовать в пользу предположения о достаточно быстрой популяционной экспансии или воздействии отрицательного отбора (Tajima, 1989). Возможно, дальнейшие исследования позволят получить более определенный ответ на вопрос о действии естественного отбора.
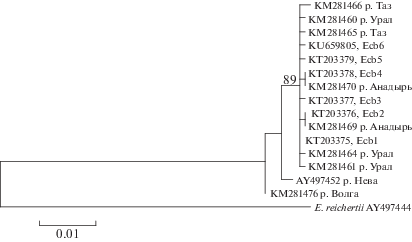
У щуки обыкновенной из исследованных локальностей обнаружено небольшое число вариабельных позиций общей длины гена cytb мтДНК (0.53%). С учетом представленных в GenBank образцов нуклеотидных последовательностей щуки обыкновенной (рис. 2) число вариабельных позиций общей длины гена cytb мтДНК значительно возросло и составило 2.1%. Внутривидовая дивергенция нуклеотидных последовательностей гена cytb мтДНК щуки в среднем составила 0.1%, однако интервал различий был шире (0–2.1%), что обусловило выделение на NJ-дендрограмме (Tamura et al., 2013) двух структурированных кластеров с высоким уровнем статистической поддержки (значение бутстреп-индекса составляет 89%) (рис. 3). Первый кластер включает в себя все гаплотипы щуки обыкновенной из анадырской и колымской популяций, а также варианты гена cytb мтДНК, характеризующие образцы из рек Таза и Урала. Второй кластер содержит гаплотипы щуки из рек Волги и Невы. Следует обратить внимание на то, что наиболее архаичны гаплотипы гена cytb мтДНК, входящие во второй кластер (рис. 3). Необходимо отметить, что гаплотип Ecb1 широко распространен на нескольких континентах (Skog et al., 2014). От него (путем нескольких замен) произошли производные варианты, характерные для щуки обыкновенной из рек разных географических районов, в том числе из рек северо-востока России.
Рис. 3.
NJ-филогенетическое дерево нуклеотидных последовательностей гена cytb мтДНК щуки обыкновенной из некоторых рек России, на ветвях приведены бутстреп-индексы в процентах.
На основании полученных и имеющихся в GenBank нуклеотидных последовательностей гена cytb мтДНК щуки обыкновенной из рек России по принципу минимального числа нуклеотидных замен (Bandelt et al., 1999) построена медианная сеть (рис. 4). Степень дивергенции мтДНК оценивали с помощью генетической дистанции p, которая соответствует среднему расстоянию от предкового гаплотипа ко всем производным вариантам, в том числе к гипотетическому (mv1) (Bandelt et al., 1999). Гаплотип КМ281476, характеризующий щуку из Волги, – предковый по отношению ко всем остальным вариантам нуклеотидных последовательностей гена cytb мтДНК. От гипотетического предка путем нескольких замен образованы две дивергировавшие ветви гаплотипов указанного гена (рис. 4). Одна ветвь представлена наиболее широко и включает в себя распространенный в большинстве исследованных нами популяций вариант Ecb1 гена cytb мтДНК – материнский для целой группы А гаплотипов (рис. 4). Анализ медианной сети нуклеотидных последовательностей гена cytb мтДНК, относящихся к этой группе, показал, что ее эволюционный возраст составляет 0.12 ± 0.03 млн. лет (рассчитано с использованием Network 4.5.1.0) (Bandelt et al., 1999).
Рис. 4.
Медианная сеть гаплотипов гена cytb мтДНК щуки обыкновенной Esox lucius. На ветвях сети цифрами обозначено число мутаций; медианный вектор (mv1) представляет собой гипотетический гаплотип; размеры кружков соответствуют числу гаплотипов. А – наиболее представленная группа. Внешняя группа – амурская щука Esox reichertii, GenBank, AY497444.
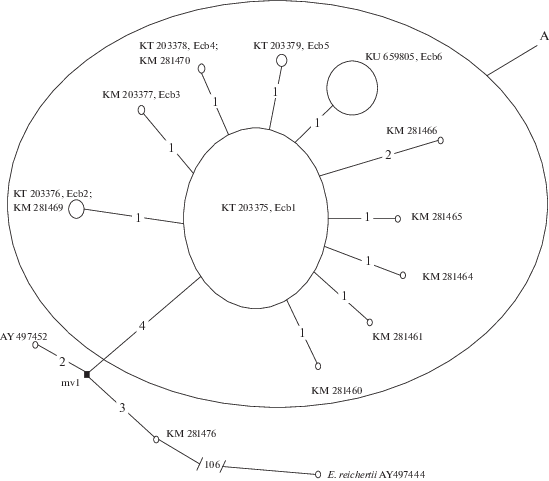
Полученные данные свидетельствуют о том, что экспансия филогенетической группы A, объединяющей все обнаруженные нами гаплотипы гена cytb мтДНК щуки обыкновенной, вероятно, произошла в позднем плейстоцене, который характеризовался благоприятными климатическими условиями. Для большей детализации генетической истории этого вида необходимы расширение ареала исследований и более подробный анализ генетической изменчивости щуки обыкновенной.
Авторы благодарят В.П. Никишина и Г.Д. Иванову за помощь в сборе материала.
Работа выполнена при частичной финансовой поддержке ДВО РАН (грант № 15-I-6-015о) и РФФИ (грант 15-04-01418).
Список литературы
Байрон И.Ю., Миллер В.Г., Минченок В.Д. Развитие низовьев р. Колымы в плейстоцене // Геоморфология. 1977. № 2. С. 44–51.
Баранова Ю.П., Бискэ С.Ф. Северо-Восток СССР. М.: Наука, 1964. 350 с.
Берг Л.С. Рыбы пресных вод СССР и сопредельных стран. М.; Л.: Изд-во АН СССР, 1949. Ч. 2. С. 469–925.
Васьковский А.П. Краткий очерк растительности, климата и хронологии четвертичного периода в верховьях рек Колымы и Индигирки и на северном побережье Охотского моря // Ледниковый период на территории Европейской части СССР и Сибири. М.: Изд-во МГУ, 1959. С. 87–95.
Грунин С.И. Изменение биологической структуры популяции обыкновенной щуки Esox lucius L. среднего течения р. Анадырь в условиях воздействия промысла разной интенсивности // Вестн. СВНЦ ДВО РАН. 2005. Вып. 3. С. 92–95.
Грунин С.И. Динамика популяционных показателей щуки Esox lucius L. (Esocidae) р. Анадырь за период 1971–2010 гг. // Изв. ТИНРО. 2014. Т. 179. С. 45–54.
Грунин С.И., Бакланов М.А. Размерная изменчивость внешне морфологических признаков сеголетков щуки Esox lucius L. // Вестн. Перм. гос. ун-та. 2004. Вып. 2: Биология. С. 99–101.
Грунин С.И., Шестаков А.В. Современное состояние популяции щуки Esox lucius L. среднего течения р. Анадырь (Чукотка) // Вопр. рыболовства. 2011. Т. 12. № 3. С. 457–471.
Дорт-Гольц Ю.Е., Терехова В.Е. История развития западной окраины Берингийской суши в кайнозое // Берингия в кайнозое. Владивосток: ДВНЦ АН СССР, 1976. С. 54–59.
Жуков В.В., Пинчук Л.Я., Пуминов А.П. Палеогеография Северо-Востока Средне-Сибирского плоскогорья и Лено-Анадырской низменности в кайнозое // Четвертичный период Сибири. М.: Наука, 1966. С. 264–272.
Кириллов Ф.Я. Рыбы Якутии. М.: Наука, 1972. 358 с.
Лунсгерсгаузен Г.Ф. Геологическая история средней Лены и некоторые вопросы стратиграфии четвертичных отложений Восточной Сибири // Матер. Всесоюз. совещания по изучению четвертич. периода. М.: Изд-во АН СССР, 1961. Ч. 3. С. 209–217.
Марков К.К., Лазуков Г.И., Николаев В.А. Четвертичный период. Ч. 1, 2. М.: Изд-во МГУ, 1965. 808 с.
Новиков А.С. Рыбы реки Колымы. М.: Наука, 1966. 135 с.
Сычевская Е.К. Ископаемые щуковидные СССР и Монголии. М.: Наука, 1975. 115 с.
Сычевская Е.К. Роль Берингийской суши в расселении щуковидных // Берингия в кайнозое. Владивосток: Изд-во ДВНЦ АН СССР, 1976. С. 242–258.
Хворостова З.М. Геоморфология бассейна верховья реки Колымы. Новосибирск: Наука, 1970. 199 с.
Хохлов Ю.Н., Хохлова Ю.Е. Особенности питания обыкновенной щуки Esox lucius L. в среднем течении р. Анадырь в осенний период // Вестн. СВНЦ ДВО РАН. 2006. № 2. С. 54–58.
Черешнев И.А. Происхождение пресноводной ихтиофауны районов Берингии // Биогеография Берингийского сектора Субарктики. Владивосток: Изд-во ДВНЦ АН СССР, 1986. С. 122–145.
Черешнев И.А. Биологическое разнообразие пресноводной ихтиофауны Северо-Востока России. Владивосток: Дальнаука, 1996. 198 с.
Черешнев И.А. Пресноводные рыбы Чукотки. Магадан: СВНЦ ДВО РАН, 2008. 324 с.
Черешнев И.А., Шестаков А.В., Скопец М.Б. Определитель пресноводных рыб Северо-Востока России. Владивосток: Дальнаука, 2001. 129 с.
Яковлев В.Н. История формирования фаунистических комплексов пресноводных рыб // Вопр. ихтиологии. 1964. Т. 4. С. 10–22.
Bandelt H.J., Forster P., Rohl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. P. 37–48.
Brown W.M., George M., Wilson A.C. Rapid evolution of animal mitochondrial DNA // Proc. Natl Acad. Sci. USA. 1979. V. 76. P. 1967–1971.
Excoffier L., Laval G., Schneider S. Arlequin ver. 3.0: An integrated software package for population genetics data analysis // Evol. Bioinform. Online. 2005. V. 1. P. 47–50.
Fleming M.A., Cook J.A. Phylogeography of endemic ermine (Mustela erminea) in southeast Alaska // Mol. Ecol. 2002. V. 11. P. 795–807.
Grande T., Laten H., Lopez J.A. Phylogenetic relationships of extant esocid species (Teleostei: Salmoniformes) based on morphological and molecular characters // Copeia. 2004. V. 4. P. 743–757.
Hansen M.M., Taggart J.B., Meldrup D. Development of new VNTR markers for pike and assessment of variability at di- and tetranucleotide repeat microsatellite loci // J. Fish Biol. 1999. V. 55. P. 183–188.
Healy J.A., Mulcahy M.F. A biochemical genetic analysis of populations of the northern pike, Esox lucius L., from Europe and North America // J. Fish Biol. 1980. V. 17. P. 317–324.
Ishiguro N.B., Miya M., Nishida M. Basal euteleostean relationships: a mitogenomic perspective on the phylogenetic reality of the “Protacanthopterygii” // Mol. Phylogenet. Evol. 2003. V. 27. P. 476–488.
Miller L.M., Kapuscinski A.R. Notes: microsatellite DNA markers reveal new jevels of genetic variation in northern pike // Trans. Am. Fish. Soc. 1996. V. 125. P. 971–977.
Miller L.M., Kapuscinski A.R. Historical analysis of genetic variation reveals low effective population size in a northern pike (Esox lucius) population // Genetics. 1997. V. 147. P. 1249–1258.
Miller L.M., Senanan W. A review of northern pike population genetics research and its implications for management // North Am. J. Fish. Managem. 2003. V. 23. P. 297–306.
Nei M. Molecular evolutionary genetics. N.Y.: Columb. Univ. Press, 1987. 512 p.
Nicod J.C., Wang Y.Z., Excoffier L., Largiadèr C.R. Low levels of mitochondrial DNA variation among central and southern European Esox lucius populations // J. Fish Biol. 2004. V. 64. P. 1442–1449.
Seeb J.E., Seeb L.W., Oates D.W., Utter F.M. Genetic variation and postglacial of populations of northern pike (Esox lucius) in North America // Can. J. Fish Aquat. Sci. 1987. V. 44. P. 556–561.
Senanan W., Kapuscinski A.R. Genetic relationships among populations of northern pike (Esox lucius) // Can. J. Fish Aquat. Sci. 2000. V. 57. P. 391–404.
Skog A., Vollestad L.A., Stenseth N.C., Kasumyan A., Jakobsen K.S. Circumpolar phylogeography of the northern pike (Esox lucius) and its relationship to the Amur pike (E. reichertii) // Frontiers Zool. 2014.11:67. http://www.frontiersinzoology. com/content/11/1/67.
Tajima F. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism // Gen. Soc. Am. 1989. V. 123 (3). P. 585–595.
Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA-6: Molecular Evolutionary Genetics Analysis Version 6.0.2.74 // Mol. Biol. Evol. 2013. V. 30. P. 2725–2729.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


