Известия РАН. Серия биологическая, 2019, № 2, стр. 162-168
Внеклеточная лакказная активность бактерий родов Azospirillum и Niveispirillum
Е. Г. Пономарева, М. А. Купряшина *, Е. П. Ветчинкина, В. Е. Никитина
Институт биохимии и физиологии растений и микроорганизмов РАН
410049 Саратов, просп. Энтузиастов, 13, Россия
* E-mail: kupryashina_m@mail.ru
Поступила в редакцию 03.04.2017
После доработки 06.07.2018
Принята к публикации 06.07.2018
Аннотация
Установлена способность к продукции внеклеточной лакказы штаммами рода Azospirillum (A. brasilense Sp7, Sp107, Sp245, SR80, A. lipoferum SR42, Sp59b, A. picis TAR-3, A. tiophilum Bv-S, A. amazonense Am) и рода Niveispirillum (N. irakense KBC1, N. irakense KA3). Показана индукция активности фермента рядом ароматических соединений и ионами меди. Впервые выделен и частично охарактеризован гомогенный препарат внеклеточной лакказы штамма A. brasilense Sp245.
В последние десятилетия большое внимание уделяется изучению оксидаз с новыми физико-химическими свойствами и поиску новых продуцентов лакказ. Лакказа (КФ 1.10.3.2) – медьсодержащая оксидаза, являющаяся одним из ключевых ферментов фенолоксидазного комплекса некоторых бактерий и грибов, обладающая широкой субстратной специфичностью и способностью к окислению многих полифенолов и ароматических аминов, восстанавливая при этом молекулярный кислород до воды, минуя стадию образования перекиси водорода (Sharma et al., 2007). Каталитические свойства лакказ обеспечивают возможность их применения в текстильной, целлюлозно-бумажной и пищевой промышленности, а также в качестве агентов биоремедиации, биосенсоров и ферментов-маркеров (Narayanan, Murugan, 2014).
Большинство исследованных и охарактеризованных лакказ выделены в основном из грибных культур. Данные ферменты – один из важнейших компонентов лигнинолитического комплекса фитопатогенных дереворазрушающих грибов, возбудителей белой гнили и почвенных сапротрофов (Морозова и др., 2007; Shraddha et al., 2011). Также известно ~30 лакказ и лакказоподобных белков бактериального происхождения (Sharma et al., 2007; Narayanan, Murugan, 2014). Бактерии, синтезирующие лакказу, представлены родами Aquifex, Azospirillum, Bacillus, Escherichia, Leptothrix, Marinomonas, Oceanobacillus, Pseudomonas, Streptomyces, Thermus, Xanthomonas (Narayanan, Murugan, 2014). Быстрый прогресс в анализе бактериального генома подтверждает, что способность к продукции ферментов фенолоксидазного комплекса широко распространена у микроорганизмов. Лакказы могут продуцироваться в виде единственной и множественных форм фермента. В основном исследованные бактериальные лакказы локализованы внутриклеточно, однако для некоторых микроорганизмов характерна способность к синтезу исключительно внеклеточных форм лакказ (Sharma et al., 2007).
Ранее в смывах с клеточной поверхности и во внутриклеточных экстрактах ряда штаммов бактерий родов Azospirillum и Niveispirillum нами была обнаружена лакказная активность, однако у некоторых штаммов активность фермента была крайне мала или не детектировалась совсем (Никитина и др., 2010).
Цель работы – обнаружение способности к продукции внеклеточной лакказы у бактерий родов Azospirillum и Niveispirillum, а также получение гомогенного препарата фермента из культуральной жидкости штамма A. brasilense Sp245.
МАТЕРИАЛЫ И МЕТОДЫ
Организмы и условия культивирования. В качестве объектов исследования были выбраны штаммы рода Azospirillum (A. brasilense Sp7, Sp107, Sp245, SR80, A. lipoferum SR42, Sp59b, A. picis TAR-3, A. tiophilum Bv-S, A. amazonense Am) и рода Niveispirillum (N. irakense KBC1, N. irakense KA3) из коллекции ризосферных микроорганизмов ИБФРМ РАН (http://collection.ibppm.ru/). Бактерии культивировали на жидкой малатно-солевой среде следующего состава, г/л: KH2PO4 – 0.1, K2HPO4 – 0.4, NaCl – 0.1, Na2MoO4 · 7H2O – 0.002, MgSO4 · 7H2O – 0.2, FeSO4 · 7H2O – 0.02, яблочная кислота – 5, NaOH – 1.7, NH4Cl – 1, CaCl2 – 0.02, pH 6.8. Посевным материалом служила 12-часовая культура, выращенная на среде того же состава.
Определение ферментативной активности. Активность лакказы в культуральной жидкости и на всех стадиях очистки белка определяли спектрофотометрически на приборе Specord M 40 (Carl Zeiss, Германия): по скорости окисления 2,6-диметоксифенола (Acros Organics, США, ε = 30.5 мМ–1 см–1) при длине волны 468 нм (Edens et al., 1999), реакционная проба общим объемом 2 мл содержала 50 мМ Na-тартратный буфер (pH 4.5), 0.2%-ный 2,6-диметоксифенол, образец; по скорости окисления сирингалдазина (Sigma, США, ε = 65 мМ–1 см–1) при длине волны 530 нм (Koroleva et al., 2002), реакционная проба общим объемом 2 мл содержала 0.1 М ацетатный буфер (pH 4.5), 0.1 М сирингалдазин, образец.
За единицу активности принимали количество фермента, катализирующего превращение 1 мкМ субстрата за 1 мин. Удельную активность выражали в ед. на 1 мг белка. Содержание белка в пробах определяли методом Брэдфорд с использованием в качестве стандарта бычьего сывороточного альбумина (БСА) (Bradford et al., 1976).
Выделение и очистка фермента. Для выделения внеклеточной лакказы использовали 48-часовую культуру бактерий A. brasilense Sp245. Клетки осаждали центрифугированием 10 мин при 4°С и 10 000 g, супернатант использовали для дальнейшей очистки. На первом этапе проводили дробное осаждение белков культуральной жидкости сульфатом аммония ((NH4)2SO4) от 0 до 85%. Далее полученный препарат подвергали гель-фильтрации на колонке с Sephadex G-75 (Sigma-Aldrich, Швеция), уравновешенной 0.025 M Na-ацетатным буфером, рН 4.5. Элюирование проводили тем же буфером, содержавшим 0.1 М NaCl. Выход белковых фракций регистрировали на приборе Uviсord S II (LKB, Швеция) при длине волны 280 нм. Активные фракции объединяли и осаждали (NH4)2SO4 до 85%-ного насыщения. Полученный препарат обессоливали на колонке с Sephadex G-25 (Sigma-Aldrich). Обессоленный образец наносили на ионообменную колонку с DEAE-Toyopearl 650 М (Tosoh, Япония), уравновешенную 0.025 M Na-ацетатным буфером, рН 4.5. Связавшиеся с носителем белки элюировали ступенчатым градиентом NaCl от 0 до 1 М. Полученную фракцию, обладающую лакказной активностью, диализовали против воды и использовали для дальнейшего анализа.
Степень очистки фермента определяли по изменению его удельной активности, а также с помощью денатурирующего электрофореза в полиакриламидном геле (ПААГ) с использованием натрия додецилсульфата (ДДС-Na).
Электрофоретический анализ ферментов. Исследование компонентного состава белков на каждой стадии очистки, а также гомогенность полученного препарата фермента и его молекулярную массу определяли с помощью ДДС-Na-электрофореза по Лэммли (Laemmly et al., 1970) в 12.5%-ном ПААГ на приборе для вертикального электрофореза VE-4M (Хеликон, Россия). В качестве стандартов молекулярной массы использовали белки-маркеры (Fermentas, Латвия): β-галактозидазу (116 кДа), БСА (66.2 кДа), яичный альбумин (45 кДа), лактатдегидрогеназу (35 кДа), эндонуклеазу Bsp981 (25 кДа), β-лактоглобулин (18.4 кДа).
Три независимых эксперимента проводились в трех повторностях. При оценке полученных результатов пользовались методом расчета стандартного отклонения среднего арифметического с использованием программы Microsoft Office Excel 2016; данные имеют соответствующие доверительные интервалы при уровне значимости P = 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Первый этап работы – обнаружение внеклеточной активности у 11 штаммов родов Azospirillum и Niveispirillum при культивировании бактерий на жидкой питательной среде в течение 24 ч. Отметим, что штаммы N. irakense KBC1, N. irakense KA3 ранее относились к роду Azospirillum, но в 2014 г. на основании результатов таксономических исследований A. irakense были реклассифицированы как N. irakense (Lin et al., 2014). С учетом полученных ранее данных сравнили штаммы родов Azospirillum и Niveispirillum.
Для более объективной оценки измерение ферментативной активности в культуральной жидкости бактерий проводили с использованием нескольких специфических хромогенных субстратов, так как было ожидаемо, что сродство фермента к субстрату у различных штаммов бактерий может различаться. Как видно на рис. 1, все исследуемые штаммы оказались способны к продукции внеклеточной лакказы. Наиболее высокие показатели лакказной активности при окислении 2,6-диметоксифенола регистрировались для A. brasilense Sp7, Sp245, A. amazonense Am и N. irakense KBC1, KA3 (рис. 1а), а сирингалдазин лучше всего окисляли штаммы A. lipoferum SR42, A. amazonense Am и N. irakense KBC1, KA3 (рис. 1б). Нами отмечено, что как представители рода Azospirillum, так и нивеиспириллы проявляли бóльшую активность при использовании в качестве хромогенного субстрата 2,6-диметоксифенола – природного субстрата лакказ, по данным некоторых авторов (Claus, 2003). Однако для штамма A. lipoferum SR42 было характерно проявление сродства фермента в большей степени к сирингалдазину – субстрату, специфичному для многих грибных лакказ (Koroleva et al., 2002).
Рис. 1.
Внеклеточная лакказная активность по степени окисления 2,6-диметоксифенола (а) и сирингалдазина (б). 1 – Azospirillum brasilense Sp7; 2 – A. brasilense Sp107; 3 – A. brasilense Sp245; 4 – A. brasilense SR80; 5 – A. lipoferum SR42; 6 – A. lipoferum Sp59b; 7 – A. picis TAR-3; 8 – A. tiophilum Bv-S; 9 – A. amazonense Am; 10 – Niveispirillum irakense KA3; 11 – N. irakense KBC1.
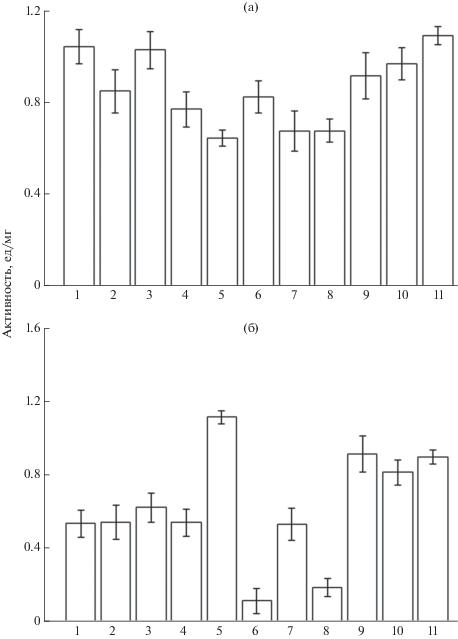
При сравнении полученных нами данных с результатами ранее проведенных исследований (Никитина и др., 2010) было обнаружено, что штаммы A. brasilense Sp7, A. lipoferum 59b, N. irakense KBC1 и A. amazonense Am, для которых отмечались крайне низкие, следовые, значения лакказной активности во внутриклеточных экстрактах и в смывах с бактериальной поверхности, проявляли высокую активность лакказы в культуральной жидкости.
Сегодня функциональная значимость лакказ в жизнедеятельности бактерий до конца не изучена. Однако известно, что растительные лакказы играют важную роль в процессах лигнификации, тогда как лакказы грибов способны, наоборот, к деструкции лигнинов и лигниноподобных веществ, а также принимают участие в споруляции, синтезе пигментов и формировании плодовых тел (Claus, 2003; Shraddha et al., 2011; Narayanan, Murugan, 2014). Для дальнейшего изучения свойств внеклеточной лакказы нами был выбран штамм A. brasilense Sp245 – природный симбионт пшеницы, для которого способность к эндофитному симбиозу строго доказана, однако до сих пор до конца не исследованы ферментные системы, позволяющие данному штамму проникать внутрь растительных тканей и существовать там в физиологически активном состоянии.
Показано, что, как правило, лакказы продуцируются в достаточно низких концентрациях, однако синтез фермента удается повысить внесением в качестве индукторов фенольных соединений (Vasconcelos et al., 2000). У грибных лакказ фенольные соединения выступают активаторами синтеза фермента уже на уровне транскрипции генов за счет наличия в промоторной области сайтов узнавания, специфических для данных ароматических соединений (Faraco et al., 2002). Согласно опубликованным данным бактериальные лакказы также являются индуцибельными ферментами и внесение в среду культивирования, к примеру, феруловой или аминобензойной кислот приводит к увеличению их продукции (Malhotra et al., 2004; McMahon et al., 2007).
Было исследовано влияние на активность внеклеточной лакказы штамма A. brasilense Sp245 присутствия в среде культивирования таких ароматических соединений, как фенол, пирокатехин, сирингалдазин, 2,2-азино-бис(3-этилбензотиазолин-6-сульфонатом) (АБТС) и гваякол. Выбранные вещества вносили стерильно при засеве культуры в концентрациях 0.05, 0.1 и 0.5 мМ. При выборе концентрации исследуемых соединений мы основывались на подобных экспериментах c другими микроорганизмами (Malhotra et al., 2004; Arora, Gill, 2005; McMahon et al., 2007). Установлено, что все используемые в эксперименте индукторы примерно в равной степени увеличивали лакказную активность. Однако было отмечено, что использование фенола даже в минимальной концентрации, а пирокатехина и сирингалдазина в концентрации 0.5 мМ негативно влияло на рост бактерий. Максимальная активность лакказы регистрировалась при культивировании A. brasilense Sp245 в присутствии 0.1 мМ гваякола.
Также известно, что эффективный индуктор лакказ – Cu2+ (Шутова и др., 2008). В экспериментах с внесением в среду Cu2+ обнаружена индукция активности лакказы у многих видов грибов, которая наряду с концентрационной зависимостью оказалась видоспецифичной. Кроме того, повышение активности лакказ под действием Cu2+ может происходить на транскрипционном уровне (Faraco et al., 2002). Для бактериальных лакказ также показано, что наличие в среде выращивания Cu2+ индуцирует продукцию фермента (Mongkolthanaruk et al., 2012; Narayanan, Murugan, 2014; Rajeswari, Bhuvaneswari, 2016). В наших исследованиях источником Cu2+ послужил сульфат меди (CuSO4). Нами установлено, что внесение CuSO4 в концентрации 0.1 мМ не ингибировало рост бактерий и положительно влияло на синтез фермента, увеличивая его активность примерно в 6 раз.
Для дальнейшего изучения свойств внеклеточной лакказы A. brasilense необходимо было выделение гомогенного фермента. Для получения внеклеточной лакказы в препаративных количествах нужно было увеличить продукцию фермента. С учетом ранее полученных результатов были подобраны оптимальные условия культивирования бактерий для продукции лакказы. В качестве индуктора ферментативной активности использовали гваякол в конечной концентрации 0.1 мМ, так как он не оказывал негативного влияния на жизнеспособность бактерий, а в среду культивирования вносили 0.1 мМ CuSO4.
Первая стадия очистки – осаждение белков из культуральной жидкости дробным фракционированием (NH4)2SO4. Для этого клетки A. brasilense Sp245 после 48 ч культивирования на жидкой питательной среде удаляли центрифугированием, в супернатант при постоянном перемешивании добавляли 242 г/л (NH4)2SO4 и оставляли в холодильной камере на 12 ч. От образовавшегося осадка избавлялись центрифугированием. Далее белок из полученного супернатанта осаждали (NH4)2SO4 до 80% полного насыщения, выдерживали 12 ч при –4°.
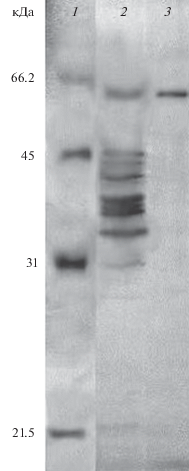
Вторая стадия очистки – отделение центрифугированием выпавшего в осадок грубого препарата фермента, перерастворение его в минимальном количестве 0.025 M Na-ацетатного буфера, pH 4.5, и гель-фильтрация на колонке с Sephadex G-75. Как видно из представленной электрофореграммы (рис. 2), в ходе второго этапа удалось избавиться от высокомолекулярных белков. В полученном препарате преобладали белки массой от 70 до 30 кДа. При этом препарат не терял ферментативной активности.
Рис. 2.
ДДС-Na-электрофорез препарата внеклеточной лакказы Azospirillum brasilense Sp245. 1 – маркеры; 2 и 3 – препарат после гельпроникающей хроматографии на колонке с Sephadex G-75 и анионообменной хроматографии на колонке с Toyopearl DEAE-650M соответственно.
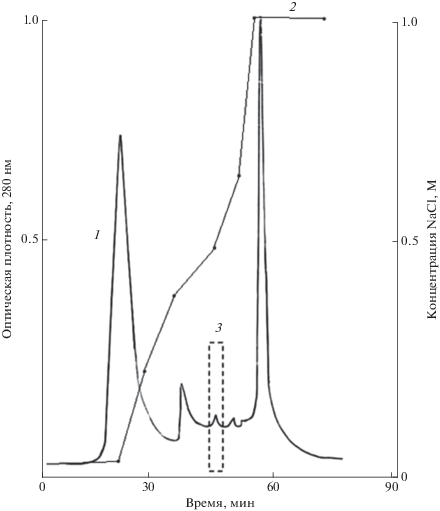
Далее ферментную вытяжку освобождали от низкомолекулярных примесей с помощью гель-фильтрации на колонке с Sephadex G-25, уравновешенной тем же стартовым буфером. Затем препарат наносили на колонку с гелем Toyopearl DEAE-650M, уравновешенную 0.025 M Na-ацетатным буфером, pH 4.5. После нанесения препарата колонку промывали стартовым буфером, элюцию проводили в ступенчатом градиенте соли от 0.1 до 1 М NaCl. Белки, обладающие лакказной активностью, элюировались при концентрации NaCl 0.5 М (рис. 3).
Рис. 3.
Анионообменная хроматография лакказы Azospirillum brasilense Sp245 на колонке Toyopearl DEAE-650M. 1 – белок, 2 – градиент ионной силы, 3 – пик с максимальной ферментативной активностью.
Таким образом, с помощью предложенной нами методики был получен препарат внеклеточной лакказы штамма A. brasilense Sp245 со степенью очистки 17 раз. Гомогенность полученного препарата фермента подтверждали методом ДДС-Na-электрофореза. Установлено, что внеклеточная лакказа A. brasilense Sp245 – это односубъединичный фермент молекулярной массой ~60 кДа (рис. 2). Молекулярная масса известных на сегодня бактериальных лакказ – 50–70 кДа (Sharma et al., 2007; Muthukumarasamy et al., 2015). Удельная активность выделенной лакказы – 20.5 ед./мг.
Выделенный белок при очистке терял ферментативную активность, однако добавление раствора CuSO4 восстанавливало потерянное свойство. Полученные нами данные согласуются с ранее опубликованными, когда при очистке внутриклеточной лакказы штамма A. lipoferum происходила полная инактивация фермента, однако активность восстанавливалась при добавлении в инкубационную смесь Cu2+ (Givaudan et al., 1993). Выделенная в чистом виде и частично охарактеризованная внутриклеточная лакказа штамма A. lipoferum после финальной стадии очистки также элюировалась с колонки в неактивной или латентной форме, но активировалась ДДС-Na (Diamantidis et al., 2000). Ранее также отмечалась активация лакказной активности при внесении в инкубационную смесь сирингалдазина, АБТС и ДДС-Na (Alexandre et al., 1996). Однако стоит отметить, что один из тестов на лакказную природу фермента – ингибирование ферментативной активности в присутствии ДДС-Na (Позднякова и др., 2006; Kuddus et al., 2013). При исследовании свойств очищенного препарата внеклеточной лакказы A. brasilense Sp245 установлено, что фермент теряет окислительную активность в присутствии 0.4 мМ ДДС-Na.
Согласно опубликованным ранее данным один из наиболее сильных ингибиторов лакказной активности – этилендиаминтетрауксусной кислоты – динатриевая соль (ЭДТА) (Castro-Sowinski et al., 2002; Kuddus et al., 2013). В концентрации 0.1 мМ ЭДТА полностью блокировала активность внеклеточной лакказы A. brasilense Sp245.
Выделенная нами фенолоксидаза не окисляла тирозин и L-диоксифенилаланин. Отсутствие способности окислять данные специфические субстраты тирозиназы подтверждает лакказную природу полученного фермента (Diamantidis et al., 2000). pH-оптимум лежал в кислой области (рН 3–4.5), что характерно для грибных лакказ (Позднякова и др., 2006; Шутова и др., 2008). Интересно, что большинство известных как внутриклеточных, так и внеклеточных бактериальных лакказ активны в щелочной среде (Sharma et al., 2007; Muthukumarasamy et al., 2015). Показано, что лакказы грибного происхождения часто инактивируются уже при воздействии температуры выше 40°С (Shraddha et al., 2011; Narayanan, Murugan, 2014). Лакказа A. brasilense Sp245 была термостабильна и не теряла активность после 30 мин инкубации при 80°С, как и некоторые известные экстраклеточные лакказы бактериального происхождения (Muthukumarasamy et al., 2015; Rajeswari, Bhuvaneswari, 2016).
ЗАКЛЮЧЕНИЕ
В ходе проведенного исследования установлена способность к продукции внеклеточной лакказы бактериями родов Azospirillum и Niveispirillum. Впервые выделен и частично охарактеризован гомогенный препарат внеклеточной лакказы A. brasilense Sp245.
Функциональную значимость фенолоксидаз в целом, и лакказ в частности, у бактерий рода Azospirillum еще предстоит исследовать. Основываясь на полученных данных об индукции лакказной активности фенольными соединениями (наиболее распространенные вторичные метаболиты растений, активно обнаруживаемые не только в экссудатах корней, но также при разложении лигниноподобных веществ), можно предположить, что подобный ферментативный отклик свидетельствует о важности фермента в адаптивном потенциале бактерии, не исключая возможного участия лакказы в колонизации бактериями как поверхностных, так и внутренних тканей растений.
Изучение бактериальных лакказ представляется крайне перспективным направлением. Показано, что, несмотря на более низкую каталитическую активность, бактериальные лакказы обладают рядом свойств, не характерных для классических грибных лакказ. Лакказы бактериального происхождения часто отличаются более высокой термостабильностью, способностью к окислительным реакциям без внесения дополнительных кофакторов. В связи с этим необходимо дальнейшее исследование свойств внеклеточных лакказ азоспирилл.
Список литературы
Морозова О.В., Шумакович Г.П., Горбачева М.А., Шлеев С.В., Ярополов А.И. “Голубые” лакказы // Биохимия. 2007. Т. 72. № 10. С. 1396–1412.
Никитина В.Е., Ветчинкина Е.П., Пономарева Е.Г., Гоголева Ю.В. Фенолоксидазная активность бактерии рода Azospirillum // Микробиология. 2010. Т. 79. № 3. С. 344–351.
Позднякова Н.Н., Турковская О.В., Юдина Е.Н., Родакевич-Новак Я. Желтая лакказа гриба Pleurotus ostreatus D1: очистка и характеристика // Прикл. биохимия и микробиология. 2006. Т. 42. № 1. С. 63–69.
Шутова В.В., Ревин В.В., Мякушина Ю.А. Влияние ионов меди на синтез лакказы грибом Lentinus (Panus) tigrinus // Прикл. биохимия и микробиология. 2008. Т. 44. № 6. С. 683–687.
Alexandre G., Jacoud C., Faure D. Population synamics of a motile and a non–motile Azospirillum lipoferum strain during rice colonization and motility variation in the rhizosphere // FEMS Microbiol. Ecol. 1996. V. 19. P. 271–278.
Arora D.S., Gill P.K. Production of ligninolytic enzymes by Phlebia floridensis // World J. Microbiol. Biotechnol. 2005. № 21. P. 1021–1028.
Bradford M.M. A rapid and sensitive method for the quantitation of microgram qualities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. P. 248–254.
Castro-Sowinski S., Martinez-Drets G., Okon Y. Laccase activity in melanin-producing strains of Sinorhizobium meliloti // FEMS Microbiol. Lett. 2002. V. 209. P. 119–125.
Claus H. Laccases and their occurrence in prokaryotes // Arch. Microbiol. 2003. V. 179. P. 145–150.
Diamantidis G., Effosse A., Potier P., Bally R. Purification and characterization of the first bacterial laccase in the rhizospheric bacterium Azospirillum lipoferum // Soil Biol. Biochem. 2000. V. 32. P. 919–927.
Edens W.A., Going T.Q., Dooley D., Henson A.M. Characterization of a secreted laccase of Gaeumannomyces graminisvar. tritici // Appl. Environ. Microbiol. 1999. V. 65. № 7. P. 3071–3074.
Faraco V., Giardina P., Palmieri G., Sannia G. Metalactivated laccase promoters // Prog. Biotechnol. 2002. V. 21. P. 105–111.
Givaudan A., Effosse A., Faure D., Potier P., Bouillant M.-L., Bally R. Polyphenol oxidase in Azospirillum lipoferum isolated from rice rhizosphere: evidence for laccase activity in non-motile strains of Azospirillum lipoferum // FEMS Microbiol. Lett. 1993. V. 108. P. 205–210.
Koroleva O.V., Stepanova E.V., Gavrilova V.P., Ikovleva N.S., Landesman E.O., Iavmetdinov I.S., Iaropolov A.I. Laccase and Mn-peroxidase production by Coriolus lirgutus strain 075 in a jan fermentor // J. Biosci. Bioeng. 2002. V. 93. № 5. P. 449–455.
Kuddus M., Joseph B., Ramteke P.W. Production of laccase from newly isolated Pseudomonas putida and its application in bioremediation of synthetic dyes and industrial effluents // Biocatal. Agricul. Biotechnol. 2013. V. 2. P. 333–338.
Laemmly U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 // Nature. 1970. V. 227. P. 680–685.
Lin S.Y., Hameed A., Shen F.T., Liu Y.C., Hsu Y.H., Shanina M., Lai W.A., Young C.C. Description of Niveispirillum fermenti gen. nov., sp. nov., isolated from a fermentor in Taiwan, transfer of Azospirillum irakense (1989) as Niveispirillum irakense comb. nov., and reclassification of Azospirillum amazonense (1983) as Nitrospirillum amazonense gen. nov // Antonie Van Leeuwenhoek. 2014. V. 105. P. 1149–1162.
Malhotra K., Sharma P., Capalash N. Copper and dyes enhance laccase production in γ-proteobacterim JB // Biotechnol. Lett. 2004. V. 26. P. 1047–1050.
McMahon M., Doyle E.M., Brooks S., O’Connor K.E. Biochemical characterisation of the coexisting tyrosinase and laccase in the soil bacterium Pseudomonas putida F6 // Enzyme Microbial. Technol. 2007. V. 40. P. 1435–1441.
Mongkolthanaruk W., Tongbopit S., Bhoonobtong A. Independent behavior of bacterial laccases to inducers and metal ions during production and activity // Afr. J. Biotechnol. 2012. V. 11(39). P. 9391–9398.
Muthukumarasamy N.P., Jackson B., Raj J.A., Sevanan M. Production of extracellular laccase from Bacillus subtilis MTCC 2414 using agroresidues as a potential substrate // Biochem. Res. Intern. 2015. Art. ID 765190.
Narayanan P.M., Murugan S. Production, purification and application of bacterial laccase: a review // Biotechnology. 2014. V. 13. № 5. P. 196–205.
Rajeswari M., Bhuvaneswari V. Production of extracellular laccase from the newly isolated Bacillus sp. PK4 // Afr. J. Biotechnol. 2016. V. 15. P. 1813–1826.
Sharma P., Goel R., Capalash N. Bacterial laccases // World J. Microbiol. Biotechnol. 2007. V. 23. P. 823–832.
Shraddha, Shekher R., Sehgal S., Kamthania M., Kumar A. Laccase: microbial sources, production, purification, and potential biotechnological applications // Enzyme Res. 2011. Art. ID 217861.
Vasconcelos A.F.D., Barbosa A.M., Dekker R.F.H., Scarminio I.S., Rezende M.I. Optimization of laccase production by Botryosphaeria sp. in the presence of veratryl alcohol by the response-surface method // Proc. Biochem. 2000. V. 35. № 10. P. 1131–1138.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


