Известия РАН. Серия биологическая, 2019, № 4, стр. 380-388
Белковый электрофорез в полиакриламидном геле как метод идентификации видов-двойников обыкновенной полевки Microtus arvalis Pallas, 1779 и M. rossiaemeridionalis Ognev, 1924 (Rodentia, Cricetidae)
И. А. Жигарев 1, 2, *, Д. И. Жигарев 1, 3, В. В. Алпатов 1, 2, В. В. Лапковский 2, В. М. Малыгин 4, С. В. Симак 5
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
2 Московский педагогический государственный университет, Институт биологии и химии
129164 Москва, ул. Кибальчича, 6, корп. 3, Россия
3 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
4 Московский государственный университет им. М.В. Ломоносова, биологический ф-т
119234 Москва, Ленинские горы, 1, стр. 12, Россия
5 Самарская государственная областная академия (Наяновой)
443001 Самара, ул. Молодогвардейская, 196, Россия
* E-mail: i.zhigarev@gmail.com
Поступила в редакцию 16.10.2017
После доработки 30.01.2018
Принята к публикации 22.03.2018
Аннотация
Предложен новый протокол идентификации двух видов-двойников обыкновенных полевок Microtus arvalis и M. rossiaemeridionalis методом электрофореза белков крови в полиакриламидном геле (ПААГ). Исследованы образцы двух видов, отловленных в 10 районах Московской, Калужской, Самарской областей и природных территорий г. Москвы (1030 особей), а также взятых из коллекций вивария (5 особей гибридов двух видов). Осуществлено сравнение электрофорезов в ПААГ, агарозном геле и на ацетатцеллюлозных пластинах. Проведена оценка использования разных органов и тканей для видовой идентификации. Определены относительная электрофоретическая подвижность и масса видоспецифического белка крови восточно-европейской полевки.
Существование симпатрических, а иногда и симбиотопических, но генетически закрытых одна для другой популяционных систем, представители которых, на взгляд исследователя, чрезвычайно схожи и, по всей видимости, одинаково используют среду обитания, представляет интерес как для систематиков, так и для экологов и эволюционистов. С использованием этого природного феномена можно решать множество задач. Однако до сих пор идентификация видов-двойников обыкновенной полевки Microtus arvalis s.l. – проблемная задача. Сегодня для распознания двух симпатрических и симбиотопических близких видов полевок – обыкновенной M. arvalis Pallas, 1779 и восточно-европейской M. rossiaemeridionalis Ognev, 1924 (=M. levis Miller, 1908, обоснование приоритета этого названия требует дополнительного исследования) полевок – существуют четыре группы методов.
Цитогенетический метод надежен для определения этих видов (Мейер и др., 1969; Малыгин, 1970, 1983; Орлов, Малыгин, 1974; Загороднюк, 1991а; Баскевич и др., 2016). Полевки имеют разные наборы хромосом: различаются их числа и формы. В кариотипе M. rossiaemeridionalis (2n = 54) преобладают акроцентрические хромосомы (число хромосомных плеч (NF) равно 56), а у M. arvalis (2n = 46) – субметацентрические и метацентрические (хромосомные формы “arvalis” (NF = 84) и “obscurus” (NF = 72)). Имеются данные об относительно широкой изменчивости NF у кариоформ “arvalis” и “obscurus”, которая обусловлена разным числом наблюдаемых акроцентриков в хромосомном наборе, что не мешает надежно различать 54- и 46-хромосомные виды (Малыгин, 1983; Загороднюк, 1991а; и др.). К недостаткам метода следует отнести его трудоемкость, продолжительность и необходимость иметь исходно живой материал для использования клеток костного мозга. В экологических исследованиях, этот метод идентификации видов можно использовать лишь при работе с живыми объектами (метод мечения и повторных поимок, лабораторные эксперименты). Идентифицировать полевок, добытых давилками и цилиндрами, цитогенетический метод не позволяет.
Морфометрический метод до последнего времени вообще не считался сколь-нибудь надежным. До сих пор не найдены более-менее четкие, дискретные морфологические признаки, по которым можно было бы различать восточно-европейских и обыкновенных полевок (Малыгин, 1978, 1983; Загороднюк, 1991б; и др.). Использование математических методов, в том числе дискриминантного анализа экстерьерных, краниометрических (Мейер, Дитятев, 1989; Малыгин, Пантелейчук Сантуш Луиш, 1996) и одонтологических признаков (Маркова и др., 2003; Markova et al., 2010), позволяет с некоторой осторожностью проводить разграничение этих видов. Однако выявленные в работах отличия двойников имеют характер ”тенденций“. Доля ошибок в определении видовой принадлежности достаточно высока (20–25%), что позволяет дифференцировать виды лишь с некоторой вероятностью. Таким образом, даже статистический анализ по множеству морфологических признаков сегодня следует признать малонадежным методом.
Убедительные различия видов-двойников и оценку внутривидового полиморфизма демонстрируют молекулярно-генетические методы. Один из них – оценка полиморфизма рестриктных фрагментов (ПДРФ) ДНК RFLP (Календарь, Глазко, 2002; Juskeviciute, Paulauskas, 2003) – основан на обработке выделенной ДНК различными рестриктазами, с дальнейшим разделением фрагментов рестрикции электрофорезом и их гибридизацией со специфическими ДНК-зондами. Другая группа методов – анализ анонимных последовательностей с помощью полимеразной цепной реакции (RAPD, AFLP, ISSR), где используют специфические праймеры, получают и анализируют дискретные ДНК-продукты амплификации. Для полевок надвидового комплекса M. arvalis s.l. в различных работах использовали анализ как ядерной, так и митохондриальной ДНК (мтДНК) (Потапов и др., 1999; Fink et al., 2004; Баскевич и др., 2009, 2012; Булатова и др., 2010). С 2004 г. растет популярность метода ДНК-штрихкодирования (ДНК-баркодинг) с использованием коротких специфических маркеров из эталонных участков генома для определения таксономического положения изучаемого организма. Для этого создается ДНК-библиотека эталонных участков генома (Galan et al., 2012).
Имеющиеся в базе данных GenBank (NCBI) расшифрованные последовательности мтДНК этих видов позволят в будущем разработать перспективные методы для дифференциации видов-двойников обыкновенной полевки.
Электрофорез гемоглобина стал наиболее перспективным, умеренно затратным и достоверным методом дифференциации близких видов обыкновенных полевок (Доброхотов, Малыгин, 1982). Идентификация видов основана на том, что гемоглобин обыкновенной полевки имеет одну широкую (мажорную) мигрирующую при электрофорезе белковую фракцию, а гемоглобин восточно-европейской полевки – две: одну широкую, схожую с таковой у предыдущего видa, и одну минорную, более узкую и подвижную (следовательно, мигрирующую в электрофорезе несколько дальше).
Техника постановки электрофореза в горизонтальной камере на ацетилцеллюлозных пластинах (Доброхотов, 1985) хорошо себя зарекомендовала и использовалась во многих исследованиях (Загороднюк, Тесленко, 1986; Барановский, Охотский, 1988; Жигарев, 1993, 2004; Тихонов и др., 1998, 2010; Баскевич и др., 2005; Тихонова и др., 2005; Михайлова и др., 2008; Опарин и др., 2010; и др.). Однако в последнее время оборудование и оснащение биохимических лабораторий существенно изменились. Современные электрофорезы белков проводят в основном в агарозном геле и ПААГ. Эти анализы можно проводить в любой биохимической лаборатории.
Цель работы – создание нового современного протокола электрофореза белков крови в ПААГ для дифференциации двух видов-двойников – M. arvalis и M. rossiaemeridionalis.
МАТЕРИАЛЫ И МЕТОДЫ
Были использованы 9 экз. цитогенетически идентифицированных особей M. arvalis, M. rossiaemeridionalis, отловленных в Калужской, Московской областях и на природных территориях г. Москвы (служили контролем в работах по электрофорезу), а также их гибридов (5 экз., коллекция кафедры зоологии позвоночных МГУ). Кроме того, использовали цитогенетически не идентифицированных серых полевок, отловленных в Калужской обл. (окрестности г. Балабаново, Жуковского р-на) − 21 экз., в Московской обл. (окрестности г. Черноголовка, Ногинского р-на) − 5 экз., в Самарской обл. (национальный парк “Самарская Лука”, Жигулевский заповедник и окрестности г. Тольятти) − 983 экз., в лесопарковых районах г. Москвы (долина р. Сетунь) − 12 экз.
Препараты для определения хромосомного набора готовили по стандартной методике из клеток костного мозга (Ford, Hamerton, 1956).
Для определения видов-двойников электрофорезом гемоглобина достаточно в полевых условиях взять несколько капель крови у живых особей или использовать органы добытых животных, содержащих кровь. Для отработки различных методических приемов мы использовали свежую кровь, кровяные сгустки, легкое, сердце, селезенку, печень и скелетные мышцы добытых зверьков. У живых особей кровь брали из подъязычной вены. В анализе использовали как свежие органы, так и замороженные. Заморозку осуществляли в двух режимах: при –18°С (температура стандартных бытовых морозильных камер) и при –80°С.
Электрофорез белков крови (>2600 анализов) проводили c использованием трех методических приемов − на ацетатцеллюлозных пластинах, в агарозном геле и ПААГ.
Молекулярную массу видоспецифичного белка (минорной полосы на фореграмме) оценивали с использованием денатурирующего электрофореза в трициновом буфере, обладающего более высокой разрешающей способностью по сравнению с нативным электрофорезом, описанным далее. Денатурирующий электрофорез требует больших временны́х и материальных затрат.
Для проведения электрофореза в ПААГ использовали следующее оборудование: вертикальную электрофорезную камеру (рассчитанную на 1–4 геля) Mini-PROTEAN Tetra Cell (Bio-Rad, США, cat. № 165-8000), pH-метр (Аквилон pH-410, Россия), источник питания “Эльф-4” (ДНК-технология, Россия, cat. № PS-400). Для электрофореза в агарозном геле и на ацетатцеллюлозных пластинах использовали камеру для горизонтального электрофореза SE-1 (Хеликон, артикул SE-1), источник питания “Эльф-4”, ацетатцеллюлозные пластины Владипор 90 × 90 (МФФС-ЩС-1).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сравнительный анализ методов разделения белков показал, что из трех существующих типов наибольшей информативностью в дифференциации видов-двойников обыкновенных полевок обладает электрофорез в ПААГ, меньшей – на ацетатцеллюлозных пластинах. Электрофорез белков крови в агарозном геле (2.5%) неприменим для разделения видов-двойников, так как диагностические белковые фракции ввиду малой разрешающей способности этого геля не разделяются.
Стерильные межвидовые гибриды M. arvalis и M. rossiaemeridionalis, как и межвидовые гибриды M. rossiaemeridionalis и M. transcaspicus, дают электрофореграмму, сходную с “чистым” видом M. rossiaemeridionalis (Жигарев и др., 2011). В этом случае диагностируется вторая (минорная) полоса.
Информативность электрофореграмм, проведенных в ПААГ, практически не зависит от того, используются в анализе цельная кровь (плазма и форменные элементы) или отмытые эритроциты. Оба варианта дают приемлемые результаты дифференциации исследуемых видов. Использование цельной крови несколько перегружает электрофореграмму дополнительными полосами белков плазмы крови, но эта работа требует меньших затрат усилий и времени. Кроме того, цельная кровь более информативна, так как включает в себя и другие белки, которые могут быть использованы для дифференциации межвидовых гибридов (Жигарев и др., 2011).
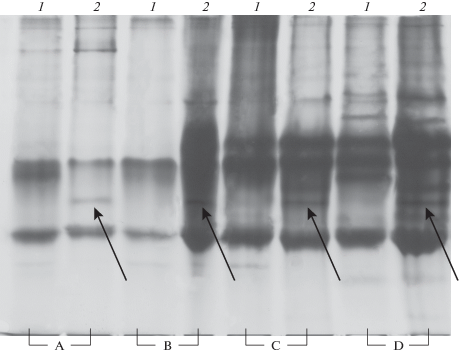
Анализ результатов электрофореза лизатов (в ЭДТА) разных органов и тканей (кровь, легкие, сердце, селезенка, печень и скелетные мышцы) показал пригодность всех проб для идентификации видов-двойников методом электрофореза в ПААГ. Более четкое разграничение видов-двойников обнаружено в пробах из свежей крови и сгустков свернувшейся крови (в том числе замороженной). Неплохие результаты получают при анализе лизатов селезенки, легких и печени, значительно хуже – результаты анализа лизатов мышц, сердца и легкого, не имеющих сгустков крови (рис. 1). Важно наличие в лизате гемоглобина. Надо учитывать, что при использовании печени для дифференциации видов на электрофореграмме проявляется много белков, поэтому камеры с малым пробегом (имеющие короткие гелевые пластины) могут давать трудноразличимые полосы, малопригодные для идентификации.
Рис. 1.
Электрофореграмма в ПААГ белков лизатов разных органов двух видов-двойников Microtus arvalis (1) и M. rossiaemeridionalis (2). A – легкое со сгустками крови, B – селезенка, C – печень, D – сердце. Стрелками указана видоспецифическая для восточно-европейской полевки полоса белков (Rf = 0.584); для рис. 1 и 2.
После проведения полевых исследований не всегда удается сразу проанализировать полученные данные. Приходится хранить материал в морозильной камере. Мы проверили влияние хранения биологического материала в холодильнике на качество получаемой информации. Оказалось, что биологический материал (трупы полевок или замороженные в том числе в растворах ЭДТА кровь и органы), хранящийся в морозильной камере (–18°С) в течение 2–3 лет, дает приемлемый для идентификации результат и практически не меняет характер распределения белков при форезе. Годятся для идентификации и более старые образцы. Со временем белки разрушаются и на электрофореграмме дают широкую полосу, не позволяющую разделять виды. К такому же результату приводит многократное замораживание и оттаивание биоматериала. Хранение при –80°С позволяет значительно продлить (по крайней мере до 6–8 лет) качество материала.
Электрофореграммы в ПААГ могут существенно отличаться по информативности в зависимости от концентраций используемых веществ и методик. Необходимо обратить внимание на степень разведения образцов раствором ЭДТА перед загрузкой в гель. При использовании концентрированных образцов получаются смазанные полосы, избыточное разведение приводит к тому, что увидеть видоспецифические полосы на электрофореграмме невозможно (рис. 2). Для получения хороших результатов необходимо разводить биоматериал раствором ЭДТА до слаборозового цвета.
Рис. 2.
Электрофореграмма в ПААГ белков лизата печени Microtus rossiaemeridionalis при разбавлении ЭДТА. 1 – однократное (лизат красноватого цвета), 2 – двукратное (лизат светло-розового цвета), 3 –четырехкратное, 4 – восьмикратное разбавление.

Были использованы разные концентрации ПААГ (6.25–12.5%) и экспериментально выявлено, что для идентификации двойников наиболее информативен 10.4%-ный гель.
В результате исследований с помощью компьютерной программы Totallab TL120 (info@totallab.com) была проведена оценка молекулярной массы видоспецифичного белка (минорная полоса на фореграмме, позволяющая идентифицировать M. rossiaemeridionalis). Массы маркерных белков составляют 12.8–13 кДа (рис. 3). Относительная электрофоретическая подвижность (Rf) белка минорной полосы в нативном электрофорезе (10.4%-гель) составила 0.58–0.59. Проведенные цитогенетический и электрофоретический анализы зверьков (1030 экз.), добытых в 10 географических районах Московской, Калужской, Самарской областей и природных территорий г. Москвы, показали численное доминирование M. arvalis. Лишь в Москве преобладала восточно-европейская полевка (табл. 1).
Рис. 3.
Оценка молекулярной массы видоспецифических белков восточно-европейской полевки. 1 – Microtus rossiaemeridionalis (сгусток крови), 2 – M. arvalis (сгусток крови), 3 – M. rossiaemeridionalis (селезенка), 4 – M. arvalis (селезенка), M – набор белковых маркеров. Овалы – видоспецифические для восточно-европейской полевки полосы белков.
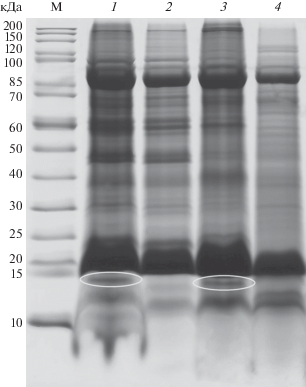
Таблица 1.
Пункты отлова и число определенных (цитогенетически и (или) электрофорезом белков крови) видов-двойников Microtus arvalis и M. rossiaemeridionalis
| Место отлова | Число особей | ||
|---|---|---|---|
| Всего | M. arv. | M. rossi. | |
| г. Москва, долина р. Сетунь, пересечение с ул. Минской (N 55.721037, E 37.501080), ул. Рябиновой (N 55.701107, E 37.412872) и Аминьевским шоссе (N 55.710323, E 37.460100) | 14 | 0 | 14 |
| Московская обл., Ногинский р-н, окр. г. Черноголовка (N 56.037164, E 38.423409; N 56.022408, E 38.415616) | 7 | 6 | 1 |
| Калужская обл., Жуковский р-н, окр. г. Балабаново (N 55.196806, E 36.717885; N 55.188731, E 36.705424) | 26 | 26 | 0 |
| Самарская обл., национальный парк “Самарская Лука”, окр. с. Брусяны (N 53.229453, E 49.374495) | 297 | 287 | 10 |
| Самарская обл., национальный парк “Самарская Лука”, окр. с. Малая Рязань (N 53.229107, E 49.302547) | 217 | 213 | 4 |
| Самарская обл., национальный парк “Самарская Лука”, окр. д. Кольцово (N 53.189586, E 49.419946) | 206 | 202 | 4 |
| Самарская обл., Жигулевский ГПБЗ, окр. с. Бахилова Поляна (N 53.428487, E 49.669588) | 91 | 88 | 3 |
| Самарская обл., окр. г. Тольятти, вблизи завода “Тольяттиазот” (N 53.532389, E 49.632381) | 35 | 34 | 1 |
| Самарская обл., окр. г. Тольятти, вблизи Васильевских очистных сооружений (N 53.539804, E 49.567104) | 59 | 57 | 2 |
| Самарская обл., окр. г. Тольятти, вблизи бывшего АО “Фосфор” (N 53.537076, E 49.508280) | 78 | 77 | 1 |
| Всего | 1030 | 990 | 40 |
Протокол детального описания электрофореза белков крови в ПААГ рассчитан на осуществление электрофореза исследователем-биохимиком любой квалификации, поэтому некоторые описания для специалистов высокой квалификации покажутся излишними. Электрофорез потребует небольших затрат времени и средств.
ПРОТОКОЛ ЭЛЕКТРОФОРЕЗА БЕЛКОВ КРОВИ ВИДОВ-ДВОЙНИКОВ M. arvalis И M. rossiaemeridionalis В 10.4%-ном ПААГ
Приготовление растворов
Трис-HCl-буферы. Для проведения электрофореза необходимы два раствора с pH 8.8 и 6.8. В обоих случаях в качестве кислотно-основного буфера используют трис (трис(гидроксиметил)аминометан (Panreac, Испания, cat. № 141940.1209)), одномолярный раствор которого имеет щелочное значение pH. Для доведения растворов до необходимого значения кислотности используют 1 M химически чистую соляную кислоту (Стерлитамакское ОАО “Каустик”, Россия).
Сначала готовят 1 М раствор триса в dH2O. На 100 мл конечного раствора необходимо 12.1 г кристаллического триса. Его растворяют в половине конечного объема воды. После полного растворения доливают воду до 100 мл. Затем раствор разливают в две емкости (20 и 80 мл, по объему 1 : 4). Больший объем доводят до pH 8.8, аккуратно добавляя HCl, отслеживая при этом изменение значения pH на потенциометре. Аналогично меньший объем доводят до pH 6.8. Готовые растворы хранят в холодильнике (+4°С). Этого объема хватит на проведение анализа 600–800 образцов.
Загрузочный буфер (4Х-раствор). Надо перемешать до получения однородной темно-синей густой жидкости 100 мл глицерина (Лабтех, Россия), 50 мл трис-HCl-буфера (pH 6.8) и добавить на кончике шпателя бромфеноловый синий (Panreac, Испания, cat. № 131165.1604). Стоковый буфер хранится в холодильнике неограниченное время. Данного объема хватит для работы с 15 000 образцов.
Раствор акриламида. Раствор акриламида (MP biomedicals, США, cat. № 814326) и N,N`-метиленбисакриламида (MP biomedicals, США, cat. № 800173) в воде – главный гелеобразующий компонент ПААГ. Для приготовления 100 мл раствора сначала в 50 мл dH2O полностью растворяют 0.9 г бисакриламида (сшивающий компонент), затем вносят 24.1 г акриламида и доводят объем дистиллированной водой до 100 мл. Готовый 25%-ный раствор акриламида хранят в холодильнике в темной таре. Данного объема хватит для анализа нескольких сотен образцов в зависимости от размеров электрофорезной камеры.
Трис-глициновый буфер (5Х-раствор). Трис-глициновый буфер (ТГБ) – основной электродный буфер в обеих камерах электрофоретической системы. Для приготовления пятикратного трис-глицинового буфера необходимо 15.1 г триса (Panreac, Испания, cat. № 141940.1209) и 94 г глицина (Panreac, Испания, cat. № 141340.1209), которые нужно разбавить дистиллированной водой до 1 л. Стоковый ТГБ хранят в холодильнике. Непосредственно перед применением его необходимо разбавить дистиллированной водой в 5 раз.
Раствор персульфата аммония, 10%. Кристаллический персульфат аммония (ПСА) (Sigma-Aldrich, США, cat. № A3678) – активатор полимеризации, который необходимо растворить в дистиллированной воде, доведя концентрацию до 10%. Хранить его надо в холодильнике не более 2 нед.
Раствор кумасси (бриллиантового синего G-250). Для приготовления 100 мл раствора необходимо 0.2 г бриллиантового синего G-250 (Panreac, Испания, cat. № 254933.1606), 45 мл этилового спирта, 10 мл уксусной кислоты ледяной х. ч. (Купавнареактив, Россия) и 45 мл дистиллированной воды. Перемешать до получения темно-синей однородной жидкости. Полученный раствор хранят при комнатной температуре.
Отмывочный раствор. Для приготовления 100 мл отмывочного раствора необходимо смешать 20 мл этилового спирта, 4 мл уксусной кислоты ледяной х. ч. и 76 мл дистиллированной воды. Хранить полученный раствор можно при комнатной температуре.
Методика проведения электрофореза
Подготовка образцов. Небольшое количество свежих тканей или органов необходимо поместить в пробирку Эппендорф и залить 0.5%-ным раствором этилендиаминтетрауксусной кислоты (ЭДТА-динатриевая соль AppliChem A1103.0500). Этот раствор можно хранить продолжительное время в морозильной камере или 1–2 сут при комнатной температуре (в этом случае перед загрузкой образца на гель его желательно подвергнуть заморозке-разморозке для эффективного разрушения мембран эритроцитов). В случае если органы были ранее заморожены, их размораживают и заливают раствором ЭДТА. Раствор должен иметь слабо-розовый цвет, его необходимо пипетировать с помощью кубового сэмплера и внести в загрузочный буфер. Для этого в чистые пробирки Эппендорф следует залить по 10 мкл загрузочного буфера и добавить по 30 мкл исследуемого лизата, после чего хорошо перемешать.
Заливка гелей и проведение электрофореза. В предлагаемом методе гель, в котором происходит разделение белков, двухкомпонентный. Он состоит из разрешающего (нижнего) и концентрирующего (верхнего) гелей. Оба раствора мономеров готовят раздельно.
Для приготовления 12 мл (на 4 геля, т.е. по 3 мл на каждый) разрешающего геля используют следующий протокол: в чистой стеклянной емкости смешать приготовленный ранее 25%-ный раствор акриламида (5 мл), dH2O (2.4 мл), трис-HCl, pH 8.8 (4.5 мл), 10%-ный раствор персульфата аммония в воде (0.13 мл), ТЕМЕД (0.01 мл).
Для инициации реакции полимеризации необходимо наличие в растворе ТЕМЕД. Поэтому, прежде чем добавлять его, надо убедиться в том, что стекла электрофоретического прибора правильно установлены (согласно инструкции прибора) и все остальные компоненты раствора добавлены. После внесения ТЕМЕД и персульфата необходимо как можно быстрее залить раствор мономеров разрешающего геля с помощью кубового сэмплера в пространство между стеклами. Для выравнивания верхней поверхности геля сверху наслаивают по 300 мл бутанола (можно заменить этанолом). Полная полимеризация происходит через 30 мин после добавления ТЕМЕД и персульфата. По завершении полимеризации нужно удалить слой бутанола с помощью фильтровальной бумаги. Полученный гель разделяющий, его концентрация 10.4%.
Для приготовления 8 мл (на 4 геля, по 2 мл на каждый) концентрирующего геля необходимо в чистой стеклянной емкости смешать приготовленный ранее 25%-ный раствор акриламида (1.34 мл), dH2O (5.5 мл), трис-HCl, pH 6.8 (1 мл), 10%-ный водный раствор ПСА (0.08 мл), ТЕМЕД (0.008 мл).
Как и в случае приготовления разрешающего геля, ТЕМЕД добавляют непосредственно перед заливкой. Концентрирующий гель наслаивают поверх уже застывшего разрешающего до верхней границы стекол. Затем для создания загрузочных карманов вставляют тефлоновую гребенку до упора в пространство между стеклами. Верхний гель полностью застывает за 15 мин.
Застывшие гели вынимают из заливочных столиков и зажимов, затем устанавливают в электрофоретический прибор. Камеры прибора заполняют разбавленным в 5 раз дистиллированной водой ТГБ (5Х-раствор). В данном исследовании использовали 10-луночные тефлоновые гребенки (соответственно, на одном геле разгоняли 10 образцов). Подготовленные образцы, смешанные с загрузочным буфером, вносят по 15 мкл в каждую лунку. После этого необходимо подключить прибор к источнику питания (необходимо выставить выходное напряжение 150 В и выходную мощность 60 Вт). Электрофорез проводят в две стадии, в которых значения силы тока различаются. Первая стадия длится 35 мин, фиксируемая сила тока источника 50 мА. По истечении этого времени фронт должен сместиться к границе концентрирующего и разрешающего гелей. После этого силу тока увеличивают до 80 мА. Вторая стадия продолжается 60–80 мин. Электрофорез считают оконченным, когда фронт подходит к нижнему краю геля. Гели вынимают и окрашивают приготовленным заранее раствором бриллиантового синего G-250 в течение нескольких часов (оставить на ночь). После окрашивания необходимо провести отмывку гелей от лишней краски. Для этого используют отмывочный раствор, в котором гели находятся до появления четких синих белковых полос на фоне прозрачного геля. После этого образцы можно фотографировать и анализировать. Для этого необходимо рассчитать на электрофореграмме Rf. Наличие полосы в области Rf = 0.58–0.59 диагностирует восточно-европейскую полевку.
Авторы благодарны Е.В. Черепановой (ИПЭЭ РАН) за помощь в проведении цитогенетического анализа.
Исследование выполнено при финансовой поддержке Российского научного фонда (№ 16-14-10269).
Список литературы
Барановский П.М., Охотский Ю.В. Использование территории, суточная активность и подвижность видов-двойников Microtus arvalis и Microtus rossiaemeridionalis (Rodentia, Microtinae) // Зоол. журн. 1988. Т. 67. Вып. 7. С. 1090–1094.
Баскевич М.И., Миронова Т.А., Черепанова Е.В., Кривоногов Д.М. Новые данные по хромосомной изменчивости, распространению видов-двойников и гибридизации 46-хромосомных форм Microtus arvalis sensu lato (Rodentia, Arvicolinae) в Верхнем Поволжье // Зоол. журн. 2016. Т. 95. № 9. С. 1096–1107.
Баскевич М.И., Окулова Н.М., Сапельников С.Ф., Балакирев А.Е., Рябина С.Б., Малыгин В.М. Цитогенетическая и электрофоретическая дифференциация видов-двойников Microtus arvalis s.l. (Rodentia, Arvicolidae) в Воронежском заповеднике // Зоол. журн. 2005. Т. 84. Вып. 10. С. 1298–1309.
Баскевич М.И., Окулова Н.М., Потапов С.Г., Миронова Т.А., Сапельников С.Ф., Сапельникова И.И., Егоров С.В., Власов А.А. Новые данные о распространении видов-двойников и гибридизации 46 хромосомных форм Microtus arvalis sensu lato (Rodentia, Arvicolinae) в Центральном Черноземье // Зоол. журн. 2012. Т. 91. № 8. С. 994–1005.
Баскевич М.И., Потапов С.Г., Окулова Н.М., Cапельников С.Ф., Власов А.А., Опарин М.Л., Миронова Т.А., Авилова Е.А. К распространению и изменчивости видов-двойников Microtus arvalis sensu lato (Rodentia, Arvicolinae) в Центральном Черноземье по хромосомным и молекулярно-генетическим данным // Зоол. журн. 2009. Т. 88. Вып. 4. С. 473–483.
Булатова Н.Ш., Потапов С.Г., Лавренченко Л.А. Геномная и хромосомная политипия в исследовании маркеров митохондриальной и ядерной ДНК у обыкновенных полевок (группа Microtus arvalis) // Генетика. 2010. Т. 46. № 5. С. 668–676.
Доброхотов Б.П. Техника постановки электрофореза гемоглобинов крови для определения некоторых трудноразличимых видов мелких млекопитающих в полевых условиях // Зоол. журн. 1985. Т. 64. Вып. 10. С. 1569–1575.
Доброхотов Б.П., Малыгин В.М. Применение электрофореза гемоглобинов для идентификации серых полевок (Microtus) группы arvalis (Rodentia, Cricetidae) // Зоол. журн. 1982. Т. 61. Вып. 3. С. 436–439.
Жигарев И.А. Изменения плотности населения мышевидных грызунов под влиянием рекреационного пресса на юге Подмосковья // Зоол. журн. 1993. Т. 72. № 12. С. 117–137.
Жигарев И.А. Мелкие млекопитающие рекреационных и естественных лесов Подмосковья. М.: Прометей, 2004. 230 с.
Жигарев И.А., Лапковский В.В., Алпатов В.В., Малыгин В.М. Идентификация видов-двойников Microtus arvalis sensu lato и их гибридов методами электрофореза // Териофауна России и сопредельных территорий. Междунар. совещ. М.: КМК, 2011. С. 165.
Загороднюк И.В. Кариотипическая изменчивость 46-хромосомных форм полевок группы Microtus arvalis (Rodentia): таксономическая оценка // Вестн. зоологии. 1991а. № 1. С. 36–46.
Загороднюк И.В. Систематическое положение Microtus brevirostris (Rodentiformes): материалы по таксономии и диагностике группы “arvalis” // Вестн. зоологии. 1991б. № 3. С. 26–35.
Загороднюк И.В., Тесленко С.В. Виды-двойники надвида Microtus arvalis на Украине. Сообщение I. Распространение Microtus subarvalis // Вестн. зоологии. 1986. № 3. С. 34–40.
Календарь Р.Н., Глазко В.И. Типы молекулярно-генетических маркеров и их применение // Физиология и биохимия культурных растений. 2002. Т. 34. № 4. С. 279–296.
Малыгин В.М. Систематика надвида обыкновенной полевки // Вестн. МГУ, Сер. биол. почв. 1970. № 5. С. 89–91.
Малыгин В.М. Сравнительно-морфологический анализ видов полевок из группы Microtus arvalis (Rodentia, Cricetidae) // Зоол. журн. 1978. Т. 57. № 7. С. 1062–1073.
Малыгин В.М. Систематика обыкновенных полевок. М.: Наука, 1983. 207 с.
Малыгин В.М., Пантелейчук Сантуш Луиш Т.М. Морфологические критерии определения голотипов таксонов видов обыкновенных полевок (Microtus, Rodentia, Mammalia) // Докл. РАН. Общ. биология. 1996. Т. 348. № 2. С. 282–286.
Маркова Е.А., Бородин А.В., Гилева Э.А. Одонтологические признаки обыкновенной (Microtus arvalis Pallas, 1779) и восточноевропейской (M. rossiaemeridionalis Ognev, 1924) полевок Уральского региона и их диагностическое значение // Зоол. журн. 2003. Т. 82. № 9. С. 1086–1094.
Мейер М.Н., Дитятев А.Э. Применение линейного дискриминантного анализа в диагностике видов-двойников обыкновенной полевки (Rodentia, Microtus) // Зоол. журн. 1989. Т. 68. № 7. С. 119–129.
Мейер М.Н., Орлов В.Н., Схоль Е.Д. Использование данных кариологического, физиологического и цитологического анализов для выделения нового вида у грызунов (Rodentia, Mammalia) // Докл. АН СССР. 1969. Т. 188. № 6. С. 1411–1414.
Михайлова Т.В., Бернштейн А.Д., Балакирев А.Е., Апекина Н.С., Альбов С.А., Новохатка А.Д., Дорофеев Э.М. Некоторые черты биологии полевок Microtus arvalis и Microtus rossiaemeridionalis (Rodentia, Cricetidae) и их взаимоотношения с хантавирусом Tula // Зоол. журн. 2008. Т. 87. № 2. С. 239–247.
Опарин М.Л., Опарина О.С., Матросов А.Н., Кузнецов А.А. Динамика фауны млекопитающих степей Волго-Уральского междуречья за последнее столетие // Поволж. экол. журн. 2010. № 1. С. 71–85.
Орлов В.Н., Малыгин В.М. Родственные связи видов из надвида Microtus arvalis по кариологическим данным // Бюл. Моск. о-ва испытателей природы. Отд. биол. 1974. Т. 79. Вып. 2. С. 23–28.
Потапов С.Г., Орлов В.Н., Ковальская Ю.М., Малыгин В.М., Рысков А.П. Генетическая дифференциация полевок трибы Arvicolini (Cricetidae, Rodentia) методом таксонопринтного анализа и полимеразной цепной реакции со случайными праймерами // Генетика. 1999. Т. 35. № 4. С. 484–492.
Тихонов И.А., Тихонова Г.Н., Полякова Л.В. Виды-двойники Microtus arvalis и M. rossiaemeridionalis (Rodentia, Cricetidae) на северо-востоке Московской области // Зоол. журн. 1998. Т. 77. Вып. 1. С. 95–100.
Тихонов И.А., Мунтяну А.И., Успенская И.Г., Коновалов Ю.Н., Бурлаку В.И., Караман Н.К., Нистреану В.Б., Тихонова Г.Н., Котенкова Е.В. Биотопическое распределение, структура популяций и некоторые особенности размножения мелких млекопитающих г. Кишинева // Поволж. экол. журн. 2010. № 4. С. 404–414.
Тихонова Г.Н., Тихонов И.А., Суров А.В., Опарин М.Л., Богомолов П.Л., Ковальская Ю.М. Экологическая характеристика фоновых видов грызунов степей в низовьях Волги и Дона // Поволж. экол. журн. 2005. № 3. С. 281–291.
Fink S., Excoffier L., Heckel G. Mitochondrial gene diversity in the common vole Microtus arvalis shaped by historical divergence and local adaptations // Mol. Ecol. 2004. V. 13. Iss. 11. P. 3501–3514.
Ford C.E., Haтerton J.L. A colchicine hypotonic citrate, squash sequence for mammalian chromosomes // Stain Technol. 1956. V. 31. P. 247–251.
Galan M., Pages M., Cosson J.-F. Next-Generation Sequencing for Rodent Barcoding: Species Identification from Fresh, Degraded and Environmental Samples // PLOS One. 2012. 7(11). [Электронный ресурс]. Режим доступа: https://doi.org/. Дата обновления: 01.12.2018. https://doi.org/10.1371/journal.pone.0048374
Juskeviciute E., Paulauskas A. Application of DNA fragment length polymorphism analysis for identification of small rodents // Ecologija. 2003. № 1. P. 21–23.
Markova E., Malygin V., Montuire S., Nadochowski A., Quere J.P. Dental variation in sibling species Microtus arvalis and M. rossiaemeridionalis (Arvicolinae, Rodentia): Between-species Comparisons and geography of morphotype dental patterns // J. Mamm. Evol., Kluwer Acad. Plenum Publ. (United States). 2010. V. 17. № 2. P. 121–139.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


