Известия РАН. Серия биологическая, 2019, № 4, стр. 368-379
Долговременное влияние инъекции сурфагона на цитологическое состояние гонад, концентрацию тиреоидных и половых стероидных гормонов в крови молоди кумжи Salmo trutta
Е. Д. Павлов 1, *, Е. В. Ганжа 1, Д. С. Павлов 1
1 Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: p-a-v@nxt.ru
Поступила в редакцию 24.07.2018
После доработки 19.11.2018
Принята к публикации 19.11.2018
Аннотация
Исследовано долговременное влияние инъекции синтетического аналога гонадотропного рилизинг-гормона – сурфагона – на репродуктивную систему молоди кумжи Salmo trutta. Через 5 мес. после инъекции отмечено повышение концентрации тиреоидных гормонов в крови, увеличение скорости гаметогенеза, ускорение физиологической адаптации особей к внешним условиям. Установлено, что выявленные изменения предопределяют формирование преимущественно жилой части популяции кумжи. Проанализирована взаимосвязь гормонального статуса, полового созревания и формирования жизненных стратегий у лососевых, основанная на обнаруженных закономерностях.
Репродуктивная система рыб, ее функционирование и развитие во многом связаны с гормональной регуляцией в организме. На разных этапах онтогенеза гонадотропный рилизинг-гормон (ГнРГ), тиреоидные (Cyr, Eales, 1996; Comeau, Campana, 2006; Nelson et al., 2010) и половые стероидные гормоны регулируют формирование и созревание половых желез. ГнРГ – один из важнейших гормонов гипоталамуса, имеющий широкий функциональный спектр действия на организм (Chen, Fernald, 2006, 2008). Основная его функция ‒ формирование и развитие половых желез посредством регуляции синтеза фолликулостимулирующего и лютеинизирующего гормонов (Crim et al., 1983, 1986; Макеева, 1992; Maugars, Schmitz, 2008). ГнРГ и его аналоги используют в аквакультуре для стимуляции созревания половых продуктов у различных видов рыб (Zohar, Mylonas, 2001; Чебанов и др., 2004) и синхронизации их нереста (Mylonas et al., 1992; Powell et al., 1998).
Синтетический пептид сурфагон ‒ аналог ГнРГ с высокой удельной активностью, обеспечивающей его более сильное биологическое действие. Ранее нами было исследовано (Павлов Е.Д. и др., 2018а, б) влияние сурфагона на состояние половых желез молоди радужной форели Parasalmo mykiss (=Oncorhynchus mykiss). Впервые было показано, что введение этого препарата не только повышает скорость гаметогенеза, но и снижает число аномалий в развитии гонад. На основании цитоморфологических результатов и данных поведенческих экспериментов (Павлов Д.С. и др., 2016) установлено, что сурфагон повышает физиологическую адаптацию рыб, т.е. адаптацию к условиям эксперимента, снижает их мотивацию к проявлению миграционной активности.
Сурфагон на короткое время (несколько часов) повышает концентрацию гонадотропинов в организме (Описание…, 2004). Эффекты от препарата регистрировали на 30–40-е сут после инъекции. Мы не обнаружили опубликованных данных о длительности сохранения эффекта от инъекции сурфагона на репродуктивную систему рыб. В то же время в литературе неоднократно упоминались взаимосвязь полового созревания рыб и формирование их жизненных стратегий (Груздева и др., 2013, 2017; Павлов Д.С. и др., 2014; Павлов Е.Д. и др., 2015). Долговременное влияние сурфагона на формирование жизненных стратегий рыб ранее не оценивали.
Цель работы – изучить цитологическое состояние гонад, концентрацию тиреоидных и половых стероидных гормонов в крови кумжи через 5 мес. после инъекции сурфагона, оценить возможную роль этих показателей в формировании жизненной стратегии.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперимент был проведен на молоди кумжи в возрасте 10‒15 мес. в аквариальной ИПЭЭ РАН. Рыб в возрасте 6 мес. привезли с рыборазводного предприятия ООО “Янисъярви” (Республика Карелия). Молодь содержали в бассейнах установки замкнутого водоснабжения размером 2.5 × 0.5 м при уровне воды ~0.5 м и средней плотности посадки 320 экз./м3, температуре воды 13–15°С, скорости течения в бассейнах 1 см/с, освещенности 3000–7000 лк. Рыб кормили 2 раза в сутки искусственным гранулированным кормом AQUAREX “Форель старт 55/13” (РФ) с размером гранул 1.2–1.4 мм. Средние длина и масса рыб в возрасте 10 мес. составляли 6.0 см и 16.6 г соответственно.
Перед инъекцией опытных особей выдерживали 1–2 мин в растворе анестетика лидокаина (100–150 мг/л воды). Показателем его действия было снижение двигательной активности особей. Сурфагон, находящийся в растворе хлорида натрия, вводили опытным рыбам в возрасте 10 мес. инсулиновым шприцом внутримышечно под грудной плавник. Для усиления гормонального эффекта инъекцию проводили двукратно (Чебанов и др., 2004) с промежутком 48 ч. Концентрация сурфагона при первой инъекции составляла 10 мкг/кг, а при второй – 15 мкг/кг рыбы. Сурфагон применяли в дозировке, которая находится в диапазоне действия на радужную форель (Павлов Д.С. и др., 2016; Павлов Е.Д. и др., 2018а, б). Опытных и контрольных (интактных) особей по 80 экз. сразу после инъекции пересадили в две отдельные емкости размером 1.2 × 0.5 м при уровне воды ~0.5 м. В таких условиях рыб содержали до возраста 15 мес. – в течение 5 мес.
Как показали ранее проведенные специальные эксперименты (Павлов и др., 2019), уже на 7-е сут после инъекции препарата не регистрируется реакция рыб на манипуляционный стресс. Поэтому при выбранных длительных сроках наблюдений не было оснований инъецировать контрольную группу физиологическим раствором (плацебо).
По проявлению серебристой окраски тела оценивали степень смолтификации кумжи с использованием шкалы (Калинина, 2012), модифицированной нами для кумжи: 0 – серебрение чешуйного покрова отсутствует, I – серебрение наблюдается только на дорсальной поверхности тела в головной части, II – серебрение распространяется на латеральные части, III – серебрение распространяется на вентральную часть тела, IV – серебрение охватывает более половины поверхности тела.
У опытных и контрольных рыб в возрасте 15 мес. (через 5 мес. после инъекции сурфагона) измеряли длину тела (L) и массу тела (W). По достижении 15-месячного возраста у опытной и контрольной молоди отбирали кровь для определения концентрации гормонов и фрагменты гонад для оценки их цитологического состояния. Пробы отобрали у 73 особей в возрасте 15 мес. – 33 экз. контрольных особей и 40 экз. опытных.
Для оценки цитологического состояния половых желез проводили их фиксацию в жидкости Буэна. Гистологические препараты изготавливали по стандартным методикам (Микодина и др., 2009) с использованием полуавтоматического специализированного гистологического оборудования (Medite, ФРГ): гистопроцессора TPC-15, заливочной станции TES-99, микротома Meditome M530. Срезы толщиной 5 мкм последовательно окрашивали гематоксилином Эрлиха и водно-спиртовым раствором эозина с использованием специализированной батареи для окраски препаратов. Фотографии срезов половых желез получили с помощью моторизованного микроскопа Biorevo BZ-9000 (Keyence, Япония).
Кровь отбирали шприцом объемом 1 мл3 из хвостовой вены рыб. Далее кровь кумжи центрифугировали в течение 5 мин со скоростью 5000 об./мин. Полученную плазму переливали в стерильные пробирки и хранили в морозильной камере при ‒30…–20°С. Методом иммуноферментного анализа с использованием тест-наборов (DRG, ФРГ) на приборе MR 96A (Mindray, КНР) определяли концентрацию тироксина (Т4), трийодтиронина (Т3), тестостерона и эстрадиола-17β. Рассчитывали отношение тиреоидных гормонов (Т4/Т3) для установления зависимой динамики их содержания в крови, поскольку известно, что за счет процесса дейодирования Т4 расщепляется до Т3 (Cyr, Eales, 1996; Hulbert, 2000).
Цитологические изменения в генеративной ткани гонад оценивали по стадии зрелости гонад, наличию и числу аномалий в строении и расчетным параметрам скорости гаметогенеза. Для определения скорости оогенеза использовали ядерно-цитоплазматическое отношение (ЯЦО), рассчитанное как отношение площади ядра к площади цитоплазматического материала ооцита на срезе вблизи центральной части ооцита (Павлов Д.С. и др., 2014). Меньшее значение ЯЦО соответствует большему размеру ооцита. Было измерено >725 ооцитов у опытных и контрольных особей.
Состояние семенников определяли по числу различных типов половых клеток (сперматогониев, сперматоцитов и сперматид) на единицу площади гистологического среза семенника (10 000 мкм2). Рассчитывали отношение занимаемой площади созревшими клетками (сперматозоидами) к общей площади, захваченной объективом микроскопа области среза.
Измерения ооцитов для расчета ЯЦО и расчет числа клеток на срезе семенника проводили с помощью программного обеспечения ImageJ ver. 1.51k. Статистическую обработку выполняли с использованием t-критерия Стьюдента, U-критерия Манна‒Уитни, а также дисперсионного анализа.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
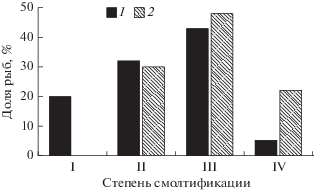
В возрасте 15 мес. рыбы как в опытной, так и в контрольной группах начинают смолтифицироваться. Степень смолтификации у молоди в опытной группе ниже (p < 0.01 по U-критерию Манна‒Уитни), чем в контрольной (рис. 1).
Рис. 1.
Распределение опытной (1) и контрольной (2) молоди кумжи по степени смолтификации. За 100% принято суммарное число рыб в опытной группе и суммарное число особей в контрольной группе.
Длина и масса молоди кумжи в возрасте 15 мес. в опытной группе составляли соответственно 16.1 ± ± 0.36 (11.9–21.2) см и 36.3 ± 2.19 (14.2–65.7) г, а в контрольной – 17.2 ± 0.34 (14.3–22.3) см и 42.0 ± ± 2.88 (20.7–99.4) г. (Здесь и далее перед скобками ‒ среднее значение показателя и его ошибка, в скобках – пределы варьирования показателя.) Опытные особи имели меньшую длину (p < 0.05 по t-критерию Стьюдента), чем контрольные.
Дисперсионный анализ показал, что степень смолтификации связана с длиной и массой тела особей (p < 0.001) – высокая степень смолтификации наблюдается у рыб с бóльшими размерами тела.
Цитологическое состояние половых желез молоди кумжи. Гонады опытных и контрольных самок кумжи различаются только по расчетным показателям (ЯЦО и доля аномалий в строении). Семенники у двух групп рыб различаются по стадиям зрелости и расчетным показателям (доля типов клеток на единицу площади, доля занимаемой сперматозоидами площади от общей площади среза). Описание клеточной структуры половых желез на одних и тех же стадиях зрелости дано без разделения на опытных и контрольных рыб.
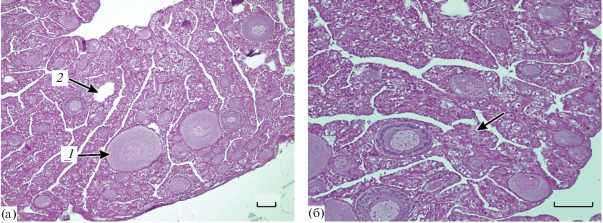
Самки. Яичники опытных и контрольных рыб находились на II стадии зрелости. Половые клетки были представлены ооцитами периода превителлогенеза, диаметр которых варьировал от 40 до 260 мкм. В гонадах наиболее многочисленными были клетки размером ~100 мкм. В ооцитах диаметром 40–60 мкм только начинался цитоплазматический рост, а в наиболее крупных клетках (диаметром 160–240 мкм) этот процесс был уже завершен (рис. 2а). В цитоплазме ооцитов малого и среднего размеров хорошо видны интенсивно окрашенные гематоксилиновым лаком зоны локализации органелл, содержащих РНК. Зоны скопления РНК либо располагаются упорядоченно, образуя кольцо вокруг ядра клетки (рис. 2б), либо лежат в толще цитоплазмы хаотично (рис. 2в). В крупных клетках РНК зоны уже не наблюдаются (рис. 2г).
Рис. 2.
Яичники молоди кумжи II стадии зрелости. а – ооциты периода превителлогенеза, общий вид; б – кольцевые зоны локализации РНК (стрелки); в – зоны локализации РНК расположены хаотично в цитоплазме (стрелка). Масштаб: 100 (а) и 20 мкм (б, в).
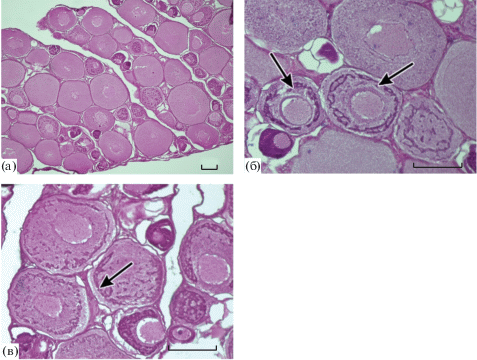
В яичниках у рыб из обеих групп обнаружено значительное число погибших половых клеток. В половых железах опытных рыб, инъецированных сурфагоном, доля таких клеток у некоторых особей достигает 27.5%, в среднем по группе – 15%. В яичниках рыб из контрольной группы погибшие клетки встречаются чаще – у отдельных особей они достигают 46% общего числа ооцитов, в среднем по группе – 28%.
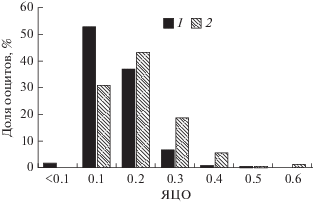
ЯЦО ооцитов в гонадах опытных и контрольных особей составляют 0.21 ± 0.003 (0.09–0.52) и 0.25 ± 0.005 (0.11–0.66) соответственно. Ооциты у опытных рыб крупнее, чем у представителей контрольной группы (p < 0.001 по t-критерию Стьюдента). Так, в гонадах опытной группы у 55% ооцитов ЯЦО < 0.2, а в контрольной группе эта доля составляет 31% (рис. 3). У некоторых ооцитов опытных особей ЯЦО < 0.1. В гонадах контрольной группы отмечены ооциты раннего периода цитоплазматического роста с ЯЦО > 0.6.
Рис. 3.
Распределение ооцитов по ядерно-цитоплазматическому отношению (ЯЦО) в гонадах опытной (1) и контрольной (2) молоди кумжи. За 100% принято суммарное число ооцитов в гонадах опытной группы и суммарное число ооцитов в гонадах контрольной группы.
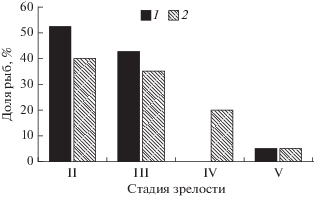
Самцы. В опытной группе у 95% рыб семенники находились на II и III стадиях зрелости. Гонады у одной особи из опытной группы находились на V стадии зрелости (рис. 4). В контрольной группе ~75% самцов имели гонады II и III стадий зрелости. У пяти особей половые железы были более развиты – находились на IV и V стадиях.
Рис. 4.
Распределение самцов опытной (1) и контрольной (2) кумжи по стадиям зрелости их гонад. За 100% принято суммарное число самцов в опытной группе и суммарное число самцов в контрольной группе.
На II стадии зрелости гонад половые клетки расположены в цистах, представлены многочисленными сперматогониями и небольшим числом клеток меньшего размера, вступающих в профазу мейоза – сперматоцитами первого порядка (рис. 5а). Расчетным методом установлено, что число сперматогониев на единицу площади (1 мм2) в гонадах опытных особей заметно больше (p < 0.05 по U-критерию Манна‒Уитни), чем в семенниках контрольных – 9423 (5766–12643) шт. против 7400 (5896–10690) шт. соответственно.
Рис. 5.
Цитологическое строение семенников у молоди кумжи в возрасте 15 мес. а – цисты со сперматогониями (II стадия зрелости), б – сперматоциты первого порядка (III стадия зрелости), в – формирование семенных каналец (поздняя III стадия зрелости), г – семенные канальца со сперматидами и сперматозоидами (IV стадия зрелости), д – семенные канальца, заполненные сперматозоидами (V стадия зрелости). 1 – сперматогонии, 2 – сперматоциты, 3 – сперматиды, 4 – сперматозоиды. Масштаб: 100 мкм.
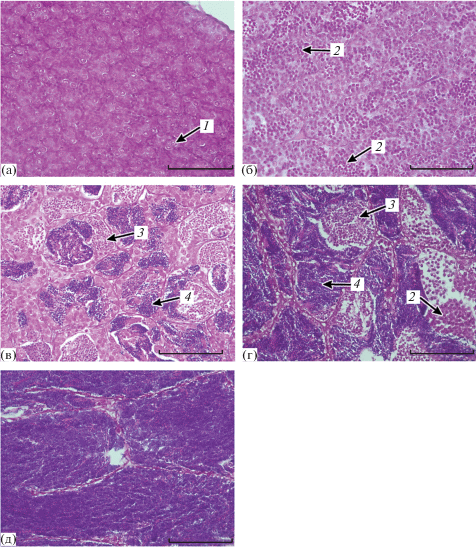
На III стадии зрелости гонад сперматогонии немногочисленны, в семенниках преобладают сперматоциты первого и второго порядков (рис. 5б). Сперматоциты второго порядка в 1.5–2 раза мельче, чем первого, интенсивнее окрашены гематоксилином. Семенники некоторых рыб развиваются интенсивнее (III поздняя стадия зрелости), в них активно протекает сперматогенез – формируются семенные канальца со сперматидами и сперматозоидами (рис. 5в). Число сперматогониев на единицу площади (1 мм2) в гонадах опытных рыб значительно меньше (p < 0.05 по U-критерию Манна‒Уитни), чем в семенниках контрольных – 534 (88–1442) шт. против 912 (403–1720) шт. соответственно. Числа сперматоцитов и сперматид в половых железах рыб из двух групп практически не различаются. Присутствующие в наиболее развитых гонадах сперматозоиды также занимают сходные площади.
В гонадах IV стадии зрелости завершается созревание половых продуктов. Семенники содержат преимущественно образующиеся в результате второго деления мейоза сперматиды и сперматозоиды. Сперматозоиды интенсивнее, чем сперматиды, окрашены гематоксилином в сине-фиолетовый оттенок. Еще встречаются участки генеративной ткани, содержащие сперматоциты первого и второго порядков и единичные сперматогонии (рис. 5г).
На V стадии зрелости гонад семенные канальца увеличиваются в размерах и целиком заполнены сперматозоидами (рис. 5д).
В контрольной группе обнаружен один гермафродит (рис. 6). В гонадах этой особи единовременно присутствуют сперматогонии и единичные ооциты периода превителлогенеза. В генеративной ткани на месте погибших ооцитов локализованы полости. На некоторых участках гонады наблюдается гипертрофия соединительной ткани.
Рис. 6.
Цитологическое строение гонады гермафродита из контрольной группы кумжи в возрасте 15 мес. а – общий вид гонады гермафродита, превителлогенный ооцит (1) и полость (2) на месте погибшего ооцита; б – прорастание соединительной ткани, циста со сперматогониями (стрелка). Масштаб: 100 мкм.
В популяциях лососевых рыб наличие единичных гермафродитов явление не редкое (Макеева, 1992; Микодина, Пукова, 2002; Павлов Е.Д. и др., 2013). Присутствие одного гермафродита в группе не свидетельствует о значимых отклонениях развития половых желез контрольных рыб от нормы.
Концентрация тиреоидных и половых стероидных гормонов в крови кумжи. Дисперсионный анализ показал, что содержание тиреоидных гормонов в крови связан с принадлежностью особи к опытной или контрольной группе (p < 0.05) и степенью ее смолтификации (p < 0.05). Чем выше степень смолтификации особи, тем ниже содержание тиреоидных гормонов в ее крови. Концентрация T3 в крови также зависит от пола особи (p < 0.05).
В контрольной группе содержание Т3 в крови самок заметно выше (p < 0.05 по t-критерию Стьюдента), чем у самцов – 16.4 ± 1.66 (5.4–30.4) и 11.9 ± 1.2 (1.5–21.6) нг/мл соответственно. В опытной группе концентрация T3 у самок составляет 19.6 ± 1.95 (5.8–40.2) нг/мл. В крови самцов из опытной группы значения этого показателя выше (p < 0.05 по t-критерию Стьюдента), чем у самцов из контрольной группы (рис. 7а).
Рис. 7.
Концентрация тиреоидных гормонов в крови опытной (1) и контрольной (2) кумжи. а ‒ концентрация T3 у самцов, б ‒ общая концентрация T4 у самок и самцов.
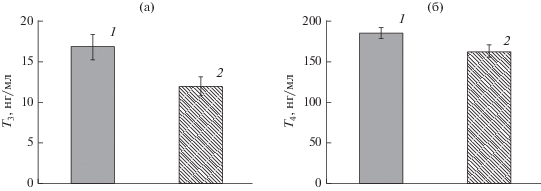
Концентрация T4 в крови рыб из опытной группы выше (p < 0.05 по t-критерию Стьюдента), чем у особей из контрольной (рис. 7б). (Графики даны только по достоверно различающимся показателям в опыте и контроле. Значения концентраций по T4 даны без разделения на самок и самцов, так как по данным дисперсионного анализа этот показатель не зависит от пола рыб (p > 0.05).)
Показатель Т4/Т3 не различается у самок и самцов, не зависит от принадлежности особей к опытной или контрольной группам и в среднем составляет 12.4 ± 1.02 (1.1–44.4) и 17.4 ± 4.4 (3.8–171.8) соответственно.
По данным дисперсионного анализа концентрация эстрадиола-17β в крови кумжи зависит только от степени их смолтификации (p < 0.05). С увеличением степени смолтификации концентрация гормона снижается. Концентрация тестостерона в крови зависит от стадии зрелости гонад и пола рыб (p < 0.001). Чем быстрее развиваются семенники кумжи, тем больше в ее крови концентрация тестостерона. Как в опытной, так и в контрольной группах содержание тестостерона выше (соответственно p < 0.01 и p < 0.001 по t-критерию Стьюдента) в крови самцов по сравнению с самками (табл. 1).
Таблица 1.
Концентрация гормонов в крови молоди кумжи из опытной и контрольной групп
| Гормон | Опыт | Контроль | ||
|---|---|---|---|---|
| ♀ | ♂ | ♀ | ♂ | |
| Эстрадиол-17 β, пг/мл | $\frac{{1.5 \pm 0.15}}{{0.6{\kern 1pt} --{\kern 1pt} 3}}$ | $\frac{{1.8 \pm 0.33}}{{0.9{\kern 1pt} --{\kern 1pt} 9}}$ | $\frac{{1.5 \pm 0.14}}{{0.8{\kern 1pt} --{\kern 1pt} 3.1}}$ | $\frac{{1.8 \pm 0.27}}{{0.7{\kern 1pt} --{\kern 1pt} 6.5}}$ |
| Тестостерон, нг/мл | $\frac{{4.4 \pm 0.54}}{{0.3{\kern 1pt} --{\kern 1pt} 10.4}}$ | $\frac{{9.1 \pm 1.15}}{{3.3{\kern 1pt} --{\kern 1pt} 24.5}}$ | $\frac{{4.1 \pm 0.5}}{{1.5{\kern 1pt} --{\kern 1pt} 9.6}}$ | $\frac{{10.7 \pm 1.31}}{{1.9{\kern 1pt} --{\kern 1pt} 22.1}}$ |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные свидетельствуют о том, что сурфагон оказывает долговременное воздействие на развитие репродуктивной системы молоди кумжи. Через 5 мес. после инъекции эффект от введения препарата наблюдается как на цитоморфологическом, так и на гормональном уровнях. Ранее (Павлов Е.Д. и др., 2018а, б) мы предположили, что сурфагон выступает как сигнальный фактор, ведущий к перестройке гормональной регуляции организма реципиента. Полученные результаты подтверждают выдвинутое предположение.
Рассмотрим последствия воздействия сурфагона на некоторые морфологические (степень смолтификации, цитоморфология половых желез) и биохимические показатели молоди кумжи, тем или иным образом связанные с развитием репродуктивной системы.
Действие сурфагона на половые железы самок выражается в ускорении оогенеза (снижение ЯЦО) – повышении темпов развития ооцитов. Согласно опубликованным данным (Crim et al., 1983, 1986) ускорение оогенеза (повышение гонадосоматического индекса, увеличение массы и диаметра ооцитов) под действием других синтетических аналогов ГнРГ отмечали и у производителей атлантического лосося Salmo salar. Действие же препарата приводит к снижению числа клеток, находящихся в состоянии деструкции – уменьшается доля аномалий в генеративной ткани. Ранее нами на примере радужной форели (Павлов Е.Д. и др., 2018а, б) было показано, что через 30–40 сут после инъекции препарата у рыб стабилизируется гаметогенез и также снижается доля ооцитов периода превителлогенеза, подверженных деструкции.
В отличие от яичников семенники как у опытной, так и у контрольной кумжи находились на разных стадиях зрелости. В опытной группе >90% самцов имели гонады II и III стадий зрелости. В контрольной группе присутствовали самцы с половым железами II (40%), III (35%), IV (20%) и V (5%) стадий зрелости. Следовательно, четверть контрольных самцов имела практически созревшие семенники, т.е. достигала половой зрелости как минимум на год раньше срока. Различия между опытной и контрольной группами рыб по скорости сперматогенеза в гонадах II и III стадий зрелости удалось определить только расчетными методами. В семенниках II стадии зрелости у опытных рыб число сперматогониев (на единицу площади) было выше (p < 0.05), чем в гонадах той же стадии у контрольных самцов. Это свидетельствует о более интенсивном сперматогенезе – ускоренное размножение сперматогониев – в гонадах опытной группы по сравнению с контрольной. На III стадии зрелости семенники опытных особей, напротив, содержали заметно меньше (p < 0.05) сперматогониев, чем половые железы контрольных рыб. Известно (Crim et al., 1983), что воздействие аналога ГнРГ на семенники производителей атлантического лосося приводит к увеличению доли сперматид и сперматозоидов на фоне снижения числа сперматоцитов. В наших экспериментах не происходило увеличения числа клеток позднего состояния в гонадах опытной группы по сравнению с контрольной. Однако снижение доли клеток раннего состояния (сперматогониев) у опытных особей с гонадами III стадии зрелости мы рассматриваем как тенденцию к увеличению скорости сперматогенеза у опытной группы по сравнению с контрольной.
Инъекция сурфагона привела к повышению концентрации тиреоидных гормонов в крови рыб из опытной группы по сравнению с особями из контрольной – у самок и самцов выросло содержание T4 в крови, у опытных самцов – T3. Применение аналогов ГнРГ на нерке Oncorhynchus nerka в возрасте 2+ также приводило к росту концентрации в крови T3 и небольшому повышению T4 (Plate et al., 2002). Показатель T4/T3 не различается у исследуемых групп, что свидетельствует об отсутствии выраженного влияния сурфагона на процесс дейодирования. Это согласуется с данными литературы (Plate et al., 2002), свидетельствующими об отсутствии такой взаимосвязи между другим примененным аналогом ГнРГ и процессом дейодирования у нерки O. nerka.
Концентрации половых стероидных гормонов в крови опытной и контрольной групп не различаются. В пределах групп для самцов характерно бóльшее содержание тестостерона в крови, чем для самок. Полученные результаты по половым стероидным гормонам свидетельствуют о том, что действие сурфагона слабо затрагивает синтез половых стероидных гормонов молоди кумжи.
Как отмечено выше, тиреоидные гормоны выполняют не только основную свою энергетическую функцию, но и вместе с половыми стероидными гормонами участвуют в развитии репродуктивной системы. Тиреоидные гормоны в синергии с гонадотропинами могут стимулировать развитие генеративной ткани у самок (Cyr, Eales, 1996). На молоди черноморской кумжи S. trutta labrax в пресной воде было показано (Павлов Д.С. и др., 2014), что повышение содержания тироксина наблюдается у рыб с интенсивно протекаюшим гаметогенезом в гонадах. Вероятно, на ранних этапах онтогенеза наблюдаемое ускорение в развитии половых желез опытной группы происходит за счет повышения активности тиреоидной оси.
Ранее (Павлов Е.Д. и др., 2018а, б) было показано, что сурфагон повышает физиологическую адаптацию рыб к внешним условиям – при неблагоприятных условиях снижается доля аномалий в строении половых желез. В то же время снижается доля рыб, двигающихся вниз по течению для поиска более подходящих условий обитания (Павлов Д.С. и др., 2016; Павлов Е.Д. и др., 2018а).
Многие авторы (Hoar, 1959; Sage, 1973; Peter, Peter, 2011; Dolomatov et al., 2013) полагают, что одна из основных функций тиреоидных гормонов ‒ адаптация особи к условиям обитания. В частности, тиреоидные гормоны повышают адаптацию рыб к температурным колебаниям воды при смене сезонов года (Hoar, 1959). Было показано (Arjona et al., 2011), что тиреоидные гормоны совместно с кортикостероидами путем изменения активности Na+,K+-АТФазы регулируют адаптивную перестройку ионного обмена при смолтификации рыб. Нами установлено (Павлов и др., 2018а), что предварительная инъекция сурфагона молоди радужной форели, содержавшейся в течение 4 сут при высокой температуре воды, снижала аномалии в развитии ее половых желез. Есть основание полагать, что повышение физиологической адаптации к условиям содержания у опытных рыб происходит за счет увеличения синтеза тиреоидных гормонов, катализируемого инъекцией препарата.
Предположения о взаимосвязи репродуктивной системы и траектории развития рыб сформулированы ранее (Thorpe, 1994; Павлов, Савваитова, 2008; Olsson, Greenberg, 2011 и др.), приведены и конкретные данные о взаимосвязи цитоморфологии гонад рыб и выбора ими жизненной стратегии (Груздева и др., 2013, 2017; Павлов Д.С. и др., 2014). Опубликованные данные свидетельствуют о том, что ускоренное развитие половых желез наблюдается у рыб с резидентной жизненной стратегией, а замедленное – с анадромной. Известно (Yamamoto et al., 1997; Volkoff, Peter, 1999; White et al., 2002; Yaron, Levavi-Sivan, 2011), что основная функция ГнРГ – формирование и развитие половых желез. Как показали проведенные ранее поведенческие эксперименты (Павлов Д.С. и др., 2016) сурфагон снижает долю рыб, двигающихся вниз по течению. По всей видимости, инъекция сурфагона переключает гормональную регуляцию организма в сторону ускорения полового созревания, блокируя реализацию покатной миграции у особей (потенциально резидентные рыбы).
Отдельно рассмотрим смолтификацию молоди кумжи и сопровождающие ее физиологические изменения. К возрасту 15 мес. молодь кумжи как в опытной, так и в контрольной группах в разной степени смолтифицируется. Смолтификация характерна для кумжи в естественной среде обитания и связана с формированием в пределах популяции разных жизненных стратегий у рыб – с образованием проходных (анадромной), жилых (резидентной) и транзитивных форм. (В данной работе термин форма используется в понимании Майра (Майр, 1971) как “нейтральный“ и не связан с образованием каких-либо генетических различий.) Смолтификация особей свидетельствует о тенденции выбора рыбами преимущественно анадромной жизненной стратегии, при реализации которой они скатываются в море на нагул (Bone, Moore 2008; Jonsson, Jonsson, 2011). Для части особей в контрольной и в опытной группах серебрение тела – временный признак происходящих морфологических изменений. У таких рыб со временем произошла бы десмолтификация. Десмолтификация у лососевых ‒ частое явление, обусловленное рядом как внешних, так и внутренних факторов. Она приводит к потере особями серебристой окраски, снижению активности Na+,K+-АТФазы и обратной их адаптации к пресной воде (Jonsson, Jonsson, 2011).
Рано созревающие самцы с гонадами IV–V стадий зрелости фактически к возрасту 15 мес. образовали обособленную так называемую карликовую форму. Обратим внимание на то, что рано созревающая кумжа в опытной группе формировалась реже, чем в контрольной (5% против 25%). Образование рано созревающих лососевых рыб ряд исследователей (Bohlin et al., 1994; Fleming, 1996; Metcalfe, 1998; Morgan, Metcalfe, 2001) связывают с благоприятными условиями обитания в раннем онтогенезе. Можно предположить, что инъекция сурфагона за счет переключения ресурсов организма на быстрое развитие половых желез приводит к образованию преимущественно жилой формы, но не рано созревающих рыб.
Степень смолтификации молоди кумжи различается в опытной и контрольной группах – серебрение тела у опытных особей менее выражено, чем у контрольных. Повышение доли проходных рыб в популяции, как правило, обусловлено неблагоприятными условиями обитания, в частности недостатком пищевых ресурсов (Павлов Д.С. и др., 2001, 2008; Павлов Д.С., Савваитова, 2008; Wysujack et al., 2008). Мы предположили (Павлов Д.С. и др., 2016; Павлов Е.Д. и др., 2018а), что инъекция сурфагона, повышая физиологическую адаптацию особей к имеющимся условиям обитания, снижает их мотивацию к осуществлению покатной миграции – изменяет траекторию развития рыб в сторону резидентности. Выявленное нами замедление смолтификации у опытных рыб согласуется с этой гипотезой.
На основании проведенного дисперсионного анализа показано, что степень смолтификации молоди кумжи связана с большинством рассматриваемых в работе показателей. Рассмотрим полученные взаимосвязи как у молоди кумжи, так и у других видов рыб:
чем больше длина и масса кумжи, тем выше степень ее смолтификации. Похожие результаты получены на молоди черноморской кумжи (Павлов Д.С. и др., 2010, 2012) – особи с анадромной жизненной стратегией характеризуются бóльшими размерами тела;
на более поздних стадиях смолтификации кумжи концентрация тиреоидных гормонов в крови рыб снижается. Известно (Jonsson, Jonsson, 2011), что тиреоидные гормоны принимают первоочередное участие в процессе серебрения при смолтификации лососевых. Полученные нами данные о тироксине совпадают с результатами Дикхоффа с соавт. (Dikhoff et al., 1978) – концентрация тироксина у кижуча O. kisutch возрастала в преддверии смолтификации и снижалась практически до первоначальных значений по завершении процесса;
концентрация эстрадиола-17β в крови снижается по мере смолтификации молоди кумжи. В возрасте 15 мес. у жилой формы черноморской кумжи по сравнению с проходной формой оогенез протекает интенсивнее (Павлов Д.С. и др., 2014). Соответственно, снижение концентрации эстрадиола-17β в крови может быть обусловлено изменением скорости оогенеза.
Таким образом, инъекция сурфагона молоди кумжи оказывает пролонгированное влияние (не менее 5 мес.) не только на репродуктивную систему рыб, но и на их траекторию развития – на формирование жизненных стратегий. Путем повышения синтеза тиреоидных гормонов сурфагон увеличивает скорость гаметогенеза, усиливает физиологическую адаптацию особей к внешним условиям и стимулирует образование преимущественно жилой формы кумжи. Смолтификация рыб связана с их размером, содержанием тиреоидных гормонов и эстрадиола-17β в крови. Мы допускаем, что в результате инъекции препарата именно повышение концентрации гонадотропинов на ранних этапах онтогенеза может регулировать траекторию развития кумжи путем повышения скорости гаметогенеза. Подобные изменения концентрации гонадотропинов в организме могут происходить у рыб и в естественной среде обитания под влиянием температуры, фотопериода, особенностей питания, половой принадлежности особи и степени зрелости ее гонад (Peter, 1981; Hellqvist et al., 2006; Martyniuk et al., 2009). Полученные результаты свидетельствуют о взаимосвязи четырех процессов, параллельно протекающих в организме рыб: гормональной регуляции, роста, полового созревания и формирования жизненной стратегии.
Авторы благодарны К.В. Кузищину (биологический факультет МГУ), М.И. Шатуновскому (ИПЭЭ РАН) за ценные замечания по тексту рукописи; Д.А. Ручьеву (ООО “Янисъярви”), М.А. Ручьеву (КарНЦ РАН), П.И. Зарипову (ИПЭЭ РАН) за содействие в работе.
Работа выполнена при финансовой поддержке Российского научного фонда (№ 14-14-01171).
Список литературы
Груздева М.А., Малютина А.М., Кузищин К.В., Белова Н.В., Пьянова С.В., Павлов Д.С. Закономерности формирования жизненной стратегии у симы Oncorhynchus masou реки Коль (западная Камчатка) в связи с процессами роста и полового созревания // Вопр. ихтиологии. 2013. Т. 53. № 5. С. 687–602.
Груздева М.А., Кузищин К.В., Павлов Е.Д., Буш А.Г., Белова Н.В., Поляков М.П., Малютина А.М., Павлов Д.С. Морфофизиологические закономерности формирования жизненных стратегий мальмы Salvelinus malma Камчатки // Вопр. ихтиологии. 2017. Т. 57. № 5. С. 587–602.
Калинина Н.Р. Качественный посадочный материал – основа биобезопасности лососевых товарных ферм // Вестн. МГТУ. 2012. Т. 15. № 3. С. 517–525.
Майр Э. Принципы зоологической систематики. М.: Мир, 1971. 454 с.
Макеева А.П. Эмбриология рыб. М.: Изд-во МГУ, 1992. 216 с.
Микодина Е.В., Пукова Н.В. Методические рекомендации по изучению фенодевиантов семенников у дальневосточных лососей. М.: Экономика и информатика, 2002. 93 с.
Микодина Е.В., Седова М.А., Чмилевский Д.А., Микулин А.Е., Пьянова С.В., Полуэктова О.Г. Гистология для ихтиологов: опыт и советы. М.: Изд-во ВНИРО, 2009. 112 с.
Описание лекарственного препарата: сурфагон // Справочник Видаль Ветеринария. 2004. www.webvidal.ru/Veterinary/2004/LP_5340000.htm.
Павлов Д.С., Савваитова К.А. К проблеме соотношения анадромии и резидентности у лососевых рыб (Salmonidae) // Вопр. ихтиологии. 2008. Т. 48. № 6. С. 810–824.
Павлов Д.С., Костин В.В., Пономарева В.Ю. Поведенческая дифференциация сеголеток черноморской кумжи Salmo trutta labrax: реореакция в год, предшествующий смолтификации // Вопр. ихтиологии. 2010. Т. 50. № 2. С. 251–261.
Павлов Д.С., Костин В.В., Пономарева В.Ю. Различия размерных и весовых показателей и особенностей питания заводской молоди черноморской кумжи (Salmo trutta labrax Pall.) из двух пространственных группировок // Докл. РАН. 2012. Т. 445. № 4. С. 479–481.
Павлов Д.С., Павлов Е.Д., Костин В.В., Ганжа Е.В. Реореакция молоди радужной форели при воздействии сурфагона // Онтогенез. 2016. Т. 47. № 2. С. 110‒116.
Павлов Д.С., Павлов Е.Д., Ганжа Е.В., Зарипов П.И., Ручьев М.А. Изменение реореакции молоди радужной форели Oncorhynchus mykiss в первые дни после инъекции сурфагона // Изв. РАН. Сер. биол. 2019. № 1. С. 90‒94.
Павлов Д.С., Павлов Е.Д., Ганжа Е.В., Костин В.В., Пономарева В.Ю. Цитологическое состояние гонад и уровень тиреоидных и половых стероидных гормонов у двух фенотипических форм молоди черноморской кумжи Salmo trutta labrax // Вопр. ихтиологии. 2014. Т. 54. № 4. С. 470–478.
Павлов Д.С., Савваитова К.А., Кузищин К.В., Груздева М.А., Мальцев А.Ю., Стэнфорд Д.А. Разнообразие жизненных стратегий и структура популяций камчатской микижи Parasalmo mykiss (Walb.) в экосистемах малых лососевых рек разного типа // Вопр. ихтиологии. 2008. Т. 48. № 1. С. 42–49.
Павлов Д.С., Савваитова К.А., Кузищин К.В., Груздева М.А., Павлов С.Д., Медников Б.М., Максимов С.В. Тихоокеанские благородные лососи и форели Азии. М.: Научный мир, 2001. 200 с.
Павлов Е.Д., Буш А.Г., Павлов Д.С. Оценка влияния сурфагона на состояние половых желез у молоди радужной форели Parasalmo mykiss (=Oncorhynchus mykiss) на фоне температурного стресса // Вопр. ихтиологии. 2018а. Т. 58. № 3. С. 365–372.
Павлов Е.Д., Ганжа Е.В., Костин В.В., Павлов Д.С. Цитологическое состояние гонад и уровень тиреоидных и половых стероидных гормонов у пестряток черноморской кумжи Salmo trutta labrax // Онтогенез. 2015. Т. 46. № 5. С. 338–345.
Павлов Е.Д., Ганжа Е.В., Нгуен Вьет Туи, Нгуен Ти Хуан Ту. Состояние половых желез годовиков триплоидной радужной форели в высокогорных условиях южного Вьетнама при воздействии андрогенного гормона // Вопр. ихтиологии. 2013. Т. 53. № 6. С. 726–740.
Павлов Е.Д., Ганжа Е.В., Во Тхи Ха, Нгуен Ан Тиен, Д.С. Павлов Состояние половых желез у сеголеток радужной форели при инъекции сурфагона // Онтогенез. 2018б. Т. 49. С. 124–132.
Чебанов М.С., Галич Е.В., Чмырь Ю.Н. Руководство по разведению и выращиванию осетровых рыб. М.: ФГНУ «Росинформагротех», 2004. 148 с.
Arjona F.J., Vargas-Chacoff L., del Río M.P., Flik G., Mancera J.M., Klaren P.H.M. Effects of cortisol and thyroid hormone on peripheral outer ring deiodination and osmoregulatory parameters in the senegalese sole (Solea senegalensis) // J. Endocrinol. 2011. V. 208. P. 323–330.
Bohlin T., Dellefors C., Faremo U. Probability of first sexual maturation of male parr in wild sea-run brown trout (Salmo trutta) depends on condition factor 1 yr in advance // Can. J. Fish. Aqua. Sci. 1994. V. 51. P. 1920–1926.
Bone Q., Moore R. Biology of fishes. N.Y.: Taylor and Francis Group, 2008. 491 p.
Chen C.C., Fernald R.D. Distributions of two gonadotropin-releasing hormone receptor types in a cichlid fish suggest functional specialization // J. Comparat. Neurol. 2006. V. 495. P. 314–323.
Chen C.C., Fernald R.D. Review paper. GnRH and GnRH receptors: distribution, function and evolution // J. Fish Biol. 2008. V. 73. P. 1099–1120.
Comeau L.A., Campana S.E. Correlations between thyroidal and reproductive endocrine status in wild atlantic cod // Can. Techn. Rept Fish. Aquat. Sci. 2006. № 2682. 14 p.
Crim L.W., Evans D.M., Vickery B.H. Manipulation of the seasonal reproductive cycle of the landlocked atlantic salmon (Salmo salar) by LHRH analogues administered at various stages of gonadal development // Can. J. Fish. Aqua. Sci. 1983. V. 40. № 1. P. 61–67.
Crim L.W., Glebe B.D., Scott A.P. The influence of LHRH analog on oocyte development and spawning in female atlantic salmon, Salmo salar // Aquaculture. 1986. V. 56. № 2. P. 139–149.
Cyr D.G., Eales J.G. Interrelationships between thyroidal and reproductive endocrine systems in fish // Fish Biol. Fish. 1996. V. 6. P. 165–200.
Dickhoff W.W., Folmar L.C., Gorbman A. Changes in plasma thyroxine during smoltification of coho salmon, Oncorhynchus kisutch // General Comp. Endocrinol. 1978. V. 36. P. 229–232.
Dolomatov S.I., Kubyshkin A.V., Kutia S.A., Zukow W. Role of thyroid hormones in fishes // J. Health Sci. 2013. V. 3. № 9. P. 279–296.
Fleming I.A. Reproductive strategies of atlantic salmon: Ecology and evolution // Rev. Fish Biol. Fish. 1996. V. 6. P. 379–416.
Hellqvist A., Schmitz M., Mayer I., Borg B. Seasonal changes in expression of LH and FSH in male and female three-spined stickleback, Gasterosteus aculeatus // General Comp. Endocrinol. 2006. V. 145. № 3. P. 263–269.
Hoar W.S. Endocrine factors in the ecological adaptation of fishes // Comparative endocrinology / Ed. Gorbman A. N.Y.: John Wiley and Sons, 1959. P. 1–23.
Hulbert A.J. Thyroid hormones and their effects a new perspective // Biol. Rev. 2000. V. 75. P. 519–631.
Jonsson B., Jonsson N. Ecology of atlantic salmon and brown trout: habitat as a template for life histories // Fish Fish. Ser. 2011. V. 33. 680 p.
Martyniuk C.J., Kroll K.J., Porak W.F., Steward C., Grier H.J., Denslow N.D. Seasonal relationship between gonadotropin, growth hormone, and estrogen receptor mRNA expression in the pituitary gland of largemouth bass // Gen Comp. Endocrinol. 2009. V. 163. № 3. P. 306–317.
Maugars G., Schmitz M. Expression of gonadotropin and gonadotropin receptor genes during early sexual maturation in male atlantic salmon parr // Mol. Reprod. Develop. 2008. V. 75. № 2. P. 403–413.
Metcalfe N.A. The interaction between behavior and physiology in determining life history patterns in atlantic salmon (Salmo salar) // Can. J. Fish. Aqua. Sci. 1998. V. 55. P. 93–103.
Morgan I.J., Metcalfe N.B. Deferred costs of compensatory growth after autumnal food shortage in juvenile salmon // Proc. R. Soc. Lond. B. 2001. V. 268. P. 295–301.
Mylonas C.C., Hinshaw J.M., Sullivan C.V. GnRHa-induced ovulation of brown trout (Salmo trutta) and its effects on egg quality // Aquaculture. 1992. V. 106. № 3–4. P. 379–392.
Nelson E.R., Allan E.R., Pang F.Y., Habibi H.R. Thyroid hormone and reproduction: regulation of estrogen receptors in goldfish gonads // Mol. Reprod. Dev. 2010. V. 77. № 9. P. 784–794.
Olsson I.C., Greenberg L.A. Life history tactics in cohorts of a partial migratory brown trout (Salmo trutta L.) population // ISRN Ecol. 2011. V. 2011(1). 7 p.
Peter R.E. Gonadotropin secretion during reproductive cycles in teleosts: Influences of environmental factors // Gen. Comp. Endocrinol. 1981. V. 45. № 3. P. 294–305.
Peter V.S., Peter M.C. The interruption of thyroid and interrenal and the inter-hormonal interference in fish: does it promote physiologic adaptation or maladaptation? // Gen. Comp. Endocrinol. 2011. V. 174. № 3. P. 249–258.
Plate E.M., Adams B.A., Allison W.E., Martens G., Hawryshyn C.W., Eales J.G. The effects of thyroxine or a GnRH analogue on thyroid hormone deiodination in the olfactory epithelium and retina of rainbow trout, Oncorhynchus mykiss and sockeye salmon, Oncorhynchus nerka // Gen. Comp. Endocrinol. 2002. V. 127. P. 59–65.
Powell J.F.F., Brackett J., Battaglia J.A. Induced and synchronized spawning of captive broodstock using Ovaplant and Ovaprim // Bull. Aquacult. Assoc. Can. 1998. V. 3. P. 14–18.
Sage M. The evolution of thyroidal function in fishes // Amer. Zool. 1973. V. 13. P. 899–905.
Thorpe J.E. Reproductive strategies in atlantic salmon Salmo salar L. // Aquacult. Fish. Manag. 1994. V. 25. P. 77–87.
Volkoff H., Peter R.E. Actions of two forms of gonadotropin releasing hormone and a GnRH antagonist on spawning behavior of the goldfish Carassius auratus // Gen. Comp. Endocrinol. 1999. V. 116. P. 347–355.
White S.A., Nguyen T., Fernald R.D. Social regulation of gonadotropin-releasing hormone // J. Exp. Biol. 2002. V. 205. P. 2567–2581.
Wysujack K., Greenberg L.A., Bergman E., Olsson I.C. The role of the environment in partial migration: food availability affects the adoption of a migratory tactic in brown trout Salmo trutta // Ecol. Freshw. Fish. 2008. V. 18. P. 52–59.
Yamamoto N., Oka Y., Kawashima S. Lesions of gonadotropin-releasing hormone-immunoreactive terminal nerve cells: effects on the reproductive behavior of male dwarf gouramis // Neuroendocrinology. 1997. V. 65. P. 403–412.
Yaron Z., Levavi-Sivan B. Endocrine regulation of fish reproduction // Encyclopedia of fish physiology: from genome to environment / Ed. Farrell A.P. San Diego: Acad. Press, 2011. V. 2. P. 1500–1508.
Zohar Y, Mylonas C.C. Endocrine manipulations of spawning in cultured fish: from hormones to genes // Aquaculture. 2001. V. 197. P. 99–136.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


