Известия РАН. Серия биологическая, 2020, № 4, стр. 352-360
Эколого-таксономические и генетические характеристики сообществ дрожжей виноградников Дагестана
Д. А. Абдуллабекова 1, *, Е. С. Магомедова 1, Д. А. Аливердиева 1, А. В. Качалкин 2, 3, **
1 Прикаспийский институт биологических ресурсов ДФИЦ РАН
367000 Махачкала, ул. М. Гаджиева, 45, Россия
2 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
3 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина ФИЦ ПНЦБИ РАН
142290 Пущино, просп. Науки, 5, Россия
* E-mail: dina2407@mail.ru
** E-mail: kachalkin_a@mail.ru
Поступила в редакцию 08.06.2019
После доработки 05.11.2019
Принята к публикации 02.12.2019
Аннотация
В результате эколого-таксономического исследования дрожжевого сообщества виноградников в Дагестане установлена заметная дифференциация видового разнообразия в зависимости от типа субстрата и фазы онтогенеза растения. С ягод виноградников Дагестана выделено 33 из 44 видов дрожжевых грибов, обнаруженных в ходе многолетних исследований данного биотопа. Отмечена сезонная встречаемость дрожжевых грибов в агроценозе виноградников, характеризуемая максимальным видовым богатством, приходящимся на период зрелости ягод – конец лета–осень. Показано, что каждый этап развития растения характеризуется специфическим типом дрожжевого населения, что в значительной степени определяет вероятность обнаружения представителей того или иного вида как на самом растении, так и в почве под ним. Методом ДНК-портретирования штаммов Saccharomyces cerevisiae, выделенных с виноградников Дагестана, выявлена их принадлежность к разным генетическим группировкам.
Изучение, сохранение и рациональное использование биологического разнообразия, согласно международной Конвенции о биологическом разнообразии – общая задача человечества (Конвенция, 1992). Конвенция рассматривает биоразнообразие на всех уровнях – от экосистем и видов до генетических популяций. Фактически Конвенция охватывает все возможные области, прямо или косвенно связанные с биоразнообразием и деятельностью человека. Эколого-таксономическое изучение одной из наиболее биотехнологически значимых групп микроорганизмов – дрожжевых грибов, выступающих обязательным компонентом микробного населения самых разных природных объектов – способствует решению многих задач. В результате получены новые сведения о численности и специфичности видового состава, выявлены закономерности распространения дрожжей в природе, обнаружены новые таксоны, созданы дрожжевые коллекции, выделены культуры, представляющие интерес для биотехнологии, биохимии и медицины (Чернов, 2013; Groenewald et al., 2017).
Большое внимание исследователи уделяют дрожжевым грибам виноградников, изучение которых традиционно для европейских винодельческих регионов (Риберо-Гайон и др., 1980; Ribéreau-Gayon et al., 2006). В последнее десятилетие в результате развития филогенетической систематики оно получило новый импульс не только в странах Старого света, но и в азиатских и южно-американских регионах (Bezerra-Bussoli et al., 2013; Sun et al., 2014; Качалкин и др., 2015; Varela, Bomeman, 2017).
В России изучение природного дрожжевого населения виноградников с учетом современных представлений об этой группе грибов и новой филогенетической систематики (Kurtzman et al., 2011) впервые начато в Республике Дагестан, на чью долю приходится 35% виноградных насаждений страны (Абдуллабекова и др., 2014, 2017а; Качалкин и др., 2015).
Многовековая история существования культуры винограда на территории Дагестана, где он произрастает в разных почвенно-климатических условиях равнинных и предгорных ландшафтов, наличие аборигенных и интродуцированных сортов винограда, происходящих из различных частей света, представляют значительный интерес для изучения экологии дрожжевых популяций. Дрожжевое население, обитающее в схожих условиях виноградников в различных винодельческих странах, характеризуется как набором аналогичных черт вне зависимости от региона (Качалкин и др., 2015), так и наличием региональных особенностей, анализ которых невозможен без детального исследования традиционных винодельческих регионов России, к которым относится Республика Дагестан.
Цель исследований – эколого-таксономический анализ дрожжевых сообществ виноградников Дагестана, проведение генетического портретирования популяции биотехнологически значимого вида дрожжей Saccharomyces cerevisiae.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование дрожжевых грибов виноградников проводили в 2001–2016 гг. в 10 хозяйствах на территории Центрального, Южного и Северного Дагестана в диапазоне высот 34–265 м над уровнем моря в следующих районах: Дербентском (пос. Мамедкала), Табасаранском (с. Ерси), Каякентском (села Каякент, Мюрего и Алходжакент), Кумторкалинском (с. Кумторкала), Хасавюртовском (села Муцалаул и Новогагатли), Новолакском (с. Новочуртах) и пригороде Махачкалы (пос. Шамхал).
При эколого-таксономическом анализе дрожжевых сообществ виноградников Дагестана были использованы все полученные к настоящему времени результаты микробиологических исследований, а также первичные данные ранее опубликованных исследований (Абдуллабекова и др., 2014, 2017а; Качалкин и др., 2015).
Для изучения видового разнообразия дрожжей был использован комплексный подход: выделение дрожжевых грибов в период зрелости винограда, исследование структуры сообществ дрожжей в годовой динамике, применение прямого и накопительного выделения для изоляции чистых культур. При отборе проб использовали вертикально-ярусный подход (Чернов, 2013), предусматривающий одновременный анализ образцов растения (ягоды, листья и другие части растения), опада, поверхностного слоя почвы (0–5 см), позволяющий проводить комплексное изучение численности и состава дрожжевых грибов на уровне биоценоза.
Дрожжи выделяли из всех субстратов с помощью прямого метода посева на агаризованную среду с предварительной десорбцией дрожжевых клеток, а также метода накопительных культур при изоляции дрожжей с ягод винограда и из почвы. В первом случае посев выполняли в день отбора проб. Десорбцию клеток с исследованных субстратов проводили в стерильной воде, разведение в зависимости от типа субстрата составляло 1/3–1/50, обработку на вортексе осуществляли в течение 10 мин. Из каждого разведения брали аликвоты 0.1 мл и высевали на 2–3 чашки Петри с глюкозопептонно-дрожжевой (ГПД) средой (глюкоза – 2%, пептон – 1%, дрожжевой экстракт – 0.5%, агар – 2%) с добавлением левомицетина (500 мг/л). При накопительном методе из ягод в местах сбора винограда с соблюдением необходимых мер стерильности получали сок, который разливали в стерильные закупоренные ватными пробками склянки объемом 0.5 л и привозили в лабораторию, где делали посевы с использованием в качестве среды виноградного сусла-агара (сахаристость 17%). В целях выявления всего спектра видов дрожжей высевы из спонтанно забродившего сока проводили в динамике: через каждые 3–4 сут до остановки ферментации.
Почву анализировали в день отбора проб. В качестве сред культивирования использовали виноградное сусло (сахаристость 17%) и селективную среду для сахаромицетов (дрожжевая азотная основа (Fluka, США) – 0.67%, раффиноза – 1%, этиловый спирт – 8%). Соотношение отобранных навесок и питательных сред составляло 1 : 5–7. Всего было исследовано по 45 навесок с использованием виноградного сусла и селективной среды. Культивирование накопительных сред проводили при 22–25°С до начала процесса брожения или помутнения среды.
Все посевы инкубировали при 22–25°С в течение 5–7 сут. Выросшие колонии дрожжей с помощью бинокулярной лупы разделяли по морфотипу, после чего подсчитывали число колоний каждого типа.
Видовую идентификацию собранной коллекции дрожжевых грибов проводили в 2011–2019 гг. на основе анализа нуклеотидных последовательностей ITS1-5.8S-ITS2 региона и/или D1/D2 доменов региона 26S (LSU) рДНК. Выделение ДНК и проведение полимеразной цепной рекции (ПЦР) осуществляли по ранее описанной методике (Качалкин, 2010). Для амплификации использовали праймеры ITS1f (5'-CTT GGT CAT TTA GAG GAA GTA) и NL4 (5'-GGT CCG TGT TTC AAG ACG G). Секвенирование амплифицированного региона проводили в научно-производственной компании “Синтол” (Москва), видовую идентификацию проводили с использованием баз данных GenBank NCBI (ncbi.nlm.nih.gov) и MycoID (mycobank.org). Исследованные культуры были помещены в коллекцию дрожжей кафедры биологии почв факультета почвоведения МГУ (КБП МГУ).
Генетическое портретирование дрожжей осуществляли по методике, описанной ранее (Качалкин и др., 2008), путем амплификации фрагментов ДНК с использованием микросателлитного праймера (GTG)5 с последующим электрофорезом продуктов ПЦР в 1.5%-ном агарозном геле. Обработку полученных результатов выполняли с использованием программы Phoretix 1D (Nonlinear Dynamics Ltd., UK). Для исследования были использованы культуры S. cerevisiae из коллекции КБП МГУ. Культуры КБП Y-4588, Y-4589, Y-4590, Y-4594, Y-5009, Y-5064, Y-5083, Y-5087, Y-5095, Y‑5160, Y-5176 были выделены с различных субстратов виноградников Дагестана, а КБП Y-4878, Y-4879, Y-4880, Y-4881 – с бродильных производств Дагестана. Более детальная информация о культурах размещена в электронном каталоге коллекции КБП МГУ (depo.msu.ru).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведенное исследование виноградников Дагестана, основанное на анализе 900 проб, позволило выделить 760 штаммов дрожжей, видовая идентификация культур показала их принадлежность к 44 видам. Данные распределения видового разнообразия дрожжевого населения по различным субстратам виноградников Дагестана представлены в табл. 1. Результаты проведенных исследований показывают, что 90% обнаруженных видов дрожжей – аскомицеты, принадлежащие к 18 родам (38 видов). Наиболее разнообразны по видовому составу роды Candida (5 видов), Metschnikowia (6 видов) и Pichia (6 видов), включающие в себя более половины аскомицетов, выделенных с различных субстратов виноградников. Дрожжи-базидиомицеты в агроценозе были представлены только 6 видами, относящимися к 5 родам: по 1 виду из родов Filobasidium, Papiliotrema, Sporisorium, Vishniacozyma, а также 2 вида рода Rhodotorula.
Таблица 1.
Виды дрожжей виноградников Дагестана
| Виды | Субстраты | ||
|---|---|---|---|
| ягоды | листья, лоза | почва | |
| Аскомицеты | |||
| Aureobasidium pullulans | + | + | + |
| Candida albicans | + | – | – |
| C. glabrata | + | + | + |
| C. membranifaciens | + | – | – |
| C. orthopsilosis | – | +* | – |
| C. sake | + | – | – |
| Debaryomyces hansenii | – | + | – |
| Hanseniaspora opuntiae | + | + | – |
| H. uvarum | + | + | + |
| Hyphopichia burtonii | + | – | – |
| Kodamaea ohmeri | – | + | + |
| Kregervanrija fluxuum** | – | – | +* |
| Lachancea thermotolerans | + | +* | + |
| Metschnikowia chrysoperlae | +* | – | – |
| M. pimensis | – | + | – |
| M. pulcherrima | + | + | + |
| M. sinensis | + | + | + |
| M. viticola | + | + | – |
| M. zizyphicola | + | – | – |
| Meyerozyma guilliermondii** | + | – | + |
| Pichia fermentans | – | + | – |
| P. kudriavzevii | + | +* | – |
| P. manshurica** | +* | – | +* |
| P. occidentalis | +* | + | – |
| Pichia sр. | + | – | – |
| P. terricola | + | +* | +* |
| Saccharomyces cerevisiae** | + | – | +* |
| Saccharomycopsis schoenii** | – | – | +* |
| S. vini | + | – | – |
| Saturnispora diversa | + | – | – |
| Schwanniomyces occidentalis | – | – | + |
| Starmerella apicola | + | – | – |
| S. bacillaris | + | – | – |
| S. lactis-condensi | + | – | – |
| Torulaspora delbrueckii | – | – | + |
| T. pretoriensis | + | – | – |
| Wickerhamomyces anomalus | + | + | – |
| Zygosaccharomyces rouxii** | – | – | +* |
| Базидиомицеты | |||
| Filobasidium magnum | + | + | + |
| Papiliotrema terrestris | + | – | + |
| Rhodotorula glutinis | + | – | – |
| Rh. mucilaginosa | + | + | + |
| Sporisorium penniseti | + | – | – |
| Vishniacozyma carnescens** | – | – | +* |
В ходе дополнительных исследований видовое разнообразие дрожжей виноградников Дагестана с 2014 г. (Качалкин и др., 2015) было дополнено семью ранее не встреченными видами, обнаруженными при дополнительном анализе 152 образцов. Таким образом, подтверждается сформулированный ранее тезис, основанный на кумулятивной кривой обнаружения видов, о возможности только незначительного прироста выявленных видов из виноградников в этом регионе в дальнейшем (Качалкин и др., 2015). Однако результаты продолженного исследования свидетельствуют об обнаружении отдельных видов в локусах, где прежде они не отмечались (табл. 1).
К дрожжам, впервые выделенным в 2014–2016 гг. с виноградников Дагестана, относятся виды Candida orthopsilosis, Kregervanrija fluxuum, Metschnikowia chrysoperlae, Pichia manshurica, Saccharomycopsis schoenii, Zygosaccharomyces rouxii и Vishniacozyma carnescens. Все эти дрожжи ранее неоднократно обнаруживались при исследовании виноградников Австрии, Аргентины, Бразилии, Индии, Испании, Италии, Китая, Португалии, США, Франции (Качалкин и др., 2015; Garofalo et al., 2016; Wang et al., 2018). Это еще раз подтверждает значительные черты сходства дрожжевого населения виноградников Дагестана и других винодельческих регионов мира.
Распределения дрожжевого населения по типам субстратов в агроценозе виноградников Дагестана принципиально различались. Наибольшее число видов (38) было изолировано с виноградного растения, в том числе 33 с ягод, из которых все, кроме вида F. magnum, были выделены в период их зрелости. Среди дрожжей с виноградного растения и из почвы под ним наиболее часто были обнаружены виды Aureobasidium pullulans, Candida spp., Hanseniaspora uvarum, Metschnikowia spp., Pichia spp. и S. cerevisiae. Однако по сравнению с растением в почвах под виноградом видовое разнообразие дрожжевых грибов составило только 20 видов, при этом не все из них выделялись с растений. Многие из обнаруженных в почве представителей родов Candida, Hanseniaspora, Lachancea, Pichia, Metschnikowia, Saccharomycopsis, Torulaspora, Zygosaccharomyces, а также вид S. cerevisiae обладают физиологическими характеристиками, свидетельствующим об их приспособленности к обитанию в средах, обогащенных легкодоступными источниками углерода, т.е. простыми сахарами (Kurtzman et al., 2011). Это свидетельствует об их аллохтонности, так как почти все они были обнаружены и на растении или плодах винограда. Некоторые виды, например K. fluxuum, S. schoenii, T. delbrueckii, Z. rouxii, выделенные только из почв, являются для этого субстрата также аллохтонными (Kurtzman et al., 2011). Все это указывает на то, что почва агроценозов играет роль резервуара микробного разнообразия, обеспечивающего сохранение многих видов дрожжей и их дальнейшее расселение. Среди типичных почвенных видов под виноградниками можно отметить P. terrestris и S. occidentalis, большинство культур которых ранее обнаруживалось именно в почвах (Kurtzman et al., 2011).
Отметим, что при изучении видового состава дрожжей почвы и виноградного растения важную роль играет метод выделения культур. Так, при использовании виноградного сусла в качестве накопительной среды частота обнаружения дрожжей в почве была почти в 2 раза выше, чем при прямом выделении (Абдуллабекова и др., 2017б). Именно благодаря этому подходу были обнаружены в почве аллохтонные виды дрожжей K. fluxuum, S. schoenii и Z. rouxii. Кроме того, именно этот метод позволил показать присутствие вида S. cerevisiae не только на зрелых ягодах, но и в почвах виноградников (Абдуллабекова и др., 2017б). Использование накопительного способа выделения культур также позволило обнаружить виды Meyerozyma guilliermondii, P. kudriavzevii, P. manshurica, P. occidentalis и S. cerevisiae на ягодах.
Исследования дрожжевых грибов, проведенные в течение года в динамике на одном из виноградников Дагестана, способствуют выявлению закономерностей сезонного распространения дрожжей. Известно, что каждый вид растения характеризуется специфическими особенностями онтогенеза, что, в свою очередь, определяет уникальный тип динамики его дрожжевого населения (Глушакова, Чернов, 2010; Чернов, 2013). Виноградное растение в процессе онтогенеза проходит годичный цикл, где наблюдаются период покоя (середина осени–начало весны) и вегетационный период, который разделяется на шесть этапов: сокодвижение, рост побегов и соцветий, цветение, рост ягод, созревание ягод, листопад. Однако изучение таксономического состава дрожжевого населения – постоянной и неотъемлемой части виноградного растения – в большинстве зарубежных исследований ограничено периодом зрелости винограда с разовым отбором проб (Качалкин и др., 2015).
Мониторинг изменения видового состава дрожжей при онтогенезе растения, проведенный с применением метода прямого посева, показал, что число видов, обитающих на виноградном растении и в почве под ним, закономерно изменяется в течение года. Всего с разных субстратов исследуемого агроценоза было выделено 20 видов дрожжей. Максимальное видовое разнообразие дрожжевых грибов (12 видов) было зафиксировано в августе, минимальное – в марте–июне (табл. 2). Разные виды дрожжей заметно различались по встречаемости. Стабильно выделяющимся с разных субстратов виноградников круглый год был эвритопный вид A. pullulans. Присутствие дрожжей рода Metschnikowia также характеризовалось длительным периодом (7 мес.) – с момента созревания ягод в августе и до конца февраля. Встречаемость представителей рода Metschnikowia – типичных обитателей цветков и сочных плодов (Kurtzman et al., 2011; Чернов, 2013) – не только отмечалась на винограде в период вегетации, но и зафиксирована в почве под ним в период покоя растения, что может быть объяснено миграцией дрожжей с растения в почву. К группе дрожжей с встречаемостью в течение 3–5 мес. после созревания винограда относились также представители сем. Saccharomycetaceae – L. thermotolerans и виды рода Torulaspora (T. delbrueckii и T. pretoriensis), а также представители сем. Saccharomycodaceae – виды рода Hanseniaspora (H. opuntiae и H. uvarum). Присутствие в посевах большинства других видов не превышало 1 мес., связанного с периодом зрелости ягод.
Таблица 2.
Годовая динамика обнаружения дрожжей на винограднике пос. Шамхал
| Виды | Месяц | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Aureobasidium pullulans | + | + | + | + | + | + | + | + | + | + | + | + |
| Candida albicans | – | – | – | – | – | – | – | + | – | – | – | – |
| C. sake | – | – | – | – | – | – | – | – | – | + | – | – |
| Debaryomyces hansenii | – | – | – | – | – | – | + | – | – | – | – | – |
| Filobasidium magnum | – | – | – | – | – | – | + | + | – | – | – | – |
| Hanseniaspora opuntiae | – | – | – | – | – | – | – | + | – | + | – | – |
| H. uvarum | – | – | – | – | – | – | – | + | + | + | – | – |
| Hyphopichia burtonii | – | – | – | – | – | – | – | + | – | – | – | – |
| Lachancea thermotolerans | – | – | – | – | – | – | – | + | + | + | + | + |
| Metschnikowia pimensis | – | – | – | – | – | – | – | – | + | – | – | – |
| M. sinensis | + | + | – | – | – | – | – | + | + | + | + | + |
| M. zizyphicola | – | – | – | – | – | – | – | + | – | – | – | – |
| Rhodotorula glutinis | – | – | – | – | – | – | – | – | + | – | – | – |
| Schwanniomyces occidentalis | – | – | – | – | – | – | – | – | – | – | + | – |
| Sporisorium penniseti | – | – | – | – | – | – | – | – | + | – | – | – |
| Starmerella apicolа | – | – | – | – | – | – | – | + | – | – | – | – |
| S. bacillaris | – | – | – | – | – | – | – | – | + | – | – | – |
| S. lactis-condensi | – | – | – | – | – | – | – | + | – | – | – | – |
| Torulaspora delbrueckii | – | – | – | – | – | – | – | – | – | – | + | – |
| T. pretoriensis | – | – | – | – | – | – | – | + | + | – | – | – |
Обнаружение наибольшего видового разнообразия дрожжей именно в период зрелости ягод, вероятнее всего, связано с форической ролью насекомых в их распространении. К примеру, известно, что плодовые мушки Drosophila melanogaster, как и другие представители сем. Drosophiliadae, – векторы распространения дрожжей, которых привлекает запах спелых и поврежденных плодов, а также повреждения растительных тканей (Broderick, Lemaitre, 2012; Чернов, 2013).
Таким образом, исследование дрожжевого населения одного из виноградников в годовой динамике четко продемонстрировало изменение соотношения видов дрожжевых грибов в течение онтогенеза виноградного растения. Всплеск видового разнообразия наблюдается в период физиологической зрелости ягод, затем, с началом периода покоя в октябре, видовое богатство заметно снижается и становится практически неизменным. Видовой состав дрожжей других виноградников Дагестана может быть несколько иным и включать в себя другие виды, характерные для данного региона (табл. 1). Однако полученные данные о сезонном изменени группировок дрожжей в некоторой степени позволяют определить вероятность встречаемости того или иного вида в течение года, а также позволяют проводить его целенаправленный поиск.
Важно, что при изучени годовой динамики дрожжевых грибов растения и почвы прямым методом вероятность обнаружения бродящих дрожжей, т.е. упомянутых представителей сем. Saccharomycetaceae (L. thermotolerans и виды рода Torulaspora) и Saccharomycodaceae (виды рода Hanseniaspora), а также видов H. burtonii, M. pimensis, S. apicola, S. bacillaris и S. lactis-condensi, возрастает в период после созревания ягод. Анализ тех же образцов с использованием накопительного способа выделения культур позволил обнаружить не только L. thermotolerans и T. delbrueckii, но и другие культуры, способные к активной ферментации, – S. cerevisiae и Z. rouxii.
Широкий спектр видового разнообразия дрожжевых грибов виноградников Дагестана включает в себя различные физиологические группы, среди которых присутствуют активные, умеренные и слабые бродильщики. Обнаруженные дрожжи также заметно различаются и по своим ассимиляционным характеристикам (Kurtzman et al., 2011). Таким образом, природный комплекс дрожжевых грибов может существенно влиять на винодельческую продукцию в ходе традиционных процессов виноделия. В частности, показано, что использование дрожжей-несахаромицетов с различным метаболизмом (Debaryomyces spp., S. bacillaris (C. zemplinina), P. terricola, T. delbrueckii, L. thermotolerans, H. uvarum, M. pulcherrima) в смешанных ферментациях с видом S. сerevisiae позволяет регулировать образование этанола, летучих кислот, высших спиртов, глицерина, сложных эфиров, терпенолов, летучих тиолов, внеклеточных протеолитических и пектинолитических ферментов (Strauss et al., 2001; Swiegers, Pretorius, 2005; Jolly et al., 2014). Все это в значительной мере влияет на качество производимой продукции. Имеются сведения о выпуске коммерческих дрожжей T. delbrueckii, M. pulcherrima, C. zemplinina, L. thermotolerans, P. kluyveri, Zygosaccharomyces spp. и других для улучшения качеств винной продукции (Jolly et al., 2014). В то же время почти все эти виды (как естественная микобиота виноградников) уже присутствуют на ягодах и листьях винограда и могут иметь важное значение при традиционном виноделии. Видовое богатство дрожжей-несахаромицетов, способных влиять на вкус и ароматический профиль вин, увеличивает возможность использования таких региональных микробных популяций.
Отдельного внимания заслуживают также дрожжи S. cerevisiae, изолированные с виноградников Дагестана и с бродильных производств (мест ферментации виноградного муста). Исследование физиологии, экологии и биогеографии “культурных” и “диких” штаммов S. cerevisiae, выделенных из природы и с производств – одно из актуальных направлений микробиологии. Результаты исследования природных локусов обитания “диких” штаммов S. cerevisiae, разделения экологических ниш “культурных” и “диких” штаммов, а также закономерностей филогеографического распространения этого вида дрожжей были представлены во многих работах (Fay, Benavides, 2005; Legras et al., 2007; Liti et al., 2009; Schacherer et al., 2009; Boynton, Greig, 2014; Sampaio, Goncalves, 2017; и др.). Проведенный ранее анализ биотехнологических свойств дрожжей S. cerevisiae, выделенных с виноградников Дагестана и с производств, свидетельствует об их высокой физиологической неоднородности (Абдуллабекова и др., 2017а). Однако генетическая характеристика дрожжей S. cerevisiae, представляющих дагестанские популяции, ранее не проводилась. Известно, что ДНК-портретирование культур с использованием микросателлитного праймера (GTG)5 неоднократно показывало высокую информативность данного подхода для выявления генетической неоднородности популяций S. cerevisiae (Baleiras Couto et al., 1996; Наумова и др., 2005). Проведенное нами ДНК-портретирование коллекции дагестанских штаммов S. cerevisiae показало, что ПЦР-профили штаммов демонстрируют заметный полиморфизм продуктов амплификации (300–750 п. н.). Кластеризация полученных результатов позволила выявить принадлежность культур к разным генетическим группировкам (рис. 1) и подтвердить данные о неоднородности физиологических характеристик популяции дагестанских штаммов S. cerevisiae. Обнаружено, что три культуры с бродильных производств (КБП Y-4879, Y-4880 и Y-4881) заметно отличаются от штаммов, выделенных с виноградников. Можно предположить, что произошло обособление данных группировок в результате синантропизации из числа “диких” дрожжей виноградников, инфицировавших производство. Известно, что на исследуемых винодельнях коммерческие культуры не применяются и брожение муста проходит спонтанно.
Рис. 1.
Кластеризация (UPGMA) ПЦР-профилей штаммов Saccharomyces cerevisiae. Звездочкой отмечены культуры с бродильных производств.
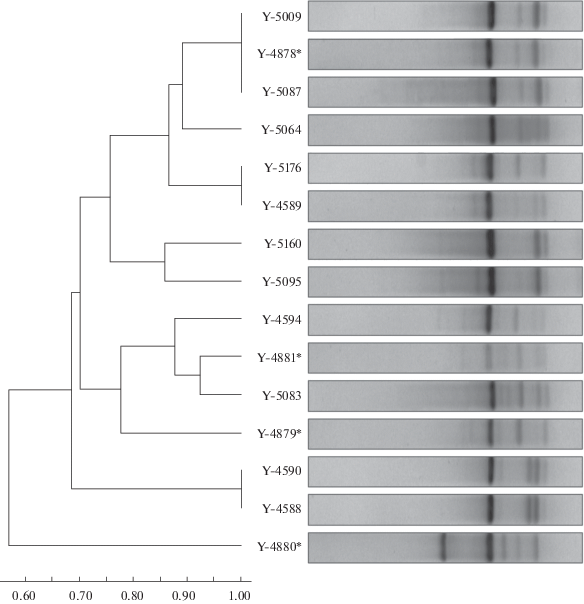
Высокий уровень сходства штамма КБП Y-4878, изолированного из спонтанно забродившего муста на винзаводе (г. Дербент), и КБП Y-5087 с виноградников, расположенных в радиусе 30–35 км от него (пос. Мамедкала), можно объяснить интродукцией дрожжей с близлежащих агроценозов в производство. По сути, как показало ДНК-портретирование, штамм КБП Y-4878, несмотря на выделение его с бродильного производства, схож с дрожжами, обитающими на винограде. Это свидетельствует о возможности участия “диких” дрожжей в традиционном виноделии. Штамм КБП Y-5009 из этой группировки также был выделен из виноградника в окрестностях бархана Сарыкум на расстоянии 150 км от упомянутого винзавода. Возможно, дрожжи с таким ПЦР-профилем, встречаемые в удаленных один от другого районах, – широко распространенные природные популяции для Дагестана.
Не исключена и обратная интродукция дрожжей-сахаромицетов с производства на виноградники, однако в наших исследованиях она не обнаружена: во-первых, исследованная выборка культур S. cerevisiae демонстрировала значительную генетическую неоднородность, характерную для природных популяций (Libkind et al., 2008; Orlic et al., 2010); во-вторых, хорошо известно о низкой выживаемости “культурных” дрожжей в природе (Cordero-Bueso et al., 2011). Однако отметим, что для более полного отражения ситуации необходимо применение альтернативных подходов к генотипированию культур и расширение исследуемой выборки. Тем не менее впервые выявленный в работе высокий уровень генетической неоднородности популяции дрожжей S. cerevisiae на виноградниках Дагестана может быть прекрасным примером для изучения биогеографических закономерностей распространения данного вида в природе.
Работа выполнена при финансовой поддержке программы фундаментальных исследований Президиума РАН “Биоразнообразие природных систем. Биологические ресурсы России: оценка состояния и фундаментальные основы мониторинга”. Видовая идентификация дрожжевых грибов в 2019 г. проводилaсь за счет средств гранта РНФ 19-74-10002.
Список литературы
Абдуллабекова Д.А., Магомедова Е.С., Магомедов Г.Г., Качалкин А.В. Технологические свойства дрожжей Saccharomyces cerevisiae различных мест обитания // Виноделие и виноградарство. 2017а. № 4. С. 4–7.
Абдуллабекова Д.А., Магомедова Е.С., Качалкин А.В., Магомедов Г.Г., Чернов И.Ю. Структура сообществ дрожжевых грибов виноградника в Дагестане // Микология и фитопатология. 2014. Т. 48. № 2. С. 78–83.
Абдуллабекова Д.А., Магомедова Е.С., Магомедов Г.Г., Аливердиева Д.А., Качалкин А.В. Дрожжевые сообщества каштановых почв под виноградниками Дагестана // Почвоведение. 2017б. № 12. С. 1494–1498.
Глушакова А.М., Чернов И.Ю. Сезонная динамика структуры сообществ эпифитных дрожжей // Микробиология. 2010. Т. 79. № 6. С. 832–842.
Качалкин А.В. Новые данные о распространении некоторых психрофильных дрожжевых грибов в Московской области // Микробиология. 2010. Т. 79. № 6. С. 843–847.
Качалкин А.В., Глушакова А.М., Юрков А.М., Чернов И.Ю. Особенности дрожжевых группировок в филлосфере сфагновых мхов // Микробиология. 2008. Т. 77. № 4. С. 533–541.
Качалкин А.В., Абдуллабекова Д.А., Магомедова Е.С., Магомедов Г.Г., Чернов И.Ю. Дрожжевые грибы виноградников Дагестана и других регионов // Микробиология. 2015. Т. 84. № 3. С. 360–368.
Конвенция о биологическом разнообразии (ООН, Рио-де-Жанейро, 5 июня 1992 г).
Наумова Е.С., Жолудева М.В., Мартыненко Н.Н., Наумов Г.И. Молекулярно-генетическая дифференциация культурных дрожжей Saccharomyces // Микробиология. 2005. Т. 74. № 2. С. 215–223.
Риберо-Гайон Ж., Пейно Э., Риберо-Гайон П., Сюдро П. Теория и практика виноделия. М.: Пищ. пром-сть, 1980. Т. 2. 352 с.
Чернов И.Ю. Дрожжи в природе. М.: КМК, 2013. 336 с.
Baleiras Couto M.M., Eijsma B., Hofstra H., Huis in’t Veld J.H., van der Vossen J.M. Evaluation of molecular typing techniques to assign genetic diversity among Saccharomyces cerevisiae strains // Appl. Environ. Microbiol. 1996. V. 62(1). P. 41–46.
Bezerra-Bussoli C., Baffi M.A., Gomes E., Da-Silva R. Yeast diversity isolated from grape musts during spontaneous fermentation from a Brazilian winery // Curr Microbiol. 2013. V. 67(3). P. 356–361.
Boynton P.J., Greig D. The ecology a evolution of non-domesticated Saccharomyces species // Yeast. 2014. V. 31. P. 449–462.
Broderick N.A., Lemaitre B. Gut-associated microbes of Drosophila melanogaster // Gut Microbes. 2012. V. 3. P. 307–321.
Cordero-Bueso G., Arroyo T., Serrano A., Valero E. Remanence and survival of commercial yeast in different ecological niches of the vineyard // FEMS Microbiol. Ecol. 2011. V. 77(2). P. 429–437.
Fay J.C., Benavides J.A. Evidence for domesticated and wild populations of Saccharomyces cerevisiae // PLoS Genet. 2005. V. 1(1). P. 66–71.
Garofalo C., Tristezza M., Grieco F., Spano G., Capozzi V. From grape berries to wine: population dynamics of cultivable yeasts associated to “Nero di Troia” autochthonous grape cultivar // World J. Microbiol. Biotechnol. 2016 V. 32(4): 59. https://doi.org/10.1007/s11274-016-2017-4
Groenewald M., Boundy-Mills K., Čadež N., Endoh R., Jindamorakot S., Pohl-Albertyn C., Rosa C.A., Turchetti B., Yurkov A. Census of yeasts isolated from natural ecosystem and conserved in worldwide collections // Yeasts in Natural Ecosystems: Diversity / Eds Buzzini P., Lachance M.-A., Yurkov A. Springer, 2017. P. 455–476.
Jolly N.P., Varela C., Pretorius I.S. Not your ordinary yeast: non-Saccharomyces yeasts in wine production uncovered // FEMS Yeast Res. 2014. V. 14. № 2. P. 215–237.
Legras J., Merdinoglu D., Cornuet J., Karst F. Bread, beer and wine: Saccharomyces cerevisiae diversity reflects human History // Mol. Ecol. 2007. V. 16. P. 2091–2102.
Libkind D., Gadanho M., van Broock M.V., Sampaio J.P. Studies on the heterogeneity of the carotenogenic yeast Rhodotorula mucilaginosa from Patagonia, Argentina // J. Basic Microbiol. 2008. V. 48. P. 93–98.
Liti G., Carter D.M., Moses A.M., Warringer J., Parts L., James S.A., Davey R.P., Roberts I.N., Burt A., Koufopanou V., Tsai I.J., Bergman C.M., Bensasson D., O’Kelly M.J.T., van Oudenaarden A., Barton D.B.H., Bailes E., Nguyen Ba A.N., Jones M., Quail M.A., Goodhead I., Sims S., Smith F., Blomberg A., Durbin R., Louis E.J. Population genomics of domestic and wild yeasts // Nature. 2009. V. 458. P. 337–341.
Orlic S., Tanja V., Huic K.B., Arroyo-Lopez F.N., Jeromel A., Kozina B., Iacumin L., Comi G. Diversity and oenological characterization of indigenous Saccharomyces cerevisiae associated with Zilavka grapes // World J. Microbiol. Biotechnol. 2010. V. 26. P. 1483–1489.
Ribéreau-Gayon P., Dubourdieu D., Donéche B., Lonvaud A. Cytology, taxonomy and ecology of grape and wine yeasts // Handbook of Enology. The Microbiology of Wine and Vinifications / Eds Ribéreau-Gayon P., Dubourdieu D., Donèche B., Lonvaud A. Chichester, UK: Wiley, 2006. V. 1. P. 1–51.
Sampaio J.P., Goncalves P. Biogeography and ecology of the genus Saccharomyces // Yeasts in Natural Ecosystems: Diversity / Eds Buzzini P., Lachance M.A., Yurkov A. Springer, 2017. P. 131–154.
Schacherer J., Shapiro A., Ruderfer D., Kruglyak L. Comprehensive polymorphism survey elucidates population structure of Saccharomyces cerevisiae // Nature. 2009. V. 458. P. 342–345.
Strauss M.L.A., Jolly N.P., Lambrechts M.G., van Rensburg P. Screening for the production of extracellular hydrolytic enzymes by non-Saccharomyces wine yeasts // J. Appl. Microbiol. 2001. V. 91(1). P. 182–190.
Swiegers J.H., Pretorius I.S. Yeast modulation of wine flavor // Adv. Appl. Microbiol. 2005. V. 57. P. 131–175.
Sun Y., Guo J., Liu F., Liu Y. Identification of indigenous yeast flora isolated from the five winegrape varieties harvested in Xiangning, China // Antonie Van Leeuwenhoek. 2014. V. 105(3). P. 533–540.
The yeasts, a taxonomic study / Eds Kurtzman C.P., Fell J.W., Boekhout T. 5th ed. Elsevier, 2011. 2080 p.
Varela C., Bomeman A.R. Yeasts found in vineyards and wineries // Yeast. 2017. V. 34. P. 111–128.
Wang X., Glawe D.A., Kramer E., Weller D., Okubara P.A. Biological control of Botrytis cinerea: Interactions with native vineyard yeasts from Washington State // Phytopathology. 2018. V. 108(6). P. 691–701.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


