Известия РАН. Серия биологическая, 2020, № 4, стр. 375-384
Дипептиды и глицин модулируют развитие проростков и регенерантов Nicotiana tabacum L.
Л. И. Федореева 1, 2, *, Н. В. Кононенко 1, Е. Н. Баранова 1, Т. А. Диловарова 1, Е. А. Смирнова 1, 3, Б. Ф. Ванюшин 1, 2
1 ВНИИ сельскохозяйственной биотехнологии РАН
127550 Москва, ул. Тимирязевская, 42, Россия
2 НИИ физико-химической биологии им. А.Н. Белозерского, МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 40, Россия
3 МГУ им. М.В. Ломоносова, биологический ф-т
119234 Москва, Ленинские горы, 1, стр. 12, Россия
* E-mail: iab@iab.ac.ru
Поступила в редакцию 29.05.2019
После доработки 19.09.2019
Принята к публикации 25.10.2019
Аннотация
Установлено, что дипептиды глицилглицин (GlyGly) и глициласпарагиновая кислота (GlyAsp), а также аминокислота глицин (Gly) в концентрации 10–7 М в среде существенно стимулируют рост и развитие регенерантов и проростков табака Nicotiana tabacum L. Отмечено, что GlyGly, GlyAsp и Gly влияют на клеточную дифференцировку и формообразовательные процессы у каллусов, а также модулируют экспрессию генов семейств KNOX и GRF. Обнаружено, что профили индукции или репрессии экспрессии генов одним и тем же препаратом в регенерантах и проростках табака различные, а GlyGly, GlyAsp и Gly могут рассматриваться как регуляторы роста и развития растений, действие которых имеет сигнальную и в основном эпигенетическую природу.
Пептиды образуют обширную и многообразную сигнальную регуляторную систему, контролирующую рост и развитие животных и растений (Khavinson, Malinin, 2005; Ванюшин и др., 2017). Большинство изученных растительных пептидов представляли собой небольшие сигнальные пептиды или противомикробные пептиды, образующиеся из нефункциональных белков-предшественников (Goyal, Mattoo, 2014). В последнее время появляются данные о пептидах, образованных из функциональных белков, непосредственно транслируемых на небольших открытых рамках считывания (Hanada, 2013). Секретируемые пептиды (от 2 до 100 аминокислотных остатков) играют важную роль в регуляции межклеточных взаимодействий, физиологических активностей и ответов на различные воздействия и сигналы внешней среды (Czyzewicz et al., 2013; Motomitsu et al., 2015; Tavormina et al., 2015).
О действии экзогенных пептидов, которые могут проникать внутрь растений, данных практически нет. Короткие экзогенные пептиды избирательно модулируют экспрессию генов и синтез белков, в том числе участвующих в репликации и репарации ДНК и отвечающих за клеточную дифференцировку у животных (Khavinson, Malinin, 2005). Действие таких пептидов геноспецифично, имеет сигнальный регуляторный характер и, по-видимому, в основном эпигенетическую природу (Ванюшин и др., 2017). Например, экзогенные пептиды (эпиталон) увеличивают продолжительность жизни животных (Khavinson et al., 2014), тетрапептид бронхоген регулирует дифференцировку, пролиферацию и апоптоз в культурах клеток бронхиального эпителия человека (Khavinson et al., 2015), а вилон оказывает такое же действие на клетки тимуса и лимфоциты периферической крови человека и животных (Khavinson et al., 2015). Эти пептиды тканеспецифичны, индуцируют экспрессию генов, отвечающих за репарацию и репликацию ДНК (Khavinson et al., 2014, 2015). Предполагается, что пептидная регуляция жизнедеятельности у эукариот едина и возникла она на ранних этапах эволюции (Ванюшин и др., 2017). В связи с этим существенный интерес вызывает действие на разные организмы и биологические системы наиболее просто организованных коротких пептидов, которые могли возникнуть в том числе и абиогенным путем на ранних этапах становления жизни.
Ранее нами было обнаружено, что экзогенные короткие пептиды эпиталон (AlaGluAspGly), бронхоген (AlaGluAspLeu) и вилон (LysGlu) влияли на рост, развитие и дифференцировку каллуса табака Nicotiana tabacum L. (Федореева и др., 2017).
Цель работы – сравнительное изучение влияния низких концентраций дипептидов глицилглицина (GlyGly), глициласпарагиновой кислоты (GlyAsp), а также аминокислоты глицина (Gly) на рост, развитие и экспрессию генов в проростках и каллусах табака N. tabacum L.
МАТЕРИАЛЫ И МЕТОДЫ
Семена табака N. tabacum L. (сортотип Самсун) стерилизовали 1.5%-ным раствором гипохлорита натрия c добавлением 0.01%-ного Triton X-100 в течение 15 мин. Затем их трижды промывали стерильной дистиллированной водой и помещали в колбы с агаризованной безгормональной средой Мурашиге–Скуга (МС) (Sigma, США) для проращивания. Образовавшиеся после прорастания семян семядоли отрезали скальпелем и выкладывали по 4 шт. на чашки Петри с агаризованой средой МС, содержащей 10–7 М GlyGly, GlyAsp или Gly. Для контроля использовали среду МС без добавления пептидов и аминокислоты. Среда содержала также фитогормоны: 2 мг/л 6-бензиламинопурина и по 0.2 мг/л α-нафтилуксусной и индолилмасляной кислот. В опыте использовали 4–5 чашек Петри. В течение 14 сут чашки Петри с эксплантами выдерживали в термостате в темноте при 25°С, а затем помещали в световую комнату. Экспланты культивировали при следующем температурном режиме: днем 20–22°С, ночью 16–18°С, длительность фотопериода 16 ч (интенсивность света 5000 лк). Эксперименты по получению регенерантов из эксплантов проводили в четырех повторностях.
Через 21 сут после эксплантации регистрировали частоту каллусогенеза и морфологию появляющихся на эксплантах регенерантов: цвет, текстуру, размер, число образовавшихся регенерантов и листьев. В конце эксперимента (через 28 сут) отмечали нормально сформировавшиеся растения (регенеранты), имеющие побеги и корневую систему. Эффективность регенерации рассчитывали по числу регенерантов на один эксплант.
Для получения проростков табака семена после обработки (описано выше) помещали на агаризованную среду МС, содержавшую 10–7 М GlyGly, GlyAsp или Gly. В качестве контроля использовалась среда МС без пептидов и Gly. Растения табака выращивали в течение 28 сут. Определяли сырую массу, длину главного корня, длину надземной части проростка, высоту проростка и площадь листа. Площадь листовой пластинки определяли с помощью микроскопа Olympus BX51 (Япония), оснащенного программой Сell. Статистическую обработку всех данных проводили в программе Exel.
РНК выделяли из регенерантов и проростков табака стандартным методом с использованием наборов реагентов для выделения РНК “РНК-Экстран” (Синтол, Россия). Концентрацию выделенных препаратов РНК определяли спектрофотометрически. кДНК получали по стандартной методике с использованием набора реагентов (Синтол) для проведения обратной транскрипции.
Сведения о первичной структуре генов KNOX1 и GRF N. tabacum и N. sylvestris получены из базы данных NCBI. Праймеры к этим генам были подобраны с помощью он-лайн сервиса NCBI Primer-BLAST и синтезированы (Синтол) (табл. 1, 2).
Таблица 1.
Гены семейства GRF и праймеры к ним
| Ген | Праймеры | Кодируемый белок | Accession number |
|---|---|---|---|
| GRF1 | ccc gga ttc cca act aca ca agc gcg tgt act tca cta ctt |
DNA-(apurinic or apyrimidinic site) lyase 2-like | LOC107764892 |
| GRF2 | cat cca gca gtg cac aga ga ctt cct gag acc gag cag tg |
DNA topoisomerase 3-alpha-like | LOC107824417 |
| GRF3 | tac gaa ctg tga ggc atc cg ttc acc act caa tgt gcc gt | 3'–5' exoribonuclease 1-like | LOC107832708 |
| GRF4 | gac gaa gag gaa ggc ttg ga gcc gta ctc cca tca gct tt | Endonuclease 8-like 3 | LOC104218308 |
Таблица 2.
Гены семейств KNAT, LET и праймеры к ним
| Ген | Праймеры | Кодируемый блок | Accession number |
|---|---|---|---|
| KNAT1 | caa ctc agc gac ctc atg gatgt tcc cat ggg cct tca tc | Homeobox protein knotted-1 like 1 | LOC107781659 |
| KNAT2 | cgc cat att ttg gat cgc cgccg aac aca ccg acg aca ta | Homeobox protein knotted-1 like 2 | LOC107807974 |
| KNAT3 | cgt gtg agg cag gag cta aaagt atc gcc cgg gag ttt tc | Homeobox protein knotted-1 like 3 | LOC107787501 |
| KNAT6 | gct gta gca gac gcg atg attct ggt ggt gct cct acc tt | Homeobox protein knotted-1 like 6 | LOC107780680 |
| LET6 | act tcc tcc tct gaa tct gct ctgc gca gca att gac ctt tc | Homeobox protein knotted-1 like LET6 | LOC104227253 |
| LET12 | agt gca aga gac agg gtt gcttt ttc acc tct ttc gtt tgc tt | Homeobox protein knotted-1 like LET12 | LOC107773625 |
Полимеразную цепную реакцию в реальном времени (ПЦР-РВ) проводили в термоциклере CFX 96 Real-Time System (Biorad, США). Образцы подготавливали стандартным методом с помощью набора реагентов для проведения ПЦР-РВ в присутствии Sybr Green (Синтол). Реакцию ПЦР-РВ проводили в одинаковых условиях для всех образцов: 95°С – 5 мин (активация полимеразы), далее 45 циклов: 94°С – 30 с, 5°С – 30 с, 72°С – 30 с. Реакцию проводили в 2–3 параллелях в трех повторностях. Ген GaPDh (LOC107828122), кодирующий белок глицерид-3-фосфатдегидрогеназу (glyceraldehyde-3-phosphate dehydrogenase), был взят в качестве референсного гена. Относительный уровень экспрессии генов рассчитывали по калибровочной кривой, построенной с ПЦР-продуктами, полученными с праймерами к гену GaPDh.
Эффективность ПЦР-РВ рассчитывали как E, % = (10–1/s – 1) – 100, где s – угол наклона зависимости десятичного логарифма значений порогового цикла (Сt) от концентрации кДНК. Эффективность ПЦР-РВ с праймерами к исследованным генам была 95–96%.
В работе использовано оборудование Центра коллективного пользования ВНИИСБ РАН.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Установлено, что GlyGly, GlyAsp или Gly при концентрации 10–7 М в среде стимулировали каллусогенез, увеличивали массы каллусной ткани табака и регенерантов и влияли на формирование листьев. Под действием пептидов масса регенерантов из каллусной ткани семядольных листьев табака увеличивалась на 35–90% по сравнению с контролем (рис. 1, табл. 3). Формирование листьев у регенерантов табака, выращенных на среде в присутствии пептидов, начиналось на 11-е–12-е сут в отличие от контрольных, у которых это наблюдалось только на 14-е–15-е сут. Следовательно, GlyGly, GlyAsp и Gly влияют на клеточную дифференцировку и вовлечены в формообразовательные процессы у растений. Наиболее активный каллусогенез наблюдался на средах с пептидом GlyGly. В контроле через 8 сут формировались участки рыхлого и плотного морфогенного каллуса, а также отдельные крупные морфогенные зоны, содержавшие множество мелких регенерантов (рис. 1a–г). В присутствии пептидов в среде увеличивалось общее число регенерантов на эксплант. Эффективность регенерации зависела от использованных пептидов и аминокислоты (табл. 3) На средах с Gly и GlyGly наблюдали образование крупных регенерантов с большой площадью листовых пластин по сравнению с среднестатистическими листовыми пластинками у контрольных регенерантов (рис. 1, табл. 3). Площадь листовой пластинки у крупных регенерантов увеличилась почти вдвое по сранению с контролем, а у регенерантов – в 1.3 раза. В присутствии GlyAsp не было отмечено образования крупных листьев, а размеры листовых пластин регенерантов даже уменьшились по сравнению с контролем почти на 30%. Таким образом, нейтральные Gly и GlyGly стимулируют образование крупных листьев у регенерантов табака в отличие от кислого дипептида GlyAsp.
Рис. 1.
28-суточная каллусная ткань табака Nicotiana tabacum L. а – контроль, б – глицин, в – глицилглицин, г – глициласпарагиновая кислота. Масштаб: 1 см.
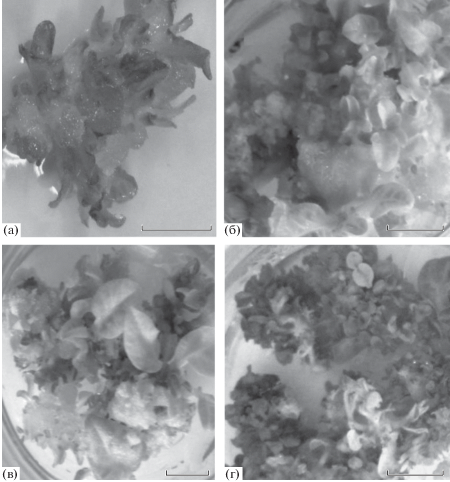
Таблица 3.
Влияние коротких пептидов и глицина на развитие биомассы каллуса и регенерационный потенциал табака
| Вариант | Сырая каллусная масса, г | Число регенерантов на эксплант, шт | Площадь листа крупных регенерантов, мм2 | Площадь листа регенерантов, мм2 |
|---|---|---|---|---|
| Контроль | 0.222 ± 0.03 | 7.8 ± 0.7 | 6.21 ± 1.0 | 3.21 ± 0.4 |
| Gly | 0.298 ± 0.02 | 8.5 ± 0.5 | 12.17 ± 1.4 | 4.17 ± 0.5 |
| GlyGly | 0.423 ± 0.04 | 9.0 ± 0.5 | 12.72 ± 2.1 | 4.06 ± 0.6 |
| GlyAsp | 0.413 ± 0.03 | 9.5 ± 0.5 | 0 | 2.52 ± 0.2 |
Пептиды и глицин воздействуют также на рост и развитие проростков табака. Наиболее выраженное стимулирующее действие оказывают GlyAsp и GlyGly, которые значительно ускоряют развитие проростков. В присутствии GlyAsp и GlyGly корневая система выглядит более развитой (рис. 2). При этом длина главного корня в присутствии пептидов увеличилась на ~40% по сравнению с контролем. Хотя длина главного корня под действием GlyAsp и GlyGly значительно увеличилась, общая высота проростка увеличилась ~15%. Надо отметить, что в присутствии дипептидов наблюдалось появление новых латеральных корней (рис. 2). На фоне снижения высоты побега площадь листовой пластинки у табака, выращенного в присутствии пептидов, по сравнению с контролем увеличилась в 1.5 раза. В присутствии пептидов происходит увеличение биомассы проростков табака на ~40% (рис. 3, табл. 4). Выраженная биологическая активность этих веществ при такой низкой концентрации их в среде (10–7 М) предположительно обусловлена тем, что они выполняют регуляторную сигнальную функцию в клетке.
Рис. 2.
28-суточные проростки табака Nicotiana tabacum L. а – контроль, б – глицин, в – глицилглицин, г – глициласпарагиновая кислота. Масштаб: 1 см.
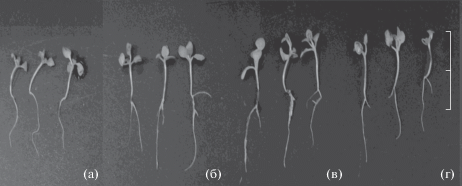
Рис. 3.
Сырая масса регенерантов и проростков Nicotiana tabacum L. при выращивании на средах без и в присутствии 10–7 М глицина и пептидов. а – контроль, б – глицин, в – глицилглицин, г – глициласпарагиновая кислота. 1 – проростки табака, 2 – регенеранты из каллусной ткани табака.
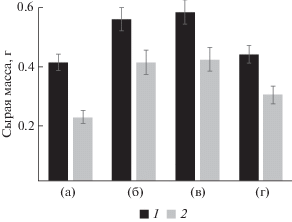
Таблица 4.
Влияние пептидов и глицина на биометрические показатели проростков табака
| Вариант | Сырая масса, г | Высота проростка, мм | Длина главного корня, мм | Длина наземной части, мм | Площадь листовой пластинки, мм 2 |
|---|---|---|---|---|---|
| Контроль | 0.412 ± 0.03 | 21.6 ± 1.2 | 12.4 ± 0.9 | 9.2 ± 0.6 | 8.91 ± 0.80 |
| Gly | 0.440 ± 0.03 | 23.7 ± 1.6 | 14.8 ± 1.1 | 8.9 ± 0.6 | 11.78 ± 0.94 |
| GlyGly | 0.587 ± 0.04 | 24.5 ± 1.6 | 17.9 ± 0.8 | 6.6 ± 0.5 | 13.69 ± 0.68 |
| GlyAsp | 0.561 ± 0.04 | 25.0 ± 1.5 | 17.8 ± 1.0 | 7.2 ± 0.5 | 13.20 ± 0.92 |
По сравнению с пептидами Gly обусловливал менее выраженный стимулирующий эффект (табл. 4): площадь листовой пластинки увеличилась в 1.3 раза по сравнению с контролем; высота проростка и длина главного корня увеличивались на 10–20 и на 10–30% соответственно (табл. 4, рис. 2б). Однако появление боковых корней указывает на то, что Gly, как и дипептиды, оказывает стимулирующее действие на развитие корневой системы табака.
Таким образом, стимулирующее действие исследованных пептидных препаратов и Gly сопровождается появлением дополнительных корней, листьев, образованием более развитой листовой пластинки по сравнению с контролем и в результате увеличением общей биомассы проростка (рис. 3, табл. 4).
Обнаружение физиологической активности у изученных пептидов (индукция формообразования, стимуляция роста каллусов, листьев, а также увеличение биомассы как у регенерантов из каллусов, так и у проростков табака) побудило нас изучить экспрессию некоторых генов семейств KNOX и GRF, кодирующих факторы транскрипции и отвечающих за клеточную дифференцировку и образование листьев.
Факторы регуляции роста (GRF) в растениях – специфические факторы транскрипции. Они играли ведущую роль в росте стебля, формировании листьев, цветков и семян, развитии корней и в координации процессов роста в неблагоприятной среде (Omidbakhsfar et al., 2015). Впервые ген GRF был идентифицирован у риса (OsGRF1) и играл регуляторную роль в элонгации стволовых клеток, индуцированной гиббереллином (GA) (Van der Knaap et al., 2000).
Недавно были открыты и охарактеризованы в N. tabacum гены семейства GRF (Zhang et al., 2018). У белков, кодируемх генами семейства GRF, различались молекулярные массы (24.4–65.4 кДа). Эти белки обладали различными физико-химическими свойствами, а их функции в настоящее время не определены. Предполагается, что гены семейства GRF участвуют в ответах на биотические и абиотические стрессоры (Zhang et al., 2018).
Почти у всех генов семейства GRF отмечен высокий уровень экспрессии во всех типах активно растущих тканей (например, прорастающие семена, каллус и цветочные почки). Для всех GRF характерен относительно более высокий уровень транскрипции в молодых листьях, чем в зрелых листьях. Это свидетельствует о том, что GRF в основном функционируют на ранних стадиях роста и развития листьев (Kim, Kende, 2004). Однако GRF3, например, характеризуется более высокой экспрессией в листьях и стеблях, а GRF4 – в корнях, т.е. эти гены могут быть связаны с регуляцией роста и развития этих органов.
Гены GRF1, GRF2 и GRF3 из Arabidopsis thaliana действуют как регуляторы клеточной пролиферации во время развития листьев (Kim, Lee, 2006). Высокий уровень экспрессии GRF4 коррелирует с увеличением общей биомассы и размером семян и приводит к увеличению общей массы и размера семян (Van Daele et al., 2012). GRF4 в A. thaliana участвует не только в пролиферации клеток в листьях, но и в эмбриональном развитии семядолей и меристемы (Kim, Lee, 2006).
Для табака у четырех генов факторов регуляции роста (GRF) были определены кодируемые ими белки (табл. 1). Этот факт определил выбор генов, экспрессию которых важно изучить под действием пептидов. Все белки, кодируемые исследуемыми нами генами, связываются с ДНК (табл. 1). Это ДНК-апуриновая/апиримидиновая лигаза (GRF1), ДНК-топоизомераза 3α (GRF2), 3',5'-экзонуклеаза (GRF3) и эндонуклеаза 8 (GRF4).
Данные об экспрессии генов GRF у регенерантов и у проростков табака, выращенных как в присутствии коротких пептидов, так и без них, представлены на рис. 4. Уровень экспрессии генов семейства GRF в проростках значительно ниже, чем в образующихся регенерантах из каллусной ткани. Как отмечено выше, все известные гены семейства GRF более активны и имеют более высокий уровень экспрессии в молодых развивающихся растениях, особенно в листьях. Вероятно, этот факт можно объяснить тем, что листья 4-недельных проростков были более развиты, чем листья 4-недельных регенерантов из каллуса.
Рис. 4.
Экспрессия генов GRF. а – контроль, б – глицин, в – глицилглицин, г – глициласпарагиновая кислота. 1 – регенеранты из каллусной ткани табака, 2 – проростки табака; для рис. 4 и 5.
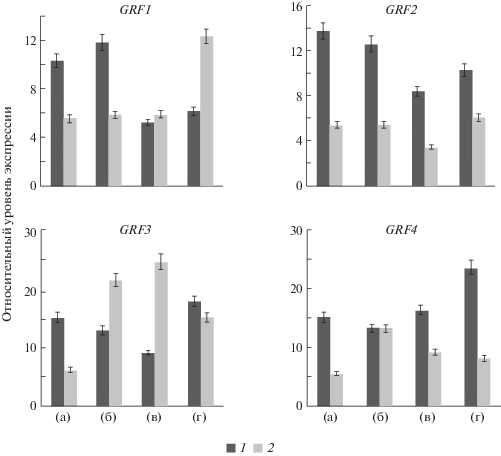
Пептиды и Gly подавляют экспрессию генов GRF2 и GRF1 в регенерантах из каллусной ткани табака, но увеличивают экспрессию генов GRF3 и GRF4 (рис. 4). GlyGly и особенно GlyAsp увеличивают экспрессию гена GRF4 почти в 4 раза по сравнению с контролем.
Действие пептидов на экспрессию генов семейства GRF в проростках табака отличается от действия пептидов в регенерантах. Так, пептиды и Gly значительно увеличивают экспрессию генов GRF3 и GRF4 в проростках табака, а экспрессия гена GRF2 практически не изменяется в присутствии этих препаратов. Экспрессия гена GRF1 в присутствии GlyGly и Gly также не меняется, однако в присутствии GlyAsp она увеличивается почти в 2 раза. Известно, что максимальный уровень экспрессии гена GRF4 наблюдается в корнях (Kim, Kende, 2004; Kim, Lee, 2006). В 4-недельных регенерантах формирование корней только начинается, а у 4-недельных проростков табака корни уже хорошо сформированы. Вероятно, этим можно объяснить и то, что активность гена GRF4 в регенерантах выше, чем в проростках, и дипептиды ее еще больше активируют.
Таким образом, GlyGly, GlyAsp и Gly влияют на экспрессию генов, кодирующих белки факторов регуляции роста. Не исключено, что пептиды могут связываться с белками, кодируемыми генами семейства GRF, и непосредственно участвовать в регуляции роста. Известно, что Gly и, вероятно, GlyGly предпочтительно связываются с остатками цистеина подобно связыванию глицина с цистеиновой петлей, расположенной на конце глицинового рецептора у животных (Lynch et al., 2017), а отрицательно заряженный пептид GlyAsp предпочтительно связывается с положительно заряженными остатками лизина или аргинина. Мы наблюдали разное воздействие на развитие табака нейтральных Gly и GlyGly и отрицательно заряженного GlyAsp. Если нейтральные Gly и GlyGly в наибольшей степени увеличивают биомассу регенерантов из каллусной ткани табака, то GlyAsp преимущественно усиливает рост проростков табака.
Было обнаружено, что белки, кодируемые генами GRF из ячменя Hordeum vulgare могут действовать как репрессоры, связываясь с интронной последовательностью гена Knotted3, а AtGRF4, AtGRF5 и AtGRF6 из A. thaliana репрессируют промоторную активность гена Knotted2 (KNAT2) (Kuijt et al., 2014). Эти данные демонстрируют, что транскрипционные факторы семейств GRF Knotted (KNOX) взаимодействуют между собой и, связываясь с той или иной последовательностью генов семейства KNOX, регулируют их активность.
Белки класса KNOTTED1–like homedomain (KNOX) – критическиме регуляторы гомеостаза стволовых клеток в проростках растений. Генами KNOX кодируются факторы транскрипции, которые участвуют в остановке клеточной дифференцировки в апикальной зоне проростка, они идентифицированы у всех одно- и двудольных растений (Lynch, 2004). Эктопическая экспрессия KNOX-генов у различных растений вызывает драматические изменения в морфологии листьев и цветков (Srinivasan et al., 2011).
Семейство генов KNOX делится на классы KNOX1 и KNOX2. Геном Arabidopsis содержит четыре гена класса KNOX1: SHOOT MERISTEMLESS (STM), BREVIPEDICELLUS (BP или KNAT1), KNAT2 и KNAT6. Эти гены участвуют в различных процессах развития растения и на разных стадиях их развития. Так, ген STM экспрессируется на стадии раннего эмбриогенеза, и его экспрессия обнаруживается во всех зонах меристемы (Zhang, Rongming, 2014), ген KNAT6 экспрессируется на стадии эмбрионального развития, и его максимальный уровень экспрессии обнаруживается по всей границе меристемы (Long et al., 1996). ВР имеет максимальный уровень экспрессии в постэмбриональный период в меристеме (Belles-Boix et al., 2006). Увеличение экспрессии гена KNAT2 происходит в период эмбриогенеза, в основном в центре меристемы (Byrne et al., 2002). Увеличение экспрессии гена STM приводит к более раннему формированию листьев в каллусных культурах. Модуляция активности KNOX1 вызывает разнообразие форм листьев цветковых растений. Функциональное различие между генами KNOX1 и KNOX2 основано на том, что экспрессия гена KNOX1 ограничена менее дифференцированными тканями, тогда как гены KNOX2 экспрессируются как в дифференцирующихся тканях, так и в сформировавшихся органах (цветках и соцветиях) (Dockx et al., 1995). Имеются доказательства взаимного подавления экспрессии генов KNOX1 и KNOX2 (Hay, Tsiantis, 2010). Ген KNAT3 у Arabidopsis кодирует β-глюкоуронидазу (GUS) и относится к классу KNOX2 (Serikawa, et al., 1997). Ген KNAT3 активен только в тканях сформировавшегося корня (Truernit, Haseloff, 2007).
Впервые гены LЕT6 и LЕT12 были охарактеризованы у томата Solanum lycopersicum (Janssen et al., 1998). Ген LЕT6 был отнесен к классу KNOX1, а ген LЕT12 – к классу KNOX2. Полагают, что ген LET6 подобен гену STM из Arabidopsis, а его экспрессию связывают с формированием латеральных органов. Выявлено, что ген LET12 экспрессируется во всех тканях развившегося растения.
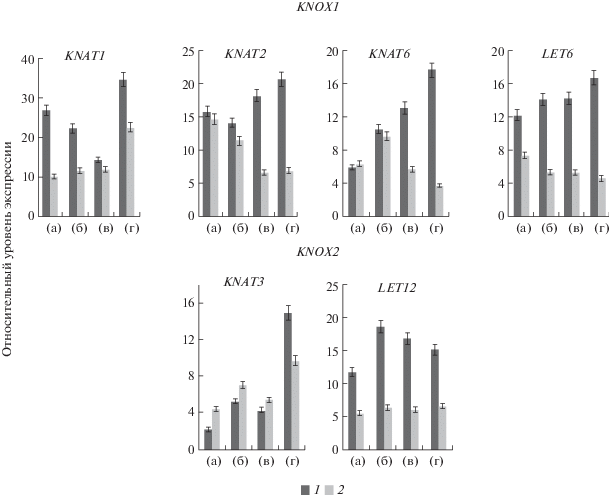
GlyGly, GlyAsp и Gly влияют на экспрессию генов семейства KNOX в регенерантах и проростках табака (рис. 5). Гены семейства KNOX, отвечающие за дифференцировку листьев и относящиеся к семейству KNOX1, в регенерантах проявляют более высокий уровень экспрессии, чем в проростках. Это свидетельствует о процессах, связанных с формированием листьев, которые происходят у образующихся регенерантов.
Уровень экспрессии генов KNAT2 и LET6 у регенерантов из каллусной ткани табака под влиянием пептидов изменяется незначительно. Присутствие дипептидов и глицина в среде для культивирования проростков приводило даже к уменьшению уровня экспрессии этих генов. В проростках табака GlyGly и GlyAsp ингибируют экспрессию гена KNAT2 в 2–3 раза, а экспрессия гена LET6 подавляется в присутствии всех используемых препаратов. Как известно, высокий уровень экспрессии генов KNOX1 вызывает более раннюю дифференцировку листьев у A. thaliana (Srinivasan et al., 2011).
В присутствии пептидов и глицина формирование листьев у регенерантов из каллусной ткани табака начинается на 4–6 сут раньше, чем у контрольных вариантов (данные не приведены). Можно предположить, что дипептиды могли инициировать более раннюю экспрессию этих генов в проростках табака и к четырем неделям развития проростка экспрессия этих генов уменьшалась. В присутствии Gly и особенно GlyGly значительно уменьшалась экспрессия гена KNAT1 у регенерантов из каллусной ткани. Напротив, GlyAsp значительно усиливает экспрессию гена KNAT1 у регенерантов. Действие этих препаратов на экспрессию гена KNAT1 у проростков табака имеет противоположный характер: GlyGly и Gly немного (на ~10%) увеличивают экспрессию, а GlyAsp уменьшает ее почти в 2 раза.
По сравнению с регенерантами уровень экспрессии гена KNAT3 в проростках был выше более чем в 2 раза. Эти данные согласуются с результатами, свидетельствующими о том, что экспрессия гена KNAT3, который относится к классу KNOX2, имеет более высокий уровень в развивающихся корнях (Serikawa et al., 1997). Уровень экспрессии генов KNAT3 в регенерантах существенно зависит от присутствия пептидов и глицина в среде, а под их влиянием он может увеличиваться в 3–5 раз и более по сравнению с контролем. Такое возрастание уровня экспрессии гена KNAT3, вероятно, может способствовать более раннему развитию корневой системы у регенерантов. Действительно, под действием Gly и GlyGly, а также GlyAsp в каллусах наблюдалось более раннее образование корней по сравнению с контролем.
Экспрессия гена KNAT3 как в регенерантах из каллусной ткани, так и в проростках увеличивается под действием GlyAsp. Под влиянием GlyAsp в проростках табака экспрессия гена KNAT6 уменьшается. Дипептиды и Gly практически не влияют на уровень экспрессии гена LET12 в проростках табака, однако в регенерантах экспрессия данного гена повышалась в 1.5–2 раза по сравнению с контролем.
Таким образом, гены семейства KNOX активно участвуют в развитии регенерантов из каллусной ткани и росте проростков табака, в формировании листьев и корней. GlyGly, GlyAsp и Gly влияют на формирование листьев у регенерантов из каллусной ткани табака (рис. 1), что сопровождается модуляцией уровня экспрессии генов семейства KNOX1 (рис. 5). В проростках табака, у которых площадь листовой пластины больше, чем у регенерантов, GlyGly, GlyAsp и Gly даже ингибировали экспрессию генов семейства KNOX1. Однако уровень экспрессии гена KNAT3, относящегося к классу KNOX2, у них увеличивался в присутствии дипептидов и глицина в 3–5 раз, особенно в присутствии GlyAsp. Вероятно, экспрессия этого гена инициировалась на более поздних стадиях развития проростков. Активность этого гена, возможно, связана с образованием латеральных корней у проростков, что мы и наблюдали (рис. 1, табл. 4).
В настоящее время молекулярные механизмы отмеченной регуляции экспрессии генов под воздействием GlyGly, GlyAsp и Gly еще неизвестны. Эти вещества, например, могут связываться с сигнальными белками и через них воздействовать на экспрессию генов. Возможно, что подобно другим коротким биологически активным пептидам (Хавинсон и др., 2011) GlyGly, GlyAsp и Gly могут напрямую связываться с промоторной областью генов и эпигенетически контролировать экспрессию генов путем блокирования метилирования промоторов. По-видимому, регуляция экспрессии генов короткими пептидами имеет эпигенетическую природу. Не исключено также, что пептиды могут взаимодействовать с N-и С-концевыми последовательностями гистонов в хроматине, блокируя их ферментативную модификацию. Пептиды могут также взаимодействовать с короткими интерферирующими РНК (siRNA), тем самым препятствуя связыванию РНК с генами.
Из полученных нами результатов следует, что дипептиды и Gly оказывают заметное влияние на рост и развитие регенерантов и проростков табака, причем характер их действия в регенерантах и проростках неодинаков. Эффективность регуляции экспрессии генов семейств GRF и KNOX у регенерантов и у проростков использованными нами агентами различна. Таким образом, аналогично другим коротким экзогенным пептидам (Федореева и др., 2017) дипептиды GlyGly, GlyAsp и аминокислота Gly обладают выраженной физиологической активностью и могут быть отнесены к эффективным регуляторам роста и развития растений.
Авторы благодарят Я.И. Алексеева и А.В. Кузубова за синтез праймеров.
Работа выполнена по госзаданию АААА-А17-117091460012-8 и при частичной финансовой поддержке Российского научного фонда (№ 14 50 00029) и РФФИ (грант 18-016-00150).
Список литературы
Ванюшин Б.Ф., Ашапкин В.В., Александрушкина Н.И. Регуляторные пептиды у растений // Биохимия. 2017. Т. 82. С. 189–195.
Федореева Л.И., Диловарова Т.А., Ашапкин В.В., Мартиросян Ю.Ц., Хавинсон В.Х., Федореева Л.И., Ванюшин Б.Ф. Короткие пептиды модулируют действие эукариотических эндонуклеаз из проростков пшеницы // Докл. РАН. 2011. Т. 437. С. 124–127.
Хавинсон В.Х., Харченко П.Н., Ванюшин Б.Ф. Короткие экзогенные пептиды регулируют экспрессию генов семейств CLE, KNOX1 и GRF у Nicotiana tabacum // Биохимия. 2017. Т. 82. С. 700–709. v. Pharmacol. 2017. V. 79. P. 225–253.
Belles-Boix E., Hamant O., Witiak S. M., Morin H., Traas J., Pautot V. KNAT6: an Arabidopsis homeobox gene involved in meristem activity and organ separation // Plant Cell. 2006. V. 18. P. 1900–1907.
Byrne M.E., Simorowski J., Martienssen R.A. Asymmetric leaves reveals knox gene redundancy in Arabidopsis // Development. 2002. V. 129. P. 1957–1965.
Czyzewicz N., Yue K., Beeckman T., De Smet I. Message in a bottle: small signalling peptide outputs during growth and development // J. Exp. Bot. 2013. V. 64. P. 5281–5296.
Dockx J., Quaedvlieg N., Keultjes G., Kock P., Weisbeek P., Smeekens S. The homeobox gene ATK1 of Arabidopsis thaliana is expressed in the shoot apex of the seedling and in flowers and inflorescence stems of mature plants // Plant Mol. Biol. 1995. V. 28. P. 723–737.
Goyal R.K., Mattoo A.K. Multitasking antimicrobial peptides in plant development and host defense against biotic/abiotic stress // Plant Sci. 2014. V. 228. P. 135–149.
Hanada K., Higuchi-Takeuchi M., Okamoto M., Yoshizumi T., Shimizu M., Nakaminami K., Nishi R., Ohashi C., Iida K., Tanaka M., Horii Y., Kawashima M., Matsui K., Toyoda T., Shinozaki K., Seki M., Matsui M. Small open reading frames associated with morphogenesis are hidden in plant genomes // Proc. Natl Acad. Sci. USA. 2013. V. 110. P. 2395–2400.
Hay A., Tsiantis M. KNOX genes: versatile regulators of plant development and diversity // Development. 2010. V. 137. P. 3153–3165.
Janssen B.J., Williams A., Chen J.J., Mathern J., Hake S., Sinha N. Isolation and characterization of two knotted-like homeobox genes from tomato // Plant Mol. Biol. 1998. V. 36. P. 417–425.
Khavinson V.Kh., Malinin V.V. Gerontological aspects of genome peptide regulation // Karger AG, Basel (Switzerland). 2005. C. 104.
Khavinson V.Kh., Tendler S.M., Kasyanenko N.A., Tarnovskaya S.I., Linkova N.S., Ashapkin V.V., Yakutseni P.P., Vanyushin B.F. Tetrapeptide KEDW interacts with DNA and regulates gene expression// Am. J. Biomed. Sci. 2015. V. 7. P. 156–169.
Khavinson V.Kh., Tendler S.M., Vanyushin B.F., Kasyanenko N.A., Kvetnoy I.M., Linkova N.S., Ashapkin V.V., Polyakova V.O., Basharina V.S., Bernadotte A. Peptide regulation of gene expression and protein synthesis in bronchial epithelium // Lung. 2014. V. 192. P. 781–791.
Kim J., Lee B. Growth-regulating factor4 of Arabidopsis thaliana is required for development of leaves, cotyledons, and shoot apical meristem // J. Plant Biol. 2006. V. 49. P. 463–468.
Kim J.H., Kende H. A transcriptional coactivator, AtGRF1, is involved in regulating leaf growth and morphology in Arabidopsis // Proc. Natl Acad. Sci. USA. 2004. V. 101. P. 13374–13379.
Kuijt S.J.H., Greco R., Agalou A., Shao J., Hoen C.C., Overnäs E., Osnato M., Curiale S., Meynard D., van Gulik R., de Faria Maraschin S., Atallah M., de Kam R.J., Lamers G.E., Guiderdoni E., Rossini L., Meijer A.H., Ouwerkerk P.B. Interaction between the growth-regulating factor and knotted1-like homebox families of transcription factors // Plant Physiol. 2014. V. 164. P. 1952–1966.
Long J.A., Moan E.I., Medford J.I., Barton M.K. A member of the KNOTTED class of homeodomain proteins encoded by the SHOOTMERISTEMLESS gene of Arabidopsis // Nature. 1996. V. 379. P. 66–69.
Lynch J.W. Molecular structure and function of the glycine receptor chloride channel // Physiol. Rev. 2004. V. 84. P. 1051–1095.
Lynch J.W., Zhang Y., Talwar S., Estrada-Mondeagon A. Glycine receptor drug discovery // Adv. Pharmacol. 2017. V. 79. P. 225–253.
Motomitsu A., Sawa S., Ishida T. Plant peptide hormone signaling // Ess. Biochem. 2015. V. 58. P. 115–131.
Omidbakhsfar M.A., Proost S., Fujikura U., Mueller-Roeber B. Growth-regulating factors (GRFs): A small transcription factor family with important functions in Plant Biol. // Mol. Plant. 2015. V. 8. P. 998–1010.
Serikawa K.A., Martinez-Laborda A., Kim H.S., Zambryski P.C. Localization of expression of KNAT3, a class 2 knotted1-like gene // Plant J. 1997. V. 11. P. 853–861.
Srinivasan C., Liu Z., Scorza R. Ectopic expression of class 1KNOX genes induce adventitious shoot regeneration and alter growth and development of tobacco (Nicotiana tabacum L.) and European plum (Prunusdomestica L.) // Plant Cell Rep. 2011. V. 30. P. 655–664.
Tavormina P., De Coninck B., Nikonorova N., De Smet I., Cammue B. The plant peptidome: an expanding repertoire of structural features and biological functions // Plant Cell. 2015. V. 27. P. 2095–2118.
Truernit E., Haseloff J. A role for KNAT class II genes in root development //Plant Signal Behav. 2007. V. 2. P. 10–12.
Van Daele N., Gonzalez I., Vercauteren L., de Smet D., Inze I., Roldan-Ruiz M. Vuylsteke. A comparative study of seed yield parameters in Arabidopsis thaliana mutants and transgenics // Plant Biotechnol. J. 2012. V. 10. P. 488–500.
Van der Knaap E., Kim J.H., Kende H. A novel gibberellin-induced gene from rice and its potential regulatory role in stem growth // Plant Physiol. 2000. V. 122. P. 695–704.
Zhang W., Rongming Yu. Molecular mechanism of stem cells in Arabidopsis thaliana // Pharmacogn. Rev. 2014. V. 8. P. 105–112.
Zhang J., Li Z., Jin J., Xie X., Zhang H., Chen Q., Luo Z., Yang J. Genome-wide identification and analysis of the growth-regulating factor family in tobacco (Nicotiana tabacum) // Gene. 2018. V. 639. P. 117–127.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая