Известия РАН. Серия биологическая, 2020, № 4, стр. 385-392
Влияние салициловой и оксибензойной кислот на in vitro культуры чайного растения и накопление в них фенольных соединений
Т. Л. Нечаева 1, *, Т. Н. Николаева 1, Н. В. Загоскина 1
1 Институт физиологии растений им. К.А.Тимирязева РАН
127276 Москва, ул. Ботаническая, 35, Россия
* E-mail: NechaevaTatyana.07@yandex.ru
Поступила в редакцию 20.11.2019
После доработки 17.12.2019
Принята к публикации 17.12.2019
Аннотация
Исследовано кратковременное воздействие салициловой и п-оксибензойной кислот на in vitro культуры чайного растения Camellia sinensis (L.) Kuntze. Установлено отсутствие их влияния на морфофизиологические характеристики каллусных культур, тогда как содержание малонового диальдегида и фенольных соединений, включая их мономерные (фенилпропаноиды, флаваны) и олигомерные (проантоцианидины) формы, уменьшалось, а количество лигнина (полимер фенольной природы) повышалось. Активность L-фенилаланинаммиаклиазы (основной фермент фенольного метаболизма) в опытных вариантах сохранялась на уровне контроля или снижалась (после воздействия п‑оксибензойной и салициловой кислот соответственно).
Одна из характерных особенностей высших растений – способность к накоплению различных вторичных метаболитов (Носов, 2005). К их числу относятся фенольные соединения или полифенолы, образование которых характерно для всех клеток (Запрометов, 1993). Структура этих веществ чрезвычайно разнообразна, число известных представителей >10 000 и продолжает увеличиваться. Фенольные соединения представлены мономерными (фенолкарбоновые кислоты, флавоноиды), олигомерными (проантоцианидины) и полимерными (лигнин) веществами. Их функциональная роль разнообразна и связана с процессами роста и развития растений, фотосинтеза, дыхания, пигментации (Запрометов, 1993; Ramawat, Mérillon, 2013). Отмечено участие фенольных соединений в повышении адаптивных свойств растений и устойчивости к стрессовым воздействиям (Naikoo et al., 2013). Эти вторичные метаболиты растительного происхождения проявляют антиоксидантные, антимикробные, антиканцерогенные, кардиопротекторные свойства, что представляет большой интерес для фармакологии (Тюкавкина, 2002; Belscak-Cvitanovi et al., 2018).
К “уникальным” представителям фенольных соединений относится салициловая кислота (СК), для которой характерно орто-положение гидроксильной группы в бензольном кольце (рис. 1а). Ее рассматривают как полифункциональную сигнально-регуляторную молекулу и как фитогормон (Тарчевский, 2002). Установлено, что СК – естественный индуктор термогенеза и цветения растений (Запрометов, 1993). Это соединение регулирует транспорт веществ по флоэме, влияет на гормональный баланс, функциональную активность митохондрий, а также индуцирует устойчивость растений к стрессовым воздействиям (Hayat et al., 2013; Шугаев и др., 2016; Klessig et al., 2018). При экзогенном воздействии СК устранялось негативное влияние низкой температуры на проростки, снижалось токсическое действие кадмия и засоления (Gharib, Hegazi, 2010; Liu et al., 2016; Simek et al., 2016).
Рис. 1.
Структурные формулы салициловой (орто-оксибензойной) и n-оксибензойной (пара-оксибензойной) кислот (а и б соответственно).
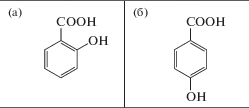
К структурным аналогам СК относится п‑оксибензойная кислота (ОК), для которой характерно пара-положение гидроксильной группы в бензольном кольце (рис. 1б). Об ее функциональной активности известно крайне мало. Сообщалось, что ОК – это предшественник образования убихинона (коэнзима Q) – компонента дыхательной цепи митохондрий (Pierrel, 2017). Отмечалось ее участие в биосинтезе шиконина – антиканцерогенного соединения, продуцируемого корнями некоторых растений семейства Boraginaceae (Singh et al., 2010). При экзогенном воздействии ОК повышалась устойчивость растений к стрессовым воздействиям: у проростков огурца – к высоким температурам (Zhang et al., 2012), у растений пшеницы – к низким температурам (Horvath et al., 2007), у растений риса – к засухе (Quan, Xuan, 2018).
Все это свидетельствует о функциональной роли СК и ОК в защите растений. Благодаря этой способности они могут использоваться в качестве веществ-адаптогенов широкого спектра действия (Колупаев, Ястреб, 2013). Однако результатов сравнения влияния СК и ОК на антиоксидантную систему растений, в том числе накопление различных веществ фенольной природы, крайне мало.
Один из способов изучения метаболизма растительных клеток и тканей и его регуляции – использование культур in vitro, сохраняющих многие свойства интактных растений и выращиваемых в строго контролируемых условиях (Nosov, 2012; Dias et al., 2016). Это относится и к каллусным культурам чайного растения, для которых характерен специализированный обмен, направленный на биосинтез различных фенольных соединений, в том числе флаванов – веществ с Р-витаминной капилляроукрепляющей активностью (Загоскина и др., 2000; Hong et al., 2014). Выполненные на культурах чая исследования определили важную роль этих представителей вторичного метаболизма в процессах адаптации к различным стрессовым воздействиям (Загоскина и др., 2007).
Цель работы – изучение экзогенного действия СК и ОК в различных концентрациях на морфофизиологические характеристики каллусных культур чайного растения, содержание в них малонового диальдегида и накопление различных классов фенольных соединений.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования – каллусные культуры стебля чайного растения Camellia sinensis. Их выращивали в факторостатной камере ИФР РАН в темноте при 25°С и относительной влажности воздуха 70% на питательной среде Хеллера, содержащей 2,4-дихлорфеноксиуксусную кислоту (5 мг/л), глюкозу (25 г/л), агар (7 г/л) (Загоскина и др., 2016). Длительность пассажа составляла 45 сут.
При проведении опытов 20-суточные каллусы чая помещали на 2 ч в стерильные водные растворы СК и ОК (0.1, 1, 10 и 100 мкМ) или в воду (контроль). После экспозиции их переносили на основную агаризованную питательную среду и выращивали в течение 12 сут в стандартных условиях. Материал для биохимических исследований фиксировали жидким азотом и хранили при –70°С.
Прирост каллусной ткани определяли стандартным методом с учетом массы каллусов в начале и конце эксперимента и выражали в процентах (Носов, 2011). Оводненность культур после их высушивания при 70°С до постоянной массы рассчитывали по стандартной формуле (Загоскина и др., 2016).
Фенольные соединения извлекали 96%-ным этанолом из замороженной жидким азотом и измельченной каллусной ткани при 45°С в течение 45 мин. Гомогенат центрифугировали (13 000 об./мин, 10 мин), надосадочную жидкость отделяли и использовали для спектрофотометрического определения различных классов полифенолов. Суммарное содержание растворимых фенольных соединений определяли с помощью реактива Фолина–Дениса (725 нм), содержание флаванов – с помощью 1%-ного ванилинового реактива (500 нм) (Загоскина и др., 2016). Содержание фенилпропаноидов определяли методом прямого спектрофотометрирования надосадочной жидкости (330 нм) (Цыпурская и др., 2019). Содержание проантоцианидинов определяли с бутанольным реактивом при 550 нм (Запрометов, 1974). Содержание суммы растворимых фенольных соединений и флаванов выражали в мг-экв. эпикатехина/г сухой масссы, содержание фенилпропаноидов – в мг-экв. кофейной кислоты/г сухой массы, содержание проантоцианидинов – в ед./г сухой массы.
Для определения лигнина каллусную ткань последовательно экстрагировали смесью этанол–бензол (1 : 2) (20 ч) и горячей водой (95°С, 4 ч). Осадок трехкратно промывали этанолом и эфиром. Полученный таким образом свободный от экстрактивных веществ остаток гидролизовали 0.5 N NaOH в течение 36 ч при 80°С. Охлажденный гидролизат центрифугировали (13 000 об./мин, 10 мин), и в надосадочной жидкости спектрофотометрическим методом определяли содержание лигнина по реакции с 2,6-дихлорхинонхлоримидом (610 нм) (Загоскина и др., 2007). Содержание лигнина выражали в мг-экв. феруловой кислоты/г свободного от экстрактивных веществ сухого остатка.
Для определения активности L-фенилаланинаммиаклиазы (ФАЛ) каллусную ткань гомогенизировали в 0.1 М Na-боратном буфере (рН 8.8), содержащем 0.5 мМ этилендиаминтетрауксусной кислоты и 3 мМ дитиотреитола, с добавлением нерастворимого поливинилпирролидона (50% массы сырой ткани) (Олениченко, Загоскина, 2005). Гомогенат фильтровали, центрифугировали (15 000 об./мин, 20 мин), надосадочную фракцию использовали для определения активности фермента. Все операции проводили при 4°C. Активность ФАЛ определяли по образованию из L-фенилаланина продукта реакции − транс-коричной кислоты в смеси, содержавшей 0.1 М Na-боратный буфер (рН 8.8), 0.01 М L-фенилаланин и ферментный препарат (70 мкг белка/мл) в общем объеме 2 мл. После ее инкубирования в течение 60 мин при 37°С в термостате реакцию останавливали добавлением 0.5 мл 1 N трихлоруксусной кислоты (ТХУ) и определяли оптическую плотность раствора при 290 нм на спектрофотометре. Активность ФАЛ выражали в мкг транс-коричной кислоты/мг белка. Количество белка в пробах определяли методом Брэдфорд (Bradford, 1976).
Уровень перекисного окисления липидов (ПОЛ) в культуре ткани определяли по содержанию малонового диальдегида (МДА) с помощью качественной реакции с тиобарбитуровой кислотой (ТБК). Для этого растительный материал гомогенизировали в 0.1 М трис-HCl-буфере (рН 7.5), содержавшем 0.35 М NaCl, и добавляли 0.5%-ный раствор ТБК в 20%-ном водном растворе ТХУ. Реакционную смесь инкубировали на кипящей водяной бане в течение 30 мин, охлаждали, после чего отделяли осадок и измеряли оптическую плотность надосадочной жидкости при 532 нм. Для расчета содержания МДА (мкмоль/г сухой массы) использовали коэффициент экстинкции, равный 156 мМ–1 ∙ см–1 (Радюкина и др., 2011).
При проведении исследований использовали микроцентрифугу MiniSpin (Eppendorf, Германия), центрифугу с охлаждением К-24 (Janetzky, Германия), спектрофотометр СФ-46 (ЛОМО, Россия), термостаты “Гном” (ДНК-технологии, Россия) и BD-115 (Binder, Германия), водяную баню-термостат с перемешиванием WB-4MS (BioSan, Латвия).
Все определения проводили в трех биологических и трех аналитических повторностях. Статистическую обработку полученных данных осуществляли с помощью программ Microsoft Excel 2010 и SigmaPlot 12.2. В табл. 1 и на рисунках представлены средние арифметические значения определений и их стандартные ошибки (±SEM). Достоверность различий средних значений определяли по t-критерию Стьюдента при P ≤ 0.05 и обозначали ее разными латинскими буквами.
Таблица 1.
Ростовые параметры каллусных культур чайного растения через 12 сут после 2 ч воздействия на них разных концентраций салициловой (СК) и п-оксибензойной (ОК) кислот или воды (контроль)
| Концентрация вещества, мкМ | Прирост культуры, % | Оводенность, % | ||
|---|---|---|---|---|
| СК | ОК | СК | ОК | |
| 0 (контроль) | 118.3 ± 6.6a | 118.3 ± 6.6a | 93.11 ± 0.44а | 93.11 ± 0.44а |
| 0.1 | 117.1 ± 8.5а | 117.4 ± 6.5a | 93.13 ± 0.6а | 92.79 ± 0.37a |
| 1 | 117.3 ± 8.5а | 119.0 ± 7.8a | 94.13 ± 0.8b | 93.25 ± 0.78a |
| 10 | 124.0 ± 10.8b | 115.5 ± 8.4a | 94.01 ± 0.5b | 93.57 ± 0.64a |
| 100 | 125.2 ± 6.8b | 118.1 ± 9.7a | 94.68 ± 0.78b | 93.6 ± 0.72a |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфофизиологические характеристики каллусных культур. Каллусные культуры чайного растения представляли собой плотные каллусы светло-желтого цвета. После кратковременного воздействия на них СК и ОК (в различных концентрациях) изменений в их морфофизиологических характеристиках не отмечалось. Прирост культур в большинстве случаев был аналогичен приросту контроля (табл. 1). Можно отметить лишь незначительное и статистически достоверное его повышение после воздействия СК (10 и 100 мкМ).
Оводненность культур in vitro – важный показатель при оценке их физиологического состояния (Носов, 2011). Во всех вариантах содержание воды в каллусах чая было практически равным и в среднем составляло 93.53% (табл. 1). Это несколько ниже содержания воды в каллусах, инициированных из других видов растений, например из льна или подорожника, у которых оводненность составляла соответственно 97 и 96.21% (Golkar et al., 2017; Гончарук и др., 2018).
Исходя из вышеизложенного можно заключить, что СК и ОК не влияли на рост и морфологические характеристики каллусных культур чая. Аналогичная тенденция отмечалась и для суспензионных культур Thevetia peruviana и Orostachys cartilaginous при воздействии СК (Mendoza et al., 2018; Wen, 2019).
Уровень перекисного окисления липидов. Изменения уровня ПОЛ, оцениваемые по количеству МДА, часто рассматривают как показатель наличия или отсутствия стрессовой реакции в растениях на воздействие различных экзогенных факторов (Полесская, 2007).
В каллусных культурах чая, подвергнутых воздействию СК и ОК (0.1 мкМ), содержание МДА было равно таковому в контрольном варианте (рис. 2). При более высоких концентрациях (1−100 мкМ) оно снижалось: для СК и ОК в среднем на 9 и 35% соответственно по сравнению с контролем. Эти изменения не зависели от концентрации действующего вещества.
Рис. 2.
Содержание малонового диальдегида в каллусных культурах чайного растения через 12 сут после 2 ч воздействия на них разных концентраций салициловой (СК) и п-оксибензойной кислот (ОК) или воды (контроль). Достоверные различия средних значений при P ≤ 0.05 отмечены разными латинскими буквами над барами.
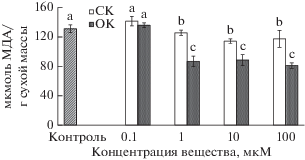
Таким образом, уровень ПОЛ в каллусных культурах чая в большинстве случаев снижался после кратковременного воздействия этих представителей оксибензойных кислот, особенно ОК. Другие авторы также отмечали уменьшение интенсивности окислительных процессов при обработке растений СК (Li et al., 2019). Имеются единичные сведения об одинаковом влиянии СК и ОК на антиоксидантную систему некоторых растений (Колупаев, Ястреб, 2013).
Содержание фенольных соединений. Соединения фенольной природы относятся к низкомолекулярным компонентам антиоксидантной системы растительных клеток (Прадедова и др., 2011). Показатель способности к их образованию – суммарное содержание фенольных соединений (Запрометов, 1974). Как следует их представленных на рис. 3а данных, оно сохранялось на уровне контроля только после кратковременного воздействия на каллусы 0.1 мкМ СК. В остальных вариантах содержание суммы фенольных соединений было ниже контрольных значений. Наибольшие изменения были отмечены при воздействии на культуры 10 мкМ ОК и 100 мкМ СК (соответственно в 2.4 и 2 раза меньше, чем в контроле). При других концентрациях СК и ОК количество фенольных соединений также было ниже, чем в контроле, но только на 25 и 33% соответственно.
Рис. 3.
Суммарное содержание фенольных соединений (а), фенилпропаноидов (б), флаванов (в), проантоцианидинов (г) и лигнина (д) в каллусных культурах чайного растения через 12 сут после 2 ч воздействия на них разных концентраций салициловой (СК) и п-оксибензойной кислот (ОК) или воды (контроль). Содержание суммы фенольных соединений и флаванов выражали в мг-экв. эпикатехина, фенилпропаноидов – в мг-экв. кофейной кислоты, проантоцианидинов – в ед., лигнина – в мг-экв. феруловой кислоты/г свободного от экстрактивных веществ сухого остатка. Достоверные различия средних значений при P ≤ 0.05 отмечены разными латинскими буквами над барами.
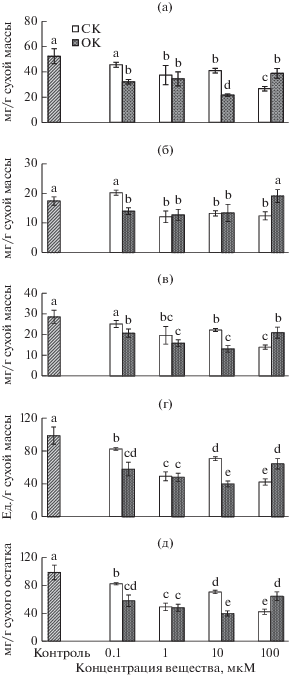
В большинстве исследований отмечалось положительное влияние СК на накопление фенольных соединений в растениях, степень которого зависела от их видовой принадлежности, концентрации вещества и длительности воздействия (Zhang et al., 2015; Wen et al., 2019). Сведения о действии ОК на образование этих метаболитов единичны и крайне неоднозначны (Quan, Xuan, 2018). Исходя из наших данных, можно заключить, что после кратковременного воздействия СК и особенно ОК суммарное содержание фенольных соединений в каллусных культурах чайного растения преимущественно уменьшалось, что предполагает изменения в их метаболизме. Ранее сообщалось, что повышенные концентрации соединений фенольной природы подавляют активность некоторых ферментов биосинтеза полифенолов (Mavandad et al., 1990).
Помимо определения суммарного содержания фенольных соединений в клетках и тканях растений важно оценить изменения в накоплении различных их классов. В первую очередь было исследовано содержание биогенетически ранних соединений – фенилпропаноидов, которые могут как накапливаться в клетках растений, так и использоваться в качестве предшественников для биосинтеза флавоноидов и фенольного полимера лигнина (Запрометов, 1993; Vogt, 2010).
После воздействия оксибензойных кислот на культуры чая количество в них фенилпропаноидов в большинстве вариантов снижалось практически в равной степени (на 25% по сравнению с контролем) (рис. 3б). Исключением были два варианта (0.1 мкМ СК и 100 мкМ ОК), в которых содержание этих веществ не изменялось. Снижение содержания фенилпропаноидов в каллусных культурах чая после воздействия СК и ОК было противоположно действию СК, повышающему их образования в ягодах винограда (Chen et al., 2006).
Основные компоненты фенольного комплекса листьев чайного растения, а также инициированных из них каллусных культур – флаваны, которые представлены катехинами и их олигомерными производными (проантоцианидинами) (Запрометов, 1993; Fraser et al., 2012).
После воздействия СК и ОК на каллусные культуры чая содержание в них флаванов снижалось, кроме варианта с 0.1 мкМ СК, где оно сохранялось на уровне контроля (рис. 3в). Отметим, что в большинстве случаев характер изменений в образовании флаванов аналогичен таковому для суммарного содержания фенольных соединений. Наряду с этим имеются сведения о повышении накопления флаванов при воздействии на растения СК (Wen et al., 2019).
Содержание в культурах чая проантоцианидинов после кратковременного воздействия СК и ОК во всех вариантах достоверно снижалось по сравнению с контролем (рис. 3г). Наибольшие изменения отмечались в вариантах с 10 мкМ ОК и 100 мкМ СК (на 60 и 57% соответственно), что было отмечено и для накопления флаванов.
Все вышеизложенное свидетельствует о снижении активности фенольного метаболизма в каллусных культурах чайного растения после кратковременного воздействия на них двух аналогов оксибензойных кислот – СК и ОК. Это проявлялось как на уровне суммарного содержания, так и на уровне различных классов фенольных соединений, включая характерные для чая флаваны и проантоцианидины.
Известно, что в растительных тканях образуется фенольный полимер лигнин – важный компонент их клеточных стенок (Запрометов, 1993). Способность к образованию лигнина характерна и для каллусных культур чая (Загоскина и др., 2000).
Изучение содержания лигнина показало его увеличение после кратковременного воздействия на каллусы СК и ОК (рис. 3д). Наиболее высокое накопление этого фенольного полимера отмечалось в вариантах с ОК (10 мкМ) и СК (100 мкМ) (соответственно на 41 и 37% выше по сравнению с контролем), что согласуется с понижением в них количества флаванов и проантоцианидинов. Следовательно, после действия СК и ОК в клетках чайного растения усиливаются процессы полимеризации фенольных соединений, что приводит к накоплению в них лигнина. О положительном влиянии СК на его образование в растительных клетках сообщалось ранее (Surendran et al., 2018).
Ключевой фермент в биосинтезе фенольных соединений – ФАЛ, а повышение его активности часто сопровождается накоплением этих вторичных метаболитов (Запрометов, 1993; Klejdus et al., 2013). Ранее было показано, что СК индуцирует активность ФАЛ в растениях сальвии и винограда (Chen et al., 2006; Dong et al., 2010).
Наши данные свидетельствуют об отличиях в ответной реакции каллусных культур чая на кратковременное воздействие двух представителей оксибензойных кислот на уровне активности ФАЛ (рис. 4). После воздействия СК она почти во всех вариантах снижалась. В наибольшей степени эти изменения характерны для варианта с 10 мкМ СК (на 22% по сравнению с контролем). После воздействия ОК изменений в активности ферментa в каллусах не происходило.
Рис. 4.
Активность L-фенилаланинаммиаклиазы в каллусных культурах чайного растения через 12 сут после 2 ч воздействия на них разных концентраций салициловой (СК) и п-оксибензойной (ОК) кислот или воды (контроль). Достоверные различия средних значений при P ≤ 0.05 отмечены разными латинскими буквами над барами.
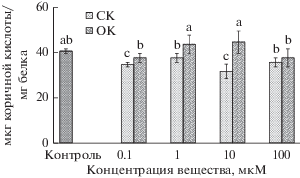
Следовательно, снижение активности ФАЛ в каллусах чая после кратковременного воздействия СК может свидетельствовать об изменениях начальных этапов фенольного метаболизма, что не отмечалось после воздействия ОК. Возможно, эти отличия в ответной реакции клеток чайного растения обусловлены положением гидроксильной группы в структуре молекулы ОК и, как считают некоторые авторы, более низкой ее физиологической активностью по сравнению с СК (Колупаев, Ястреб, 2013).
ЗАКЛЮЧЕНИЕ
После кратковременного воздействия двух представителей оксибензойных кислот (СК и ее структурного аналога – ОК) морфофизиологические характеристики каллусных культур чайного растения не изменялись, содержание МДА снижалось, как и содержание фенольных соединений, включая их мономерные (фенилпропаноиды, флаваны) и олигомерные (проантоaцинидины) формы. Это согласуется с активностью ФАЛ (ключевого фермента фенольного метаболизма), которая в опытных вариантах либо сохранялась на уровне контроля (воздействия ОК), либо снижалась (воздействия СК). Интересен и факт повышения в культуре чая содержания лигнина (полимер фенольной природы) в опытных вариантах. Это свидетельствует о том, что у культур с конституционно высоким содержанием полифенолов отдаленный ответ на действие СК и ОК проявлялся в полимеризации соединений фенольной природы. Вероятно, это связано с “балансом” содержания этих вторичных метаболитов в растительных клетках в виде мономерных, олигомерных и полимерных форм. При этом концентрационной зависимости действия СК и ОК на эти процессы не наблюдалось. Следует также отметить, что после кратковременного воздействия оксибензойных кислот, особенно ОК, на каллусы чая содержание МДА в них уменьшалось, что свидетельствует о снижении окислительных процессов в растительных клетках и отсутствии в них стрессовой реакции.
Все вышеизложенное позволяет сделать вывод, что кратковременное воздействие двух близких по структуре фенольных соединений (СК и ОК) на клетки чайного растения, выращиваемые в условиях in vitro, в большинстве случаев приводит к одинаковым изменениям в их морфофизиологических и биохимических характеристиках, включая накопление различных классов фенольных соединений.
Работа выполнена при финансовой поддержке Минобрнауки РФ в рамках темы государственного задания Института физиологии растений им. К.А. Тимирязева Российской академии наук № АААА-А19-119041890054-8.
Список литературы
Гончарук Е.А., Николаева Т.Н., Назаренко Л.В., Калашникова Е.А., Загоскина Н.В. Ответная реакция культивируемых in vitro клеток Linum grandiflorum Desf. на действие кадмия и глифосата // С.-х. биология. 2018. Т. 53. № 5. С. 938–946.
Загоскина Н.В., Гончарук Е.А., Алявина А.К. Изменения в образовании фенольных соединений при действии кадмия на каллусные культуры, инициированные из различных органов чайного растения // Физиология растений. 2007. Т. 54. № 2. С. 267–274.
Загоскина Н.В., Дубравина Г.А., Запрометов М.Н. Особенности формирования хлоропластов и накопление фенольных соединений в фотомиксотрофных каллусных культурах чайного растения // Физиология растений. 2000. Т. 47. № 4. С. 537−543.
Загоскина Н.В., Нечаева Т.Л., Николаева Т.Н., Лапшин П.В., Гончарук Е.А. Углеводы питательной среды и их влияние на каллусные культуры чайного растения (Camellia sinensis L.) // Науч. ведомости Белгород. гос. ун-та. Сер. Естеств. науки. 2016. № 5(246). Вып. 37. С. 45–55.
Запрометов М.Н. Основы биохимии фенольных соединений. М.: Высш. шк., 1974. 214 с.
Запрометов М.Н. Фенольные соединения. Распространение, метаболизм и функции в растениях. М.: Наука, 1993. 272 с.
Колупаев Ю.Е., Ястреб Т.О. Стресс-протекторные эффекты салициловой кислоты и ее структурных аналогов // Физиология и биохимия культ. растений. 2013. Т. 45. С. 113–124.
Носов А.М. Вторичный метаболизм // Физиология растений / Под. ред. Ермакова И.П. М.: Академия, 2005. С. 588–620.
Носов А.М. Методы оценки и характеристики роста культур клеток высших растений // Молекулярно-генетические и биохимические методы в современной биологии растений. М.: БИОНОМ, 2011. С. 386–403.
Олениченко Н.А., Загоскина Н.В. Ответная реакция озимой пшеницы на действие низких температур: образование фенольных соединений и активность L‑фенилаланинаммиаклиазы // Прикл. биохимия и микробиология. 2005. Т. 41. С. 600–603.
Полесская О.Г. Растительная клетка и активные формы кислорода. М., Книжный дом “Университет”, 2007. 140 с.
Прадедова Е.В., Ишеева О.Д., Саляев Р.К. Классификация системы антиоксидантной защиты как основа рациональной организации экспериментального исследования окислительного стресса у растений // Физиология растений. 2011. Т. 58. № 2. С. 177–185.
Радюкина Н.Л., Иванов Ю.В., Шевякова Н.И. Методы оценки содержания активных форм кислорода, низкомолекулярных антиоксидантов и активностей основных антиоксидантных ферментов // Молекулярно-генетические и биохимические методы в современной биологии растений. М.: БИОНОМ, 2011. С. 347–365.
Тарчевский И.А. Сигнальные системы клеток растений. М.: Наука, 2002. 294 с.
Тюкавкина Н.А. Биофлавоноиды. М.: Русский врач, 2002. 56 с.
Цыпурская Е.В., Казанцева В.В., Фесенко А.Н., Загоскина Н.В. Рост проростков гречихи обыкновенной (Fagopyrum esculentum) и накопление первичных и вторичных метаболитов при различных условиях минерального питания // С.-х. биология. 2019. Т. 54. № 5. С. 946–958.
Шугаев А.Г., Буцанец П.А., Шугаева Н.А. Салициловая кислота индуцирует протонную проницаемость внутренней мембраны митохондрий семядолей люпина // Физиология растений. 2016. Т. 63. № 6 С. 765–776.
Belscak-Cvitanovi A., Durgo K., Hudek A., Bacun-Druzina V., Komes D. Overview of polyphenols and their properties / Ed. Galanakis C.M. // Polyphenols: Properties, Recovery, and Applications. Duxford, UK: Woodhead Publ., 2018. P. 3–44.
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Analyt. Biochem. 1976. V. 72. № 1–2. P. 248–254.
Chen J.Y., Wen P.F., Kong W.F., Pan Q.H., Zhan J.C., Li J.M., Huang W.D. Effect of salicylic acid on phenylpropanoids and phenylalanine ammonia-lyase in harvested grape berries // Postharvest Biol. and Technol. 2006. V. 40. № 1. P. 64–72.
Dias M.I., Sousa M.J., Alves R.C., Ferreira I.C. Exploring plant tissue culture to improve the production of phenolic compounds // A Rev. Ind. Crops Prod. 2016. V. 82. P. 9–22.
Dong J., Wan G., Liang Z. Accumulation of salicylic acid-induced phenolic compounds and raised activities of secondary metabolic and antioxidative enzymes in Salvia miltiorrhiza cell culture // J. Biotechnol. 2010. V. 148. № 2–3. P. 99–104.
Fraser K., Harrison S.J., Lane G.A., Otter D.E., Hemar Y., Quek S.Y., Rasmussen S. HPLC–MS/MS profiling of proanthocyanidins in teas: a comparative study // J. Food Composit. Analysis. 2012. V. 26. № 1–2. P. 43–51.
Gharib F.A., Hegazi A.Z. Salicylic acid ameliorates germination, seedling growth, phytohormone and enzymes activity in bean (Phaseolus vulgaris L.) under cold stress // J. Am. Sci. 2010. V. 6. № 10. P. 675–683.
Golkar P., Amooshahi F., Arzani A. The effects of salt stress on physio-biochemical traits, total phenolic and mucilage content of Plantago ovata Forsk under in vitro conditions // J. Appl. Bot. Food Qual. 2017. V. 90. P. 224–231.
Hayat S., Ahmad A., Alyemeni M.N. Salicylic acid, plant growth and development. Dordrecht: Springer Sci. Bus. Media, 2013. 389 p.
Hong G., Wang J., Zhang Y., Hochstetter D., Zhang S., Pan Y., Wang Y. Biosynthesis of catechin components is differentially regulated in dark-treated tea (Camellia sinensis L.) // Plant Physiol. Biochem. 2014. V. 78. P. 49–52.
Horvath E., Pal M., Szalai G., Paldi E., Janda T. Exogenous 4-hydroxybenzoic acid and salicylic acid modulate the effect of short-term drought and freezing stress on wheat plants // Biol. Plant. 2007. V. 51. № 3. P. 480–487.
Klejdus B., Kovacik J., Babula P. PAL inhibitor evokes different responses in two hypericum species // Plant Physiol. Biochem. 2013. V. 63. P. 82–88.
Klessig D.F., Choi H.W., Dempsey D.M.A. Systemic acquired resistance and salicylic acid: past, present, and future // Mol. Plant-microbe Interact. 2018. V. 31. № 9. P. 871–888.
Li Q., Wang G., Wang Y., Yang D., Guan C., Ji J. Foliar application of salicylic acid alleviate the cadmium toxicity by modulation the reactive oxygen species in potato // Ecotoxicol. Environ. Safety. 2019. V. 172. P. 317–325.
Liu W., Zhang Y., Yuan X., Xuan Y., Gao Y., Yan Y. Exogenous salicylic acid improves salinity tolerance of Nitraria tangutorum // Russ. J. Plant Physiol. 2016. V. 63. № 1. P. 132–142.
Mavandad M., Edwards R., Liang X., Lamb C.J., Dixon R.A. Effects of trans-cinnamic acid on expression of the bean phenylalanine ammonia-lyase gene family // Plant Physiol. 1990. V. 94. № 2. P. 671–680.
Mendoza D., Cuaspud O., Arias J.P., Ruiz O., Arias M. Effect of salicylic acid and methyl jasmonate in the production of phenolic compounds in plant cell suspension cultures of Thevetia peruviana // Biotechnol. Repts. 2018. V. 19. P. e00273.
Naikoo M.I., Dar M.I., Raghib F., Jaleel H., Ahmad B., Raina A., Naushin F. Role and regulation of plants phenolics in abiotic stress tolerance: an overview // Plant Signal. Mol. Woodhead Publ.: Springer Netherlands, 2013. P. 15–30.
Nosov A.M. Application of cell technologies for production of plant-derived bioactive substances of plant origin // Appl. Biochem. Microbiol. 2012. V. 48. № 7. P. 609–624.
Pierrel F. Impact of chemical analogs of 4-hydroxybenzoic acid on coenzyme Q biosynthesis: from inhibition to bypass of coenzyme Q deficiency // Frontiers Physiol. 2017. V. 8. P. 436–444.
Quan N.T., Xuan T.D. Foliar application of vanillic and p‑hydroxybenzoic acids enhanced drought tolerance and formation of phytoalexinmomilactones in rice // Arch. Agronomy Soil Sci. 2018. V. 64. № 13. P. 1831–1846.
Ramawat K.G., Mérillon J.M. Natural products: phytochemistry, botany and metabolism of alkaloids, phenolics and terpenes. Heidelberg, Germany: Springer, 2013. P. 1541–2662.
Simek J.,Tuma J., Dohnal V., Musil K., Ducaiová Z. Salicylic acid and phenolic compounds under cadmium stress in cucumber plants (Cucumis sativus L.) // Acta Phys. Plant. 2016. V. 38. № 7. P. 1–9.
Singh R.S., Gara R.K., Bhardwaj P.K., Kaachra A., Malik S., Kumar R., Kumar S. Expression of 3-hydroxy-3-methylglutaryl-CoA reductase, p-hydroxybenzoate-m-geranyltransferase and genes of phenylpropanoid pathway exhibits positive correlation with shikonins content in arnebia [Arnebia euchroma (Royle) Johnston] // BMC Mol. Biol. 2010. V. 11. № 1. P. 88–99.
Surendran A., Siddiqui Y., Manickam S., Ali A. Role of benzoic and salicylic acids in the immunization of oil palm seedlings-challenged by Ganoderma boninense // Industr. Crops Products. 2018. V. 122. P. 358–365.
Vogt T. Phenylpropanoid biosynthesis // Mol. Plant. 2010. V. 3. № 1. P. 2–20.
Wen T., Hao Y.J., An X.L., Sun H.D., Li Y.R., Chen X., Lian M.L. Improvement of bioactive compound accumulation in cell cultures of Orostachys cartilaginous A. Bor. through elicitation with salicylic acid and effect of cell extract on bioactive activity // Industr. Crops Products. 2019. V. 139. P. 111570.
Zhang J., Li D.M., Sun W.J., Wang X.J., Bai J.G. Exogenous p-hydroxybenzoic acid regulates antioxidant enzyme activity and mitigates heat stress of cucumber leaves // Sci. Horticult. 2012. V. 148. P. 235–245.
Zhang S., Li H., Liang X., Yan Y., Xia P., Jia Y., Liang Z. Enhanced production of phenolic acids in Salvia miltiorrhiza hairy root cultures by combing the RNAi-mediated silencing of chalcone synthase gene with salicylic acid treatment // Biochem. Eng. J. 2015. V. 103. P. 185–192.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


