Известия РАН. Серия биологическая, 2021, № 5, стр. 470-478
Активность ферментов энергетического и углеводного обмена у молоди горбуши Oncorhynchus gorbuscha (Walb.) при переходе из пресной среды в морскую
М. В. Чурова 1, *, Н. С. Шульгина 1, М. Ю. Крупнова 1, Д. А. Ефремов 1, Н. Н. Немова 1
1 Институт биологии – обособленное подразделение ФГБУН ФИЦ “Карельский научный центр
Российской академии наук”
185910 Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: mchurova@yandex.ru
Поступила в редакцию 03.07.2020
После доработки 10.09.2020
Принята к публикации 10.09.2020
Аннотация
Исследовали биохимические адаптации энергетического обмена и некоторых путей окисления глюкозы при смене солености среды у личинок и смолтов горбуши Oncorhynchus gorbuscha (Walb.), обитающей в Белом море. Изучали активность ферментов энергетического и углеводного обмена (цитохром с оксидазы ЦО, лактатдегидрогеназы, ЛДГ, глюкозо-6-фосфатдегидрогеназы, Г6ФДГ, 1‑глицерофосфатдегидрогеназы, 1-ГФДГ и альдолазы) у личинок горбуши в коротком аквариальном и у смолтов горбуши в длительном садковом экспериментах, моделирующих переход молоди из пресной среды в морскую. Показано снижение активности ЦО, ЛДГ, 1-ГФДГ и альдолазы уже в первый час после переноса личинок в морскую воду. У смолтов, выдержанных в эстуарии и в море, по сравнению с особями из реки, установлены низкие уровни активности 1-ГФДГ и альдолазы. По-видимому, у исследуемой молоди горбуши происходит перераспределение углеводов между реакциями аэробного и анаэробного обмена в пользу анаэробного синтеза АТФ. Изменений в активности фермента пентозофосфатного пути – Г-6-ФДГ как у личинок, так и у смолтов по сравнению с особями, выдержанными в пресной воде, установлено не было. Поддержание необходимого уровня анаэробного обмена и пентозо-фосфатного пути, вероятно, является одним из механизмов биохимической адаптации горбуши к изменению соленосного режима.
Жизненный цикл лососевых включает в себя различные стадии развития со сложной системой адаптаций. Стадия смолтификации – генетически запрограммированный процесс, при котором лососевые, живущие в пресной воде, физиологически готовятся к миграции в море и обитанию в условиях повышенной солености (McCormick, 2012). В то время как у большинства лососевых период до наступления смолтификации может продолжаться до нескольких лет, молодь горбуши O. gorbuscha (Walb.) мигрирует в море непосредственно после выхода из грунта в состоянии малька, оставляя сравнительно мало времени для смолтификации (Grant et al., 2009, 2010). Из-за маленького размера молоди (0.2 г) в период миграции большое соотношение площади поверхности тела к его объему дополнительно затрудняет поддержание ионного и водного баланса в морской воде. Однако было показано (Weisbart, 1967), что на самой ранней стадии жизни ювенильные особи горбуши лучше других видов тихоокеанских лососей Oncorhynchus способны регулировать ионы в плазме крови при резком переходе в морскую воду. Так, мальки нерки Oncorhynchus nerka (Walb), кижуча Oncorhynchus kisutch (Walb) и чавычи Oncorhynchus tshawytscha (Walb), не прошедшие смолтификацию, гибли при переносе в морскую воду, в то время как мальки горбуши приспосабливались к новым условиям (Weisbart, 1967; Grant et al., 2009). Ранее на мигрирующей молоди горбуши (0.2 г) было показано, что при переносе ее в соленую воду в организме (в пересчете на грамм сырой массы) увеличивается концентрация Na+ и Cl–, которая некоторое время (до 2 недель) сохраняется на одном уровне. Авторы связывают это с тем, что увеличение ионов в организме является адаптационной стратегией вида, направленной на уменьшение ионного градиента с окружающей средой (Grant et al., 2009, 2010). При этом обезвоживания у молоди горбуши не наблюдали, а увеличение активности Na+/K+-АТФазы (основного фермента осморегуляции) до максимального уровня происходило не сразу, а постепенно, в течение некоторого времени после изменения солености (Grant et al., 2009, 2010). Однако данных исследований биохимических механизмов, обеспечивающие при этом перестройку метаболических процессов у горбуши все еще недостаточно.
Известно, что процессы адаптации рыб к изменению солености среды, опосредованные глюкокортикоидными гормонами, такими как кортизол (McCormick, 2001), включают изменения в осморегуляторной системе и перераспределение энергетических ресурсов (Soengas et al., 2007; Ruiz, Jarabo, 2019). Данные исследований интенсивности потребления кислорода у рыб при изменении солености среды указывают на увеличение расходования энергии для модуляции и стимуляции процессов транспорта ионов (Soengas et al., 2007; Tseng, 2008). Перестройка в метаболизме в целом и изменения в интенсивности и направлении путей энергетического и углеводного обмена, в частности, направлены на удовлетворение возросших потребностей молоди рыб в энергии, связанных с их акклиматизацией к солености. Показано, что энергия, необходимая осморегуляторным органам рыб, включая жабры и почки, в первую очередь, поддерживается окислением глюкозы и лактата, поступающих из кровеносных путей (Tseng, 2008). Энергетические траты на регуляцию метаболизма при изменении солености среды могут быть проанализированы двумя подходами: 1) оценкой общего метаболизма по степени поглощения кислорода; 2) изменениями в количестве энергетических субстратов или активности ферментов, контролирующих их метаболизм (Soengas et al., 2007). По активности ключевых ферментов аэробного и анаэробного синтеза АТФ, основных путей окисления глюкозы, можно судить об энергетическом статусе и функциональной активности органов рыб. Так, ЦО – ключевой фермент дыхательной цепи митохондрий, активность которого свидетельствует об уровне аэробного метаболизма (Goolish, Adelman, 1987). ЛДГ, фермент гликолиза, может служить показателем анаэробного обмена (Gauthier et al., 2008). Активность альдолазы характеризует степень использования углеводов в гликолизе (Johansen., Overturf, 2006). Фермент 1-ГФДГ катализирует реакцию образования 1-глицерофосфата, который является предшественником структурных и запасных липидов. Фермент Г6ФДГ участвует в функционировании пентозофосфатного пути (ПФП) (Tian et al., 1998). Различия в характере изменения активности этих ферментов при адаптации к солености были ранее показаны в исследованиях на эвригалинных и анадромных рыбах (Sangiao-Alvarellos et al., 2003; Le Francois, Blier, 2003; Le Francois et al., 2004; Чурова и др., 2018).
Принимая во внимание особенности физиолого-биохимических адаптаций у горбуши, связанные с миграцией мальков в морскую среду сразу после выхода из грунта, что требует сравнительно быстрой ответной реакции организма на смену солености среды обитания, можно предположить, что энергетически этот процесс обеспечивается изменением направления и интенсивности путей энергетического обмена и окисления глюкозы. Следует выяснить каким образом распределяются субстраты между аэробным и анаэробным путями энергетического обмена, пентозофосфатного пути, какова пластичность (обратимость изменений) вышеназванных реакций при возвратном переносе мальков горбуши в морскую воду из пресной.
Таким образом, целью настоящей работы было изучение активности ферментов энергетического и углеводного обмена (цитохром с оксидазы, лактатдегидрогеназы, глюкозо-6-фосфатдегидрогеназы, 1-глицерофосфатдегидрогеназы и альдолазы) у личинок и смолтов горбуши Oncorhynchus gorbuscha (Walb.) при изменении солености в краткосрочном аквариальном и долгосрочном садковом экспериментах. Для достижения этой цели и проверки вышеуказанной гипотезы были поставлены два эксперимента по изучению адаптивных возможностей молоди горбуши к смене солености среды на ранней стадии (личинки, вышедшей из гнезда) и смолтов в период ската. Первый (короткосрочный) эксперимент был направлен на исследование устойчивости личинок горбуши к переносу в морскую воду и пластичности реакции при возврате в пресную. Во втором (длительном) эксперименте в сравнительном аспекте изучали биохимические адаптации смолтов на разных по солености участках их покатной миграции: реки, эстуария, моря.
МАТЕРИАЛЫ И МЕТОДЫ
Аквариальный краткосрочный эксперимент по влиянию смены солености на личинок горбуши (при переносе в морскую воду из пресной)
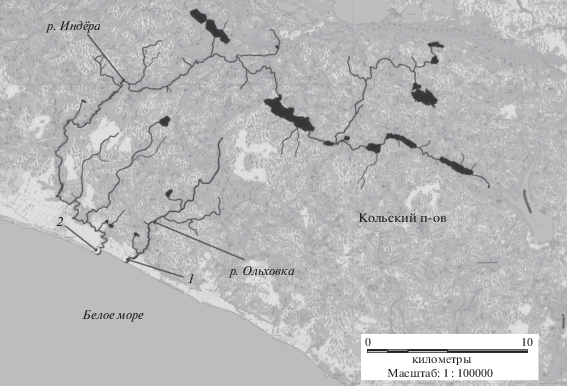
Эксперимент проводили с личинками горбуши из нерестового гнезда, обнаруженного 20 июня в реке Ольховка (бассейн Белого моря) (рис. 1). Остаток желточного мешка у личинок на этот момент составлял 10–15%. Во всех экспериментах молодь горбуши фиксировали в жидком азоте, а затем хранили при –80°С до начала анализа.
Рис. 1.
Место сбора проб и проведения эксперимента. 1 – место лова личинок горбуши; 2 – место проведения эксперимента в садках.
Собранных личинок поместили в садок в той же реке и 21 июня начали аквариальный экспери мент. Рыб из садка разделили на две группы, 20 особей из первой группы зафиксировали для анализа (контроль), вторую поместили в емкость с морской водой при температуре воды 14.6°С. Затем через 1 ч отловили 20 особей и зафиксировали. Через 24 ч были отобраны для анализа еще 20 рыб. Оставшихся личинок пересадили в рядом стоящую емкость с пресной водой и через 24 ч зафиксировали. В ходе эксперимента в емкости с мальками горбуши подавали воздух c помощью компрессора Sera air 275R. Размерно-весовые характеристики рыб представлены в табл. 1. Гибели личинок в процессе эксперимента не наблюдали.
Садковый долгосрочный эксперимент по влиянию переноса смолтов горбуши из пресной воды в эстуарий и в море
14 июня на реке Индера (бассейн Белого моря) были отловлены 100 смолтов горбуши малой ловушкой мережного типа, при температуре воды 8.8°С. Затем молодь разделили на 4 группы по 25 шт. в каждой (рис. 2.). Первую группу зафиксировали (контроль) для последующего анализа. Вторую группу поместили в русловой садок в пресную воду (садок “река”), который был на 60% погружен в воду (течение 0.3–0.4 м/с) при температуре 8.8°С. Эксперимент завершили 24 июня при температуре воды 14.5°С, отобрали пробы и зафиксировали их для дальнейшего анализа. Третью группу смолтов поместили в морской садок (садок “море”) с соленостью воды 28‰ (постоянная) и температурой 3.9°С. Смолтов предварительно выдержали 1 ч в воде пресная : морская 1 : 1, и еще 1 ч – в 100% морской воде. Садок был расположен на расстоянии 400 м от берега с глубинами 4–5 м, на расстоянии 1 м от дна, на растяжках, и независимо от прилива/отлива находился в толще воды. Сбор проб на биохимический анализ осуществили 24 июня при температуре воды 11.5°С.
Рис. 2.
Положение экспериментальных садков в районе устья реки Индера. (а) во время отлива, (б) во время прилива: 1 – садок в пресной воде; 2 – садок в морской воде; 3 – садок в эстуарии; a – пресная вода; b – соленая вода; c – распресненная вода; серым цветом показана суша.
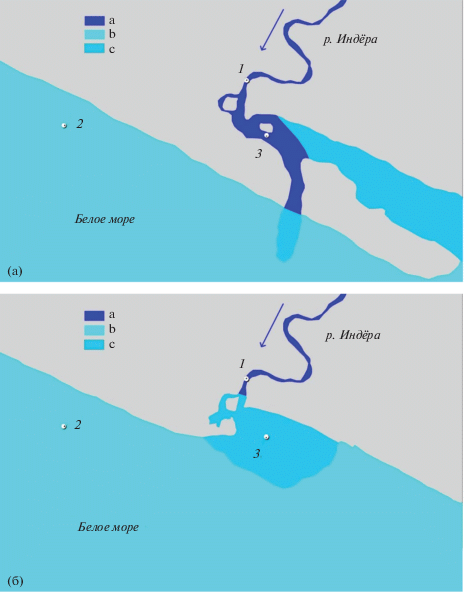
Четвертую группу 14 июня поместили в садок в эстуарии (садок “эстуарий”), но эксперимент был прерван действиями третьих лиц (форс-мажор), поэтому посадку в садок в эстуарии повторили 17 июня. Во время отлива садок находился на струе пресной воды при температуре воды 8.8°С, затопленный на 50% (скорость потока 0.3–0.4 м/с); во время прилива садок был погружен в воду на расстоянии 0.4–0.5 м от дна, вода соленая/распресненная (в зависимости от направления ветра и локального течения). Два раза в сутки во время полного прилива и полного отлива садок находился в воде с циклом пресная/ соленая/пресная/ соленая вода и т.д. каждые 24 ч. Одновременно менялась температура воды, пресная вода прогревалась быстрее, соленая вода медленнее, в каждый прилив вода становилась холодной, в каждый отлив – теплой (амплитуда до 10 градусов). Эксперимент закончили 27.06.18 при температуре воды 18.1°С во время отлива.
Время экспозиции для второй, третьей и четвертой групп составило 9 дней 11 ч (226 ч). Гибели смолтов за время исследования не наблюдалось. Размерно-весовые характеристики рыб представлены в табл. 2.
Таблица 2.
Размерно-весовые характеристики молоди горбуши в садковом (длительном) эксперименте
| Группа | Т, °С (в день сбора) | Длина (AB), см | Масса, г |
|---|---|---|---|
| 14.06 до эксперимента, река | 8.8 | 3.35 ± 0.06 | 0.17 ± 0.013 |
| 24.06 река | 14.5 | 3.53 ± 0.03 | 0.16 ± 0.010 |
| 27.06 эстуарий | 18.1 | 3.51 ± 0.05 | 0.19 ± 0.007 |
| 24.06 море | 11.5 | 3.41 ± 0.02 | 0.17 ± 0.006 |
Активность ферментов энергетического и углеводного обмена определяли индивидуально для каждой особи. Активность цитохром с оксидазы (КФ 1.9.З.1.) определяли по методу Смита (Smith, 1955), измеряя увеличение количества окисленного цитохрома с. Общую активность лактатдегидрогеназы (ЛДГ, 1.1.1.27), глюкозо-6-фосфатдегидрогеназы (Г6ФДГ, 1.1.1.49), 1-глицерофосфатдегидрогеназы (1-ГФДГ, 1.1.1.49) определяли, измеряя количествo восстановленных НАД и НАДФ по общепринятым методикам (Кочетов, 1980). Активность альдолазы (КФ 4.1.2.13) определяли по методике Beck в модификации Ананьева и Обуховой (Колб, Камышников, 1976). Активность ферментов представлена в мкмоль/мин/мг белка. Концентрацию белка определяли спектрофотометрически по поглощению пептидной связи при длине волны 220 нм (Noble, Bailey, 2009). Статистический анализ полученных результатов производили с помощью критерия Краскела–Уоллиса с последующим сравнением выборок с использованием критерия Манна–Уитни. Различия считали достоверными при р < 0.05. Исследования выполнены на оборудовании Центра коллективного пользования ФИЦ “Карельский научный центр Российской академии наук”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Активность исследуемых ферментов у личинок горбуши при переносе в морскую воду из пресной (краткосрочный аквариальный эксперимент)
Получены данные, указывающие на различия в изменениях активности исследуемых ферментов энергетического и углеводного обмена у личинок горбуши при их прямом переносе из пресной в морскую воду. При этом показано, что активности ферментов ЦО, ЛДГ, 1-ГФДГ и альдолазы снижаются фактически в первый час после переноса особей в морскую воду (рис. 3), что указывает как на снижение аэробного и анаэробного обмена, так и на снижение использования углеводов в гликолизе и в синтезе глицерофосфата (в частности). Как ранее было показано (Grant et al., 2009, 2010), перенос молоди горбуши в соленую воду сопровождается увеличением в организме концентрации Na+ и Cl–, которая некоторое время (до 2 недель) сохраняется на одном уровне, при этом увеличение активности Na+/K+-АТФазы до максимального уровня происходит постепенно. В нашем эксперименте активность Na+/K+-АТФазы у личинок горбуши при переносе ее в морскую воду (Немова и др., 2021) постепенно возрастала через час эксперимента и далее – через сутки. Вышеуказанное снижение активности исследуемых ферментов энергетического и углеводного обмена у личинок горбуши при резком увеличении концентрации ионов в организме, по-видимому, согласуется с “запуском” механизмов перераспределения энергии между осморегуляцией и другими энергозатратными метоболическими процессами, такими как рост и развитие (Sangiao-Alvarellos et al., 2003, Le Francois et al., 2004).
Рис. 3.
Относительная активность ферментов ЦО (а), ЛДГ (б), Г-6-ФДГ (в), 1-ГФДГ (г), альдолазы (д) (мкмоль/мин/мг белка) у личинок горбуши при переносе в морскую воду в краткосрочном эксперименте. * – различия по сравнению с контрольной точкой достоверны (p < 0.05).
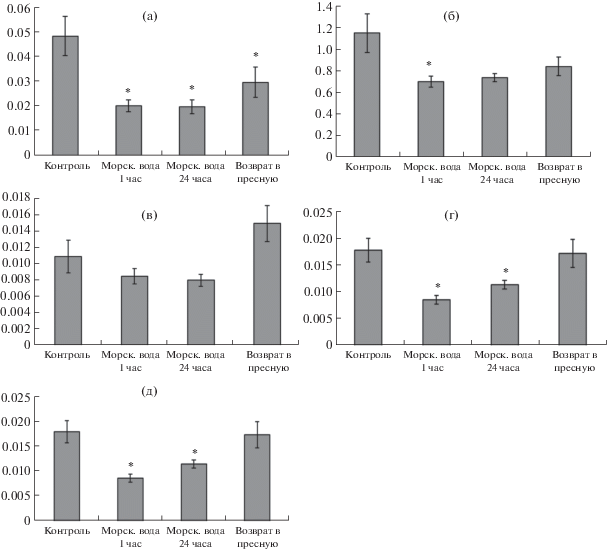
Поскольку при возврате в пресную воду активность ЛДГ, 1-ГФДГ и альдолазы (рис. 3б, 3г и 3д) у личинок возвращается к исходному уровню, то можно говорить о пластичности ответной реакции исследуемых метаболических путей при резкой смене солености/опреснения. Активность ЦО (фермента аэробного обмена) повышается незначительно.
Активность фермента пентозофосфатного пути Г6ФДГ у личинок горбуши на протяжении эксперимента не изменялась (рис. 3в), что согласуется с данными литературы (Soengas et al., 1993) об отсутствии изменений активности Г6ФДГ в мышцах молоди форели при переносе в морскую воду. Вероятно, что сохранение активности пентозофосфатного пути является необходимым для поддержания уровня НАДфН, использующегося в реакциях биосинтеза жирных кислот, холестерина, стероидных гормонов, сфинголипидов (Tian et al., 1998). В условиях гиперосмотического шока происходит активация синтеза стероидов, в том числе и стероидных гормонов, участвующих в регуляции осморегуляторных механизмов (McCormick, 2001; Ruiz-Jarabo et al., 2019).
Активность исследуемых ферментов у смолтов горбуши, выдержанных в реке, эстуарии, море (длительный садковый эксперимент)
В садковом эксперименте установлено снижение активности ЦО (рис. 4а) у смолтов горбуши, выдержанных в эстуарии и в море, по сравнению с особями, оставшимися в пресной воде, что согласуется с вышеприведенными данными аквариального краткосрочного эксперимента по снижению активности фермента аэробного обмена при переносе личинок в морскую воду. Ранее в исследовании на молоди палии 1+ (Salvelinus fontinalis) было также показано, что перемещение ее в морскую воду из пресной на месяц приводит к снижению активности ЦО в жабрах на фоне увеличения активности Na+/K+-АТФазы (Le Francois, Blier, 2003). У молоди (1+) пятнистой зубатки при выдерживании в течение 14 и 19 недель в воде с разной соленостью (7, 14, 21, 28‰) низкая активность ЦО в жабрах была установлена в среде с наименьшей соленостью (7‰), а при остальных концентрациях разницы не наблюдалось, при этом корреляции между изменением активности Na+/K+-АТФазы и ЦО установлено не было (Le Francois et al., 2004). Было сделано предположение (Le Francois et al., 2004), что у разных видов рыб существуют определенные различия в регуляции активности ЦО при изменении солености.
Рис. 4.
Относительная активность ферментов ЦО (а), ЛДГ (б), Г-6-ФДГ (в), 1-ГФДГ (г), альдолазы (д) (мкмоль/мин/мг белка) у смолтов горбуши при выдерживании в эстуарии и в море в долгосрочном эксперименте. * – различия по сравнению с данными “24.06 река” достоверны (p < 0.05); # – различия по сравнению с данными “14.06 до эксперимента” достоверны (p < 0.05).
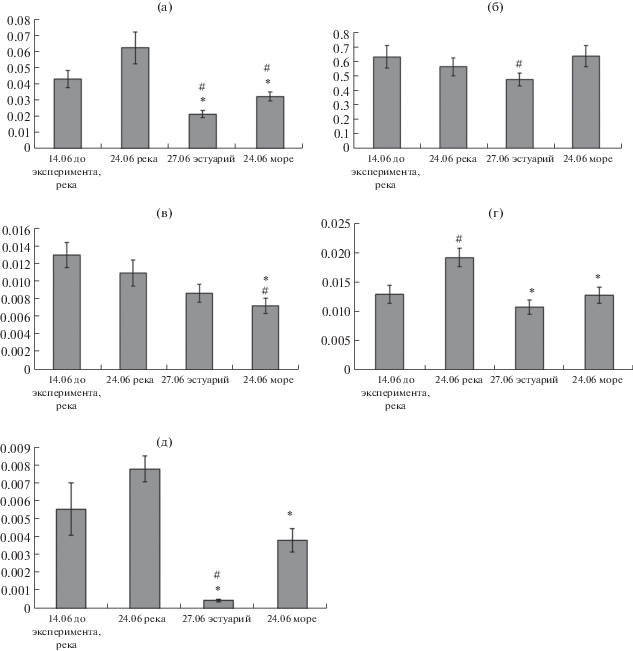
Низкая аэробная емкость у молоди горбуши в море и в эстуарии компенсируется, вероятно, анаэробным синтезом АТФ, на что указывает отсутствие разницы в уровне активности ЛДГ у этих групп рыб при сравнении с таковой у особей из русла реки (рис. 4б) на фоне уменьшения активности ЦО. Согласно данным литературы (Tseng, Hwang, 2008), анаэробный метаболизм углеводов выполняет ведущую роль в адаптивных реакциях водно-солевого обмена к обитанию в морской воде, являясь механизмом, быстро реагирующим на изменение в потребности энергии АТФ. Так, в исследованиях адаптации молоди зубатки к разным условиям солености (7, 14, 21, 28‰) показано, что наряду с увеличением активности Na+/K+-АТФазы повышалась активность ЛДГ и пируваткиназы (ПК) (Le Francois et al., 2004). У зрелых особей палии S. fontinalis в исследовании чувствительности к изменению солености в репродуктивный период, изменение активности Na+/K+-АТФазы в жабрах при выдерживании в морской воде не было связано с изменением ПК и ЛДГ, в то время как у стерильных, не зрелых особей активность и ЛДГ иNa+/K+-АТФазы в жабрах была выше в морской воде (Le Francois, Blier, 2003; Le Francois et al., 2004). О значении анаэробного обмена (гликолиза) у рыб в энергообеспечении при изменении солености среды свидетельствует увеличение уровня окисления глюкозы и лактата, которые становятся основными источниками энергии при адаптации разных видов рыб к солености (Soengas et al., 2007).
У особей, выдержанных в эстуарии и в море, по сравнению с особями из реки установлены низкие уровни активности 1-ГФДГ и альдолазы (рис. 4в, 4г), что также согласуется с результатами аквариального эксперимента (краткосрочного) на личинках горбуши (рис. 3в, 3г). Это указывает на снижение использования углеводов в гликолизе и синтезе глицерофосфата у смолтов. Поскольку активность ЦО снижается, а ЛДГ не изменяется, то, вероятно, у исследуемой молоди горбуши происходит перераспределение углеводов между реакциями аэробного и анаэробного обмена в пользу анаэробного синтеза АТФ. Обращает на себя внимание также и самый низкий уровень активности альдолазы у молоди горбуши в эстуарии. В эстуарии смолты в большей степени подвержены влиянию изменяющихся условий (смена пресной и соленой воды, температур, скорости потока). Вероятно, что у смолтов горбуши, находящихся в условиях эстуария, имеет место наибольшая трата энергетических субстратов.
Изменений в активности фермента пентозофосфатного пути – Г-6-ФДГ у смолтов в эстуарии по сравнению с особями, выдержанными в пресной воде установлено не было. Эти результаты согласуются с данными, полученными в краткосрочном аквариальном эксперименте, и подтверждают важность сохранения активности ПФП при изменении условий солености среды. Низкий уровень активности Г-6-ФДГ наблюдается у особей, выдержанных в море (рис. 4в). Снижение Г-6-ФДГ при длительном нахождении в морской воде может быть связано и с другими факторами, влияющими на общий метаболизм молоди горбуши, такими, например, как наличие пищи или изменение температуры воды.
Таким образом, результаты проведенных исследований изменений активности ферментов энергетического и углеводного обмена у личинок горбуши, отобранных из нерестового гнезда в кратковременном аквариальном эксперименте и у мигрирующих смолтов горбуши в долговременном садковом эксперименте при изменении солености среды обитания, свидетельствуют о наличии у них адаптивных перестроек в аэробном и анаэробном обмене, функционировании пентозо-фосфатного пути. Данные экспериментов показывают, что метаболические перестройки, связанные с увеличением солености воды, свойственны молоди горбуши уже на стадии личинки. Использование анаэробного пути синтеза АТФ и поддержание функционирования ПФП, а также пластичность регуляции этих процессов, являются, по-видимому, одним из механизмов биохимической адаптации молоди горбуши к резкой смене солености среды обитания, что имеет значение в подготовке молоди горбуши к покатной миграции в море.
Работа выполнена при финансировании из средств государственного бюджета, выделенных по темам (0218-2019-0076 и 0218-2019-0081).
Список литературы
Колб В.Г., Камышников В.Г. Клиническая биохимия. Минск: Изд-во Беларусь, 1976. 311 с.
Кочетов Г.А. Практическое руководство по энзимологии. М.: Высш. шк., 1980. 272 с.
Немова Н.Н., Кяйвяряйнен Е.И., Рендаков Н.Л., Никерова К.М., Ефремов Д.А. Содержание кортизола и активность Na+/K+-АТФазы при адаптации молоди горбуши Оncorhynchus gorbuscha (Salmonidae) к изменению солeности среды // Вопросы ихтиологии. 2021. в печати
Чурова М.В., Шульгина Н.С., Немова Н.Н. Активность ферментов энергетического и углеводного обмена в органах колюшки в период нереста из разных биотопов Белого моря // Доклады Академии наук. 2018. Т. 482. № 1. С. 111–113.
Gauthier C., Campbell P., Couture P. Physiological correlates of growth and condition in the yellow perch (Perca flavescens) // Comp. Biochem. Physiol. Part A. 2008. V. 151. P. 526–532.
Goolish E.M., Adelman I.R. Tissue specific cytochrome c oxidase activity in largemouth bass: the metabolic cost of feeding and growth // Physiol. Zoology. 1987. V. 60. P. 454–464.
Grant A., Gardner M., Nendick L., Sackville M, Farrell A.P., Brauner C.J. Growth and ionoregulatory ontogeny of wild and hatchery-raised juvenile pink salmon (Oncorhynchus gorbuscha) // Can. J. Zoology. 2009. V. 87. P. 221–228.
Grant A.M., Gardner M.L., Hanson L.M., Farrell A.P., Brauner C.J. Early life stage salinity tolerance of wild and hatchery-reared juvenile pink salmon Oncorhynchus gorbuscha // J. Fish Biol. 2010. V. 77. № 6. P. 1282–1292.
Johansen K.A., Overturf K. Alterations in expression of genes associated with muscle metabolism and growth during nutritional restriction and refeeding in rainbow trout //Comp. Biochem. Physiol. Part B: Biochem. Mol. Biol. 2006. V. 144. P. 119–127.
Le Francois N.R., Blier P.U. Reproductive events and associated reduction in the seawater adaptability of brook charr (Salvelinus fontinalis): evaluation of gill metabolic adjustments // Aquat. Living Resour. 2003. 16. P. 69–76.
Le Francois N.R., Lamarre S.G., Blier P.U. Tolerance, growth and haloplasticity of the Atlantic wolffish (Anarhichas lupus) exposed to various salinities. // Aquaculture. 2004. V. 236(1–4). P. 659–675.
McCormick S.D. Endocrine control of osmoregulation in teleost fish // Amer. zoologist. 2001. V. 41. № 4. P. 781–794.
McCormick S.D. Smolt Physiology and Endocrinology // Euryhaline Fishes / Eds. S.D. McCormick, A.P. Farrell, C.J. Brauner. 2012. P. 199–251.
Noble J.E., Bailey M.J.A. Quantitation of Protein // Methods in Enzymology. 2009. V. 463. P. 73–95.
Ruiz-Jarabo I., Tinoco A.B., Vargas-Chacoff L., Martos-Sitcha J.A., Rodríguez-Rúa A., Cárdenas S., Mancera J.M. Environmental salinity affects growth and metabolism in fingerling meagre (Argyrosomus regius) // Fishes. 2019. V. 4. P. 6.
Sangiao-Alvarellos S., Laiz-Carrio’n R., Guzma’n J.M., Martı’n del Rı´oM.P., Miguez J.M., Mancera J.M., Soengas J.L. Acclimation of S. aurata to various salinities alters energy metabolism of osmoregulatory and nonosmoregulatory organs // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2003. V. 285. P. 897–907.
Soengas J.L., Barciela P., Fuentes J., Otero J., Andrés M.D., Aldegunde M. Changes in muscle carbohydrate-metabolism in domesticated rainbow-trout (Oncorhynchusmykis) after transfer to seawater // Comp. Biochem. Phys. Part B: Comp. Biochem. 1993. V. 104. № 1. P. 73–179.
Soengas J.L., Sangiao-Alvarellos S., Laiz-Carrion R., Mancera J.M. Energy metabolism and osmotic acclimation in teleost fish. In Fish Osmoregulation; Baldiserotto B., Mancera J.M., Kapoor, B.G., Eds.; Science Publishers: Enfield, NH USA. 2007. P. 277–307.
Smith L. Spectrophotometric assay of cytochrome c oxidase // Methods in Biochem. Analysis. 1995. V. 2. P. 427–434.
Tian W.N., Braunstein L.D., Pang J., Stuhlmeier K.M., Xi Q.C., Tian X., Stanton R.C. Importance of glucose-6-phosphate dehydrogenase activity for cell growth // J. Biol. Chem. 1998. V. 273. P. 10609–10617.
Tseng Y.C., Hwang P.P. Some isights into enrtgy metabolism for osmoregulation in fish // Comp. Biochem. Phisiol, Part C. 2008. V. 148. P. 419–429.
Weisbart M. Osmotic and ionic regulation in embryos, alevins, and fry of the five species of Pacific salmon // Can. J. Zool. 1967. V. 46. P. 385–397.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


