Известия РАН. Серия биологическая, 2021, № 5, стр. 479-485
Изменение гормонального статуса и интенсивности фотосинтеза растений картофеля, трансформированных Bt-геном
Т. И. Пузина 1, *, В. В. Король 1, И. Ю. Макеева 1
1 ФГБОУ ВО “Орловский государственный университет им. И.С. Тургенева”
302026 Орел, ул. Комсомольская, 95, Россия
* E-mail: tipuzina@gmail.com
Поступила в редакцию 16.07.2019
После доработки 27.03.2020
Принята к публикации 03.09.2020
Аннотация
Изучен гормональный статус, интенсивность фотосинтеза и продуктивность нетрансформированных и трансформированных Bt-геном растений картофеля сорта Супериор. Показано, что в период вынужденного покоя в глазках клубней транформированных растений содержание АБК было в два раза выше нетрансформированных, тогда как содержание ИУК и зеатина – в 1.5 раза меньше. Отношение зеатин/АБК и, в большей степени, ИУК/АБК было ниже контроля. В листьях трансгенных растений уровень АБК на 40% был меньше нетрансформированных, низким оставалось отношение зеатин/АБК, но возросло отношение ИУК/АБК. На фоне данной гормональной ситуации в листьях трансгенных растений на 24% повысилась ассимиляция 14СО2, однако отмечена меньшая продуктивность (на 21%) при выращивании в почвенной культуре. У трансформированных растений выявлено меньшее количество клубней в кусте и снижение содержания в них крахмала, что может свидетельствовать как о нарушении инициации процесса клубнеобразования, так и оттока ассимилятов из листьев.
Генно-инженерные технологии все чаще используются в фундаментальных исследованиях для изучения механизмов роста и развития растений (Аксенова и др., 2005; Giannarelli et al., 2009; Дерябин, Трунова, 2014). Трансгенные растения являются моделью для исследования стрессовых ответов на действие биотических и абиотических факторов (Пирузян и др., 2000; Астахова и др., 2011; Scalabrin et al., 2016; Xu et al., 2018). В последнее время пристальное внимание уделяется исследованию растений с усиленным или ослабленным синтезом фитогормонов, что позволяет изучить молекулярно-генетические основы гормонального действия и снять вопросы, связанные с поступлением, транспортом и метаболизмом при их экзогенном применении (Nishiyama et al., 2011; Ермошин и др., 2013; Kolachevskaya et al., 2015; Данилова и др., 2016). Наряду с этим имеются работы как отечественных, так и зарубежных авторов по изучению содержания гормонов у растений, трансформированных генами, не связанными с их синтезом или метаболизмом (Абдеев и др., 2004; Загорская и др., 2009; Debast et al., 2011; Eschen-Lippold et al., 2012). Изучение гормонального статуса таких трансгенных растений должно быть одним из приоритетных направлений, так как фитогормоны являются ведущими регуляторами жизнедеятельности растений.
В настоящее время во всем мире увеличивается выращивание сельскохозяйственных растений, трансформированных Bt-геном из грам-положительной аэробной спорообразующей бактерии Bacillus thuringiensis. Данные растения содержат δ‑эндотоксин, губительно действующий на личинки насекомых, в том числе и колорадского жука. Основное внимание исследователи уделяют изучению генетических аспектов трансформации растений Bt-геном, а также экологическим рискам, возникающим при возделывании трансгенных культур (Zwahlen et al., 2003; Catarino et al., 2015; Викторов, 2017; Xu et al., 2018), в некоторых работах показано влияние на скорость развития растений (Lumbierres et al., 2004), содержание в них азота (Escher et al., 2000). При этом не найдено сведений о реакции гормональной системы растений, в том числе и картофеля, на введение Bt-гена.
Цель исследования – изучение содержания и соотношения фитогормонов в прорастающих клубнях и листьях растений картофеля сорта Супериор, трансформированных Bt-геном, а также интенсивности ассимиляции СО2 листьями.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили растения картофеля (Solanum tuberosum L.) сорта Супериор и полученные на их основе компанией “Monsanto” трансгенные растения с Bt-геном. Клубни трансгенных растений были предоставлены лабораторией генетики ВНИИ КХ (Россия). Bt-ген встроен с маркерным геном npt-II. Bt-ген продуцирует белки CRY-дельта-эндотоксины, специфичные к различным видам насекомых. Для колорадского жука токсичен белок CRN111A. В исследованиях (Watanabe et al., 2004) методом ПЦР-анализа подтверждено наличие встроенного Bt-гена у картофеля сорта Супериор. Опыты проводили с клубнями, находящимися в состоянии вынужденного покоя (хранились в овощехранилище при температуре +4°С), в первые 72 ч прорастания после перенесения в лабораторию (20 ± 2°С), через 14 сут после начала прорастания, а также с растениями, выращенными в почвенной культуре в условиях вегетационного домика на агробиостанции Орловского госуниверситета. В почвенной культуре использовали серую лесную средне-суглинистую почву. В период закладки опытов в почву вносили оптимальные для картофеля количества азота, фосфора и калия – соответственно: 2.3, 0.7, 3.1 г на сосуд. В сосуде с 10 кг почвы выращивали одно растение и поддерживали влажность почвы 60% от полной влагоемкости.
Анализировали средние пробы апикальных глазков клубней, 14-дневных проростков, листьев 7 яруса срединной формации в фазе бутонизации. В конце вегетации растений учитывали их продуктивность и содержание крахмала в клубнях.
Фитогормоны экстрагировали 80%-ным этанолом из исследуемого растительного материала, зафиксированного в жидком азоте. После очистки экстракта фитогормонов с помощью хроматографии по методике (Веселов, 1998) определяли содержание ауксинов, цитокининов и абсцизовой кислоты методом твердофазного иммуноферментного анализа (Кудоярова и др., 1986, 1990). В лунки полистиролового планшета вносили конъюгат гормона с белком, а затем сыворотку с антителами к соответствующему гормону и раствор стандартного гормона или экспериментальных образцов. Количество антител, специфически связанных с белковым конъюгатом гормона, определяли с помощью бараньих антител против иммуноглобулинов кролика, меченых пероксидазой. Для определения активности связавшейся пероксидазы использовали ортофенилендиамин. Интенсивность хромофорного ответа определяли на микрофотометре Dombi plate (ЗАО “Пикон”, Россия) при длине волны 492 нм. Для анализов использовали отечественные реактивы фирмы “Уралинвест” (Россия). В качестве стандартных растворов фитогормонов были взяты ИУК, зеатин и АБК (“Serva”, Германия).
Интенсивность фотосинтеза определяли с помощью радиоактивного изотопа 14С (Петрухин, Константинова, 1982). 14СО2 получали в газгольдере из смеси 4 мг радиоактивной соды и 2.525 г чистой соды. В фазе бутонизации растений интактный лист 7 яруса экспонировали 10 мин в камере-прищепке, в которую вводили 10 мл 14СО2 из газгольдера с помощью медицинского шприца при температуре 19°С, влажности воздуха 49% и освещенности 13 000 лк. Удельная радиоактивность в атмосфере 14СО2 – 0.0334 мБк/нМ, концентрация 14СО2 – 0.6%. Для определения скорости фотосинтеза лист фиксировали при температуре 105°С 30 мин. Затем высушивали при 60°С. Измерение радиоактивности проводили на торцовом счетчике Т‑25-БФЛ (“Изотоп”, Россия).
Для определения сухой массы клубни и листья высушивали в сушильно-стерилизационном шкафу ШСС-80 (“Гродненский завод пищевого машиностроения”, Беларусь) при 105°С до постоянной массы.
Продуктивность растений картофеля, выращенных в почвенной культуре в условиях вегетационного домика, учитывали путем взвешивания клубней из каждого сосуда.
Содержание крахмала в клубнях определяли в конце вегетации растений на сахариметре СУ-4 (“Аналитприбор”, Россия) по методике (Радов и др., 1971). Навеску клубней подвергали гидролизу с 1.124%-ной HCl, затем охлаждали и добавляли 30%-ный ZnSO4 и 15%-ный железистосинеродистый калий. Фильтратом наполняли поляризационную трубку и делали отсчет по шкале сахариметра. Содержание крахмала вычисляли по формуле: $\frac{{k\alpha \times 100}}{{100 - w,}}$ где k – переводной коэффициент (для картофеля 1.912), α – показатель сахариметра в градусах шкалы, w – влажность навески в %.
В таблицах и на рисунках представлены средние арифметические значения из девяти биологических повторностей и их стандартные ошибки. Аналитическая повторность – 7-кратная. Достоверность результатов оценивали с помощью критерия Стьюдента. Достоверными различия были при уровне доверительной вероятности выше 0.95.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты определения содержания фитогормонов в апикальных глазках клубней, находящихся в состоянии вынужденного покоя, свидетельствуют о различном гормональном статусе трансформированных Bt-геном и нетрансформированных растений (табл. 1). Так, клубни трансгенных растений характеризовались меньшим количеством ауксинов (ИУК) и цитокининов (зеатина) в полтора раза. Напротив, уровень абсцизовой кислоты (АБК) в них был в два раза выше. В результате соотношение ИУК/АБК и зеатин/АБК в глазках клубней трансгенных растений было почти в три раза меньше.
Таблица 1.
Содержание и соотношение фитогормонов в глазках клубней, находящихся в состоянии вынужденного покоя
| Вариант | Содержание фитогормонов, мкг/г сухой массы | Соотношение фитогормонов | |||
|---|---|---|---|---|---|
| зеатин | ИУК | АБК | зеатин/АБК | ИУК/АБК | |
| Нетрансформированные растения | 0.75 ± 0.04 | 0.28 ± 0.01 | 1.10 ± 0.11 | 0.68 | 0.25 |
| Трансгенные растения | 0.51 ± 0.02 | 0.19 ± 0.01 | 2.22 ± 0.20 | 0.23 | 0.09 |
Через 72 ч от начала прорастания глазков клубней уровень абсцизовой кислоты снизился в 1.7 раза как у нетрансформированных, так и трансгенных растений (табл. 2). Вместе с тем, значительно (более чем на порядок) увеличилось содержание зеатина в глазках клубней обоих вариантов. Однако, и в данном случае, их уровень был незначительно (на 17%), но достоверно ниже в глазках клубней трансгенных растений. Содержание ИУК повысилось в 2.5 раза в клубнях нетрансформированных растений и в меньшей степени – в 1.5 раза у трансгенных (табл. 1, табл. 2).
Таблица 2.
Содержание и соотношение фитогормонов в глазках клубней через 72 ч прорастания
| Вариант | Содержание фитогормонов, мкг/г сухой массы | Соотношение фитогормонов | |||
|---|---|---|---|---|---|
| зеатин | ИУК | АБК | зеатин/АБК | ИУК/АБК | |
| Нетрансформированные растения | 9.6 ± 0.3 | 0.71 ± 0.04 | 0.66 ± 0.06 | 14.5 | 1.10 |
| Трансгенные растения | 8.0 ± 0.3 | 0.28 ± 0.02 | 1.26 ± 0.09 | 6.3 | 0.22 |
Таким образом, к концу третьих суток прорастания глазки клубней растений, трансформированных Bt-геном и нетрансформированных, имели разный гормональный баланс. Так, у трансгенных растений отношение зеатин/АБК было меньше более чем в два раза, а ИУК/АБК – меньше в пять раз по сравнению с нетрансформированными.
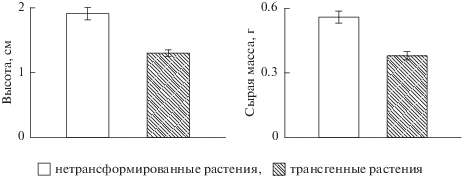
Через 14 сут после начала прорастания глазков высота ростков клубней трансгенных растений и их сырая масса была меньше на 32% по сравнению с нетрансформированными растениями (рис. 1).
Рис. 1.
Ростовые показатели ростков клубней трансформированных Bt-геном и нетрансформированных растений.
В отличие от прорастающих глазков клубней в листьях трансгенных растений в фазе бутонизации уровень абсцизовой кислоты был ниже на 41% по сравнению с нетрансформированными (табл. 3). При этом сохранилась закономерность в содержании ИУК и зеатина. Оно было ниже, чем у нетрансформированных растений. Надо заметить, что в отличие от прорастающих глазков клубней, в листьях растений, трансформированных Bt-геном, в большей степени уменьшился уровень цитокининов – на 64%, тогда как ауксинов только на 20%. В результате изменения в гормональном статусе листьев трансгенных растений привели к меньшему соотношению зеатин/АБК (на 40%), но большему (на 35%) ИУК/АБК (табл. 3).
Таблица 3.
Содержание и соотношение фитогормонов в листьях растений картофеля
| Вариант | Содержание фитогормонов, мкг/г сухой массы | Соотношение фитогормонов | |||
|---|---|---|---|---|---|
| зеатин | ИУК | АБК | зеатин/АБК | ИУК/АБК | |
| Нетрансформированные растения | 50.2 ± 3.2 | 100.2 ± 5.7 | 2.04 ± 0.18 | 24.6 | 49.1 |
| Трансгенные растения | 17.8 ± 1.0 | 79.6 ± 4.5 | 1.20 ± 0.11 | 14.8 | 66.3 |
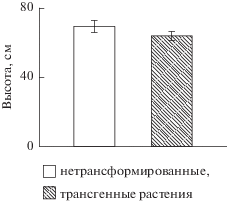
В этот период онтогенеза высота трансгенных растений практически не отличалась от нетрансформированных (рис. 2). Ее некоторое снижение находилось в пределах ошибки опыта.
Рис. 2.
Высота растений, трансформированных Bt-геном и нетрансформированных растений (фаза бутонизации).
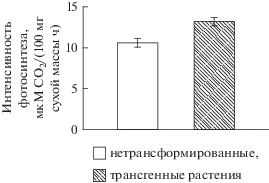
Наряду с гормональными изменениями в листьях трансгенных растений наблюдали изменение интенсивности фотосинтеза, о котором судили по поглощению 14СО2 (рис. 3). У растений, трансформированных Bt-геном, интенсивность ассимиляции СО2 листьями была на 24% выше.
Рис. 3.
Интенсивность фотосинтеза трансформированных Bt-геном и нетрансформированных растений картофеля.
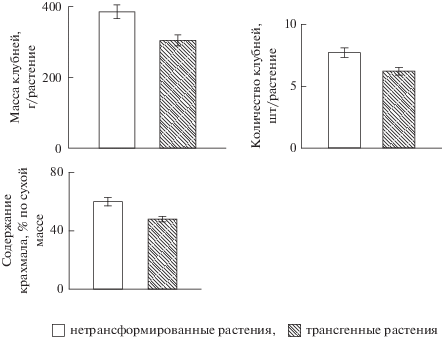
Продуктивность трансгенных растений картофеля, выращенных в почвенной культуре в условиях вегетационного домика при отсутствии пораженности колорадским жуком, была на 21% ниже по сравнению с нетрансформированными растениями (рис. 4). Трансгенные растения отличались меньшим количеством клубней в кусте (на 19%) и пониженным содержанием крахмала (на 20%).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ имеющихся работ по внедрению чужеродных генов в растения картофеля, не связанных с гормональным метаболизмом, свидетельствует о чувствительности их гормональной системы к данной трансформации. При этом следует заметить, что авторы исследуют в основном содержание какой-то одной группы фитогормонов, в основном относящейся к ингибиторам роста. Так, в исследовании (Debast et al., 2011) показано изменение содержания АБК у картофеля с измененным уровнем трегалозо-6-фосфата под влиянием трансформации OtsA-геном. Увеличение уровня АБК отмечено в картофеле, трансформированном СаBZ1-геном, повышающем устойчивость к солевому и осмотическому стрессам (Moon et al., 2015). У модифицированных растений картофеля с уменьшенной экспрессией гена StSYR1, ответственного за устойчивость к фитофторозу, отмечали снижение уровня салициловой кислоты и неизменное содержание жасмоновой кислоты (Eschen-Lippold et al., 2012).
Нами не найдено сведений о действии трансформации Bt-геном растений картофеля на их гормональный статус. Имеется лишь работа, в которой показано, что у трансформированных Bt-геном растений тополя в культуре in vitro увеличивалось содержание ИУК и гибберелловой кислоты (Han et al., 2007).
Проведенное нами исследование показало, что у трансформированных растений картофеля сорта Супериор по гену Bt был иной гормональный баланс по сравнению с нетрансформированными растениями. При этом имела значение фаза онтогенеза. В период вынужденного покоя в глазках клубней трансгенных растений выявлено высокое содержание АБК и меньшее соотношение ИУК/АБК, зеатин/АБК. Через трое суток после начала прорастания глазков у трансгенных растений в меньшей степени увеличилось содержание ауксинов по сравнению с цитокининами. Поэтому отношение ИУК/АБК было существенно ниже, чем зеатин/АБК. Уровень АБК оставался высоким. Иная гормональная ситуация наблюдалась в листьях трансгенных растений в фазе бутонизации. Произошло значительное снижение уровня АБК по сравнению с нетрансформированными растениями и увеличение отношения ИУК/АБК.
Известно, что фитогормоны занимают важное место в эндогенной регуляции фотосинтеза (Якушкина, Похлебаев, 1980; Чернядьев, 2009; Gururani et al., 2015). В ранних исследованиях мы показали, что наивысшему соотношению ИУК/АБК в листьях растений картофеля соответствует максимум фотосинтетической активности, а именно, реакции Хилла, фотофосфорилирования и интенсивности ассимиляции СО2 (Пузина и др., 1998). Выявленное в работе повышение интенсивности ассимиляции 14СО2 у растений картофеля, трансформированных Bt-геном, возможно также связано с увеличением в листьях отношения ИУК/АБК, главным образом, за счет уменьшения уровня АБК.
Вызывает интерес тот факт, что растения картофеля, трансформированные Bt-геном, в условиях почвенной культуры были менее продуктивны по сравнению с нетрансформированными, несмотря на более интенсивный фотосинтез. Возможно, это связано с нарушением инициации процесса клубнеобразования, на что указывает меньшее количество клубней в кусте. Известно, что процесс закладки клубней на столонах во многом зависит от уровня цитокининов (Ewing, Straik, 1992). Трансгенные растения в фазе бутонизации, когда происходит процесс клубнеобразования, характеризовались меньшим содержанием зеатина и низким соотношением зеатин/АБК. Не исключено, что меньшая продуктивность может быть связана и с нарушением донорно-акцепторных отношений. Не всегда существует прямая корреляция между интенсивностью фотосинтеза и продуктивностью сельскохозяйственных растений (Чиков, 2008). Известно, что эндогенная регуляция транспорта ассимилятов зависит, прежде всего, от гормональной ситуации, которая складывается на определенном этапе онтогенеза. Ранее мы выявили, что смена акцепторной функции листа на донорную у картофеля происходит на фоне снижения соотношения ИУК/АБК (Пузина и др., 2000). У растений, трансформированных Bt-геном, в фазе бутонизации, когда интенсивно идет процесс клубнеобразования, этого не наблюдалось. Меньшее содержание крахмала в клубнях трансгенных растений может указывать на торможение оттока ассимилятов из листьев.
Таким образом, в ходе исследования показано, что растения картофеля сорта Супериор, трансформированные Bt-геном, отличаются от нетрансформированных по содержанию и соотношению фитогормонов как на начальном этапе прорастания почек клубней, так и в ходе дальнейшей вегетации растений. При этом отмечена специфичность в гормональном статусе листьев трансгенных растений, проявившаяся в снижении содержания АБК и увеличении отношения ИУК к АБК по сравнению с нетрансформированными растениями, тогда как в прорастающих клубнях наблюдали противоположную картину. Выявлена меньшая продуктивность трансгенных растений картофеля в контролируемых условиях вегетационного опыта, несмотря на некоторое повышение интенсивности процесса фотосинтеза. Одной из вероятных причин снижения продуктивности может быть как нарушение процесса инициации клубнеобразования в условиях меньшего содержания цитокининов, так и снижение оттока ассимилятов в формирующиеся клубни из листьев с высоким соотношением ИУК/АБК.
Список литературы
Абдеев P.M., Мусийчук К.А., Голденкова И.В., Сотченков Д.В., Салехи Джузани Г.Р., Алявина А.К., Загоскина Н.В., Пирузян Э.С. Изменение морфологии и фитогормонального статуса у трансгенных растений табака в результате экспрессии бактериальной термостабильной целлюлазы // Физиология растений. 2004. Т. 51. № 5. С. 714–720.
Аксенова Н.П., Константинова Т.Н., Ложникова В.Н., Голяновская С.А., Гукасян И.А., Гатс К., Романов Г.А. Фотопериодическая и гормональная зависимость клубнеобразования у картофеля, трансформированного геном PHYB Arabidopsis // Физиология растений. 2005. Т. 52. № 5. С. 701–707.
Астахова Н.В., Демин И.Н., Нарайкина Н.В., Трунова Т.И. Влияние гена desA Δ12-ацил-липидной десатуразы на структуру хлоропластов картофеля, в связи с устойчивостью к гипотермии // Физиология растений. 2011. Т. 58. № 1. С. 21–27.
Веселов С.Ю. Использование антител для количественного определения, очистки и локализации регуляторов роста растений. Уфа: БГУ, 1998. 138 с.
Викторов А.Г. Эколого-физиологические особенности Bt-растений, приводящие к вспышкам численности вторичных вредителей // Физиология растений. 2017. Т. 64. № 4. С. 243–250.
Данилова М.Н., Кудрякова Н.В., Дорошенко А.С., Забродин Д.А., Виноградов Н.С., Кузнецов В.В. Молекулярные и физиологические ответы растений Arabidopsis thaliana, дефектных по генам рецепции и метаболизма АБК и цитокининов, на тепловой шок // Физиология растений. 2016. Т. 63. № 3. С. 327–338.
Дерябин А.Н., Трунова Т.И. Морфофизиологические и биохимические характеристики растений картофеля, экспрессирующих ген SUC2 инвертазы Saccharomyces cerevisiae, при выращивании in vitro // Вестник Томского государственного университета. Биология. 2014. Т. 4. № 28. С. 150–168.
Ермошин А.А., Кондратков П.В., Алексеева В.В., Рукавцова Е.Б. Развитие арбускулярной микоризы у трансгенных растений табака с измененным синтезом изопреноидов и растений с гиперпродукцией ауксинов // Вестник Нижегородского университета им. Н.И. Лобачевского. 2013. Т. 1. № 1. С. 146–150.
Загорская А.А., Сидорчук Ю.В., Шумный В.К., Дейнеко Е.В. Динамика ИУК и цитокининов в тканях цветков трансгенных растений табака с мутантным фенотипом // Физиология растений. 2009. Т. 56. № 6. С. 917–925.
Кудоярова Г.Р., Веселов С.Ю., Еркеев М.И., Гюли-Заде В.З., Гимаева Р.М., Загидуллин Н.В., Шакирова Ф.М. Иммуноферментное определение индолилуксусной кислоты в семенах кукурузы с использованием меченых антител // Физиол. растений. 1986. Т. 33. № 6. С. 1221–1227.
Кудоярова Г.Р., Веселов С.Ю., Каравайко Н.Н., Гюли-Заде В.З., Чередова Е.П., Мустафина А.Р., Мошков И.Е., Кулаева О.Н. Иммуноферментная тест-система для определения цитокининов // Физиол. растений. 1990. Т. 37. № 1. С. 193–199.
Петрухин Ю.А., Константинова Л.М. Фотосинтетический метаболизм углерода в листьях хлорофитума // Биологические науки. 1982. № 7. С. 95–99.
Пирузян Э.С., Кобец Н.С., Метт В.Л., Серебрийская Т.С., Неумывакин Л.В., Ализаде Х., Ленец А.А., Симонова М.Л., Шевелуха В.С., Голденкова И.В. Трансгенные растения с экспрессируемыми чужеродными генами как модель для изучения стрессовых ответов и источник создания устойчивых форм // Физиология растений. 2000. Т. 47. № 3. С. 370–381.
Пузина Т.И. Кириллова И.Г., Якушкина Н.И. Влияние ауксина на фотосинтетическую деятельность и рост клубней картофеля // Докл. РАСХН. 1998. № 6. С. 29–31.
Пузина Т.И. Кириллова И.Г., Якушкина Н.И. Динамика индолилуксусной кислоты в органах картофеля на разных этапах онтогенеза и ее роль в регуляции роста клубня // Изв. Академии Наук. Сер. биологическая. 2000. № 2. С. 170–177.
Радов А.С., Пустовой И. В., Корольков А. В. Практикум по агрохимии. М.: Колос, 1971. 335 с.
Чернядьев И.И. Протекторное действие цитокининов на фотосинтетический аппарат и продуктивность растений при стрессе (обзор) // Прикл. биохимия и микробиология. 2009. Т. 45. № 4. С. 389–402.
Чиков В.И. Эволюция представлений о связи фотосинтеза с продуктивностью растений // Физиол. растений. 2008. Т. 55. № 1. С. 140–154.
Якушкина, Н.И., Похлебаев С.М. Особенности гормонального регулирования фотохимической активности хлоропластов // Биол. науки. 1980. № 3. С.67–70.
Catarino R., Ceddia G., Areal F.J., Park J. The impact of secondary pests on Bacillus thuringiensis (Bt) crops // Plant Biotech. J. 2015. V. 13. P. 601–612.
Debast S., Nunes-Nesi A., Hajirezaei M.R., Hofmann J., Sonnewald U., Fernie A.R., Boernke F. Altering trehalose-6-phosphate content in transgenic potato tubers affects tuber growth and alters responsiveness to hormones during Sprouting // Plant Physiol. 2011. V. 156. P. 1754–1771.
Eschen-Lippold L., Lubken T., Smolka U., Rosahl S. Characterization of potato plants with reduced StSYR1 expression // Plant Signal. Behavior. 2012. V. 7. P. 559–562.
Escher N., Kaech B., Nentwig W. Decomposition of transgenic Bacillus thuringiensis maize by microorganisms and woodlice Porcellio scaber (Crustacea: Isopoda) // Basic Appl. Ecology. 2000. № 1. P. 161–169.
Ewing E.E., Struik P.C. Tuber formation in the potato: induction, initiation and growth // Horticultural Rev. 1992. V. 14. P. 89–198.
Giannarelli S., Muscatello B., Bogani P., Spiriti M.M., Buiatti M., Fuoco R. Comparative determination of some phytohormones in wild-type and genetically modified plants by gas chromatography-mass spectrometry and high-performance liquid chromatography-tandem mass spectrometry // Anal. Biochem. 2009. V. 398. P. 60–68.
Gururani, M.A., Mohanta T.K., Bae H. Current understanding of the interplay between phytohormones and photosynthesis under environmental stress // Intern. J. Mol. Sciences. 2015. V. 16. P. 19055–19085.
Han H.-J., Zhang F.-Y., Yang M.-S., Liang H.-Y. and Zhang H.-X. Effects of NaCl stress on the exogenous gene expression in transgenic poplar plants // J. Plant Physiol. Mol. Biology. 2007. V. 33. P. 435–440.
Kolachevskaya O.O., Alekseeva V.V., Sergeeva L.I., Rukavtsova E.B., Getman I.A., Vreugdenhil D., Buryanov Ya.I., Romanov G.A. Expression of auxin synthesis gene tms1 under control of tuber-specific promoter enhances potato tuberization in vitro // J. Integr. Plant Biol. 2015. P. 734–744.
Lumbierres B., Albajes R. and Pons X. Transgenic Bt. maize and Rhopalosiphum padi (Hom., Aphididae) performance // Ecol. Entomol. 2004. P. 309–317.
Moon S.-J., Han S.-Y., Kim D.-Y., Yoon I.S., Shin D., Byun M.-O., Kwon H.-B., Kim B.-G. Ectopic expression of a hot pepper bZIP-like transcription factor in potato enhances drought tolerance without decreasing tuber yield // Plant Mol. Biol. 2015. V. 89. P. 421–431.
Nishiyama R., Watanabe Y., Fujita Y., Le D.T., Kojima M., Werner T., Vankova R., Yamaguchi-Shinozaki K., Shinozaki K., Kakimoto T., Sakakibara H., Schmülling T. and Tran L.S. Analysis of cytokinin mutants and regulation of cytokinin metabolic genes reveals important regulatory roles of cytokinins in drought, salt and abscisic acid responses, and abscisic acid biosynthesis // Plant Cell. 2011. P. 2169–2183.
Scalabrin E., Radaelli M., Capodaglio G. Simultaneous determination of shikimic acid, salicylic acid and jasmonic acid in wild and transgenic Nicotiana langsdorffii plants exposed to abiotic stresses // Plant Phys. Biochem. 2016. P. 53–60.
Xu C., Cheng J.H., Lin H.Y., Lin C.Y., Gao J.H., Shen Z.C. Characterization of transgenic rice expressing fusion protein Cry1Ab/Vip3A for insect resistance // Sci. Reports. 2018. P. 1–8.
Watanabe T., Kuribara H., Mishima T, Kikuchi H., Kodama T., Futo S., Kasama K., Toyota A., Nouno M., Saita A., Takahashi K., Hino A., Akiyama H., Maitani T. New qualitative detection methods of genetically modified potatoes // Biol. Pharmac. Bulletin. 2004. V. 27. P. 1333–1339.
Zwahlen C., Hilbeck A., Gugerli P., Nentwig W. Degradation of the Cry1Ab protein within transgenic Bacillus thuringiensis corn tissue in the field // Mol. Ecology. 2003. V. 12. P. 765–775.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая