Известия РАН. Серия биологическая, 2021, № 5, стр. 495-506
Преобладание самок в некоторых выборках сеголеток и производителей трехиглой колюшки Gasterosteus aculeatus обусловлено не генетическими, а экологическими факторами
В. С. Артамонова 1, Н. В. Бардуков 1, П. В. Головин 2, Т. С. Иванова 2, М. В. Иванов 2, Д. Л. Лайус 2, А. А. Махров 1, 2, *
1 ФГБУН Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский проспект, 33, Россия
2 С.-Петербургский государственный университет
199934 Санкт-Петербург, Университетская наб., 7/9, Россия
* E-mail: makhrov12@mail.ru
Поступила в редакцию 02.08.2020
После доработки 12.12.2020
Принята к публикации 12.12.2020
Аннотация
В настоящей работе с помощью генетических маркеров (полоспецифичные локусы Ga1 и Ga2) было изучено соотношение полов в выборках, собранных на разных этапах онтогенеза трехиглой колюшки. В потомстве всех самок, тестированных индивидуально, присутствовали как самки, так и самцы, а достоверных отклонений от 1:1 в соотношении полов в развивающейся икре из природных гнезд не выявлено. Равное соотношение полов у молоди сохранялось, по крайней мере, в течение первых полутора–двух месяцев жизни, но в дальнейшем у сеголеток на нерестилищах доля самок достоверно превышала долю самцов (этот факт отмечен впервые). Среди производителей преобладали самки – это связано, в значительной мере, с преимущественной элиминацией самцов в нерестовый и постнерестовый периоды, вероятные причины которой обсуждаются в работе.
Трехиглая колюшка – один из модельных объектов популяционной биологии (обзоры: Зюганов, 1991; Paepke, 1996; Östlund-Nilsson et al., 2007; Bell, Aguirre, 2013; Hendry et al., 2013), а для специалистов в области эволюционных исследований – даже “супермодельный” (Gibson, 2005). Этот вид, способный размножаться как в пресной, так и соленой воде, играет важную роль не только в речных и озерных, но и в морских экосистемах. Так, в последнее десятилетие трехиглая колюшка стала самым многочисленным видом рыб в Белом море (Ivanova et al., 2016; Лайус и др., 2020; Lajus et al., 2020).
Для представителей данного вида характерно сложное нерестовое поведение, в частности, охрана самцом территории на нерестилище и постройка гнезда, куда откладывают икру 3–5 самок, для которых, как считается, характерен порционный нерест (Зюганов, 1991). Впоследствии самцы охраняют не только развивающуюся икру, но и вышедших из нее личинок до их перехода на внешнее питание.
Во многих выборках производителей трехиглой колюшки отмечено выраженное отклонение в соотношении полов в пользу самок (Мухомедияров, 1966; Aneer, 1973; Hagen, Gilberton, 1973; Kynard, 1978; Arnold et al., 2003; Пичугин и др., 2003; Saat, Turovski, 2003; Niksirat et al., 2010; Patimar et al., 2010; Yershov, Sukhotin, 2015; Rollins et al., 2017; Golovin et al., 2019). Объяснения этого явления в литературе нам найти не удалось. Между тем, соотношение полов особей – важнейшая характеристика, от которой напрямую зависит популяционная плодовитость и, соответственно, характер динамики численности популяций колюшек (Wootton et al., 1995).
На соотношение полов у рыб может влиять ряд причин. С одной стороны, генетические механизмы определения пола у низших позвоночных несовершенны, и, кроме того, значительное влияние на формирование пола в онтогенезе могут оказывать факторы среды, в связи с чем у рыб может наблюдаться несоответствие генетического пола фенотипическому (обзоры: Брыков, 2014; Heule et al., 2014). Гипотеза о смене пола в онтогенезе у трехиглой колюшки высказана в работе Lindsey (1962). Смена пола наблюдалась в экспериментах по воздействию стероидных гормонов на особей этого вида на ранних стадиях онтогенеза (Hahlbeck et al., 2004).
Кроме того, у рыб достаточно широко распространен гиногенез, при котором все потомки некоторых самок оказываются самками (обзор: Devlin, Nagahama, 2002). У трехиглой колюшки гиногенетическое потомство получено экспериментально (Samonte-Padilla et al., 2011). Недавно описан интересный факт развития икры в полости тела самки трехиглой колюшки из природной популяции: хотя часть этих эмбрионов имели отца, из 56 изученных особей 42 были генетическими самками (Dean et al., 2019).
И, наконец, самцы и самки у некоторых видов рыб сильно отличаются по своему поведению, и, следовательно, пространственному распределению, что может оказывать влияние на соотношение полов в выборке, собранной в определенной точке в то или иное время года. К тому же, различия в поведении могут приводить к разной продолжительности жизни самцов и самок, а это оказывает влияние на соотношение полов во всей популяции (обзор: Wootton, Smith, 2015). Такое объяснение преобладания самок у производителей было предложено и для трехиглой колюшки (см. ссылки в работе: Golovin et al., 2019).
Целью данной работы стала проверка гипотез о влиянии перечисленных выше причин на соотношение полов в популяции трехиглой колюшки, в которой регулярно регистрировали примерно двукратное преобладание самок на нерестилищах (Golovin et al., 2019). Для этого мы проверили соответствие фенотипического пола генетическому у производителей, чтобы исключить возможность переопределения пола рыб в онтогенезе (гипотеза 1). Далее, было установлено соотношение полов в развивающейся икре трехиглой колюшки, с целью выяснить, наблюдается ли у этого вида естественный гиногенез (гипотеза 2). Наконец, мы собрали материал по соотношению полов в разных возрастных группах колюшки для проверки гипотезы о различии в темпе роста и миграционном поведении самцов и самок и/или выявления различий в их выживаемости, начиная со стадии личинки до возраста 1 год и половозрелости (гипотеза 3).
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили в лагуне Колюшковая, расположенной в Керетском архипелаге Кандалакшского залива Белого моря, на побережье Республики Карелия (субъект Российской Федерации). В ранних работах (например, Rybkina et al., 2016) это местообитание называли безымянной лагуной. Детальная характеристика колюшки этой лагуны дана в работе (Golovin et al., 2019). Для сравнения взяты выборки из трех других участков беломорского побережья. Места сбора проб показаны на рис. 1. Рыб отлавливали неводом длиной 7.5 м, высотой 1.5 м, с ячеей в крыльях 5 мм, в куту –1 мм.
Рис. 1.
Места сбора выборок: 1a – лагуна Колюшковая (66°18.787′ N; 33°38.790′ E); 1б – пролив Сухая Салма (66°18.608′ N; 33°39.114′ E); 2 – губа Кислая (66°31.954′ N; 33°6.338′ E); 3 – губа Сельдяная (66°20.255′ N; 33°37.401′ E); 4 – о. Кондостров (64°13.305′ N; 36°37.390′ E).
При изучении соответствия фенотипического пола генетическому, из выборки, где доля фенотипических самок составляла 70%, были отобраны зрелые самцы (n = 50) и самки (n = 50) трехиглой колюшки. Производители были отловлены 22 июня 2014 г. в лагуне Колюшковая. Для того, чтобы исключить ошибки при определении фенотипического пола, все особи, взятые для генетических исследований, были вскрыты: половую принадлежность подтверждали на основании визуального анализа гонад.
Сбор развивающейся икры для определения соотношения полов на стадии эмбриогенеза проводили 28 июня 2014 г. в лагуне Колюшковая. Три гнезда колюшек были локализованы по характерному поведению самца, икра собрана вручную. Дополнительно, с целью выявления гиногенетических самок в популяции лагуны Колюшковая и оценки соотношения полов на стадии эмбриогенеза, было выполнено искусственное осеменение икры четырех самок из данной популяции (каждую партию осеменяли спермой одного самца). Из каждой партии развивающейся икры 28 июня 2014 г. для генетического анализа было взято по 4–7 эмбрионов (всего 23 эмбриона).
В 2014 г. сеголетки колюшки были собраны в четырех локальностях: Кондостров (5 августа, 44 особи), губа Сельдяная (20 августа, 80 особей), лагуна Колюшковая (20 августа, 41 особь), губа Кислая (16 сентября, 43 особи). Рыбы были пойманы мальковым неводом 7.5 × 1.5 м с мельничным газом в кутке или сачком из мельничного газа диаметром 30 см.
В 2015 г. выборки сеголетков отбирали в лагуне Колюшковая 27 июня (94 особи) и 15 июля (33 особи). Мелких неполовозрелых рыб (всего 65 особей) отобрали при облове, проведенном с целью количественного учета производителей трехиглой колюшки в лагуне Колюшковая 15 июня. Они не имели брачной окраски. Их возраст (годовики) был подтвержден анализом отолитов (Yurtseva et al., 2019).
Сроки начала нереста в 2014 и 2015 гг. соответствовали среднегодовым, т.е. первые производители появлялись на нерестилищах 2–4 июня, а 6–8 июня нерестилища оказывались заполненными колюшкой.
15–25 июня 2018 г. были собраны выборки половозрелых годовиков трехиглой колюшки в трех местообитаниях: лагуне Колюшковая (34 особи), Сельдяной губе (86 особей), и проливе Сухая Салма (29 особей). Половую принадлежность этих особей определяли на основании визуального анализа гонад.
Ткани половозрелых рыб, развивающуюся икру и молодь трехиглой колюшки, предназначенные для генетического анализа, фиксировали 96%-ным этанолом в соотношении не менее чем 1 : 5 и доставляли в лабораторию. Фиксированную молодь затем фотографировали на фоне размерной шкалы, последующие измерения их длины выполняли по фотографиям с точностью до 0.5 мм.
ДНК из фиксированных тканей выделяли с помощью набора “К-сорб” (“Синтол”) согласно рекомендациями производителя. Для определения генетического пола было выполнено тестирование двух локусов: Ga1, длина последовательности которого различается в X- и Y-хромосомах, и Ga2, который имеется только в Y-хромосоме (Griffiths et al., 2000).
При сравнении длины рыб в разных выборках использован t-тест Стьюдента. При объединении выборок разноразмерных рыб проводили их стандартизацию, т.е. делили длину каждой особи на среднюю длину рыб в выборке. Для статистической оценки отличий распределения полов в выборке от теоретического соотношения 1 : 1 использовали тест Хи-квадрат. Статистическая обработка данных была выполнена с использованием программ Statistica 7 и Past 4.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
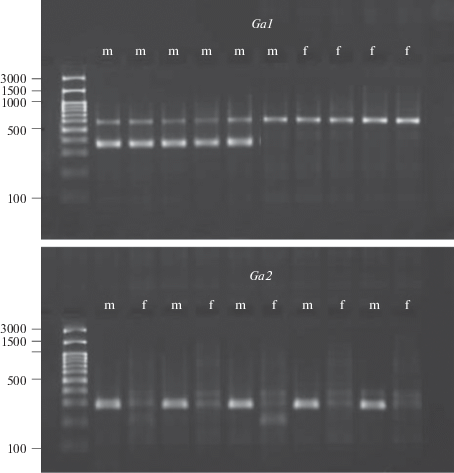
Половозрелые особи. Генотипирование половозрелых особей, собранных в лагуне Колюшковая, показало, что генетический пол всегда совпадал с фенотипическим; особей, для которых было бы обнаружено переопределение пола в онтогенезе, выявлено не было. При этом для всех 100 особей результаты определения пола на основании данных для локусов Ga1 and Ga2 совпадали. Примеры тестирования данных локусов у фенотипических самцов и самок приведены на рис. 2.
Рис. 2.
Пример тестирования генетического пола производителей трехиглой колюшки (ПЦР с праймерами для полоспецифичных локусов). Ga1, Ga2 – тестированные полоспецифичные локусы; m – фенотипические самцы, f – фенотипические самки. Слева указаны длины некоторых фрагментов маркера (п.н.), имеющего шаг 100 п.н. в диапазоне от 100 до 1000 п.н. и дополнительные фрагменты 1500 и 3000 п.н.
Эмбрионы. Соотношение полов у эмбрионов трехиглой колюшки ни в одной из исследованных нами естественных кладок икры достоверно не отличалось от 1 : 1 (табл. 1), хотя в одной из кладок (№ 1) заметно преобладали самцы.
Таблица 1.
Соотношение полов развивающихся эмбрионов из природных гнезд трехиглой колюшки, собранных в лагуне Колюшковая
| № гнезда | Количество самок | Количество самцов | Отклонение от 1 : 1 (тест Хи-квадрат, p-значение) |
|---|---|---|---|
| 1 | 29 | 44 | 0.21 |
| 2 | 32 | 28 | 0.71 |
| 3 | 31 | 29 | 0.86 |
В потомстве всех четырех самок, икра которых была оплодотворена искусственно, были выявлены как самки, так и самцы, т.е. гиногенетические самки среди производителей отсутствовали. Анализ в данном случае проводили до обнаружения в потомстве, по крайней мере, одного эмбриона каждого пола. Всего было проанализировано 23 эмбриона, среди которых оказалось 11 самок и 12 самцов (p = 0.83).
Таким образом, на стадии эмбриогенеза у потомков производителей трехиглой колюшки лагуны Колюшковая доли самцов и самок не имели статистически достоверных отличий от равновесного соотношения полов 1 : 1.
Соотношение полов у молоди. Результаты тестирования пола молоди, собранной в четырех различных локальностях в 2014 г., представлены на рис. 3. Средняя длина рыб в выборках варьировала от 18.3 ± 0.25 мм до 23.9 ± 0.28 мм (табл. 2). Хорошо видно, что соотношение полов в разных выборках заметно различается. При этом в двух выборках (из лагуны Колюшковая и района Кондострова) доля самок достоверно превышала долю самцов (в обоих случаях p < 0.05). Для совокупности всех четырех изученных выборок преобладание самок среди сеголеток также было достоверным (p = 0.0073).
Рис. 3.
Доли самцов (серый цвет) и самок (белый цвет) в выборках трехиглой колюшки Белого моря, собранных в августе–сентябре 2014 г. на разных нерестилищах. KO – Кондостров (5 августа), SG –губа Сельдяная (20 августа), KL – лагуна Колюшковая (20 августа), KG – губа Кислая (16 сентября).
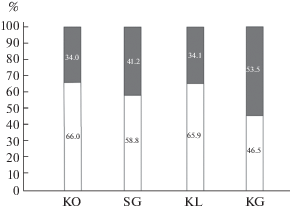
Таблица 2.
Основные характеристики изученных выборок молоди трехиглой колюшки
| Место сбора | Дата сбора | Стадия | Число самок | Число самцов | Доля самок | Отклонение от 1 : 1 (тест Хи-квадрат, p-значение) | Средняя длина самок | Средняя длина самцов | t-test сравнение размеров |
|---|---|---|---|---|---|---|---|---|---|
| Колюшковая лагуна | 27.06.2015 | Предличинки | 29 | 23 | 55.8 | 0.41 | 5.66 ± 0.135 | 5.93 ± 0.176 | 0.112 |
| Колюшковая лагуна | 27.06.2015 | Личинки | 26 | 32 | 44.8 | 0.43 | 7.51 ± 0.097 | 7.6 ± 0.176 | 0.248 |
| Колюшковая лагуна | 15.07.2015 | Ранние сеголетки | 17 | 16 | 51.5 | 0.86 | 11.9 ± 0.841 (n = 9) | 12.57 ± 0.176 (n = 9) | 0.319 |
| Колюшковая лагуна | 20.08.2014 | Поздние сеголетки | 27 | 14 | 65.9 | 0.029 | 18.35 ± 0.304 | 18.18 ± 0.176 | 0.745 |
| Кондостров | 05.08.2014 | Поздние сеголетки | 31 | 16 | 66.0 | 0.042 | 18.61 ± 0.382 | 18.4 ± 0.176 | 0.755 |
| Сельдяная губа | 20.08.2014 | Поздние сеголетки | 47 | 33 | 58.8 | 0.12 | 19.07 ± 0.304 | 19.91 ± 0.176 | 0.058 |
| Кислая губа | 20.09.2014 | Поздние сеголетки | 20 | 23 | 46.5 | 0.65 | 24.03 ± 0.401 (n = 18) | 23.71 ± 0.176 (n = 17) | 0.578 |
| Колюшковая лагуна | 15.06.2015 | Годовики (неполовозрелые) | 35 | 30 | 53.8 | 0.53 | – | – | – |
| Колюшковая лагуна | 15–25.06.2018 | Годовики (половозрелые) | 21 | 13 | 61.8 | 0.17 | – | – | – |
| Сельдяная губа | 15–25.06.2018 | Годовики (половозрелые) | 44 | 42 | 51.2 | 0.83 | – | – | – |
| Пролив Сухая Салма | 15–25.06.2018 | Годовики (половозрелые) | 12 | 17 | 41.4 | 0.35 | – | – | – |
В то же время необходимо отметить, что выборки, собранные в 2014 г., различались между собой как временем, так и местами сбора материала (рис. 3), что не давало возможности оценить, как менялось соотношение полов во времени.
С целью выявления динамики изменения соотношения полов у молоди, в 2015 г. в лагуне Колюшковая были собраны дополнительные выборки, которые различались только временем сбора материала. Результаты тестирования пола молоди из этой локальности приведены на рис. 4.
Рис. 4.
Доли самцов (серый цвет) и самок (белый цвет) в выборках сеголеток трехиглой колюшки разного возраста, собранных в лагуне Колюшковая. KL1 – 27.06.2015 (KL1a – личинки с нерассосавшимся желточным мешком, KL1b – личинки с рассосавшимся желточным мешком), KL2 – 15.07.2015, KL3 – 20.08.2014.
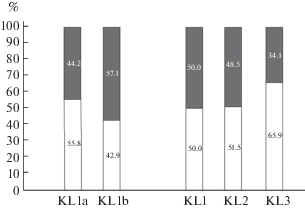
Данные по соотношению полов в выборках молоди трехиглой колюшки, собранной в июне, июле и августе из лагуны Колюшковая, показывают, что в июне и июле соотношение полов у молоди не отклоняется от 1 : 1, а к концу августа в районе нерестилища наблюдается достоверное преобладание самок (p = 0.042).
В то же время мы определили, что выборка неполовозрелых годовиков трехиглой колюшки включала 35 самок и 30 самцов, т.е. в процентном выражении соотношение полов составляло 53.8:46.2. Это соотношение не отличалось достоверно от 1 : 1, как не отличалось достоверно от 1 : 1 и соотношение полов у половозрелых годовиков (табл. 2).
Для интерпретации полученных результатов особенно важна выборка, собранная 27 июня 2015 г., представленная личинками с желточным мешком, и личинками, у которых желточный мешок к моменту отлова уже успел рассосаться: среди первых преобладали самки, а среди вторых – самцы (рис. 4). Хотя различие между этими двумя группами не было достоверным (p > 0.05), это позволило нам сделать осторожное предположение, что самцы трехиглой колюшки развиваются быстрее самок, и мы проверили это предположение, сравнив средние линейные размеры самцов и самок в выборках молоди возраста 0+.
Размеры молоди разного пола. Данные о длинах молоди возраста 0+ разного пола приведены в табл. 2. При анализе этого материала становится ясным, что тенденция к более быстрому росту самцов проявляется только в выборках молоди, собранных в июне и июле.
Во всех таких группах самцы, в среднем, оказывались крупнее самок, хотя ограниченные объемы выборок и использованный нами способ измерения длины фиксированных сеголеток по фотографиям с точностью до 0.5 мм не позволили показать, что для каждой конкретной выборки эти различия статистически значимы. При объединении выборок сеголеток, собранных в лагуне Колюшковая в июне и июле, после их стандартизации по средней длине эти различия также оказались статистически недостоверны (т-тест, p = 0.168).
В выборках сеголеток старших возрастов, собранных в августе–сентябре 2014 г. в разных локальностях (Кондостров, лагуна Колюшковая, губа Кислая) средние размеры самцов и самок практически не различались для всех изученных выборок, а также для их совокупности, в то время как соотношение полов, как было отмечено выше, достоверно сдвигалось в пользу самок. Исключением является выборка из губы Сельдяная, где самцы были крупнее самок (p = 0.058).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проверка гипотез, объясняющих преобладание самок на нерестилищах. Полученные данные позволили отвергнуть две из трех гипотез, которые были выдвинуты, чтобы объяснить двукратное преобладание самок среди половозрелых производителей трехиглой колюшки на нерестилищах.
Во-первых, мы предполагали, что на формирование фенотипического пола у трехиглой колюшки могут оказывать влияние внешние условия, что должно приводить к несоответствию генетического пола фенотипическому, как это иногда наблюдается у рыб других видов (Devlin, Nagahama, 2002).
Несмотря на то, что у многих видов рыб половые хромосомы не выражены цитологически (Брыков, 2014), у трехиглой колюшки они были выявлены (Yoshida et al., 2014), и некоторые последовательности ДНК, локализованные в Y-хромосоме, хорошо известны (Griffiths et al., 2000; Peichel et al., 2004; Toli et al., 2016; Bakker et al., 2017).
Тестирование, базирующееся на идентификации полоспецифических последовательностей, проведенное нами на материале 100 производителей трехиглой колюшки показало, что пол рыб, определенный по внешним признакам, всегда совпадал с генетическим полом. Это согласуется с данными, представленными в ряде других работ (Griffiths et al., 2000; Arnold et al., 2003; Hahlbeck et al., 2004; Bakker et al., 2017; Velando et al., 2017). Не было обнаружено переопределения пола у этого вида и в эксперименте, в котором из группы рыб удаляли созревающих самцов (Bakker, 2016).
Совокупность всех этих данных показывает, что переопределения пола под действием факторов среды у трехиглой колюшки в норме не происходит. Исключение – эксперименты по воздействию на нее химических веществ на ранних стадиях онтогенеза. Так, изменение пола рыб и появление интерсексов было зарегистрировано после воздействия на трехиглую колюшку стероидных гормонов (steroid hormones) (Hahlbeck et al., 2004). Кроме того, был отмечен факт изменения пола у трех особей колюшки в эксперименте по воздействию на рыб перхлората натрия на ранних стадиях развития (Furin et al., 2015). В другом опыте по влиянию этого соединения были выявлены три гермафродита, оказавшиеся генетическими самками (Bernhardt et al., 2006).
Таким образом, гипотеза 1, объясняющая преобладание самок в популяции возможностью переопределения пола у трехиглой колюшки в естественных местообитаниях, не подтверждается.
Во-вторых, мы проверили гипотезу, которая недавно обсуждалась в работе (Dean et al., 2019), о присутствии в популяции гиногенетических самок. Несмотря на то, что в эксперименте у трехиглой колюшки удавалось получить искусственный гиногенез (Samonte-Padilla et al., 2011), во всех изученных нами кладках икры, как естественных, так и искусственных, были обнаружены самцы. Учитывая, что естественные кладки могут содержать икру от нескольких самок (до 6–7, Зюганов, 1991), среди которых могут оказаться гиногенетики (исходя из соотношения полов производителей в изученной популяции, такой должна была оказаться каждая вторая-третья самка), мы предполагали, что это должно привести, по крайней мере, к преобладанию самок среди эмбрионов. Однако такого преобладания ни в одном из трех природных гнезд обнаружено не было.
Наши данные согласуются с результатами, полученными другими авторами, которые показали, что самцы присутствовали в потомстве соответственно всех девяти (Hahlbeck et al., 2004) и двух (Peichel et al., 2004) пар производителей трехиглой колюшки.
Все это позволяет исключить гиногенез как причину преобладания самок среди производителей трехиглой колюшки, т.е. отвергнуть гипотезу 2.
Согласно гипотезе 3, преобладание самок среди производителей, отловленных на нерестилищах, может объясняться либо различием в пространственном распределении самцов и самок, либо отбором против самцов, который, в свою очередь, также может объясняться различием в поведении особей разного пола. В случае наличия отбора мы планировали выяснить, начинается ли этот процесс на первом году жизни трехиглой колюшки, или же он происходит позже, когда рыбы становятся половозрелыми.
Выполненные исследования показали, что на ранних стадиях онтогенеза у колюшки соотношение полов остается близким к 1 : 1, по крайней мере, в течение первых полутора–двух месяцев жизни. В августе молодь, достигшая 20–25 мм в длину, начинает постепенно мигрировать с нерестилищ (Bakhvalova et al., 2016), и в этот же период на нерестилищах регистрируется достоверное преобладание самок.
Данное явление можно объяснить, предположив, что самцы трехиглой колюшки растут быстрее самок, и их миграция начинается раньше, а также допустив, что триггером для миграции является достижение определенной длины тела. Однако статистически подтвердить эту гипотезу нам пока не удалось, возможно, в силу ограниченности объема выборок. Стоит отметить, что после начала миграции части молоди с нерестилищ, никаких различий в размерах самцов и самок, еще остающихся в лагуне Колюшковая, мы также не зарегистрировали, как и различий в размерах молоди из других местообитаний, собранной в августе–сентябре (исключение – выборка из губы Сельдяная).
Косвенно гипотезу о более ранней миграции крупных самцов с нерестилищ может подтвердить примерно равное соотношение полов в выборке неполовозрелых годовиков, собранных в июне 2015 г., и выборках половозрелых годовиков, собранных в июне 2018 г. при облове нерестилищ. Ранее этот факт был отмечен при исследовании фенотипического пола годовиков колюшки Белого моря (Golovin et al., 2019).
В то же время следует отметить, что изучение соотношения полов у молоди каждой конкретной популяции в возрасте одного года представляет собой отдельную, достаточно сложную задачу. Это обусловлено тем, что у беломорской колюшки, в том числе, и в подробно изученной нами популяции лагуны Колюшковая, только часть самцов и самок становятся половозрелыми в возрасте одного года. Другие рыбы того же возраста остаются неполовозрелыми, причем не все они подходят к берегу и могут быть отловлены в районе нерестилищ (Ivanova et al., 2016). С учетом сказанного, полностью исключать преобладание самок среди годовиков трехиглой колюшки данной популяции было бы все-таки преждевременно.
Таким образом, наши исследования показывают, что у трехиглой колюшки лагуны Колюшковая наблюдается выраженная тенденция более быстрого развития и роста самцов по сравнению с самками того же возраста, что, по-видимому, приводит к более ранней миграции самцов в открытое море; окончательные выводы можно будет сделать только после дополнительных, более масштабных исследований этого вопроса на свежем материале и при повышении точности измерений, по крайней мере, до 0.1 мм. В данном исследовании нам не удалость обнаружить факты, которые свидетельствовали бы об отборе против самцов на первом году жизни особей, до наступления половозрелости, однако исключить то, что это явление все-таки имеет место, начиная с момента ухода молоди с нерестилищ, нельзя.
Полученные нами данные говорят о том, что объяснение двукратного преобладания самок на нерестилище трехиглой колюшки в лагуне Колюшковая следует искать в рамках гипотезы 3: вероятно, оно обусловлено различиями в поведении самцов и самок, что, в свою очередь, может приводить к отбору против самцов.
Такой вывод согласуется с данными, имеющимися в литературе. Так, в исследованиях, проведенных на сеголетках, выращенных искусственно, значимых различий в размерах или массе тела самцов и самок на первом году жизни выявлено не было (Bell et al., 2011; Ramler et al., 2014; Velando et al., 2017), однако, в одной из работ отмечено, что, размер самцов в возрасте 300 дней был значимо больше при выращивании молоди в присутствии хищника, в то время как на размеры самок присутствие хищника значимого влияния не оказывало (Bell et al., 2011). Уже в возрасте 100 дней отмечены различия в морфологических признаках у самцов и самок трехиглой колюшки – в частности, самцы имеют более длинные спинной, хвостовой и анальный плавники (Ramler et al., 2014), что согласуется с гипотезой о разной скорости развития представителей разных полов, с возможностью проявления различий в их поведении уже на ранних этапах онтогенеза.
Возможные причины преимущественной элиминации самцов. Преимущественная элиминация самцов – практически единственное возможное объяснение преобладания самок среди производителей трехиглой колюшки. Доказательством этого, кроме приведенных выше данных, служит бóльшая доля самок среди колюшек возраста 3 года, по сравнению с колюшками возраста 2 года, выявленная как в двух популяциях Балтики, обитающих у побережья Эстонии (Saat, Turovski, 2003), так и в Белом море (Yershov, Sukhotin, 2015).
С высокой степенью вероятности именно преимущественной гибелью самцов объясняется и преобладание самок среди рыб, выживших в экспериментах по изучению влияния на трехиглую колюшку выращивания при различной температуре и солености (Lindsey, 1962). Упомянутый автор допускал в качестве объяснения этих результатов и фенотипическое переопределение пола, но это явление, как мы показали выше, у трехиглой колюшки не наблюдается.
Анализ литературы позволяет выделить четыре возможных причины преимущественной гибели самцов.
1. У самок и самцов трехиглой колюшки в некоторых популяциях преобладают разные виды паразитов, в частности, у самцов чаще встречается цестода Cyathocephalus truncatus, трематода Bunodera (Reimchen, Nosil, 2001) и микроспоридия Glugea anomala (Arnold et al., 2003), а смертность рыб, зараженных разными паразитами, может быть различна сама по себе, даже если не принимать во внимание, что различный состав паразитофауны может свидетельствовать о длительном пребывании представителей разных полов в разных биотопах, где они подвержены элиминации в разной степени, или о разном иммунном статусе самцов и самок. Однако первые два паразита в Белом море отсутствуют, а последний у беломорской трехиглой колюшки встречается редко (Шульман, Шульман-Альбова, 1953; Rybkina et al., 2016), поэтому избирательная гибель самцов из-за большей степени заражения указанными паразитами для изученной нами популяции маловероятна.
2. В условиях эксперимента показано, что самцы в возрасте пяти месяцев были значительно смелее (bolder) и светлее (paler), чем самки (Velando et al., 2017). Неудивительно, что самцы-сеголетки чаще поедаются хищниками, чем самки, по крайней мере, в экспериментальных условиях (Bell et al., 2011). При этом важно отметить, что если в июле в желудках хищных рыб Белого моря молодь колюшки не обнаруживается, то в начале августа она составляет значительную часть рациона трески (Gadus morhua) и наваги (Eleginus nawaga); у последнего вида она становится основным кормовым объектом (Bakhvalova et al., 2016).
Интенсивное выедание хищниками может быть актуально и для половозрелых самцов. Учитывая особенности их поведения (они защищают гнезда с развивающейся икрой и личинками), вполне вероятно и их преимущественное уничтожение хищниками. До недавнего времени это объяснение не находило подтверждения: соотношение полов трехиглой колюшки в желудках радужной форели Parasalmo mykiss (Walbaum, 1792) из Lake Wapato (State Washington, USA) было таким же, как и в выборках рыб, отловленных непосредственно в этом озере (Hagen, Gilbertson, 1973). Более того, в небольших водоемах, расположенных в эстуарии реки Святого Лаврентия (Канада), в нерестовый период выживаемости самцов и самок колюшки оказались почти одинаковыми – 82% у самцов и 83% у самок, а в аналогичных водоемах, защищенных от птиц, выжили все самцы и 90% самок (Whoriskey, FitzGerald, 1985).
Однако в экспериментальных группах трехиглой колюшки, из которых рыб удаляли случайным образом, доля самок увеличивалась: среди отловленных рыб преобладали самцы (Bakker, 2016). В специальном эксперименте по отлову проявилась сходная, но не значимая тенденция, однако, в этой работе (King et al., 2013) отмечено, что поведение самцов и самок трехиглой колюшки различно – взрослые самцы, в целом, смелее самок.
Кроме того, в литературе отмечено, что в период нереста самцы окрашены значительно ярче, чем самки, они защищают гнездо с икрой, и их реакции, нацеленные на самосохранение (anti-predator behavior), ослаблены (Huntingford et al., 1994). К тому же и результаты полевых исследований и эксперименты показали, что хищники в большей степени поедают ярко окрашенных самцов трехиглой колюшки, чем самцов и самок с неяркой окраской (Johnson, Candolin, 2017).
Недавнее исследование, проведенное в Белом море в период нереста трехиглой колюшки, показало, что доля взрослых самцов в желудках хищных рыб значительно выше, чем доля самцов в море. Однако влияние хищников на численность колюшки в этот период, скорее всего, невелико, и поэтому доля самцов среди производителей не меняется в течение нерестового периода (Golovin et al., 2019).
3. Как показывают наблюдения, к концу нереста индекс наполнения желудков у взрослых самцов колюшки значительно ниже, чем у взрослых самок на всех трех изученных нерестилищах Белого моря, исследованных в работе (Демчук и др., 2018). Это может приводить к повышенной посленерестовой смертности самцов в результате истощения. Хотя в целом доля погибших особей колюшки на нерестилищах в Белом море довольно низкая – менее 1%, локальная смертность самцов превышает таковую для самок; эта тенденция может продолжаться и в период времени после отхода рыб в открытое море, где ее оценивать технически гораздо сложнее (Golovin et al., 2019).
4. Возможно, существует еще одна причина отбора против самцов, хотя данное предположение, высказанное совсем недавно, требует последующего детального изучения. В работе (Bissegger et al., 2020) было показано, что у трехиглой колюшки наблюдается различие в частотах аллелей многих генов между выборками самок и самцов из одной популяции (модальное различие (median magnitude) этих частот составляет 0.053). Для объяснения этого факта было высказано предположение, что в Y-хромосому этого вида регулярно переносятся гены из аутосом, и в Y-хромосоме эти гены быстро мутируют (Bissegger et al., 2020). Если это предположение верно, то в дальнейшем может оказаться, что многие из этих мутаций приводят к тому, что продукты мутантных генов плохо совместимы с продуктами тех генов, которые задействованы вместе с ними в некоем физиологически важном процессе, а потому жизнеспособность самцов может оказаться пониженной.
Отметим, что гипотеза о более быстрой эволюции Y-хромосомы при мужской гетерогаметности была ранее высказана В.А. Геодакяном (1996), который исходил из представления о том, что самцы являются полом, отвечающим за эволюционные инновации.
ЗАКЛЮЧЕНИЕ
Обнаруженное нами преобладание самок над самцами в некоторых выборках поздних сеголеток трехиглой колюшки ранее не описано в литературе. Однако этот факт согласуется с отмеченным ранее четким различием между самками и самцами этого вида по морфологическим признакам, проявляющимся уже в возрасте 100 дней, задолго до полового созревания. Аналогичных примеров в литературе по другим видам рыб нам найти не удалось.
Следует отметить, что интенсивный отбор против самцов, которым, как мы показали, только и может объясняться двукратное преобладание самок среди производителей трехиглой колюшки – явление, которое может быть адаптивно-важным для популяции в целом, причем возможность такого отбора в каждом поколении, судя по всему, обусловлена генетически.
В результате, за счет элиминации большого количества самцов, отбор способен очень быстро менять частоты аллелей различных генов в популяции, что обеспечивает быструю адаптацию этой популяции к меняющимся условиям среды на генетическом уровне. Судя по всему, такой механизм адаптации популяций должен быть очень эффективен для короткоцикловых организмов, к которым относится и трехиглая колюшка. При этом, в случае изменения условий среды, отбор в следующем поколении может пойти в обратном направлении.
Преимущественный отбор против самцов, как и отбор в пользу гетерозигот, известный у ряда организмов, может быть назван “сизифовым циклом”, однако оба эти явления не бесполезны. Хотя при отборе в пользу гетерозигот в следующем поколении в популяции снова восстанавливается исходное соотношение гомозигот и гетерозигот, тем не менее, такой цикл обеспечивает близкие частоты аллелей целого ряда генов, важных для адаптации к меняющимся условиям среды. Преимущественный отбор против самцов, при том, что в следующем поколении доли самцов и самок снова выравниваются, может обеспечить быстрое изменение частот аллелей различных генов без снижения воспроизводительной способности популяции.
Важно подчеркнуть, что высокая наследуемость количественных признаков и вызванная этим высокая эффективность отбора по этим признакам – характерные особенности трехиглой колюшки; для большинства видов рыб они не описаны.
Работа выполнена при финансовой поддержке гранта РНФ (19-14-00092).
Список литературы
Брыков В.А. Механизмы определения пола у рыб: эволюционные и практические аспекты // Биология моря. 2014. Т. 40. № 6. С. 417–426.
Геодакян В.А. Половые хромосомы: для чего они? (новая концепция) // Докл. АН. 1996. Т. 346. № 4. С. 565–569.
Демчук А.С., Иванов М.В., Иванова Т.С., Полякова Н.В., Головин П.В., Лайус Д.Л. Питание беломорской трехиглой колюшки Gasterosteus aculeatus (Linnaeus, 1758) на нерестилищах // Тр. Карел. науч. центра РАН. 2018. № 4. С. 42–58.
Зюганов В.В. Семейство колюшковых (Gasterosteidae) мировой фауны. Л.: Наука, 1991. 261 с.
Лайус Д.Л., Головин П.В., Зеленская А.Е., Демчук А.С., Доргам А.С., Иванов М.В., Иванова Т.С., Мурзина С.А., Полякова Н.В., Рыбкина Е.В., Юрцева А.О. Трехиглая колюшка Белого моря: популяционные характеристики и роль в экосистеме // Сиб. эколог. журн. 2020. № 2. С. 167–183.
Мухомедияров Ф.Б. Трехиглая колюшка (Gasterosteus aculeatus L.) Кандалакшского залива Белого моря // Вопр. ихтиол. 1966. Т. 6. Вып. 3. С. 454–467.
Пичугин М.Ю., Сидоров Л.В., Гриценко О.Ф. Биологические и морфологические особенности трехиглой колюшки Gasterosteus aculeatus Курильских островов // Вопр. ихтиол. 2003. Т. 43. № 2. С. 169–177.
Шульман С.С., Шульман-Альбова Р.Е. Паразиты рыб Белого моря. М.-Л. Изд-во АН СССР, 1953. 200 с.
Aneer G. Biometrical characteristics of the three-spined stickleback (Gasterosteus aculeatus L.) from Northern Baltic proper // Zoologica Scripta. 1973. V. 2. P. 157–162.
Arnold K.E., Adam A., Orr K.J., Griffiths R., Barber I. Sex-specific survival and parasitism in three-spined sticklebacks: seasonal patterns revealed by molecular analysis // J. Fish Biology. 2003. V. 63. P. 1046–1050.
Bakhvalova A.E., Ivanova T.S., Ivanov M.V., Demchuk A.S., Movchan E.A., Lajus D.L. Long-term changes in the role of threespine stickleback (Gasterosteus aculeatus) in the White Sea: predatory fish consumption reflects fluctuating stickleback abundance during the last century // Evol. Ecol. Res. 2016. V. 17. P. 317–334.
Bakker T.C.M. No evidence of sex reversal by means of experimentally altered sex ratios in threespine stickleback // Evol. Ecol. Res. 2016. V. 17. P. 291–300.
Bakker T.C.M., Giger T., Frommen J.G., Largiadèr C.R. Rapid molecular sexing of three-spined sticklebacks, Gasterosteus aculeatus L., based on large Y-chromosomal insertions // J. Appl. Genetics. 2017. V. 58. P. 401–407.
Bell A.M., Dingermanse N.J., Hankison S.J., Langenhof M.B.W., Rollins K. Early exposure to nonlethal predation risk by size-selective predators increases somatic growth and decreases size at adulthood in threespined sticklebacks // J. Evol. Biol. 2011. V. 24. P. 943–953.
Bell M.A., Aguirre W.E. Contemporary evolution, allelic recycling, and adaptive radiation of the threespine stickleback // Evol. Ecol. Res. 2013. V. 15. P. 377–411.
Bernhardt R.R., von Hippel F.A., Cresko W.A. Perchlorate induces hermaphroditism in threespine sticklebacks // Environ. Toxicol. Chem. 2006. V. 25. P. 2087–2096.
Bissegger M., Laurentino T.G., Roesti M., Berner D. Widespread intersex differentiation across the stickleback genome – the signature of sexually antagonistic selection? // Mol. Ecol. 2020. V. 29. P. 262–271.
Dean L.L., Robertson S., Mahmud M., MacColl A.D.C. Internal embryonic development in a non-copulatory, egg-laying teleost, the three-spined stickleback, Gasterosteus aculeatus // Sci. Reports. 2019. V. 9. P.2395.
Devlin R.H., Nagahama Y. Sex determination and sex differentiation in fish: an overview of genetic, physiological, and environmental influences // Aquaculture. 2002. V. 208. P. 191–364.
Furin C.G., von Hippel F.A., Postlethwait J.H., Buck C.L., Cresko W.A., O’Hara T.M. Developmental timing of sodium perchlorate exposure alters angiogenesis, thyroid follicle proliferation and sexual maturation in stickleback // Gen. Compar. Endocrin. 2015. V. 219. P. 24–35.
Gibson G. The synthesis and evolution of a supermodel // Science. 2005. V. 307. P. 1890–1891.
Golovin P.V., Bakhvalova A.E., Ivanov M.V., Ivanova T.S., Smirnova K.A., Lajus D.L. Sex-biased mortality of marine threespine stickleback (Gasterosteus aculeatus L.) during their spawning period in the White Sea // Evol. Ecol. Res. 2019. V. 20. P. 279–295.
Griffiths R., Orr K.J., Adam A., Barber I. DNA sex identification in the three-spined stickleback // J. Fish Biology. 2000. V. 57. P. 1331–1334.
Hahlbeck E., Griffiths R., Bengtsson B.-E. The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption. I. Sexual differentiation // Aquatic Toxic. 2004. V. 70. P. 287–310.
Hagen D.W., Gilbertson L.G. Selective predation and intensity of selection acting upon the lateral plates of threespine stickleback // Heredity. 1973. V. 30. P. 273–287.
Hendry A.P., Peichel C.L., Matthews B., Boughman J.W., Nosil P. Stickleback research: the now and the next // Evol. Ecol. Res. 2013. V. 15. P. 111–141.
Heule C., Salzburger W., Böhne A. Genetics of sexual development: an evolutionary playground for fish // Genetics. 2014. V. 196. P. 579–591
Huntingford F.A., Wright P.J., Tierney J.F. Adaptive variation in antipredator behavior in threespined stickleback // The evolutionary biology of threespine stickleback / Eds Bell M.A., Foster S.A. Oxford: Oxford University Press, 1994. P. 277–296.
Ivanova T.S., Ivanov M.V., Golovin P.V., Polyakova N.V., Lajus D.L. The White Sea threespine stickleback population: spawning habitats, mortality, and abundance // Evol. Ecol. Res. 2016. V. 17. P. 301–315.
Johnson S., Candolin U. Predation cost of a sexual signal in the threespine stickleback // Behav. Ecol. 2017. V. 28. P. 1160–1165.
King AJ, Fürtbauer I, Mamuneas D., James C, Manica A. Sex-differences and temporal consistency in stickleback fish boldness // PLoS ONE. 2013. V. 8. P. 81116. https://doi.org/10.1371/journal.pone.0081116
Kynard B.E. Breeding behavior of a lacustrine population of threespine sticklebacks (Gasterosteus aculeatus L.) // Behaviour. 1978. V. 67. P. 178–207.
Lajus D., Ivanova T., Rybkina E., Lajus J., Ivanov M. Multidecadal fluctuations of threespine stickleback in the White Sea and their correlation with temperature // ICES J. Marine Sci. 2020. doi.org/https://doi.org/10.1093/icesjms/fsaa192
Lindsey C.C. Experimental study of meristic variation in a population of threespined stickleback, Gasterosteus aculeatus // Can. J. Zool. 1962. V. 40. P. 271–312.
Niksirat H., Hatef A., Abdoli A. Life cycle and feeding habits of the threespined stickleback Gasterosteus aculeatus (Linnaeus, 1758): an alien species in the southeast Caspian sea // Intern. Aquatic Res. 2010. V. 2. P. 97–104.
Östlund-Nilsson S., Mayer I., Huntingford F.A. Biology of the three-spine stickleback / Boca Raton: CRC Press, 2007. 392 p.
Paepke H.-J. Die Stichlinge: Gasterosteidae. Magdeburg: Westarp-Wiss, 1996. 176 p.
Patimar R., Najafabadi M.H., Souraki M.G. Life history features of the nonindigenous three-spined stickleback (Gasterosteus aculeatus Linnaeus, 1758) in the Gomishan wetland (southeast Caspian Sea, Iran) // Turk. J. Zool. 2010. V. 34. P. 461–470.
Peichel C.L., Ross J.A., Matson C.K., Dickson M., Grimwood J., Schmutz J., Myers R.M., Mori S., Schluter D., Kingsley D.M. The master sex-determination locus in threespine sticklebacks is on a nascent Y chromosome // Curr. Biol. 2004. V. 14. P. 1416–1424.
Ramler D., Mitteroecker P., Shama L.N.S., Wegner K.M., Ahnelt H. Nonlinear effects of temperature on body form and developmental canalization in the threespine stickleback // J. Evol. Biol. 2014. V. 27. 497–507.
Reimchen T.E., Nosil P. Ecological causes of sex-biased parasitism in threespine stickleback // Biol. J. Linn. Soc. 2001. V. 73. P. 51–63.
Rollins J.L., Chiang P., Waite J.N., von Hippel F.A., Bell M.A. Jacks and jills: alternative life-history phenotypes and skewed sex ratio in anadromous threespine stickleback (Gasterosteus aculeatus) // Evol. Ecol. Res. 2017. V. 18. P. 363–382.
Rybkina E.V., Demchuk A.S., Lajus D.L., Ivanova T.S., Ivanov M.V., Galaktionov K.V. Dynamics of parasite community during early ontogenesis of marine threespine stickleback, Gasterosteus aculeatus // Evol. Ecol. Res. 2016. V. 17. P. 335–354.
Saat T., Turovski A. Three-spined stickleback, Gasterosteus aculeatus L. // Fishes of Estonia. Eds Ojaveer E., Pihu E., Saat T. Tallinn: Estonian Academy Publishers, 2003. P. 274–280.
Samonte-Padilla I.E., Eizaquirre C., Scharsack J.P., Lenz T.L., Milinski M. Induction of diploid gynogenesis in an evolutionary model organism, the three-spined stickleback (Gasterosteus aculeatus) // BMC Develop. Biol. 2011. P. 11–55.
Toli E.-A., Calboli F., Shikano T., Merilä J. A universal and reliable assay for molecular sex identification of three-spined sticklebacks (Gasterosteus aculeatus) // Mol. Ecol. Res. 2016. V. 16. P. 1389–1400.
Velando A., Costa M.M., Kim S.-Y. Sex-specific phenotypes and metabolism-related gene expression in juvenile sticklebacks // Behav. Ecol. 2017. V. 28. P. 1553–1563.
Whoriskey F.G., FitzGerald G.L. The effects of bird predation on an estuarine stickleback (pisces: Gasterosteidae) community // Can. J. Zool. 1985. V. 63. P. 301–307.
Wootton R.J., Fletcher D.A., Smith C., Whoriskey F.G. A review of reproductive rates in sticklebacks in relation to parental expenditure and operational sex ratios // Behaviour. 1995. V. 132. P. 915–933.
Wootton R.J., Smith C. Reproductive biology of teleost fishes. Chichester: John Wiley sons, Ltd., 2015. 472 p.
Yershov P., Sukhotin A. Age and growth of marine three-spined stickleback in the White sea 50 years after a population collapse // Polar Biology. 2015. V. 38. P. 1813–1823.
Yoshida K., Makino T., Yamaguchi K., Shigenobu S., Hasebe M., Kawata M., Kume M., Mori S., Peichel C.L., Toyoda A., Fujiyama A., Kitano J. Sex chromosome turnover contributes to genomic divergence between incipient stickleback species // PLoS Genet. 2014. V. 10: e1004223.
Yurtseva A., Noreikiene K., Lajus D., Li Z., Alapassi T., Ivanova T., Ivanov M., Golovin P., Vesala S., Merilä J. Aging three-spined sticklebacks Gasterosteus aculeatus: comparison of estimates from three structures // J. Fish Biology. 2019. V. 95. P. 802–811.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


