Известия РАН. Серия биологическая, 2021, № 5, стр. 507-520
Структура и формирование капсулы вокруг скребня Corynosoma strumosum в естественном паратеническом хозяине – рыбе Hadropareia middendorffii. 2. Экспериментальное изучение процесса инкапсуляции (предварительные результаты)
Е. М. Скоробрехова 1, В. П. Никишин 1, *
1 Институт биологических проблем Севера ДВО РАН
685000 Магадан, Портовая ул., 18, Россия
* E-mail: nikishin@ibpn.ru
Поступила в редакцию 02.05.2019
После доработки 09.03.2021
Принята к публикации 09.03.2021
Аннотация
Впервые экспериментально исследован процесс инкапсуляции скребней в паратеническом хозяине. Показано, что образование лейкоцитарной капсулы вокруг скребня Corynosoma strumosum (Rudolphi, 1802) (Lühe, 1904) в толстощеке Миддендорфа Hadropareia middendorffii (Schmidt, 1904) происходит в три этапа. В первые дни после проникновения скребня в полость тела хозяина наблюдается миграция к паразиту лейкоцитов, включая макрофаги. Через две недели в состав капсулы включаются немногочисленные фибробласты и коллагеновые волокна, количество которых в дальнейшем возрастает. Через 50 дней после начала инкапсуляции в составе капсулы вместе с лейкоцитами обнаруживается значительное количество фибробластов/фиброцитов и пучков коллагеновых волокон, и по своему клеточному составу она не отличается от описанной из толстощеков, инвазированных естественным образом. В ответ на клеточную реакцию хозяина паразит формирует на своей поверхности типичный толстый слой гликокаликса.
В первом сообщении мы представили результаты исследования гистологической и ультратонкой организации капсул, окружающих скребня Corynosoma strumosum в толстощеке Миддендорфа, инвазированного естественным образом. Было показано, что эти капсулы относятся к лейкоцитарному типу, для которого характерно наличие значительного или даже преобладающего количества лейкоцитов. В ответ коринозома формирует на своей поверхности толстый слой гликокаликса, образование которого мы рассматриваем как защиту от клеточной реакции хозяина. Обе эти особенности, по нашему мнению, являются признаками одной из двух известных на сегодняшний день стратегий взаимоотношений скребней с паратеническими хозяевами (Никишин, Скоробрехова, 2018).
Возможность заражения скребнями паратенических хозяев в условиях эксперимента была неоднократно продемонстрирована в исследованиях В.П. Шарпило (1965, 1971), однако процесс инкапсуляции скребней в подобных случаях оставался не изученным. С целью изучения процесса формирования капсулы вокруг скребня Corynosoma strumosum в естественных паратенических хозяевах было проведено экспериментальное заражение толстощеков Миддендорфа. С морскими рыбами подобные эксперименты проведены впервые. В настоящем сообщении приводятся предварительные результаты этого исследования.
МАТЕРИАЛЫ И МЕТОДЫ
Выбор для экспериментов толстощеков Миддендорфа был обусловлен двумя причинами. Во-первых, во время отливов эти рыбы часто остаются под камнями и в литоральных ваннах, что позволило в аквариуме создать условия, приближенные к естественным. Во-вторых, в бухте Нагаево был обнаружен участок литорали, в котором обитающие там толстощеки имели низкую зараженность: в течение 2011–2013 гг. в разные периоды с июня по сентябрь было вскрыто 146 рыб этого вида, отловленных на этом участке, и экстенсивность их естественной инвазии составила менее 5%, при интенсивности от одного до трех экземпляров.
Подопытных рыб отлавливали во время отливов под камнями или в литоральных ваннах. Часть рыб вскрывали сразу (контрольная группа), остальных использовали в эксперименте (опытная группа). Эксперименты проведены в лабораторных условиях в июне и сентябре–ноябре 2012 г.
Опытную группу рыб содержали в аквариуме с морской водой (объем 80 л). На дно аквариума поместили крупногалечный грунт, взятый из естественного биотопа подопытных животных. В качестве укрытий были сооружены нагромождения из крупных камней и установлены полые керамические изделия. Вода в аквариуме постоянно обогащалась кислородом посредством аэрирующего фильтра. С целью максимальной имитации естественных условий аквариум был установлен в неотапливаемом помещении. Перед экспериментами пойманных рыб выдерживали в покое в течение недели. Через два–три дня после поимки рыбы начинали принимать корм. Кормили рыб один раз в день мороженым кормом.
Первый эксперимент был проведен в июне 2012 г. с целью исследования начальных этапов процесса инкапсуляции скребней, поэтому все подопытные рыбы были вскрыты через трое суток после заражения. Опытную группу рыб составили 12 толстощеков длиной от 8.2 до 11.8 см (табл. 1). Одновременно с опытной группой рыб была исследована контрольная группа из 14 рыб; результаты вскрытия показали отсутствие естественной инвазии скребнями. Температура воздуха в помещении с аквариумом колебалась от +12 до +18°С. Заражение подопытных рыб проводили пероральным способом инкапсулированными скребнями с кусочками прилежащих тканей, извлеченными из других естественных паратенических хозяев (бельдюг и толстощеков), выловленных на участке с высокой зараженностью рыб этим скребнем. Всего было скормлено 32 скребня.
Второй эксперимент был проведен в сентябре–ноябре того же года с целью изучения более поздних этапов процесса инкапсуляции скребней. Опытная группа рыб насчитывала 11 особей длиной от 6.3 до 18.2 см. Контрольная группа состояла из 26 рыб; по результатам вскрытия все они оказались незараженными. Условия содержания подопытных рыб и способ их заражения были аналогичными описанным выше. В помещении, где располагался аквариум, температура воздуха от начала эксперимента до его завершения снизилась от +12 до –3°С. Поскольку рыбы предпочитали держаться в определенных участках аквариума, было проведено индивидуальное заражение каждой из них. Трем рыбам было скормлено по 11 скребней, четырем – по 5 скребней, остальным четырем – от 5 до 11 скребней каждой (табл. 1). В последнем случае для заражения использовали как обычные, так и более крупные капсулы, которые содержали более одного скребня (мы находили капсулы, включающие от двух до шести коринозом). Вскрытие проводили через 14 (две рыбы), 30 (две рыбы) и 50 (семь рыб) суток после заражения.
Подготовку препаратов, свето-микроскопические и электронно-микроскопические исследования осуществляли по методикам, изложенным в первом сообщении. Всего свето-микроскопически было исследовано 58 скребней, электронно-микроскопически – 7.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты экспериментов по заражению коринозомами толстощека Миддендорфа представлены в табл. 1.
Срок заражения 3 суток. Зараженными оказались пять из 12 вскрытых рыб. Все скребни, проникшие в полость тела хозяина, имели признаки начавшейся инкапсуляции. Формирующаяся капсула или была представлена прерывистым клеточным слоем (рис. 1а, 1б), или небольшими скоплениями клеток (рис. 1в), или же почти полностью окружала паразита (рис. 1г).
Рис. 1.
Общий вид скребня Corynosoma strumosum на брыжейке кишечника (а, б), брюшной стенке (в) и печени (г) толстощека Миддендорфа Hadropareia middendorffii через трое суток после заражения. (а, б) – Продольный (а) и поперечный (б) срезы скребня, частично окруженного тонкой формирующейся капсулой (стрелки); (в) – эвагинированный хоботок скребня проник до мышц брюшной стенки, капсула не сформирована, видны лишь отдельные скопления клеток хозяина (стрелки); (г) – скребень почти полностью окружен капсулой, наиболее толстой в участке, прилегающем к печени, и в складке гельминта. БК – брыжейка кишечника, СК – стенка кишечника, Т – тегумент скребня, Х – хоботок скребня. Масштаб: 200 мкм.
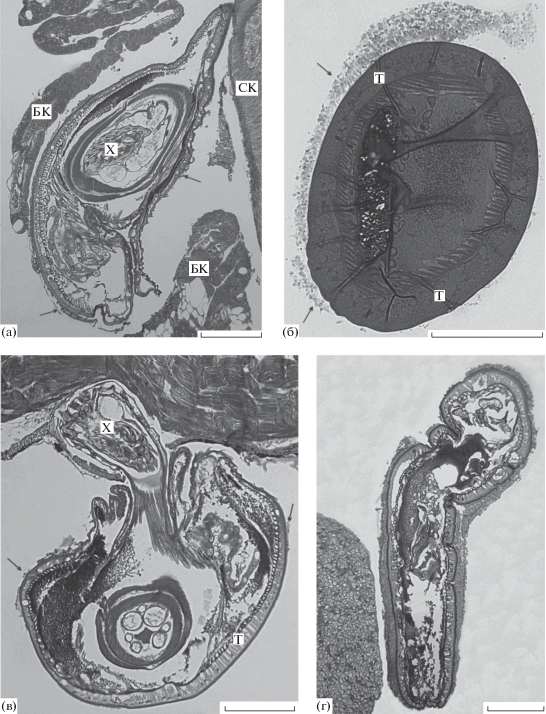
Таблица 1.
Результаты экспериментального заражения толстощека Миддендорфа скребнем Corynosoma strumosum
| № рыбы | Длина (см) и пол рыбы | Количество скормленных скребней (экз) |
Время
с момента введения инвазии (сут) |
Локализация и количество обнаруженных скребней | ||||
|---|---|---|---|---|---|---|---|---|
| просвет кишечника | брыжейка кишечника | брюшная стенка | печень | гонады/ селезенка |
||||
| 1 | 8.2♀ | 10 | 3 | 1 | 1 | |||
| 2 | 9.2♀ | Всего 22 | 3 | 1 | 1 | |||
| 3 | 9.4 | 3 | 2 | 1 | 1 | 1/ | ||
| 4 | 9.1♀ | 3 | Не обнаружены | |||||
| 5 | 9.0♂ | 3 | Не обнаружены | |||||
| 6 | 9.6♀ | 3 | Не обнаружены | |||||
| 7 | 11.8♀ | 3 | Не обнаружены | |||||
| 8 | 9.2♂ | 3 | Не обнаружены | |||||
| 9 | 9.6♀ | 3 | 1 | 1 | ||||
| 10 | 10.0♂ | 3 | Не обнаружены | |||||
| 11 | 10.7♂ | 3 | Не обнаружены | |||||
| 12 | 9.2♀ | 3 | 3 | 1 | ||||
| 13 | 18.2♀ | Каждой рыбе от 5 до 11 | 14 | 6 | ||||
| 14 | 12.3♀ | 14 | 5 | |||||
| 15 | 18.0♀ | 30 | 11 | |||||
| 16 | 13.3♀ | 30 | 6 | |||||
| 17 | 9.9♂ | 50 | 3 | |||||
| 18 | 9.0 | 50 | 1 | |||||
| 19 | 6.9 | 50 | 1 | /1 | ||||
| 20 | 10.6♀ | 50 | 1 | |||||
| 21 | 10.0 | 50 | 1 | 2 | ||||
| 22 | 9.0 | 50 | 3 | 1 | ||||
| 23 | 6.3 | 50 | 3 | |||||
Особенности строения тегумента скребня. Свето-микроскопически на поверхности тегумента всех трехдневных скребней обнаруживали гомогенный светло-окрашенный слой гликокаликса. Электронная микроскопия показала, что гликокаликс образован фибриллярным и гранулярным материалом невысокой электронной плотности и имеет толщину 1.5–2.1 мкм (рис. 2а–2г). Наружная граница его неровная, в него часто внедряются псевдоподии клеток хозяина, однако, не достигающие поверхности тегумента (рис. 2а). Узкая внутренняя часть гликокаликса отличается более плотной организацией образующего его материала и имеет повышенную электронную плотность. В некоторых участках в основании гликокаликса наблюдались скопления мелких везикул, диаметром 18–23 нм, окруженных оболочкой, напоминающей мембрану (рис. 2в). В толще гликокаликса часто обнаруживались образования в виде трубочек, диаметром 21–26 нм, ориентированные более или менее перпендикулярно поверхности паразита; стенка этих трубочек была сходна со стенкой везикул, однако точный ее характер не определялся (рис. 2г). В некоторых участках гликокаликс был отделен от тегумента, но при этом сохранял свою непрерывность (рис. 2б). В этих случаях в пространствах, образующихся между ним и поверхностью тегумента, нередко наблюдались фрагменты клеток хозяина.
Рис. 2.
Ультраструктура поверхности тегумента и гликокаликса скребня Corynosoma strumosum на брыжейке кишечника толстощека Миддендорфа Hadropareia middendorffii через трое суток после заражения. (а) – Отростки макрофага хозяина (*) погружены в слой гликокаликса; просветленная цитоплазма и набухшие митохондрии свидетельствуют о деструкции макрофага; (б) – отслоение слоя гликокаликса от тегумента скребня; (в) – скопления мелких везикул во внутренней части гликокаликса; погруженные части “каналов” (*) тегумента, образующие его везикулярный слой, расширены; (г) – внутренняя часть гликокаликса включает многочисленные трубочковидные образования. Устья “каналов” (стрелки) тегумента расширены. Г – гликокаликс, М – макрофаг, Мт – митохондрии, Н – нейтрофилы, Т – тегумент скребня, Я – ядро макрофага.
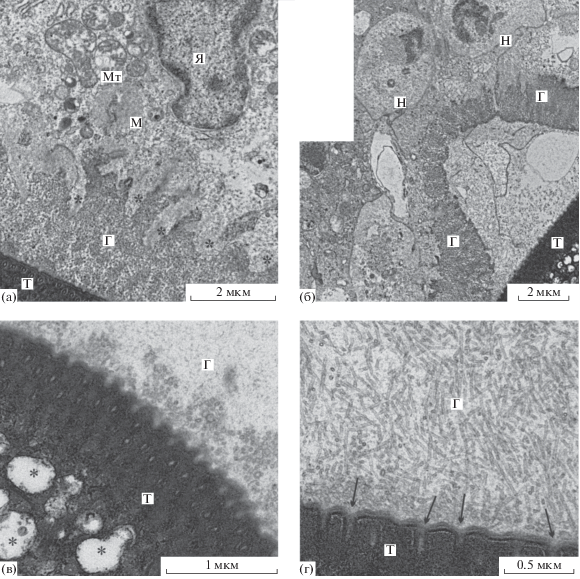
Тегумент трехсуточных скребней по своему строению в целом сходен с таковым у инкапсулированных скребней из естественных паратенических хозяев (см. сообщение 1) (рис. 3а–3в). На полутонких срезах в его составе отчетливо различаются поперечно-полосатый, войлочно-волокнистый и радиально-волокнистый слои. У шести скребней определялся везикулярный слой, элементы которого были расширены до 0.5 мкм и содержали неясный хлопьевидный материал или везикулярные образования, сходные с везикулами, отмеченными в гликокаликсе (рис. 2в). В этих случаях, как показала электронная микроскопия, устья каналов поперечно-полосатого слоя, связывающих эти везикулы с внешней средой, также были расширены до 30–60 нм, что может свидетельствовать о повышенной секреторной активности тегумента (рис. 2г).
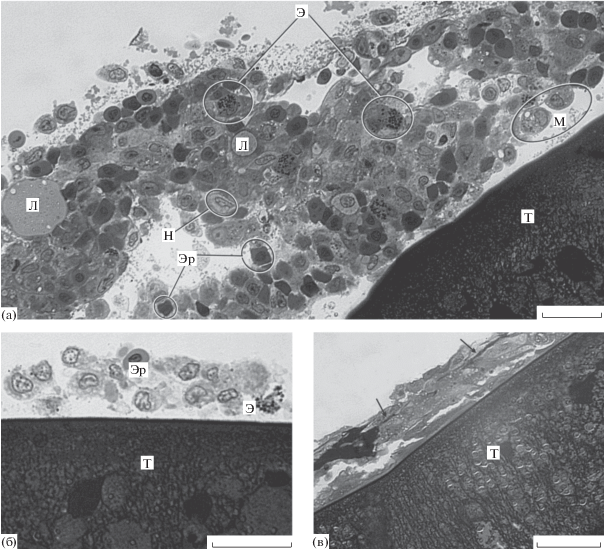
Рис. 3.
Микроструктура тегумента и капсулы скребня Corynosoma strumosum на гонадах (а), брюшной стенке (б) и печени (в) толстощека Миддендорфа Hadropareia middendorffii через трое суток после заражения. (а) – В составе капсулы определяются эозинофилы, макрофаги, эритроциты, нейтрофил и крупные липидные капли; (б) – формирующаяся капсула представлена двумя-тремя слоями клеток хозяина; (в) – в составе капсулы в межклеточных пространствах виден плотный гомогенный материал неясного происхождения (стрелки). Л – липидные капли, М – макрофаги, Н – нейтрофил, T – тегумент скребня, Э – эозинофилы, Эр – эритроциты. Масштаб: 20 мкм.
Структура капсулы. На брыжейке кишечника найдено шесть скребней; все они имели инвагинированные хоботки. Вокруг двух из них капсула полностью отсутствовала, и лишь единичные скопления клеток хозяина наблюдались у поверхности гельминтов. Вокруг остальных скребней капсула имела прерывистый характер и неравномерную толщину (рис. 1а, 1б). В участках, в которых скребни контактировали с брыжейкой, толщина капсулы достигала наибольших значений, по мере удаления от них ее толщина снижалась, она становилась прерывистой и перемежалась участками, свободными от клеток. Клетки в капсуле располагались рыхло с заметными межклеточными пространствами. Во внутренней части капсулы они характеризовались многочисленными псевдоподиями, направленными в сторону паразита и часто погруженными в верхнюю часть слоя гликокаликса на его поверхности (рис. 2а).
Четыре скребня эвагинированными хоботками были прикреплены к стенке брюшной полости. При этом три из них были лишены капсулы, и на их поверхности имелись лишь небольшие скопления клеток (рис. 1в). Вблизи заднего отдела одного из этих скребней наблюдался крупный клеточный инфильтрат, состоящий из нескольких десятков (на одном срезе) эритроцитов. Признаки инкапсуляции этого скребня наблюдались только в участке его контакта с инфильтратом, над остальной поверхностью паразита клетки хозяина отсутствовали. У четвертого скребня капсула была прерывистой, но отдельные участки его поверхности не были покрыты клетками хозяина. Капсула состояла из двух–трех слоев клеток, и ее толщина варьировала от 20 до 60 мкм (рис. 3б). Некоторые из наиболее внутренних клеток образовывали пальцевидные отростки, направленные к поверхности скребня.
На поверхности печени рыб найдено два скребня. Оба гельминта содержали инвагинированный хоботок, и большая часть их тела была окружена капсулой (рис. 1г, 3в); в других участках она полностью отсутствовала. Толщина капсулы варьировала от 16 до 35 мкм, причем наибольших значений она достигала в местах контакта скребней с печенью, а также в изгибах тела гельминтов.
На гонадах найден один частично инкапсулированный скребень с втянутым хоботком. Капсулой, толщиной от 35 до 129 мкм, была покрыта передняя часть скребня, тогда как его задний конец был свободен, и лишь в некоторых местах на его поверхности наблюдались единичные скопления клеток. В капсуле клетки располагались рыхло, с широкими межклеточными пространствами (рис. 3а).
В составе всех обнаруженных капсул выявлено несколько типов клеток, среди которых преобладают макрофаги, нейтрофилы и эритроциты, менее многочисленными были эозинофилы и лимфоциты. Многие клетки характеризуются признаками деструкции, наиболее ярко проявляющимися в просветлении периферической цитоплазмы и набухании митохондрий (рис. 2а). По своим характеристикам клетки в целом не отличаются от описанных в капсулах из рыб, инвазированных естественным образом. Фибробласты в составе трехсуточных капсул не обнаружены.
Диаметр макрофагов варьирует от 8 до 14 мкм (рис. 2а, 3а). Ядра их светлые, округлой или бобовидной формы, расположены эксцентрично. Цитоплазма включает короткие канальцы гранулярной эндоплазматической сети, мелкие темные фагосомы, светлые вакуоли и липидные капли.
Нейтрофилы – округлые клетки, диаметром 6–9 мкм, характеризуются эксцентрично расположенным ядром (рис. 3а); преобладают клетки с округлыми и палочковидными ядрами, реже ядра состоят из 2–3 сегментов. Ядра характеризуются грубыми скоплениями гетерохроматина вдоль оболочки, а в цитоплазме видны мелкие специфические гранулы округлой, реже вытянутой, формы. Периферическая часть гранул включают плотное гомогенное содержимое, а их центральная часть представляется “пустой”.
Эозинофилы чаще имеют вытянутую форму, ширина их составляет 6–7 мкм, длина – 12–15 мкм (рис. 3а, 3б); их ядра расположены эксцентрично. В отличие от нейтрофилов для эозинофилов характерны более крупные специфические гранулы с темным однородным содержимым.
Лимфоциты отличаются от других клеток небольшими размерами (~5 мкм) и плотным ядром, занимающим большую часть их тела.
В межклеточных пространствах наблюдался плотный гомогенный материал; на полутонких срезах он окрашивался в темно-синий цвет (рис. 3в), на гистологических срезах, окрашенных по методу Маллори – в интенсивно красный цвет. Электронно-микроскопически этот материал состоит из хаотично ориентированных тонких фибрилл, не имеющих поперечной исчерченности. Кроме того, в капсулах большинства исследованных скребней в межклеточных пространствах присутствовали крупные липидные капли, диаметром 4–5 мкм, в отдельных случаях – до 20 мкм (рис. 3а).
Срок заражения 14 суток. Спустя 14 сут после начала эксперимента вскрыто две рыбы. В первой из них (№ 13) найдено 6 скребней, во второй (№ 14) – 5. Все паразиты располагались на брыжейке кишечника хозяев; в просвете кишечника скребни не обнаружены. У первой рыбы два паразита были практически полностью лишены капсулы, а вблизи их поверхности наблюдались редкие группы клеток, остальные гельминты были покрыты тонкой прерывистой капсулой. У второй рыбы один скребень также был свободен от капсулы, три скребня были окружены тонкой прерывистой капсулой. Последний скребень был заключен в почти сплошную многослойную капсулу, прерывающуюся лишь в отдельных коротких участках (рис. 4а–4в).
Рис. 4.
Скребень Corynosoma strumosum на брыжейке кишечника толстощека Миддендорфа Hadropareia middendorffii через 14 суток после заражения. (а) – Тегумент скребня с расширенными элементами везикулярного слоя (стрелки); окружающая капсула многослойная и образована лейкоцитами и макрофагами; (б) – коллагеновые волокна в составе капсулы (стрелки), окрашивающиеся по Маллори в синий цвет; (в) – межклеточный материал в составе капсулы (стрелки), окрашивающийся по Маллори в красный цвет; (г, д) – тегумент скребня с расширенными элементами везикулярного слоя (*) и устьями “каналов” (стрелки) поперечно-полосатого слоя; слой гликокаликса на поверхности тегумента, образован аморфным материалом (г) и включает микротрубочки (д). Г – гликокаликс, К – капсула, Т – тегумент скребня, Я – ядра тегумента.
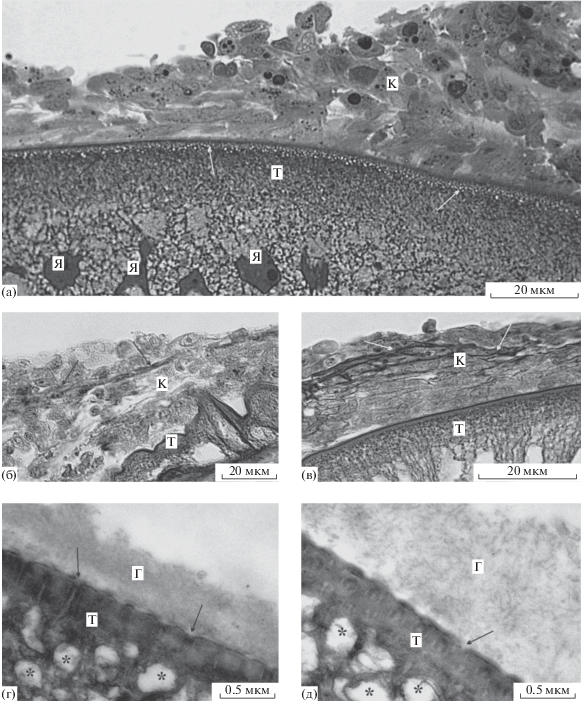
Особенности строения тегумента. На свето-микроскопических и электронно-микроскопических препаратах у трех скребней отмечены расширенные элементы везикулярного слоя тегумента, аналогичные описанным у некоторых скребней в возрасте трех суток (рис. 4а); устья каналов, связывающих эти везикулы с внешней средой, также были расширены до 40–60 нм (рис. 4г, 4д). У других скребней везикулярный слой имел “нормальную” внешность (рис. 4б, 4в). На поверхности тегумента во всех случаях был хорошо виден рыхлый слой гликокаликса, образованный войлокоподобным материалом (рис. 4г, 4д). Участками в этом материале наблюдались трубочки, по морфологии сходные с отмеченными в гликокаликсе трехсуточных коринозом, но в значительно меньшем количестве (рис. 4д).
Структура капсулы. Основу капсул у исследованных скребней составляли макрофаги и нейтрофильные лейкоциты, в меньшем количестве присутствовали эозинофилы, лимфоциты, и эритроциты (рис. 4а). Кроме того, были отмечены немногочисленные фибробласты, отличающиеся крупными размерами, округлой или удлиненной формой, относительно высоким ядерно-плазменным отношением и светлым ядром с отчетливым ядрышком. Межклеточный материал капсулы был представлен двумя модификациями волокон. Волокна первой модификации образуют довольно крупные скопления, окрашивающиеся по методу Маллори в ярко-красный цвет (рис. 4в). Материал второй модификации, в отличие от первой, представлен сетью коллагеновых волокон, о чем свидетельствует их окраска по методу Маллори в синий цвет (рис. 4б).
Срок заражения 30 суток. На тридцатые сутки эксперимента вскрыто 2 рыбы: у первой (№ 15) найдено 11 скребней, у второй (№ 16) – 6. Все обнаруженные скребни располагались на брыжейке кишечника и были окружены сплошной многослойной капсулой, толщиной от 32 до 160 мкм. Как и на предыдущих сроках эксперимента наблюдалось увеличение толщины капсулы в участках, в которых скребни были наиболее близко расположены к брыжейке (рис. 5а).
Рис. 5.
Скребень Corynosoma strumosum на брыжейке кишечника толстощека Миддендорфа Hadropareia middendorffii через тридцать суток после заражения. (а) – Общий вид скребня в капсуле, наиболее толстой в участке, обращенном к ткани брыжейки; (б) – фрагмент капсулы, образованной не только лейкоцитами и макрофагами, но и фибробластами; на поверхности тегумента заметен слой гликокаликса (стрелка); (в) – гликокаликс, образованный тонко волокнистым материалом; элементы везикулярного слоя тегумента расширены (*); (г) – трубочки в составе гликокаликса. Г – гликокаликс, К – капсула, М – макрофаги, Т – тегумент скребня, ТБ – ткань брыжейки, Ф – фибробласты.
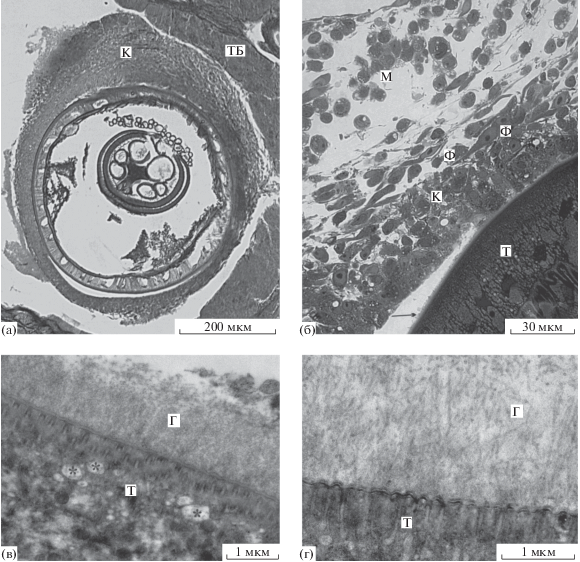
Особенности строения тегумента. Свето-микроскопически тегумент исследованных скребней по своему строению не отличался от такового у скребней из рыб, инвазированных естественным образом (рис. 5б). Слой гликокаликса на поверхности тегумента отчетливо наблюдался в случаях, когда между скребнем и капсулой имелся просвет (рис. 5б).
Электронно-микроскопически были изучены два скребня. У обоих элементы везикулярного слоя были расширены (рис. 5в). Гликокаликс скребней достигал в толщину 1.5–2.0 мкм и был образован тонкофибриллярным материалом (рис. 5в) с включением в отдельных участках микротрубочек (рис. 5г). В этих участках устья “каналов” поперечно-полосатого слоя представляются расширенными, в остальных участках имеют “нормальную” внешность.
Структура капсулы. В составе капсул обнаружены многочисленные макрофаги, нейтрофилы и фибробласты, в значительно меньшем количестве наблюдались эозинофилы, лимфоциты и эритроциты. Плотность расположения клеток в капсуле меняется от плотной в ее внутренней части до рыхлой в среднем и поверхностном слоях (рис. 5б). Строение клеточных элементов сходно с описанным на предыдущих сроках эксперимента. Фибробласты – крупные (17.7–24.0 × 3.3–6.6 мкм) вытянутые клетки с овальным ядром, включающим 1–2 ядрышка. Межклеточный материал в этих капсулах представлен только коллагеновыми волокнами, организованными в виде более толстых, чем у 14-дневных капсул пучков, хорошо выявляемых на гистологических препаратах. Их количество заметно увеличивается в участках, в которых капсула прилегает к брыжейке хозяина.
Срок заражения 50 суток. Спустя 50 сут после заражения вскрыто 7 толстощеков. У двух из них найдено по 1 скребню, у трех – по 3, у одного – 2 и еще у одного – 4. Большинство скребней располагалось на брыжейке кишечника, по одному скребню обнаружено на печени (№ 22) и селезенке (№ 19) и пять скребней – на брюшной стенке. В одном случае (№ 21) в одной капсуле располагались два скребня, в другом (№ 23) – три.
Особенности строения тегумента. Микроскопически и электронно-микроскопически изучены два скребня. Заметных различий в строении тегумента этих скребней по сравнению с червями из естественно инвазированных толстощеков не обнаружено. Однако в строении гликокаликса наблюдались различия. У червя из рыбы № 17 гликокаликс имел толщину не менее 2 мкм и был образован нежными переплетающимися филаментами с включением скоплений мелких пузырьков, диаметром до 50 нм (рис. 6г). В основании слоя гликокаликса на расстоянии не более 0.1 мкм от поверхности тегумента наблюдалась сплошная полоска умеренно плотного материала (рис. 6г). Форма полоски была правильно волнистой, вероятно, повторяющей очертание поверхности тегумента. Ее максимальная толщина составляла 0.3 мкм. Другой исследованный скребень, извлеченный из рыбы № 22, не был покрыт толстым слоем гликокаликса, и клетки капсулы контактировали непосредственно с поверхностью его тегумента (рис. 6в).
Рис. 6.
Скребень Corynosoma strumosum на брыжейке кишечника толстощека Миддендорфа Hadropareia middendorffii через 50 суток после заражения. (а) – Общий вид скребня в капсуле; (б) – фрагмент капсулы, в составе которой преобладают лейкоциты; (в) – скребень, на поверхности которого отсутствует типичный слой гликокаликса, и клетки капсулы контактируют с поверхностью тегумента; (г) – на поверхности скребня имеется типичный толстый слой гликокаликса, включающий также скопления пузырьков; в основании гликокаликса имеется полоска электронно-плотного материала (стрелки). Г – гликокаликс, К – капсула, Т – тегумент скребня.
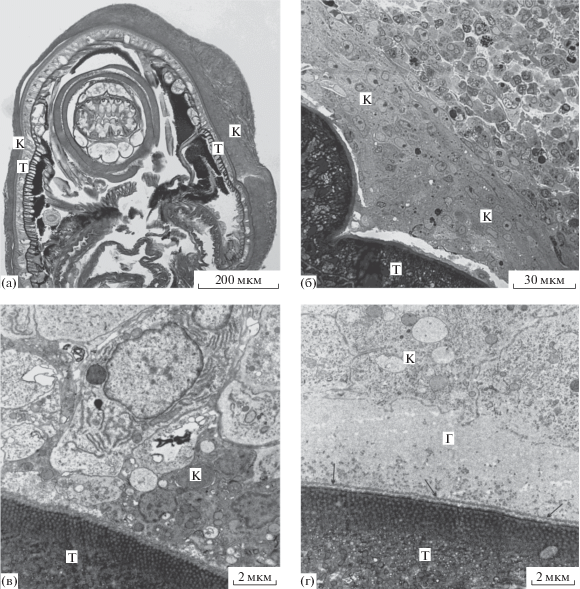
Структура капсулы. Все исследованные скребни имели инвагинированный хоботок и были окружены сплошной толстой капсулой, клеточный состав которой был в целом сходен с таковым 30-дневных капсул и визуально отличался несколько бóльшим количеством коллагеновых волокон (рис. 6а–6в). Толщина капсулы на разных органах была примерно одинаковой и составляла 87–116 мкм. Клетки в капсулах располагаются либо плотно, либо между ними видны небольшие межклеточные пространства (рис. 6б). Как и 30-дневные капсулы, 50-дневные образованы преимущественно макрофагами, лейкоцитами и фибробластами (рис. 6в); межклеточное вещество представлено только коллагеновыми волокнами.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее нами было показано, что тегумент скребня Corynosoma strumosum в естественных паратенических хозяевах многих видов покрыт толстым слоем гликокаликса (Никишин, Скоробрехова, 2007; Skorobrechova, Nikishin, 2011; Скоробрехова, Никишин, 2013). Коринозомы из толстощека, изученные в первом сообщении, не являются исключением и также характеризуются наличием такого же слоя гликокаликса. Результаты, полученные в описанном здесь эксперименте, свидетельствуют, что этот гликокаликс формируется уже в течение первых трех суток инвазии. Если же принять во внимание время, необходимое для проникновения скребня из кишечника в полость тела паратенического хозяина, то период формирования этого гликокаликса на поверхности паразита должен быть еще меньшим.
Факт реформирования гликокаликса в обсуждаемом эксперименте представляется наиболее вероятным. Известно, что в его состав входят, преимущественно, кислые и нейтральные мукополисахариды, а также гликопротеиды (Bennett, 1963; Ito, 1969, 1974). Поэтому при попадании коринозомы в паратенического хозяина гликокаликс, покрывающий скребня в предыдущем хозяине, должен разрушаться под воздействием пищеварительных ферментов. Следовательно, в нашем эксперименте толстый слой гликокаликса на поверхности коринозомы, по всей вероятности, формируется заново, а не сохраняется от предыдущей стадии развития. В пользу этого предположения свидетельствуют также факты отсутствия гликокаликса у коринозом в процессе их миграции сквозь стенку кишечника паратенического хозяина (Skorobrechova et al., 2012), а также частичной его утраты при последовательном моделировании сред желудка и двенадцатиперстной кишки в случаях с цистицеркоидами цестод (наши неопубликованные данные). Более детальное обсуждение факта новообразования гликокаликса выполнено нами ранее (Никишин, 2018).
Механизм формирования гликокаликса ранее был изучен с применением метода радиоавтографии на примере эпителия кишечника крысы (Bennett, 1970; Bennett, Leblond, 1970). В частности, этими авторами показано, что после инъекции животному углеводов, меченных тритием, они через какое-то время скапливаются в комплексе Гольджи, из которого в виде везикул поступают к апикальной клеточной мембране, и затем наблюдаются среди микроворсинок в слое гликокаликса. Сходный процесс перемещения везикул по цитоплазматическим мостикам из цитонов тегумента в его дистальную часть и затем на поверхность паразита мы наблюдали в стенке цисты цистицеркоидов некоторых цестод (Краснощеков, Никишин, 1979). Похожие мелкие везикулы обнаруживались в настоящем исследовании на третьи сутки эксперимента в слое гликокаликса на поверхности коринозом, а также в терминальных расширениях “каналов” поперечно-полосатого слоя тегумента. Эти факты, а также характер расположения этих везикул в виде относительно небольших скоплений свидетельствуют об их вероятном образовании в тегументе скребня и выделении на его поверхность через “каналы” поперечно-полосатого слоя. Косвенным подтверждением этих предположений является заметное расширение устьев “каналов” поверхностного слоя тегумента. По аналогии с вышеприведенным предположением (Bennett, 1970; Bennett, Leblond, 1970) можно предполагать, что эти везикулы, как в случае со скребнями, так и в случае с цистицеркоидами, могут быть связаны с формированием слоя гликокаликса на поверхности коринозом.
Необычным является факт обнаружения в гликокаликсе этих же скребней обширных скоплений трубочек. Для его интерпретации в настоящее время данных явно недостаточно. Можно отметить, однако, что, во-первых, по своему диаметру эти трубочки почти не отличаются от типичных микротрубочек, имеющихся в цитоплазме многих клеток (см. Ченцов, 2005), а во-вторых, диаметры микротрубочек и выше упомянутых везикул почти идентичны, что позволяет предполагать их генетическое сходство. Мы предполагаем, что эти трубочки, как и везикулы, выделяются из “каналов” поперечно-полосатого слоя тегумента и каким-то образом связаны с формированием толстого слоя гликокаликса.
Еще более затруднительна интерпретация трех других особенностей в организации гликокаликса у исследованных скребней. Во-первых, упомянутые скопления трубочек обнаруживались не только в самом начале эксперимента (у трехсуточных скребней), но и на всех других исследованных стадиях. Если принять во внимание предполагаемое участие трубочек в формировании толстого слоя гликокаликса на поверхности тегумента (а оно весьма вероятно), то обсуждаемая особенность предполагает продолжение процесса формирования гликокаликса на протяжении всего периода эксперимента.
Второй трудно интерпретируемой особенностью гликокаликса является его частичное отделение от поверхности тегумента у некоторых трех- и четырнадцати-суточных скребней; при этом его слой сохранял свою непрерывность. Этот процесс можно было бы рассматривать как выражение некоей патологии, тем более, что у одного из исследованных пятидесяти-суточных скребней толстый слой гликокаликса на поверхности тегумента полностью отсутствовал. Однако, поскольку одной из наиболее вероятных предполагаемых функций гликокаликса является защитная (см. обзоры Никишин, 2016, 2018), более приемлемым, на наш взгляд, является предположение о периодической смене (частичной или полной) гликокаликса на начальном этапе инвазии паратенического хозяина. Это предположение хорошо согласуется с возможным участием вышеупомянутых везикул и трубочек в образовании этого гликокаликса, которые наблюдались у скребней на всех сроках эксперимента. Кроме того, таким способом паразит может избавляться от негативного материала, накопленного в гликокаликсе в результате противодействия иммунному ответу хозяина на инвазию.
Наконец, третьей особенностью гликокаликса, отмечаемой впервые, является волнистая полоска материала повышенной электронной плотности, обнаруженная в его основании поблизости от поверхности тегумента у пятидесяти-суточных червей. По внешнему виду она несколько напоминает внутренний слой цисты, одноразово секретируемый поздними акантеллами из “каналов” поперечно-полосатого слоя тегумента (Nikishin, 1992), или же может представлять собой отделившийся внутренний слой гликокаликса, который обычно прилежит к тегументу вплотную (Никишин, 2016, 2018) и который хорошо виден на рис. 3а в первом сообщении. Для проверки этих версий необходимы дальнейшие исследования.
Полученные результаты свидетельствуют, что процесс инкапсуляции скребня Corynosoma strumosum в толстощеке Миддендорфа начинается с интенсивной миграции к паразиту лейкоцитов и макрофагов. Этот результат сходен с большинством ранее полученных данных об инкапсуляции гельминтов во вторых промежуточных хозяевах. Так, основу молодых капсул, окружающих плероцеркоидов цестод Ligula intestinalis в мальках плотвы, инвазированных естественным путем, составляли клетки воспалительного ряда (Hoole, Arme, 1982, 1983a). При имплантации, в том числе и перекрестной, плероцеркоидов этого вида в плотву или пескарей также не отмечались фибробласты и пучки коллагеновых волокон (Hoole, Arme, 1983b). В экспериментально зараженных золотых карасях метацеркарии трематод Ribeiroia marini на ранней стадии инкапсуляции окружались макрофагами, гранулоцитами и лимфоцитами, а фибробласты включались в состав капсулы лишь на третьи сутки эксперимента (Huizinga, Nadakavukaren, 1997).
В то же время, инкапсуляция метацеркарий Posthodiplostomum cuticola, паразитирующих в вобле, начинается с отложения одного-двух слоев фибробластов (Березанцев, Добровольский, 1968), при этом наличие в составе капсул лейкоцитов не отмечено. Это различие можно объяснить тем, что капсула, окружающая этих трематод, возможно является фибробластической, процесс образования которой может отличаться от такового лейкоцитарной капсулы. В нашем исследовании немногочисленные фибробласты впервые наблюдались в составе капсулы только на четырнадцатый день эксперимента, и затем их количество возрастало. Увеличивалось и количество коллагеновых фибрилл, причем большая их часть наблюдалась в дистальной половине капсулы, что соответствует схеме расположения коллагена в капсулах из толстощеков, зараженных естественным образом.
Таким образом, полученные результаты позволяют предположить следующую схему инкапсуляции коринозомы в толстощеке Миддендорфа. В течение первых трех дней заражения скребень проникает сквозь стенку кишечника хозяина, локализуется на каком-либо его органе и покрывается слоем гликокаликса. В это же время из окружающих скребня тканей хозяина мигрируют макрофаги и лейкоциты, контактирующие со слоем гликокаликса на поверхности червя. В дальнейшем часть из них, очевидно, гибнет в результате этого взаимодействия, и их остатки образуют внутренний слой, обнаруживаемый у более “возрастных” капсул. По истечении двух недель после заражения в формирующуюся капсулу мигрируют фибробласты, но продолжается также и миграция лейкоцитов. К 50-му дню эксперимента миграция в капсулу лейкоцитов и фибробластов продолжается, но клетки в толще капсулы располагаются плотнее, а оставшиеся межклеточные пространства заполняются коллагеновыми фибриллами, синтезированными фибробластами.
Заметных различий в характере образования капсул, локализующихся на разных органах хозяина, не выявлено. В то же время, участки скребней, ближе других расположенные к прилежащей ткани хозяина, покрываются его клетками быстрее, чем отдаленные, и капсула в этих участках, как правило, имеет бóльшую толщину.
* * *
Экспериментальное изучение процесса инкапсуляции скребней в морских рыбах – естественных паратенических хозяевах скребня Corynosoma strumosum – проведено впервые. Обнаружено, что уже на третьи сутки на поверхности скребня формируется типичный толстый слой гликокаликса. С этим процессом, по всей вероятности, связаны мелкие везикулы и микротрубочки, обнаруживаемые в составе гликокаликса и, вероятно, секретируемые через расширенные устья “каналов” поперечно-полосатого слоя тегумента. Явление отслоения участков гликокаликса от поверхности тегумента, возможно, является следствием его взаимодействия с макрофагами хозяина.
В процессе инкапсуляции паразита можно выделить три этапа. На первом к скребню мигрируют макрофаги и лейкоциты, часть из которых гибнет, по-видимому, в результате взаимодействия с гликокаликсом червя. Через две недели к мигрирующим макрофагам и лейкоцитам добавляются фибробласты и появляются первые пучки коллагеновых волокон. Через пятьдесят дней инвазии количество коллагеновых волокон в составе капсулы значительно увеличивается, организация клеточных элементов в ней становится более плотной, и по своему строению она приближается к капсулам из толстощеков, инвазированных естественным образом.
Работа выполнена в рамках государственного задания “Таксономическое, морфологическое и экологическое разнообразие гельминтов позвоночных животных Северной Азии” (ААА-А17-117012710031-6).
Список литературы
Березанцев Ю.А., Добровольский А.А. Процессы инкапсуляции метацеркариев трематод Posthodiplostomum cuticola (Nordmann, 1832) (Dubois, 1936) в рыбах // Тр. Астраханского заповедника: сборник гельминтологических работ. 1968. № 11. С. 7–12.
Краснощеков Г.П., Никишин В.П. Ультраструктура стенки цисты метацестод Aploparaksis polystictae (Schiller, 1955) и A. furcigera (Cestoda, Cyclophyllidea) // Паразитология. 1979. Т. 13. № 3. С. 250–256.
Никишин В.П. Морфофункциональное разнообразие гликокаликса у ленточных червей // Успехи соврем. биол. 2016. Т. 136. № 5. С. 506–526.
Никишин В.П. Модификации гликокаликса скребней // Известия РАН. Сер. биол. 2018. № 1. С. 42–54. https://doi.org/10.7868/S000233291801006X
Никишин В.П., Скоробрехова Е.М. Инкапсуляция скребней Corynosoma sp. в резервуарных хозяевах двух видов // Докл. Академии наук. 2007. Т. 417. № 4. С. 566–569. https://doi.org/10.1134/S0012496607060154
Никишин В.П., Скоробрехова Е.М. Две стратегии взаимоотношений скребней с паратеническими хозяевами // Зоологический журн. 2018. Т. 97. № 9. С. 1100–1109. https://doi.org/10.1134/S0044513418090106
Скоробрехова Е.М., Никишин В.П. Зависимость строения капсулы, окружающей скребня Corynosoma strumosum, от видовой принадлежности естественного паратенического хозяина // Известия РАН. Сер. биол. 2013. № 6. С. 696–712. https://doi.org/10.7868/S0002332913050160
Ченцов Ю.С. Введение в клеточную биологию. М.: “Академкнига”, 2005. 495 с.
Шарпило В.П. О способности акантелл рода Centrorhynchus (Acanthocephala, Giganthorhynchidae) к пассажу через резервуарных хозяев // Мат. научной конф. Всесоюз. общества гельминтологов. М.: Б. и. 1965. Ч. 4. С. 312–317.
Шарпило В.П. Использование резервуарных хозяев для аккумулирования и хранения инвазионных личинок гельминтов // Паразитология. 1971. Т. 5. № 1. С. 88–91.
Bennett H.S. Morphological aspects of extracellular polysaccharides // J. Histochem. Cytochem. 1963. V. 11. № 1. P. 14–23. https://doi.org/10.1177/11.1.14
Bennett G. Migration of glycoprotein from Golgi apparatus to cell coat in the columnar cells of the duodenal epithelium // J. Cell Biol. 1970. V. 45. № 3. P. 668–673. https://doi.org/10.1083/jcb.45.3.668
Bennett G., Leblond C.P. Formation of the cell coat material for the whole surface of columnar cells in the rat small intestine, as visualized by radioautography with L-fucose-3H // J. Cell Biol. 1970. V. 46. № 2. P. 409–416. https://doi.org/10.1083/jcb.46.2.409
Hoole D., Arme, C. Ultrastructural studies on the cellular response of roach, Rutilus rutilus L., to the plerocercoid larva of the pseudophyllidean cestode, Ligula intestinalis // J. Fish Diseases. 1982. V. 5. № 2. P. 131–144. https://doi.org/10.1111/j.1365-2761.1982.tb00466.x
Hoole D., Arme C. Ligula intestinalis (Cestoda, Pseudophyllidea): an ultrastructural study of the cellular response of roach fry Rutilus rutilus // Intern. J. Parasitol. 1983a. V. 13. № 4. P. 359–365. https://doi.org/10.1016/S0020-7519(83)80041-1
Hoole D., Arme C. Ultrastructural studies on the cellular response of fish hosts following experimental infection with the plerocercoid of Ligula intestinalis (Cestoda, Pseudophyllidea) // Parasitology. 1983b. V. 87. № 1. P. 139–149. https://doi.org/10.1017/S0031182000052483
Huizinga H.W. Nadakavukaren M.J. Cellular response of goldfish, Carassius auratus (L.), to metacercarie of Ribeiroia marini (Faust and Hoffman, 1934) // J. Fish Diseases. 1997. V. 20. № 6. P. 401–408.
Ito S. Structure and function of the glycocalyx // Federation Proc. 1969. V. 28. P. 12–25.
Ito S. Form and function of the glycocalyx on free cell surfaces // Philosoph. Transact. Royal Society. B. Biol. Sci. 1974. V. 268. № 891. P. 55–66. https://doi.org/10.1098/rstb.1974.0015
Nikishin V.P. Formation of the capsule around Filicollis anatis (Acanthocephala) in its intermediate host // J. Parasitology. 1992. V. 78. № 1. P. 127–137.
Skorobrechova E., Nikishin V. Structure of capsule surrounding acanthocephalans Corynosoma strumosum in paratenic hosts of three species // Paras. Res. 2011. V. 108. № 2. P. 467–475. https://doi.org/10.1007/s00436-010-2088-3
Skorobrechova E., Nikishin V., Lisitsyna O. Structure of the capsule around acanthocephalan Corynosoma strumosum from uncommon paratenic hosts – lizards of two species // Parasitology Res. 2012. V. 110. № 1. P. 459–467. https://doi.org/10.1007/s00436-011-2512-3
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


