Известия РАН. Серия биологическая, 2022, № 6, стр. 585-596
Регенерационная способность клеточных линий лиственницы сибирской в культуре in vitro
И. Н. Третьякова 1, *, М. Э. Пак 1, Н. В. Орешкова 1, 2, В. Е. Падутов 3
1 Институт леса им. В.Н. Сукачева Сибирского отделения РАН – обособленное подразделение ФИЦ КНЦ СО РАН
660036 Красноярск, ул. Академгородок, 50/28, Россия
2 Научно-образовательный центр геномных исследований Сибирского федерального университета
660041 Красноярск, пр. Свободный, 79, Россия
3 Институт леса НАН Беларуси
246050 Гомель, ул. Пролетарская, 71, Беларусь
* E-mail: cultureinvitro@mail.ru
Поступила в редакцию 13.05.2021
После доработки 04.03.2022
Принята к публикации 14.03.2022
- EDN: UDKRJO
- DOI: 10.31857/S1026347022050195
Аннотация
В статье изложены результаты исследования регенерационной способности одиннадцати клеточных линий (КЛ) лиственницы сибирской, культивируемых in vitro на питательной среде АИ в течение одного–десяти лет. КЛ отличались по продуктивности и плоидности эмбриогенных культур, морфогенезу соматических зародышей, способности их созревать и прорастать. Высокая регенерационная способность была установлена у КЛ6. Эмбриогенные культуры этой клеточной линии продуцировали крупные глобулярные зародыши, имели высокую продуктивность эмбрионально-суспензорной массы (ЭСМ) и стабильную плоидность. Генотипирование по девяти ядерным микросателлитным локусам клонированных деревьев лиственницы показало полную идентичность их КЛ6, из которой они были получены. В семилетнем возрасте у клонов деревьев появились генеративные органы. В последующий весенне-летний период завершился процесс микро- и макроспорогенеза, происходило опыление и развитие семян.
Виды Larix – одни из основных лесообразователей России, занимают обширный ареал (Дылис, 1947; Рожков и др., 1991; Ирошников, 2004). Однако виды Larix характеризуются неравномерностью урожаев в многолетнем цикле и низким качеством семян. Наиболее сильно этот феномен проявляется у лиственницы сибирской (Larix sibirica Ledeb.), у которой урожаи семян значительно ниже по сравнению с другими видами рода Larix (Третьякова и др., 2006). Сильное негативное влияние на урожай лиственницы сибирской оказывает повреждение почек лиственничной почковой галлицей Dasineura rozhkovi (Mam. et Nik). Однако в популяциях лиственницы встречаются единичные деревья, устойчивые к этому вредителю (Баранчиков, Малютина, 1987; Baranchikov, 2006).
Для реализации программ лесоразведения и лесовосстановления лиственничных лесов наиболее перспективным направлением является клонирование высокопродуктивных, устойчивых к патогенам деревьев лиственницы с использованием современных биотехнологий микроклонального размножения. Одна из них – биотехнология соматического эмбриогенеза в культуре in vitro, реализована за рубежом в программе Мульти-сортового лесного хозяйства (Multi Variety Forest, MVF) (Park et al., 2014). Применение данной технологии в сочетании с криоконсервацией создает основу для получения хозяйственно ценных генетически тестированных клонов и элитных генотипов, а также позволяет сохранить генетические ресурсы лиственницы на долгие годы (Lelu et al., 1994; Klimaszewska, Cyr, 2002; Lelu-Walter et al., 2008; Klimaszewska et al., 2016).
В настоящее время биотехнология соматического эмбриогенеза разработана для следующих видов и гибридов Larix: L. decidua (von Aderkas et al., 1990), L. kaempferi (Lelu-Walter, Paques, 2009); L. occidentalis (Thompson, von Aderkas, 1992), L. × × eurolepis (L. decidua × L. kaempferi (Klimaszewska, 1989; von Aderkas et al., 1990; Lelu et al., 1994), L. × × marschlinsii (L. kaempferi × L, decidua (Lelu et al., 1994; Lelu-Walter, Paques, 2009), L. leptolepis (Wang et al., 2007), L. sibirica, L. sukaczewii, L. gmelinii (Третьякова, Барсукова, 2012; Третьякова, Пак, 2018).
Выявлено, что соматический эмбриогенез идет под строгим генетическим контролем. Только отдельные деревья-доноры способны формировать эмбриогенные культуры и соматические зародыши в культуре in vitro (MacKay et al., 2001, 2006; Третьякова, Барсукова, 2012). На видах с контролируемым соматическим эмбриогенезом был показан уровень генетического разнообразия при использовании молекулярных маркеров (хлоропластных, ядерных микросателлитов) (Helmersson et al., 2004; Lelu-Walter et al., 2008). Эмбриогенные культуры лиственницы могут характеризоваться генетической нестабильностью, также как и другие древесные растения (von Aderkas, Anderson, 1993; Burg et al., 2007). В эмбриогенных культурах L. marschlinsii (Fourre et al., 1997), L. decidua (von Aderkas, Bonga, 1993; von Aderkas, Anderson, 1993; von Aderkas et al., 2003), L. leptolepis (von Aderkas et al., 1990), а также Picea abies (Lelu, 1987), Рinus nigrа (Salajova, Salaj, 1992), Pinus radiata (O’Brien et al., 1996) была обнаружена полиплоидия. Изучение локусов ядерных микросателлитов в клеточных линиях Pinus pinaster (Marum et al., 2009), Pinus sylvestris (Burg et al., 2007), Abies cephalonica (Aronen et al., 1999; Krajňáková et al., 2011), Quercus subres и Quercus robus (Endemann et al., 2001; Lopes et al., 2006; Wilhelm et al., 2005), Populus tremuloides (Rahman, Rajora, 2001) показало повышенную частоту мутаций и генетическую нестабильность, что, вероятно, было стимулировано длительным культивированием эмбриогенных культур (ЭК). Гетерогенные клетки с генотипами, отличными от родительского дерева, также обнаружены в наших исследованиях 2–5-месячных клеточных линий, полученных из мегагаметофитов L. sibirica (Krutovsky et al., 2014). Вместе с тем, в эмбриогенных культурах P. abies, Picea glauca, Picea mariana × P. glauca, P. pinaster, Picea orientalis сомаклональная изменчивость не обнаружена (Mo et al., 1989; Eastman et al., 1991; Tremblay et al., 1999; Harvengt et al., 2001; Hеlmersson et al., 2004; Arrillaga et al., 2014; Cabezas et al., 2016; Ahn, Choi, 2017). Проведенный нами микросателлитный анализ длительно пролиферирующих эмбриогенных культур L. sibirica показал слабую аллельную изменчивость клеточных линий (Третьякова и др., 2016).
Несмотря на активные исследования по соматическому эмбриогенезу и сомаклональной изменчивости эмбриогенных культур Larix и других хвойных видов, регенерация растений через биотехнологию соматического эмбриогенеза все еще остается проблематичной. Критическим моментом являются процессы гистодифференцировки и созревания соматических зародышей, регенерации и адаптации в условиях почвенного субстрата (Klimaszewska, Cyr, 2002; Белоруссова, Третьякова, 2008; Третьякова, Ижболдина, 2008; Третьякова, Барсукова, 2010; Пак и др. 2016).
Коллекция пролиферирующих эмбриогенных культур лиственницы сибирской ежегодно пополняется нами, начиная с 2008 г. Коллекционные клеточные линии были получены от трех генотипов №№ А4, 10 и 1(35) в результате свободного и контролируемого опыления (Третьякова и др., 2015; Пак и др., 2016). Для успешной регенерации соматических зародышей и получения клонированных растений необходимо изучить процесс реализации морфофизиологических программ, генетическую стабильность полученных эмбриогенных культур и соответствие их родительскому генотипу. В настоящей работе был проведен анализ сомаклональной вариабельности клеточных культур (морфогенез, плоидность, генотипирование) и показано ее влияние на регенерационную способность отдельных клеточных линий. Кроме того, дано описание особенности роста клонированных деревьев и проведено их генотипирование на соответствие родительскому генотипу.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводили на одиннадцати эмбриогенных клеточных линиях, полученных из незрелых зиготических зародышей материнского дерева № А4, не имеющего внешних признаков повреждения (галлов) лиственничной почковой галлицей. Это дерево произрастает в дендрарии Института леса (Красноярск, 55°59′09′′ N 92°45′53′′ E). Шишки от свободного и контролируемого опыления собирали в середине июля в 2008–2019 гг. Зародыши на предсемядольной стадии развития вводили в культуру in vitro на среду АИ (Третьякова, 2012). Иследовали следующие КЛ: КЛ4 (2009; свободное опыление), КЛ5 (2009; перекрестное опыление L. sibirica × L. sukaczewii), КЛ6 (2011; свободное опыление), КЛ10 (2012; свободное опыление), КЛ107 (2013; свободное опыление), КЛ12 (2015; свободное опыление), КЛ16.1 (2016; контролируемое самоопыление), КЛ16.28 (2016; свободное опыление), КЛ17.7 (2017; перекрестное опыление L. sibirica × L. sibirica; дерево №10), КЛ17.16 (2017; свободное опыление), КЛ18.3 (2018; свободное опыление).
Введение в культуру, индукция и пролиферация соматических зародышей были описаны нами ранее у лиственницы сибирской (Третьякова, 2012; Третьякова, Барсукова, 2012; Третьякова и др., 2015; Пак и др., 2016). Пролиферирующие эмбриогенные культуры субкультивировали на свежую питательную среду АИ через каждые две недели. Культуры инкубировали в темноте при температуре 24 ± 1°С.
Созревание соматических зародышей. Эксперименты по созреванию соматических зародышей лиственницы сибирской выполняли на базовой среде АИ, содержащей сахарозу (40 г л–1), абсцизовую кислоту (АБК, 121 мкМ), индолилмасляную кислоту (ИМК, 1 мкМ) и полиэтиленгликоль (ПЭГ, М.в. 8000, 10%). В качестве желирующего агента использовали Gelrite (4 г л–1). Культивирование осуществляли в темноте при температуре 24 ± 1°С. Регуляторы роста (АБК и ИМК), а также L-глутамин и аскорбиновую кислоту добавляли в охлажденную питательную среду после автоклавирования методом холодной стерилизации с использованием бактериальных фильтров (ТРР, Швейцария, размер пор 0.22 мкм).
Прорастание соматических зародышей. Для проращивания соматических зародышей использовали базовую питательную среду 1/2АИ, в которой в 2 раза была снижена концентрация микро-, макроэлементов, железа и сахарозы, а также исключены регуляторы роста, источники органического азота и витаминов. Соматические зародыши считали проросшими при появлении корешка. Проростки (после 5–12-ти нед. периода прорастания) переносили в стеклянные сосуды, содержащие стерильный почвенный субстрат (песок : вермикулит : : торф = 1 : 1 : 1), увлажненный 25%-ным раствором солей (среда АИ с 25%-м содержанием макро-, микросолей и железа). Культивирование осуществляли на свету при 24 ± 1°С в условиях климатокамеры.
Гистологический анализ. Для проведения гистологического анализа использовали временные препараты. Свежую эмбрионально-суспензорную массу (ЭСМ) помещали на предметное стекло и окрашивали 2%-ным водным раствором сафранина 2–3 мин. Для “двойного окрашивания” применяли 1%-ный раствор ацетокармина и 0.5%-ный раствор синего Эванса (Gupta, Durzan, 1987). Далее добавляли каплю глицерина и накрывали препарат покровным стеклом.
Продуктивность эмбриогенных клеточных линий оценивали, подсчитывая число соматических зародышей в 1 г пролиферирующей ЭСМ через неделю после пересадки. Индекс роста рассчитывали по формуле:
I = (Wt – W0)/W0, где W0 – начальная масса каллуса, г; Wt – масса каллуса в конце цикла выращивания, г (Дитченко, 2007; Farshadfar, Amiri, 2016).
Микросателлитный анализ. Для генотипирования микросателлитных локусов, выделяли ДНК из хвои материнского дерева № А4, эмбрионально-суспензорной массы КЛ6 и из хвои деревьев, регенерированных из КЛ6. ДНК выделяли с помощью CTAB-метода (Devey et al., 1996). Качество и количество ДНК проверяли с помощью Флюорометра Qubit 2 (“Invitrogen”, США). Выделенную ДНК использовали для ПЦР-анализа с девятью парами олигонуклеотидов, разработанных ранее для микросателлитного генотипирования различных видов лиственницы (Krutovskу et al., 2014). Микросателлитные локусы и условия ПЦР, которые использовались в данном исследовании, приведены в табл. 1. Использовали наборы для ПЦР анализа GenePak® PCRCore (ООО “Лаборатория Изоген”, Россия). ПЦР-амплификацию проводили на приборе ДНК-амплификатор T100 ThermalCycler (“Bio-Rad”, США). Продукты амплификации разделяли путем электрофореза в 6%-ном полиакриламидном геле в камерах для вертикального электрофореза с использованием Тris-EDTA-боратного электродного буфера. Гели окрашивали в растворе бромистого этидия и визуализировали с помощью системы гель документирования Gel Imager-2 (“Хеликон”, Россия). Молекулярную массу фрагментов определяли путем сравнения со стандартным маркером с помощью программного обеспечения PhotoCapt (“Vilber”). Плазмидную ДНК pBR322, расщепленную рестриктазой HpaII, использовали в качестве маркера.
Таблица 1.
Микросателлитные локусы, отобранные для генотипирования лиственницы сибирской (Larix sibirica)
| Локус | Мотив | Размер фрагмента | t°C отжига |
Источник литературы |
|---|---|---|---|---|
| bcLK056 | (AG)20 | 174–200 | Touchdown 63–53°С |
Isoda, Watanabe, 2006 |
| bcLK066 | (TG)12 | 155–172 | ||
| bcLK224 | (AG)17 | 152–168 | ||
| bcLK260 | (TG)14(AG)9 | 115–126 | ||
| bcLK232 | (AG)19 | 142–178 | ||
| bcLK225 | (GA)20 | 180–213 | ||
| bcLK235 | (TC)9(AC)2AG(AC)14 | 177–220 | ||
| UBCLXtet-1-22 | (TATC)9(TA)12 | 175–250 | 58°С | Chen et al., 2009 |
| UAKLly6 | (GT)17 | 214–264 | Khasa et al., 2006 |
Цитогенетический анализ. Цитогенетический анализ проводили по общепринятой для хвойных методике (Правдин и др., 1972, Пухальский и др., 2007) с собственными модификациями (Горячкина и др., 2017). Окрашивали образцы 1%-ным ацетогематоксилином. Просмотр микроскопических образцов осуществляли с помощью микроскопа “МИКМЕД-6” (“ЛОМО”, Россия) и цифровой камеры МС-12 (“ЛОМО”, Россия). Число хромосом определяли не менее чем в 100 метафазных пластинках для каждой клеточной линии.
Статистический анализ. Статистический анализ проводили с использованием стандартных методик (Шмидт, 1984) с помощью Microsoft Excel (“Microsoft Corporation”, США) и Statistica 6.0 (“Tulsa Scientific”, США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
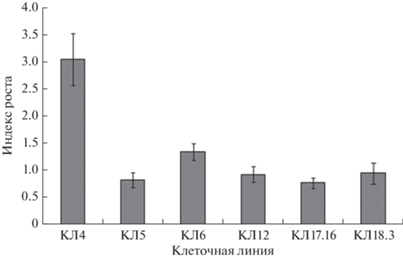
Анализ пролиферирующих клеточных линий. Пролиферирующие ЭК разного возраста (от одного года до десяти лет) (табл. 2) внешне были представлены рыхлыми структурами белого или кремового цвета, которые активно пролиферировали (рис. 1, 2). Интенсивность роста ЭК значительно варьировала между различными клеточными линиями. Анализ роста ЭК в период между субкультивированиями показал, что КЛ4 растет быстрее, чем другие клеточные линии. Индекс роста данной КЛ составил 3.07 и был в 2–3 раза выше по сравнению с другими КЛ (рис. 3). Прирост КЛ4 за 14 суток, в среднем, составил 0.77 ± 0.03 г.
Таблица 2.
Продуктивность соматических эмбриогенных клеточных линий Larix sibirica
| Клеточная линия | Дерево-донор | Год получения | Число зрелых соматических зародышей на 1 г сырого веса ЭСМ, шт | Частота созревания зародышей, от числа глобулярных % |
|---|---|---|---|---|
| 4* | А4 | 2009 | 1221 ± 138 | 33 |
| 5* | А4 × L. sukaczewii | 2009 | Зародыши не созревают | 0 |
| 6* | А4 | 2011 | 13 ± 3 | 0.6 |
| 10* | А4 | 2012 | 662 ± 73.5 | 0.6 |
| 107* | А4 | 2013 | 10 ± 2 | – |
| 12 | А4 | 2015 | 120 ± 12 | 6 |
| 16.1 | А4 × А4 | 2016 | 51 ± 7 | 1.7 |
| 16.28 | А4 | 2016 | Единичные зародыши | – |
| 17.7 | А4 × 10 | 2017 | 110 ± 55 | 3.7 |
| 17.16 | А4 | 2017 | 11 ± 5 | 0.4 |
| 18.3 | А4 | 2018 | Единичные зародыши | – |
Рис. 2.
Гистология эмбрионально-суспензорной массы лиственницы сибирской. (а) – “двойное окрашивание” эмбионального комплекса (клетки глобулы, т.е. собственно зародыша – красные, клетки суспензора – синие); (б) – глобулярные соматические зародыши. Масштаб 200 мкм.
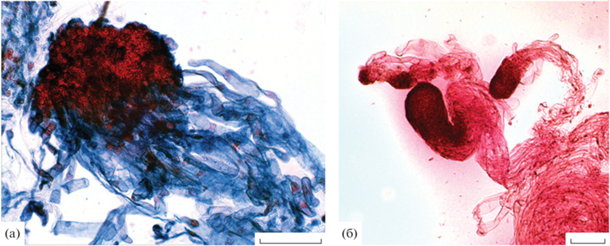
Проведенные нами ранее исследования показали, что ЭК лиственницы состояли из ЭСМ (Третьякова и др., 2016). Число глобулярных соматических зародышей у разных КЛ лиственницы колебалось от 2040 ± 189 (КЛ6) до 11103 ± 259 (КЛ10) на 1 г сырой ЭСМ (Третьякова и др., 2016). В ЭСМ были сформированы полиэмбриональные комплексы со множественными эмбрионами. Эти комплексы включали 2–8 или даже больше эмбрионов (Третьякова, Пак, 2018). Мультипликация соматических зародышей шла через кливаж и образование адвентивных почек на суспензоре. Кливаж происходил независимо от размера глобулы и активно шел как в мелких (до 90 мкм), так и в крупных (282 мкм) глобулах (Третьякова, Пак, 2018).
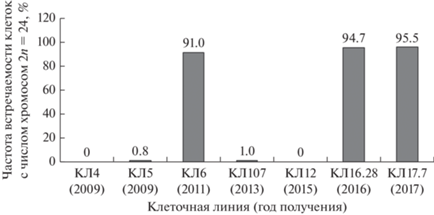
Цитогенетическое исследование.Клетки соматических зародышей однолетней КЛ17.7 и двухлетней КЛ16.28, имели стабильное число хромосом (2n = = 24, характерное для L. sibirica). У трехлетней КЛ12 большинство клеток содержали 23 + 1 хромосому, длина которой была аномальной (делеция сегмента хромосомы). Аналогичная ситуация наблюдалась и в КЛ107: только 1% клеток содержали 24 хромосомы без аберраций. У возрастных КЛ4 и КЛ5 (возраст культур 10 лет) была обнаружена цитогенетическая нестабильность, что проявлялось в значительной вариации числа хромосом в метафазных клетках. Заслуживает внимания КЛ6, которая в течение семи лет культивирования оставалась цитогенетически стабильной (рис. 4).
Рис. 4.
Частота встречаемости диплоидного числа хромосом (2n = 24) у клеточных линий лиственницы сибирской разного возраста.
Созревание соматических зародышей. Для созревания соматических зародышей эмбриогенные культуры переносили на среду АИ, дополненную АБК и ИМК. После одной–двух недель созревания соматические эмбрионы отделялись из полиэмбриональных комплексов. Гистодифференцировка зародыша была отчетливо видна уже через две–три недели культивирования на среде с АБК. На семядольной стадии развития зародыша происходила элиминация клеток суспензоров. Клеточные линии были ранжированы в соответствии с их способностью к созреванию. Мелкие соматические эмбрионы КЛ5 с коротким суспензором оставались на глобулярной стадии развития и не созревали. Соматические зародыши КЛ4 созревали очень быстро за 20–45 сут. Среднее значение длины зрелых эмбрионов КЛ4 составляло 1.2 мм. Число зрелых соматических эмбрионов в КЛ4 составило 1221 ± 138 на 1 г сырого веса ЭСМ (частота созревания – 33%, табл. 2). У остальных клеточных линий процесс созревания зародышей занимал до 60 сут.
В процессе созревания соматических зародышей лиственницы были отмечены многочисленные нарушения морфогенеза в различных областях эмбриона. Некоторые эмбрионы образовывали каллус в области центральных и базальных доменов, область семядольного кольца была аномально утолщена. Их размеры (средняя длина 2.9 мм; толщина 2 мм) превышали обычные размеры зрелых зиготических эмбрионов (длина 2 мм; толщина 0.5 мм). У КЛ6 морфогенез зародышей шел без отклонений, однако частота их созревания была низкой (0.6%) (табл. 2).
Прорастание соматических зародышей. Все эмбрионы, полученные в результате экспериментов по созреванию, были использованы для испытаний на прорастание. Появление корешка у соматических эмбрионов происходило в течение 7–10 дней на среде АИ с пониженным в 2 раза содержанием сахарозы (10 г л–1), микро-, макроэлементов, железа, без добавления гормонов, витаминов и источников органического азота. В период прорастания у соматических зародышей наблюдался ряд отклонений в развитии: уменьшение числа семядолей, утолщение (появление каллуса) в области корня. У КЛ4 при активном прорастании зародышей (83.3%) происходило образование каллуса в области корешка у большинства из них, что препятствовало дальнейшему прорастанию. Регенеранты без отклонений в развитии составили от 5 до 15%. Стабильное прорастание эмбрионов было обнаружено у КЛ6. Прорастающие зародыши переносили в почвенный субстрат и выращивали в условиях климатокамеры. В 2012 г. сеянцы, полученные от КЛ6 были высажены в теплицу.
Генотипирование по микросателлитным локусам. Трехлетние клонированные саженцы были высажены в почву лесопитомника опытной станции “Погорельский Бор” ИЛ СО РАН, в 38 км от Красноярска. Генотипирование по девяти микросателлитным локусам дерева-донора, КЛ6 и пятнадцати клонированных деревьев показало, что только два локуса bcLK235 и UAKLly6 были гетерозиготными у материнского дерева № А4, в то время как КЛ6 и клоны, полученные от этой клеточной линии, оказались гомозиготами с одним аллелем, идентичным материнскому генотипу. По локусам bcLK056, bcLK066, bcLK224, bcLK232, bcLK260, UBCLXtet_1-22 у клонов и КЛ6 наблюдалась полная идентичность генотипу дерева-донора №А4. По локусу bcLK225 в данной клеточной линии был выявлен генотип отличный от родительского (табл. 3). При этом клоны полностью идентичны КЛ6, из которой они были получены.
Таблица 3.
Микросателлитные аллели генотипа дерева-донора А4, полученной от него клеточной линии КЛ6 и клонированных деревьев лиственницы сибирской
| Локус | А4 | Кл6 | 1 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| bcLK056 | 145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
145/ 145 |
| bcLK066 | 151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
151/ 151 |
| bcLK224 | 130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
130/ 130 |
| bcLK225 * | 205/ 205 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
183/ 183 |
| bcLK232 | 134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
134/ 134 |
| bcLK235 * | 216/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
208/ 208 |
| bcLK260 | 102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
102/ 102 |
| UBCLXtet_1-22 | 180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
180/ 180 |
| UAKLly6 * | 240/ 234 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
240/ 240 |
Клонированные деревья из КЛ6 успешно растут в течение восьми лет в почве лесопитомника. Деревья не имеют никаких признаков повреждения лиственничной почковой галлицей. В семилетнем возрасте у клонированных деревьев появились генеративные органы, которые развились в последующий весенне-летний период в микро- и мегастробилы. В восьмилетнем возрасте клоны сформировали семена (рис. 5).
ОБСУЖДЕНИЕ
Основным преимуществом соматического эмбриогенеза, как стратегии вегетативного размножения хвойных видов (по сравнению с половым размножением), является высокая пролиферативная активность эмбриогенной культуры, которую возможно поддерживать в течение длительного периода времени при условии регулярного субкультиварования или путем криоконсервации (Klimaszewska et al., 2009; Lelu-Walter, Pâques, 2009). Образование соматических зародышей в длительно пролиферирующей эмбриогенной культуре гибридных лиственниц (L. × eurolepis и L. × marschlinsii) может поддерживаться в течение десяти лет. При этом, по эмбриогенной активности возрастные культуры не отличались от молодых пролиферирующих КЛ (Lelu-Walter, Pâques, 2009). Культуры, полученные из мегагаметофитов L. decudua, демонстрировали эмбриогенную способность в течение 17 лет. Однако плоидность и содержание ДНК в этих культурах увеличивались (von Aderkas et al., 2003). У других хвойных видов, таких как P. pinaster, способность самоподдержания эмбриогенной культуры была короче (Klimaszewska et al., 2009).
В настоящем исследовании эмбриогенный потенциал длительно пролиферирующих эмбриогенных культур лиственницы сибирской оставался неизменным до десяти лет. В высокопродуктивной эмбриогенной линии КЛ4 большинство соматических зародышей созревали и прорастали (табл. 2). Однако во время прорастания в области корешка образовывался каллус. У КЛ5 (L. sibirica × × L. sukaczewii) мелкие многочисленные зародыши активно размножались через кливаж в течение десяти лет, но созревание таких зародышей не происходило. Другое можно сказать о КЛ6, у которой формировались крупные соматические зародыши. Зародыши данной КЛ созревали и прорастали, затем успешно росли в почвенном субстрате. Клонированные деревья КЛ6 восемь лет растут в почве лесопитомника. Они отличаются интенсивным ростом и сверхранним появлением генеративных органов.
Известно, что эмбриогенные культуры могут характеризоваться генетической нестабильностью. Полиплоидия была описана в ЭСМ у P. s nigra (Salajova, Salaj, 1992), L. decidua, L. leptolepis, L. marschlinsii (Nkongolo, Klimaszewska, 1995) и P. radiata (O’Brien et al., 1996). У семилетних эмбриогенных КЛ Quercus robur частота полиплоидии (тетраплоидии), достигала 8%, а частота мутаций в течение соматического эмбриогенеза в зависимости от генотипа донорского дерева составляла 29.2–62.5% (Wilhelm et al., 2005). Мутации по четырем микросателлитным локусам были обнаружены в эмбриогенных КЛ Pinus sylvestris. Эти мутации произошли во время пролиферации клеток. Мутировавшие КЛ теряли способность к дифференцировке при созревании семядольных соматических зародышей (Fourre et al., 1997; De Verno, 1999). Генетические вариации по семи микросателлитным локусам были обнаружены в эмбриогенных клеточных линиях P. pinaster после 6–22-месячной пролиферации in vitro, а также у 9.6% проростков данного вида (Marum et al., 2009). Однако корреляция между наличием мутаций в клетках эмбриогенного каллуса и аномальными фенотипами проростков P. pinaster не была выявлена (Miguel, Marum, 2011). Наличие изменений было отмечено в геноме эмбриогенной культуры P. abies и Picea omorica, культивируемых в течение 42–44 месяцев (Hazubska-Przybył, Dering, 2017).
Генетическая изменчивость, определяемая при помощи микрасателлитных маркеров, была показана в культуре мегагаметофитов P. pinaster. Однако из 23 КЛ P. pinaster лишь одна КЛ оказалась генетически стабильной (Arrillaga et al., 2014). Анализ каллусных линий P. abies также показал генетическую стабильность только у одной клеточной линии (Hazubska-Przybył et al., 2013). В наших экспериментах из одиннадцати КЛ (пять из которых были длительно пролиферирующими), только одна длительно культивируемая линия (КЛ6) продемонстрировала генетическую стабильность как по числу хромосом, так и по микросателлитным локусам.
Ряд авторов (Mo et al., 1989; Isabel et al., 1993; Fourre et al., 1997; Harvengt et.al., 2001, Helmersson et al., 2004; Nunes et al., 2018) сообщали об отсутствии сомаклональных вариаций в процессе соматического эмбриогенеза у голосеменных растений (P. abies, Picea glauca, Picea mariana, P. mariana × × P. glauca, P. pinaster, Pinus etlliottii × Pinus caribaea) и других видов (Rahman and Rajora, 2001). Высокая стабильность трех ядерных микросателлитных локусов была обнаружена у P. glauca во время соматического эмбриогенеза и в регенерантах (Helmersson et al., 2004). Исследования методом проточной цитометрии плоидности гибридных видов P. ellioiiii var. elliotii × P. caribaea var. hondurensis показали, что эмбриогенные культуры имели уровень плоидности, аналогичный их материнским растениям (Numes et al., 2018).
Микросателлитный анализ, проведенный нами ранее на ЭСМ эмбриогенных культур L. sibirica, показал слабую аллельную вариабельность между КЛ и деревом-донором (Третьякова и др., 2016). Эти данные соответствовали литературным источникам, в которых указывалось на генетическую стабильность эмбриогенных культур некоторых видов Picea и Pinus (Mo et al., 1989; Isabel et al., 1993; Fourre et al., 1997; Harvengt et al., 2001; Helmersson et al., 2004; Nunes et al., 2018). Вероятно, в значительном большинстве случаев генетическая стабильность эмбриогенных культур сохраняется у молодых клеточных линий, а с возрастом культуры теряют генетическую стабильность. Это было показано в наших экспериментах с лиственницей сибирской. Плоидность эмбриогенных КЛ начинает изменяться с трехлетнего возраста и только семилетние культуры КЛ6 остаются генетически стабильными. Хелмерсон с соавторами (Helmersson et al., 2004) предположили, что изменения числа хромосом и повреждения ДНК в клетках эмбриогенной культуры хвойных может привести к элиминации мутирующих зародышей и выживанию тех из них, которые оставались генетически стабильными. Это предположение может объяснить появление нормальных соматических эмбрионов, генетически идентичных исходным эксплантам (Helmersson et.al., 2004). Была высказана гипотеза (Vendrame et al., 1999), что генетическая изменчивость культуры Carya illinoinensis контролируется генотипом (а не возрастом культуры). Таким образом, можно предположить, что мутировавшие клетки, обнаруженные в соматических зародышах L. sibirica, также как и P. abies, P. glauca и P. mariana × P. glauca (Helmersson et al., 2004) в процессе созревания и прорастания соматических зародышей элиминируются. Следовательно, можно объяснить, почему возрастные КЛ, такие как генетически стабильная КЛ6 у лиственницы сибирской, могут продуцировать жизнеспособные соматические зародыши, которые успешно созревают и способны развиваться в быстро растущие растения. Эти восьмилетние деревья L. sibirica успешно растут в почве питомника. Клоны лиственницы сибирской, полученные из КЛ6, не имеют морфологических отклонений, внешних признаков повреждения лиственничной почковой галлицей и генетически стабильны (табл. 3). Совершенствование протоколов получения соматических зародышей и отбор генетически стабильных клеточных линий лиственницы являются перспективными направлениями для создания высокопродуктивных, устойчивым к энтомовредителям лиственничных насаждений в России и республике Беларусь.
* * *
Из одиннадцати проанализированных нами клеточных линий лиственницы сибирской только одна КЛ6 имела высокую регенерационную способность. Эмбриогенные культуры этой линии продуцировали крупные глобулярные зародыши, были стабильными по продуктивности ЭСМ, плоидности и имели слабую изменчивость по микросателлитным локусам. На стадии созревания соматические зародыши данной линии завершали эмбриогенез. Однако все они прорастали и сеянцы успешно росли в теплице и далее в почве лесопитомника. Клонированные деревья были генетически стабильными и полностью соответствовали КЛ6, из которой они были получены. В семилетнем возрасте у деревьев, полученных из эмбриогенных культур, произошла закладка генеративных органов, которые развились в последующий весенне-летний период в возрасте восьми лет. Таким образом, создание высокопродуктивных, устойчивых к патогенам клоновых плантаций лиственницы в Сибири из эмбриогенных клеточных культур очень перспективно.
Финансирование. Работа выполнена при частичной финансовой поддержке РФФИ, Правительства Красноярского края, Красноярского краевого фонда поддержки научной и научно-технической деятельности в рамках научных проектов № 19-44-240009 и РФФИ-Бел_а № 18-54-00010.
Конфликт интересов: Авторы заявляют, что какой-либо конфликт интересов отсутствует.
Список литературы
Баранчиков Ю.Н., Малютина В.С. Рост почек и устойчивость лиственниц к поражению почковой галлицей // Лесоведение. 1987. № 3. С. 39–45.
Белоруссова А.С., Третьякова И.Н. Особенности формирования соматических зародышей у лиственницы сибирской: эмбриологические аспекты // Онтогенез. 2008. Т. 39. № 2. С. 106–115.
Горячкина О.В., Пак М.Э., Третьякова И.Н. Цитогенетические особенности эмбриогенных клеточных линий Larix sibirica (Ledeb.) в культуре in vitro // Вестник Томского государственного университета. Биология. 2017. № 39. С. 140–153.
Дитченко Т.И. Культура клеток, тканей и органов растений: Метод. рекомендации к лабораторным занятиям, задания для с амостоятельной работы и контроля знаний студентов // Минск: БГУ, 2007. 25 с.
Дылис Н.В. Сибирская лиственница // М.: Изд. МОИП, 1947.
Ирошников А.И. Лиственницы России. Биоразнообразие и селекция // М.: ВНИИЛМ. 2004. 182 с.
Пак М.Э., Иваницкая А.С., Двойнина Л.М., Третьякова И.Н. Эмбриогенный потенциал длительно пролиферирующих клеточных линий Larix sibirica in vitro // Сибирский лесной журн. 2016. № 1. С. 27–38.
Правдин Л.Ф., Бударагин В.А., Круклис М.В., Шершукова О.П. Методика хромосомного изучения хвойных пород I Лесоведение. 1972. № 2. С. 67–75.
Пухальский В.А., Соловьёв А.А., Бадаева Е.Д., Юрцев В.Н. Практикум по цитологии и цитогенетике растений // М.: Изд. КолосС, 2007.
Рожков А.С., Хлиманкова Е.С., Степанчук Е.С. Восстановительные процессы у хвойных при дефолиации. Новосибирск: Наука. Сиб. отд-ние, 1991. 88 с.
Третьякова И.Н. Способ микроклонального размножения лиственницы сибирской в культуре in vitro через соматический эмбриогенез на среде АИ для плантационного лесовыращивания. Патент РФ RU 2456344 C2. М.: Федеральная служба по интеллектуальной собственности, 2012.
http://www.freepatent.ru/images/patents/5/2456344/patent-2456344.pdf
Третьякова И.Н., Баранчиков Ю.Н., Буглова Л.В., Белоруссова А.С., Романова Л.И. Особенности формирования генеративных органов лиственницы сибирской и их морфогенетический потенциал // Успехи современной биологии. 2006. Т. 126. № 5. С. 472–481.
Третьякова И.Н., Барсукова А.В. Сохранение генофонда хвойных видов Сибири при помощи соматического эмбриогенеза in vitro – современного метода биотехнологии // Хвойные бореальной зоны. 2010. Т. 27. № 1–2. С. 203–206.
Третьякова И.Н., Барсукова А.С. Соматический эмбриогенез в культуре in vitro трех видов лиственницы // Онтогенез. 2012. Т. 43. № 6. С. 425–435.
Третьякова И.Н., Иваницкая А.С., Пак М.Э. Продуктивность эмбриогенных клеточных линий и их сомаклональная изменчивость у лиственницы сибирской in vitro // Лесоведение. 2015. № 1.С. 27–35.
Третьякова И.Н., Ижболдина М.В. Особенности роста эмбриогенного каллуса и получение соматических зародышей у кедра сибирского // Хвойные бореальной зоны. 2008. Т. 25. № 1–2.
Третьякова И.Н., Пак М.Э., Иваницкая А.С., Орешкова Н.В. Особенности соматического эмбриогенеза длительно пролиферирующих клеточных линий Larix sibirica in vitro // Физиол. Раст. 2016. Т. 63. № 6. С. 912–822.
Третьякова И.Н., Пак М.Э. Соматический полиэмбриогенез Larix sibirica в эмбриогенной культуре in vitro // Онтогенез. 2018. Т. 49. № 4. С. 1–13.
Шмидт В.М. Математические методы в ботанике. Учеб. пособие. Л.: Изд-во Ленингр. ун-та, 1984. 288 с.
Ahn C.H., Choi Y.E. In vitro clonal propagation and stable cryopreservation system for Platycladus orientalis via somatic embryogenesis // Plant Cell Tissue Organ Cult. 2017. V. 131. № 3. P. 513–523.
Aronen T.S., Krajnakova J., Häggman H., Ryynänen L.A. Genetic fidelity of cryopreserved embryogenic cultures of open-pollinated Abies cephalonica // Plant Sci. 1999. V. 142. P. 163–172.
Arrillaga I., Guevara M.A., Muñoz-Bertomeu J., Lázaro-Gimeno D., Sáez-Laguna E., Díaz L.M., Torralba L., Mendoza-Ponderous I., Segura I., Cervera M.T. Selection of haploid cell lines from megagametophyte cultures of maritime pine as a DNA source for massive sequencing of the species // Plant Cell Tissue Organ Cult. 2014. V. 118. P. 147–155.
Baranchikov Yu.N. Factors of resistance to the larvae of gall midge Dasineura rozhkovi Mam. et Nik. (Diptera, Cecidomyiidae) in larch // Russian J. Ecology. 2006. V. 37.4. P. 288–290.
Burg K., Helmersson A., Bozhkov P., von Arnold S. Developmental and genetic variation in nuclear microsatellite stability during somatic embryogenesis in pine // J. Exp. Bot. 2007. V. 58. P. 687–698.
Cabezas J.A., Morcillo M., Vélez M.D., Díaz L., Segura J., Cervera M.T., Arrillaga I. Haploids in conifer species: characterization and chromosomal integrity of a maritime pine cell line // Forest. 2016. V. 7. P. 274.
Chen C., Liewlaksaneeyanawin C., Funda T., Kenawy A., Newton C.H., El-Kassaby Y.A. Development and characterization of microsatellite loci in western larch (Larix occidentalis Nutt) // Mol Ecol Resour. 2009. V. 9. P. 843–845.
De Verno L.L., Park Y.S., Bonga J.M., Barrett J.D. Somaclonal variation in cryopreserved embryogenic clones of white spruce [Picea glauca (Moench) Voss.] // Plant Cell Rep. 1999. V. 18. P. 948–953.
Devey M.E., Bell J.C., Smith D.N., Neale D.B., Moran G.F. A genetic linkage map for Pinus radiate based on RFLP, RAPD, and microsatellite markers // Theor Appl Genet. 1996. V. 92. P. 673–679.
Eastman P., Webster F.B., Pitel J.A., Roberts D.R. Evaluation of somaclonal variation during somatic embryogenesis of interior spruce (Picea glauca engelmanii complex) using culture morphology and isozyme analysis // Plant Cell Rep. 1991. V. 10. P. 425–430.
Endemann M., Hristoforoglu K., Stauber T., Wilhelm E. Assessment of age-related polyploidy in Quercus robur L. somatic embryos and regenerated plants using DNA flow cytometry // Biol Plant. 2001. V. 44. P. 339–345.
Farshadfar E., Amiri R. In vitro application of integrated selection index for screening drought tolerant genotypes in common wheat // Acta agriculturae Slovenica. 2016. V. 107. № 2. P. 335–344.
Fourre J.L., Berger P., Niquet L., André P. Somatic embryogenesis and somaclonal variation in Norway spruce: morphogenetic, cytogenetic and molecular approaches // Theor Appl Genet. 1997. V. 94. P. 159–169.
Gupta P.K., Durzan D.J. Biotechnology of somatic polyembryogenesis and plantlet regeneration in loblolly pine // Bio/technology. 1987. V. 5. № 2. P. 147–151.
Harvengt L., Trontin J.F., Reymond I., Canlet F., Pâques M. Molecular evidence of true-to-type propagation of a 3-year-old Norway spruce through somatic embryogenesis // Planta 2001. V. 213. P. 828–832.
Hazubska-Przybył T., Chmielarz P., Michalak M., Dering M., Bojarczuk K. Survival and genetic stability of Picea abies embryogenic cultures after cryopreservation using a pregrowth-dehydration method // Plant Cell Tissue and Organ Culture. 2013. V. 113. № 2. P. 303–313.
Hazubska-Przybył T., Dering M. Somaclonal variation during Picea abies and P. omorika somatic embryogenesis and cryopreservation // Acta Biologica Cracoviensia s. Botanica. 2017. V. 59. № 1. P. 93–103.
Helmersson A., von Arnold S., Burg K., Bozhkov P.V. High stability of nuclear microsatellite loci during the early stages of somatic embryogenesis in Norway spruce // Tree Physiol. 2004. V. 24. P. 1181–1186.
Isabel I.N., Tremblay L., Michaud M., Krusberg L., Hammerschlag E. RAPDs as an aid to evaluate the genetic integrity of somatic embryogenesis-derived populations of Picea mariana (Mill) B.S.P. // Theor Appl Genet. 1993. V. 86. P. 81–87.
Isoda K., Watanabe A. Isolation and characterization of microsatellite loci from Larix kaempferi. Mol Ecol. 2006. V. 6. P. 664–666.
Khasa D.P., Jaramillo-Correa J.P., Jaquish B., Bousquet J. Contrasting microsatellite variation between subalpine and western larch, two closely related species with different distribution patterns // Mol Ecol. 2006. V. 15. P. 3907–3918.
Klimaszewska K., Noceda C., Pelletier G., Label P., Rodriguez R., Lelu-Walter M.A. Biological characterization of young and aged embryogenic cultures of Pinus pinaster (Ait) // In Vitro Cell Dev Biol Plant. 2009. V. 45. P. 20–33.
Klimaszewska K., Cyr D.R. Conifer somatic embryogenesis: I. Development. // Dendrobiology. 2002. V. 48. P. 31–39.
Klimaszewska K., Hargreaves C., Lelu-Walter M. A., Trontin J.F. Advances in conifer somatic embryogenesis since year 2000 // In vitro embryogenesis in higher plants. Humana Press, New York, NY. 2016. P. 131–166.
Klimaszewska K. Recovery of somatic embryos and plantlets from protoplast cultures of Larix× eurolepis // Plant cell rep. 1989. V. 8. № 8. P. 440–444.
Krajňáková J., Sutela S., Aronen T., Gömöry D., Vianello A., Häggman H. Long-term cryopreservation of Greek fir embryogenic cell lines: recovery, maturation and genetic fidelity // Cryobiology. 2011. V. 63. P. 17–25.
Krutovsky K.V., Tretyakova I.N., Oreshkova N.V., Pak M.E., Kvitko O.V., Vaganov E.A. Somaclonal variation of haploid in vitro tissue culture obtained from Siberian larch (Larix sibirica Ledeb.) megagametophytes for whole genome de novo sequencing // In Vitro Cell Dev Biol – Plant. 2014. V. 50. P. 655–664.
Lelu M.A., Bastien C., Klimaszewska K., Ward C., Charest P.J. An improved method for somatic plantlet production in hybrid larch (Larix × leptoeuropaea): Part 1. Somatic embryo maturation // Plant Cell Tissue Organ Cult. 1994. V. 36. № 1. P. 107–115.
Lelu M.A. Variations morphologiques et génétiques chez Picea abies obtenues après embryogenèse somatique. In: Annales de recherches sylvicoles de l’AFOCEL de l’ année 1987. P. 35–47.
Lelu-Walter M.-A., Pâques L.E. Simplified and improved somatic embryogenesis of hybrid larches (Larix × eurolepis and Larix × marschlinsii). Perspectives for breeding // Ann For Sci. 2009. V. 66. V. 104–104.
Lelu-Walter M.A., Bernier-Cardou M., Klimaszewska K. Clonal plant production from self-and cross-pollinated seed families of Pinus sylvestris (L.) through somatic embryogenesis // Plant Cell Tissue Organ Cult. 2008. V. 92. № 1. P. 31–45.
Lopes T., Pinto G., Loureiro J., Costa A., Santos C. Determination of genetic stability in long-term somatic embryogenic cultures and derived plantlets of cork oak using microsatellite markers // Tree Physiol. 2006. V. 26. P. 1145–1152.
MacKay J., Becwar M., Park Y., Perfetti C., Cordero J., Pullman G., Lockhart L. Genetics of somatic embryogenesis in loblolly pine. In: Dean JF (ed) Proceedings (publ no 48) 26th southern forest tree improvement Conference, University of Georgia, Athens. 2001. P. 40–47.
MacKay J.J., Becwar M.R., Park Y.-S., Corderro J.P., Pullman G.S. Genetic control of somatic embryogenesis initiation in loblolly pine and implications for breeding // Tree Genet Genomes. 2006. V. 2. P. 1–9. https://doi.org/10.1007/s11295-005-0020-2
Marum L., Rocheta M., Maroco J., Oliveira M., Miguel C. Analysis of genetic stability at SSR loci during somatic embryogenesis in maritime pine (Pinus pinaster) // Plant Cell Rep. 2009. V. 28. P. 673–682.
Miguel C., Marum L. An epigenetic view of plant cells cultured in vitro: somaclonal variation and beyond // J Exp Bot. 2011. V. 62. P. 3713–3725.
Mo L.M., von Arnold S., Lagererantz U. Morphogenic and genetic stability in long term embryogenic cultures and somatic embryos of Norway spruce (Picea abies [L.] Karst.) // Plant Cell Rep. 1989. V. 8. P. 375–378.
Nkongolo K.K., Klimaszewska K. Cytological and molecular relationships between Larix decidua, L. leptolepis and Larix × eurolepis: identification of species specific chromosomes and synchronization of mitotic cell. Theor Appl Genet. 1995. V. 90. P. 827–834.
Nunes S., Marum L., Farinha N., Pereira V.T., Almeida T., Sousa D., Mano N., Figueiredo J., Dias M.C., Santos C. Somatic embryogenesis of hybrid Pinus elliottii var. elliottii× P. caribaea var. hondurensis and ploidy assessment of somatic plants // Plant Cell Tissue Organ Cult. 2018. V. 132. № 1. P. 71–84.
O’Brien E.W., Smith D.R., Gardner R.C., Murray B.G. Flow cytometric determination of genome size in Pinus // Plant Sci. 1996. V. 115. P. 91–99.
Park Y.-S. Conifer somatic embryogenesis and multi-varietal forestry. In: Fenning T (ed) Challenges and Opportunities for the World’s Forests in the 21st Century. Forestry Sciences, Springer, Dordercht. 2014. V. 81. P. 425–439.
Rahman M., Rajora O. Microsatellite DNA somaclonal variation in micropropagated trembling aspen (Populus tremuloides) // Plant Cell Rep. 2001. V. 20. P. 531–536.
Salajova T., Salaj J. Somatic embryogenesis in European black pine (Pinus nigra Arn.) // Biol Plant. 1992. V. 34. P. 213–218.
Thompson R.G., von Aderkas P. Somatic embryogenesis and plant regeneration from immature embryos of western larch // Plant cell reports. 1992. V. 11. № 8. P. 379–385.
Tremblay L., Levasseur C., Tremblay F.M. Frequency of somaclonal variation in plants of Black spruce (Picea mariana, Pinaceae) and White spruce (P. glauca, Pinaceae) derived from somatic embryogenesis and identification of some factors involved in genetic instability // Am J Bot. 1999. V. 86. P. 1373–1381.
Vendrame W.A., Kochert G., Wetzstein H.Y. AFLP analysis of variation in pecan somatic embryos // Plant Cell Report. 1999. V. 18. P. 853–857.
Von Aderkas P., Pattanavibool R., Hristoforoglu K., Ma Y. Embryogenesis and genetic stability in long term megagametophyte-derived cultures of larch // Plant Cell Tissue Organ Cult. 2003. V. 74. P. 27–34.
Von Aderkas P., Klimaszewska K., Bonga J.M. Haploid and diploid embryogenesis in Larix leptolepis, L. decidua and their reciprocal hybrids // Can. J. For. Res. 1990. V. 20. P. 9–14.
Von Aderkas P., Anderson P. Aneuploidy and polyploidization in haploid tissue cultures of Larix deciduas // Physiol Plant. 1993. V. 88. P. 73–77.
Von Aderkas P., Bonga J.M. Plants from haploid tissue culture of Larix deciduas // Theoretical and Applied Genetics. 1993. V. 87. № 1–2. P. 225–228.
Wang X.X., Lu L.D., Hao H.Q., Teng N.J., Chen T., Guo Y.M., Yang Y.G., Guo Z.C., Lin J.X. High-efficiency somatic embryogenesis and morphohistology and histochemistry of somatic embryo development in Larix leptolepis Gordon // Forestry Studies in China. 2007. V. 9. № 3. P. 182–188.
Wilhelm E., Hristoforoglu K., Fluch S., Burg K. Detection of microsatellite instability during somatic embryogenesis of oak // Plant Cell Rep. 2005. V. 23. P. 790–795.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая