Известия РАН. Серия биологическая, 2022, № 6, стр. 575-584
Экспрессия матричных РНК транскрипционных факторов GATA3, FOXP3, TBX21, STAT3, NFKB1, MAPK8 у человека и их кооперативные взаимодействия в отдаленные сроки после хронического радиационного воздействия
В. С. Никифоров 1, 2, *, А. В. Аклеев 1, 2
1 ФГБУН “Уральский научно-практический центр радиационной медицины” ФМБА
454048 Челябинск, ул. Воровского, д. 68, корп. А, Россия
2 ФГБОУВО “Челябинский государственный университет”
454001 Челябинск, ул. Братьев Кашириных, д. 129, Россия
* E-mail: nikiforovx@mail.ru
Поступила в редакцию 20.04.2022
После доработки 05.05.2022
Принята к публикации 16.05.2022
- EDN: MBCBCJ
- DOI: 10.31857/S1026347022060105
Аннотация
Представлены результаты оценки экспрессии мРНК транскрипционных факторов GATA3, FOXP3, TBX21, STAT3, NFKB1 и MAPK8 в клетках периферической крови у 264 жителей прибрежных сел реки Течи Челябинской и Курганской областей, которые в 1950-х гг. подверглись хроническому низкоинтенсивному радиационному воздействию. Диапазон индивидуальных значений дозы облучения красного костного мозга за счет внешнего гамма-излучения и 90Sr составил 77.8–3507.1 мГр, среднее значение – 706.3 ± 46.3 мГр. Установлено, что в отдаленные сроки после хронического облучения на молекулярном уровне происходят изменения в транскрипционном ответе клетки. Отмечена модификация экспрессии иммунорегуляторных генов NFKB1 и MAPK8 в клетках периферической крови облученных людей. Сравнительный анализ взаимодействия исследуемых мРНК продемонстрировал наличие связи генов MAPK8 и NFKB1 в группе хронически облученных лиц. Полученные результаты могут свидетельствовать о вовлеченности этих транскрипционных факторов в нарушение иммунного ответа у облученного населения.
Большинство клеточных процессов, определяющих генетический гомеостаз организма, а также надежность хранения и передачи наследственной информации после облучения, генетически детерминированы. При изучении ответа клеток на действие малых доз ионизирующего излучения (преимущественно с низкой мощностью дозы), наблюдается изменение экспрессии ряда генов, в том числе транскрипционных факторов, вовлеченных в сигнальные пути, направленные на регуляцию функций субпопуляций лимфоцитов, секрецию цитокинов и хемокинов, что позволяет экспонированным клеткам и тканям восстанавливать генетический гомеостаз (Amundson et al., 2003). Так, облучение в диапазоне малых доз способствует изменению уровня транскрипции ключевых белков (p105, JNK1, p38 MAPK, Lck, ZAP70), участвующих в трансдукции сигнала CD4+-лимфоцитов, и изменению экспрессии генов, регулирующих иммунный ответ (Rizvi et al., 2011).
В Челябинской и Курганской областях у облученных жителей прибрежных сел реки Течи описаны некоторые изменения иммунитета в период реализации отдаленных медицинских последствий. У данной категории лиц отмечается пониженное количество лейкоцитов в крови за счет снижения содержания нейтрофилов и лимфоцитов, пониженные показатели интенсивности внутриклеточного кислородзависимого метаболизма моноцитов, активация лизосомальной активности нейтрофилов и воспалительные изменения цитокинового спектра сыворотки крови, в частности снижение содержания ИЛ-4 и повышение уровней ФНОα и ИФНγ (Аклеев, 2020).
В некоторых случаях изменение паттерна экспрессии генов вовлечено в патогенез отдаленных радиационных эффектов, таких как злокачественные новообразования и изменение иммунного статуса у облученных людей (Шуленина и др., 2012). Показано, что хроническое радиационное воздействие в диапазоне малых доз в отдаленные сроки приводит к модификации экспрессии транскрипционного фактора NFKB1, сопровождающейся усилением экспрессии ИЛ-1 и ИЛ-6 (Hosoi et al., 2001). Повышенное содержание мРНК генов семейства NFKB (NFκB1, NF-κB2 и Rel), а также генов, регулирующих пролиферацию и дифференцировку иммунокомпетентных клеток, наблюдалось в отдаленные сроки (спустя более 20 лет) у лиц с раком предстательной железы (Savli et al., 2008), щитовидной железы (Cine et al., 2012), и лейкозом (Savli et al., 2012), облученных вследствие аварии на ЧАЭС. В работе (Albanese et al., 2007.) говорится об изменении активности 116 генов цитокинов и репарации спустя 11–12 лет у людей, облученных в диапазоне накопленных доз от 0.18 до 49.0 мГр. Детальное описание картины полученных изменений свидетельствовало о смещении иммунного баланса в сторону воспалительных реакций у данной категории людей в отдаленные сроки.
Поскольку вызванные радиационно-индуцированные изменения в системе клеточного гомеостаза могут сохраняться в течение длительного времени после облучения, целью настоящей работы явилась оценка экспрессии транскрипционных факторов, участвующих в регуляции системного иммунитета у хронически облученных жителей прибрежных сел реки Течи в период реализации отдаленных соматико-стохастических эффектов радиационного воздействия.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили образцы периферической крови от 264 жителей прибрежных сел реки Течи, подвергшихся хроническому радиационному воздействию вследствие сбросов жидких радиоактивных отходов (ЖРО) ПО “Маяк”. Внутреннее облучение формировалось за счет радионуклидов, поступивших в организм с речной водой и продуктами местного производства, внешнее γ-излучение было сформировано за счет загрязнения радионуклидами донных отложений и пойменных почв. В качестве основных дозиметрических величин, определяющих меры воздействия ИИ на организм обследованных лиц, являлись дозы облучения ККМ, тимуса и периферических лимфоидных органов.
Массированные сбросы радиоактивных отходов начались в 1950 г., и в первые годы основными источниками облучения были короткоживущие радионуклиды. Затем в результате защитных мероприятий и распада короткоживущих радионуклидов мощность дозы внешнего облучения, а также внутреннего облучения мягких тканей существенно снизилась и после 1960 г. не превышала 10–5 Гр/год для всех, кто проживал на прибрежных территориях. Несколько иная картина облучения была у красного костного мозга, поскольку главный вклад в формирование дозы вносил долгоживущий остеотропный 90Sr, обеспечивающий хроническое облучение с монотонно снижающейся мощностью дозы, которая к 1985 г. у всех облученных была менее 10–5 Гр/год (Degteva et al., 2019).
Из исследования были исключены лица: а) в период острых или обострения хронических воспалительных заболеваний; б) имеющие онкологические и аутоиммунные заболевания; в) принимающие во время обследования антибиотики, гормональные и цитостатические препараты; г) имевшие контакт с генотоксичными агентами в процессе профессиональной деятельности.
На основании сформулированных критериев были выделены две основные группы обследуемых людей:
1. Группа облученных лиц с индивидуальными накопленными дозами облучения ККМ более 70 мГр.
2. Группа сравнения – лица, проживающие в сходных социально-экономических условиях, но с накопленной дозой облучения ККМ, не превышающей 70 мГр за весь период жизни (условный внутренний контроль).
Исследование экспрессии транскрипционных факторов у облученных людей проводили в отделенные сроки от начала хронического радиационного воздействия (спустя более 60 лет). Группа хронически облученных лиц составила 168 человек, в группу сравнения вошло 96 человек. В табл. 1 представлена характеристика обследуемых групп.
Таблица 1.
Характеристика обследованных групп
| Характеристика групп | Облученные лица | Группа сравнения | |
|---|---|---|---|
| 168 | 96 | ||
| Возраст на момент обследования, лет: M ± SE (min–max) | 71.0 ± 0.4 (60.0–87.0) |
66.4 ± 0.7 (60.0–87.0) |
|
| Пол, n (%) | Мужчины | 62 (37) | 33 (34) |
| Женщины | 106 (63) | 63 (66) | |
| Накопленные дозы облучения ККМ, мГр: M ± SE (min–max) | 706.3 ± 46.3 (77.8–3507.1) |
18.8 ± 1.7 (0.0–67.5) |
|
| Мощность дозы облучения ККМ в период максимального воздействия, мГр/год: M ± SE (min–max) | 131.3 ± 10.0 (2.3–719.2) |
0.62 ± 0.2 (0.0–9.5) |
|
| Накопленные дозы облучения тимуса и периферических лимфоидных органов, мГр: M ± SE (min–max) | 92.2 ± 7.9 (2.8–644.88) |
7.1 ± 0.9 (0.0–33.57) |
|
| Мощность дозы облучения тимуса и периферических лимфоидных органов в период максимального воздействия, мГр/год: M ± SE (min–max) | 38.47 ± 3.8 (0.3–321.0) |
0.31 ± 0.1 (0.0–6.4) |
|
Среднее значение возраста для хронически облученных лиц составило 71.04 ± 0.43 год (диапазон: 60–87 лет), для группы сравнения – 66.45 ± 0.70 лет (диапазон: 60–87 лет). В двух группах подавляющее большинство образцов крови было получено от женщин. Обследуемые группы состояли из лиц, принадлежавших к двум этническим группам: славяне (в основном русские, а также украинцы и белорусы) и тюрки (в основном татары и башкиры).
Средняя накопленная доза облучения ККМ у лиц, подвергшихся хроническому радиационному воздействию, составила 706.3 ± 46.3 мГр (диапазон: 77.8–3507.1 мГр). Средняя накопленная доза облучения тимуса и периферических лимфоидных органов составила 131.3 ± 10.0 мГр (диапазон: 2.3–719.2 мГр). Максимальное значение мощности дозы облучения ККМ было получено людьми в период повышенного радиационного воздействия (1950–1951 гг.). Среднее значение мощности дозы облучения ККМ в период максимального воздействия в группе хронически облученных людей составило 131.3 ± 10.0 мГр/год (диапазон: 2.3–719.2 мГр/год), среднее значение мощности дозы облучения тимуса и периферических лимфоидных органов в период максимального воздействия составило 38.5 ± 3.8 мГр/год (диапазон: 0.3–321.0 мГр/год). Все пациенты подписывали добровольное информированное согласие на проведение исследования, одобренное этическим комитетом УНПЦ РМ ФМБА России.
Материалом для исследования служили образцы периферической крови, собранные в стерильные вакуумные пробирки Tempus Blood RNA Collection Tubes (“Applied Biosystem”, США), содержащие транспортную среду для стабилизации РНК в биопробах. Взятие крови осуществлялось из локтевой вены утром натощак.
Выделение РНК проводили на колонках с помощью набора GeneJET Stabilized and Fresh Whole Blood RNA Kit (Thermo Scientific™, США) по стандартной методике. Информацию о концентрации и чистоте выделенных образцов РНК получали с помощью спектрофотометра NanoDrop 2000С (Thermo Scientific, США). Отношение оптических плотностей, измеренных при A260/280 для РНК, выделенной из всех образцов крови, составило 2.0 ± 0.05. Исходным количеством для анализа было 100 нг/мкл РНК каждого образца. Реакцию обратной транскрипции для синтеза кДНК проводили с использованием коммерческого набора реагентов High-Capacity cDNA Reverse Transcription Kit (Applied Biosystem, США). Относительное количественное содержания мРНК определяли с помощью ПЦР в режиме реального времени с использованием амплификатора CFX96 Touch (Bio-Rad Laboratories, USA).
Количественную оценку экспрессии анализируемых генов проводили по методу 2–ΔΔСt (Livak et al., 2001). Данные оценивали относительно уровней мРНК генов “домашнего хозяйства” (housekeeping genes) COMT и B2M. Анализ кривых амплификации производили в программе Bio-Rad CFX Manager 2.1 (Bio-Rar Laboratories, США) методом пороговой линии. Расчет проводился с учетом трех повторов для каждого гена и эффективности амплификации, которая была получена путем построения калибровочных кривых. В работе были использованы коммерческие наборы праймеров/зондов от Applied Biosystems, США: STAT3 (Hs00374280_m1), GATA3 (Hs00231122_m1), MAPK8 (Hs01548508_m1), NFKB1 (Hs00765730_m1), FOXP3 (Hs01085834_m1) и TBX21 (Hs00894392_m1).
Статистический анализ данных исследования проводили с применением стандартных методов математико-статистической обработки с использованием пакетов программ прикладного статистического анализа (Statistica v. 10.0 и SigmaPlоt). Для оценки межгрупповых различий значений признаков применяли U-критерий Манна–Уитни. Определение вида зависимости экспрессии транскрипционных факторов от дозовых характеристик у облученных людей проводилось с использованием корреляционного и регрессионного анализа. Для всех критериев и тестов различия признавали статистически значимыми при p < 0.05. При 0.05 < < p < 0.1 различие рассматривали как тенденцию к значимому различию и необходимости увеличения числа наблюдений.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты определения экспрессии мРНК иммунорегуляторных генов GATA3, FOXP3, TBX21, STAT3, NFKB1, MAPK8 в клетках периферической крови обследованных групп продемонстрированы на рис. 1.
Рис. 1.
Экспрессия генов GATA3, FOXP3, TBX21, STAT3, NFKB1, MAPK8 в группе сравнения и группе хронически облученных лиц (среднее и ошибка среднего). # – достоверные различия в экспрессии генов между группой сравнения и хронически облученными лицами.
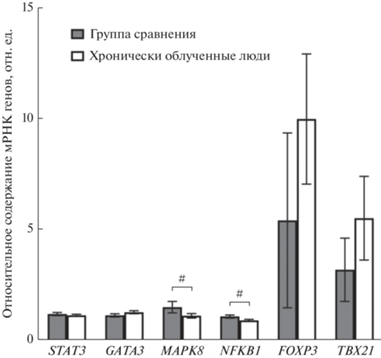
Обращает на себя внимание, что в группе хронически облученных лиц относительно группы сравнения статистически значимо снижена экспрессия транскрипционных факторов MAPK8 (1.51 ± 0.26 отн. ед. против 1.12 ± 0.10 отн. ед., при p = 0.01) и NFKB1 (1.10 ± 0.07 отн. ед. против 0.91 ± 0.04 отн. ед., при p = 0.02).
Кроме того в группе хронически облученных людей отмечена тенденция к увеличению относительного содержания мРНК генов FOXP3 (5.43 ± ± 3.95 отн. ед. против 10.01 ± 2.94 отн. ед.) и TBX21 (3.21 ± 1.43 отн. ед. против 5.53 ± 1.89 отн. ед.), однако в силу высокой степени вариабельности данных и как следствие большой стандартной ошибки средней, статистически значимых различий не обнаружено.
Поскольку кумулятивные дозы облучения у хронически облученных людей находились в достаточно широком диапазоне значений, представляло интерес оценить экспрессию мРНК исследуемых генов в зависимости от величины поглощенных дозы облучения ККМ. С этой целью обследованные лица были условно поделены на три дозовые подгруппы (облученные в диапазоне промежуточных значений доз: 1 группа: 77.8–484.4 мГр (80 человек), 2 группа: 522.6–994.4 мГр (50 человек) и облученные в диапазоне высоких значений доз: 3 группа: >1000 мГр (диапазон от 1032.1 до 3507.1 мГр) (38 человек).
Данные, представленные на рис. 2, демонстрируют статистически значимое низкое относительное содержание мРНК гена MAPK8 у хронически облученных людей, чьи накопленные дозы облучения ККМ находились в диапазоне промежуточных значений доз 77.8–484.4 мГр (p = 0.08) и 522.2–994.4 мГр (p = 0.03) при сопоставлении показателей с группой сравнения.
Рис. 2.
Экспрессия генов GATA3, FOXP3, TBX21, STAT3, NFKB1, MAPK8 в дозовых подгруппах облученных лиц (среднее и ошибка среднего). # – достоверные различия в экспрессии генов между группой сравнения и хронически облученными лицами (дозы облучения ККМ 77.79–484.39 мГр); ## – достоверные различия в экспрессии генов между группой сравнения и хронически облученными лицами (дозы облучения ККМ 522.16–994.40 мГр).
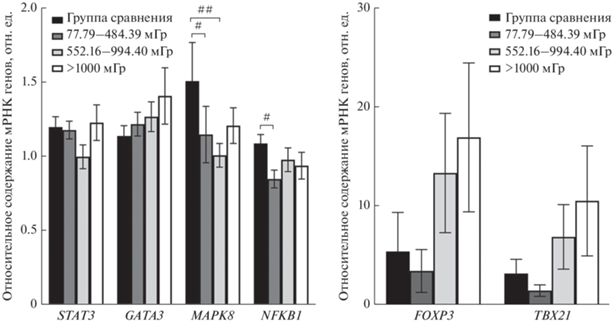
Что касается результатов, полученных для гена NFKB1, экспрессия которого была снижена в общей выборке хронически облученных лиц, то статистически значимые различия были получены только между группой сравнения и подгруппой лиц, облученных в диапазоне доз 77.8–484.4 мГр (p = = 0.02).
Таким образом, различия в показателях транскрипционной активности вышеуказанных генов между сравниваемыми группами преимущественно были отмечены для лиц, чьи накопленные дозы облучения ККМ находились в диапазоне промежуточных значений.
Согласно данным, представленным в табл. 2, не было отмечено статистически значимых корреляционных связей между относительным содержанием мРНК иммунорегуляторных генов GATA3, STAT3, MAPK8, NFKB1, FOXP3 и TBX21 от величин накопленных доз облучения ККМ, тимуса и периферических лимфоидных органов, а также от величин мощностей доз облучения ККМ, тимуса и периферических лимфоидных органов в период максимального радиационного воздействия. Тем не менее, на уровне тенденции отмечена положительная связь, демонстрирующая увеличение экспрессии мРНК гена GATA3 от дозы облучения ККМ (p = 0.06) и тимуса и периферических лимфоидных органов (p = 0.07).
Таблица 2.
Коэффициенты ранговой корреляции Спирмена (R) между относительным содержанием мРНК исследуемых генов и величинами доз и мощности доз в период максимального воздействия
| Ген | Доза облучения ККМ, мГр | Мощность дозы облучения ККМ в период максимального воздействия, мГр/год | Доза облучения тимуса и периферических лимфоидных органов, мГр/год | Мощность дозы облучения тимуса и периферических лимфоидных органов в период максимального воздействия, мГр/год |
|---|---|---|---|---|
| R(р) | ||||
| STAT3 | –0.07 (0.28) |
0.04 (0.65) |
–0.001 (0.98) |
0.06 (0.47) |
| GATA3 | 0.11 (0.06) |
0.001 (0.98) |
0.11 (0.07) |
0.05 (0.56) |
| MAPK8 | –0.09 (0.14) |
–0.09 (0.16) |
0.05 (0.54) |
0.01 (0.91) |
| NFKB1 | –0.05 (0.51) |
0.09 (0.27) |
–0.016 (0.80) |
0.12 (0.15) |
| FOXP3 | 0.14 (0.17) |
0.22 (0.10) |
0.06 (0.54) |
0.11 (0.38) |
| TBX21 | 0.05 (0.65) |
0.22 (0.10) |
0.05 (0.68) |
0.17 (0.19) |
В настоящее время доказана активация некоторых внутриклеточных сигнальных каскадов, вовлеченных в регуляцию иммунной системы, после радиационного воздействия (Аклеев и др., 2019). В рамках данной работы, методом корреляционного анализа была проведена оценка взаимосвязи транскрипционной активности исследуемых генов у людей, подвергшихся хроническому радиационному воздействию, и в группе сравнения.
Результаты, представленные в виде корреляционных матриц (рис. 3, 4), свидетельствуют о наличии слабых положительных связей в двух выборках между экспрессией мРНК генов SATA3 и GATA3 (в группе сравнения (R = 0.28, p = 0.005); в группе хронически облученных людей (R = 0.17, p = 0.02)) и экспрессией мРНК генов GATA3 и NFKB1 (в группе сравнения (R = 0.27, p = 0.008); в группе хронически облученных людей (R = 0.19, p = 0.01)).
Рис. 3.
Матрица парных коэффициентов корреляции экспрессии мРНК исследуемых генов в клетках периферической крови у лиц, составляющих группу сравнения.
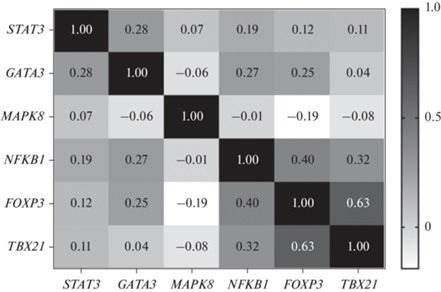
Рис. 4.
Матрица парных коэффициентов корреляции экспрессии мРНК исследуемых генов в клетках периферической крови у хронически облученных людей.
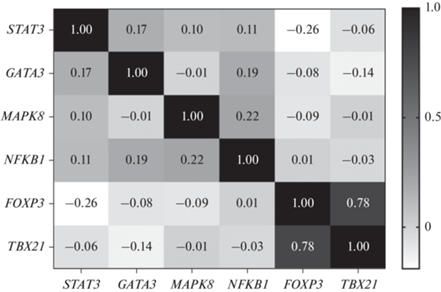
Кроме того в двух исследуемых выборках отмечена сильная положительная корреляционная связь между экспрессией мРНК генов FOXP3 и TBX21 (в группе сравнения (R = 0.63, p = 0.0001); в группе хронически облученных людей (R = 0.78, p = 0.0001)). Отличительной особенностью группы сравнения являлась умеренная положительная корреляционная связь между экспрессией мРНК генов FOXP3 и NFKB1в группе сравнения (R = 0.40, p = 0.02). В то время как в группе хронически облученных людей были зарегистрированы слабая обратная связь между экспрессией мРНК генов FOXP3 и STAT3 (R = –0.26, p = 0.02) и слабая прямая связь между экспрессией мРНК генов NFKB1 и MAPK8 (R = 0.22, p = 0.02).
Таким образом, результаты настоящего исследования свидетельствуют о том, что хроническое радиационное воздействие с преимущественным облучением ККМ человека может длительно модифицировать транскрипционную активность иммунорегуляторных генов MAPK8 и NFKB1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Хорошо доказано, что ионизирующее излучение способно модулировать экспрессию генов, продукты которых координируют общий клеточный ответ на стресс, включая иммунный ответ (Fachin et al., 2009, Morandi et al., 2009). В свою очередь аберрантная активность гомеостатических генов может служить первостепенной причиной развития как ранних, так и отдаленных эффектов облучения.
Исследование по оценке экспрессии мРНК иммунорегуляторных генов было проведено у хронически облученных жителей прибрежных сел реки Течи (Челябинская и Курганская области) в отдаленные сроки. Показано, что даже через столь удаленный период после начала радиационного воздействия наблюдаются статистически значимые сдвиги в функциональном состоянии транскриптома у данной когорты лиц.
Результаты нашего исследования показали, что в период реализации отдаленных последствий (злокачественные новообразования, лейкозы и заболевания сердечно-сосудистой системы) после хронического радиационного воздействия с преимущественным облучением ККМ у жителей прибрежных сел реки Течи отмечено статистически значимое снижение экспрессии мРНК транскрипционных факторов NFKB1 и MAPK8 относительно внутреннего контроля (людей, дозы облучения ККМ у которых не превышали 70 мГр).
Очевидно, что пострадиационные изменения транскрипционной активности генов NFKB1 и MAPK8 у хронически облученных лиц могут оказывать влияние на состояние иммунитета и клеточного гомеостаза.
Ген NFKB1 кодирует одноименный транскрипционный фактор NFKB1, который является регулятором транскрипции генов иммунного ответа. В частности, попадая в ядро клетки, этот транскрипционный фактор модулируют экспрессию генов, кодирующих антигенные рецепторы на иммунных клетках, молекулы клеточной адгезии, провоспалительных цитокинов (TNF, IL1, LPS) и хемоаттрактантов (MCP-1) (Cartwright et al., 2016). Кроме этого, NFKB1 контролирует экспрессию ряда генов, вовлеченных в широкий спектр биологических функций клетки. В ряде сообщений говорится, что после острого облучения NFKB1 способен оказывать влияние на транскрипцию генов, кодирующих апоптотические белки семейства BCL-2, таких как BCL-XL, BFL-1/A1, Nr13, BAX и BCL-2, тем самым блокировать инициацию апоптоза (Chen et al., 2002). Однако снижение экспрессии мРНК NFKB1, которое мы отмечаем у облученных лиц в данной работе, по сути, должно приводить к противоположному эффекту.
Это косвенно может подтвердить данные наших предыдущих работ, в которых мы демонстрируем достоверное изменение транскрипционной активности апоптотических генов BAX и BCL-2, приводящее к смещению баланса клеточного гомеостаза в сторону индукции процесса апоптоза в мононуклеарных клетках периферической крови у облученных людей (Никифоров и др. 2020).
Полученные результаты в очередной раз подтверждают идею о том, что характер изменений на молекулярном уровне напрямую зависит от характера облучения и величины дозы воздействия. Так, облучение с низкой мощностью дозы приводит к отличной от острого радиационного воздействия модели генной экспрессии.
MAPK8, экспрессия которого также была достоверно понижена в группе облученных людей, является субстратом для многих клеточных процессов, в частности пролиферации и развитии иммунокомпетентных клеток. В T-лимфоцитах MAPK8 играет ключевую роль в дифференцировке T-хелперов в Т-хелперы 1 (Th1) (Dent et al., 2003). Немаловажную роль этот транскрипционный фактор также оказывает на процесс апоптоза, способствует активной его инициации в клетках, находящихся в состоянии стресса, за счет фосфорилирования ключевых факторов регуляции, включая p53 (Yue et al., 2020).
Не для всех исследованных иммунорегуляторных генов были продемонстрированы транскрипционные ответы на хроническое радиационное воздействие. Статистически значимых отклонений в экспрессии генов, кодирующих белки Stat3 (фактор роста и развития иммунокомпетентных клеток), Gata3 (фактор воспалительных и гуморальных иммунных реакций, регулятор развития Т-клеточного звена), Foxp3 (регулятор развития и функционирования регуляторных Т-клеток), Tbx21 (фактор активации пролиферации Т-хелперов 1 типа) у хронически облученных людей по отношению к группе сравнения выявлено не было.
Тем не менее, отмечены тенденции к увеличению экспрессии мРНК генов TBX21 и FOXP3 в группе хронически облученных людей, и положительная корреляция связь между экспрессией мРНК гена GATA3 и дозами облучения ККМ, тимуса и периферических лимфоидных органов. Данные предварительные, необходимо продолжать исследование с расширенными выборками обследованных лиц, для уточнения значимости вышеуказанных факторов в развитии отдаленных эффектов облучения.
В зависимости от радиационных факторов, таких как мощность и доза излучения, изменению подвергаются определенные сигнальные каскады, которые способны модифицировать функции клеток иммунной системы у человека (Azimian et al., 2015). Однако до настоящего времени сигнальные пути, которые вовлечены в иммунный ответ на действие хронического низкоинтенсивного радиационного воздействия, остаются мало изученными.
Интерес представляют данные по исследованию кооперативных взаимодействий генов. Помимо связей, которые были зафиксированы в двух исследуемых выборках, отмечены соотношения, характерные только для группы облученных людей. В частности положительная слабая корреляция между экспрессией ранее упомянутых мРНК генов MAPK8 и NFKB1.
Как было сказано ранее, продукты этих генов осуществляют регуляцию иммунного ответа через контроль процессов пролиферации и дифференцировки иммунокомпетентных клеток. Кроме того, согласно данным литературы оба этих гена являются ключевыми активаторами сигнальных путей, участвующих в воспалительных реакциях (Loza et al., 2007). Помимо продукции провоспалительных цитокинов (ФНО-a, IL-6 и др.), эти транскрипционные факторы контролируют экспрессию генов хемоаттрактантов макрофагов, нейтрофилов и Т-клеток (Dent et al., 2003). Однако вовлеченность MAPK8 и NFKB1 в патогенез воспалительных реакций у облученных людей в отдаленные сроки требует дополнительного изучения.
Таким образом, в отдаленные сроки у жителей прибрежных сел реки Течи, подвергшихся многолетнему радиационному воздействию с преимущественным облучением красного костного мозга (максимальные поглощенные дозы достигали 3507.1 мГр), отмечены особенности экспрессии транскрипционных факторов MAPK8 и NFKB1, участвующих в регуляции системного иммунитета человека. Принимая во внимание важность экспрессии этих транскрипционных факторов в поддержании генетического гомеостаза иммунокомпетентных клеток, можно полагать, что изменения в регуляции системного иммунитета у облученных людей в отдаленные сроки могут быть опосредованы модификацией их транскрипционной активности.
Список литературы
Аклеев А.А. Иммунный статус человека в отдаленном периоде хронического радиационного воздействия // Медицинская радиология и радиационная безопасность. 2020. Т. 65. № 4. С. 29–36.
Аклеев А.А., Никифоров В.С., Блинова Е.А., Долгушин И.И. Экспрессия генов иммунного ответа у лиц, подвергшихся хроническому радиационному воздействию, в отдаленные сроки // Российский иммунологический журнал. 2019. № 2. С. 1042–1044.
Никифоров В.С., Блинова Е.А., Аклеев А.В. Транскрипционная активность генов клеточного цикла и апоптоза у хронически облученных лиц, имеющих повышенную частоту TCR-мутантных лимфоцитов // Радиация и риск (Бюллетень национального радиационно-эпидемиологического регистра). 2020. № 2. С. 89–100.
Шуленина Л.В., Ушенкова Л.Н., Ледин Е.В., Шагирова Ж.М., Раева Н.Ф., Засухина Г.Д., Михайлов В.Ф. Экспрессия генов Р53, NPM1, Кras, с-Мус, P14АRF в крови онкологических больных до и после лучевой терапии // Радиационная биология. Радиоэкология. 2012. № 6. С. 572–581.
Albanese J., Martens K., Karanitsa L.V., Schreyer S.K., Dainiak N. Multivariate analysis of low-dose radiation-associated changes in cytokine gene expression profiles using microarray technology // Exp. Hematol. 2007. V. 35. № 4. P. 47–54.
Amundson S.A., Lee R.A., Koch-Paiz C.A., Bittner M.L., Meltzer P., Trent J.M., Jr. Fornace A.J. Differential responses of stress genes to low dose-rate gamma irradiation // Mol. Cancer Res. 2003. V. 1. № 6. P. 445–452.
Azimian H., Bahreyni-Toossi M.T., Rezaei A.R. Up-regulation of Bcl-2 expression in cultured human lymphocytes after exposure to low doses of gamma radiation // J. Med. Phys. 2015. V. 40. № 1. P. 38–44.
Cartwright T., Perkins N.D., Wilson C.L. NFKB1: a suppressor of inflammation, ageing and cancer // FEBS J. 2016. V. 283. № 10. P. 1812–1822.
Cine N., Tarkun I., Canturk N., Gunduz Y., Sunnetci D., Savli H. Whole genome expression, canonical pathway and gene network analysis in the cases of papillary thyroid cancer // Eur. Soc. Human Genet. Confer. Proc. 2012. V. 20. № 1. P. 192.
Chen X., Shen B., Xia L., Khaletzkiy A., Chu D., Wong J.Y., Li J.J. Activation of nuclear factor kappaB in radioresistance of TP53-inactive human keratinocytes // Cancer Res. 2002. V. 62. № 4. P. 1213–1221.
Degteva M., Napier B., Tolstykh E., Shiskina E., Bougrov N., Krestinina L., Akleev A. Individual dose distribution in cohort of people exposed as a result of radioactive contamination of the Techa rive // Med. Rad. Rad. Safety. 2019. V. 64. № 3. P. 46–53.
Dent P., Yacoub A., Fisher P.B., Hagan M.P., Grant S. MAPK pathways in radiation responses // Oncogene. 2003. V. 22. № 37. P. 5885–5896.
Fachin A.L., Mello S.S., Sandrin-Garcia P., Junta C.M., Ghilardi-Netto T., Donadi E.A., Passos G.A., Sakamoto-Hojo E.T. Gene expression profiles in radiation workers occupationally exposed to ionizing radiation // J. Radiat Res. 2009. V. 50. № 1. P. 61–71.
Hosoi Y., Miyachi H., Matsumoto Y., Enomoto A., Nakagawa K., Suzuki N., Ono T. Induction of interleukin-1beta and interleukin-6 mRNA by low doses of ionizing radiation in macrophages // Int. J. Cancer. 2001. V. 96. № 5. P. 270–276.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method // Methods. 2001. V. 25. № 4. P. 402–408.
Loza M.J., McCall C.E., Li L., Isaacs W.B., Xu J., Chang B.L. Assembly of inflammation-related genes for pathway-focused genetic analysis // PLoS One. 2007. V 10. № 2. e1035.
Morandi E., Severini C., Quercioli D., Perdichizzi S., Mascolo M.G., Horn W., Vaccari M., Nucci M.C., Lodi V., Violante F.S., Bolognesi C., Grilli S., Silingardi P., Colacci A. Gene expression changes in medical workers exposed to radiation // Radiat. Res. 2009. V. 172. № 4. P. 500–508.
Rizvi A., Pecaut M.J., Slater J.M., Subramaniam S., Gridley D.S. Low-dose γ-rays modify CD4(+) T cell signalling response to simulated solar particle event protons in a mouse model // Int. J. Radiat Biol. 2011. V. 87. № 1. P. 24–35.
Savli H., Szendröi A., Romics I., Nagy B. Gene network and canonical pathway analysis in prostate cancer: a microarray study // Exp. Mol. Med. 2008. V. 40. № 2. P. 176–185.
Savli H., Sunnetci D., Cine N., Gluzman D.F., Zavelevich M.P., Sklyarenko L.M., Nadgornaya V.A., Koval S.V. Gene expression profiling of B-CLL in Ukrainian patients in post-Chernobyl period/ // Exp. Oncol. 2012. V. 34. № 1. P. 57–63.
Yue J., Lopez J.M. Understanding MAPK signaling pathways in apoptosis // Int. J. Mol. Sci. 2020. V. 21. № 7. P. 2346.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


