Известия РАН. Серия биологическая, 2022, № 6, стр. 597-606
Элиситорное действие дрожжевого экстракта на накопление фенольных соединений и антирадикальную активность клеток Linum grandiflorum в условиях in vitro
Е. А. Гончарук 1, *, О. Л. Сайбель 2, Г. П. Зайцев 3, Н. В. Загоскина 1, **
1 Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, ул. Ботаническая, 35, Россия
2 ФГБУН ВНИИ лекарственных и ароматических растений
117216 Москва, ул. Грина, 7, Россия
3 ФГБУН ВНИИ виноградарства и виноделия “МАГАРАЧ” РАН
298600 Ялта, ул. Кирова, 31, Россия
* E-mail: goncharuk.ewgenia@yandex.ru
** E-mail: zagoskina@ifr.moscow
Поступила в редакцию 29.04.2022
После доработки 13.05.2022
Принята к публикации 16.05.2022
- EDN: GPLVLM
- DOI: 10.31857/S1026347022060063
Аннотация
Изучено элиситорное действие различных концентраций дрожжевого экстракта (ДЭ, 200–1000 мг/л) на накопление фенольных соединений (ФС) и антирадикальную активность in vitro культуры льна крупноцветкового (Linum grandiflorum Desf.). Установлено повышение в ней суммарного содержания ФС и содержания фенилпропаноидов, особенно при высоких концентрациях ДЭ в среде (500 и 1000 мг/л). Антирадикальная активность экстрактов культур льна в большинстве случаев сохранялась на уровне контроля. Следовательно, элиситация in vitro культур льна крупноцветкового ДЭ сопровождалась активацией биосинтеза ФС, что способствовало накоплению этих вторичных метаболитов на фоне сохранения антирадикальной активности, получаемых из них экстрактов относительно контроля.
Одним из активно развиваемых направлений биологии является изучение действия различных элиситоров на растения (in vitro культуры клеток и тканей), что позволяет регулировать их генетический и продукционный потенциал, в том числе накопление специализированных (вторичных) метаболитов с фармакологически ценными свойствами (Тарчевский, 2002; Naik, Al-Khayri, 2016; Jamiołkowska, 2020). Механизм элиситации достаточно сложен и включает трансдукцию сигнала в клетки растений, в том числе при участии небольших молекул-мессенджеров: пероксида водорода, окиси азота, олигосахаринов, различных низкомолекулярных соединений (Тарчевский, 2002; Ramirez-Estrada et al., 2016). Мажорными факторами, определяющими эффективность этого процесса, являются тип элиситора, его концентрация, длительность воздействия и способ применения (Narayani, Srivastava, 2017; Naskar et al., 2021).
Согласно современным данным, элиситоры подразделяются на биотические, абиотические, эндогенные, экзогенные, общие и специфические (Jamiołkowska, 2020). Биотические элиситоры имеют рядом преимуществ перед абиотическими элиситорами и применяются, как правило, для оптимизации фитохимического состава растений (Kannojia et al., 2019). К их числу относится дрожжевой экстракт (ДЭ), представляющий собой комплекс соединений, благотворно влияющих на рост, продуктивность, микроэлементный состав, содержание фитогормонов и других растительных метаболитов (Naik, Al-Khayri, 2016; Halder et al., 2019).
Одним из наиболее ранних “ответов” растительных клеток на элиситацию является генерация активных форм кислорода (АФК), рассматриваемая как их универсальная неспецифическая реакция (Hasanuzzaman et al., 2020). Ключевое положение в регуляции их количества принадлежит антиоксидантной системе, представленной высокомолекулярными и низкомолекулярными соединениями. Низкомолекулярные антиоксиданты рассматривают как вторую линию защиты клеток от АФК, что имеет важное значение при пониженном уровне высокомолекулярных антиоксидантов (Erb, Kliebenstein, 2020).
К низкомолекулярным антиоксидантам относятся фенольные соединения (ФС) – вторичные метаболиты растений, разнообразные по структуре и химическим свойствам (Cheynier et al., 2013; Wagay et al., 2020). Их взаимодействие с АФК предотвращает/снижает свободнорадикальные процессы окисления, тем самым защищая клетки растений от их токсического действия (Kumar, Pandey, 2013). Антиоксидантные свойства растительных ФС сохраняются и при поступлении в организм человека, благодаря чему они успешно используются в фармакологии при лечении различных заболеваний (Tungmunnithum et al., 2018).
Следует отметить, что с каждым годом растительное сырье становится все менее доступным по экологическим и геополитическим причинам (Nosov, 2012). Альтернативой традиционному агрономическому земледелию или сбору фармакологически ценных растений для промышленного получения вторичных метаболитов могут быть биотехнологические подходы, в том числе in vitro культуры клеток и тканей (Naik, Al-Khayri, 2016; Hidalgo et al., 2018). Их использование позволяет оптимизировать рост и продуктивность растительных клеток, а также автоматизировать эти процессы. Важен и тот факт, что культуры in vitro обладают “метаболической состоятельностью” в большей степени, чем растения (Nosov, 2012). Разработки в этой области предполагают получение высокопродуктивных клеточных линий, иммобилизацию и пермеабилизацию клеток, биореакторную и метаболическую инженерию, а также элиситацию (Hidalgo et al., 2018; Salem et al., 2020). Последний из способов является привлекательной стратегией для повышения содержания вторичных метаболитов в клетках растений в тех случаях, когда другие – трудоемки и малоэффективны (Naik, Al-Khayri, 2016; Halder et al., 2019).
К числу элиситоров, широко используемых при выращивании клеток растений в условиях in vitro, относится ДЭ (Ramirez-Estrada et al., 2016; Narayani, Srivastava, 2017). При его воздействии отмечалось значительное увеличение содержания ФС в каллусной культуре Zingiber officinale (Ali et al., 2018), в культуре бородатых корней Polygonum multiflorum (Ho et al., 2018), а также в каллусных и суспензионных культурах, инициированных из других растений (El-Nabarawy et al., 2015; Bhaskar et al., 2022).
Высокая биологическая и антиоксидантная активность большинства растительных ФС ставит задачу расширения видового разнообразия культур, способных к их накоплению в условиях in vitro. К числу перспективных в этом отношении растений относятся представители рода Linum, насчитывающего более 200 распространенных по всему миру видов (Cullis, 2019). Для них характерно быстрое онтогенетическое развитие, а также использование в качестве коммерчески важной масличной, лубяной, лекарственной культуры (Горшкова, 2007; Zuk et al., 2015). Одним из их представителей является лен крупноцветковый (Linum grandiflorum Desf.) – декоративное и лекарственное растение (Asad et al., 2021). Его экстракты обладают широким спектром противовирусной и антибактериальной активности, способностью ингибировать ферменты класса гидролаз бактериальных клеток (тирозинкиназу, фосфордиэстеразу), а также HIV транскриптазу (обратную транскриптазу вируса иммунодефицита) (Mohammed et al., 2010). Для льна крупноцветкового характерно образование различных фенольных соединений (ФС), в том числе флавонов и их гликозидов (лютеолин, глюколютеолин, виценин) с гипотензивными и противовоспалительными свойствами (Karuppusamy, 2009; Alamgir, 2017). К ценным биологически активным соединениям, продуцентом которых является L. grandiflorum, относятся соединения класса лигнанов (подофиллотоксин и его производные – деоксиподофиллотоксин и метоксиподофиллотоксин), обладающие высокой антиканцерогенной, цитотоксической и противовирусной активностью, получение которых из других культур сопряжено с трудностями (Asad et al., 2021).
В связи с малочисленностью работ по элиситации каллусной культуры льна крупноцветкового веществами биотической природы, целью исследования являлось изучение регуляции накопления в ней фенольных соединений при действии дрожжевого экстракта, а также оценка антирадикальной активности этанольных экстрактов, полученных из in vitro культуры L. grandiflorum.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования была каллусная культура льна крупноцветкового (L. grandiflorum Desf.), инициированная из гипокотилей молодых проростков. Ее выращивали при +24°С и 16-час. фотопериоде (5000 люкс) в камере фитотрона ИФР РАН на питательной среде Гамборга, содержащей 2 мг/л 2,4-дихлофеноксиуксусной кислоты. Длительность пассажа составляла 30 сут.
При проведении опытов каллусы 15-дневного возраста (середина линейной фазы роста) переносили на питательные среды, содержащие помимо основных компонентов различные концентрации ДЭ (200, 500 или 1000 мг/л). В качестве контроля использовали основную питательную среду. Каллусные культуры анализировали через 1 и 7 сут после начала элиситации. Для биохимических исследований их фиксировали жидким азотом и хранили при –70°С.
Оводненность каллусов анализировали после их высушивания до постоянного веса при +70°С (Рогожин, Рогожина, 2013).
Уровень перекисного окисления липидов (ПОЛ) определяли по содержанию малонового диальдегида (МДА), образуемого в реакции с тиобарбитуровой кислотой (ТБК) (Радюкина и др., 2011). Навеску замороженного растительного материала гомогенизировали в 0.1 М трис-HCl-буфере (рН 7.5), содержащем 0.35 М NaCl, после чего добавляли 1 мл 0.5%-ного раствора ТБК в 20%-ном водном растворе трихлоруксусной кислоты. Реакционную смесь выдерживали в течение 30 мин на водяной бане (+100°С). Оптическую плотность раствора измеряли на спектрофотометре при 532 нм. Для расчета содержания МДА (мкмоль/г сырой массы) использовали коэффициент молярной экстинкции (1.56 × 10–5 см–1 М–1).
ФС извлекали из замороженного в жидком азоте и измельченного растительного материала 96%-ным этанолом в течение 45 мин при +45°С. Экстракты центрифугировали (13500 g, 10 мин) и надосадочную жидкость использовали для спектрофотометрического определения содержания суммы ФС (реактив Фолина–Дениса) и содержания фенилпропаноидов (прямое спектрофотометрирование раствора) (Олениченко, Загоскина, 2005; Оленников, Танхаева 2011).. Содержание суммы ФС выражали в мг-экв. рутина/г сухой массы, а содержание фенилпропаноидов – в мг-экв. кофейной кислоты/г сухой массы.
Антирадикальную активность этанольных экстрактов каллусных культур льна определяли спектрофотометрическим методом, основанным на способности ФС ингибировать предварительно генерируемые в модельных условиях in vitro супероксид и ОН● (Волкова и др., 2011). Для этого использовали реакционную смесь, в состав которой входили метионин, рибофлавин, нитро-синий тетразолий, экстракт (опытный вариант) или экстрагент (контроль), анализируя в ней количество формазана при 560 нм. Антирадикальную активность рассчитывали в % ингибирования супероксида по формуле:
где А1 – оптическая плотность формазана при длине волны 560 нм без добавления экстракта, А2 – оптическая плотность формазана после добавления экстракта.
Спектры поглощения этанольных экстрактов каллусных культур льна измеряли на спектрофотометре “Specord 40” (Германия) в пределах длин волн 250–350 нм.
Наличие 6-метоксиподофиллотоксина в этанольных экстрактах каллусных культур льна анализировали методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием системы Agilent Technologies (модель 1100) (Kubyshkin et al., 2018). Хроматограф укомплектован проточным вакуумным дегазатором G1379А, 4-х канальным насосом градиента низкого давления G13111А, автоматическим инжектором G1313А, термостатом колонок G13116А, диодноматричным детектором G1316A и флуоресцентным детектором G1315B.
Для разделения ФС применяли хроматографическую колонку “ZORBAX” SB-C18 (2.1 × 150 мм), заполненную силикагелем с привитой октадецилсилильной фазой зернением 3.5 мкм. Состав элюента: раствор А – метанол, раствор В – 0.6%-ный водный раствор трифторуксусной кислоты. Хроматографирование проводили в градиентном режиме. Состав элюента изменялся по следующей схеме (по содержанию компонента В): 0 мин – 8%; 0 – 8 мин – 8 – 38%; 8 – 24 мин – 38 – 100%; 24 – 30 мин – 100%. Скорость потока элюента – 0.25 мл/мин. Объем вводимой пробы – 1 мкл. Хроматограммы регистрировали при 280 нм. Идентификацию 6-метоксиподофиллотоксина производили путем сравнения его спектральных характеристик и времени удерживания с аналогичными характеристиками стандарта.
Статистическую обработку данных проводили по общепринятым методикам с использованием программ статистического пакета Excel (MS Office 2007). В экспериментах использовали трехкратные биологические и трех-четырехкратные аналитические повторности измерений. На диаграммах представлены средние арифметические значения полученных величин и их стандартные ошибки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
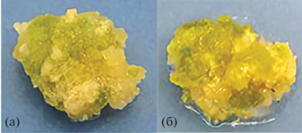
Морфофизиологические характеристики каллусной культуры льна крупноцветкового. Каллусные культуры льна крупноцветкового контрольных и опытных вариантов были средней плотности, желто-зеленого цвета и состояли из крупноагрегированных клеточных конгломератов (рис. 1). Наличие зеленой окраски свидетельствовало о формировании хлорофилл-содержащих клеток на поверхности каллусов. Для всех культур характерна низкая скорость роста: прирост биомассы к концу пассажа в среднем составлял 220 ± 20%.
Рис. 1.
Внешний вид каллусных культур Linum grandiflorum, выращиваемых на основной питательной среде (а) или на среде с дрожжевым экстрактом (500 мг/л; (б)). Возраст каллусов – 22 дня.
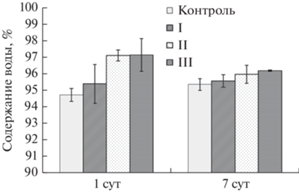
Определение содержания воды, как важного физиологического показателя культур in vitro, показало, что после 1 сут элиситации оно сохранялось на уровне контроля при низком количестве ДЭ в среде (200 мг/л) и повышалось в равной степени на средах с высоким его количеством (500 и 1000 мг/л) (рис. 2). При более длительном периоде элиситации (7 сут) во всех вариантах оно было аналогично таковому контроля. По всей видимости, в начальный период действия ДЭ происходила инициация процессов растяжения и вакуолизации клеток льна и этот процесс был концентрационно зависимым, что отмечалось и другими исследователями (Farjaminezhad, Garoosi, 2021).
Рис. 2.
Оводненность каллусных культур Linum grandiflorum, подвергнутых кратковременной (1 сут) и длительной (7 сут) элиситации различными концентрациями дрожжевого экстракта (I, II, III – 200, 500 и 1000 мг/л соответственно). Контроль – отсутствие элиситора.
Содержание малонового диальдегида в каллусной культуре льна крупноцветкового. Для жизнедеятельности растительных клеток, в том числе при действии различных факторов, большое значением имеет их редокс-гомеостаз , обусловленный равновесием между образованием и деструкцией АФК (Hasanuzzaman et al., 2020). Важным критерием этого процесса служит уровень ПОЛ, оцениваемый по содержанию МДА (Колупаев и др., 2019). После 1 сут элиситации в каллусах льна, выращиваемых на средах с 200 и 500 мг/л ДЭ, оно было равным и на 30% ниже значения контроля (рис. 3). Иная тенденция отмечалась при действии высокой концентрации ДЭ (1000 мг/л): уровень ПОЛ превышал таковой контроля на 25%. Следовательно, кратковременное воздействие элиситора на клетки льна в условиях in vitro приводило к изменениям в функционировании антиоксидантной системы. Это проявлялось как в снижении (низкие концентрации ДЭ), так и в увеличении (высокая концентрация ДЭ) уровня ПОЛ в каллусах опытных вариантов. О том, что условия элиситации приводят к изменениям количества АФК в клетках растений, сообщалось и другими авторами (Ali et al., 2018; Hasanuzzaman et al., 2020).
Рис. 3.
Содержание малонового диальдегида (МДА) в каллусных культурах Linum grandiflorum, подвергнутых кратковременной (1 сут) и длительной (7 сут) элиситации различными концентрациями дрожжевого экстракта (I, II, III – 200, 500 и 1000 мг/л соответственно). Контроль – отсутствие элиситора.
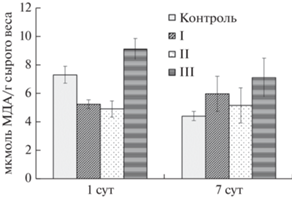
Интересен факт более низкого уровня ПОЛ (на 30%) в каллусах льна контрольного и одного из опытных вариантов (1000 мг/л ДЭ) в период завершения эксперимента (7 сут) по сравнению с его началом (1 сут). По всей видимости, это связано с уменьшением в них количества АФК и нормализацией баланса про/антиоксидантной активности (Naik, Al-Khayri, 2016; Колупаев и др., 2019). В целом после длительного воздействия ДЭ (7 сут) во всех вариантах количество МДА превышало таковое контроля, хотя достоверные отличия (на 40%) характерны только для его высокой концентрации в среде (1000 мг/л).
Известно, что процесс элиситации клеток растений зависим как от концентрации вещества, так и от длительности его воздействия (Тарчевский, 2002; Makowski et al., 2020). Исходя из наших данных можно предположить, что кратковременное действие высокой концентрацией ДЭ (1000 мг/л, 1 сут) предположительно приводило к активации образования АФК у культивируемых in vitro клеток льна, в отличие от эффекта действия более низких его концентраций (200 и 500 мг/л), при которых уровень ПОЛ в них снижался за счет изменений про/антиоксидантного равновесия (Naskar et al., 2021). При более длительном периоде элиситации (7 сут) содержание МДА в каллусах льна возрастало относительно контроля, что, по-видимому, обусловлено избыточным образованием АФК и нарушением окислительно-восстановительного баланса. Это согласуется с данными других авторов об отличиях в ответной реакции растительных клеток на длительность действия элиситоров и их концентрации (Makowski et al., 2020; Farjaminezhad, Garoosi, 2021).
Содержание фенольных соединений в каллусной культуре льна крупноцветкового. К числу эффективных антиоксидантов относятся различные ФС, образование которых характерно для всех клеток и тканей растений (Karuppusamy, 2009). Их биосинтез является отличительной чертой различных растений рода Linum, в том числе и льна крупноцветкового (Tchoumtchoua et al., 2019; Asad et al., 2021).
Определение суммарного содержания ФС позволяет установить вклад этих низкомолекулярных антиоксидантов в формирование ответных реакций растительных клеток на действие изучаемого фактора (Karuppusamy, 2009). Как следует из представленных на рис. 4а данных, наиболее низкое их количество было в культуре льна, подвергнутого кратковременному действию (1 сут) низкой концентрацией ДЭ (200 мг/л), равное таковому контрольного варианта. При более высоких концентрациях элиситора в среде, содержание ФС значительно возрастало (в 2 и 3 раза соответственно при 500 и 1000 мг/л ДЭ). Исходя из этих данных, можно заключить, что кратковременное воздействие ДЭ способствовало накоплению ФС в каллусных культурах льна крупноцветкового.
Рис. 4.
Содержание суммы фенольных соединений (а) и фенилпропаноидов (б) в каллусных культурах Linum grandiflorum, подвергнутых кратковременной (1 сут) и длительной (7 сут) элиситации различными концентрациями дрожжевого экстракта (I, II, III – 200, 500 и 1000 мг/л, соответственно). Контроль – отсутствие элиситора.
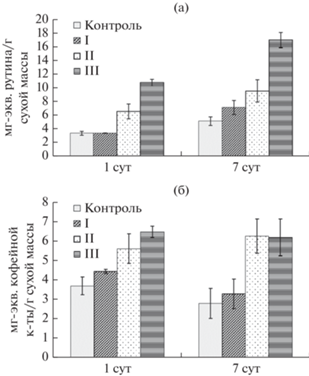
При длительном действии элиситора (7 сут) тенденции в определенной степени были аналогичными: возрастание суммарного содержания ФС в культурах практически на 200 и 300% по сравнению с контролем в присутствии 500 и 1000 мг/л ДЭ в среде, соответственно. Кроме того, увеличение их количества отмечалось и при действии 200 мг/л ДЭ, но в значительно меньшей степени (на 35% относительно контроля).
Полученные нами результаты согласуются с немногочисленными данными других исследователей о стимулирующем влиянии элиситоров биотической природы на накопление ФС у каллусов, полученных из различных видов растений (El-Nabarawy et al., 2015; Bhaskar et al., 2022). Отмечалась концентрационная и экспозиционная зависимость содержания этих метаболитов при элиситации культур in vitro (Ali et al., 2018; Nunes da Silva et al., 2021). Имеются сведения о том, что некоторые элиситоры способствовали не только увеличению количества ФС, в том числе флавоноидов, но и одновременному снижению их жизнеспособности, что влечет замедление роста и гибель клеток (Jesionek et al., 2018). В частности, стратегия индуцирования биосинтеза такого противоопухолевого соединения, как паклитаксел в суспензионных культурах тиса сопровождалась замедлением их роста, что значительно затрудняло использование элиситации для крупномасштабной обработки (Salem et al., 2020).
Содержание фенилпропаноидов в каллусной культуре льна крупноцветкового. Важным показателем ответа растительных клеток на элиситацию может быть изменение накопления фенилпропаноидов как наиболее простых соединений из ряда специализированных фенольных метаболитов, образование которых характерно для льна (Волынец, 2013). Определение их содержания в контрольных вариантах каллусных культур льна показало, что в начальный период исследования (1 сут) оно было на 30% выше, чем в конце (7 сут) (рис. 4б). Это может быть обусловлено изменениями в их образовании в течение пассажа, как это отмечалось и другими авторами (Asad et al., 2021).
Элиситация каллусных культур льна сопровождалась накоплением в них фенилпропаноидов и этот эффект зависел от концентрации ДЭ в питательной среде и длительности его воздействия. Количество этих фенольных метаболитов повышалось после кратковременного воздействия (1 сут) 200, 500 и 1000 мг/л ДЭ на 20, 50 и 175% соответственно, по сравнению с контролем. Следовательно, чем выше была концентрация элиситора в питательной среде, тем в большей степени увеличивалось содержание фенилпропаноидов в каллусах льна. Это согласуется с данными других авторов о прямой корреляционной зависимости между концентрацией действующего экзогенного фактора и ответной реакцией клеток на уровне накопления в них ФС (Ali et al., 2018; Halder et al., 2019; Makowski et al., 2020).
Сравнение содержание фенилпропаноидов в каллусах льна после длительной элиситации (7 сут) также свидетельствует о более высоком их накоплении в опытных вариантах по сравнению с контролем, что наиболее выражено при действии высоких концентраций ДЭ (500 и 1000 мг/л). При этом оно было равным таковому предыдущего периода исследования (1 сут воздействия).
Исходя из полученных данных можно предположить, что активация биосинтеза фенилпропаноидов характерна преимущественно для начальных этапов элиситации in vitro культур льна. Так, при кратковременном воздействии на них элиситора накопление этих ФС зависело от его действующей концентрации и было наибольшим при высоких дозах, тогда как в дальнейшем активации этого процесса уже не происходило. О повышении содержания фенилпропаноидов и увеличении экспрессии генов фенилпропаноидного пути при экзогенной обработке растительных культур in vitro биотическими элиситорами, представленными полисахаридами (в том числе ДЭ), сообщалось в литературе. Это было характерно для некоторых представителей семейства Яснотковых и Бурачниковых, а также для такой ценной лекарственной культуры, как зверобой продырявленный (Park et al. 2016; Shakya et al., 2019). Все это может свидетельствовать о регуляторной роли фенилпропаноидов, для которых характерна высокая радикал-связывающая способность, в поддержании редокс-гомеостаза в растительных клетках.
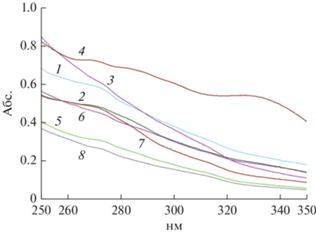
О фенольных соединениях и лигнанах в каллусных культурах льна крупноцветкового. Изучение состава ФС и его изменений при экзогенных воздействиях является важным показателем метаболической активности растительных клеток и тканей (Cheynier et al., 2013). В первую очередь были проведены исследования спектров поглощения этанольных экстрактов каллусных культур льна крупноцветкового, что позволяет провести оценку наличия в них определенных метаболитов. В нашем случае был использован интервал длин волн от 250 до 350 нм, где регистрируются основные и дополнительные максимумы поглощения большинства ФС (Волынец, 2013). Во всех случаях в этанольных экстрактах каллусов льна крупноцветкового отмечен максимум поглощения при 260 нм (рис. 5). Это соответствует основному максимуму поглощения оксибензойных кислот (235–270 нм). При других длинах волн четко выраженных максимумов в УФ области не наблюдалось, что может быть следствием низкой концентрации ФС в этанольных экстрактах каллусных культур, хотя иногда присутствовал дополнительный максимум при 330 нм. Все это подтверждает наличие в них соединений фенилпропаноидной природы, представленных конъюгатами п-оксибензойной, п-кумаровой, феруловой и кофейной кислот, как это отмечалось нами ранее (Гончарук и др., 2018). Следует также отметить значительное сходство УФ-спектров экстрактов всех исследованных вариантов каллусных культур льна крупноцветкового, что может свидетельствовать о сходстве состава их фенольных комплексов. Об отсутствии различий в фенольном комплексе in vitro культур растительных клеток, в том числе подвергнутых действию различных экзогенных факторов, сообщалось в литературе (Ossipov et al., 2022). Судя по спектрам поглощения экстрактов, полученных из каллусных культур льна различных вариантов, содержание ФС в них было различным, что согласуется с данными по их количественному определению (рис. 4).
Рис. 5.
УФ-спектры поглощения этанольных экстрактов из каллусных культур Linum grandiflorum, после кратковременной (1 сут; варианты 1–4) и длительной (7 сут; варианты 5–8) элиситации различными концентрациями дрожжевого экстракта (200 мг/л – варианты 2, 6; 500 мг/л – варианты 3,7; 1000 мг/л – варианты 4, 8). Контроль – отсутствие элиситора (варианты 1, 5).
Одними из важных и фармакологически ценных метаболитов растений льна являются лигнаны, представляющие собой димерные фенилпропаноиды и рассматриваемые как первичные антиоксиданты, нейтрализующие свободные радикалы (Mohammed et al., 2010; Alamgir et al., 2017). Сообщалось о накоплении этих соединений в фотомиксотрофных каллусных культурах льна, а также о стимулирующем действии элиситации на их образование (Karuppusamy, 2009; Naik, Al-Khayri, 2016).
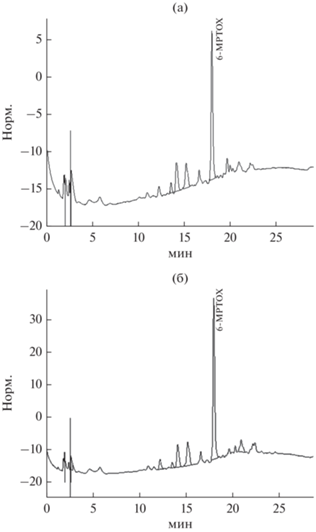
В большинстве литературных источников сообщалось об образовании в растениях льна, в том числе льна крупноцветкового, таких лигнанов, как подофиллотоксин, деоксиподофиллотоксин и 6-метоксиподофиллотоксин (MPTOX) (Mohammed et al., 2010). Использование ВЭЖХ хроматографии позволило установить наличие MPTOX в этанольных экстрактах каллусных культур льна крупноцветкового (рис. 6). При этом его содержание было невысоким и достаточно близким во всех вариантах. Следовательно, для каллусных культур льна крупноцветкового характерен биосинтез 6-метоксиподофиллотоксина – производного фенилпропаноидного пути. О том, что в условиях in vitro клетки сохраняют способность к биосинтезу характерных для интактных тканей растений вторичных метаболитов неоднократно сообщалось в литературе (Nosov, 2012; Halder et al., 2019).
Рис. 6.
ВЭЖХ-хроматограмма этанольного экстракта каллусной культуры льна крупноцветкового контрольного (а) и опытного (действие 500 мг/л дрожжевого экстракта; (б) (регистрация при 280 нм). По оси ординат представлены данные mAU, по оси абсциз – время выхода соединения (мин). MPTOX – 6-метоксиподофиллотоксин.
Все вышеизложенное свидетельствуют о том, что культивируемые in vitro клетки льна крупноцветкового сохраняли способность к накоплению ФС, в том числе лигнанов, характерных для интактного растения. При этом их состав не изменялся при действии элиситора, а количество – повышалось. Следовательно, элиситация клеток льна ДЭ позволяет регулировать их биосинтетическую активность в отношении накопления ФС, преимущественно фенилпропаноидов – биологически активных метаболитов с антиоксидантой активностью.
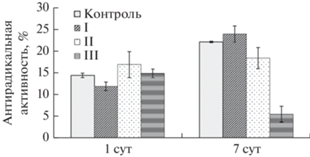
Определение антирадикальных свойств экстрактов каллусных культур льна крупноцветкового. Антирадикальная активность растительных экстрактов является одним из важных показателей, характеризующих возможность их практического применения в фармакологических целях (Mohammed et al., 2010; Alamgir, 2017). Поскольку для ФС характерно ее проявление в отношении свободных радикалов, образующихся при действии внешних факторов различной природы, важно было сравнить антирадикальную активность растительных экстрактов каллусных культур льна крупноцветкового контрольных и опытных вариантов. Как следует из представленных на рис. 7 данных, при кратковременном действии ДЭ (1 сут) она имела близкие значения, и различия между ними были статистически недостоверны. После 7 сут элиситации в экстрактах культур льна контрольного варианта и варианта с действием 200 мг/л ДЭ антирадикальная активность была равной, наибольшей и на 50% превышала таковую более раннего периода элиситации (1 сут). В других вариантах она была ниже: на 17% в экстрактах каллусов на среде с 500 мг/л ДЭ и в 4.5 раза – на среде с 1000 мг/л ДЭ. Следовательно, применение данной стратегии элиситации каллусных культур льна крупноцветкового сопровождалось ингибированием антирадикальной активности их этанольных экстрактов (после 7 сут воздействия высокими концентрациями ДЭ) или же не оказывало влияния на изучаемый процесс (кратковременное воздействие ДЭ, 1 сут). Все это отражает многофункциональность действия низкомолекулярных антиоксидантов и сложность оценки их вклада в антирадикальную активность экстрактов, получаемых из растительных объектов. О том, что содержание вторичных метаболитов фенольной природы в клетках и тканях растений не всегда коррелирует с антирадикальной и антиоксидантной активностью полученных из них экстрактов, сообщалось в литературе (Ali et al., 2018).
Рис. 7.
Антирадикальная активность этанольных экстрактов каллусных культур Linum grandiflorum, подвергнутых кратковременной (1 сут) и длительной (7 сут) элиситации различными концентрациями дрожжевого экстракта (I, II, III – 200, 500 и 1000 мг/л соответственно). Контроль – отсутствие элиситора.
Все вышеизложенное подтверждает положения о том, что потенциал получения специализированных метаболитов, в частности ФС, из in vitro культур клеток и тканей растений варьирует в зависимости от их типа, происхождения, параметров элиситации и внешних факторов. ДЭ, являясь экологически безопасным соединением биотической природы, оказывает стимулирующий эффект в отношении образования соединений фенольной природы, однако его элиситорное действие во многом зависит от концентрации и длительности воздействия. Исходя из этих данных, можно заключить, что для оптимизации их образования в клеточных культурах растений и понимания регуляции биосинтеза в условиях элиситации необходимы дальнейшие транскриптомные, метаболомные и протеомные исследования, столь необходимые для решения как фундаментальных, так и прикладных задач получения уникальных растительных метаболитов с антиоксидантными свойствами.
Финансирование. Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (121050500047-5).
Список литературы
Волкова Л.А., Урманцева В.В., Бургутин А.Б., Маевская С.Н., Носов А.М. Стимулирование защитных реакций у растений картофеля in vitro с помощью стероидных гликозидов в условиях абиотического стресса // Физиология растений. 2011. Т. 58. С. 766−773.
Волынец А.П. Фенольные соединения в жизнедеятельности растений. Минск.: Беларусь, 2013. 283 с.
Гончарук Е.А., Николаева Т.Н., Назаренко Л.В., Калашникова Е.А., Загоскина Н.В. Ответная реакция культивируемых in vitro клеток Linum grandiflorum Desf. на действие кадмия и глифосата // Сельскохозяйственная биология. 2018. Т. 53(5). С. 938–946.
Горшкова Т.А. Растительная клеточная стенка как динамичная система. М.: Наука, 2007. 426 с.
Колупаев Ю.Е., Карпец Ю.В., Кабашникова Л.Ф. Антиоксидантная система растений: клеточная компартментация, защитные и сигнальные функции, механизмы регуляции (обзор) // Прикладная биохимия и микробиология. 2019. Т. 55. №. 5. С. 419–440.
Олениченко Н.А., Загоскина Н.В. Ответная реакция озимой пшеницы на действие низких температур: образование фенольных соединений и активность L‑фенилаланин-аммиак-лиазы // Прикладная биохимия и микробиология. 2005. Т. 41. № 6. С. 681–685.
Оленников Д.Н., Танхаева Л.М. Фенольные соединения листьев Cacalia hastata L. и их количественный анализ // Химия растительного сырья. 2011. № 3. С. 143–148.
Радюкина Н.Л., Иванов Ю.В., Шевякова Н.И. Методы оценки содержания активных форм кислорода, низкомолекулярных антиоксидантов и активностей основных антиоксидантных ферментов // Молекулярно-генетические и биохимические методы в современной биологии растений. М.: БИОНОМ, 2011. С. 347–365.
Рогожин В.В., Рогожина Т.В. Практикум по физиологии и биохимии растений. СПб.: ГИОРД, 2013. 352 с.
Тарчевский И.А. Сигнальные системы клеток растений. М.: Наука, 2002. 294 с.
Alamgir A.N.M. Therapeutic use of medicinal plants and their extracts: volume 2. Springer International Publishing AG. 2017. 785 p.
Ali A.M.A., El-Nour M.E.M., Yagi S.M. Total phenolic and flavonoid contents and antioxidant activity of ginger (Zingiber officinale Rosc.) rhizome, callus and callus treated with some elicitors // J. Genetic Engin. Biotechn. 2018. V. 16(2). P. 677–682.
Asad B., Khan T., Gul F.Z, Ullah M.A, Drouet S. Scarlet flax Linum grandiflorum (L.) in vitro cultures as a new source of antioxidant and anti-inflammatory lignans // Molecules. 2021. V. 26(15). P. 4511–4526.
Bhaskar R., Spandhana L., Xavier E., Udayakumaran G., Kumar D.S., Venkatesh R., Nagella P. Biotic elicitors: A boon for the in vitro production of plant secondary metabolites // Plant Cell, Tissue and Organ Culture (PCTOC). 2022. V. 149. P. 7–24.
Cheynier V., Comte G., Davies K.M., Lattanzio V., Martens S. Plant phenolics: recent advances on their biosynthesis, genetics, and ecophysiology // Plant Physiology and Biochemistry. 2013. V. 72. P. 1–20.
Cullis C.A. Fundamental insights into plant biology that might be offered by flax // Genetics and genomics of Linum. Springer, Cham. 2019. P. 261–263.
El-Nabarawy M.A., El-Kafafi S.H., Hamza M.A., Omar M.A. The effect of some factors on stimulating the growth and production of some substances in Zingiber officinalis callus cultures // Ann. Agric. Sci. 2015. V. 60(1). P. 1–9.
Erb M., Kliebenstein D.J. Plant secondary metabolites as defenses, regulators, and primary metabolites: the blurred functional trichotomy // Plant Physiology. 2020. V. 184. № 1. P. 39–52.
Farjaminezhad R., Garoosi G. Improvement and prediction of secondary metabolites production under yeast extract elicitation of Azadirachta indica cell suspension culture using response surface methodology // AMB Express. 2021. V. 11(1). P. 1–16.
Halder M., Sarkar S., Jha S. Elicitation: A biotechnological tool for enhanced production of secondary metabolites in hairy root cultures // Engineering in Life Sciences. 2019. V. 19(12). P. 880–895.
Hasanuzzaman M, BorhannuddinBhuyan M.H.M., Zulfiqar F., Raza A., Mohsin S.M., Al Mahmud J. Reactive oxygen species and antioxidant defense in plants under abiotic stress: revisiting the crucial role of a universal defense regulator // Antioxidants. 2020. V. 9(8). P. 681–733.
Hidalgo D., Raul S., Liliana L., Mercedes B., Purificacion C., Javier P. Biotechnological production of pharmaceuticals and biopharmaceuticals in plant cell and organ cultures // Current medicinal chemistry. 2018. V. 25(30). P. 3577–3596.
Ho T.T., Lee J.D., Jeong C.S., Paek K.Y., Park S.Y. Improvement of biosynthesis and accumulation of bioactive compounds by elicitation in adventitious root cultures of Polygonum multiflorum // Applied microbiology and biotechnology. 2018. V. 102(1). P. 199–209.
Jamiołkowska A. Natural compounds as elicitors of plant resistance against diseases and new biocontrol strategies // Agronomy. 2020. V. 10(2). P. 173–184.
Jesionek A., Kokotkiewicz A., Krolicka A., Zabiegala B., Maria L. Elicitation strategies for the improvement of essential oil content in Rhododendron tomentosum (Ledum palustre) bioreactor-grown microshoots //Industrial Crops and Products. 2018. V. 123. P. 461–469.
Kannojia P., Choudhary K.K., Srivastava A.K, Singh A.K. PGPR bioelicitors: induced systemic resistance (ISR) and proteomic perspective on biocontrol // PGPR Amelioration in Sustainable Agriculture. Woodhead Publishing, 2019. P. 67–84.
Karuppusamy S. A review on trends in production of secondary metabolites from higher plants by in vitro tissue, organ and cell cultures // J. Medicinal Plants Res. 2009. V. 3(13). P. 1222–1239.
Kubyshkin A., Ogai Y., Fomochkina I., Chernousova,I., Zaitsev G., Shramko Y. Polyphenols of red grape wines and alcohol-free food concentrates in rehabilitation technologies // Polyphenols. Ed. Wong J. L. InTechOpen. 2018. P. 99–120.
Kumar S., Pandey A.K. Chemistry and biological activities of flavonoids: an overview // Sci. World J. 2013. V. 2013. P. 1–17.
Makowski W., Tokarz K. M., Tokarz B., Banasiuk R., Witek K., Królicka A. Elicitation-based method for increasing the production of antioxidant and bactericidal phenolic compounds in Dionaea muscipula J. Ellis tissue // Molecules. 2020. V. 25. P. 1794.
Mohammed M.M.D., Chenc M., Zhaic L., Ibrahim N.A. The cytotoxic activity of Linum grandiflorum leaves // European J. Chemistry. 2010. V.1. P.110–114.
Naik P. M., Al-Khayri J. M. Abiotic and biotic elicitors – role in secondary metabolites production through in vitro culture of medicinal plants // Abiotic and biotic stress in plants – recent advances and future perspectives. 2016. P. 247–277.
Narayani M., Srivastava S. Elicitation: a stimulation of stress in in vitro plant cell/tissue cultures for enhancement of secondary metabolite production // Phytochem. Rev. 2017. V. 16. P. 1227–1252.
Naskar S., Roy C., Ghosh S., Mukhopadhyay A., Hazarika L.K., Chaudhuri R.K., Roy S., Chakraborti D. Elicitation of biomolecules as host defense arsenals during insect attacks on tea plants (Camellia sinensis (L.) Kuntze) // Appl. Microbiol. Biotech. 2021. V. 105. P. 7187–7199.
Nosov A.M. Application of cell technologies for production of plant-derived bioactive substances of plant origin // Appl. Biochem. Microbiol. 2012. V. 48. P. 609–624.
Nunes da Silva M.N. Santos C.S, Cruz1 A., López‑Villamor A., Vasconceloset M.W. Chitosan increases Pinus pinaster tolerance to the pinewood nematode (Bursaphelenchus xylophilus) by promoting plant antioxidative metabolism // Scientific Reports. 2021. V. 11(1). P. 1–10.
Ossipov V., Zubova M., Nechaeva T., Zagoskina N., Salminen J.-P. The regulating effect of light on the content of flavan-3-ols and derivatives of hydroxybenzoic acids in the callus culture of the tea plant, Camellia sinensis L. // Biochem. System. Ecology. 2022. V. 101. P. 104383–104394.
Park W.T., Arasu M.V., Al-Dhabi N.A 2, Yeo S.K., Jeon J., Park J.S. Yeast extract and silver nitrate induce the expression of phenylpropanoid biosynthetic genes and induce the accumulation of rosmarinic acid in Agastache rugosa cell culture // Molecules. 2016. V. 21(4). P. 426–439.
Ramirez-Estrada K., Vidal-Limon H., Hidalgo D., Moyano E., Golenioswki M., Cusidó R.M., Palazon J. Elicitation, an effective strategy for the biotechnological production of bioactive high-added value compounds in plant cell factories // Molecules. 2016. V. 21. P. 182–206.
Salem M.A., de Souza L.P., Serag A., Fernie A.R., Farag M.A., Ezzat Sh.M., Alseekh S. Metabolomics in the context of plant natural products research: From sample preparation to metabolite analysis // Metabolites. 2020. V. 10. P. 37–67.
Shakya P.,Marslin G.,Siram K.,Beerhues L.,Franklin G. Elicitation as a tool to improve the profiles of high value secondary metabolites and pharmacological properties of Hypericum perforatum // J. Pharm. Pharmacol. 2019. V. 71. P. 70–82.
Tchoumtchoua J., Mathiron D., Pontarin N., Gagneul D., van Bohemen A. Phenolic profiling of flax highlights contrasting patterns in winter and spring varieties // Molecules. 2019. V. 24. P. 4303–4317.
Tungmunnithum D., Thongboonyou A., Pholboon A., Yangsabai A. Flavonoids and other phenolic compounds from medicinal plants for pharmaceutical and medical aspects: an overview // Medicines. 2018. V. 5. P. 93. https://doi.org/10.3390/medicines5030093
Wagay N.A., Lone R., Rafiq S., Bashir S.U. Phenolics: a game changer in the life cycle of plants // Plant Phenolics in Sustainable Agriculture. Singapore: Springer., 2020. P. 241–275.
Zuk M., Richter D., Matuła J., Szopa J. Linseed, the multipurpose plant // Industrial Crops and Products. 2015. V. 75. P. 165–177.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


