Известия РАН. Серия биологическая, 2022, № 6, стр. 607-613
Идентификация генов альтернативной оксидазы митохондрий Lupinus luteus и влияние на их экспрессию салициловой кислоты
П. А. Буцанец 1, *, Н. А. Шугаева 1, А. Г. Шугаев 1
1 ФГБУН Институт физиологии растений им. К.А. Тимирязева РАН
127276 Москва, ул. Ботаническая, 35, Россия
* E-mail: p.corbeau@list.ru
Поступила в редакцию 28.02.2022
После доработки 27.04.2022
Принята к публикации 27.04.2022
- EDN: GWYTNJ
- DOI: 10.31857/S102634702206004X
Аннотация
Исследовано влияние стрессового фитогормона – салициловой кислоты (СК) на изменения активности альтернативного пути дыхания и экспрессию генов альтернативной оксидазы митохондрий в семядолях этиолированных проростков люпина (Lupinus luteus L.). Обнаружено, что у L. luteus имеются минимум 3 ядерных гена двух подсемейств (AOX1a, AOX1d и AOX2), кодирующих различные изоформы белка альтернативной оксидазы. Выявлена активация СК альтернативного пути окисления в митохондриях и накопление транскриптов двух генов альтернативной оксидазы (AOX1a и AOX2). Экспрессия генов зависела от концентрации фитогормона. При 0.5 мМ концентрации фитогормона увеличивалось содержание мРНК гена АОХ2, а при 1 мМ происходило накопление de novo транскриптов гена АОХ1а.
Известно, что в дыхательной цепи митохондрий растений функционируют две различные терминальные оксидазы: цитохромоксидаза (ЦО) и CN-резистентная альтернативная оксидаза (АОХ), шунтирующая основную дыхательную цепь на уровне пула убихинона и переносящая электроны непосредственно на кислород в обход двух пунктов энергетического сопряжения (второго и третьего; Шугаев, 1999; Millar et al., 2011). При этом большая часть энергии, выделяемой при окислении дыхательных субстратов, не используется на синтез АТФ, а расходуется в виде тепла. Показано, что активация АОХ в неблагоприятных условиях, а также при ингибировании работы ЭТЦ (например, при действии цианида, антимицина А и других ингибиторов дыхания) способствует снижению скорости образования активных форм кислорода (АФК) основной дыхательной цепью благодаря уменьшению степени восстановленности ее переносчиков электронов (Maxwell et al., 2002; Грабельных и др., 2011).
АОХ кодируется ядерными генами двух подсемейств: АОХ1 и АОХ2 (Considine et al., 2001; Millar et al., 2011). Экспрессия генов семейства АОХ1, особенно АОХ1а, и последующая активация нефосфорилирующего альтернативного пути окисления (АП) в дыхательной цепи митохондрий повышается в стрессовых условиях (Clifton et al., 2006; Macherel et al., 2007). Наоборот, до недавнего времени считалось, что АОХ2 является конститутивным геном и его экспрессия не активируется в условиях стресса, однако наблюдается на отдельных этапах роста и развития растений, в частности, на начальном этапе прорастания семян Arabidopsis thaliana (Considine et al., 2001; Clifton et al., 2006; Macherel et al., 2007). Тем не менее, при прорастании семян Vigna unguiculata L. (семейство Fabaceae, к которому относится и Lupinus luteus), в условиях низкой температуры, а также в присутствии салициловой кислоты (СК) или Н2О2, активировалась экспрессия не только гена АОХ1а, но и АОХ2, хотя в разные временные периоды (Costa et al., 2010). Авторы предположили, что экспрессия гена АОХ2b имеет двойную природу: конститутивную и индуцибельную. В этом отношении интересны последние данные, свидетельствующие, что промоторы всех генов АОХ арабидопсиса содержат стресс-чувствительные цис-регуляторные элементы (Garmash et al., 2020). Предполагается, что экспрессия генов АОХ регулируется, как со стороны митохондрий (O–, перекись водорода, цитрат, а также CN– и другие ингибиторы цитохромного пути окисления), так и со стороны клетки, в которой прямо или опосредовано участвуют фитогормоны АБК, СК и этилен) (Vanlerberghe, 2013). Молекулярная природа этих сигнальных путей пока изучена слабо, тем не менее, в промоторе гена АОХ1а A. thaliana идентифицирована область митохондриальной ретроградной регуляции (МРР) его экспрессии (Dojcinovic et al., 2005), а также обнаружено 10 цис-активирующих регуляторных элементов чувствительных к Н2О2 и ротенону, но нечувствительных к СК (Ho et al., 2008). К настоящему времени накоплены убедительные доказательства роли митохондриальных АФК в активации экспрессии генов АОХ, в частности, АОХ1а (Vanlerberghe et al., 2020). Кроме того, экспрессия генов АОХ может регулироваться многими другими эффекторами, например, интермедиатами трикарбонового цикла, а также редокс-состоянием митохондрий и хлоропластов, на которые СК также оказывает существенное влияние (Selinski et al., 2018; Van Aken 2021).
Салициловая кислота (СК) – фитогормон, оказывающий регуляторное воздействий на многие физиологические процессы: прорастание семян, цветение, старение листьев, дыхание, фотосинтез и другие (Vlot et al., 2009; Rivas-San Vicente, Plasencia, 2011; Maruri-López et al., 2019). Однако доказана и детально изучена функциональная роль СК только в процессе индукции термогенеза при цветении ароидных, у которых фитогормон регулирует этот процесс через активацию экспрессии генов AOX и многократное увеличение активности АОХ в митохондриях початков (Raskin et al., 1987). Ранее было показано, в том числе и в наших исследованиях, что в зависимости от концентрации СК может оказывать, как разобщающее, так и ингибирующее действие на дыхание митохондрий растений, включая митохондрии семядолей L. luteus (Norman et al., 2004; Шугаев и др., 2014). Кроме того, было обнаружено, что увеличение концентрации СК существенно усиливало образование АФК митохондриями семядолей L. luteus (Буцанец и др., 2021).
В настоящее время мультигенное семейство альтернативной оксидазы в люпине не секвенировано, поэтому целью данной работы была идентификация генов АОХ L. luteus с последующим изучением влияния СК на их экспрессию и активность альтернативного пути дыхания в митохондриях семядолей.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. В качестве растительного объекта в работе были использованы семядоли этиолированных проростков люпина желтого (Lupinus luteus L., сорт Дружный 165) и изолированные из них митохондрии. Проращивание семян проводили в термостате при 25°С без света в течение 84 ч, затем семядоли отделяли от зародыша и инкубировали во влажной камере на дистиллированной воде в течение 12 ч. Для изучения влияния СК на АП и экспрессию генов АОХ семядоли переносили на фильтровальную бумагу, пропитанную водой (контроль) или раствором СК (0.1, 0.5, 1 мМ) в тех же условиях в течение 12 ч.
Митохондрии из семядолей L. luteus выделяли с использованием метода дифференциального центрифугирования как описано ранее (Шугаев и др., 2014). Циклы центрифугирования проводили на высокоскоростной центрифуге с охлаждением HITACHI CR22G-III (“Hitachi”, Япония) при 4°C. Пробирку с полученной суспензией интактных митохондрий хранили во льду.
Скорость дыхания митохондрий измеряли амперометрически на приборе Oxytherm Electrode Control Unit (“Hansatech Instruments”, Англия). Активности различных путей митохондриального окисления определяли с использованием специфических ингибиторов терминальных оксидаз дыхательной цепи: 2 мМ цианида калия (ингибитор цитохромоксидазы) и 3 мМ салицилгидроксамовую кислоту (СГК; ингибитор АОХ). Активность АП дыхания определяли по скорости поглощения О2 митохондриями при окисления малата в присутствии глутамата, которая ингибируется под действием СГК в присутствии цианидa (Шугаев, 1999).
Методы молекулярной биологии. Геномную ДНК экстрагировали методом фенольно-хлороформной экстракции (Sambrook et al. 1989). Плазмидную ДНК получали по методу Birnboim, Doly (1979), тотальную РНК выделяли по методу Chomczynski, Sacchi (1987). Синтез кДНК на матрице РНК выполняли по протоколу RevertAid M-Mul.V Reverse Transcription (“Fermentas”) с олиго(dT)18-праймерами. Праймеры для амплификации фрагментов целевых генов, а также биоинформационный анализ нуклеотидных последовательностей генов осуществляли в программах Unipro UGENE и Vector NTI.
Уровень экспрессии генов АОХ оценивали в полимеразной цепной реакции после обратной транскрипции (ОТ-ПЦР) на амплификаторе Light Cycler (“Roche”, Швейцария) с использованием кДНК в качестве матрицы и специфических праймеров генов АОХ (табл 1). ПЦР-продукты разделяли в
Таблица 1.
Список использованных праймеров в работе по идентификации и изучению экспрессии генов белка альтернативной оксидазы L. luteus
| Ген | Прямой праймер | Обратный праймер | |
|---|---|---|---|
| A. thaliana | AOX1a | F: 5'-ggaccacgtttgttctcgacg-3' | R: 5'-cctccaaccattccWggWacYg-3' |
| AOX1b | F: 5'-ctgctgtgactcacagccatc-3' | R: 5'-cctccaaccattccWggWacYg-3' | |
| AOX1c | F: 5'-gcatcaaagcaagcgacatcc-3' | R: 5'-cctccaaccattccWggWacYg-3' | |
| AOX1d | F: 5'-cctacagatcgatttaccgc-3' | R: 5'-cctccaaccattccWggWacYg-3' | |
| AOX2 | F: 5'-cgtgagttctgtttcctccac-3` | R: 5'-cctccaaccattcctggactg-3' | |
| L. luteus | AOX1a | F: 5'-gaatggaagtggaactgtttc-3' | R: 5'-cggtaggccaacgaagagatt-3' |
| AOX1d | F: 5'-catcataaaccctccaatttca -3' | R: 5'-gccaccgtctctagcaacat -3' | |
| AOX2 | F: 5'-gatgaaaattactcggaaaga-3' | R: 5'-gaggagcttgacaatccggta-3' | |
| UBQ | F: 5'-agcaaaaatccaggacaagg-3' | R: 5'-tccacggagacgtaaaacaa-3' | |
Для исследования нуклеотидной последовательности фрагментов целевых генов ампликоны ПЦР лигировали с плазмидным вектором pTZ57R/T с использованием набора InsTAclonTM PCR Cloning Kit (“Fermentas”) по протоколу и отдавали на секвенирование в компанию “Синтол”.
Статистика. Все эксперименты проводили в 3‑х биологических и 3-х аналитических повторностях. На рисунках приведены данные характерных опытов, данные на диаграммах выражают средние арифметические значения и стандартное отклонение.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для идентификации генов АОХ у L. luteus за основу были выбраны известные последовательности генов АОХ A. thaliana. Были подобраны праймеры к участкам всех 5 генов ядерного кодирования АОХ A. thaliana (АОХ1а, 1b, 1c, 1d и 2) длиной ~1000 п. н. (табл. 1) с зоной интрона и таким образом, чтобы длина получаемых фрагментов с кДНК составляла ~120 п. н.
С использованием ген-специфичных праймеров для пяти генов белка АОХ A. thaliana (табл. 1) на геномной ДНК, выделенной из семядолей этиолированных проростков L. luteus, в качестве матрицы, нами были получены фрагменты трех схожих генов белка АОХ (рис. 1б). Полученные ПЦР-фрагменты были очищены и клонированы в вектор pTZ57R/T. Целевые конструкции использовали для секвенирования полученных фрагментов.
Рис. 1.
Результаты электрофореза после амплификации на геномной ДНК Arabidopsis thaliana (а) или Lupinus luteus (б) в качестве матрицы с использованием генспецифичных праймеров для генов альтернативной оксидазы Arabidopsis thaliana. Обозначения: m – маркер длин фрагментов ДНК (1 т.п.н.).
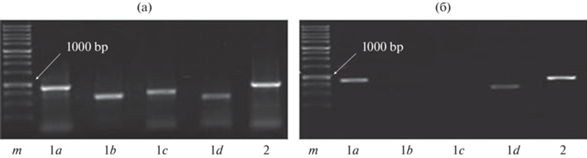
Определение нуклеотидной последовательности (секвенирование) изучаемых фрагментов и дальнейший биоинформационный анализ показали, что идентичность нуклеотидных последовательностей фрагментов трех выявленных генов АОХ L. luteus с генами АОХ A. thaliana составляла 100% (рис. 2). Таким образом, обнаружено, что АОХ L. luteus кодируется тремя генами из двух подсемейств – АОХ1а, АОХ1d и АОХ2.
Рис. 2.
Нуклеотидные последовательности лидирующих цепей изучаемых фрагментов генов альтернативной оксидазы Lupinus luteus.

Далее, методом полуколичественного ПЦР после обратной транскрипции изучали влияние различных концентраций СК на накопление матричных РНК (мРНК) генов АОХ L. luteus (рис. 3а). Для этого интактные семядоли проростков выдерживали во влажной камере на воде (контроль) или на растворах СК различной концентрации в течение 12 ч. Показано, что в контрольных семядолях L. luteus обнаруживалась только мРНК гена АОХ2 (рис. 3а). Выдерживание интактных семядолей на растворе 0.5 мМ СК приводило к заметному увеличению содержания мРНК гена АОХ2, что не наблюдалось при более высокой концентрации фитогормона (рис. 3а, 3б). Напротив, 1 мМ СК индуцировала накопление de novo мРНК гена АОХ1а. Стоит отметить, что транскриптов гена АОХ1d не обнаружено ни в одном варианте (рис. 3а). Интересно, что при действии очень высокой концентрации фитогормона (5 мМ СК) не было идентифицировано мРНК ни одного из трех исследуемых генов АОХ люпина (данные не представлены). Возможно, это связано с более ранним ответом АОХ на воздействие высокой концентрации СК. Таким образом, показано, что в семядолях этиолированных проростков L. luteus под влиянием СК происходят количественные и качественные изменения пула транскриптов генов, кодирующих АОХ.
Рис. 3.
Влияние различной концентрации СК в течение 12 ч на изменение количества транскриптов генов альтернативной оксидазы в интактных семядолях этиолированных проростков Lupinus luteus. Результаты электрофореза после ПЦР (а) и нормализованные относительно уровня референсного гена убиквитина (UBQ) содержание мРНК (б) в относительных единицах.
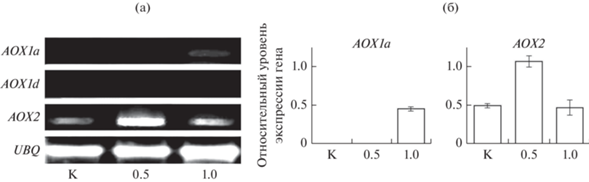
Как уже было отмечено выше, экспрессия гена AOX1a регулируется 10 высокочувствительными к перекиси цис-элементами, но не чувствительными к СК (Ho et al., 2008). Возможно, что влияние СК осуществляется через процессы, регулирующие редокс-состояние и уровень АФК как митохондрий, так и клетки в целом. На изолированных митохондриях растений было показано, что СК в зависимости от концентрации разобщает или ингибирует митохондриальное дыхание (Norman et al., 2004; Шугаев и др., 2014). Исходя из этого, зависимость индукции гена АОХ1а от концентрации фитогормона можно объяснить тем, что 1 мМ СК, ингибируя работу ЭТЦ митохондрий и, возможно, активность антиоксидантных ферментов, усиливает генерацию и накопление АФК в митохондриях, а в более низких концентрациях, разобщая дыхание, препятствует их образованию (Moller, 2001; Norman et al., 2004). Действительно, данные литературы, полученные на ткани листьев А. thaliana и на выделенных из них митохондриях, подтверждают зависимость уровня АФК от концентрации СК (Nie et al., 2015; Belt et al., 2017).
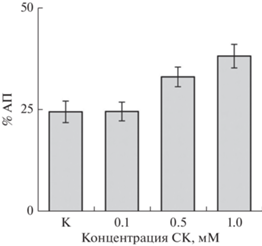
Известно, что изменение экспрессии гена под влиянием различных эффекторов не всегда сопровождается параллельным изменением скорости биосинтеза кодируемого им белка, а также активности этого белка. Отличительная особенность белка АОХ в том, что он функционирует в виде гомодимера и в результате изменения типа связи между тиоловыми группами консервативных участков двух мономеров молекулы АОХ осуществляется биохимическая регуляция его работы. Образование окисленной формы димера (формирование дисульфидных ковалентных связей) должно приводить к существенному снижению активности АОХ (Umbach et al., 2002). Тем не менее, было обнаружено, что под влиянием СК происходило не только накопление продуктов экспрессии соответствующих генов АОХ (рис. 3а), но и увеличение максимальной активности АП в изолированных митохондриях (рис. 4). Данные свидетельствующие об увеличении активности АП под влиянием 0.5–1 мМ СК, получены также на других растительных объектах (Gilliland et al., 2003; Clifton et al., 2006; Fung et al., 2006). Однако наши данные не согласуются с результатами, полученными на культуре клеток Nicotiana tabacum L., где СК в низкой концентрации (0.1–0.5 мМ) индуцировала экспрессию гена АОХ1а, а в высокой (3 мМ) – нет (Cvetkovska, Vanlerberghe, 2012). Возможно, что клетки суспензионной культуры более чувствительны к влиянию экзогенной СК, чем клетки ткани семядолей, или это обусловлено более ранним ответом АОХ на воздействие высокой концентрации фитогормона.
Рис. 4.
Влияние СК на активность альтернативного пути дыхания (АП) при окислении малата митохондриями семядолей Lupinus luteus.
Таким образом, в семядолях Lupinus luteus нами идентифицировано три ядерных гена АОХ двух подсемейств (AOX1a, AOX1d и AOX2), кодирующих различные изоформы белка. Обнаруженная СК-индукция гена АОХ2 ранее была показана только на прорастающих семенах V. unguiculata, где подсемейство АОХ2 представлено двумя генами (АОХ2а, АОХ2b), один из которых (АОХ2b) индуцировался гормоном. Постулируется, что стресс-индуцибельность конститутивных генов приобретается присоединением к промотору регуляторных цис-элементов, чувствительных к окислительному стрессу. Ранее было показано, в том числе, и в наших экспериментах, что увеличение концентрации СК существенно усиливало образование АФК митохондриями растений, включая митохондрии семядолей L. luteus, т.е. способствовало возникновению окислительного стресса. Однако в данной работе при инкубации семядолей в присутствии 1 мМ СК увеличения экспрессии гена АОХ2 не было обнаружено. На основании этого, можно предположить, что активация экспрессии гена АОХ2 не связана с повышением уровня АФК и окислительным стрессом, а реализуется, по-видимому, с участием другого регуляторного механизма. Исходя из обнаруженных различий в механизмах регуляции СК экспрессии двух генов АОХ, не исключено, что кодируемые ими изоформы белка играют в метаболизме митохондрий семядолей L. luteus различную функциональную роль.
Финансирование. Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации в рамках государственного задания (номер темы 121040800153-1).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Соблюдение этики исследований. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов.
Список литературы
Буцанец П.А., Шугаева Н.А., Шугаев А.Г. Влияние мелатонина и салициловой кислоты на генерацию АФК митохондриями семядолей люпина // Физиология растений. 2021. Т. 68. С. 421–429.
Грабельных О.И., Побежимова Т.П., Павловская Н.С., Королева Н.А., Боровик О.А., Любушкина И.В., Войников В.К. Антиоксидантная функция альтернативной оксидазы в митохондриях озимой пшеницы при холодовом закаливании // Биол. мембраны 2011. Т. 28 № 4 С. 274–283.
Шугаев А.Г. Альтернативная CN-резистентная оксидаза митохондрий растений: структурная организация, механизмы регуляции активности, возможная физиологическая роль // Физиология растений. 1999. Т. 46. С. 307–320.
Шугаев А.Г., Буцанец П.А., Андреев И.М., Шугаева Н.А. Влияние салициловой кислоты на метаболическую активность митохондрий растений // Физиология растений. 2014. Т. 61. С. 43–52.
Van Aken. O. Mitochondrial redox system as central hubs in plant metabolism and signaling // Plant Physiol. 2021. V. 186. P. 36–52.
Belt K., Huang S., Thatcher L.F., Casarotto H., Singh K.B., Van Aken O., Millar A.H. Salicylic acid-dependent plant stress signaling via mitochondrial succinate dehydrogenase // Plant Physiol. 2017. V. 173. P. 2029–2040.
Birnboim H.C., Doly J. A rapid alkaline extraction procedure for screening recombinant plasmid DNA // Nucl. Acids Res. 1979. V. 7. P. 1513–1523.
Chomczynski P., Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction // An. Biochem. 1987. V. 162. P. 156–159.
Clifton R., Millar A.H., Whelan J. Alternative oxidase: a comparative analysis of different expression in the gene family provides new insights into function on nonphosphorylating bypasses // Biochim. Biophys. Acta. 2006. V. 1757. P. 730–741.
Considine M.J., Holtzapffel R.C., Day D.A., Whelan J., Millar A.H. Molecular distinction between alternative oxidase from monocots and dicots // Plant Physiol. 2001. V. 129. P. 949–953.
Costa J.H., Mota E.F., Cambursano M.V., Lauxmann M.A., de Oliveira L.M.O., Lima M.G.S., Orellano E.G., de Melo D.F. Stress-induced co-expression of two alternative oxidase (VuAox1 and 2b) genes in Vigna unguiculata // J. Plant Physiol. 2010. V. 167. P. 561–570.
Cvetkovska M., Vanlerberghe G.C. Coordination of a mitochondrial superoxide burst during the hypersensitive response to bacterial pathogen in Nicotiana tabacum // Plant, Cell Environ. 2012. V. 35. P. 1121–1136.
Dojcinovic D., Krosting J., Harris A.J., Wagner D.J., Rhoads D.M. Identification of a region of the Arabodopsis AtAOX1a promoter necessary for mitochondrial retrograde regulation of expression // Plant Mol. Biol. 2005. V. 58. P. 159–175.
Fung R.W., Wang C.Y., Smith D.L., Gross K.C., Tao Y., Tian M. Characterization of alternative oxidase (AOX) gene expression in response to methyl salicylate and methyl jasmonate pre-treatment and low temperature in tomatoes // Plant Physiol. 2006. V. 163 P. 1049–1060.
Garmash E.V., Velegzhaninov I.O., Ermolina K.V., Rubak A.V., Malyshev R.U. Altered levels of AOX1a expression results in changes in the metabolic pathways in Arabidopsis thaliana plants acclimated to low dose rates of ultraviolet B radiation // Plant Sci. 2020. V. 291: 110332.
Gilliland A., Singh D.P., Hayward J.M., Moore C.A., Murphy A.M., York C.J., Slator J., Carr J.P. Genetic modification of alternative respiration has differential effects on antimycin A-induced versus salicylic acid-induced resistance to Tobacco mosaic virus // Plant Physiol. 2003. V. 132(3) P. 1518–1528.
Ho L.H.M., Giraud E., Uggalla V., Lister R., Clifton R., Glen A., Thirkettle-Watts D., Van Aken O., Whelan J. Identification of regulatory pathways controlling gene expression of stress-responsive mitochondrial proteins in Arabidopsis // Plant Physiol. 2008. V. 147. P. 1858 –1873.
Macherel D., Benamar A., Avelange-Macherel M.H., Tolleter D. Function and stress tolerance of seed mitochondria // Physiol. Plant. 2007. V. 129. P. 233–241.
Maruri-López I., Aviles-Baltazar N.Y., Buchala A., Serrano M. Intra and extracellular journey of the phytohormone salicylic acid // Front. Plant Sci. 2019. V. 10. P. 423.
Maxwell D.P., Nickels R., McIntosh L. Evidence of mitochondrial involvement in the transduction of signals required for the induction of genes associated with pathogen attack and senescence // Plant Journal. 2002. V. 29. P. 269–279.
Millar A.H., Whelan J., Soole K.L., Day D.A. Organization and regulation of mitochondrial respiration in plants // Ann. Rev. Plan Biol. 2011. V. 62. P. 79–104.
Møller I.M. Plant mitochondria and oxidative stress: electron transport, NADPH turnover, and metabolism of reactive oxygen species // Annu Rev. Plant. Physiol. Plant Mol. Biol. 2001. V. 52 P. 561–591.
Nie S., Yue H., Zhou J., Xing D. Mitochondria-derived reactive oxygen species play a vital role in the salicylic acid signaling pathway in Arabidopsis thaliana // PLoS One. 2015. V. 10. e0119853.
Norman C., Howell K.A., Millar A.H., Whelan J.M., Day D.A. Salicylic acid is uncoupler and inhibitor of mitochondrial electron transport // Plant Physiol. 2004. V. 134. P. 492–501.
Raskin I., Ehmann A., Melander W.R., Meeuse B.J.D. Salicylic acid: A natural inducer of heat production in Arum lilies // Science. 1987. V. 237. P. 1601–1602.
Rivas-San Vicente M., Plasencia J. Salicylic Acid beyond Defence: Its Role in Plant Growth and Development // J. Exp. Bot. 2011. V. 62. P. 3321–3338.
Saisho D., Nakazono M., Lee K.H., Tsutsumi N., Akita S., Hirai A. The gene for alternative oxidase-2 (AOX-2) from Arabidopsis thaliana consists of five exons unlike other AOX genes and is transcribed at an early stage during germination // Genes Genet. Systems. 2001. V. 76 P. 89–97.
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning: A Laboratory Manual. // Cold Sp. Harbor Lab. Press. 1989.
Selinski J., Scheibe R., Day D. A., Whelan J. Alternative oxidase is positive for plant performance // Trends Plant Sci. 2018. V. 23. P. 588–597.
Umbach A.L., Gonzalez-Meler M.A., Sweet C.R., Siedow J.N. Activation of the plant mitochondrial alternative oxidase: insights from site-directed mutagenesis // Biochim. Biophys. Acta. 2002. V. 1554 P. 118–128.
Vanlerberghe G.C. Alternative oxidase: a mitochondrial respiratory pathway to maintain metabolic and signaling homejstasis during abiotic and biotic stress in plants // Int. J. Mol. Sci. 2013. V. 14. P. 6805–6847.
Vanlerberghe G.C., Dahal K., Alber N.A., Chadee A. Photosynthesis, respiration and growth: A carbon and energy balancing act for alternative oxidase // Mitochondrion. 2020. V. 52. P. 197–211.
Vlot A.C., Dempsey D.A., Klessig D.F. Salicylic acid, a multifaceted hormone to combat disease // Annu. Rev. Phytopatol. 2009. V. 47 P. 177–206.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


