Известия РАН. Серия физическая, 2019, T. 83, № 1, стр. 100-105
Фолдинг белков как процесс автоволновой самоорганизации в активных средахА. Э. Сидорова, Е. В. Малышко, А. Р. Котов, Н. Т. Левашова, М. Н. Устинин, В. А. Твердислов
А. Э. Сидорова 1, Е. В. Малышко 1, А. Р. Котов 1, Н. Т. Левашова 1, М. Н. Устинин 2, В. А. Твердислов 1, *
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
2 Институт математических проблем биологии РАН – филиал ИПМ имени М.В. Келдыша РАН
Москва, Россия
* E-mail: tverdislov@mail.ru
Аннотация
Фолдинг белков рассмотрен как процесс автоволновой самоорганизации в активных средах, где гомохиральность первичных структур создает распределенный запас свободной энергии. Представлена количественная модель описания выявленной ранее закономерности фолдинга – стратифицированного структурообразования с переменным знаком хиральности в иерархиях L-аминокислот, D-α-спиралей и L-суперспиралей.
Работа посвящена развитию выдвинутой ранее авторами гипотезы относительно физической сущности и фундаментальной системной значимости явления хиральности в молекулярной биологии [1, 2]. Это явление широко известно как положение о “хиральной чистоте биосферы” – жестком наборе диссимметрий, характерных для базовых биологических соединений. Диссимметрий, как принято считать, между собой напрямую не связанных, но накладывающих жесткие ограничения на процессы биосинтеза и метаболизма. Гомохиральность аминокислот в белках (L), всех углеводов и, в т.ч., рибозы и дезоксирибозы в нуклеиновых кислотах (D), (фосфо)липидов у бактерий и животных (L) и т.д. трактуется как рациональный выход живых систем из гипотетического рацемата абиогенного “первичного бульона” органических соединений на стадии биопоэза [3]. Гомохиральность входящих в белки “левых” L-аминокислот обеспечивает стереоспецифичность комплементарных взаимодействий и минимизирует объем информации, необходимый для однозначного кодирования нуклеиновыми кислотами аминокислотных последовательностей.
ХИРАЛЬНОСТЬ, СТРУКТУРНЫЕ ИЕРАРХИИ И ФОЛДИНГ БЕЛКОВ
Симметрийные особенности отдельных классов биомолекул традиционно рассматриваются разрозненно как набор независимых нарушений симметрии на “нижнем этаже” структурных иерархий [4, 5]. Причем, рассматриваются только в одном тетраэдрическом типе симметрии, непосредственно связанном с асимметричным углеродом в sp3-гибридизации. Верхние структурные “этажи” белков и нуклеиновых кислот, также хиральные ̶ спиральные и суперспиральные, в общее рассмотрение не вовлекаются. Тем не менее, все важнейшие биологические макромолекулярные соединения природа объединила общим принципом нарушения симметрии.
В вопросах биологической хиральности общепризнанной и обсуждаемой проблемой остается вопрос о физическом механизме возникновения хиральных диссимметрий. Мы же поднимаем не менее важный вопрос о физических аспектах и системной роли (гомо)хиральности в процессах структурообразования, взаимодействия и трансформации биомакромолекул и надмолекулярных структур. На основании анализа различных баз данных нами было установлено, что иерархии первичной, вторичной и т.д. структур белков и нуклеиновых кислот характеризуются сменой типов симметрии, увеличением масштабов и чередованием знаков хиральности, определяющих их физические особенности и молекулярно-биологические функции. Выявлена и обоснована новая молекулярно-биологическая закономерность: начиная с уровня асимметричного углерода в аминокислотах и дезоксирибозе, прослежена тенденция чередования знака хиральности внутримолекулярных структурных уровней [1, 6].
У белков первичная структура – полипептидная цепочка – последовательность “левых” аминокислотных остатков. Образуя вторичные структуры, она скручивается в “правые” α-спирали, которые, в свою очередь, сворачиваются в “левые” суперспирали. Четвертичные структуры белков, собирающиеся уже из индивидуальных молекул, снова образуют “правые” витые конструкции. Поэтому у белков последовательность смены знака хиральности в структурно-функциональной иерархии: L–D–L–D. Для ДНК последовательность схожая, но иная: D–L–D–L (подробно см. [1]). Заметим, что такая спонтанно формирующаяся знакопеременная хиральная иерархия не является “изобретением” исключительно живой природы – она свойственна также многим неживым объектам [6].
Смещение по фазе знака хиральности соответствующих структурных уровней белков и нуклеиновых кислот на половину периода, по всей вероятности, служит универсальным интегральным кодом распознавания “свой–чужой” для этих важнейших классов биомолекул, предшествующим локальному распознаванию на основе комплементарных соответствий. В таком случае все поле молекулярно-биологических соответствий можно представить в виде периодической таблицы типа шахматной доски, где по клеткам хиральности передвигаются и взаимодействуют хиральные химические соединения. Иными словами, в молекулярной биологии имеется некий физический фундамент симметрийных соответствий, по которому движутся, взаимодействуют и трансформируются хиральные потоки биосинтеза и метаболизма.
Таким образом, суть “гомохиральной находки” биопоэза состоит не столько в экономии ресурсов, сколько в возможности построения на ее основе связной системы симметрийных соответствий при построении “вертикальных” иерархий структур в веществах одного типа и “горизонтальных” взаимодействий между подобными и различными веществами.
Формирование самих знакопеременных хиральных иерархий в макромолекулярных структурах связывают с предположением о существовании воронки в конфигурационном пространстве на поверхности потенциальной энергии со сложным ландшафтом, которая втягивает процесс сворачивания полипептидной цепи в нативную конформацию [7, 8]. Считается, что эта воронка, характеризующаяся минимумом свободной энергии, задает направление траектории фолдинга в конфигурационном пространстве макромолекулы, проходящей через цепочку локальных минимумов энергии. Мы предполагаем, что данный процесс обусловлен четкой физической причиной – стремлением системы понизить исходный уровень свободной энергии, образующийся при энергозависимом отборе гомохиральных мономеров первичных структур макромолекул из их рацемических смесей. Действительно, известно, что в живых клетках антиэнтропийный отбор левых аминокислот молекулами т-РНК происходит с затратой энергии АТФ [9]. Таким образом, первичная структура белков – полипептидная цепь из остатков левых аминокислот – содержит распределенный запас свободной энергии. Поэтому можно полагать, что обнаруженные нами знакопеременные хиральные комплементарные друг к другу последовательности структурных уровней L–D–L–D для белков определяют траекторию, по которая направляется фолдинг макромолекул, происходит процесс “вертикальной рацемизации”.
Гомохиральность первичной структуры белков обусловливает наличие в системе рассредоточенного запаса свободной энергии, что придает ей свойства одномерной активной среды и создает предпосылки автоволновой самоорганизации – последовательного формирования спиральных, суперспиральных и складчатых регулярных структур [2]. Диссипация происходит не за счет локальной рацемизации отдельных мономеров, а за счет изменения знака хиральности при формировании более крупномасштабной структуры уже с иным типом симметрии. При этом волна структурных перестроек в полипептидной цепи формирует стабильные регулярные вторичные и третичные структуры лишь в тех ее участках, где водородные связи и ван-дер-ваальсовы взаимодействия способны зафиксировать эффект “кристаллизации”. Формирование спиральных участков при фолдинге апериодично – здесь реализуется идея Шредингера феномен “апериодического кристалла”. При этом реализуется также давняя идея “конформационных волн”, теперь уже в представлениях активных сред и автоволновой самоорганизации в макромолекулах.
МЕТОДИКА ИССЛЕДОВАНИЯ ХИРАЛЬНОСТИ В ИЕРАРХИЯХ БЕЛКОВЫХ СТРУКТУР
На сегодняшний день имеется достаточное количество работ [10–16], в которых предлагаются различные методы выработки критерия нарушения симметрии. Однако эта проблема на настоящий момент по-прежнему не решена. Но даже самые удачные их этих методов лишь позволяют определить меру сходства исходного множества точек со своим зеркальным отображением и, следовательно, не позволяют получать “переключение” знака хиральности для противоположных стереоизомеров. Так, метод, основанный на двугранных углах для аминокислотных остатков цепи (широко известные карты Рамачандрана) [16] определяет только преобладающую конформацию аминокислот в белке [17], не позволяет определять знак хиральности и не применим к нуклеиновым кислотам.
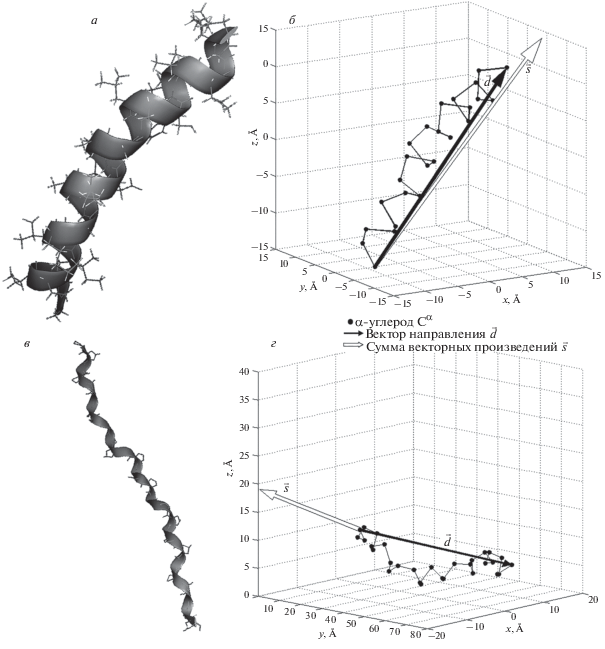
В отличие от рассмотренных методов, наш подход оценки хиральных структур носит более общий характер и позволяет более полно определять вторичную структуру: ее тип и знак хиральности с информацией о пространственной структуре. Достаточным условием для определения знака хиральности вторичной структуры белков является взаимное расположение α-углеродов Сα, что является явным преимуществом при обработке больших массивов данных (рис. 1).
Рис. 1.
Изображение правой α-спирали (PDB: 5UA8) и левой полипролиновой спирали (PDB: 1CAG, chain A): а, в – до обработки; б, г – после обработки [18].
Разработанный метод оценки хиральности основан на векторных произведениях. Для n атомов получаем (n – 1) векторов, сумма которых – “вектор направления” d:
(1)
$\begin{gathered} \overrightarrow {C_{1}^{\alpha }C_{2}^{\alpha }} + \overrightarrow {C_{2}^{\alpha }C_{3}^{\alpha }} + \ldots + \overrightarrow {C_{{\left( {n - 1} \right)}}^{\alpha }C_{n}^{\alpha }} = \\ = \sum\limits_{j = 1}^{\left( {n - 1} \right)} {\overrightarrow {C_{j}^{\alpha }C_{{j - 1}}^{\alpha }} } = \,\,\quad\overrightarrow {C_{1}^{\alpha }C_{n}^{\alpha }} = \vec {d}. \\ \end{gathered} $Использование векторного произведения позволяет заложить в модель чувствительность к направлению закрутки спирали: поднимаясь в правой спирали по оси “вверх”, векторные произведения направлены также “вверх” относительно направления оси спирали (рис. 2а), а поднимаясь “вверх” в левой спирали – направлены “вниз”, по правилу правой руки, (рис. 2б).
Рис. 2.
Модели витков правой (а) и левой (б) спиралей, угол между вектором направления $\vec {d}$ и суммой векторных произведений $\vec {s}$ в зависимости от направления спирали (в, г).

Для (n – 1) векторов сумма (n – 2) векторных произведений – вектор $\vec {s}\,:$
(2)
$\begin{gathered} \overrightarrow {C_{1}^{\alpha }C_{2}^{\alpha }} \times \overrightarrow {C_{2}^{\alpha }C_{3}^{\alpha }} + \overrightarrow {C_{2}^{\alpha }C_{3}^{\alpha }} \times \overrightarrow {C_{3}^{\alpha }C_{4}^{\alpha }} + \ldots = \\ = \sum\limits_{j = 1}^{\left( {n - 2} \right)} {\overrightarrow {C_{j}^{\alpha }C_{{\left( {j + 1} \right)}}^{\alpha }} } \times \overrightarrow {C_{{\left( {j + 1} \right)}}^{\alpha }C_{{\left( {j + 2} \right)}}^{\alpha }} = \vec {s}. \\ \end{gathered} $Угол между $\vec {d}$ и $\vec {s}$:
(3)
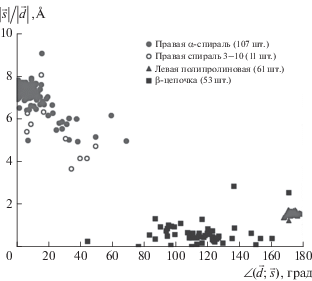
$\angle \left( {\vec {d},\vec {s}} \right) = \arccos \left( {\frac{{\vec {d} \cdot \vec {s}}}{{\left| {\vec {d}} \right| \cdot \left| {\vec {s}} \right|}}} \right).$Согласно рассматриваемому методу, для правых спиралей угол ∠($\vec {d},\vec {s}$) должен быть менее 90° (рис. 2в), а для левой спирали – более 90° (рис. 2г). Предлагается представлять данные в виде оригинальных “карт хиральности”, где по горизонтальной оси откладывается угол ∠($\vec {d},\vec {s}$), а по вертикальной оси – отношение |${{\left| {\vec {s}} \right|} \mathord{\left/ {\vphantom {{\left| {\vec {s}} \right|} {\left| {\vec {d}} \right|}}} \right. \kern-0em} {\left| {\vec {d}} \right|}}$| (рис. 3).
На “карте” правые α-спирали располагаются выше, что объясняется плотной упаковкой витков. Левые полипролиновые спирали и β-цепочки располагаются внизу, так как это растянутые и плоские структуры. Как можно видеть, все правые спирали имеют угол менее 90° (cos∠($\vec {d},\vec {s}$) > 0), а левые полипролиновые – более 90° (cos∠($\vec {d},s$) < 0). Таким образом, наш метод верно определяет направление закрутки. Также надо отметить, что наш численный метод смог выявить неочевидное для визуального анализа: β-цепочки имеют тенденцию к левой закрутке.
МАТЕМАТИЧЕСКАЯ МОДЕЛЬ ФОЛДИНГА БЕЛКОВ КАК ПРОЦЕССА АВТОВОЛНОВОЙ САМООРГАНИЗАЦИИ В АКТИВНЫХ СРЕДАХ
На основании полученных данных предложена пространственная математическая модель фолдинга белков как процесса автоволновой самоорганизации в активных средах, позволяющая независимо от длины цепи учитывать знак хиральности структуры и иерархический уровень. В ходе компьютерной симуляции, согласно модели, формируется спиральная структура u, определяемая переменными (x, y) с заданным направлением закрутки. Модель представляет собой следующее двумерное автоволновое уравнение:
(4)
$D\Delta u = u\left( {u - \frac{{{{z}_{\upsilon }}\left( {x,y} \right)}}{2}\frac{{{{x}^{2}} + {{y}^{2}}}}{{x_{\upsilon }^{2} + y_{\upsilon }^{2}}}} \right)\left( {u - {{z}_{\upsilon }}\left( {x,y} \right)} \right),$(5)
$\begin{gathered} {{C}_{1}} = \left( {\begin{array}{*{20}{c}} {{\text{cos}}\left( {\pi - \quad\alpha } \right)}&{ - {\text{sin}}\left( {\pi - \quad\alpha } \right)}&0 \\ {{\text{sin}}\left( {\pi - \quad\alpha } \right)}&{{\text{cos}}\left( {\pi - \quad\alpha } \right)}&0 \\ 0&0&1 \end{array}} \right) = \\ = \left( {\begin{array}{*{20}{c}} { - {\text{cos}}\quad\alpha }&{ - {\text{sin}}\quad\alpha }&0 \\ {{\text{sin}}\alpha }&{ - {\text{cos}}\quad\alpha }&0 \\ 0&0&1 \end{array}} \right), \\ {{C}_{2}} = \left( {\begin{array}{*{20}{c}} 1&0&0 \\ 0&0&{ - 1} \\ 0&1&0 \end{array}} \right), \\ {{C}_{3}} = \left( {\begin{array}{*{20}{c}} {\cos \beta }&0&{ - \sin \beta } \\ 0&1&0 \\ {\sin \beta }&0&{\cos \beta \quad} \end{array}} \right)\quad.\quad \\ \end{gathered} $Рис. 4.
Результаты математического моделирования автоволнового процесса фолдинга: а – виток из 4 аминокислот, б – спираль из 12 аминокислот.

Автоволновой фронт будет иметь форму спирали, проекция которой на плоскости OXY будет описываться уравнением ${{x}^{2}} + {{y}^{2}}$ =  (рис. 4).
(рис. 4).
На рис. 4а представлена начальная стадия формирования правой спирали движением влево от условно принятого первого элемента. На рис. 4б представлена правая спираль из 12 элементов (4 витка). Активатором системы является первичный носитель знака хиральности. Учет знака хиральности заложен в модель и позволяет описывать стратификацию в структурно-функциональной иерархии белковых молекул, что обусловливает процесс фолдинга.
ЗАКЛЮЧЕНИЕ
Таким образом, можно считать, что в дополнение к классическим представлениям [19, 20] представления о знакопеременной хиральной иерархичности сопряженных уровней структур в макромолекулах существенно расширяют наши знания о природе структурообразования в белках. Становится ясна физическая основа дискретности структурных уровней, которая служит инструментом пространственной самоорганизации (уникальной самосборки – фолдинга), структурной основой “выделенных механических” степеней свободы в конструкциях биологических макромолекулярных машин. А сам процесс иерархического структурообразования – фолдинг – следует рассматривать как автоволновой процесс структурного фазового перехода. В этом отношении теоретическая модель, развитая в работе, позволяет перейти к количественным термодинамическим оценкам формирования третичных и четвертичных хиральных структур.
Первая часть работы выполнена при частичной поддержке гранта Российского научного фонда (проект № 14-50-00029), а вторая – в рамках реализации проекта Российского фонда фундаментальных исследований: проект 18-01-00424.
Список литературы
Твердислов В.А. и др. // Биофизика. 2017. Т. 62. № 3. С. 421.
Твердислов В.А., Малышко Е.В., Ильченко С.А. // Изв. РАН. Сер. физ. 2015. Т. 79. № 12. С. 1728.
Твердислов В.А., Сидорова А.Э., Яковенко Л.В. // Биофизика. 2012. Т. 57. № 1. С. 146.
Гольданский В.И., Кузьмин В.В. // УФН. 1989. Т. 157. С. 3.
Flügel R.M. Chirality and Life: A Short Introduction to the Early Phases of Chemical Evolution. Berlin Heidelberg: Springer-Verlag, 2011.
Твердислов В.А. // Биофизика. 2013. Т. 58. № 1. С. 159.
Levinthal C. in Mossbauer Spectroscopy in Biological Systems: Proc. meeting held at Allerton House, Monticello, Illinois (Eds DeBrunner J.T.P., Munck E.) University of Illinois, 1969. P. 22.
Шайтан К.В., Ложников М.А., Кобельков Г.М. // Биофизика. 2016. Т. 61. № 4. С. 629.
Lewin B. et al. Cells. London: Jones and Bartlett Publishers, 2007; Пер. на русск. яз.: Льюин Б. и др. Клетки. М.: БИНОМ, 2011. 951 с.
Guye P.A. // Compt. Rendus. 1890. V. 110. P. 714.
Ruch E., Schönhofer A. // Theor. Chim. Acta. 1970. V. 19. № 3. P. 225.
Mezey P.G. // J. Molec. Struct.: THEOCHEM. 1998. V. 455. P. 183.
Zabrodsky H., Peleg S., Avnir D. // J. Amer. Chem. Soc. 1992. V. 114. № 20. P. 7843.
Petitjean M. // Entropy. 2003. V. 5. № 3. P. 271.
Лузанов А.В., Иванов В.В., Миняев Р.М. // Журн. структур. химии. 1998. Т. 39. № 2. С. 319.
Ramachandran G.N., Ramakrishnan C., Sasisekharan V. // J. Molec. Biol. 1963. V. 7. № 1. P. 95.
Овчинников Ю.А. // Биоорганическая химия. М.: Просвещение, 1987. 815 с.
Документация формата PDB файла. URL: http://www.wwpdb.org/documentation/file-format.
Dill K.A., MacCallum J.L. // Science. 2012. V. 338. P. 1042.
Финкельштейн А.В. // Усп. биол. химии. 2018. Т. 58. С. 7.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая