Известия РАН. Серия физическая, 2019, T. 83, № 3, стр. 408-414
Синтез и спектральная охарактеризация новых биоразлагаемых производных арабиногалактана для диагностики и терапии
Т. В. Туник 1, 2, 3, *, У. М. Немченко 3, Т. В. Ганенко 1, 2, Г. В. Юринова 4, Ю. П. Джиоев 2, 3, Б. Г. Сухов 1, 2, В. И. Злобин 5, Б. А. Трофимов 1
1 Федеральное государственное бюджетное учреждение науки Иркутский институт химии им. А.Е. Фаворского Сибирского отделения Российской академии наук
Иркутск, Россия
2 Федеральное государственное бюджетное учреждение науки Иркутский научный центр
Сибирского отделения Российской академии наук
Иркутск, Россия
3 Федеральное государственное бюджетное научное учреждение “Научный центр проблем здоровья семьи
и репродукции человека”
Иркутск, Россия
4 Научно-исследовательский институт прикладной физики федерального государственного бюджетного образовательного учреждения высшего образования “Иркутский государственный университет”
Иркутск, Россия
5 Федеральное государственное бюджетное образовательное учреждение высшего образования “Иркутский государственный медицинский университет” Министерства здравоохранения Российской Федерации
Иркутск, Россия
* E-mail: t-mironova87@mail.ru
Поступила в редакцию 03.09.2018
После доработки 10.09.2018
Принята к публикации 22.10.2018
Аннотация
На основе биосовместимого, биоразлагаемого бета-полисахарида арабиногалактана синтезировано его окисленное производное – полиальдегид арабиногалактана, из которого получены гидрогели с хитозаном и с пара-аминобензойной кислотой. Обсуждаются спектральные характеристики всех новых соединений и колориметрическое тестирование их биоразлагаемости бифидобактериями.
ВВЕДЕНИЕ
В XXI веке интенсивными темпами идут работы по созданию новейших лекарственных препаратов с адресной системой доставки. В качестве матриц для создания таких систем все чаще используют углеводные полимеры – полисахариды, способные доставить выбранный терапевтический или диагностический агент к определенным клеткам [1]. Присоединение физиологически активных веществ требует предварительной функционализации полимера-носителя. Простым и эффективным методом активации полисахаридов является периодатное окисление, которое приводит к генерации на макромолекулах полисахаридов высокореакционноспособных альдегидных групп [2–6]. Однако большинство подобных исследований посвящено модификации наиболее доступных и используемых в медицине и ветеринарии полисахаридов – целлюлозе, декстрану, хитозану. Следует отметить, что арабиногалактан (АГ) лиственницы сибирской является особо перспективной матрицей для создания композитных систем доставки наночастиц и лекарственных препаратов благодаря биосовместимости, биоразлагаемости и комплексу других ценных биомедицинских свойств [7–25].
Таким образом, модифицирование бета-полисахарида арабиногалактана реакционноспособными альдегидными группами с последующим превращением полиальдегида арабиногалактана в ценные гидрогелевые конструкции с хитозаном и с витамином – пара-аминобензойной кислотой – при сохранении способности к биоразложению (биоутилизации) у получаемых новых производных арабиногалактана является актуальной задачей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование
Спектры оптического поглощения водных растворов изучаемых субстанций были записаны на спектрометре LAMBDA 35 UV-Vis (Perkin Elmer, США). В качестве раствора сравнения использовали дистиллированную воду.
ИК-спектры записывали на фурье-спектрометре Vertex 70 (Bruker, Германия) в таблетках KBr.
Спектры ЯМР 1Н записывали на спектрометре DPX 400 (Bruker, Германия) в растворе D2O. В качестве стандарта использовали сигналы остаточных протонов растворителя.
Реактивы
В работе использовали промышленный комплекс арабиногалактана с флавоноидами производства (ООО “Химия древесины”, Иркутск), а также специально очищенный арабиногалактан (АГ). Водные растворы конъюгата арабиногалактана с фенольными примесями имеют кислую реакцию (pH 3.5), а растворы очищенного АГ − близкую к нейтральной реакцию (pH 5.5). Очистку раствора конъюгата АГ от фенольных примесей проводили методом колонной хроматографии на полиамидном порошке “НИОХ” с последующим высаживанием раствора в этанол (1 : 4) и просушкой.
Все химические реактивы производства ООО “Реахим” (Россия) имели квалификацию не ниже ч. д. а: метапериодат натрия х. ч., NaOH х. ч., LiOH х. ч., Na2S2O3 х. ч., NH2OH·HCl х. ч., K2CO3 х. ч. Приготовление растворов HCl, I2 осуществляли из готовых фиксаналов производства “Киевский завод РИАП”.
Для создания гелевых конструкций на основе полученного полиальдегида АГ был использован аминополисахарид хитозан (ЗАО “Биопрогресс”) и пара-аминобензойная кислота (ООО “Реахим”).
В качестве растворителя и реакционной среды использовалась дистиллированная вода.
Синтез полиальдегида арабиногалактана
В коническую колбу к 1.5 г арабиногалактана приливали 150 мл 0.05 М раствора периодата натрия. Окисление происходило в течение 0.5–4 ч при перемешивании в темноте, при комнатной температуре во избежание “сверхокисления”. Раствор оставляли в темноте в колбе с открытым горлом при перемешивании на 24 ч. По окончании синтеза реакционную смесь диализовали против дистиллированной воды. Мешок для диализа изготовлен из целлюлозной мембраны с пределом пропускания по белку 3500 Да. Диализовали в цилиндре объемом 3 литра при перемешивании против дистиллированной воды в течение 5 суток с трехкратной сменой воды. Диализат упаривали на роторном испарителе под вакуумом до сиропообразного состояния при температуре бани 45°C. Полученный полиальдегид арабиногалактана досушивали без нагрева под вакуумом и хранили в высушенном состоянии при комнатной температуре в темноте.
Обратное йодометрическое титрование
Степень окисления полученного полиальдегида арабиногалактана определяли методом обратного йодометрического титрования заместителей. Методика титрования заместителя основана на прибавлении к анализируемому раствору избытка вспомогательного реагента, с которым определяемое вещество вступает в стехиометрическую реакцию. В результате образуется эквивалентное (по отношению к анализируемому веществу) количество нового соединения, которое называют заместителем. Заместитель оттитровывают прямым титрованием рабочим раствором тиосульфата натрия.
Четыре навески альдегида АГ по 20 мг, взвешенные с точностью до 0.1 мг, растворяли в 10 мл 0.1 н NaOH каждую, перемешивали 5 мин, прибавляли по 20 мл 0.01 н раствора I2 и перемешивали еще 30 мин, затем добавляли по 12 мл 0.1 н раствора HCl и оттитровывали 0.01 н раствором Na2S2O3 до бледно-соломенного цвета. В каждую пробу добавляли по 2 мл раствора крахмала и титровали голубой раствор до обесцвечивания.
Определение степени окисления полиальдегида
Степень окисления γок рассчитывали по формуле (1) исходя из данных, полученных методом обратного йодометрического титрования:
(1)
${{\gamma }_{{{\text{о к }}}}} = \frac{{V\left( {{\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}} \right)N{\text{'}}\left( {{\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}} \right)24.7 \cdot {{{10}}^{3}}}}{{2g}},$(2)
$N{\text{'}} = \frac{{V\left( {{{{\text{I}}}_{{\text{2}}}}} \right)N\left( {{\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}} \right)}}{{V{\text{'}}\left( {{\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}} \right){\text{к о н т р }}}},$V '(Na2S2O3)контр – поправочный коэффициент, полученный путем титрования тиосульфата натрия йодом:
(3)
$\begin{gathered} V\left( {{\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}} \right) = V\left( {{\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}} \right){\text{х о л }} - \\ - \,\,V\left( {{\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}} \right){\text{к о н т р ,}} \\ \end{gathered} $V(Na2S2O3)хол – объем, пошедший на титрование неокисленного полисахарида тиосульфатом натрия (холостой опыт); V(Na2S2O3)контр – объем, пошедший на титрование диальдегидполисахарида тиосульфатом натрия.
Синтез полиоксима арабиногалактана
В пенициллинку к водному раствору, содержащему 2.5 мл 2 N NH2OH · HCl, 0.9 мл 4 N LiOH, 0.6 мл 2 N K2CO3, добавляли 100 мг полиальдегида арабиногалактана и перемешивали в течение 1 ч при комнатной температуре. Продукт высаживали в 4-кратный объем спирта. Осадок оксима выделяли фильтрованием, сушили под вакуумом. Содержание азота в полиоксиме определяли методом элементного анализа. По содержанию азота затем рассчитывали количество альдегидных групп.
Определение количества альдегидных групп
Количество альдегидных групп рассчитывали по формуле (4):
(4)
$\begin{gathered} C\left( \% \right)\left( {_{{{\text{Н С }} = {\text{О }}}}} \right) = \\ = {{\nu N \cdot 29} \mathord{\left/ {\vphantom {{\nu N \cdot 29} {\left( {m\left( {{\text{у г л }}{\text{.о с т }}} \right) + \nu N \cdot 29} \right) \cdot 100\% }}} \right. \kern-0em} {\left( {m\left( {{\text{у г л }}{\text{.о с т }}} \right) + \nu N \cdot 29} \right) \cdot 100\% }}, \\ \end{gathered} $νN = CN/AN, ν(НС=О) = νN, m(угл. ост) = 100 – – m(НС=NOH), m(НС=NOH) = νN · 44, M(НС=NOH) = 44, M(HC=O) = 29, m(НС=О) = νN · 29.
Синтез гелевых конструкций на основе полиальдегида арабиногалактана-хитозана
В пенициллинке предварительно растворяли 40 мг полиальдегида арабиногалактана в 1 мл дистиллированной воды. За счет присутствия большого количества полуацетальных связей растворение продукта требовало 48 ч. К полученному раствору прибавляли раствор 40 мг хитозана в 1 мл дистиллированной воды. Через 30 мин наблюдали изменение цвета раствора с бледно-желтого до насыщенного красно-коричневого оттенка и гелеобразование, усиливающееся со временем.
Синтез гелевых конструкций на основе полиальдегида арабиногалактана- пара-аминобензойной кислоты
В пенициллинке предварительно растворяли 40 мг полиальдегида арабиногалактана в 1 мл дистиллированной воды. К полученному раствору прибавляли раствор 40 мг пара-аминобензойной кислоты в 1 мл дистиллированной воды.
Оценка биоразлагаемости новых субстанций, полученных на основе арабиногалактана
Для культивирования бифидобактерий (коммерческий препарат “Бифидумбактерин”) использовали голодную тиогликолевую среду в качестве контроля. Для оценки влияния интенсивности роста культуры бифидобактерий в соответствующие среды вносили арабиногалактан, полиальдегид арабиногалактана, конъюгат полиальдегида арабиногалактана с хитозаном, а также конъюгат полиальдегида арабиногалактана с пара-аминобензойной кислотой в концентрации 40 мг на пробу. Культивирование бифидобактерий (Bifidobacterium bifidum) осуществляли в слое среды (пробирки с 5 мл среды) при 37°C в течение 8 суток (192 ч) в трех повторах для каждого варианта. Оптическую плотность растущей культуры бифидобактерий измеряли при помощи NanoPhotometerTMP-Class (Германия) при длине волны 600 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для повышения реакционной способности гидроксильные группы полисахаридов модифицируют в альдегидные группы химическим окислением [2–6], а также радиационным методом с использованием тормозного γ-излучения [26]. В полиальдегидах полисахаридов, полученных с использованием радиационного излучения, существуют пострадиационные дефекты, способные негативно повлиять на живые организмы, поэтому в дальнейшем такие соединения непригодны для биомедицинских целей [26]. Реакция окисления полиолов периодатами щелочных металлов останавливается на этапе образования альдегидных групп и не может протекать дальше с образованием карбоновых кислот в отличие от окисления перманганатом калия [26]. Кроме того, периодат натрия (NaIO4) является коммерчески доступным и хорошо растворимым реактивом. При использовании в качестве активации полисахаридов периодатов щелочных металлов конечное содержание присоединенных фармацевтических групп к полиальдегиду будет соответствовать количеству альдегидных групп в полисахариде.
Известно, что для проведения реакции окисления периодат ионом на каждый моль мономерного звена требуется 1 моль иона IO4–, концентрация полисахарида в растворе должна быть не более 1%, а периодата не более 0.05 М. [27] Исходя из этих литературных данных проводили расчет количества реагентов, необходимого для окисления.
Реакция протекает через последовательное ступенчатое образование двух эфиров с участием атомов кислорода периодат иона и атомов углерода пиранозного цикла полисахарида [6]. Первый из таких эфиров формируется в результате нуклеофильной атаки атомов кислорода периодат иона по вицинальным гидроксильным атомам углерода С3 и С4, играющей решающую роль в разрыве С–С–связей пиранозного цикла и приводящей к образованию ациклического альдегида [2, 4]. На второй стадии в реакции с образованием циклического эфира участвуют периодат ион, атом углерода альдегидной группы и соседний с ним. В результате разрыва С–С-связи образуется одна молекула муравьиной кислоты и конечный альдегид, который находится в растворе в равновесии со своим циклическим аддуктом присоединения одной молекулы воды [26]. Первыми в реакцию окисления будут вступать концевые звенья как основной, так и боковых цепей, и чем дальше от конца молекулы находится кольцо, тем меньше вероятность его окисления [5].
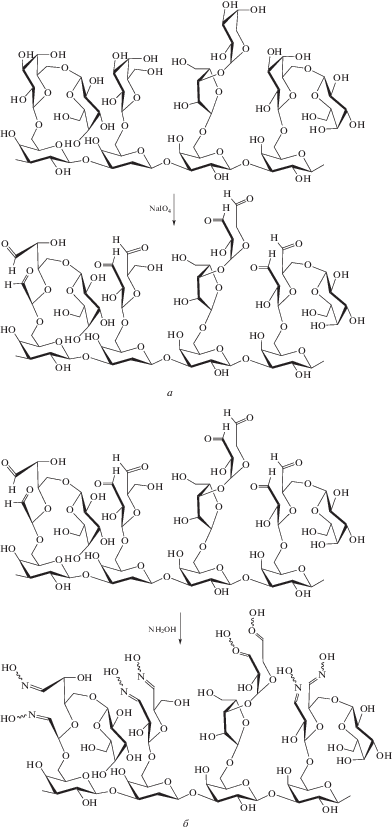
Макромолекула арабиногалактана содержит определенное количество диольных группировок, которые удобно превратить в требуемые альдегидные группы известным из органической химии периодатным окислением диолов (рис. 1а).
Рис. 1.
а – схема получения полиальдегида арабиногалактана; б – схема получения полиоксима арабиногалактана.
В инфракрасных спектрах (рис. 2а) окисленных метапериодатом натрия образцов полиальдегида арабиногалактана появляется слабая по интенсивности полоса, характерная для валентных колебаний карбонильной группы альдегидов в диапазоне νC=O = 1710–1727 см–1, остальные области, характерные для колебаний связей полимерного скелета, остаются неизменными.
Рис. 2.
а – ИК-спектр полиальдегида арабиногалактана; б – спектр оптического поглощения водного раствора полиальдегида арабиногалактана.

В ультрафиолетовом спектре (рис. 2б) резко возрастает оптическое поглощение этих альдегидных групп (две полосы при 225 и 290 нм), слабо проявляющиеся также в исходном арабиногалактане за счет незначительного количества альдегидных групп разомкнутых форм концевых моносахарных звеньев этого полисахарида.
Относительно малочувствительным ЯМР-методом на ядрах 1Н и 13С не удалось зафиксировать сигнал альдегидной группы, что легко объясняется взаимодействием альдегидных групп с гидроксильными спиртовыми группами с образованием полуацеталей. Следует отметить, что эта реакция является обратимой, и в равновесной смеси всегда присутствует некоторое количество альдегидных групп, равновесная концентрация которых достаточна для детектирования высокочувствительными оптическими методами, однако недостаточна для низкочувствительного метода ЯМР.
В результате окисления происходит деструкция полимерного остова макромолекул и, как следствие, уменьшение молекулярной массы, что влияет на физико-химические свойства. Полученные образцы полиальдегида арабиногалактана хорошо растворяются в воде с добавлением щелочи, однако требуется длительное время для растворения в дистиллированной воде нейтральной реакции (по сравнению с нативным арабиногалактаном), при этом не растворяются в ацетоне, этаноле.
Приобретаемую новую реакционную способность у полиальдегида арабиногалактана демонстрировали в реакции образования оксимов из альдегидов и получения таким образом нового производного арабиногалактана – полиоксима арабиногалактана (рис. 1б).
Строение полученного полиоксима арабиногалактана доказывали сочетанием данных, полученных различными физико-химическими методами. В составе этих производных по данным элементного анализа появляется азот в количестве 6.6–7.8% в зависимости от продолжительности проведения реакции, доказывающий формирование оксимных групп. Полиоксим арабиногалактана является удобным аналитическим соединением для определения количества образующихся альдегидных групп при получении полиальдегида арабиногалактана. При расчете по формуле (1) было установлено, что данное количество азота соответствует 14.7–17.8% альдегидных групп в полиальдегиде. В ИК-спектре соединения появляется характерная полоса поглощения валентных колебаний νN–O = 950 см–1 оксимной группы (рис. 3а).
Рис. 3.
а – ИК-спектр полиоксима арабиногалактана; б – спектр оптического поглощения гидрогелевого конъюгата полиальдегида арабиногалактана с хитозаном.
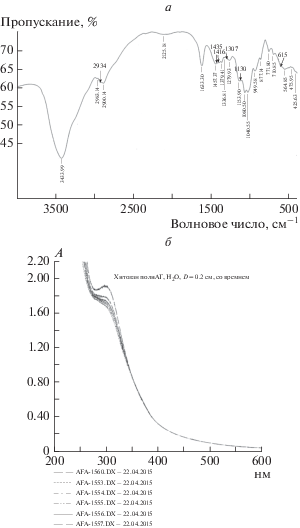
Высокую реакционную способность полиальдегида арабиногалактана подтверждали также реакцией образования –НC=N-связи оснований Шиффа в новых гидрогелевых конъюгатах с хитозаном и пара-аминобензойной кислотой. Так, в спектре оптического поглощения конъюгата полиальдегида с хитозаном нарастает во времени полоса поглощения с максимумом при 300 нм, характерная для –C=N-связи оснований Шиффа (рис. 3б).
В спектре оптического поглощения гидрогелевого конъюгата полиальдегида арабиногалактана с пара-аминобензойной кислотой также наблюдается полоса поглощения связи –C=N-связи оснований Шиффа.
Как видно из рис. 4, максимальное значение оптической плотности достигается при культивировании штамма Bifidobacterium bifidum на среде с добавкой конъюгата полиальдегида арабиногалактана с хитозаном.
Рис. 4.
Прирост биомассы (в единицах оптической плотности) штамма Bifidobacterium bifidum при культивировании на средах с арабиногалактаном (2), полиальдегидом арабиногалактана (4), а также конъюгатами на основе полиальдегида арабиногалактана (конъюгат полиальдегида арабиногалактана с пара-аминобензойной кислотой – 3, конъюгат полиальдегида арабиногалактана с хитозаном – 5), 1 – контрольная среда. Отличия достоверны при p < 0.05.

При этом с каждым днем культивирования наблюдается тенденция к уменьшению оптической плотности среды, что может свидетельствовать о быстром расходовании субстрата (особенно хитозана) в первые дни роста бифидобактерий, а в последующие − о сильной конкуренции между отдельными микроорганизмами за питательные вещества (происходит снижение числа микробных клеток на 30% к 8 суткам культивирования). В эксперименте уровень роста бифидобактерий на среде с полиальдегидом незначительно превышал данный показатель на среде с арабиногалактаном и контрольной среде. Среда с включением конъюгата полиальдегида с пара-аминобензойной кислотой оказывала ингибирующее действие.
ЗАКЛЮЧЕНИЕ
Таким образом, из арабиногалактана лиственницы сибирской получены и спектрально охарактеризованы его новые биоразлагаемые производные: полиальдегид арабиногалактана, а также гидрогелевые конструкции полиальдегида арабиногалактана с хитозаном и пара-аминобензойной кислотой – перспективные биоматериалы для дальнейшего использования в качестве стимуляторов полезной микрофлоры (пребиотиков), компонентов синбиотиков, средств доставки терапевтических и диагностических агентов.
Список литературы
García I., Marradi M., Penadés S. // Nanomed. (Lond.). 2010. V. 5. № 5. P. 777.
Kristiansen K.A., Potthast A., Christensen B.E. // Carbohydr. Res. 2010. V. 345. № 10. P. 1264.
Sirvio J., Hyvakko U., Liimatainen H. et al. // Carbohydr. Polym. 2011. V. 83. № 3. P. 1293.
Kristiansen K.A., Tomren H.B., Christensen B.E. // Carbohydr. Polym. 2011. V. 86. № 4. P. 1595.
Li H., Wu B., Mu C., Lin W. // Carbohydr. Polym. 2011. V. 84. P. 881.
Мамаева С.А., Круппа И.С., Дятлов В.А. и др. // Успехи в хим. и хим. технол. 2014. Т. XXVIII. С. 45.
Groman E.V., Enriquez P.M., Jung C., Josephson L. // Bioconjug. Chem. 1994. V. 5. № 6. P. 547.
Pawar R.P., Kushekar B.A., Jadhav B.S. et al. Chap. 7 in Book “Biodegradable Polymers in Clinical Use and Clinical Develop.” Hoboken: John Wiley & Sons, 2011. 752 p.
Александрова Г.П., Грищенко Л.А., Богомяков А.С. и др. // Изв. РАН. Сер. хим. 2010. № 12. С. 2261; Aleksandrova G.P., Grishchenko L.A., Bogomyakov A.S. et al. // Rus. Chem. Bull. 2010. V. 59. № 12. P. 2318.
Shurygina I.A., Sukhov B.G., Fadeeva T.V. et al. // Nanomed.: NBM. 2011. V. 7. № 6. P. 827.
Petrova M.V., Kiryutin A.S., Savelov A.A. et al. // Appl. Magn. Reson. 2011. V. 41. № 2–4. P. 525.
Ганенко Т.В., Костыро Я.А., Сухов Б.Г. и др. Патент РФ № 2462254. Опубл. 27.09.2012.
Сухов Б.Г., Погодаева Н.Н., Кузнецов С.В. и др. // Изв. РАН. Сер. хим. 2014. № 9. С. 2189; Sukhov B.G., Pogodaeva N.N., Kuznetsov S.V. et al. // Russ. Chem. Bull. 2014. V. 63. № 9. P. 2189.
Медведева А.С., Сафронова Л.П., Ганенко Т.В. и др. // Изв. РАН. Сер. хим. 2014. № 9. С. 2136; Medvede-va A.S., Safronova L.P., Ganenko T.V. et al. // Russ. Chem. Bull. 2014. V. 63. № 9. P. 2136.
Костыро Я.А., Алексеев К.В., Петрова Е.Н. и др. Патент РФ № 2513186. Опубл. 20.04.2014.
Фадеева Т.В., Шурыгина И.А., Сухов Б.Г. и др. // Изв. РАН. Сер. физ. 2015. Т. 79. № 2. С. 297; Fadeeva T.V., Shurygina I.A., Sukhov B.G. et al. // Bull. Russ. Acad. Sci.: Phys. 2015. V. 79. № 2. P. 273.
Карпова Е.А., Сухов Б.Г., Колесникова Л.И. и др. Патент РФ № 2557992. Опубл. 27.07.2015.
Колесникова Л.И., Карпова Е.А., Власов Б.Я. и др. // Бюлл. эксп. биол. мед. 2015. Т. 159. № 2. С. 183; Kolesnikova L.I., Karpova E.A., Vlasov B.Ya. et al. // Bull. Exp. Biol. Med. 2015. V. 159. № 2. P. 225.
Ганенко Т.В., Танцырев А.П., Сапожников А.Н. и др. // Журн. общ. хим., 2015. Т. 85. № 2. С. 305; Ganenko T.V., Tantsyrev A.P., Sapozhnikov A.N. et al. // Russ. J. Gen. Chem. 2015. V. 85. № 2. P. 477.
Родионова Л.В., Шурыгина И.А., Сухов Б.Г. и др. // Журн. общ. хим. 2015. Т. 85. № 2. С. 314; Rodionova L.V., Shurygina I.A., Sukhov B.G. et al. // Russ. J. Gen. Chem. 2015. V. 85. № 2. P. 485.
Шурыгина И.А., Родионова Л.В., Шурыгин М.Г. и др. // Изв. РАН. Сер. физ. 2015. Т. 79. № 2. С. 280; Shurygina I.A., Rodionova L.V., Shurygin M.G. et al. // Bull. Russ. Acad. Sci.: Phys. 2015. V. 79. № 2. P. 256.
Шурыгина И.А., Шурыгин М.Г., Дмитриева Л.А. и др. // Изв. РАН. Сер. хим. 2015. № 7. 1629; Shurygina I.A., Shurygin M.G., Dmitrieva L.A. et al. // Russ. Chem. Bull. 2015. V. 64. № 7. P. 1629.
Погодаева Н.Н., Кузнецов С.В., Смирнова Е.А. и др. Патент РФ № 2611999. Опубл. 01.03.2017.
Сухов Б.Г., Ганенко Т.В., Погодаева Н.Н. и др. Патент РФ № 2614363. Опубл. 24.03.2017.
Титов Е.А., Новиков М.А., Соседова Л.М. и др. Патент РФ № 2621122. Опубл. 31.05.2017.
Медведев В.С. // Дисс. канд. техн. наук. ФГБУ “Научный центр клинической и экспериментальной медицины” СО РАМН. Бийск. 2014. 172 с.
Степаненко Б.Н. // Химия и биохимия углеводов (полисахариды). Учеб. пособие для ВУЗов. М.: Высш. Школа, 1978. 256 с.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


