Известия РАН. Серия физическая, 2019, T. 83, № 7, стр. 1003-1008
Исследование потока вторичных частиц медицинского ускорителя электронов
М. В. Желтоножская 1, Е. Н. Лыкова 1, *, А. П. Черняев 1, В. Н. Яценко 2
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
2 Федеральное государственное бюджетное учреждение “Государственный научный центр Российской Федерации – Федеральный медицинский биофизический центр имени А.И. Бурназяна”
Федерального медико-биологического агентства России, лаборатория радиометрических
и спектрометрических исследований человека и окружающей среды
Москва, Россия
* E-mail: iv-kate@yandex.ru
Поступила в редакцию 01.10.2018
После доработки 15.10.2018
Принята к публикации 19.11.2018
Аннотация
Исследованы потоки вторичных нейтронов при использовании медицинского ускорителя электронов с энергией 20 МэВ, возникающие на конструкционных материалах самого ускорителя и в процедурных помещениях. Исследования потоков вторичных нейтронов проводились с использованием активационных методов на основе (γ,n)- и (n,γ)-реакций на детектирующей мишени естественного тантала 181Ta. Облученные мишени тантала исследовались с помощью спектрометра с детектором из сверхчистого германия большого объема. Распределение нейтронов по энергии было получено с помощью спектрометра-дозиметра с органическим сцинтиллятором. Установлено, что поток нейтронов составил 7% от потока тормозных гамма-квантов.
ВВЕДЕНИЕ
Развитие современных методов лечения онкологических заболеваний привело к широкому распространению и внедрению в лечебных онкологических учреждениях большого числа линейных ускорителей – высокотехнологичных установок лучевой терапии. Многие годы в радиационной онкологии использовались ускорители с энергиями до 6–8 МэВ. Эти энергии ниже порогов фотонейтронных реакций на подавляющем числе элементов, применяемых при конструировании ускорителей, других приборов, строений и т.д. Поэтому вопрос о роли вторичных нейтронов при формировании поглощенной дозы не обсуждался. Однако в последнее время наряду с действующими ускорителями в медицине стали применять и ускорители с более высокими энергиями до 20 МэВ. В этой связи стала актуальной задача исследования потоков нейтронов, которые могут возникать в результате фотонейтронных реакций.
Высокоэнергетические линейные ускорители электронов для лечения пациентов, работающие на энергиях выше 8 МэВ, создают потоки вторичных нейтронов при взаимодействии тормозных фотонов с элементами ускорителя и помещения. Нейтроны в большей степени образуются в головке ускорителя (которая включает в себя мишень, коллиматоры, сглаживающий фильтр и т.д.), в процедурном кабинете, и непосредственно в теле пациента.
Для всех ядер тяжелее кислорода порог фотонейтронных реакций лежит в диапазоне от 6 до 18 МэВ. Большая часть нейтронов образуется в реакциях (γ, n) и (n, γ). Другими возможными каналами являются реакции (γ, pn) и (γ, αn), однако для всех ядер кроме $_{3}^{6}{\text{Li,}}\,\,_{5}^{{10}}{\text{B}}\,\,{\text{и }}\,\,_{7}^{{14}}{\text{N}}$ сечения этих реакций невелики.
Одним из основных элементов конструкции головки ускорителя, как правило, является вольфрам. В первую очередь из него изготовлена тормозная мишень линейного медицинского ускорителя.
Тормозная мишень, должна иметь высокий атомный номер (поскольку сечение образования тормозных фотонов пропорционально квадрату заряда мишени), высокую температуру плавления и, желательно, высокую теплопроводность. Этим условиям хорошо удовлетворяет вольфрам, который обычно и используют в качестве тормозной мишени. В коллиматорах вольфрам используют в качестве защиты от излучения фотонов. Естественный вольфрам включает в себя несколько изотопов. Они имеют небольшие значения порогов фотонейтронных реакций и достаточно большие сечения, как видно из таблицы.
Вещества с большим атомным номером Z, в частности вольфрам, имеют низкое сечение поглощения возникающих в нем вторичных нейтронов [1–5]. Эти нейтроны не экранируются коллиматором линейного ускорителя и достигают пациента, внося дополнительный вклад в дозу, который как правило, не учитывается при планировании радиотерапевтического лечения. Из-за высокой радиобиологической эффективности нейтронов, вклад потока вторичных нейтронов в общий поток ионизирующего излучения даже на уровне нескольких процентов существенно увеличивает дозу, получаемую пациентом.
На проблемы учета вклада вторичных частиц (фотонов, электронов, нейтронов и др.) обратили внимание еще в конце 90-х–начале 2000-х гг. Было проведено много исследований относительно роли фотоядерных реакций в формировании дозы, а также реакций на пучках протонов и ионов [6–13].
В последние годы появилось большое количество зарубежных исследований, посвященных проблемам недоучета вклада дозы от вторичных нейтронов в общую дозу, получаемую пациентом при лучевой терапии [1–5, 14, 15]. Проведенные к настоящему времени исследования не создают полной картины о роли вторичных нейтронов в формировании общей дозы, а также о влиянии максимальной энергии ускорителя, срока его эксплуатации на величину потоков вторичных нейтронов. Несмотря на то, что ускорители с энергией выше 6 МэВ активно используются в лучевой терапии, такие исследования в нашей стране проводятся впервые.
Необходимо отметить, что основным требованием к проведению лучевой терапии и к радиационной защите пациентов является максимально возможное снижение дозы в нормальных тканях и органах, окружающих объект лечения. Поэтому исследования дозы от вторичных нейтронов при работе линейного медицинского ускорителя и оценка возможного влияния этого фактора на рецидив злокачественных новообразований является актуальной и важной с практической точки зрения задачей.
ПРИБОРЫ И МЕТОДЫ ЭКСПЕРИМЕНТА
В настоящей работе исследовались потоки вторичных нейтронов, возникающие при работе линейного медицинского ускорителя Varian Trilogy. Этот ускоритель может работать в двух режимах: с энергией тормозных гамма-квантов 6 и 20 МэВ с мощностью дозы от 1 до 6 Гр. Он оснащен встроенным 120-лепестковым коллиматором для формирования полей размерами от 0.5 × 0.5 см до 40 × 40 см.
Линейный медицинский ускоритель работает в импульсном режиме с высокой плотностью потока частиц в поле излучения (по разным оценкам ~1012–1014 частиц · см–2 · с–1 [16]). Поэтому использование прямых спектрометрических методов для измерения потока тормозных гамма-квантов и нейтронов крайне затруднено. Для решения этой задачи мы использовали активационный метод регистрации излучения. Регистрация тормозных гамма-квантов и нейтронов проводилась с использованием (γ, n)- и (n, γ)-реакций. В качестве детектирующей мишени использовался естественный тантал 181Ta.
При облучении танталовых мишеней линейный ускоритель работал при максимальной энергии тормозного излучения 20 МэВ, был ориентирован вертикально вниз на пол с углом поворота гантри и коллиматора равным 0°. Использовалась максимальная установленная мощность дозы равная 6 Гр ∙ мин–1. На ложе был установлен полистереновый пластинчатый твердотельный фантом (RW3) для имитации тела пациента. Размеры фантома составляли 40 × 40 × 10 см3. Стандартный фантом RW3 считается водно-эквивалентным в диапазонах энергий 1.17–1.33 МэВ изотопа 60Co, а также до 25 МэВ для фотонов и электронов с энергиями 4–25 МэВ [17].
Танталовые фольги, нарезанные в виде кружков диаметром 24 мм и толщиной 10 мкм, помещались в фантом на глубину 5 см на расстоянии 95 см от источника до поверхности фантома. Время облучения мишеней из танталовой фольги составляло 8 мин 50 с. Принципиальная схема эксперимента представлена на рис. 1 и 2.
После облучения активность танталовых фольг измерялась на полупроводниковом спектрометре Canberra с детектором из сверхчистого германия большого объема с энергетическим разрешением 1.8 кэВ по гамма-линии 1332 кэВ 60Co.
Данные об энергетическом распределении нейтронов в помещении во время работы медицинского ускорителя были получены с помощью спектрометра-дозиметра нейтронного и γ-излучения SDMF-1608PRO.DB22 с органическим сцинтиллятором. В связи с высокой плотностью потока гамма-квантов и нейтронов измерения проводились при размере радиационного поля 5 × 5 см2 с минимально возможной мощностью дозы 1 Гр ∙ мин–1 около внутренней стены защитного лабиринта на расстоянии 3 м от мишени (рис. 1).
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Известно, что при облучении детектирующей мишени потоком бомбардирующих частиц скорость образования ядер dN*/dt радиоактивного изотопа определяется двумя процессами: накоплением ядер в результате ядерной реакции ФσN и уменьшением их количества при их радиоактивном распаде λN*:
(1)
${{dN*} \mathord{\left/ {\vphantom {{dN*} {dt}}} \right. \kern-0em} {dt}} = \Phi \sigma N--\lambda N*,\quad$Таким образом, при бомбардировке естественного тантала 181Ta тормозными гамма-квантами в результате (γ, n)-реакции образуется 180Ta:
(2)
$А \left( {^{{{\text{18}}0}}{\text{Ta}}} \right) = N\frac{{\left( {1 - {{e}^{{ - {{{\lambda }}_{1}}t}}}} \right)}}{{{{\lambda }_{1}}}}\int\limits_{{{E}_{{{\text{п о р о г }}}}}}^{E_{{\gamma }}^{{max}}} {{{\sigma }_{{{\gamma },n}}}({{E}_{{\gamma }}}){{\Phi }_{{\gamma }}}({{E}_{{\gamma }}})d{{E}_{{\gamma }}}} ,$При взаимодействии естественного тантала 181Ta с потоком нейтронов в результате (n, γ)-реакции образуется 182Ta, активность которого описывается выражением:
(3)
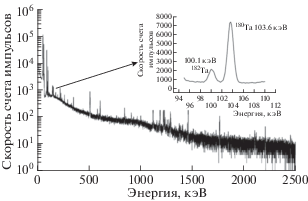
$А \left( {^{{{\text{182}}}}{\text{Ta}}} \right) = N\frac{{\left( {1 - {{e}^{{ - {{{\lambda }}_{2}}t}}}} \right)}}{{{{\lambda }_{2}}}}\int\limits_0^{E_{n}^{{max}}} {{{\sigma }_{{n,{\gamma }}}}({{E}_{n}}){{\Phi }_{n}}({{E}_{n}})d{{E}_{n}}} ,$После облучения мишени тантала измерялись на полупроводниковом спектрометре. Общий вид полученного спектра облученной мишени приведен на рис. 3.
В измеренных спектрах надежно выделялись гамма-кванты радионуклида 180Ta с периодом полураспада T1/2 = 8.15 ч, образующиеся в реакции 181Ta(γ, n)180Ta и радионуклида 182Ta с периодом полураспада T1/2 = 115 дней, образующихся в реакции 181Ta(n, γ)182Ta. Активность 180Ta составила – 6040 ± 302 Бк. Активность 182Ta составила 12.60 ± ± 0.63 Бк. Для оценки потоков тормозных гамма-квантов и нейтронов (уравнения (2) и (3)) необходимо знать выход реакций (γ, n) и (n, γ). Выход (γ, n)-реакции определить достаточно легко, так как данные о зависимости сечения реакции от энергии гамма-квантов измерены с хорошей точностью [18]. Для этого необходимо проинтегрировать распределение σγ,n по энергии с тормозным распределением гамма-квантов (рис. 4). В результате у нас получилось, что выход (γ, n)-реакции равен 28 мб для тормозных гамма-квантов с граничной энергией 20 МэВ.
Рис. 4.
Тормозное распределение гамма-квантов с максимальной энергией 20 МэВ линейного медицинского ускорителя Varian Trilogy, смоделированное с помощью программы Geant4.

Использование спектрометра-дозиметра нейтронного и γ-излучения SDMF-1608PRO позволило измерить энергетическое распределение плотности потока вторичных нейтронов в диапазоне энергий нейтронов 0.1–15 МэВ и гамма-квантов в диапазоне энергий 0.08–6.5 МэВ в смешанном потоке гамма-квантов и нейтронов. Полученные спектры приведены на рис. 5.
Рис. 5.
Спектры, полученные в помещении при работе медицинского ускорителя с помощью спектрометра-дозиметра SDMF-1608PRO.DB (а – спектр гамма-квантов, б – спектр нейтронов).

На гамма-спектре (рис. 5а) отчетливо наблюдается пик в области 2.2 МэВ ((n, γ)-реакция на водороде), что также свидетельствует о наличии в помещении нейтронов.
Таблица 1.
Основные характеристики фотонейтронных реакций на вольфраме
| Содержание изотопа, % |
Реакция | Пороговая энергия, МэВ | Максимум сечения, мб |
|---|---|---|---|
| $_{{74}}^{{186}}{\text{W}}$ (28.60) | $_{{74}}^{{186}}{\text{W(}}\gamma {\text{,}}n)_{{74}}^{{185}}{\text{W}}$ | 7.19 | ~400 |
| $_{{74}}^{{186}}{\text{W(}}\gamma {\text{,2}}n)_{{74}}^{{184}}{\text{W}}$ | 12.95 | ~200 | |
| $_{{74}}^{{184}}{\text{W}}$ (30.70) | $_{{74}}^{{184}}{\text{W(}}\gamma {\text{,}}n)_{{74}}^{{183}}{\text{W}}$ | 7.41 | ~400 |
| $_{{74}}^{{184}}{\text{W(}}\gamma {\text{,2}}n)_{{74}}^{{182}}{\text{W}}$ | 13.60 | ~200 | |
| $_{{74}}^{{183}}{\text{W}}$ (14.28) | $_{{74}}^{{183}}{\text{W(}}\gamma {\text{,}}n)_{{74}}^{{182}}{\text{W}}$ | 6.19 | ~450 |
| $_{{74}}^{{183}}{\text{W(}}\gamma {\text{,2}}n)_{{74}}^{{181}}{\text{W}}$ | 14.26 | ~150 | |
| $_{{74}}^{{182}}{\text{W}}$ (26.30) | $_{{74}}^{{182}}{\text{W(}}\gamma {\text{,}}n)_{{74}}^{{181}}{\text{W}}$ | 8.07 | ~400 |
| $_{{74}}^{{182}}{\text{W(}}\gamma {\text{,2}}n)_{{74}}^{{180}}{\text{W}}$ | 14.75 | ~200 | |
| $_{{74}}^{{180}}{\text{W}}$ (0.12) | $_{{74}}^{{180}}{\text{W(}}\gamma {\text{,}}n)_{{74}}^{{179}}{\text{W}}$ | 8.41 | ~400 |
| $_{{74}}^{{180}}{\text{W(}}\gamma {\text{,2}}n)_{{74}}^{{178}}{\text{W}}$ | 15.35 | ~100 |
В полученном спектре нейтронов мы наблюдаем резонансы в области энергий от 0.2 до 1.5 МэВ (рис. 5б). Исходя из полученного распределения нейтронов по энергии, данных о сечениях (n, γ)-реакций на тантале из [19] (рис. 6) и предполагая, что относительная интенсивность резонансов близка к относительной интенсивности нейтронов в резонансах после вылета из экранирующих материалов, мы оценили интегральный выход (n, γ)-реакции. Он оказался равным 250 мб.
Рис. 6.
Сечения181Ta (n, γ)-реакции (значения из международных библиотек эксперим. ядерных данных ENDF/B-VII.1, JEFF-3.2, JENDL-4.0) [25 ] .

Для оценки вклада тепловых нейтронов в общий поток нейтронов были проведены эксперименты по облучению сборки фольг “тантал–кадмий–тантал–кадмий” при тех же условиях работы ускорителя в течение 65 мин. Облученные мишени тантала исследовались на полупроводниковом спектрометре с детектором из сверхчистого германия. Активность 182Ta из мишени между кадмиевыми фольгами составила 5.42 ± 0.27 Бк, а активность 182Ta из мишени перед кадмиевой фольгой – 6.13 ± 0.31 Бк. Активность 180Ta в обеих мишенях с погрешностью 1% оказалась равной 2190 Бк.
С учетом зависимости сечения нейтронов в эпитепловой области σn ~ 1/V, где V – скорость нейтронов, мы оценили, что общий вклад тепловых и эпитепловых нейтронов не превышает 0.3–0.4%.
Решив уравнения (2) и (3), мы получили, что поток нейтронов на мишени тантала составляет 7% при работе ускорителя с максимальной энергией тормозных гамма-квантов 20 МэВ.
ЗАКЛЮЧЕНИЕ
В работе исследовались потоки вторичных нейтронов при работе линейного медицинского ускорителя Varian Trilogy. В результате было получено, что поток нейтронов на мишени тантала составляет 7% от потока тормозных гамма-квантов при работе ускорителя с энергией тормозного излучения 20 МэВ.
Важно отметить, что с учетом коэффициента относительной биологической эффективности (ОБЭ) нейтронного излучения для нейтронов с энергиями 0.1–200 кэВ, равного 10, по сравнению коэффициентом ОБЭ для гамма-квантов (равного 1), даже в предварительных исследованиях наблюдается существенный недоучет вклада излучения вторичных нейтронов в общую дозу, получаемую пациентом при лучевой терапии тормозными гамма-квантами с энергией 20 МэВ.
Список литературы
Carrillo H.R., Almaraz B.H., Dávila V.M., Hernández A.O. // J. Radioanal. Nucl. Chem. 2010. V. 283. P. 261.
Zanini A., Durisi E., Fasolo F. et al. // Phys. Med. Biol. 2004. V. 49. P. 571.
Pena J., Franco L., Gómez F. et al. // Phys. Med. Biol. 2005. № 50. P. 5921.
Seltzer S.M. An assessment of the role of charged seconderies from nonelastic nuclear interaction by therapy proton beam in water. National Inst. of Standards and Tehn. Techn. Rep. № NISTIR 5221. 1993.
Schimmerling W., Rapkin M., Wong M., Howard J. // Med. Phys. 1986. V. 13. P. 217.
Варзарь С.М., Тултаев А.В., Черняев А.П. // Мед. физ. 2001. № 9. С. 58.
Satherberg A., Johansson L. // Med. Phys. 1998. V. 25. P. 683.
Allen P.D., Chaudhri M.A. // Med. Phys. 1982. V. 9. P. 904.
Spurny F., Johansson L., Satherberg A. et al. // Phys. Med. Biol. 1996. V. 41. P. 2643.
Ahnesjo A., Weber L., Nilsson P. // Med. Phys. 1995. V. 22. P. 1711.
Gottschalk B., Platais R., Paganetti H. // Med. Phys. 1999. V. 26. P. 2597.
Carlsson C.A., Carlsson G.A. // Health. Phys. 1977. V. 33. P. 481.
Deasy J.O. // Phys. Med. 1998. V. 25. P. 476.
Nedaie H. A., Darestani H., Banaee N. et al. // J. Med. Phys. 2014. V. 39. P. 10.
Hashemi S.M., Hashemi-Malayeri B., Raisali G. et al. // Nukleonika. 2007. V. 52. P. 39.
Naseria A., Mesbahia A. // Rep. Pract. Oncology Radiotherapy. 2010. V. 15. P. 138.
http://www.ptw.de/acrylic_and_rw3_slab_phantoms0.html.
Varlamov A.V., Varlamov V.V., Rudenko D.S., Stepa-nov M.E. Atlas of Giant Dipole Resonances. IAEA Nucl. Data Sect. Vienna: Wagramerstrasse 5. A-1400. 1999. 321 p.
McDermott B. J., Blain E., Daskalakis A. et al. // Phys. Rev. C. 2017. V. 96. Art. № 014607.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая