Известия РАН. Серия физическая, 2020, T. 84, № 1, стр. 56-60
Когезия и теплоемкость жидкой воды с позиций электростатической модели
А. А. Волков 1, А. А. Васин 1, *, А. А. Волков мл. 2
1 Федеральное государственное бюджетное учреждение науки Институт общей физики
имени А.М. Прохорова Российской академии наук
Москва, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
* E-mail: alexcampeones@yandex.ru
Поступила в редакцию 29.07.2019
После доработки 30.08.2019
Принята к публикации 27.09.2019
Аннотация
В рамках ион-молекулярной модели воды, предполагающей высокую концентрацию короткоживущих ионов Н3О+ и ОН– и их протонный обмен с нейтральными молекулами Н2О, найдено, что когезия воды реализуется в форме электростатического взаимодействия осциллирующих ионов с окружающими их молекулярными диполями. Показано, что эти осцилляторы c частотой 5 ТГц ответственны за теплоемкость.
ВВЕДЕНИЕ
Атомно-молекулярное устройство жидкой воды до сих пор с определенностью не установлено, оно активно дискутируется в литературе. Общепринято, что вода представляет собой ансамбль неделимых молекул Н2О, скрепленных сеткой водородных связей [1, 2]. Этой идее следуют все современные исследования [3]. Проблемным остается вопрос о том, как в сетке водородных связей осуществляется вращательно-поступательное движение молекул Н2О, ответственное за неимоверное многообразие свойств воды – механических, тепловых, электрических [4].
Система водородных связей считается неотъемлемым атрибутом жидкой воды, резервуаром ее внутренней энергии. Энергию отдельной водородной связи исчисляют прямым делением энтальпии испарения воды (2240 кДж ∙ кг–1 при температуре кипения) на концентрацию молекул (55.5 моль ∙ л–1) и 4 связи на молекулу. Результат: 10 кДж (или 0.1 эВ) на связь. Считается, что связи рвутся и восстанавливаются за пикосекундные времена, позволяя молекулам в момент свободы вращаться и трансляционно перемещаться [4]. Современные модели такой динамики сложны и специфичны. Поиск ясной физической модели остается актуальным: “Water’s structure and dynamics continue to defy a simple, consistent description” [4].
В работе [5] мы описали диэлектрические спектры жидкой воды моделью, в которой понятие водородной связи не используется. Воду мы представили в виде плотного газа частиц – молекул и ионов, претерпевающих тепловые столкновения и обменивающихся протонами, другими словами, друг в друга превращающихся. Модель успешно описала электродинамику воды с неожиданным условием – присутствием в воде высокой концентрации ионов, на 7 порядков превышающей принятую (1.5 ∙ 1027 м–3 вместо 6.6 ∙ 1019 ионов обоих знаков для рН 7).
Высокая концентрация разделенных зарядов означала бы наличие в воде электрического поля с высокой плотностью энергии, способного служить связующим (когезионным) фактором жидкой воды, по сути, быть материальным воплощением сетки водородных связей. В настоящей работе, опираясь на представления электростатики и гидродинамики, мы исследуем возможность описания моделью тепловых свойств воды – теплоты испарения и теплоемкости.
МОДЕЛЬ
На рис. 1 представлена модельная среда со структурой жидкой воды. Кружками показаны молекулы Н2О диаметром d = 2.8 ∙ 10–10 м, разделенные дистанцией в четверть диаметра δ = 0.7 ∙ 10–10 м [1, 3]. Обычно такой набор молекул показывают опутанным сеткой водородных связей: соединяют кружки линиями.
Рис. 1.
Ион-молекулярная модель жидкой воды. Кружки – молекулы Н2О, плюсы – лишние протоны на молекулах (ион Н3О+), минусы – дырки от протонов (ион ОН–). Наслоение кружков в центре рисунка символизирует трехмерность среды.
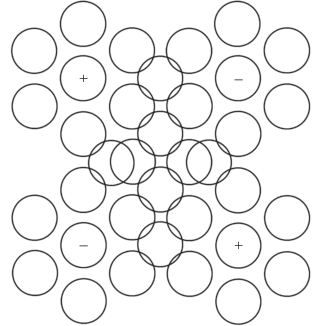
В нашем случае молекулы свободны. Среда представляет собой плотный газ, молекулы которого совершают тепловое столкновительное движение. Разлет молекул, по нашему предположению, сдерживается кулоновским полем присутствующих в среде ионов Н3О+ и ОН– (отмечены значками “+” и “–”). Ионы представляют собой молекулы Н2О, обладающие лишним протоном или в них нехватает протона. Заряженный ион является центром притяжения и поляризации для окружающих нейтральных дипольных молекул Н2О. Среда выглядит состоящей из центрированных ионами молекулярных сгустков, состоящих из n молекул.
При столкновениях лишние протоны и дырки меняют “хозяина”. Заряды переходят от молекулы к молекуле так, что молекулы и ионы взаимопревращаются: периодически каждая молекула становится заряженным ионом, а каждый ион – нейтральной молекулой. Заряженные центры хаотически блуждают. Вместе с зарядами перемещаются окружающие их поляризационные клетки (центрированная ионом поляризационная конфигурация). Ионы в гидратной оболочке движутся как большие частицы переменного состава.
Считаем, что движение частиц в воде подчиняется закону броуновской диффузии. Это значит, что в процессе диффузии реализуется непрерывное восстановление структуры молекул с шагом 𝓁 и ионов с шагом L, где 𝓁 и L расстояния между центрами, соответственно, молекул и ионов. Предполагаем, что выполняется условие плотной упаковки сфер, так что концентрация молекул N0 среды равна
(1)
${{N}_{0}} = {{\sqrt 2 } \mathord{\left/ {\vphantom {{\sqrt 2 } {{{l}^{3}}}}} \right. \kern-0em} {{{l}^{3}}}}.$Концентрацию, в свою очередь, рассматриваем, как отношение плотности воды ρ к ее молекулярной массе ${{m}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 3 ∙ 10–26 кг: N0 = ${{\rho } \mathord{\left/ {\vphantom {{\rho } {{{m}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}} \right. \kern-0em} {{{m}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}},$ где базовой характеристикой модельной среды на рис. 1 считаем справочную плотность жидкой воды ρ [6], а величины N0 и 𝓁 производными от нее. При комнатной температуре ρ = 103 кг ∙ м–3, N0 = 3.3 ∙ · 1028 м–3 и 𝓁 = 3.5 ∙ 10–10 м. Зазор между молекулами в первом приближении равен δ ~ 𝓁 – d ~ 7 Å, где d = 2.8 ∙ 10–10 м – диаметр молекулы Н2О [1].
Локальные перестройки происходят за пикосекунды. Временной масштаб определяется тепловой скоростью молекулы $\upsilon = \sqrt {{{3kT} \mathord{\left/ {\vphantom {{3kT} {{{m}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}} \right. \kern-0em} {{{m}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}} $ и соответственно, временем пролета ею расстояния δ: t = δ/υ.
В динамическом поведении среда имеет описанное Френкелем [7] свойство твердого тела: в процессе диффузного теплового движения ион (кружок с плюсом или минусом на рис. 1) на некоторое время прерывает трансляционное перемещение и осциллирует внутри клетки из поляризованных молекул (диполей). Как всякая система колеблющихся зарядов, такой осциллятор испускает/поглощает электромагнитное излучение. Это осцилляторное движение, по нашему предположению, проявляет себя в спектрах инфракрасного поглощения в форме пика на частоте 5.3 ТГц [5].
В работах, в которых упоминается пик 5 ТГц, он отмечен как особенный: пик слабо зависит от температуры, пропадает в закритическом состоянии, не поддается описанию методами молекулярной динамики: “even polarizable models fail in reproducing this feature” [8]. Считается, что пик отражает динамику растяжения водородных связей, “H-bond stretching” [9].
Принципиально важной для нас является слабая чувствительность пика к изотоп-эффекту, т.е., замещению протонов более тяжелыми дейтонами [10]. Этот факт дает основание предположить, что с откликом на 5 ТГц осциллируют тяжелые частицы, а именно, атомы кислорода с нечетным числом протонов, т.е. ионы.
КОГЕЗИЯ И ТЕПЛОЕМКОСТЬ
На рис. 1 обращаем внимание на характерный молекулярный мотив в виде иона, окруженного нейтральными молекулами Н2О (4 таких образования находятся по углам рисунка). Вследствие теплового движения образования диффузным образом быстро перемещаются в объеме среды. На этом основании предполагаем, что дипольные молекулы Н2О в среднем постоянно находятся в поле притяжения ионов. Выражаем энергию этого притяжения формулой электростатического ион-дипольного взаимодействия Eqp [11]:
(2)
${{E}_{{qp}}} = {{qp} \mathord{\left/ {\vphantom {{qp} {(4\pi {{\varepsilon }_{0}}{{l}^{2}})}}} \right. \kern-0em} {(4\pi {{\varepsilon }_{0}}{{l}^{2}})}},$Рис. 2.
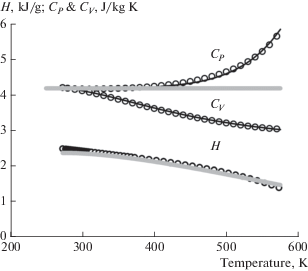
Энтальпия испарения H и теплоемкость CP и CV жидкой воды в зависимости от температуры. Точки – эксперимент [12], толстые серые линии – расчет по электростатическим формулам (4) и (10), тонкие черные линии – подгонка по формулам 11a и 11б.
Найденную энергию Н = N0Eqp считаем способной в результате тепловых флуктуаций конвертироваться в кинетическую энергию составляющих среду микрочастиц. В качестве механизма конвертации предполагаем колебание иона с частотой 5 ТГц в клетке из окружающих центрально-поляризованных молекул Н2О. Энергию колебаний выражаем классической формулой
(3)
${{U}_{{OSC}}} = {3 \mathord{\left/ {\vphantom {3 {(2\kappa {{\delta }^{2}}),}}} \right. \kern-0em} {(2\kappa {{\delta }^{2}}),}}$Рассмотрение работы осциллятора осложняется тем, что центр колебаний в результате протонного обмена между ионами и молекулами Н2О (в результате перескока протонов с кислорода на кислород) диффузно перемещается [5]. За перемещением центра с задержкой следует поляризационная конфигурация нейтральных молекул Н2О. Перемещение конфигурации обеспечивается перераспределением протонов на окружающих ион молекулах Н2О. Описанный механизм, очевидно, сложный. Для продолжения рассмотрения принимаем два упрощения: 1) увеличиваем в формуле (3) число степеней свободы осциллятора от стандартных 3 до n; под n понимаем число частиц, задействованных в работе осциллятора; 2) учитываем взаимопревращение молекул и ионов, а именно, распределяем энергию H, согласно принципу равнораспределения энергии по степеням свободы, между осциллирующими ионами и находящимися в их поле дипольными молекулами Н2О.
На основании сказанного рассматриваем энергию H как сумму энергий осцилляторов и записываем ее в виде двух слагаемых:
(4)
$\begin{gathered} H = {{{{N}_{0}}qp} \mathord{\left/ {\vphantom {{{{N}_{0}}qp} {\left( {4\pi {{\varepsilon }_{0}}{{l}^{2}}} \right)}}} \right. \kern-0em} {\left( {4\pi {{\varepsilon }_{0}}{{l}^{2}}} \right)}} = \\ = {{N}_{i}}\left[ {{{qp} \mathord{\left/ {\vphantom {{qp} {\left( {8\pi {{\varepsilon }_{0}}{{\delta }^{2}}} \right)}}} \right. \kern-0em} {\left( {8\pi {{\varepsilon }_{0}}{{\delta }^{2}}} \right)}} + {{n\kappa {{\delta }^{2}}} \mathord{\left/ {\vphantom {{n\kappa {{\delta }^{2}}} 4}} \right. \kern-0em} 4}} \right], \\ \end{gathered} $Предположение 2) означает, что каждое из слагаемых, будучи удвоенным, равно полной энергии H. В таком предположении формула (2) образует систему из трех уравнений, решение которой дает выражения для δ, n и Ni:
(5)
$\delta = {1 \mathord{\left/ {\vphantom {1 {l\sqrt {{{qp} \mathord{\left/ {\vphantom {{qp} {\left( {2\pi {{\varepsilon }_{0}}\kappa } \right)}}} \right. \kern-0em} {\left( {2\pi {{\varepsilon }_{0}}\kappa } \right)}}} }}} \right. \kern-0em} {l\sqrt {{{qp} \mathord{\left/ {\vphantom {{qp} {\left( {2\pi {{\varepsilon }_{0}}\kappa } \right)}}} \right. \kern-0em} {\left( {2\pi {{\varepsilon }_{0}}\kappa } \right)}}} }}.$(6)
$n = {{qp} \mathord{\left/ {\vphantom {{qp} {(2\pi {{\varepsilon }_{0}}\kappa {{\delta }^{4}}),}}} \right. \kern-0em} {(2\pi {{\varepsilon }_{0}}\kappa {{\delta }^{4}}),}}$Значения перечисленных величин для комнатной температуры приведены в таблице. Рис. 3 – графическая иллюстрация формулы (4).
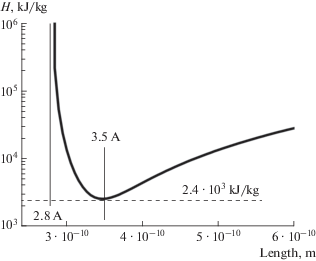
Рис. 3.
Энергия связи ансамбля взаимопревращающихся заряженных и дипольных частиц в зависимости от расстояния между центрами частиц, рассчитанная по формуле (4). Положение минимума и значение энергии в минимуме с точностью до нескольких процентов соответствуют параметрам жидкой воды
Второе слагаемое в формуле (4)
(8)
$Q = {{{{N}_{0}}\kappa {{\delta }^{2}}} \mathord{\left/ {\vphantom {{{{N}_{0}}\kappa {{\delta }^{2}}} 4}} \right. \kern-0em} 4}$по логике модели представляет собой энергию (5 ТГц)-осциллятора, отвечающего за накопление тепла. В таком качестве Q имеет равные по величине потенциальную QП и кинетическую QК составляющие. Последняя с учетом того, что константа упругости κ = m(2πν0)2, частота колебаний ν0 = υ/δ, и тепловая скорость частицы υ = = (3kBT/m)1/2 приводится к виду
где α – безразмерный подгоночный коэффициент, который определим ниже. В рамках избранного подхода производная QК по температуре представляет собой теплоемкость где штрихом обозначено дифференцирование по T.На рис. 2 две верхние кривые демонстрируют результат сравнения расчета по формуле (10) с экспериментом из базы данных [12]. В области комнатных температур теплоемкости жидкой воды при постоянном давлении CP и постоянном объеме СV одинаковы, и они точно передаются формулой (10) c коэффициентом α, близким к единице (0.935). При повышенных температурах экспериментальные CP и СV расходятся. Этот эффект в формуле (10) заключен в специфическом температурным поведении сомножителя (αN0T)'. Формальная подгонка α к экспериментальным CP и СV дает
(11а)
${{\alpha }_{P}} = {{1.65 \times {{{10}}^{4}}} \mathord{\left/ {\vphantom {{1.65 \times {{{10}}^{4}}} {(4.4 \times {{{10}}^{4}} + {{{(T--247)}}^{2}})}}} \right. \kern-0em} {(4.4 \times {{{10}}^{4}} + {{{(T--247)}}^{2}})}} + 0.57,$Происхождении разницы СP и CV пока не исследуем, фокусируемся на совпадении расчета по (10) с экспериментом при комнатных температурах.
Таблица 1.
Параметры модели для комнатной температуры. Входные: N0 – общая концентрация частиц, κ – константа упругости 5 ТГц осциллятора. Выходные: Ni – концентрация ионов, 𝓁 = расстояние между центрами молекул, δ – межмолекулярный зазор, n – число частиц в составе осциллятора
| N0, м–3 | κ, кг · с–2 | Ni,м–3 | 𝓁, м | δ, м | n |
|---|---|---|---|---|---|
| 3.3 · 1028 | 33 | 1.4 · 1027 | 3.5 · 10–10 | 0.7 · 10–10 | 24 |
ОБСУЖДЕНИЕ
Рис. 2 демонстрирует факт, что усредненная по времени энергия ион-молекулярных взаимодействий в воде передается простой электростатической формулой (4). В результате взаимопревращения заряженных и дипольных частиц эта энергия в зависимости от расстояния между молекулами имеет выраженный минимум (рис. 3). Параметры минимума точно соответствуют параметрам жидкой воды – энтальпии испарения H = 2.4 ∙ 103 кДж ∙ кг–1 и расстоянию между центрами молекул 𝓁 = 3.5 ∙ ∙ 10–10 м. В динамике картина выглядит так, что стремящиеся к разлету молекулы с дипольным моментом p удерживаются стягивающим их зарядом q на стационарном расстоянии 𝓁.
Электростатическая модель (4) дает высокую концентрацию разделенных зарядов (ионов) Ni ≈ ≈ 1.5 ∙ 1027 м–3 при наивысшей плотности, именно ту, которую мы получали ранее при модельном описании диэлектрических характеристик воды [5]. При указанной концентрации ионы разделены расстоянием, которое составляет L = 1 ± 0.05 нм. Это расстояние представляется принципиальным параметром модели, предопределяющим поведение воды в условиях пространственного структурирования воды (в пористых средах).
Взаимопревращения ионов и молекул происходят в результате протонного обмена при тепловых ион-молекулярных соударениях. Характерное время обмена определяется тепловой скоростью частицы υ = $\sqrt {{{3kT} \mathord{\left/ {\vphantom {{3kT} {{{m}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}} \right. \kern-0em} {{{m}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}}}} $ и, соответственно, временем свободного пробега: t = λυ = 0.7 ∙ 10–10/(6.4 ∙ 102) с ≈ ≈ 0.1 пс. Если так, то процесс столкновительного перераспределения протонов на n = 24 молекулах вокруг иона занимает ~2.5 пс (время жизни заряда в гидратной клетке). Похожее время фигурирует в современных моделях, но имеет другой смысл, а именно, считается характерным временем разрыва–восстановления водородных связей, временем жизни водородной связи [3].
Накопление тепла в жидкой воде Q, согласно нашей модели, происходит энергетической накачкой (5 ТГц)-осциллятора. В процессе участвуют 24 молекулы Н2О, каждая из которых на время 2.5 пс в результате столкновений и протонного обмена становится ионом Н3О+ или ОН–. Эффективность работы такого механизма в απ2 ≈ 3 раза увеличена по сравнению со случаем классического гармонического осциллятора EOSC = 3kT.
Существует подход к описанию свойств жидкостей с позиций физики твердого тела, трактующий теплоемкость жидкостей на языке фононов [13]. Рассмотренные в настоящей работе блуждающие (5 ТГц)-осцилляторы соответствуют этому подходу. Они придают воде макроупругость. Проблема представляется перспективной для теоретического анализа.
ЗАКЛЮЧЕНИЕ
В работе показано, что в рамках ион-молекулярной модели, предложенной нами ранее, связующим фактором молекул жидкой воды является кулоновское поле зарядов (протонов и протонных дырок), броуновским способом блуждающих по молекулам Н2О. Модель объясняет устойчивость воды как системы кислородных и водородных атомов конкуренцией двух процессов – теплового разбегания молекул Н2О и сборки их кулоновским притяжением ионов.
В рамках модели накопление тепла жидкой водой осуществляется ионными осцилляторами с частотой 5 ТГц, представляющими собой группы из ~24 молекул Н2О, обегаемых с временем локализации 2.5 пс стягивающим их зарядом.
Список литературы
Eisenberg D., Kauzman W. The structure and properties of water. Oxford: Clarendon Press, 1969. 330 p.
Маленков Г.Г. // Журн. cтрукт. хим. 2006. Т. 47. С. 5.
Brini E., Fennell C.J., Fernandez-Serra M. et al. // Chem. Rev. 2017. V. 117. Art. № 12385.
Henchman R.H. // J. Phys. Cond. Matt. 2016. V. 28. Art. № 384001.
Volkov A.A., Artemov V.G., Volkov A.A. jn., Sysoev N.N. // J. Mol. Liq. 2017. V. 248. P. 564.
Kell G. S. // J. Chem. Engin. Data. 1975. V. 20. № 1. P. 97.
Frenkel J. Kinetic theory of liquids. Oxford: Univ. Press, 1946. 485 p.
Sega M., Schröder C. // J. Phys. Chem. A. 2015. V. 119. № 9. P. 1539.
Shi L., Ni Y., Drews S.E.P., Skinner J.L. // J. Chem. Phys. 2014. V. 141. Art. № 084508.
Zelsmann H.R. // J. Molec. Struct. 1995. V. 350. P. 95.
Ландау Л.Д., Лифшиц. Е.М. Теоретическая физика. Электродинамика сплошных сред. 2-е изд. М.: Наука, 1982. 621 с.
Ривкин С.Л., Александров А.А. Теплофизические свойства воды и водяного пара. М.: Энергия, 1980. 424 с.
Bolmatov D., Brazhkin V. V., Trachenko K. // Sci. Rep. 2012. V. 2. P. 421.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


